人参(Panax ginseng C.A.Meyer)为五加科多年生草本植物人参的根,是我国传统的名贵中草药,主要产于东北三省、河北、河南、湖北、云南等省份[1]。人参皂苷(Ginsenoside,GS)是人参皂苷元与糖基相连形成的三萜类化合物,主要分为原人参二醇型皂苷、原人参三醇型皂苷、齐墩果酸型人参皂苷[2]。作为人参生理活性的主要物质基础,人参皂苷具有多种生理功能,尤其是稀有人参皂苷(rare ginsenosides)具有极高的药用价值[3]。研究发现,稀有人参皂苷CK具有抗老化、护肝、抗炎、抗血栓等作用[4-5];稀有皂苷 Rh1具有增强记忆力、脑皮层神经细胞缺氧保护、抗过敏、降血糖等作用[6-8];稀有皂苷Rg3的分子式为C42H72O13,研究发现Rg3对肺癌实体瘤细胞具有较强的毒性作用,可以通过抑制肺癌细胞的增殖和转移起到抗肿瘤的作用[9],Rg3还在调节中枢神经系统、降血糖、抗炎等方面有良好效果[9-10]。人参总皂苷含量约为4%[2],其中Ra1、Rb1、Rb2、Rc、Rd、Re、Rf、Rg1的含量占比超过95%,稀有皂苷含量极低[11],Rg3含量仅为0.000 3%~0.03%[3]。人参皂苷中的原有皂苷含量较高,但是不易被人体消化吸收,需要经过肠道菌群转化为稀有皂苷才能发挥生理功能,因此国内外学者多采用化学法(酸解法、碱解法)[12-13]、生物法(酶解法、微生物转化法)[14-15]将原有人参皂苷转化为稀有人参皂苷,其中微生物转化法具有成本低、绿色高效、副产物少等优点,备受关注。
乳酸菌是(lactic acid bacteria,LAB)是一类利用碳水化合物发酵产生大量乳酸的细菌,是人体肠道内重要的益生菌群,能够维持肠道菌群平衡[16]、提高机体免疫力[17]、抑制胆固醇的吸收[18]。乳酸菌常用作酸奶、乳酪、泡菜及其他发酵食品的发酵剂,具有绿色高效、安全、副产物少等优点,在发酵制品领域应用非常广泛,如已有研究者利用乳酸菌发酵枸杞汁、柿子、树莓等[19-21]。乳酸菌也已经广泛应用于稀有人参皂苷的转化,刘涛[2]利用乳酸菌发酵人参,将原有皂苷转化为稀有皂苷并探究其抗氧化能力,朱珺等[22]从78株植物乳杆菌中筛选具有人参皂苷转化能力的菌株。目前植物乳杆菌是最常用的乳酸菌发酵剂。研究发现,乳酸菌能够产生β-葡萄糖苷酶,β-葡萄糖苷酶能够水解人参皂苷的β-葡萄糖苷,从而改变人参皂苷分子结构中所连接的糖苷配基,将原有皂苷转化为活性更高、功能更强的稀有皂苷,提高稀有皂苷的含量,改善人参发酵产品风味,增强人参的生理功能,促进肠道吸收[3,23-24]。
本研究选择唾液乳杆菌B19 WI2401、戊糖片球菌B06 WI2702、副干酪乳杆菌B16 WI2101、戊糖片球菌G16 WI7101、副干酪乳杆菌B16 WI2110、副干酪乳杆菌B16 NY2106、植物乳杆菌B16 NJ2201、副干酪乳杆菌B04 WI2501、副干酪乳杆菌B16 NY2107共9株菌对人参进行发酵,通过定向微生物转化将人参原有皂苷转化为稀有人参皂苷,以稀有人参皂苷Rg3含量为评价指标进行发酵工艺的优化,确定最适宜的发酵工艺,并分析发酵过程中人参皂苷生物转化可能途径,以期为人参发酵产品的开发和利用提供参考。
1 材料与方法
1.1 材料与仪器
人参,完美(中国)日用品有限公司;菌株,中国食品发酵工业研究院有限公司;人参皂苷标准品,北京索莱宝科技有限公司;小麦水解蛋白(纯度>95%),中国食品发酵工业研究院有限公司;乙腈(色谱纯)、甲醇(色谱纯),默克股份两合公司;乙酸铵(色谱级),上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
HZQ-211C恒温培养箱,上海一恒科学仪器有限公司;1300 SERIES A2生物安全柜,赛默飞世尔科技(中国)有限公司;IKA T25匀浆机,德国IKA公司;pH211型精密pH计,HANNA公司;LC-MS/MS 8060—三重四级杆液质联用仪液相色谱质谱联用仪,日本岛津公司;BLBIO-5GJ发酵罐,上海百仑生物科技有限公司;GZ-5高速离心机,德国Sigma离心机有限公司;KQ-250DE超声仪,昆山市超声仪器有限公司;LX-B50 L型灭菌锅,合肥华泰医疗设备有限公司。
1.2 实验方法
1.2.1 人参原料基本指标检测
采用GB 5009.5—2016测定蛋白质含量,GB 5009.6—2016测定脂肪含量,SN/T 4260—2015测定粗多糖含量,GB 5009.7—2016滴定法测定还原糖含量,GB 5009.88—2014测定总膳食纤维含量,GB 5009.4—2016测定原料灰分,GB/T 19506—2009测定人参总皂苷含量,采用pH211型精密pH计测定人参原料的pH值。
1.2.2 菌株培养
菌种保藏于-80 ℃,室温解冻,以1%(体积分数)的接种比例接种于液体培养基中,(36±1) ℃条件下培养24 h,活化2代待用。
1.2.3 人参前处理
称取一定量的人参,按照1∶20(g∶mL)的料液比添加100 ℃沸水浸泡后,温度自然冷却过夜。用剪刀将人参剪成2 cm小段,破碎打浆3 min,添加0.1%(质量分数)小麦水解蛋白粉作为氮源,蔗糖作为碳源,柠檬酸和碳酸钙调整pH,115 ℃下灭菌20 min。
1.2.4 人参发酵
于生物安全柜中按照1%(体积分数)接种比例接种,置于30 ℃下发酵14 d,发酵结束后于沸水浴中灭菌30 min终止发酵,3 000 r/min离心10 min,取上清液待用。
1.2.5 人参皂苷HPLC定量方法建立
样品制备:取人参上清液,用0.22 μm的过滤膜过滤,用50%(体积分数)甲醇水溶液稀释50倍后待测。
方法建立:色谱柱为ACQUITY UPLC®HSS T3(2.1 mm×100 mm, 1.8 μm),流动相A为水溶液,B为5 mmol/L乙酸铵乙腈溶液。梯度洗脱程序:0~5.0 min,30%~50% B;5.0~8.0 min,50%~100% B;8.0~10.0 min,100% B;10.00~10.01 min,100%~30% B;10.01~12.00 min,30% B;流速0.4 mL/min;进样体积1 μL;柱温40 ℃。质谱条件:电喷雾离子源(electrospray ionization, ESI),负离子扫描模式;离子喷雾电压为+4.5 kV;雾化气流速为氮气3.0 L/min;加热气流速为氮气10 L/min;干燥气流速为氮气10 L/min;接口温度250 ℃;加热器温度400 ℃;离子源温度300 ℃。利用多反应监测(multiple reaction monitoring,MRM)进行Rb1、Rb2、Rc、Rd、Re、Rf、Rg1、Rg3、Rh1、Rh2、CK、F2 12种人参皂苷的参数优化。
标准曲线的确定:分别精密称取12种人参皂苷标准品,用50%甲醇溶液溶解配制成10 μg/mL混合溶液,将该混合液稀释成156.25、312.5、625、1 250、2 500、5 000、10 000 μg/L,以峰面积和标准品浓度做标准曲线。
样品处理:取发酵前及终止发酵离心后的人参上清液,用0.22 μm膜过滤,稀释50倍待测。
实验方法精密度及稳定性:通过对同一浓度的样品重复进样和相同间隔时间段(8 h)分别进样,计算各组数据的相对标准偏差(relative standard deviation,RSD,%),评价该方法的精密度和稳定性。
1.2.6 菌株筛选
单一菌株筛选:根据自有菌库情况,选择唾液乳杆菌B19 WI2401、戊糖片球菌B06 WI2702、副干酪乳杆菌B16 WI2101、戊糖片球菌G16 WI7101、副干酪乳杆菌B16 WI2110、副干酪乳杆菌B16 NY2106、植物乳杆菌B16 NJ2201、副干酪乳杆菌B04 WI2501、副干酪乳杆菌B16 NY2107共9株菌进行单一菌株筛选实验,所选乳酸菌均为兼性厌氧菌。蔗糖添加量为2%(质量分数),初始pH值为5.62,添加0.1%(质量分数)小麦水解蛋白粉作为氮源,接种量为1%(体积分数),于30 ℃下发酵12 d。
复配菌株筛选:根据单一菌株发酵后Rg3的含量,选择发酵效果最好的3株菌株,进行复配实验研究。分别设计2个菌株复配和3个菌株复配共4组实验,蔗糖添加量为5%(质量分数),初始pH值为5.62,添加0.1%小麦水解蛋白粉作为氮源,接种量为1%(体积分数)(菌种比例为1∶1或1∶1∶1),于30 ℃下发酵12 d,选择发酵后Rg3的含量最高的菌株复配组合,确定发酵终点。
1.2.7 发酵工艺研究
1.2.7.1 单因素试验
设计单因素试验探究初始pH值、发酵温度(℃)、蔗糖添加量(%,质量分数)对发酵工艺的影响,以发酵后Rg3的含量为评价指标,具体实验参数如下:
设计接菌量为1%,接菌比例为1∶1,蔗糖添加量为5%,发酵温度为30 ℃,pH值分别为3、4、5、6、7,探究初始pH值对于发酵效果的影响;
设计接菌量为1%,接菌比例为1∶1,蔗糖添加量为5%,pH值为6,发酵温度为25、30、35、40、45 ℃,探究发酵温度对发酵效果的影响;
设计接菌量为1%,接菌比例为1∶1,pH值为6,发酵温度为30 ℃,蔗糖添加量为3%、5%、7%、9%、11%探究蔗糖添加量对发酵效果的影响。
1.2.7.2 响应面优化实验
在单因素试验的基础上,以初始pH值、发酵温度、蔗糖添加量为考察因素,采用Box-Benhnken中心组合设计3因素3水平的响应面实验,以人参发酵后Rg3含量为响应值,分析影响人参发酵各因素的交互作用,确定最佳工艺条件。中心组合实验水平如表1所示。
表1 中心组合实验水平表
Table 1 Center combination experiment level table

水平A(初始pH值)B(发酵温度)/℃C(蔗糖添加量)/%-133550440715459
1.3 数据分析
采用Design Expert 12进行响应面分析,Origin 8.5和SPSS 18.0进行数据处理和分析,每个处理3组平行,实验数据表示为平均数±标准偏差。
2 结果与分析
2.1 人参原料基本成分分析
称取一定量的人参原料,破碎磨粉,过80目筛,测定基本成分,结果如表2所示。其中总皂苷含量为(3.12±0.58) g/100 g,约为3.12%;稀有皂苷Rg3含量为(0.012±0.006) g/100 g,约为0.012%。研究发现,人参总皂苷含量约为4%,其中Rg3含量约为0.000 3%~0.03%,说明本原料中稀有皂苷Rg3含量极低,乳酸菌的转化作用对于稀有皂苷Rg3含量的提升十分重要。测得人参原料前处理的pH值为5.60±0.24,乳酸菌适合生长繁殖的pH值在4~6左右,这说明人参原料前处理后的pH值适合乳酸菌生长,可用于菌株筛选实验研究。本研究中采用的乳酸菌最适pH值将在工艺实验中进行确定。
表2 人参原料基本成分 单位:g/100 g
Table 2 Basic ingredients of ginseng raw materials
基本成分蛋白质脂肪粗多糖还原糖膳食纤维灰分总皂苷Rg3含量含量14.41±0.022.26±0.1214.90±0.152.07±0.0224.85±2.523.51±0.083.12±0.580.012±0.006
2.2 人参皂苷定量及方法验证
测定人参发酵前后的Rb1、Rb2、Rc、Rd、Re、Rf、Rg1、Rg3、Rh1、Rh2、CK、F2共12种人参皂苷,根据标准品保留时间、前体离子和产物离子信息进行定量分析。选取156.25、312.5、625、1 250、2 500、5 000、10 000 μg/L共7个质量浓度绘制标准曲线,确定线性范围。选择混标中的同一质量浓度(5 000 μg/L)进行重复进样(n=6),计算RSD,用于评价方法的精密度;选择混标中的同一质量浓度(5 000 μg/L)进行相同间隔时间段(8 h)的重复进样(n=6),计算RSD,用于评价方法的稳定性,结果如表3所示。本研究方法的精密度良好,在48 h内保持稳定。
表3 十二种人参皂苷定量方法参数及验证
Table 3 Parameters and validation of 12 ginsenosides quantitative methods
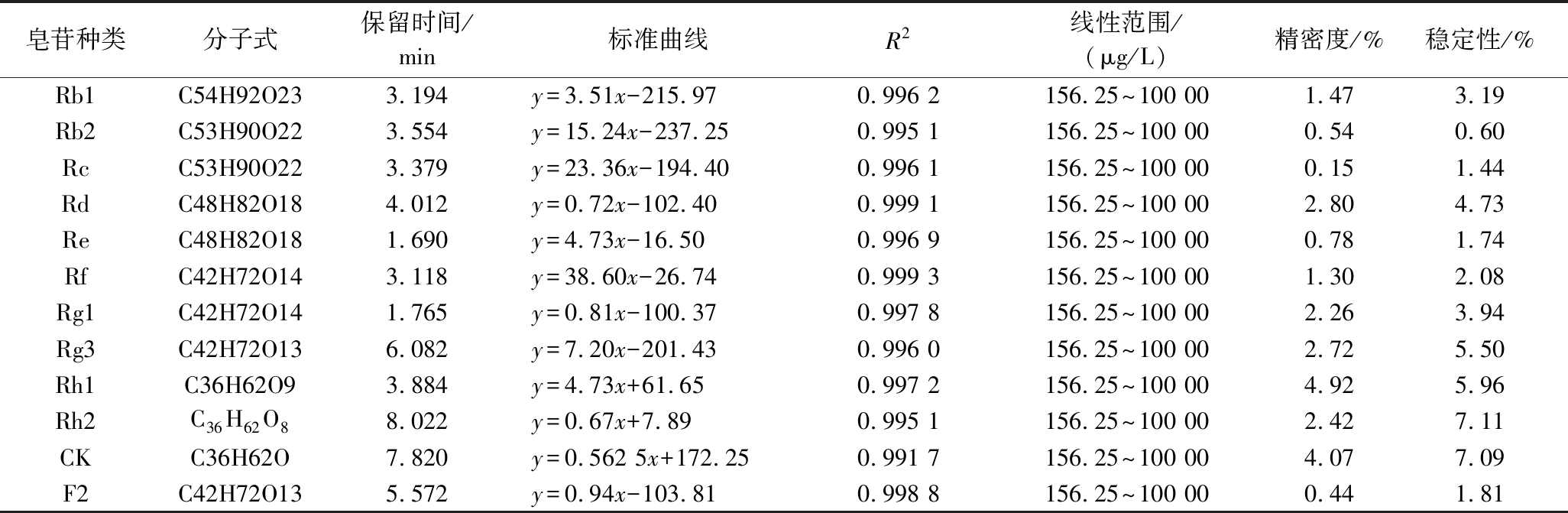
皂苷种类分子式保留时间/min标准曲线R2线性范围/(μg/L)精密度/%稳定性/%Rb1C54H92O23 3.194y=3.51x-215.970.996 2156.25^100 001.47 3.19Rb2C53H90O22 3.554y=15.24x-237.250.995 1156.25^100 000.54 0.60RcC53H90O22 3.379y=23.36x-194.400.996 1156.25^100 000.15 1.44RdC48H82O18 4.012y=0.72x-102.400.999 1156.25^100 002.80 4.73ReC48H82O18 1.690y=4.73x-16.500.996 9156.25^100 000.78 1.74RfC42H72O14 3.118y=38.60x-26.740.999 3156.25^100 001.30 2.08Rg1C42H72O14 1.765y=0.81x-100.370.997 8156.25^100 002.26 3.94Rg3C42H72O13 6.082y=7.20x-201.430.996 0156.25^100 002.72 5.50Rh1C36H62O9 3.884y=4.73x+61.650.997 2156.25^100 004.92 5.96Rh2C36H62O88.022y=0.67x+7.890.995 1156.25^100 002.42 7.11 CKC36H62O 7.820y=0.562 5x+172.250.991 7156.25^100 004.07 7.09F2C42H72O13 5.572y=0.94x-103.810.998 8156.25^100 000.44 1.81
2.3 菌株及其复配方案筛选结果
2.3.1 菌株筛选
本研究中采用唾液乳杆菌B19 WI2401、戊糖片球菌B06 WI2702、副干酪乳杆菌B16 WI2101、戊糖片球菌G16 WI7101、副干酪乳杆菌B16 WI2110、副干酪乳杆菌B16 NY2106、植物乳杆菌B16 NJ2201、副干酪乳杆菌B04 WI2501、副干酪乳杆菌B16 NY2107共4种菌种9个菌株进行单一菌株筛选,以Rg3含量为评价指标,结果如图1所示。结果显示,随着发酵时间的延长,Rg3含量升高,说明所选菌株均有转化作用,能够提高Rg3含量。发酵第8~10天时,菌株B16 NY2107和B04 WI2501发酵液中Rg3含量明显高于其他组,发酵第12天时,菌株B16 NY2107、B16 WI2110和B04 WI2501发酵液中Rg3含量最高,分别达到(915.03±100.42)、(895.94±17.62)、(871.59±88.28) μg/L,且三者之间无显著性差异,这说明本研究中副干酪乳杆菌B16 NY2107、B16 WI2110、B04 WI2501对人参稀有皂苷Rg3的转化效果最好。刘涛[2]以市售人参提取物(易溶于水)为原料,选用植物乳杆菌GIM1.648、嗜酸乳杆菌GIM1.731、干酪乳杆菌GIM1.204、副干酪乳杆菌BNCC195633和发酵乳杆菌GIM1.985共5种菌种进行人参皂苷生物转化及发酵工艺研究,发现植物乳杆菌GIM1.648产生β-葡萄糖苷酶的活性最高,其转化人参稀有皂苷F2、Rg3、CK能力最强。张倩等[25]总结了植物乳杆菌、发酵乳杆菌、肠膜明串珠菌、鼠李糖乳杆菌、德氏乳杆菌保加利亚亚种和德氏乳杆菌乳亚种生物转化人参有效成分的能力,发现不同菌株对人参皂苷转化效果不同,同一菌株对不同来源的人参原料中皂苷转化效果也不同,这说明菌株的转化能力及原料来源具有差异性。本研究选择Rg3转化效果最好的副干酪乳杆菌B16 NY2107、B16 WI2110和B04 WI2501进行后续菌种复配研究。

图1 单一菌株发酵后Rg3含量
Fig.1 The content of Rg3 after fermentation of sole strain
2.3.2 复配实验结果
人参皂苷分子结构中连接的糖苷配基不同,皂苷种类也不同。乳酸菌转化人参皂苷的能力取决于其产生β-葡萄糖苷酶的能力,β-葡萄糖苷酶能够水解人参皂苷的β-葡萄糖苷,从而将原有皂苷转化为稀有皂苷[3,23-24]。单一菌株转化人参皂苷的能力取决于单一菌株产生β-葡萄糖苷酶的能力,而复合菌株转化人参皂苷的能力则取决于复合菌株之间的协同作用。复合菌株之间协同,可以促进反应体系中酶的多样化和互补性,充分分解、溶出和利用人参组织中的有效成分和营养物质,从而提高稀有皂苷转化能力。LEE等[26]利用酿酒酵母、嗜酸乳杆菌、植物乳杆菌、短乳杆菌、枯草芽孢杆菌组合菌发酵转化人参稀有皂苷Rh1、F2、Rg3、CY,发现转化率最高可分别达127.3%、63.5%、255.8%、226.6%[26]。AH等[27]利用植物乳杆菌KK-1和发酵乳杆菌KK-2混合发酵,发现复合菌株比单一菌株发酵效果更好,混合发酵转化率达41%。但是菌株之间也会存在拮抗作用,不同菌株生长过程中产生竞争性抑制,皂苷转化能力下降,薛兢兢[28]研究发现复合菌(乳杆菌+酵母菌)发酵效果不如单一乳杆菌株,这说明复合菌株发酵要综合考虑菌株生长之间的协同作用和拮抗作用。
根据单一菌株发酵后稀有皂苷Rg3含量,对所选择的B16 NY2107、B04 WI2501、B16 WI2110进行复合菌发酵,复配组合分别为B16 NY2107+B04 WI2501、B16 NY2107+B16 WI2110、B04 WI2501+B16 WI2110、B16 NY2107+B04 WI2501+B16 WI2110。蔗糖添加量为5%,接种量为1%(体积分数)(菌种比例为1∶1或1∶1∶1),于30 ℃下发酵12 d,确定发酵终点和复合方案,结果如图2所示。随着反应时间的延长,B16 NY2107+B04 WI2501、B16 NY2107+B16 WI2110、B04 WI2501+B16 WI2110实验组呈现先上升后下降趋势,这可能是因为发酵过程中,部分原有皂苷转化为Rg3的同时,Rg3也在发生降解,Rg3定量是综合原有皂苷转化作用和降解作用后的含量。B16 NY2107+B04 WI2501在发酵第9天,Rg3含量最高,达到(1 784.81±61.62) μg/L;B16 NY2107+B16 WI2110和B04 WI2501+B16 WI2110复配组合发酵第9天和第10天无显著性差异,发酵后Rg3含量分别达到(1 410.15±84.3)、(1 384.06±48.96) μg/L和(1 425.96±71.46)、(1 496.21±21.75) μg/L。而3个菌株复合组B16 NY2107+B04 WI2501+B16 WI2110发酵后,Rg3含量呈现逐渐上升趋势,发酵12 d时含量达到最高,为(1 260.39±41.60) μg/L,这可能是由于3个菌株生长过程中的抑制作用,产生β-葡萄糖苷酶的能力下降,稀有皂苷Rg3转化能力下降。综上,最终复合菌株方案选择分离自乳制品的副干酪乳杆菌B16 NY2107和分离自动物源固体饮料的副干酪乳杆菌B04 WI2501,发酵时间为9 d。
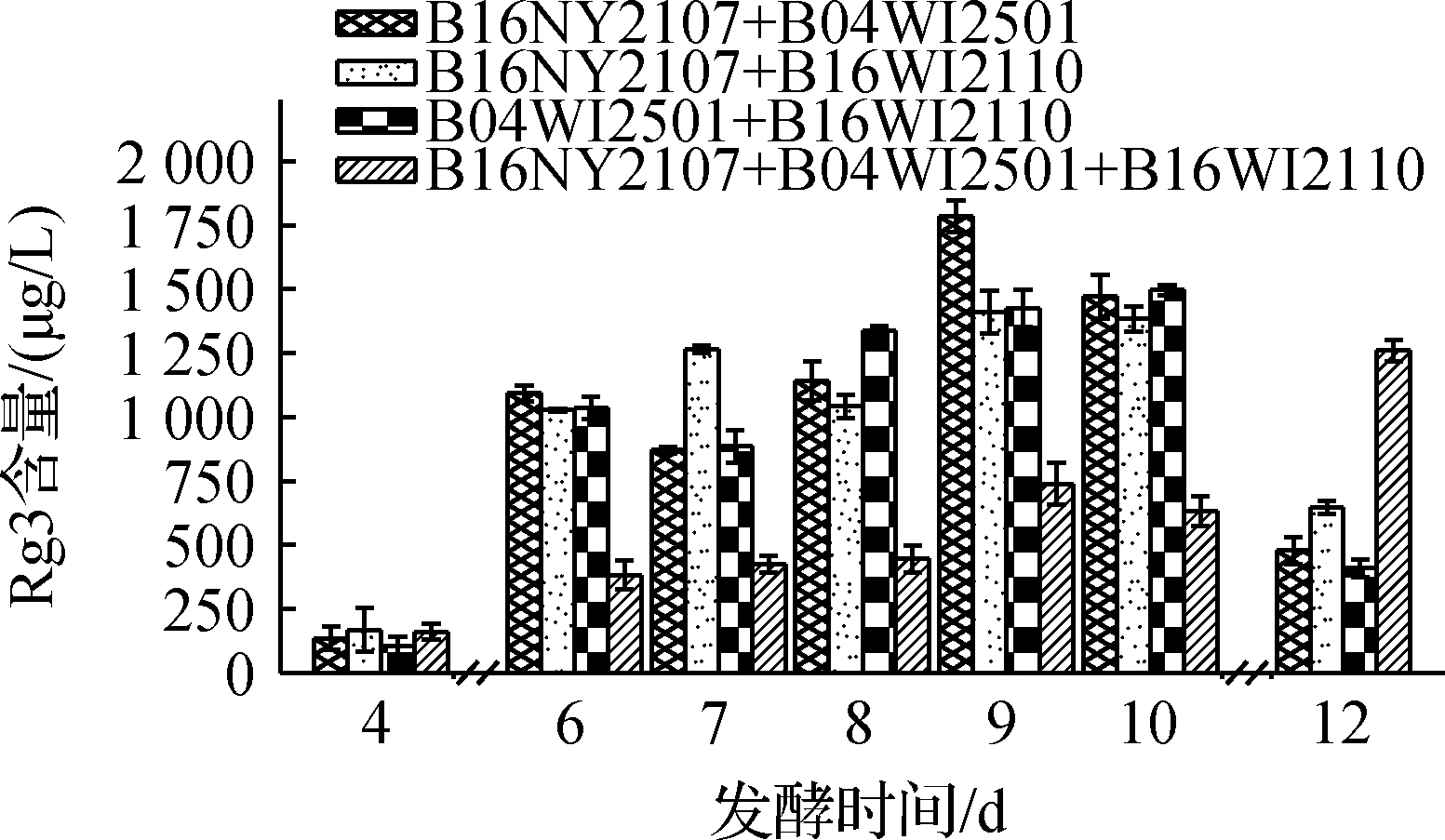
图2 复配菌株发酵后Rg3含量
Fig.2 The content of Rg3 after fermentation of the complex strain
2.4 发酵工艺单因素试验优化结果
2.4.1 初始pH值对发酵效果的影响
研究发现,乳酸菌在较酸环境下可以正常生长繁殖,最适于中性环境或者弱酸环境[29]。利用碳酸钙和柠檬酸调整人参发酵液的初始pH值为3、4、5、6、7,探究初始pH值对人参稀有皂苷Rg3转化作用的影响,结果如图3所示。随着pH值的增加,Rg3含量呈现先上升后下降的趋势,pH值在4~6时发酵效果较好。乳酸菌在发酵过程中产生乳酸的含量是衡量乳酸菌发酵程度的重要指标[20],而乳酸含量是影响反应体系pH值最主要的因素,当反应体系偏中性或碱性时,乳酸菌产生的乳酸主要用于中性和碱性环境,乳酸菌生长较为缓慢;当pH值过低时,酸性环境会抑制乳酸菌的生长,也会抑制β-葡萄糖苷酶的活性,人参皂苷转化效果较差。因此,选择初始pH值为3~5进行响应面实验优化发酵工艺。
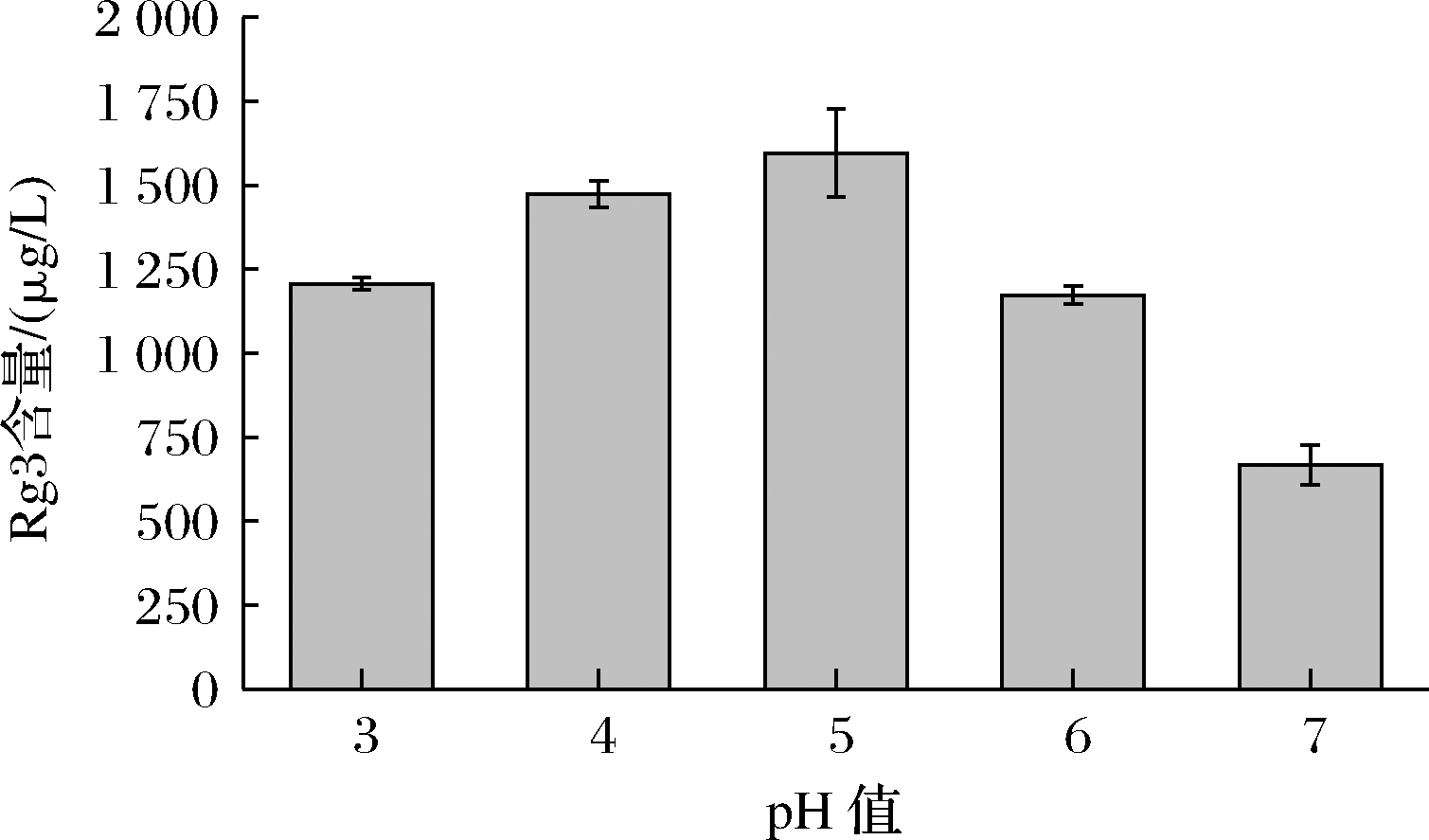
图3 初始pH值对发酵后Rg3含量的影响
Fig.3 Effect of initial pH value on Rg3 content after fermentation
2.4.2 发酵温度对发酵效果的影响
选择发酵温度为25、30、35、40、45 ℃,探究发酵温度对乳酸菌转化Rg3能力的影响,结果如图4所示。随着发酵温度的升高,Rg3含量呈现先上升后下降的趋势,发酵温度为40 ℃时,Rg3含量最高,为(1 428.48±20.19) μg/L。研究发现,发酵温度对微生物的新陈代谢十分重要,温度高低直接影响菌体活性[30],且会影响发酵产品的风味和口感[21],因此,选择35~45 ℃的发酵温度进行响应面实验优化发酵工艺。

图4 发酵温度对发酵后Rg3含量的影响
Fig.4 Effect of fermentation temperature on Rg3 content after fermentation
2.4.3 蔗糖添加量对发酵效果的影响
碳源是乳酸菌生长繁殖的必要条件,蔗糖添加量影响乳酸菌的生长繁殖,进而影响人参稀有皂苷的转化效果。选取蔗糖添加量为3%、5%、7%、9%、11%探究蔗糖添加量对乳酸菌转化人参皂苷Rg3能力的影响,结果如图5所示。随着蔗糖添加量的增大,Rg3含量呈现先上升后下降的趋势,当蔗糖添加量为7%时,Rg3含量最高,达到(1 768.29±75.64) μg/L。蔗糖添加量是微生物生长繁殖的重要影响因素,蔗糖添加量过低时,营养物质缺乏,乳酸菌生长缓慢,发酵终点延长;蔗糖添加量过高时,会导致反应体系渗透压增高,进而影响乳酸菌的生长和代谢[20]。此外,研究发现蔗糖添加量也会影响发酵后产品的口感,一般蔗糖添加量为7%~9%时,发酵产品感官评分较高[31],选择5%~9%的蔗糖添加量进行响应面实验优化发酵工艺。
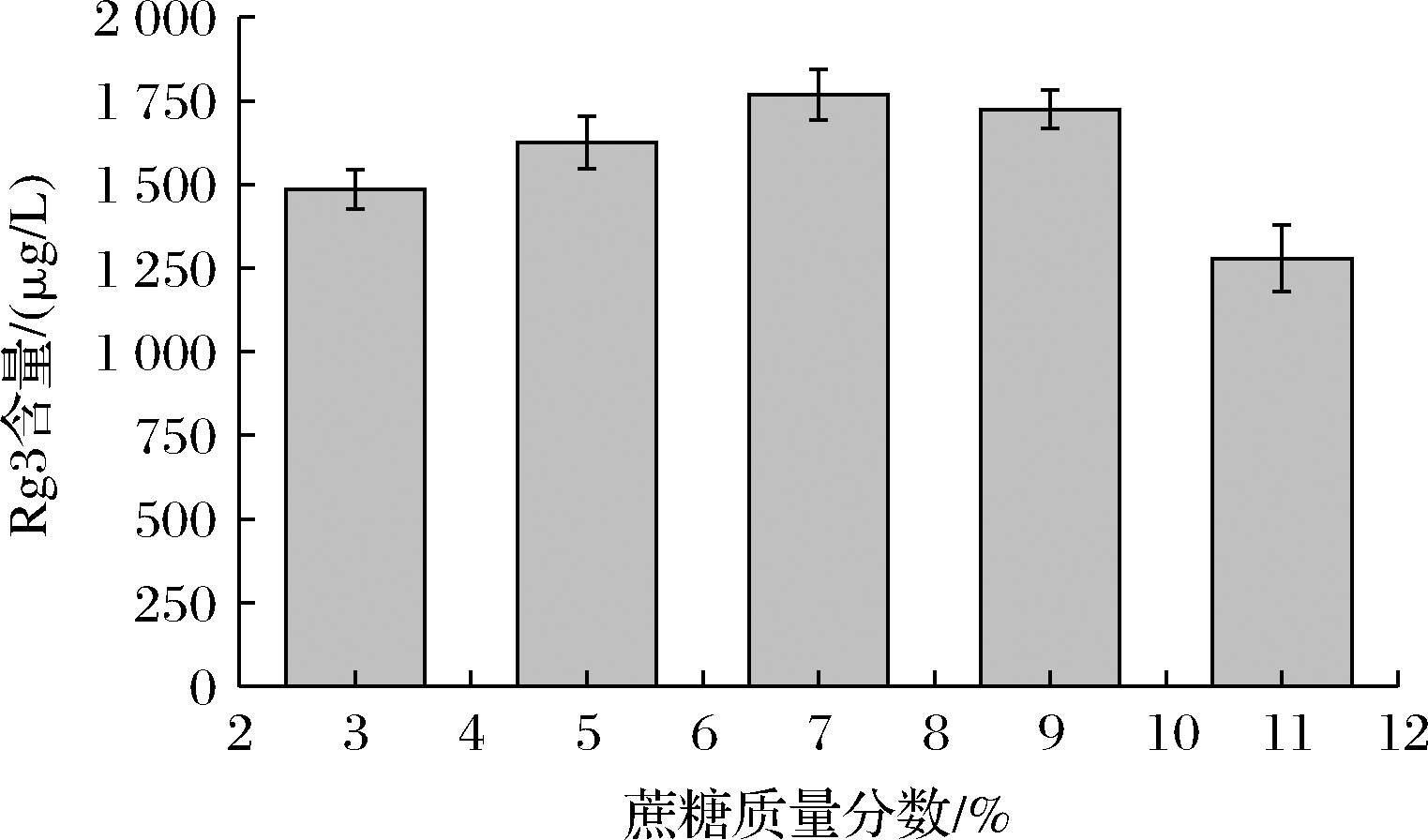
图5 蔗糖添加量对发酵后Rg3含量的影响
Fig.5 Effect of sucrose addition on Rg3 content after fermentation
2.5 发酵工艺响应面实验优化结果
根据单因素试验结果,设计初始pH值、发酵温度、蔗糖添加量3因素3水平实验探究各影响因素对Rg3转化效果的影响。根据Box-Behnken 试验设计方案,以人参稀有皂苷Rg3含量(Y)为响应值共17个试验点,实验设计及结果如表4所示。
表4 响应面实验结果
Table 4 The experimental results of response surface
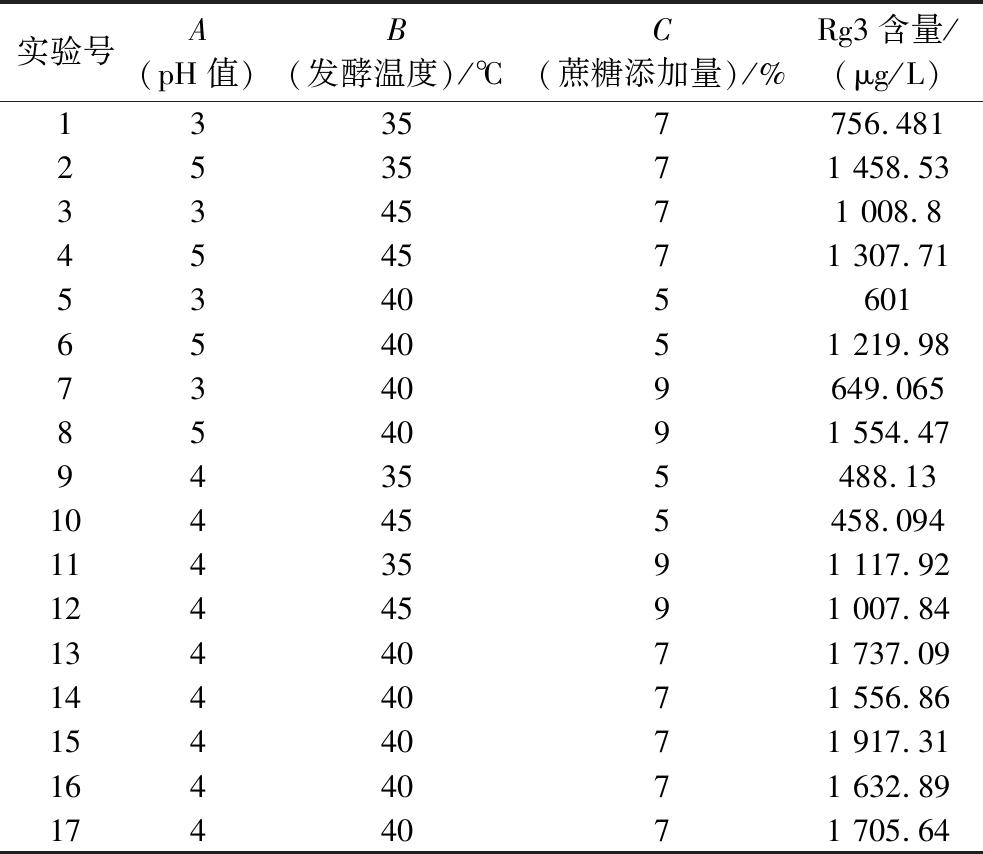
实验号A(pH值)B(发酵温度)/℃C(蔗糖添加量)/%Rg3含量/(μg/L)13357756.481253571 458.53334571 008.8454571 307.7153405601654051 219.9873409649.065854091 554.4794355488.13104455458.0941143591 117.921244591 007.841344071 737.091444071 556.861544071 917.311644071 632.891744071 705.64
采用Design Expert 8.0.6软件拟合回归多项参数,得到人参稀有皂苷Rg3含量(Y)对初始pH值(A)、发酵温度(B)、蔗糖添加量(C)的二次多项回归模型方程:Y=1 709.96+315.67A-4.83B+195.26C-100.78AB+71.61AC-20.01BC-169.47A2-407.61B2-534.36C2。
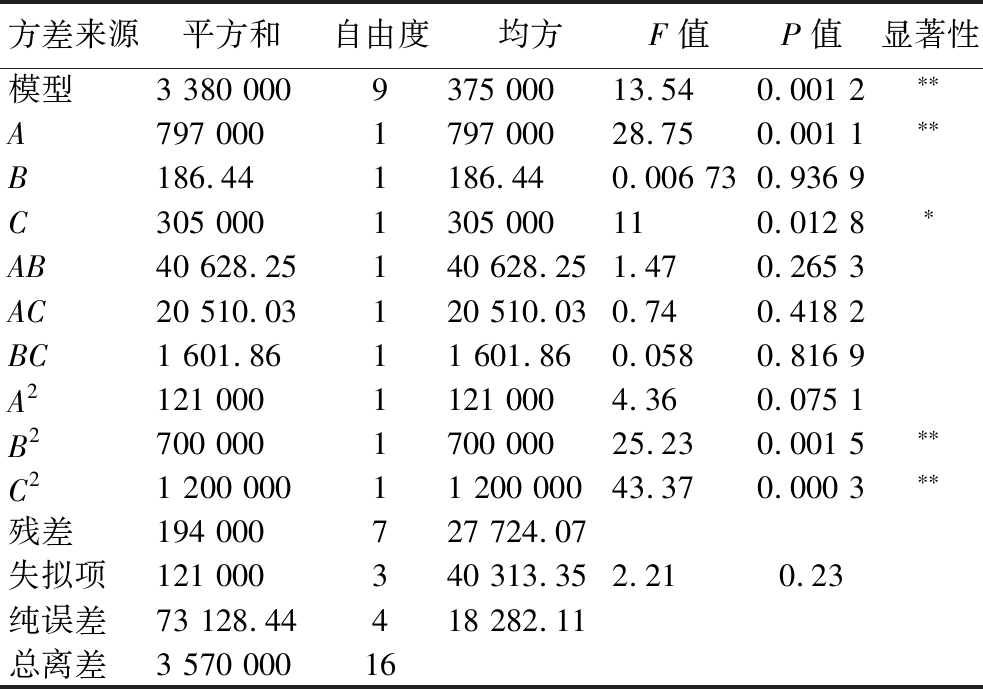
对回归模型进行方差分析,分析结果如表5所示。根据实验数据得到的回归模型P<0.01,模型极显著;失拟项P=0.23>0.05,模型失拟项不显著;R2=0.945 7,说明本次试验的模型相关度较好,置信度较高,可以用于分析和预测工艺条件。各项因素中,一次项A对Rg3含量有极显著影响(P<0.01),C对于Rg3含量有显著影响(P<0.05);二次项B2、C2均对Rg3含量有极显著性影响(P<0.01),其他项对发酵后人参稀有皂苷Rg3含量无显著影响(P>0.05)。综合F值结果,在所取因素水平范围内,各种因素对发酵后人参稀有皂苷Rg3含量的影响顺序为A(pH值)>C(蔗糖添加量)>B(发酵温度)。
表5 以Rg3含量为响应指标的回归模型方差分析
Table 5 Variance analysis of regression model with Rg3 content as response index
注:**表示差异极显著(P<0.01),*表示差异显著(P<0.05),P>0.05表示不显著。
方差来源平方和自由度均方F值P值显著性模型3 380 0009375 00013.540.001 2∗∗A797 0001797 00028.750.001 1∗∗B186.441186.440.006 730.936 9C305 0001305 000110.012 8∗AB40 628.25140 628.251.470.265 3AC20 510.03120 510.030.740.418 2BC1 601.8611 601.860.0580.816 9A2121 0001121 0004.360.075 1B2700 0001700 00025.230.001 5∗∗C21 200 00011 200 00043.370.000 3∗∗残差194 000727 724.07失拟项121 000340 313.352.210.23纯误差73 128.44418 282.11总离差3 570 00016
各因素间的交互作用对人参稀有皂苷Rg3转化效果的响应面图和等高线如图6所示。响应面图中坡度梯度越大,颜色变化越明显,说明该因素对响应值的影响作用越显著。随着发酵温度、蔗糖添加量的增加,人参稀有皂苷Rg3的含量均呈现出先增加至抛物线最高点再下降的趋势;而随着初始pH值的增加,人参稀有皂苷Rg3的含量呈现逐渐上升的趋势。其中初始pH值和发酵温度的响应面图坡度最大,说明这两个影响因素的交互作用最显著。各影响因素交互作用的等高线呈现椭圆形或者马鞍形时,两因素交互作用显著,呈现圆形时两因素交互作用不显著[32],根据等高线图可知,初始pH值和发酵温度、初始pH值和蔗糖添加量的交互作用均强于发酵温度和蔗糖添加量的交互作用。
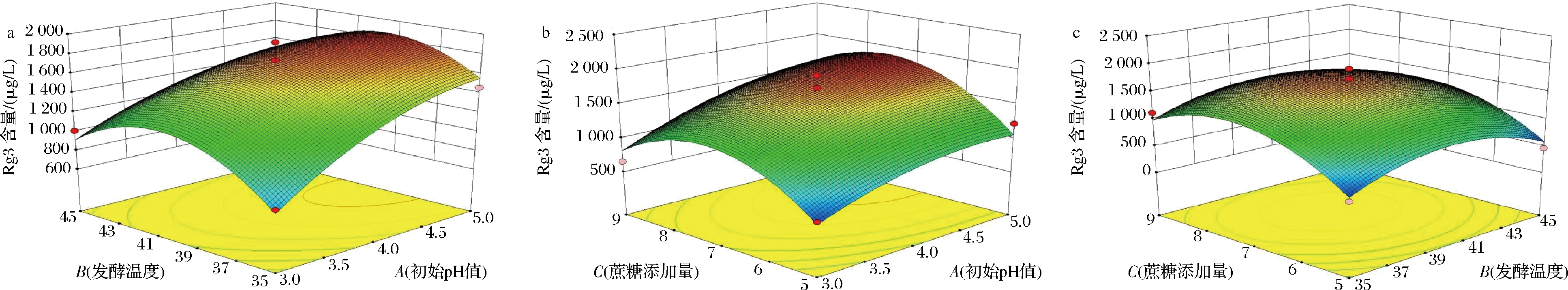
a-初始pH值和发酵温度;b-初始pH值和蔗糖添加量;c-发酵温度和蔗糖添加量
图6 各因素交互作用的响应面
Fig.6 Response surface of the interaction of various factors
综上分析,利用Design Expert 8.0.6软件得出Rg3含量最高(1 896.98 μg/L)的工艺参数为pH值5.0、发酵温度39.33 ℃、蔗糖添加量7.51%。但是各条件在有限范围内进行微调,对Rg3含量影响较小。考虑实际工艺条件,选择发酵最优条件为初始pH值5.0、发酵温度39.0 ℃、蔗糖添加量7.5%。在最优参数下进行5组验证实验,测得Rg3含量为(1 859.62±63.75) μg/L[即(92.981±3.188) mg/L人参发酵液],与理论值接近,该模型得到的优化参数准确性较高。
2.6 发酵过程中人参皂苷生物转化可能途径分析
在最优工艺下,测定人参发酵前后12种人参皂苷含量,所得结果如图7所示。
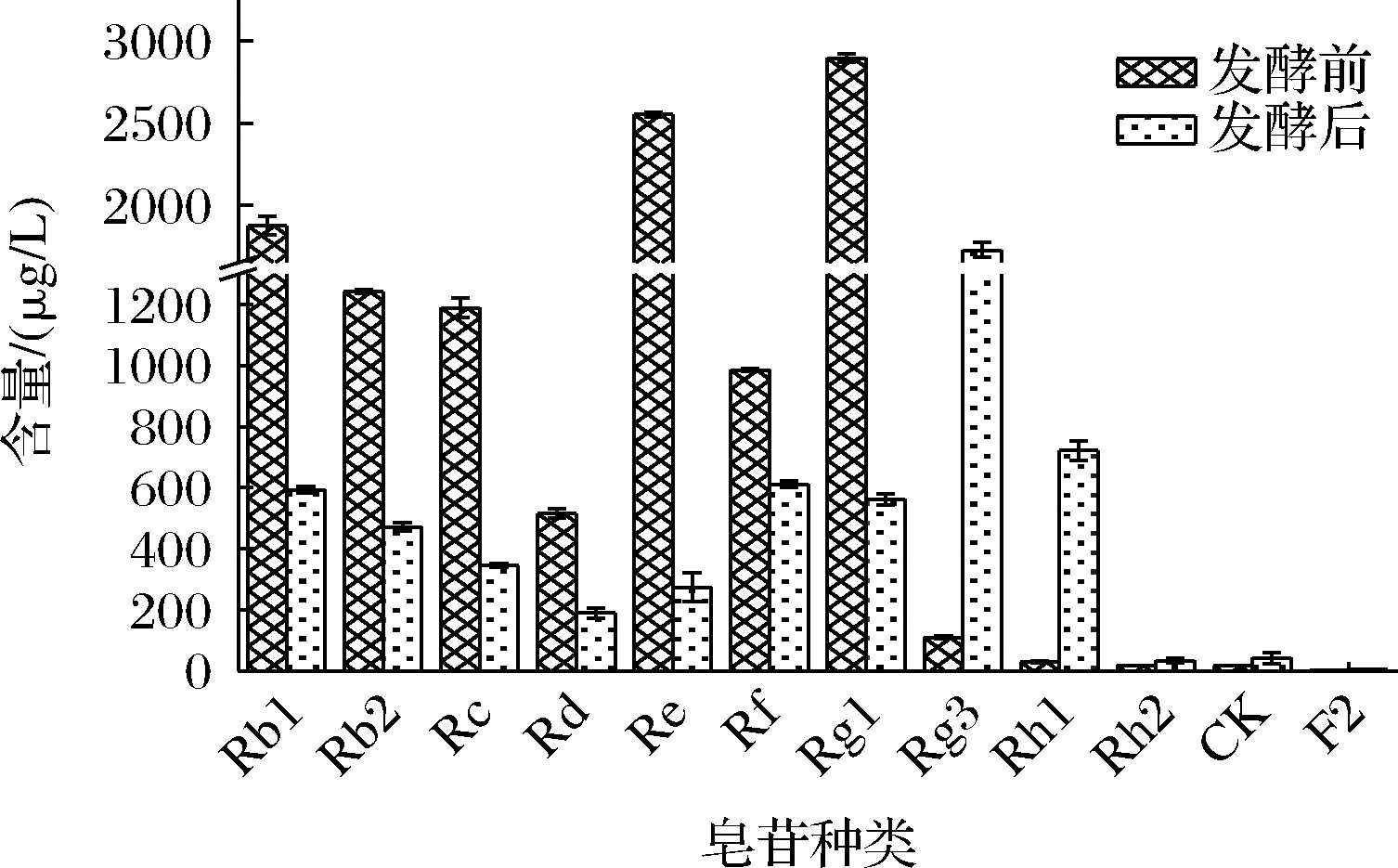
图7 发酵前后人参皂苷的含量
Fig.7 The content of ginsenoside before and after fermentation
12种人参皂苷中,Rb1、Rb2、Rc、Rd、Re、Rf、Rg1经过发酵含量均呈现下降趋势,分别降低68.36%、62.03%、70.94%、63.12%、89.30%、38.01%、80.57%。而Rg3、Rh1、Rh2、CK含量均呈现上升趋势,其中Rg3和Rh1含量提升最为明显,提高倍数均高于10倍。人参原料中Rh2、CK、F2含量较低,F2在发酵前后含量变化不明显。这说明经过乳酸菌发酵作用,有部分原有皂苷转化成稀有皂苷Rg3、Rh1、Rh2、CK。人参皂苷分子结构中所连接的糖苷配基不同,皂苷种类也不同,稀有人参皂苷和原有皂苷结构相比,C3、C6、C20位置上糖基的类型或数目不同,从而生理活性更强。乳酸菌发酵过程中产生的β-葡萄糖苷酶能够水解人参皂苷结构中C3、C6、C20位置上的糖基,将原有皂苷转化为稀有人参皂苷[33]。刘涛[2]发现植物乳杆菌产生的β-葡萄糖苷酶能够水解C3、C20位置上的糖基,实现原人参二醇型皂苷Rb1/Rb2→Rd→F2→CK和Rb1→Rd→Rg3的转化,因此Rb1、Rb2、Rd含量降低而Rg3、F2、CK含量升高。此外人参皂苷Rh1是三醇皂苷型Re、Rg1的次级代谢产物之一,故Re、Rg1浓度降低而Rh1浓度升高[2]。这与本研究结果一致。根据二醇型人参皂苷转化机理,Rh2可以通过Rb1/Rc→Rd→Rg1→Rh2途径进行转化[2]。赵彩秀等[34]发现枯草芽孢杆菌产生的β-葡萄糖苷酶能够断裂Rb1 C20位上的糖苷键生成Rg3。陈玲[35]发现鼠李糖乳杆菌产生的β-葡萄糖苷酶能够将原人参三醇型皂苷Re的C6、C20位分别脱去一分子鼠李糖和葡萄糖生成Rh1。夏晚霞等[3]利用乳酸菌发酵人参皂苷发现转化主要为Rb1→CK、Re→CK、Rb1→Rh1、Re→Rh1、Rb1→Rd→F2→Rg3→CK 5种途径,且该转化途径与发酵过程中皂苷含量变化一致。综上,本研究发酵过程中人参皂苷生物转化可能途径为Rb1/Rb2→Rd→Rg3、Rb1/Re/Rg1→Rh1、Rb1/Re→CK、Rb1→Rd→F2、Rb1/Rc→Rd→Rg1→Rh2。
3 结论与讨论
本研究选用9株乳酸菌进行人参发酵,以发酵后稀有人参皂苷Rg3含量作为评价指标,筛选出副干酪乳杆菌B16 NY2107、B16 WI2110、B04 WI2501共3株发酵效果较好的单菌株后进行菌株间的复合菌发酵,确定最优复合菌组合为副干酪乳杆菌B16 NY2107和B04 WI2501,发酵时间为9 d,接种量为1%,接种比例为1∶1。利用单因素试验和响应面实验进行发酵工艺优化,确定最优发酵工艺为初始pH值5.0,发酵温度39.0 ℃,蔗糖添加量7.5%,此条件下人参发酵后发酵液中Rg3含量为(92.981±3.188) mg/L,较发酵前含量提高14.86倍,所选择的乳酸菌及复合方案发酵效果良好,说明菌种及其复配方案、最优条件的选择对人参皂苷转化程度非常重要。对本研究发酵过程中人参皂苷生物转化可能途径进行分析,人参皂苷生物转化可能途径为Rb1/Rb2→Rd→Rg3、Rb1/Re/Rg1→Rh1、Rb1/Re→CK、Rb1→Rd→F2、Rb1/Rc→Rd→Rg1→Rh2。综上,乳酸菌发酵转化人参皂苷是一种绿色环保、安全高效的生物转化方法,具有广泛的应用前景,未来可进一步进行扩大菌株及其复配方案、最优发酵工艺的选择,促进乳酸菌发酵技术在人参皂苷转化领域的应用,同时需加强发酵过程皂苷定量研究,以明确人参发酵过程中皂苷的转化机理。本研究确定了发酵过程中的菌株、复合方案及发酵工艺,并对可能的生物转化途径进行分析,以期为乳酸菌在稀有人参皂苷转化研究中的利用及人参发酵产品的开发提供参考。
[1] 国家药典委员会编. 中国药典[M].北京:化学工业出版社, 2010:8-9.
National Pharmacopoeia Commission.Chinese Pharmacopoeia[M].Beijing:Chemical Industry Press, 2010:8-9.
[2] 刘涛. 人参酵素生物转化及发酵工艺研究[D].广州:华南理工大学, 2018.
LIU T.Study on biotransformation and fermentation process of ginseng jiaosu[D].Guangzhou:South China University of Technology, 2018.
[3] 夏晚霞, 张尚微, 葛亚中, 等.乳酸菌发酵转化人参皂苷[J].现代食品科技, 2018, 34(9):136-142;157.
XIA W X, ZHANG S W, GE Y Z, et al.Fermentation transformed ginsenoside by lactic acid bacteria[J].Modern Food Science and Technology, 2018, 34(9):136-142;157.
[4] PARK J S, SHIN J A, JUNG J S, et al.Anti-inflammatory mechanism of compound K in activated microglia and its neuroprotective effect on experimental stroke in mice[J].The Journal of Pharmacology and Experimental Therapeutics, 2012, 341(1):59-67.
[5] LAW C K M, KWOK H H, POON P Y, et al.Ginsenoside compound K induces apoptosis in nasopharyngeal carcinoma cells via activation of apoptosis-inducing factor[J].Chinese Medicine, 2014, 9(1):11.
[6] 杨凯, 吴小梅.人参皂甙单体 Rh2、Re、Rh1对小鼠皮层神经细胞缺氧的保护作用[J].南通医学院学报, 2002, 22(2):134-135.
YANG K, WU X M.Protective effects of ginsenosides Rg2、Re、Rh1 on hypoxic indury of cultured mouse cortical neurons[J].Journal of Nantong University(Medical Sciences), 2002, 22(2):134-135.
[7] CHOI Y J, YOON J H, CHA S W, et al.Ginsenoside Rh1 inhibits the invasion and migration of THP-1 acute monocytic leukemia cells via inactivation of the MAPK signaling pathway[J].Fitoterapia, 2011, 82(6):911-919.
[8] JUNG J S, KIM D H, KIM H S.Ginsenoside Rh1 suppresses inducible nitric oxide synthase gene expression in IFN-γ-stimulated microglia via modulation of JAK/STAT and ERK signaling pathways[J].Biochemical and Biophysical Research Communications, 2010, 397(2):323-328.
[9] 倪劲松, 辛颖, 王心蕊, 等.20(S)-人参皂苷Rg3对Lewis肺癌生长及转移的抑制作用[J].肿瘤防治研究, 2006, 33(5):311-313.
NI J S, XIN Y, WANG X R, et al.Inhibitory effect of 20(S)-ginsenoside Rg3 on growth and metastasis of Lewis pulmonary carcinoma[J].Cancer Research on Prevention and Treatment, 2006, 33(5):311-313.
[10] HAN N R, KO S G, MOON P D, et al.Ginsenoside Rg3 attenuates skin disorders via down-regulation of MDM2/HIF1α signaling pathway[J].Journal of Ginseng Research, 2021, 45(5):610-616.
[11] 裴文渊. 人参乳酸菌发酵工艺优化及Rh1对环氧丙醇所致细胞损伤的保护作用研究[D].长春:吉林大学, 2020.
PEI W Y.Optimization of ginseng fermentation process with lactic acid bacteria and the protective effect of Rh1 on cell damage induced by glycidol[D].Changchun:Jilin University, 2020.
[12] SHOJI S B, TOSHO A. Chemical studies on the oriental plant drugs. XVII. The prosapogenin of the ginseng saponins: Ginsenosides-Rb1, -Rb2, and -Rc[J]. Chempharm Bull, 1966,14(10):1157-1161.
[13] ZHANG J, GUO H Z, TIAN Y, et al.Biotransformation of 20(S)-protopanaxatriol by Mucor spinosus and the cytotoxic structure activity relationships of the transformed products[J].Phytochemistry, 2007,68(20):2523-2530.
[14] KIM B H, LEE S Y, CHO H J, et al. Biotransformation of Korean Panax ginseng by pectinex[J]. Biological and Pharmaceutical Bulletin, 2006, 29(12):2472-2478.
[15] BAI Y P, G NZLE M G.Conversion of ginsenosides by Lactobacillus plantarum studied by liquid chromatography coupled to quadrupole trap mass spectrometry[J].Food Research International, 2015, 76:709-718.
NZLE M G.Conversion of ginsenosides by Lactobacillus plantarum studied by liquid chromatography coupled to quadrupole trap mass spectrometry[J].Food Research International, 2015, 76:709-718.
[16] AZAD M A K, SARKER M, LI T J, et al.Probiotic species in the modulation of gut microbiota:An overview[J].Biomed Research International, 2018, 2018:9478630.
[17] MALDONADO GALDEAND C, CAZORLA S I, LEMME DUMIT J M, et al.Beneficial effects of probiotic consumption on the immune system[J].Annals of Nutrition &Metabolism, 2019, 74(2):115-124.
[18] 王文梅, 许丽.乳酸菌体外和体内降解胆固醇的机理及其应用[J].动物营养学报, 2014,26(2):295-303.
WANG W M, XU L.Lactic acid bacteria:Mechanisms for cholesterol degradation in vitro and in vivo and its application[J].Chinese Journal of Animal Nutrition, 2014,26(2):295-303.
[19] 黄宁馨. 复合乳酸菌发酵枸杞汁的工艺优化及其营养品质变化研究[D].武汉:华中农业大学, 2021.
HUANG N X.Study on the optimization of fermatation process of Coji juice by combined lactic acid bacteria and the changes of nutritional quality[D].Wuhan:Huazhong Agricultural University, 2021.
[20] 张倩茹, 尹蓉, 王贤萍, 等.乳酸菌发酵树莓饮料的工艺优化[J].食品科技, 2021, 46(5):99-103.
ZHANG Q R, YIN R, WANG X P, et al.Optimization of fermented technology of raspberry beverage by lactic acid bacteria[J].Food Science and Technology, 2021, 46(5):99-103.
[21] 王玥, 杨明美, 李梦丽, 等.柿子乳酸菌发酵饮料的加工工艺研究[J].中国食品学报, 2020, 20(7):118-125.
WANG Y, YANG M M, LI M L, et al.Studies on the fermentation process of persimmon fruit lactic acid beverage[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(7):118-125.
[22] 朱珺, 钱永清, 吴琴, 等.人参发酵菌种的筛选及皂苷转化能力研究[J].食品与发酵工业, 2023, 49(8):159-163.
ZHU J, QIAN Y Q, WU Q, et al.Screening of ginseng fermented bacteria strains and research on the transformation abilities of ginsenoside[J].Food and Fermentation Industries, 2023, 49(8):159-163.
[23] 万振堂, 杨丽杰.产胞外β-葡萄糖苷酶乳酸菌的筛选及其酶学性质的初步研究[J].食品与发酵工业, 2009, 35(4):28-32;37.
WAN Z T, YANG L J.Screening lactic acid bacteria to produce extracellular β-glucosidase and the preliminary studies of the enzyme properties[J].Food and Fermentation Industries, 2009, 35(4):28-32;37.
[24] PARK C S, YOO M H, NOH K H, et al.Biotransformation of ginsenosides by hydrolyzing the sugar moieties of ginsenosides using microbial glycosidases[J].Applied Microbiology and Biotechnology, 2010, 87(1):9-19.
[25] 张倩, 国立东, 都晓伟.人参的益生菌发酵及其发酵产品研究进展[J].食品与发酵工业, 2022, 48(13):311-319.
ZHANG Q, GUO L D, DU X W.Research progress on probiotic fermentation of ginseng and its products[J].Food and Fermentation Industries, 2022, 48(13):311-319.
[26] LEE S J, KIM Y, KIM M G.Changes in the ginsenoside content during the fermentation process using microbial strains[J].Journal of Ginseng Research, 2015, 39(4):392-397.
[27] AH B E, YOUNG K N, JOO H M, et al.Transformation of ginsenosides to compound K(IH-901) by lactic acid bacteria of human intestine[J].Journal of Microbiology and Biotechnology, 2003, 13(1):9-14.
[28] 薛兢兢, 周仕林, 董锋, 等.人参提取和人参发酵工艺的主要有效成分对比评价[J].改革与开放, 2017(8):78-81.
XUE J J, ZHOU S L, DONG F, et al.Comparative evaluation of main effective components in ginseng extraction and ginseng fermentation processes[J].Reform &Openning, 2017(8):78-81.
[29] 步李卿. 乳酸菌发酵玉米工艺条件优化及其对营养价值和发酵品质影响的研究[D].烟台:烟台大学, 2021.
BU L Q.Optimization of fermentation conditions of corn by lactic acid bacteria and its effect on nutritional value and fermentation quality[D].Yantai:Yantai University, 2021.
[30] 冯金晓, 李明珠, 俞莹.乳酸菌及酵母菌复合发酵紫甘薯汁工艺研究[J].现代食品, 2020(19):97-100.
FENG J X, LI M Z, YU Y.Study on the technology of purple sweet potato juice fermentation by lactic acid bacteria and yeast[J].Modern Food, 2020(19):97-100.
[31] 刘国明, 孙健, 彭宏祥, 等.龙眼发酵饮料的工艺优化及其对DPPH的清除效果研究[J].食品工业科技, 2019, 40(24):104-109.
LIU G M, SUN J, PENG H X, et al.Process optimization and DPPH scavenging effect of Longan fermented beverage[J].Science and Technology of Food Industry, 2019, 40(24):104-109.
[32] 董舒月. 人参提取物对乳酸菌发酵特性的影响及其应用研究[D].长春:吉林大学, 2022.
DONG S Y.Effect of ginseng extract on fermentation characteristics of lactic acid bacteria and its application[D].Changchun:Jilin University, 2022.
[33] 章沙沙, 张海玲, 叶静, 等.稀有人参皂苷微生物转化研究进展[J].特产研究, 2021, 43(2):91-96.
ZHANG S S, ZHANG H L, YE J, et al.Advances in studies on microbial transformation of rare ginsensides[J].Special Wild Economic Animal and Plant Research, 2021, 43(2):91-96.
[34] 赵彩秀, 王楠, 黄鑫, 等.枯草芽孢杆菌JLGA-SD-28转化人参皂苷Rb1的特性及其全基因组测序分析[J].中成药, 2021, 43(2):518-523.
ZHAO C X, WANG N, HUANG X, et al.Characteristics and genome-wide sequencing of ginsenoside Rb1 transformed by Bacillus subtilis JLGA-SD-28[J].Chinese Traditional Patent Medicine, 2021, 43(2):518-523.
[35] 陈玲. 乳酸菌发酵对人参皂苷的影响及抗肿瘤活性研究[D].长春:吉林大学, 2017.
CHEN L.Study on the effect of lactic acid bacteria fermentation on ginsenoside and its antitumor activity[D].Changchun:Jilin University, 2017.