随着人们生活习惯和膳食结构的改变,肥胖和高脂血症在全球范围内的发病率日趋增高。高脂血症是指因机体内脂肪代谢异常,使血浆中的一种或多种脂质高于正常指标的一种代谢紊乱综合症。其与冠心病、脑中风、高血压等高致死率疾病的形成过程密切相关,同时,也是引起脂肪肝、动脉粥样硬化和心脑血管疾病的罪魁祸首[1]。研究发现,高脂饮食会改变肠道微生物结构,增加肠胃炎症性反应,进而对代谢及免疫系统造成不利影响[2]。近年来,国内外学者研究发现,肠道微生物与脂质代谢之间存在着错综复杂的关系。肠道微生物能够通过控制宿主从食物中摄取能量的效率,来调控脂肪代谢以及高脂血症的发生[3],高脂血症通过破坏肠道微生物赖以生存的环境来影响肠道菌群的构成[4]。目前临床上对高脂血症的治疗主要以他汀类药物为主,该类药物在治疗中常会伴随如肝损害、肌肉毒性和出血性脑卒中等一些不良反应。因此,寻求安全、天然的降血脂药是当前高脂血症治疗领域的迫切需求。
茯砖茶是中国地区特有的一类黑茶,其经过微生物后发酵过程,在茶叶表面和内部形成独特的“金花”-冠突散囊菌(Eurotium cristatum)。众多研究报道了茯砖茶在降脂减肥、降糖降压、抑制炎症、保护肝脏、调节肠道菌群等方面的保健功效[5-6]。近期研究表明,茯砖茶具有多种生物活性,特别是抗肥胖和降脂活性为当前研究的热点,同时,越来越多的研究表明其调节脂代谢的活性可能跟其调节肠道菌群活性相关[7-8]。甘薯(Dioscorea esculenta (Lour.) Burkill)属旋花科,又名白薯、番薯、红薯等,茎叶含有大量的蛋白质、胡萝卜素、类胡萝卜素、维生素以及黄酮类、酚类和一些人体所需的必需氨基酸等。甘薯提取物具有较好的降血脂和降胆固醇、防止动脉硬化、抗衰老、增强机体免疫力等功效。其在饮食诱导的糖尿病[9]、高血脂[10]和肿瘤[11]等研究中均表现出了较好的调节和治疗作用。甘薯茎叶生长茂盛,产量极高,但是大部分都废弃在田地中自然凋零,造成极大的资源浪费。本研究以甘薯茎叶为原料,通过冠突散囊菌的固态发酵过程获得发酵甘薯茶,同时建立SD大鼠高脂模型,探讨其甘薯茶对高脂大鼠血脂以及肠道菌群的影响。
1 材料与方法
1.1 材料与试剂
高脂饲料配方(猪油10%、胆固醇2%、蔗糖30%、蛋黄粉5%、胆酸盐0.5%、基础饲料52.5%,质量分数),基础饲料购自北京华阜康生物科技股份有限公司。总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白(low density lipoprotein- cholesterol, LDL-C)及高密度脂蛋白(high density lipoprotein-cholesterol, HDL-C)等测量试剂盒,南京建成生物科技有限公司。
孢子悬浮液制备:将冠突散囊菌保存菌种接种于制备好的PDA培养基上,在28 ℃下培养4 d后刮取菌丝,转移到盛有100 mL无菌水的三角瓶中,28 ℃、120 r/min振荡30 min,血球计数板计数,并稀释至细胞密度为4×106/mL。
新鲜甘薯叶经分捡,切碎,烘干后,按照接种量为培养基质量的5%将制备的孢子悬液接种到叶上,在28 ℃、相对湿度75%的环境下渥堆发酵4 d,以叶上布满冠突散囊菌菌丝,生长旺盛,即为发酵结束。取茶饼200 g,加500 mL水文火煎煮30 min,过滤,二次煎煮20 min,过滤,合并2次滤液,冷冻干燥,获得冻干粉,密封包装,-20 ℃保存备用。每次使用前充分溶于5 mL无菌水备用。
1.2 实验方法
1.2.1 实验动物分组及模型建立
健康雄性SD大鼠体重(200±20) g,由北京华阜康生物科技股份有限公司提供,许可证号SCXK(京)2019-0008。在室温22~26 ℃、相对湿度50%~70%的环境下饲养。本研究中涉及实验动物的处理,符合陕西中医药大学实验动物伦理委员会的相关规定(动物伦理审查备案编号SUCMDL为20220328001)。
实验大鼠适应性基础喂养1周后,分为对照组(NC,n=8)、模型组(HFD,n=8)、低剂量组(ZHL,n=8)和高剂量组(ZHH,n=8)。正常组和模型组每天各灌胃一次5 mL无菌水,剂量组每天灌胃一次5 mL 冻干粉水溶液。每次使用前根据各组大鼠体重调节所需冻干粉剂量,实验期间,大鼠可自由进食和随意饮水。每组所给饲料和实验处理如表1所示。给药剂量依据《药理试验方法学》中“标准体重动物剂量换算表”来确定。
表1 实验动物模型构建方法
Table 1 Method of constructing experimental animal model
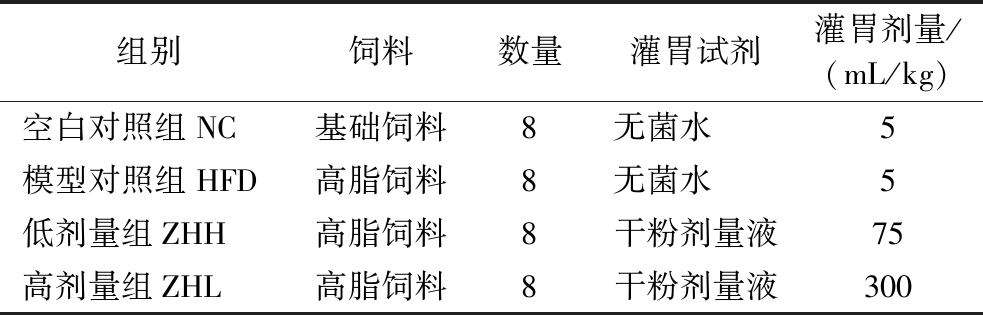
组别饲料数量灌胃试剂灌胃剂量/(mL/kg)空白对照组NC基础饲料8无菌水 5 模型对照组HFD高脂饲料8无菌水 5低剂量组ZHH高脂饲料8干粉剂量液75高剂量组ZHL高脂饲料8干粉剂量液300
1.2.2 组织样品采集
实验大鼠每周称重1次。末次给药后禁食不禁水12 h,收集新鲜粪便于无菌EP管中,置于-80 ℃冰箱保存待测。大鼠处死后,收集血清待测,并摘取肝脏组织,生理盐水冲洗后,置于4%多聚甲醛溶液中,4 ℃冰箱保存。
1.2.3 血清生化指标的测定
将1.2.2节收集的血清,在4 ℃下低温3 000 r/min离心15 min分离血清,依据测量试剂盒中的操作说明,检测血清中TC、TG、LDL-C、HDL-C含量。
1.2.4 大鼠肝脏组织形态学的观察
取4%多聚甲醛溶液固定的大鼠肝脏组织,经过脱水、包埋,制备成石蜡切片,苏木精-伊红(hematoxylin-eosin,HE) 染色后,光学显微镜下观察肝脏组织的病理改变。
1.2.5 肠道微生物DNA的提取及测序
将-80 ℃冰箱保存的大鼠粪便,使用E.Z.N.A.® Soil DNA抽提试剂盒提取DNA。所有操作步骤均严格按照试剂盒说明书进行。提取后DNA样品用Nano-drop超微量分光光度计检测DNA样品的浓度和纯度。PCR扩增和测序工作由上海美吉生物医药科技有限公司按照标准流程运用 Illumina MiSeq PE300 平台完成。以338F(5′-ACTCCTACGGGAGCAG-3′)和806R(5′-GCACTACHVGGGTWTCTAAT-3′)为引物,扩增大鼠粪便菌群16S rDNA的V3+V4可变区。
使用NEXTFLEX Rapid DNA-Seq Kit构建MiSeq PE文库,并利用QIIME v1.9.1对从Illumina MiSeq平台获取的原始数据进行特定过滤处理。用UPARSE(version 7.1)对筛选序列进行操作分类单元(operational taxonomic units, OTU)聚类分析,控制序列相似度为97%,按照各样本OTUs最低数量,将原始数据抽平分析。用RDP classifier贝叶斯算法对97%相似的OTUs序列进行分类学分析。基于OTU水平,Wilcoxon秩和检验分析样本内大鼠肠道菌群的Alpha多样性;基于Bray-Curtis距离进行主坐标分析(principle coordinate analysis, PCoA)计算样本间的Beta多样性,并分析菌群间的组成差异性。
1.2.6 数据分析
实验数据均以“平均值±标准差”表示,采用SPSS 22.0软件进行统计学分析,Graphpad Prism 8.0软件绘图。采用ANOVA及Dunnett’s t检验进行组间差异性分析,P<0.05为差异显著。
2 结果与分析
2.1 甘薯茶饮对大鼠体重的影响
体重是判断个体肥胖的直观指标,如图1-a所示,HFD组大鼠的体重相对稳定上升,且保持组间最高,NC组大鼠体重明显低于HFD组,表明高脂饮食增加了实验大鼠的体重。在1~2周时大鼠体重变化幅度不稳定,可能是由于不适应灌胃方式。从3周开始,各组大鼠体重相对平稳上升,HFD组大鼠体重最高,ZHH组体重最低。Lee′s指数是评价肥胖程度的有效指数,数值越大、表明动物肥胖程度越严重。如图1-b所示,HFD组大鼠Lee′s指数最高,且显著高于NC组(P<0.05),ZHH组Lee′s指数相比HFD组显著降低(P<0.05)。综上表明,甘薯茶可以降低肥胖大鼠体重和Lee′s指数,减轻其肥胖程度。
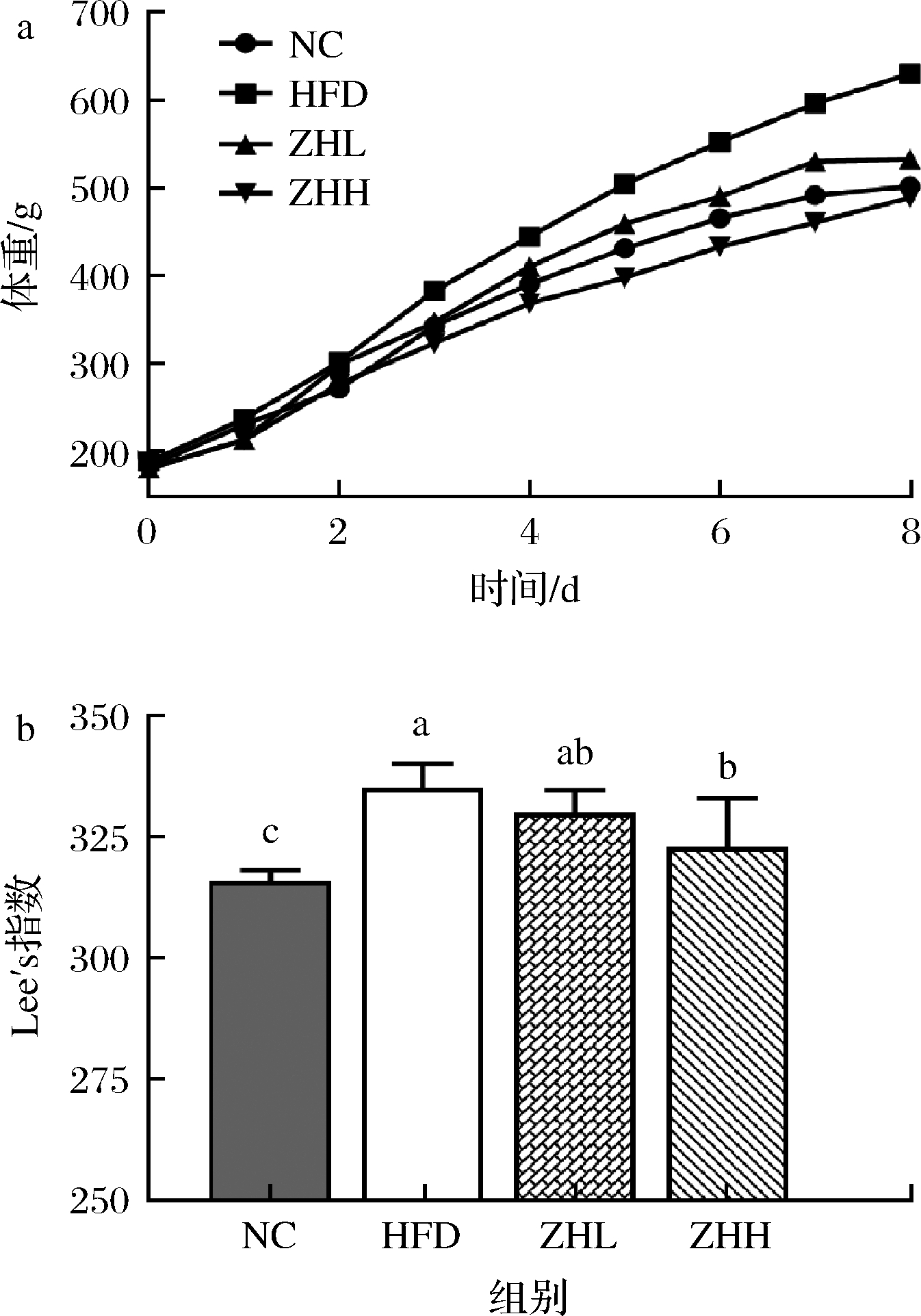
a-体重变化;b-Lee′s指数
图1 甘薯茶饮对大鼠体重的影响
Fig.1 Effect of sweet potato tea on body weight of rats
注:不同字母表示组间存在显著差异(P<0.05)(下同)。
2.2 对大鼠血脂水平的影响
如图2-a~图2-c所示,与NC组相比较,HFD组大鼠血清中的TC、TG以及LCL-C含量显著升高(P<0.05),表明高脂喂养导致大鼠血脂异常,动物模型建立成功。与HFD组相比较,ZHL组和ZHH组的TC、TG以及LCL-C含量均显著降低(P<0.05),说明甘薯茶可以有效降低血清中的TG、TC以及LCL-C含量。图2-d显示,HFD组的HDL-C含量低于NC组,而ZHH组相比HFD组,血清中HDL-C含量升高,但无统计学差异。长期的高热量饮食会导致血清中总胆固醇和甘油三酯含量的增高,从而引发高血脂症、糖尿病等相关疾病。低密度脂蛋白可以促进动脉管壁形成动脉粥样硬化,是动脉粥样硬化一项非常危险的因素[12]。结果表明,甘薯茶具有较好的降脂效果,同时有助于减少宿主患动脉粥样硬化几率。
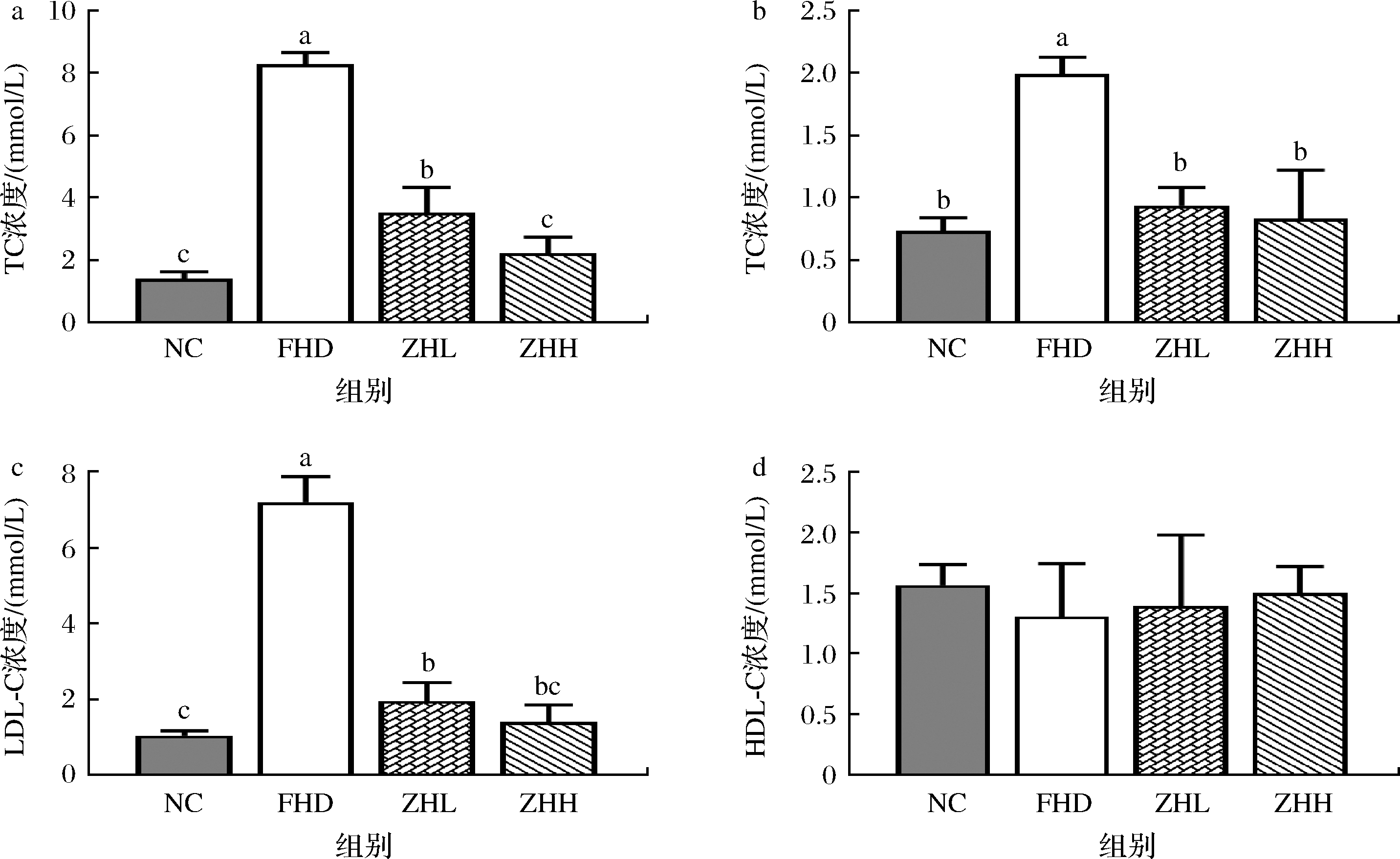
a-TC;b-TG;c-LDL-C;d-HDL-C
图2 大鼠血清脂质含量
Fig.2 Serum lipid levels of rats
2.3 对大鼠肝脏结构的影响
灌胃8周后,镜下观察大鼠肝脏组织HE染色石蜡切片的病理显微结构。如图3所示,NC组肝细胞形态正常,细胞核染色清晰,肝组织结构清晰完整。HFD组大鼠的肝脏组织出现肝索结构紊乱,具有明显的空泡样变性,肝细胞坏死等现象。与HFD组相比较,ZHL组和ZHH组肝脏组织细胞结构趋于整齐,未见明显空泡现象。ZHH组肝索排列更为整齐,细胞核清晰可见。以上信息表明甘薯茶对高脂大鼠肝损伤有一定保护作用。
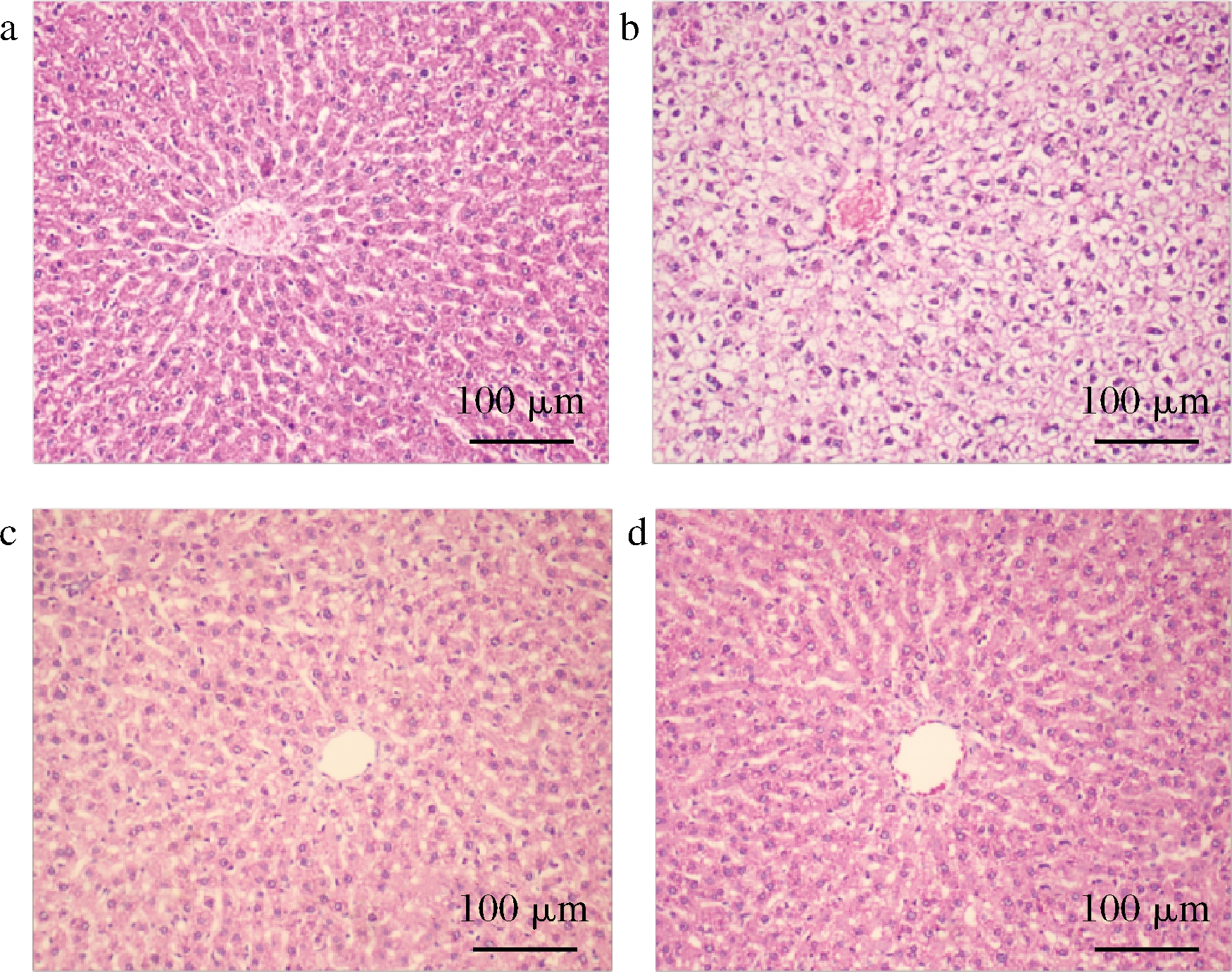
a-NC;b-FHD;c-ZHL;d-ZHH
图3 干预对高脂大鼠肝脏组织形态的影响(200×)
Fig.3 Effects of intervention on liver morphology in high-fat rats(200×)
2.4 菌群多样性分析
Alpha多样性是对样本中物种多样性的分析,反映微生物群落的丰富度和多样性。各组大鼠α多样性指标如表2所示。
表2 肠道菌群Alpha多样性统计表(n=8)
Table 2 Statistic of gut microbiota Alpha-diversity (n=8)

注:不同字母表示组间存在显著差异(P<0.05)。
组别SobsSimpsonChao1CoverageNC622.75±34.238a0.033±0.030a693.8±22.995a0.997 37HFD397.25±74.786b0.043±0.016a489.52±97.428b0.997 68ZHH490.75±85.078a0.058±0.046a594.01±98.421a0.997 29
Coverage指数反映了样本微生物群落的覆盖度,如表2所示,样本中的Coverage指数值均在0.997以上,表明测序数据覆盖率达到99.7%以上,测序深度和广度合理。Sobs指数和Chao1指数反映了微生物群落多样性和丰富度。与NC组相比,HFD组Chao1指数和Sods指数均显著性降低,表明经过高脂喂养,大鼠肠道菌群的丰富度和均匀度均有所下降。与HFD组相比ZHH组指数呈上升趋势。Simpson指数则反映了群落均匀度。ZHH组Simpson指数高于HFD组,无统计学差异。以上结果表明长期高脂饮食可以降低大鼠肠道菌群的物种丰富度和均匀度,而甘薯茶饮则能更好的改善大鼠肠道菌群的物种多样性和丰富度,但未能显著提高物种均匀度。
基于Bray-Curtis距离进行PCoA比较各组大鼠菌群结构的差异。经基于置换的多元方差分析(permutational multivariate analysis of variance, Per MANOVA) (置换次数999,P=0.001 0),如图4所示,沿着PC1水平,高脂饮食大鼠菌群与NC组分布较远,说明其群落结构的分布明显不同。同时ZHH组与HFD组很好的区分开,并且与正常组在PC1水平有接近的趋势。表明甘薯茶使得ZHH组大鼠肠道菌群结构与HFD组相比发生了改变,部分恢复了大鼠肠道菌群的结构。PC1的贡献度是30.25%,PC2的贡献度是15.12%。
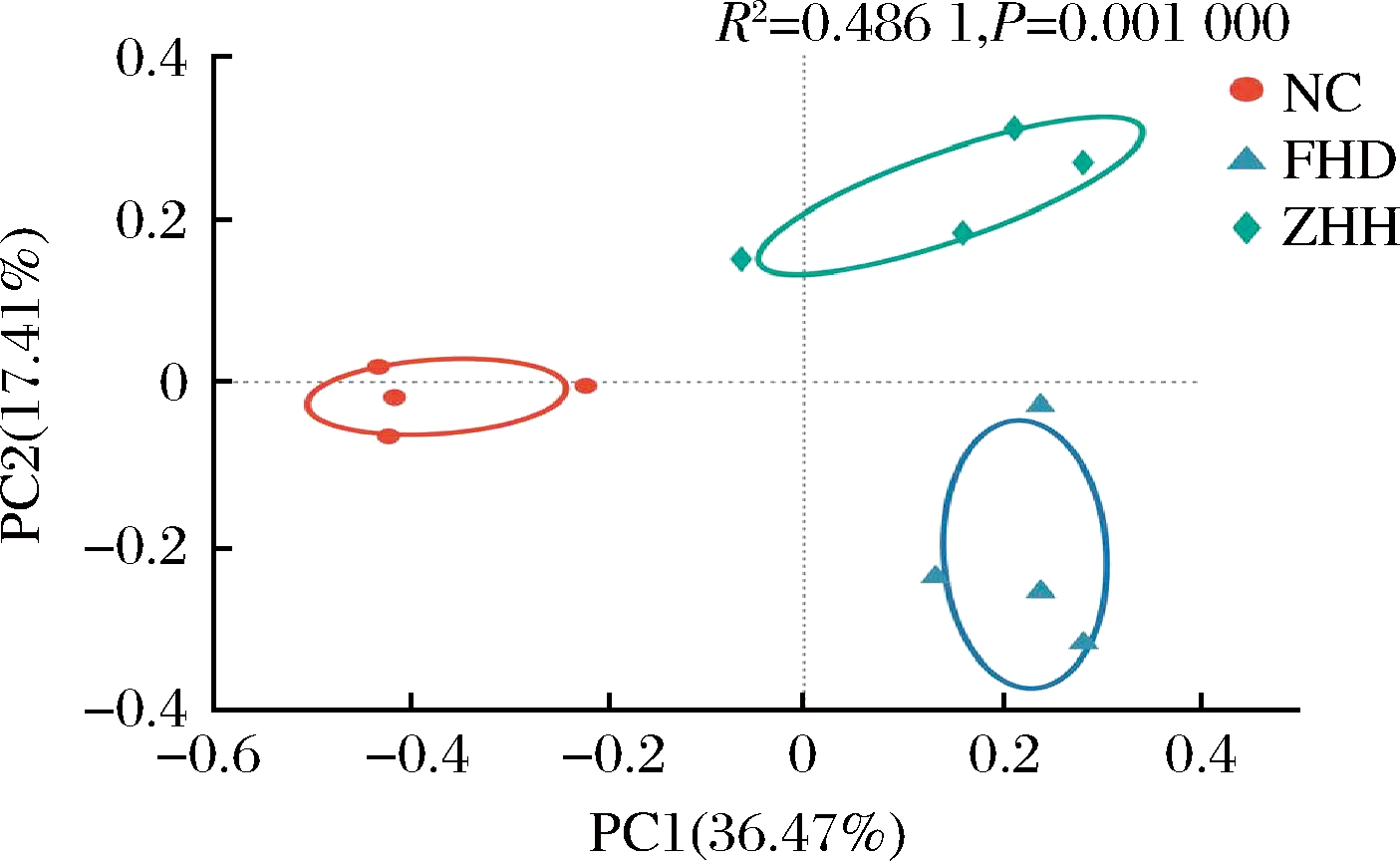
图4 β多样性分析:PCoA分析
Fig.4 β-diversity index:PCoA
2.5 大鼠肠道菌群门水平的分析
如图5-a所示,在门水平上,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)等菌门的丰度相对较高,其中厚壁菌门和拟杆菌门的丰度之和占总细菌的80%以上,是各组中的绝对优势菌门。由图5-b、图5-c可知,与NC组相比,经高脂喂养,大鼠体内Firmicutes丰度显著降低,Bacteroidota丰度被升高,其中厚/拟比值也显著降低,这一结果与ZHANG等[13]、LIN等[14]研究一致,高脂模型组内拟杆菌门相对更丰富。经干预后大鼠肠道菌群的厚/拟比值升高。上述结果表明经冠突散囊菌发酵后的甘薯茶能够减轻高脂饮食引起的肠道菌群门水平紊乱。

a-门水平相对丰度;b-厚壁菌门的相对丰度;c-拟杆菌门的相对丰度;d-厚/拟比
图5 大鼠肠道菌群门水平物种相对丰度
Fig.5 Relative abundance of species at the phylum level of intestinal flora in rats
2.6 大鼠肠道菌群属水平的分析
如图6-a所示,长期高脂饮食导致各组大鼠菌属相对丰度不同。研究发现,瘤胃球菌属与代谢紊乱存在关联,其在高脂膳食宿主肠道内的相对丰度较低[14]。Christensenellaceae属于厚壁菌门,是人类和动物肠道及黏膜中广泛存在的潜在益生菌,对宿主健康非常重要,与脂肪沉积和炎症等代谢疾病呈负相关[15]。如图6-b 所示,与NC组相比较,HFD组NK4A214 group、Christensenellaceae_R-7 group的含量显著降低,经过甘薯茶饮干预后,在ZHH组二者含量均升高。

a-属水平相对丰度;b-部分菌群的相对丰度
图6 大鼠肠道菌群属水平物种相对丰度
Fig.6 Relative abundance of species at the geneus level of intestinal flora in rats
有研究表明,布劳特氏菌(Blautia)含量的增加响应于高脂饮食的摄入[16-17]。Lachnoclostridium相对丰度与血清脂肪酶水平呈正相关,可促使机体发生炎症反应[18]。拟杆菌属(Bacteroides)可通过促进对植物多糖的消化吸收及抑制FIAF基因(fasting-induced adipocyte factor,禁食引起的脂肪细胞因子)的表达,来促使脂肪的积累及肥胖的形成[19]。如图6-b所示,HFD组Blautia、Lachnoclostridium和Bacteroides含量相比NC组显著升高,而经过甘薯茶饮干预后,ZHH组的含量均明显降低。
2.7 肠道菌群功能预测的差异分析
为了进一步探讨甘薯茶饮对大鼠肠道菌群代谢的影响,将通过16S rDNA测序获得的物种构成与KEGG PATHWAY数据库比对,应用STAMP差异分析对各组样品进行功能预测分析,结果如图7所示,HFD组大鼠半胱氨酸和蛋氨酸代谢显著低于NC组,蛋氨酸可通过转硫途径生成半胱氨酸,进而促进谷胱甘肽合成,参与体内抗氧化反应,抑制脂质过氧化,减少肝内脂肪蓄积[20]。结果显示高脂饮食可抑制该代谢水平导致紊乱,引起机体肝细胞脂肪变性,促进脂肪肝形成。通过干预后,ZHH组半胱氨酸和蛋氨酸代谢得以恢复。亚油酸是脂肪酸代谢的关键物质,也是花生四烯酸合成的前体物质,体内亚油酸和花生四烯酸含量升高会导致机体炎症加强[21]。结果显示高脂饮食可导致大鼠体内亚油酸代谢及花生四烯酸代谢通路紊乱,甘薯茶可以显著下调该代谢通路,降低炎症几率。

a-FHD组与NC组比较;b-FHD组与ZHH组比较
图7 大鼠肠道菌群功能预测
Fig.7 Differential analysis of intestinal flora function prediction
3 讨论
有研究表明,长期高脂饮食可诱发如肥胖、非酒精性脂肪肝和高脂血症等多种慢性疾病的发生[13-14]。本研究通过高脂饲料喂养来建立高脂血症大鼠模型,并观察冠突散囊菌固态发酵的甘薯茶对高脂血症大鼠肥胖及肠道菌群紊乱的影响。研究中发现,高脂饮食不但能够引起大鼠肥胖,还会导致大鼠血脂代谢异常的发生。血脂代谢异常是指血浆中的一种或多种脂质高于正常指标。本实验中,模型组大鼠血清TC、TG以及LDL-C含量均显著升高,这表明高脂血症大鼠模型建立成功。LDL-C携带的胆固醇积存在动脉壁上,可以促进动脉管壁形成动脉粥样硬化,是动脉粥样硬化一项非常危险的因素[22]。实验结果显示,甘薯茶饮在有效改善高脂饮食引起的血脂异常的同时,也可以显著降低宿主患动脉粥样硬化的几率。很多流行病学研究和临床实验均表明茶叶具有很好的抗肥胖活性[23]。其中发酵茶更是具有优异的减肥降脂活性,茯砖茶中茶多酚[24]、多糖[25]、茶褐素[26]等不同组分均具有其特异性。
肝脏是脂类代谢的关键场所,人体内血脂的相对恒定主要靠肝细胞来调节,肝细胞能够将胆固醇转化成胆汁酸,促进脂肪在肠道内的消化吸收。而高脂饮食可导致宿主的氧化应激增加,从而引发肝脏脂肪变性,肝功能受损,胆汁的生成和排泄受阻,进而导致血脂代谢发生异常。研究表明,茯砖茶及其活性成分可以显著提高实验动物血清及肝脏中谷胱甘肽过氧化物酶、过氧化氢酶和超氧化物歧化酶等的活性从而降低对肝脏的氧化损伤[27]。本研究结果也显示,甘薯茶饮不但能够明显抑制高脂大鼠体重增长,降低肥胖指数,还可以改善高脂大鼠肝脏病理状况,缓解高脂饮食引起的肝脏功能损伤。
众多研究均表明,高脂饮食可诱导机体肠道菌群发生紊乱,引起宿主生理功能的改变,从而导致如肥胖等各类疾病的发生。本研究发现,高脂饮食可导致大鼠肠道菌群Alpha多样性显著降低,经过甘薯茶饮的调节,高脂大鼠肠道菌群的丰度和多样性均得到提升。高通量测序结果还显示,经过高脂喂养,大鼠肠道中厚壁菌门细菌数量减少,拟杆菌门细菌数量增加,这一结果与LIN等[14]、ZHANG等[13]研究结果一致,肠道内厚/拟菌门的相对比例具有饮食依赖性。厚壁菌门和拟杆菌门的比值在脂肪代谢中发挥着重要作用,厚/拟比值的降低,有助于促进宿主的肥胖[28]。经甘薯茶饮干预后,厚/拟比值得到上调,有效改善了因脂肪摄入而造成的菌群结构改变和宿主肥胖。有研究表明[29-31],发酵茶中的茶多糖、金花菌胞内和胞外多糖均可通过调节肠道菌群、改善肠道屏障来增加机体的免疫功能,具有良好的降脂减肥功效。
除了对门水平的调控,高脂饮食对机体某些菌属也有影响。经过高脂饲料喂养,模型组大鼠肠道内瘤胃球菌NK4A214 group、Christensenellaceae R-7 group菌属的丰度显著降低,而Blautia、Lachnoclostridium和bacteroides菌属的丰度显著升高。其中Ruminococcaceae_NK4A214 group为厚壁菌门的一种有益菌,其可以通过代谢产生丁酸类物质,来调节肠上皮细胞的代谢和免疫应答功能[14]。该菌属丰度下降,提示高脂血症会在一定程度上减少肠道内抗菌肽类物质的释放,降低肠道的防御保护功能,增加炎症发生的概率[32]。Christensenellaceae R-7 group为一类具有抗炎特性的产丁酸菌,可下调促炎细胞因子,改善肠道黏膜屏障功能[33]。本实验结果显示,甘薯茶饮可以提高大鼠肠道中Ruminococcaceae_NK4A214 group和Christensenellaceae R-7 group菌属的含量,进而调节脂质代谢,降低机体肥胖及炎症的发生。WANG等[16]在肠道微生物群个性化治疗高脂血症实验中发现,高脂血症患者的粪便样本中Blautia含量明显增加。SHEN等[17]亦发现非酒精性脂肪性肝炎患者体内Blautia的丰度显著高于健康人群,表明肝脏形态结构的损伤可能与该菌属丰度的升高有关。动物研究发现,Lachnoclostridium不但与体重增长呈正相关,还可以影响血清脂肪酶水平的升高,通过降低肠道中Lachnoclostridium的含量,可减轻机体炎症反应,改善肥胖[18]。也有研究表明,拟杆菌属Bacteroides不仅可通过抑制控制脂肪进出脂肪细胞的FIAF基因的表达来增加脂肪积累,同时,该菌属中也含有大量可产生乙酸的致病菌,该菌属丰度增加,不仅会导致脂肪进一步堆积,还增加了宿主感染的风险[34]。本实验结果表明,甘薯茶饮可以降低Blautia、Lachnoclostridium和bacteroides等菌属的丰度,有效减轻其对肝脏的损伤,降低机体炎症反应以及患相关代谢综合征的几率。
综上所述,饮用发酵甘薯茶可显著抑制高脂模型大鼠的体重增加及血清中TC、TG以及LDL-C的积累。同时,高脂饮食所导致的肠道内厚/拟菌门比值和瘤胃球菌、Christensenellaceae等有益菌属丰度的下降、以及与脂肪积累和机体炎症有关菌属丰度的增加,在甘薯茶饮干预后均得到调整和改善。
4 结论
高脂饮食是高脂血症最主要的诱因。高脂饮食中的大量脂质会引发血脂代谢异常和血脂水平增高,进而诱发高脂血症。本研究结果显示,补充甘薯茶饮后,有效改善了大鼠肥胖状态和脂质代谢紊乱。同时也降低与促进脂肪积累及机体炎症有关的菌属丰度,增加了部分有益菌的丰度。但高脂饮食造成的肥胖及脂质代谢紊乱和肝脏结构的损伤是否与这些菌属丰度的变化有关,仍有待进一步研究。
[1] MACH F, BAIGENT C, CATAPANO A L, et al.2019 ESC/EAS Guidelines for the management of dyslipidaemias:Lipid modification to reduce cardiovascular risk[J].European Heart Journal, 2020, 41(1):111-188.
[2] ZHENG D P, LIWINSKI T, ELINAV E.Interaction between microbiota and immunity in health and disease[J].Cell Research, 2020, 30(6):492-506.
[3] 曹宏芳, 张家超, 王芳, 等.高脂饮食对雄性SD大鼠肠道菌群的影响[J].中国微生态学杂志, 2012, 24(2):102-108.
CAO H F, ZHANG J C, WANG F, et al.Intake of a high-fat diet alters intestinal flora in male SD rats[J].Chinese Journal of Microecology, 2012, 24(2):102-108.
[4] LEY R E, B CKHED F, TURNBAUGH P, et al.Obesity alters gut microbial ecology[J].Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(31):11070-11075.
CKHED F, TURNBAUGH P, et al.Obesity alters gut microbial ecology[J].Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(31):11070-11075.
[5] DU H P, WANG Q, YANG X B.Fu brick tea alleviates chronic kidney disease of rats with high fat diet consumption through attenuating insulin resistance in skeletal muscle[J].Journal of Agricultural and Food Chemistry, 2019, 67(10):2839-2847.
[6] 胡安恺, 姚立筠, 赵悦伶, 等.茯砖茶提取物对葡聚糖硫酸钠诱导小鼠炎症性肠病的保护作用研究[J].茶叶科学, 2019, 39(6):641-651.
HU A K, YAO L Y, ZHAO Y L, et al.Protective effects of fu brick tea extracts on inflammatory bowel disease induced by dextran sulfate sodium in mice[J].Journal of Tea Science, 2019, 39(6):641-651.
[7] ZHOU F, LI Y L, ZHANG X, et al.Polyphenols from fu brick tea reduce obesity via modulation of gut microbiota and gut microbiota-related intestinal oxidative stress and barrier function[J].Journal of Agricultural and Food Chemistry, 2021, 69(48):14530-14543.
[8] LIU D M,HUANG J N,LUO Y,et al.Fuzhuan brick tea attenuates high-fat diet-induced obesity and associated metabolic disorders by shaping gut microbiota[J].Journal of Agricultural and Food Chemistry, 2019, 67(49):13589-13604.
[9] 陆红佳, 游玉明, 刘金枝, 等.纳米甘薯渣纤维素对糖尿病大鼠血糖及血脂水平的影响[J].食品科学, 2015, 36(21):227-232.
LU H J, YOU Y M, LIU J Z, et al.Effects of cellulose nanocrystals from sweet potato residues on the levels of blood glucose and serum lipid in diabetic rats[J].Food Science, 2015, 36(21):227-232.
[10] 王文婷. RS4型甘薯抗性淀粉对高脂饮食C57BL/6J小鼠血脂和肠道的影响[D].雅安:四川农业大学, 2013.
WANG W T.Effect of RS4-type sweet potato resistant starch on blood lipid and intestine of C57BL/6J mice fed with high-fat diet[D].Ya’an:Sichuan Agricultural University, 2013.
[11] 张子依, 陈锦瑞, 刘荣瑜, 等.甘薯及其主要成分体内生物活性研究进展[J].中草药, 2020, 51(12):3308-3317.
ZHANG Z Y, CHEN J R, LIU R Y, et al.Research progress of biological activity of Ipomoea batatas and its main components in vivo[J].Chinese Traditional and Herbal Drugs, 2020, 51(12):3308-3317.
[12] 徐路. 基于FXR/FGF15/FGFR4通路研究黄连吴茱萸配伍调控胆汁酸代谢发挥降脂效应的作用机制[D].成都:成都中医药大学, 2020.
XU L.Study on the effect of Coptis chinensis and Evodia retaecarpa on regulating bile acid metabolism and lipid-lowering based on the pathway of FXR/FGF15/FGFR4[D].Chengdu:Chengdu University of Traditional Chinese Medicine, 2020.
[13] ZHANG Y T, ZHAO W Y, XIE P Z, et al.Effects of Auricularia auricula and its polysaccharides on hypolipidemic and regulating intestinal flora in high-fat diet rats[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(9):89-101.
[14] LIN L, LIU Z J, LEI Z Y, et al.Study on the effect of tea seed saponins on intestinal microflora in rats with hyperlipidemia[J].Natural Product Research and Development, 2020, 32(2):173-181.
[15] 杨海花. Christensenella minuta对宿主肠道健康的潜在益生功能[D].广州:华南理工大学, 2020.
YANG H H.Potential probiotic function of Christensenella minuta on host intestinal health[D].Guangzhou:South China University of Technology, 2020.
[16] WANG Y, TONG Q A, SHOU J W, et al.Gut microbiota -mediated personalized treatment of hyperlipidemia using berberine[J].Theranostics, 2017, 7(9):2443-2451.
[17] SHEN F, ZHENG R D, SUN X Q, et al.Gut microbiota dysbiosis in patients with non-alcoholic fatty liver disease[J].Hepatobiliary &Pancreatic Diseases International, 2017, 16(4):375-381.
[18] YANG F, WEI J D, LU Y F, et al.Galacto-oligosaccharides modulate gut microbiota dysbiosis and intestinal permeability in rats with alcohol withdrawal syndrome[J].Journal of Functional Foods, 2019, 60:103423.
[19] B CKHED F, DING H, WANG T, et al.The gut microbiota as an environmental factor that regulates fat storage[J].Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44):15718-15723.
CKHED F, DING H, WANG T, et al.The gut microbiota as an environmental factor that regulates fat storage[J].Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44):15718-15723.
[20] 许皖. 葛花、枳椇子及其配伍对急性酒精性肝损伤小鼠保护作用的实验研究[D].北京:北京中医药大学, 2020.
XU W. Experimental study on protective effects of Flos puerariae lobatae, Semen hoveniae and their compatibility on acute alcoholic liver injury in mice[D].Beijing: Beijing University of Chinese Medicine, 2020.
[21] 李海玲,张思晨,赵志敏,等.共轭亚油酸降脂及分子机理研究进展[J].中国油脂, 2022, 47(1):60-67.
LI H L, ZHANG S C, ZHAO Z M, et al.Progress in fat reduction of conjugated linoleic acid and its molecular mechanism[J].China Oils and Fats, 2022, 47(1):60-67.
[22] 侯美琪. 健脾益气活血法改善动脉粥样硬化小鼠血脂及炎症反应的实验研究[D].沈阳:辽宁中医药大学, 2021.
HOU M Q. Experimental study on improving blood lipid and inflammatory reaction in atherosclerotic mice by invigorating spleen, benefiting qi and promoting blood circulation[D].Shenyang: Liaoning University of Traditional Chinese Medicine, 2021.
[23] YANG C S, ZHANG J S, ZHANG L, et al.Mechanisms of body weight reduction and metabolic syndrome alleviation by tea[J].Molecular Nutrition &Food Research, 2016, 60(1):160-174.
[24] 刘天囡,徐梦佳,胡冰,等.茯砖茶多酚类物质对胰脂肪酶活性的抑制作用[J].食品科学, 2015, 36(21):46-49.
LIU T N, XU M J, HU B, et al.Inhibitory activity of polyphenols from fuzhuan brick tea on pancreatic lipase[J].Food Science, 2015, 36(21):46-49.
[25] 许凌凌, 程旺开, 周小楠.普洱茶多糖对健康小鼠短链脂肪酸代谢与肠道菌群组成的调节作用[J].食品与发酵工业, 2021, 47(21):115-122.
XU L L, CHENG W K, ZHOU X N, et al.Regulatory effect of Pu-erh tea polysaccharide on short-chain fatty acid metabolism and gut microbiota in mice[J].Food and Fermentation Industries, 2021, 47(21):115-122.
[26] 山波, 龚加顺, 王秋萍, 等.菌方普洱熟茶水提物和茶褐素的组成及其降脂作用[J].食品科学, 2023,44(8):257-267.
SHAN P, GONG J S, WANG Q P, et al.Composition and lipid-lowering effect of fermented tea extract and tea fuscin in Jiefang Pu-erh tea[J].Food Science, 2023,44(8):257-267.
[27] CHEN G J, WANG M J, XIE M H, et al.Evaluation of chemical property, cytotoxicity and antioxidant activity in vitro and in vivo of polysaccharides from Fuzhuan brick teas[J].International Journal of Biological Macromolecules, 2018, 116:120-127.
[28] 祝莉娜, 胡锦宏, 张婷, 等.黑木耳改善高脂饮食引起的小鼠肥胖及肠道菌群紊乱[J].食品与发酵工业, 2021, 47(21):94-101.
ZHU L N, HU J H, ZHANG T, et al.Ameliorating effects of Auricularia auricula on obesity and gut microbiota dysbiosis in mice induced by high fat diet[J].Food and Fermentation Industries, 2021, 47(21):94-101.
[29] XIE Z Y, BAI Y X, CHEN G J, et al.Immunomodulatory activity of polysaccharides from the mycelium of Aspergillus cristatus, isolated from Fuzhuan brick tea,associated with the regulation of intestinal barrier function and gut microbiota[J].Food Research International, 2022, 152:110901.
[30] BAI Y X, ZENG Z Q, XIE Z Y, et al.Effects of polysaccharides from Fuzhuan brick tea on immune function and gut microbiota of cyclophosphamide-treated mice[J].The Journal of Nutritional Biochemistry, 2022, 101:108947.
[31] 刘韦, 张格超, 李倩, 等.泾阳茯茶中冠突散囊菌的鉴定及降脂作用研究[J].食品安全质量检测学报, 2019, 10(23):7907-7914.
LIU W, ZHANG G C, LI Q, et al.Study on identification and lipid-lowering effect of Eurotium cristatum in Fu tea from Jingyang County[J].Journal of Food Safety &Quality, 2019, 10(23):7907-7914.
[32] BAXTER N T, SCHMIDT A W, VEVKATARAMAN A, et al.Dynamics of human gut microbiota and short-chain fatty acids in response to dietary interventions with three fermentable fibers[J].mBio, 2019, 10(1):e02566-e02518.
[33] 崔丽军. 粪菌移植联合防风通圣丸对肥胖大鼠肠道菌群-SCFAs-GPR43-胃肠肽通路的影响[D].北京:北京中医药大学, 2021.
CUI L J. Effect of fecal bacteria transplantation combined with Fangfeng Tongsheng Pill on intestinal flora-SCFAs-GPR43-gastrointestinal peptide pathway in obese rats[D].Beijing: Beijing University of Chinese Medicine, 2021.
[34] PERRY R J, PENG L, BARRY N A, et al.Acetate mediates a microbiome-brain-β-cell axis to promote metabolic syndrome[J].Nature, 2016, 534(7606):213-217.