作为白酒酿造过程中重要的发酵剂、糖化剂和生香剂,大曲的质量及其微生物群落结构在白酒酿造中至关重要[1]。根据制曲温度的不同可将酿酒大曲分为低温大曲(40~50 ℃)、中温大曲(50~60 ℃)和高温大曲(60~70 ℃),不同类大曲的微生物群落丰度和多样性存在差异,适用于不同香型的白酒,其中中温大曲适用于生产浓香型白酒[2]。HOU等[3]对中温大曲进行分析,表明大曲从发酵到贮存过程中其内部和外部的微生物群落和理化特性发生明显变化。YANG等[4]基于宏基因组学对中温大曲中参与风味代谢的微生物进行分析,表明大曲的品质可以显著影响白酒的感官特性,且不同微生物的代谢作用各有不同。肖辰[5]通过分析泸型酒中温大曲对酒醅发酵的作用发现曲中酯类、醇类以及酸类等挥发性物质多出现在酒醅和基酒中,且酒醅和基酒中风味物质含量明显提高。
高通量测序技术(high-throughput sequencing technology,HTS)为现代生命科学研究提供了前所未有的机遇[6]。基于该技术研究人员实现了对大曲中微生物群落结构的解析、微生物来源的探究以及不同阶段大曲微生物群落结构演替的分析等。周森等[7]利用HTS对清香型白酒大曲微生物多样性结构进行解析,结果显示样品中真菌丰度远大于细菌丰度,且不同大曲样品真菌群落主体均为扣囊覆膜酵母(Saccharomycopsis fibuligera),细菌群落结构则较为多样化。周天慈等[8]对中高温大曲微生物群落结构及其来源进行解析发现发酵初期大曲中细菌和真菌的主要来源分别为制曲原料和制曲环境,其中大曲中真菌53.7%来自于室外地面,23%来自于室内屋顶。HE等[9]通过MiSeq高通量技术对浓香型白酒大曲发酵和贮存阶段微生物群落结构进行分析可知,大曲发酵和贮存阶段微生物群落组成基本不变,相对丰度含量有所变化,嗜热子囊菌属(Thermoascus)、根霉属(Rhizopus)、毕赤酵母属(Pichia)和根毛霉属(Rhizomucor)为大曲中的优势真菌属。由此可知,酿酒大曲中含有丰富的真菌群落结构,且大曲中微生物受到制曲原料和制曲环境的影响可能组成不同,因而对不同来源大曲中真菌类群进行解析是很有必要的。
河套地区属于温带大陆性气候,位于黄河中上游地区,拥有良好的自然环境和土壤条件,是中国西北最主要的农业区之一。本研究使用HTS技术对采集自河套地区某酒厂制曲车间的5份中温大曲样品进行真菌群落结构的解析,通过对大曲理化特性指标的测定分析大曲品质,从而进一步探究大曲中真菌群落结构对理化特性的影响,并通过传统微生物技术对大曲样品中的酵母菌进行解析。本研究侧重于对中温大曲真菌微生物群落结构的解析,有助于筛选大曲中优良发酵菌株,从而提升白酒品质,同时为酿酒大曲的规范化生产提供参考依据。
1 材料与方法
1.1 材料与试剂
中温大曲,河套地区某酒厂制曲车间;QIAGEN DNeasymericon Food Kit试剂盒,德国QIAGEN公司;Axygen清洁试剂盒,康宁生命科学(吴江)有限公司;引物ITS3F/ITS4R、ITS1/ITS4和M13F(-47)/M13R(-48),武汉天一辉远生物科技有限公司;5×TransStartTM FastPfu Buffer、dNTPs、FastPfu Fly DNA Polymerase、牛血清白蛋白(bovine albumin,BSA)、2×PCR Buffer、rTaq酶、PMD 18-T载体,北京全式金生物技术有限公司;Escherichia coli top10,湖北省食品配料工程技术研究中心制备;氢氧化钠、盐酸、次甲基蓝、可溶性淀粉、硫酸、甲醛、己酸,国药集团化学试剂有限公司;无水乙酸钠、氯化钠、冰乙酸、氯化钴、无水乙醇,西陇化工股份有限公司;葡萄糖和重铬酸钾,天津市福晨化学试剂厂;PDA培养基,上海博微生物科技有限公司。
1.2 仪器与设备
BF-10小型高速粉碎机,河北本辰科技有限公司;5810R型台式高速冷冻离心机,德国Eppendorf公司;DYY-12型电泳仪,北京六一仪器厂;vetiri梯度基因扩增仪,美国AB公司;UVPCDS8000凝胶成像分析系统,美国ProteinSimple公司;ND-2000C微量紫外分光光度计,美国Nano Drop公司;Miseq PE300型高通量测序平台,美国Illumina公司;R920型机架式服务器,美国DELL公司;GZX-9076MBE电热鼓风干燥箱:上海博迅实业有限公司;DHS-16水分测定仪,宁波市鄞州华丰电子仪器厂;K1100全自动凯氏定氮仪,山东海能科学仪器有限公司;KSL-1200X-M马弗炉,合肥科晶材料技术有限公司;HR40-IIB2生物安全柜,海尔集团电子商务有限公司。
1.3 实验方法
1.3.1 中温大曲样品的制备和采集
制曲的工艺流程如下[10]:
制曲原料(优质冬小麦)→润料→粉碎→拌料压曲→入房卧曲→喷酒强化→培曲翻曲→出房入库→大曲贮存
样品的采集和预处理:从制曲车间选择颜色均匀、厚度适中、有特殊香气[11]的中温大曲共5份,编号为HT1~HT5。在实验室条件下,将整块大曲进行切割粉碎,置于无菌自封袋中低温贮存。
1.3.2 样品宏基因组DNA提取、真菌ITS区PCR扩增和MiSeq测序
本研究参考QIAGEN DNeasymericon Food Kit试剂盒中的方法,提取中温大曲样品中宏基因组DNA。通过1%琼脂糖凝胶电泳(120 V,30 min)对样品总DNA进行检测,将检测合格的DNA作为模板进行PCR扩增[12]。经过检测将扩增出目的片段的PCR产物使用清洁试剂盒进行清洁,并通过微量紫外分光光度计检测PCR清洁产物的浓度[13],用无菌ddH2O将浓度稀释至100 nmol/L后寄至上海美吉生物医药科技有限公司进行MiSeq高通量测序。
1.3.3 序列下机处理和生物信息学分析
MiSeq高通量测序数据下机后根据重叠关系将序列的双端序列进行拼接,并进行序列质量控制[14],将拼接过程中不合格的序列删除,获取高质量序列。通过QIIME(V1.9.1)平台对获取的高质量序列进行真菌群落注释和多样性分析,具体流程:(1)去除嵌合体序列[15];(2)按照97%相似度结合UNITE数据库进行序列的操作分类单元(operational taxonomic units,OTU)划分和物种注释[16-17];(3)计算样品中α多样性指数[18]。
1.3.4 样品理化指标的测定
参考QB/T 4257—2011《酿酒大曲通用分析方法》对中温大曲样品的水分含量、酸度、淀粉含量、发酵力、液化力、糖化力、酯化力、灰分、氨基酸态氮和酒化力进行测定,使用水分活度测定仪进行样品中水分活度的测定,使用凯氏定氮仪对样品中含氮量进行测定,从而计算样品中蛋白质含量。
1.3.5 样品中酵母菌的分离纯化与鉴定
霉菌和酵母计数:参考GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》中平板计数法进行大曲样品中菌落计数,依照菌落计数原则计算样品中霉菌和酵母菌的菌落数。
酵母菌的分离纯化:5份中温大曲等量混合均匀取样,用0.85%的无菌生理盐水对样品进行梯度稀释,选择合适梯度的稀释液100 μL涂布于PDA固体平板上,28 ℃培养3~5 d后挑取菌落形态和颜色不同的单菌落进行纯化,并使用30%的甘油保藏菌体。
酵母菌的鉴定:参考CHOW等[19]研究并略做调整对样品中分离株进行DNA提取和ITS区扩增,经过清洁、连接和转化操作后将阳性单克隆产物送往上海桑尼生物科技有限公司进行测序,对反馈回的序列进行引物的查找与去除后在GenBank数据库进行Blast同源性比对,明确其微生物学地位。
1.3.6 核酸登录号申请
本研究5份中温大曲高通量测序数据已提交至MG-RAST数据库申请核酸登录号,ID号为mgp104048。
1.3.7 数据处理和可视化分析
经生物信息学分析后在Excel 2021中进行数据可视化处理和表格绘制,使用在线绘图工具jvenn(http://jvenn.toulouse.inra.fr/app/example.html)绘制韦恩(Venn)图,利用Spearman相关性分析进行优势真菌属与理化特性指标间的相关性分析,使用R-4.1.3软件绘制瀑布图、堆积柱状图和相关性热图,利用MEGA7构建样品中分离株的系统发育树。
2 结果与分析
2.1 高通量测序数据统计及质量评估
采用Illumina MiSeq测序技术对采集自河套地区的5份中温大曲进行真菌群落结构分析,测序后的原始序列经过拼接和质量控制筛选出优质序列,并对其进行数据统计,结果如表1所示。
表1 样品ITS基因测序数据统计
Table 1 Statistics of ITS gene sequencing reads in samples
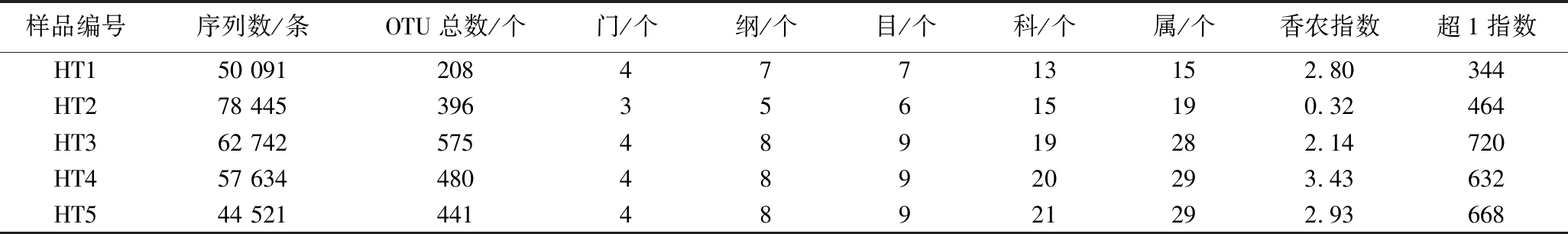
注:本研究中α多样性指数值均是在44 010 bp测序量下获得。
样品编号序列数/条OTU总数/个门/个纲/个目/个科/个属/个香农指数超1指数HT150 09120847713152.80344HT278 44539635615190.32464HT362 74257548919282.14720HT457 63448048920293.43632HT544 52144148921292.93668
由表1可知,本次测序共得到高质量序列293 433条,划分为2 100个OTU,平均每个样品含有58 686条序列。α多样性指数可以有效评估样品中微生物的丰度和多样性,香农指数又称为多样性指数,用以衡量样品中物种类群的多少,超1指数又称为丰富度指数,用以衡量样品中物种数量的多少。其中,样品HT4香农指数最大,样品HT3超1指数最大,表明样品HT4中物种类群最多,样品HT3中物种数量最多。
2.2 不同中温大曲样品中OTU分析
为解析大曲中真菌群落结构,本研究对样品中OTU分布进行可视化分析,在所有样品中均存在的OTU被称为核心OTU。由图1-A可知,本研究的5份中温大曲样品中核心OTU数有61个,包含239 613条序列,占总序列数的81.66%,且平均相对含量>1%的核心OTU有5个。
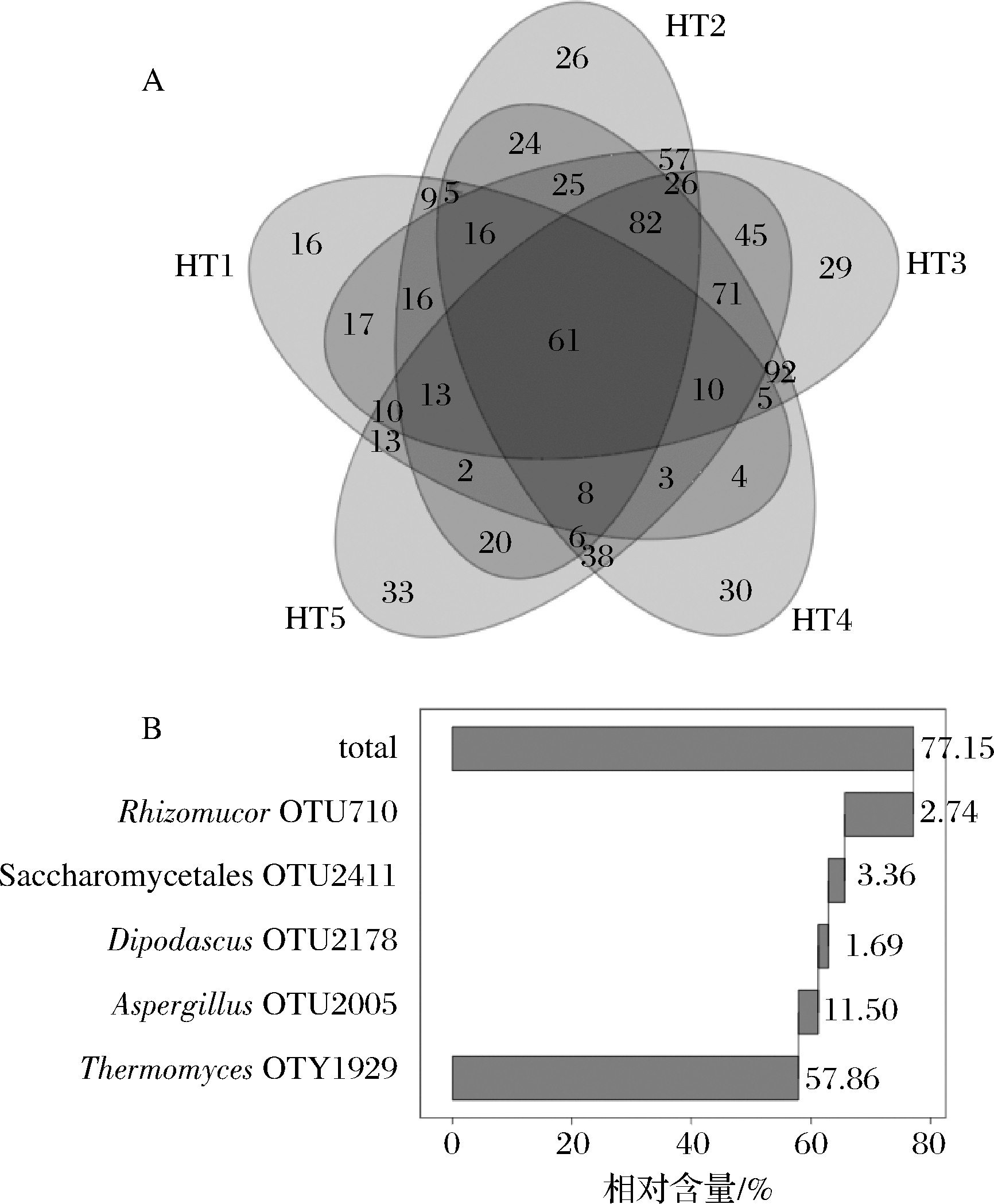
A-韦恩图;B-瀑布图
图1 基于OTU水平的韦恩图和瀑布图
Fig.1 OTU level based venn diagram and waterfall diagram
为进一步明确核心OTU的分布情况和分类学地位,本研究对平均相对含量>1%的核心OTU进行分析。由图1-B可知,平均相对含量>1%的核心OTU包括OTU1929(嗜热真菌属,Thermomyces)、OTU2005(曲霉属,Aspergillus)、OTU2178(双足囊菌属,Dipodascus)、OTU2411(酵母菌目,Saccharomycetales)和OTU710(Rhizomucor),累积平均相对含量达77.15%。2.3 不同中温大曲样品中真菌群落结构分析
为进一步分析不同中温大曲样品间的差异性,本研究基于真菌门和属水平解析不同样品中群落结构,对样品中平均相对含量>1%的优势真菌门和属进行可视化分析,结果如图2所示。
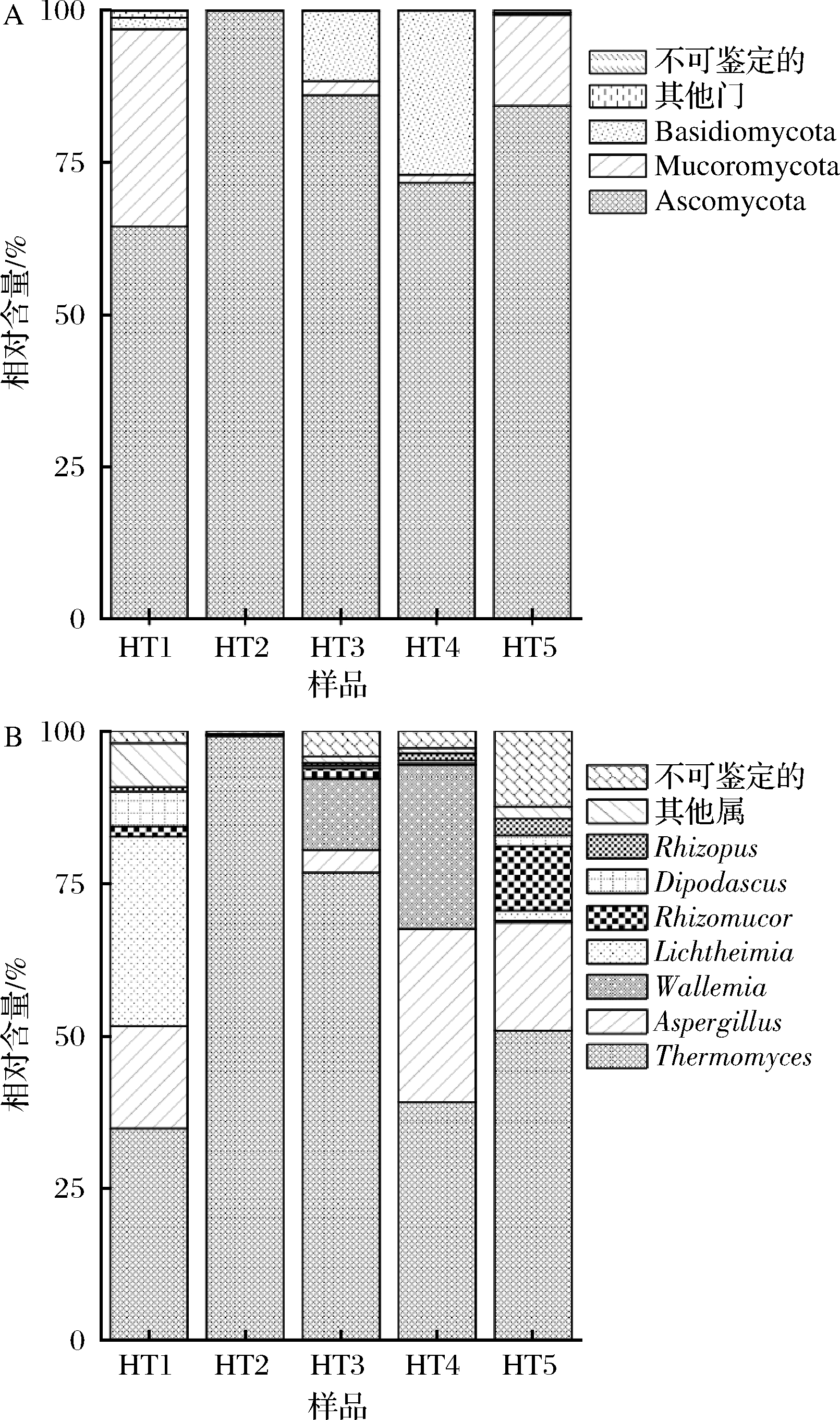
A-优势真菌门;B-优势真菌属
图2 样品中优势真菌门和优势真菌属的分布
Fig.2 Distribution of dominant fungal phylum and genus in the samples
由图2-A可知,中温大曲样品中优势真菌门主要隶属于Ascomycota、Mucoromycota和担子菌门(Basidiomycota),平均相对含量分别为81.24%、10.22%和8.15%,与襄阳地区中温大曲中真菌群落结构相似[20]。由图2-B可知,样品中优势真菌属有7个,分别隶属于Thermomyces(60.08%)、Aspergillus(13.37%)、节担菌属(Wallemia,7.76%)、横梗霉属(Lichtheimia,6.63%)、Rhizomucor(2.79%)、Dipodascus(1.69%)和Rhizopus(1.02%),占总测序量的93.36%。根据可视化分析结果显示,不同样品中真菌群落丰度和多样性存在一定差异,与表1中α多样性分析结果基本一致。
2.4 样品中优势真菌与理化指标的相关性分析
依据1.3.4节对5份中温大曲样品的理化指标进行测定,其结果如表2所示。
表2 样品中理化指标的分析
Table 2 Analysis physicochemical indicators in the sample
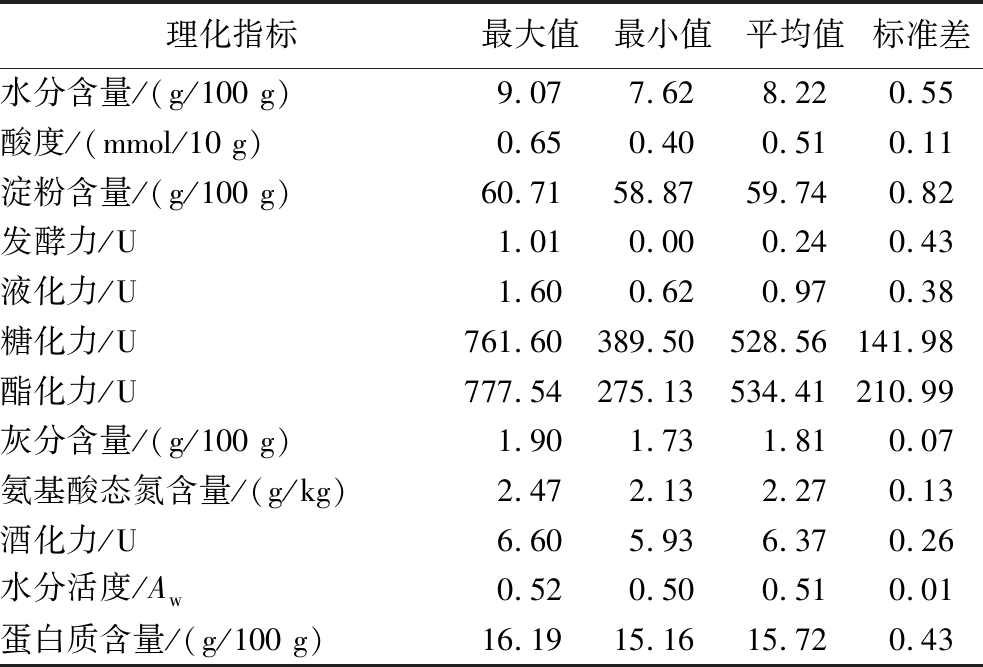
理化指标最大值最小值平均值标准差水分含量/(g/100 g)9.077.628.220.55酸度/(mmol/10 g)0.650.400.510.11淀粉含量/(g/100 g)60.7158.8759.740.82发酵力/U1.010.000.240.43液化力/U1.600.620.970.38糖化力/U761.60389.50528.56141.98酯化力/U777.54275.13534.41210.99灰分含量/(g/100 g)1.901.731.810.07氨基酸态氮含量/(g/kg)2.472.132.270.13酒化力/U6.605.936.370.26水分活度/Aw0.520.500.510.01蛋白质含量/(g/100 g)16.1915.1615.720.43
由表2可知,在糖化力指标上样品平均值为528.56 U,标准差为141.98,在酯化力指标上样品平均值为534.41 U,标准差为210.99。样品间糖化力和酯化力数值波动较大,这可能与本研究中温大曲的贮存期较长有关[21],且样品HT2糖化力和酯化力最小。尉嘉眙等[22]对不同类大曲的理化性质与白酒产品风味进行分析发现,大曲的发酵力与正丙醇呈显著正相关(P<0.05),酯化力与β-苯乙醇和乙醛、液化力与总酸总酯呈显著负相关(P<0.05)。MA等[23]对浓香型大曲发酵过程中微生物群落演替进行研究发现,细菌群落演替的主要驱动因素是酸度、湿度和温度,真菌群落演替的主要驱动因素是水分,据此推测大曲中水分含量可能与真菌群落之间存在相关性。
为进一步深入探究中温大曲样品中优势真菌属与理化指标的相关性,本研究使用Pearsom系数法对7个优势真菌属和12个理化指标进行可视化相关性分析,结果如图3所示。
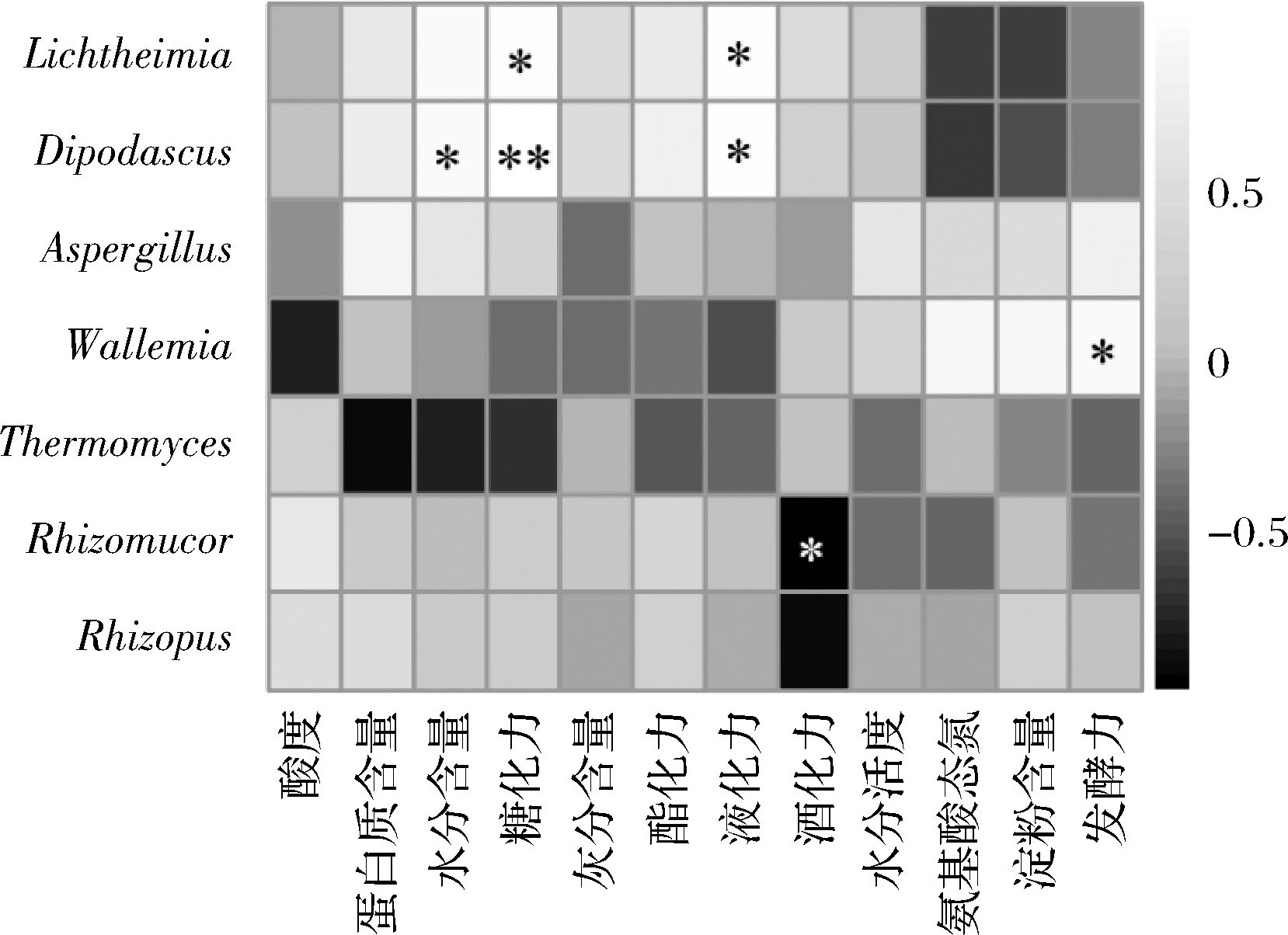
图3 优势真菌属与理化指标相关性热图
Fig.3 Correlation heatmap between dominant fungal genus and physicochemical indicators
注:“*”代表P<0.05,相关性显著;“**”代表P<0.01,相关性极显著。
由图3可知,优势真菌属与中温大曲理化酶活性(糖化力、液化力、发酵力、酯化力)和水分含量之间具有显著相关性,Lichtheimia与大曲液化力(r=0.937,P<0.05)和糖化力(r=0.932,P<0.05)均呈显著正相关性,Dipodascus与大曲液化力(r=0.929,P<0.05)和水分含量(r=0.898,P<0.05)正相关性显著,且与大曲糖化力呈极显著正相关(r=0.981,P<0.01),Wallemia与大曲发酵力正相关性显著(r=0.881,P<0.05),Rhizomucor与大曲酒化力呈显著负相关(r=-0.928,P<0.05)。栾春光等[24]对清香型大曲研究显示,Lichtheimia与清茬曲的酯化力提升密切相关。杜向军等[25]通过对大曲微生物群落结构及关键影响因素研究显示,Rhizomucor是影响大曲糖化力、液化力和酒化力的主要微生物之一。HE等[9]分析亦显示,糖化力与浓香型大曲中Rhizomucor呈现正相关。唐鳗秋等[26]对8种中日酒曲进行分析可知,酒曲种群结构与其理化指标存在明显相关性,其中Aspergillus与水分、糖化力、液化力、酸度和还原糖呈正相关,与发酵力呈负相关,且发酵力和液化力对微生物物种分布影响最大。
2.5 中温大曲样品中酵母菌分析
本研究参考国标对5份中温大曲样品进行霉菌和酵母菌计数,样品中霉菌和酵母菌总数在1.41×105~2.88×106 CFU/g。将采集样品等量混合均匀后通过传统微生物技术进行大曲中酵母菌的分离,其菌落形态和显微镜形态如图4所示。

A-分离株菌落形态;B-显微镜形态
图4 样品中分离株菌落形态和显微镜形态
Fig.4 Colony morphology and microscopic morphology of the isolates in the samples
由图4可知,两株分离株的菌落形态和显微镜形态相似,菌落呈乳白色、有光泽、较平坦、边缘整齐,分离株细胞呈椭圆形或圆筒形。
为进一步明确分离株的分类学地位,对分离株进行ITS区PCR扩增与鉴定,分离株序列在数据库中经过同源性分析获取可靠信息,其与标准菌株之间的同源性分析如图5所示。
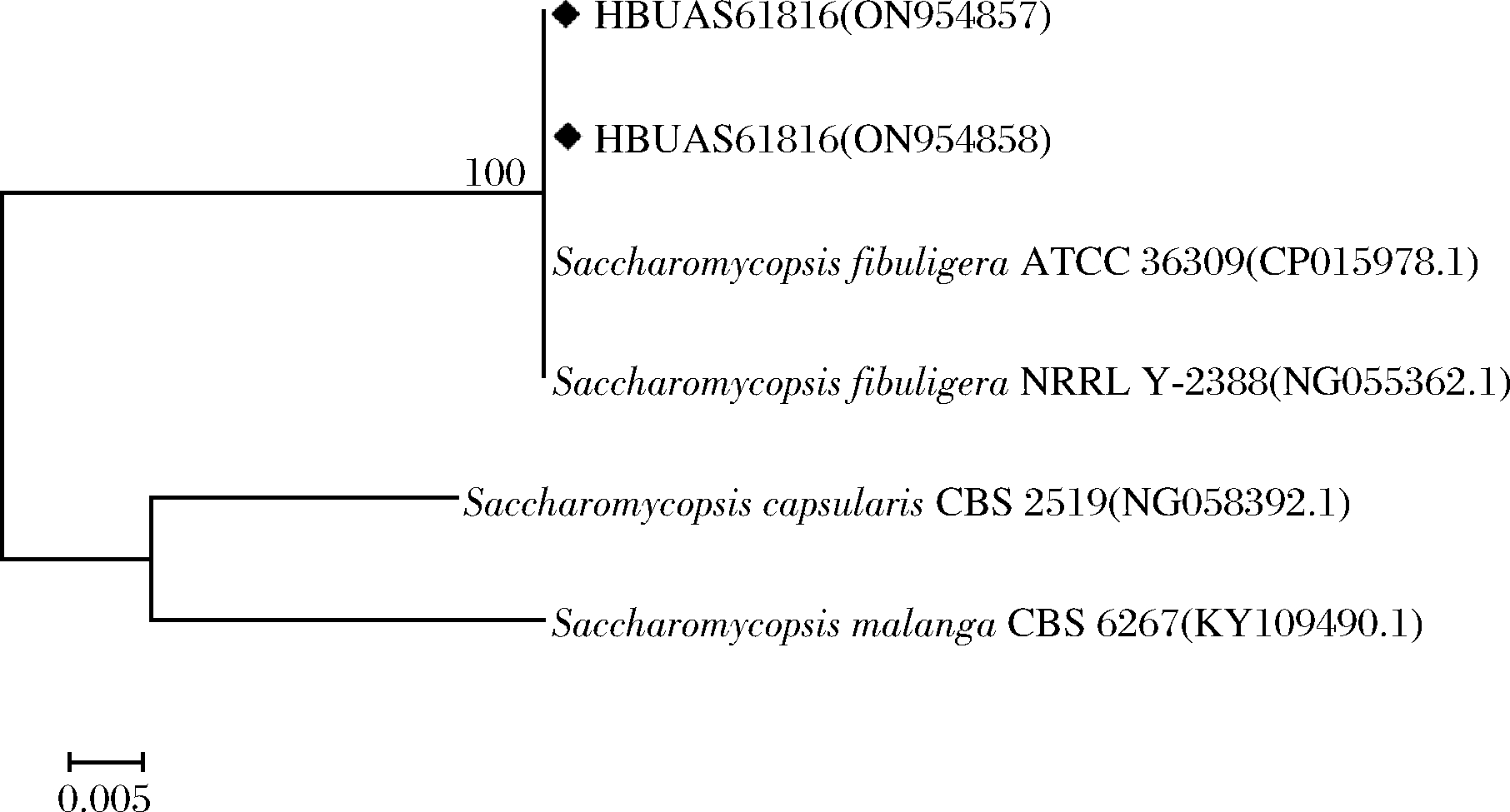
图5 样品中分离株系统发育树
Fig.5 Phylogenetic tree of isolates in the sample
由图5可知,分离株HBUAS61816和HBUAS61817与标准菌株S.fibuligera ATCC 36309和S.fibuligera NRRL Y-2388之间同源性均达到100%。由此可知,本研究中分离株HBUAS61816和HBUAS61817隶属于S.fibuligera。
根据霉菌和酵母菌总数测定结果显示,样品中含有丰富的可培养霉菌和酵母菌。霉菌、酵母菌和细菌作为大曲中3种重要菌群,在白酒酿造中发挥着重要作用,其中霉菌作为糖化动力,酵母菌作为发酵动力,细菌作为生香动力,相辅相成,对白酒的发酵及风味的产生具有重要意义。PU等[27]使用接种酵母菌的强化大曲进行白酒酿造,发现强化大曲酿造的白酒其风味物质含量更高,感官评分更佳。YI等[28]研究表明,曲霉和青霉等真菌为酱香大曲中活性最强的微生物,能表达与芳香类化合物降解相关的功能酶,在白酒香气前体物质形成中具有不可忽视的作用。因此在后续研究中采用“培养组学”策略[29],进一步挖掘其中的微生物资源,解析大曲中真菌群落自发式构建机制,探究其对白酒品质的影响十分必要。
3 结论
本研究采集自河套地区的中温大曲主要真菌微生物,主要隶属于Ascomycota、Mucoromycota和Basidiomycota,且不同样品间真菌群落组成和多样性存在差异。大曲中优势真菌属Thermomyces、Aspergillus、Wallemia、Lichtheimia、Rhizomucor、Dipodascus、Rhizopus与理化指标间存在一定相关性,其中优势菌属与大曲水分含量和理化酶活性之间均呈现显著相关性。S.fibuligera是大曲样品中主要的酵母菌分离株。
[1] 张春林. 泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学, 2012.
ZHANG C L.The relationship between quality, microorganisms and flavour components of Luzhou Laojiao Daqu[D].Wuxi:Jiangnan University, 2012.
[2] SAKANDAR H A, HUSSAIN R, KHAN Q F, et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu (starters):A review[J].Food Research International, 2020, 138:109830.
[3] HOU X G, HUI M, SUN Z K, et al.Comparative analysis of the microbiotas and physicochemical properties inside and outside medium-temperature Daqu during the fermentation and storage[J].Frontiers in Microbiology, 2022, 13:934696.
[4] YANG Y, WANG S T, LU Z M, et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in medium-temperature Daqu starter[J].Food Research International, 2021, 140:110037.
[5] 肖辰. 泸型酒中温大曲微生物群落的演替及其对酒醅发酵的贡献[D].无锡:江南大学, 2018.
XIAO C.Succession of mid-temperature Daqu microbiota and its contribution to the fermentation of Luzhou-flavor Baijiu[D].Wuxi:Jiangnan University, 2018.
[6] WANG X Q, WANG G H, QIAO F, et al.Progress on high-throughput sequencing and its applications in food web analysis[J].Acta Ecologica Sinica, 2017, 37(8):2530-2539.
[7] 周森, 胡佳音, 崔洋, 等.应用高通量测序技术解析清香型大曲微生物多样性[J].中国食品学报, 2019, 19(6):244-250.
ZHOU S, HU J Y, CUI Y, et al.Microbial diversity analysis of flight-flavor Daqu using high-throughput sequencing[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(6):244-250.
[8] 周天慈, 何宏魁, 周庆伍, 等.基于高通量扩增子测序技术解析中高温大曲微生物来源[J].食品与发酵工业, 2021, 47(16):66-71.
ZHOU T C, HE H K, ZHOU Q W, et al.Exploring the source of microbiota in medium-high temperature Daqu based on high-throughput amplicon sequencing[J].Food and Fermentation Industries, 2021, 47(16):66-71.
[9] HE M W, JIN Y, ZHOU R Q, et al.Dynamic succession of microbial community in Nongxiangxing daqu and microbial roles involved in flavor formation[J].Food Research International, 2022, 159: 111559.
[10] XU B Y, XU S S, CAI J, et al.Analysis of the microbial community and the metabolic profile in medium-temperature Daqu after inoculation with Bacillus licheniformis and Bacillus velezensis[J].LWT, 2022, 160:113214.
[11] ZHANG Y D, DING F, SHEN Y, et al.Characteristics of the microbiota and metabolic profile of high-temperature Daqu with different grades[J].World Journal of Microbiology &Biotechnology, 2022, 38(8):137.
[12] DONG W W, SHEN H Y, LIU H M, et al.Unraveling the microbial community and succession during Zha-chili fermentation and their relationships with flavor formation[J].Food Research International, 2022, 157:111239.
[13] MERCH N A V, RUIZ-MOYANO S, V
N A V, RUIZ-MOYANO S, V ZQUEZ-HERN
ZQUEZ-HERN NDEZ M, et al.Characterization of autochthonal yeasts isolated from Spanish soft raw ewe milk protected designation of origin cheeses for technological application[J].Journal of Dairy Science, 2022, 105(4):2931-2947.
NDEZ M, et al.Characterization of autochthonal yeasts isolated from Spanish soft raw ewe milk protected designation of origin cheeses for technological application[J].Journal of Dairy Science, 2022, 105(4):2931-2947.
[14] 王雪山, 杜海, 徐岩.清香型白酒发酵过程中微生物种群空间分布[J].食品与发酵工业, 2018, 44(9):1-8.
WANG X S, DU H, XU Y.Spatial distribution of microbial community during Chinese light-flavor liquor fermentation[J].Food and Fermentation Industries, 2018, 44(9):1-8.
[15] MARTIN CEREZO M L, RAVAL R, DE HARO REYES B, et al.Identification and quantification of chimeric sequencing reads in a highly multiplexed RAD-seq protocol[J].Molecular Ecology Resources, 2022, 22(8):2860-2870.
[16] NILSSON R H, LARSSON K H, TAYLOR A F S, et al.The UNITE database for molecular identification of fungi:Handling dark taxa and parallel taxonomic classifications[J].Nucleic Acids Research, 2019, 47(D1):D259-D264.
[17] PÉREZ-LOSADA M, NARAYANAN D B, KOLBE A R, et al.Comparative analysis of metagenomics and metataxonomics for the characterization of vermicompost microbiomes[J].Frontiers in Microbiology, 2022, 13:854423.
[18] FRAZILIO D A, DE ALMEIDA O G G, DE OLIVEIRA C A F, et al.Metataxonomics contributes to unravel the microbiota of a Brazilian dairy[J].Journal of Dairy Research, 2020, 87(3):360-363.
[19] CHOW B, GROESCHEL M, CARSON J, et al.Development and evaluation of a novel fast broad-range PCR and sequencing assay (FBR-PCR/S) using dual priming oligonucleotides targeting the ITS/LSU gene regions for rapid diagnosis of invasive fungal diseases:Multi-year experience in a large Canadian healthcare zone[J].BMC Infectious Diseases, 2022, 22(1):375.
[20] 邓长阳, 黎婷玉, 刘文汇, 等.襄阳地区中高温大曲曲皮和曲心真菌多样性解析[J].中国酿造, 2021, 40(6):65-69.
DENG C Y, LI T Y, LIU W H, et al.Fungal diversity in surface and center of medium-high temperature Daqu in Xiangyang area[J].China Brewing, 2021, 40(6):65-69.
[21] GUAN T W, YANG H, OU M Y, et al.Storage period affecting dynamic succession of microbiota and quality changes of strong-flavor Baijiu Daqu[J].LWT, 2021, 139:110544.
[22] 尉嘉眙, 常强, 蒋超, 等.大曲理化性质与白酒产品风味的相关性分析[J].食品工业科技, 2020, 41(18):244-251.
YU J Y, CHANG Q, JIANG C, et al.Correlation analysis between physicochemical properties of Daqu and flavor of liquor products[J].Science and Technology of Food Industry, 2020, 41(18):244-251.
[23] MA S Y, LUO H B, ZHAO D, et al.Environmental factors and interactions among microorganisms drive microbial community succession during fermentation of Nongxiangxing daqu[J].Bioresource Technology, 2022, 345:126549.
[24] 栾春光, 郝建国, 江伟, 等.不同工艺清香型大曲理化指标差异与微生物菌群结构的相关性研究[J].酿酒, 2021, 48(2):43-48.
LUAN C G, HAO J G, JIANG W, et al.The correlational study between the phys-chemical index and the microbiota in Fen flavor starter (Daqu)[J].Liquor Making, 2021, 48(2):43-48.
[25] 杜向军, 明红梅, 马浩, 等.机制与人工大曲曲块部位间微生物群落结构差异及其关键影响因素分析[J].食品与发酵工业, 2023,49(3):83-91.
DU X J, MING H M, MA H, et al.Microbial community structure differences and key influencing factors among different parts of mechanical and artificial Daqu[J].Food and Fermentation Industries, 2023,49(3):83-91.
[26] 唐鳗秋, 夏玙, 吴正云, 等.基于宏基因组学技术的八种中日酒曲微生物多样性对比分析[J].食品与发酵工业, 2022, 48(5):233-239.
TANG M Q, XIA Y, WU Z Y, et al.Comparative analysis on microbial diversity of eight kinds of Chinese Jiuqu and Japanese koji based on metagenomics technology[J].Food and Fermentation Industries, 2022, 48(5):233-239.
[27] PU S C, ZHANG Y, LU N, et al.Yeasts from Chinese strong flavour Daqu samples:Isolation and evaluation of their potential for fortified Daqu production[J].AMB Express, 2021, 11(1):1-12.
[28] YI Z L, JIN Y L, XIAO Y, et al.Unraveling the contribution of high temperature stage to Jiang-flavor Daqu, a liquor starter for production of Chinese Jiang-flavor Baijiu, with special reference to metatranscriptomics[J].Frontiers in Microbiology, 2019, 10:472-486.
[29] 魏军林, 聂尧, 杜海, 等.营养相互作用对传统发酵食品微生物群落构建的推动作用研究进展[J].微生物学通报, 2021, 48(11):4412-4424.
WEI J L, NIE Y, DU H, et al.How trophic interactions drive the spontaneous construction of microbial community in traditional fermented foods:A review[J].Microbiology China, 2021, 48(11):4412-4424.