益生菌制剂是天然的免疫激活剂,可以激活巨噬细胞并提高干扰素的含量,激活机体免疫力和抗病能力[1]。当益生菌进入机体后,其可定殖于肠道并繁殖,在机体消化过程中可以产生多种维生素、氨基酸、过氧化氢和乳酸等物质,可抑制肠道内病原菌的生产繁殖,维持肠道健康,促进机体对营养物质的消化和吸收[2-3]。
免疫是机体通过识别和排除抗原性异物,从而保持体内外环境稳定的一种特异性生理反应[4]。在新冠疫情的大环境下,如何提升机体免疫力引起了越来越多人的关注。机体的细胞免疫应答过程主要由T细胞介导,有研究表明,鼠李糖乳杆菌(Lactobacillus rhamnosus,LGG)能够促进动物肠道T淋巴细胞的有效增殖,表现为成熟T淋巴细胞(CD3+)和辅助性T细胞(CD4+)数量升高[5];WANG等[6]通过在饲料中添加植物乳杆菌和低聚果糖,显著提高了动物血清中IgG和IgA含量,从而有效介导机体体液免疫应答反应;此外,肠道免疫屏障作为肠道黏膜免疫系统的第一道防线,益生菌能够通过对细胞因子分泌量的调节来改善肠道免疫屏障功能,例如,动物肠道白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor,TNF-α)、Toll样受体2和γ干扰素(interferon-γ,IFN-γ)的基因表达可经唾液乳杆菌B1进行增强[7],同时,植物乳杆菌ZLP001能够对产肠毒素性大肠杆菌(enterotoxigenic Escherichia coli,ETEC)诱导的动物小肠上皮细胞中IL-6、IL-8以及TNF-α分泌的增加产生显著的抑制作用[8];YANG等[9]报道证实,植物乳杆菌通过NF-κB和MAPK信号通路能够在一定程度上抑制ETEC K88诱导的IL-6、IL-8、TNF-α和IL-1α表达的增强及抗炎细胞因子PPAR-γ表达的减弱。目前,益生菌及其制剂对机体免疫功能的调节机制的研究已经日趋全面,然而,对于某单个菌株肠道定殖稳定性及其免疫调节机制的综合研究较少。
对于人体,具有较强肠道定殖稳定特性的益生菌菌株更能够有效地发挥其免疫调节机制,从而增强人体免疫力。因此,本研究主要针对嗜热链球菌S131肠道定殖稳定性及其对巨噬细胞免疫调节的功能特性进行研究,并对其提升免疫力的作用机制进行解析,为益生菌及其免疫力调节功能产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
氯化钠、三氯乙酸、95%(体积分数)乙醇、苯酚、浓硫酸、透析袋(10 kDa)、胎牛血清、磷酸盐缓冲液(phosphate buffered saline, PBS)、青链霉素混合液、CCK-8试剂盒、0.4%台盼蓝染色液,生工生物工程(上海)股份有限公司;MRS液体培养基、MRS固体培养基,北京陆桥技术股份有限公司;2型猪胃黏蛋白(Sigma M2 378-100G)、吐温20、曲拉通X-100,生工生物工程(上海)股份有限公司;DMEM高糖培养液,美国Invitrogen公司;快速细胞冻存液(无血清),上海雅酶生物医药科技有限公司;脂多糖(lipopolysaccharide,LPS),美国Sigma公司;中性红细胞增殖及细胞毒性检测试剂盒,碧云天;ELISA试剂盒,北京四正柏生物科技有限公司;DMEM完全培养液由90%(体积分数)的DMEM、10%(体积分数)的胎牛血清和1%(体积分数)的青链霉素混合液组成。
1.2 仪器与设备
CX41显微镜,日本奥林巴斯公司;Micro21R离心机、Multiscan Go多功能酶标仪,美国Thermo公司;Accri C6 Plus流式细胞仪,君晓电子。
1.3 实验方法
1.3.1 菌株活化富集及细胞培养
将嗜热链球菌S131和阳性对照组鼠李糖乳杆菌LGG在MRS液体培养基中活化3代及以上,分别离心后收集各菌泥;用含10%胎牛血清的DMEM培养液对菌泥进行重悬,0.9%(体积分数)生理盐水对重悬菌液进行梯度稀释,用流式细胞仪检测菌液浓度,调整菌液浓度1.5×108CFU/mL左右,得到活菌菌悬液。灭活菌菌体收集同上,重悬菌体,置于80 ℃水浴锅中30 min进行灭活,盐水稀释后调整菌悬液浓度为1.5×108CFU/mL左右。
将RAW264.7细胞于含有10%胎牛血清的DMEM完全培养液中复苏,于37 ℃、5%(体积分数)CO2细胞培养箱中进行孵育,待细胞生长状态良好且密度达80%左右进行传代,传代3次后进行后续实验。
1.3.2 菌株黏附能力测定
向96孔板中各孔加入100 μL质量浓度为1.0 mg/mL黏蛋白溶液,4 ℃过夜孵育,向过夜孵育后的96孔板中每孔加入含1%(体积分数)吐温20的PBS封闭1 h;去除PBS后,向各孔中加入菌悬液,每组3个平行,空白对照组加入PBS,37 ℃孵育3 h,待孵育完毕后,加入含0.05%吐温20的PBS,清洗2次,去除未黏附的菌,在60 ℃烘箱中干燥1 h;干燥后向每孔加入结晶紫溶液,室温放置染色45 min;PBS清洗后加入无水乙醇,静置10 min;于595 nm波长下使用酶标仪测各孔的吸光值[10]。
1.3.3 菌株产胞外多糖能力检测
参考李嘉文等[11]的方法对待测菌悬液中的胞外多糖进行粗提取,样品测定采用苯酚-硫酸法[12],建立葡萄糖标准曲线,并依据标准曲线方程计算胞外多糖含量。
1.3.4 菌株对细胞增殖和吞噬能力影响的实验
用自动细胞计数仪检测1.3.1节中活化后的细胞数量并调整细胞浓度为1.5×105个/mL,接种于96孔板,每孔100 μL细胞悬液在37 ℃、5% CO2培养箱中过夜孵育。
细胞贴壁后,弃去上清液,每孔加入100 μL细胞培养液(DMEM培养基,10%胎牛血清)和100 μL的活菌菌悬液或灭活菌悬液(1.3.1节中已调整好),空白对照组为100 μL细胞培养液,每组5个重复,在37 ℃、5% CO2条件下活菌组与RAW264.7细胞一起孵育4 h,灭活菌组与细胞RAW264.7一起孵育24 h。
用CCK-8法检测细胞活性及增殖情况[13-14]。按公式(1)计算细胞增殖率:
细胞增殖率![]()
(1)
式中:As表示各个实验组OD值;Ac表示空白对照组OD值。
中性红试剂盒检测细胞吞噬效果[15-16]。按公式(2)计算细胞吞噬率:
细胞吞噬率![]()
(2)
式中:As表示各个实验组OD值;Ac表示空白对照组OD值。
1.3.5 菌株对细胞免疫因子分泌能力影响的测定
RAW264.7细胞以2×105个/mL浓度接种于24孔板中,待细胞贴壁后,去除上清液,进行不用分组试验。各组设置如下(每组5个重复):
阴性对照组(DMEM):各孔中加100 μL DMEM,阴性对照组一孵育4 h,阴性对照组二孵育24 h;阳性对照组(LPS):加入LPS,阳性对照组一孵育4 h,阳性对照组二孵育24 h;LGG组:各孔中加100 μL鼠李糖乳杆菌LGG活菌菌悬液或灭活菌菌悬液,活菌组孵育4 h(24 h)。S131组:各孔中加100 μL嗜热链球菌S131活菌菌悬液或灭活菌菌悬液,活菌组孵育4 h(24 h);竞争组(S131+LPS):在各孔中同时加入LPS和嗜热链球菌S131活菌菌悬液或灭活菌菌悬液,活菌组孵育4 h(24 h);预防组(S131+LPS):各孔中先加入嗜热链球菌S131活菌菌悬液或灭活菌菌悬液,然后再加入LPS,活菌组孵育4 h+4 h(12 h+12 h);治疗组(LPS+S131):各孔中先加入LPS,然后再加入嗜热链球菌S131活菌菌悬液或灭活菌菌悬液,活菌组孵育4 h+4 h(12 h+12 h)。(注:括号内的时间为灭活菌需孵育时间,孵育均于37 ℃,5%CO2 培养箱中进行。)
收集细胞培养上清液,1 000 r/min离心10 min后分装到无菌离心管中,-80 ℃保藏备用。
按ELISA试剂盒说明书测定上述7种不同组中的TNF-α、IL-6和IL-10的细胞因子的分泌量[17-18]。
1.4 统计学分析
采用Excel 2019软件对试验数据进行统计整理,SPSS 24.0进行单因素方差分析,最小显著差别(least significant difference,LSD)法进行多重比较。使用Prism 8.0软件统计数据并作图,组间采用单因素方差分析,数据以![]() 为差异有统计学意义。
为差异有统计学意义。
2 结果与分析
2.1 菌株黏附能力的测定
通过对不同菌株黏附能力的检测试验,结果显示,嗜热链球菌S131和鼠李糖乳杆菌LGG菌株的活菌与灭活菌均显示出一定的黏附能力。同一菌株(嗜热链球菌S131或鼠李糖乳杆菌LGG)的活菌与灭活菌的黏附能力未表现出显著性差异,通过对比不同菌株的黏附能力检测结果,发现活化3代之后的嗜热链球菌S131相较于鼠李糖乳杆菌LGG,其活菌和灭活菌株均表现出较强的黏附能力,且灭活菌结果具有显著性差异(P<0.01),结果见图1。从该结果可以推论,具有较好黏附能力的嗜热链球菌S131,也应具备更加优异的机体肠道定殖稳定性潜力。该结论可以为嗜热链球菌S131益生菌相关产品的开发与创新提供肠道定殖稳定性的理论依据,为后续研究提供良好的基础。

图1 菌株黏附实验各组吸光度值
Fig.1 Absorbance values of each group in the strain adhesion experiment
注:*表示组间具有显著性差异。
2.2 嗜热链球菌S131菌株产胞外多糖能力检测
以MRS为对照组,葡萄糖标准曲线为y=0.005x-0.01,R2=0.998时胞外多糖含量为(304.2±0.416 3) μg/mL[19]。同条件下,嗜热链球菌S131的胞外多糖产量测定结果为(444.2±2.013) μg/mL,存在极显著差异(P<0.000 1)。研究表明,不同乳酸菌产胞外多糖的能力不同,产量大致在25~600 μg/mL[20]。本研究结果S131胞外多糖的产量在合理范围之内。此外,胞外多糖作为一种具有抗氧化、抗炎、抗肿瘤和调节机体免疫的作用的活性生物大分子[21-22],嗜热链球菌S131高产胞外多糖的生物特性,为其在调节免疫功能方面的应用提供理论依据。同时,结合糖代谢和生物信息学分析研究其菌株遗传背景,为运用基因工程获得高产优质胞外多糖菌株奠定基础。
2.3 嗜热链球菌S131对巨噬细胞增殖和吞噬能力的影响
通过对嗜热链球菌S131对RAW264.7细胞增殖和吞噬试验结果进行分析。如图2所示,嗜热链球菌S131的活菌与灭活菌对巨噬细胞均具有一定的促增殖能力;且进一步试验研究表明,在同为活性菌株或者同为灭活菌株条件下,嗜热链球菌S131对巨噬细胞的增殖能力高于鼠李糖杆乳菌LGG,且无显著性差异。
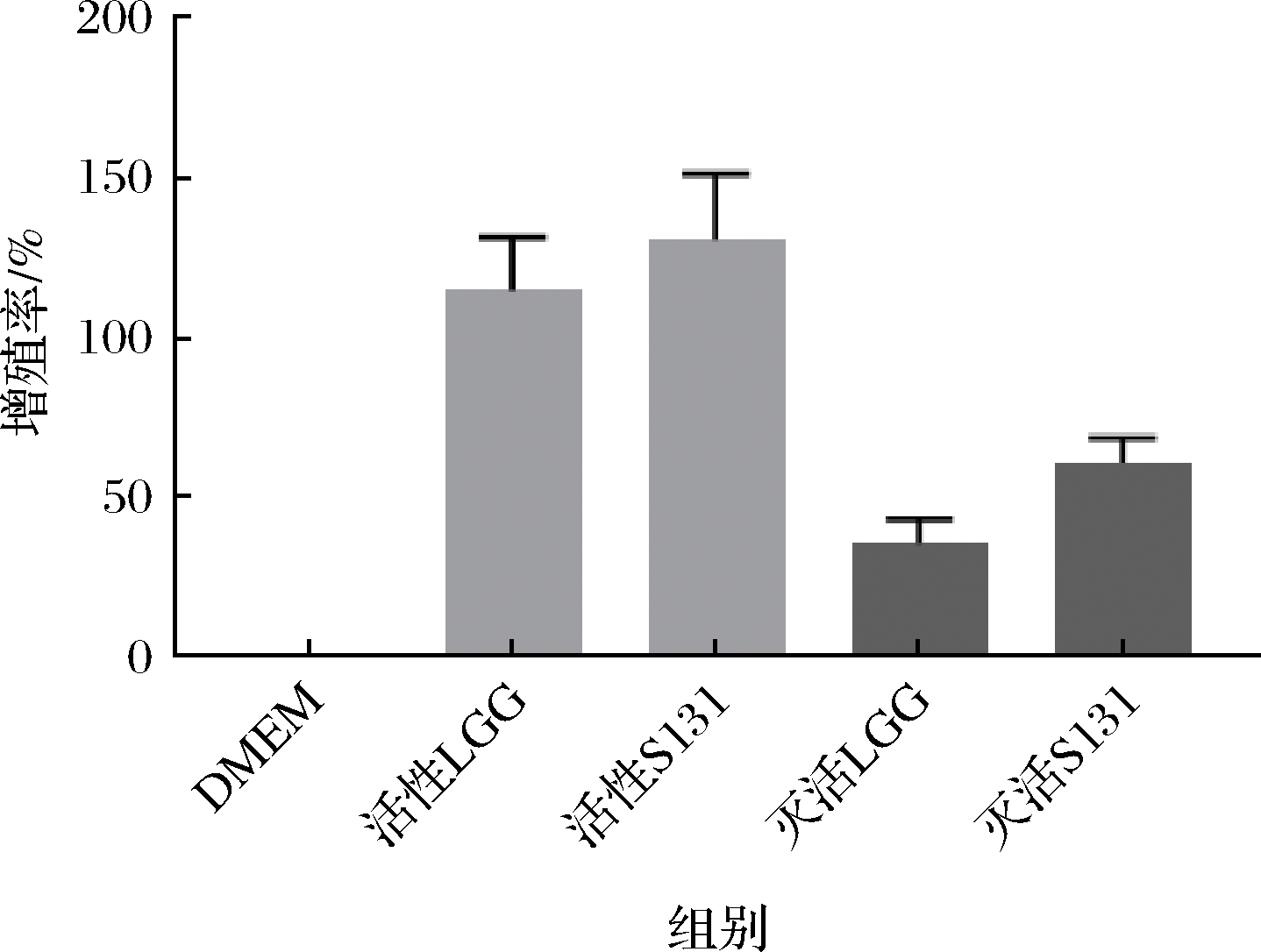
图2 不同菌株处理RAW264.7细胞的增殖率
Fig.2 Proliferation rate of RAW264.7 cells treated with different strains
如图3所示,嗜热链球菌S131的活菌与灭活菌均可促进巨噬细胞的吞噬作用,且在同为活菌或同为灭活菌株条件下,灭活的嗜热链球菌S131对巨噬细胞吞噬能力的促进作用高于鼠李糖乳杆菌LGG,且该结果具有显著性差异(P<0.01)。巨噬细胞在宿主抵抗外来物质入侵机体,免疫防御和创伤修复等过程中发挥着重要作用[23],结果显示,嗜热链球菌S131可以提高巨噬细胞增殖和吞噬能力,说明S131可以激活巨噬细胞,进而可以改善机体免疫力。此结果与FOO等[24]的结果相近,益生菌可以促巨噬细胞RAW264.7细胞增殖和吞噬,进而提升机体免疫力。
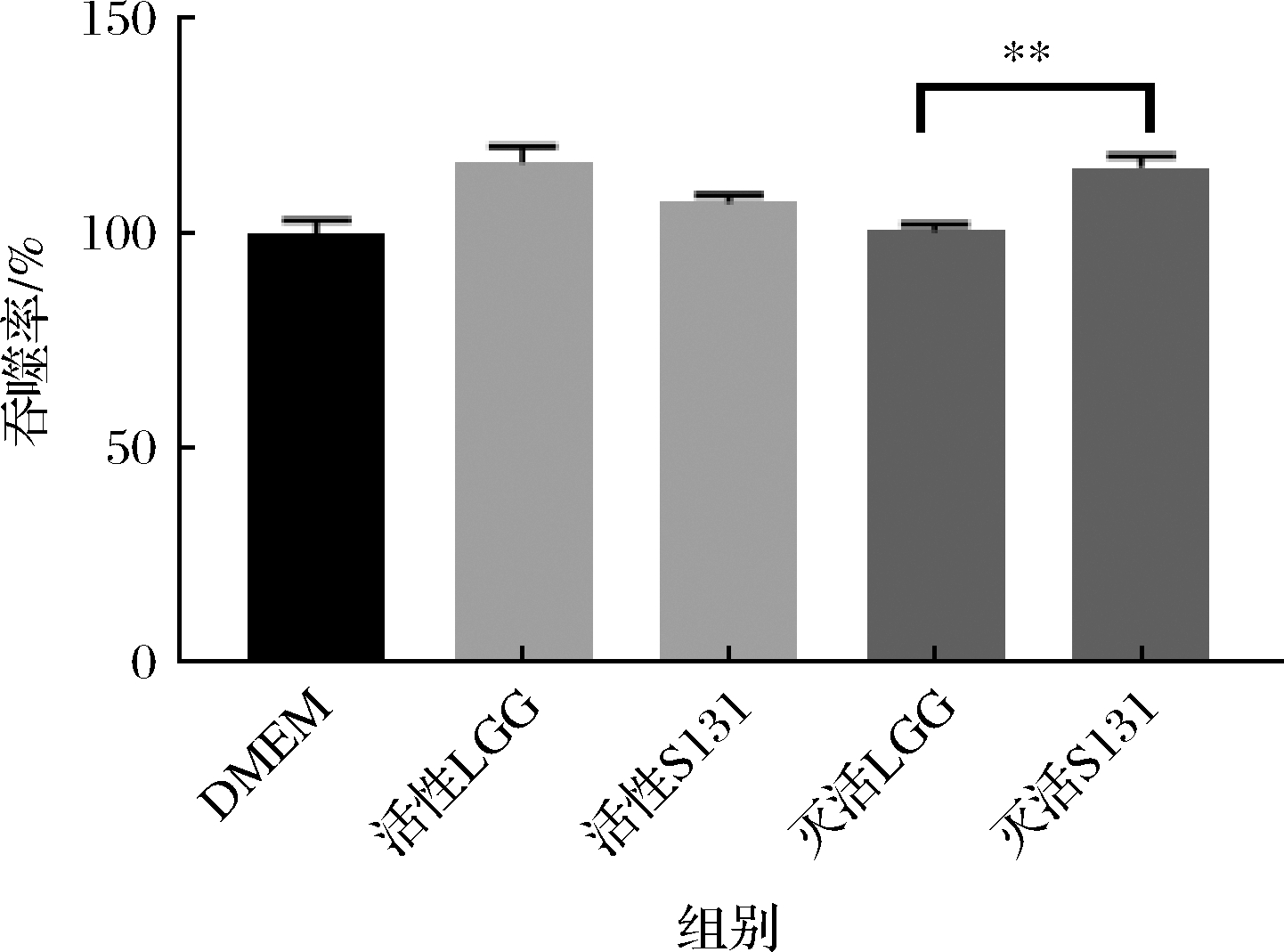
图3 不同菌株处理RAW264.7细胞的吞噬率
Fig.3 Phagocytosis rate of RAW264.7 cells treated with different strains
注:**表示组间具有极显著性差异。
2.4 菌株对巨噬细胞炎症因子分泌量的影响结果
由表1可知,与阴性对照相比,S131活菌组和LGG活菌组与细胞共孵育可促进细胞因子IL-10、IL-6和TNF-α的分泌,活菌组S131可上调TNF-α、IL-6和IL-10的分泌,引起生理性炎症反应,提高机体免疫,且活菌组促细胞分泌IL-10的能力高于LGG活菌组,表现出较良好的激活免疫系统的能力;当LPS诱导细胞形成炎症细胞时,S131活菌的竞争组、治疗组、预防组的TNF-α和IL-6值没有出现差异,且分泌抑炎因子IL-10增多,说明S131活菌可以增加炎症反应中抑炎因子IL-10的分泌,从而调节细胞炎症反应。细胞因子是由多种组织细胞合成分泌的小分子多肽或糖蛋白,且具有多种生物学功能,可以直接表征细胞功能。此结果与王琳琳[25]的研究结果相似,益生菌具有菌株特异性,部分菌株可以降低由LPS诱导的巨噬细胞炎症模型中促炎因子TNF-α和IL-6的分泌量,还可促抗炎因子IL-10的分泌。结果表明,S131在细胞处于正常状态时,可以促细胞分泌细胞因子,进而激活免疫细胞,提升免疫系统免疫能力;同时,当细胞处于炎症状态时,S131可以下调促炎因子的分泌量,提升抗炎因子的分泌量,进而缓解细胞炎症状态,说明S131可以双向调控巨噬细胞分泌细胞因子,证明其可激活细胞的免疫功能,进而提升机体免疫力。
表1 各组中RAW264.7细胞分泌细胞因子结果
Table 1 Cytokines secreted by RAW264.7 cells in each group
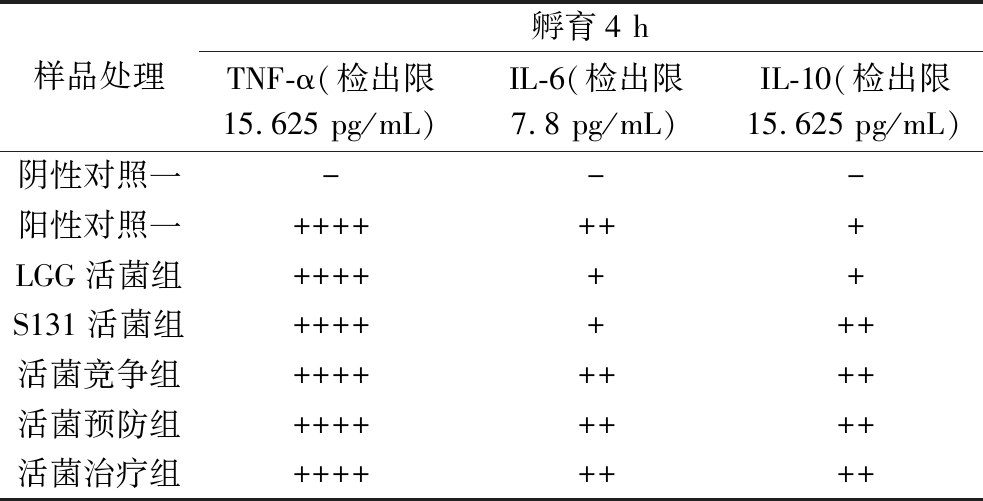
注:“-”代表细胞因子分泌量小于检出限;“+”代表分泌量15.625~125 pg/mL;“++”代表分泌量125~500 pg/mL;“+++”代表分泌量500~1 000 pg/mL;“++++”代表分泌量大于1 000 pg/mL。
样品处理孵育4 hTNF-α(检出限15.625 pg/mL)IL-6(检出限7.8 pg/mL)IL-10(检出限15.625 pg/mL)阴性对照一---阳性对照一+++++++LGG活菌组++++++S131活菌组+++++++活菌竞争组++++++++活菌预防组++++++++活菌治疗组++++++++
3 结论
本研究结果表明,嗜热链球菌S131具有良好的黏附能力,即可以较好地在肠道内定殖;对菌株产胞外多糖能力的测定结果表明,嗜热链球菌S131相较于对照组具有更优良的产胞外多糖特性,大量研究表明,胞外多糖是益生菌生长代谢过程中的主要次级代谢产物,其具有多种生理功能,可增强人体免疫力等[26]。同时,也可作为增稠剂、稳定剂、乳化剂等运用到食品、医药及生化产品等领域[27]。为进一步研究S131代谢产物的开发利用提供基础。
巨噬细胞在机体免疫系统中处于关键位置,在机体免疫过程中,它发挥着监视、防御、抗原识别和呈递、调节和清除凋亡细胞等功能,是免疫反应的第一道防线[28]。S131可以提升巨噬细胞的增殖和吞噬能力,其中增殖率和吞噬率作为巨噬细胞的活化能力最显著的特征,具有增强宿主防御和自身免疫的能力[29]。说明S131可以活化巨噬细胞,并提升机体的免疫力系统的免疫能力。
综上,嗜热链球菌S131可以定殖于肠道,并且可以高产胞外多糖,为之后继续研究S131的功能方向提供良好的基础实验依据。同时通过免疫细胞实验,S131不仅可以激活正常状态下的免疫细胞,增加其增殖和吞噬能力,还可促其分泌相关细胞因子;此外,S131还可降低炎症状态下促炎因子的分泌量,提升抗炎因子的分泌量,进而缓解细胞的炎症状态,S131可双向调节免疫细胞,改善不同状态下免疫细胞的相关指标。因此,认为嗜热链球菌S131具有调节免疫的功能,对于应用于保健食品和提升机体免疫力益生菌产品开发提供理论依据。
[1] AL-FATAFTAH A R, ABDELQADER A.Effects of dietary Bacillus subtilis on heat-stressed broilers performance, intestinal morphology and microflora composition[J].Animal Feed Science and Technology, 2014, 198:279-285.
[2] LEE K W, KIM D K, LILLEHOJ H S, et al.Immune modulation by Bacillus subtilis-based direct-fed microbials in commercial broiler chickens[J].Animal Feed Science and Technology, 2015, 200(1):76-85.
[3] 简宗辉, 孙帅, 豆腾飞, 等.益生菌在养鸡生产中应用的研究进展[J].畜牧与兽医, 2021, 53(11):129-134.
JIAN Z H, SUN S, DOU T F, et al.Advances in the application of probiotics in chicken production[J].Animal Husbandry &Veterinary Medicine, 2015, 200(1):76-85.
[4] 蔡淑娴, 万娟, 刘仲华.茶叶的调节免疫作用[J].中国茶叶, 2020, 42(4):1-12.
CAI S X, WAN J, LIU Z H.Regulative effects and mechanisms of tea on immune function[J].China tea, 2020, 42(4):1-12.
[5] SHONYELA S M, FENG B, YANG W T, et al.The regulatory effect of Lactobacillus rhamnosus GG on T lymphocyte and the development of intestinal villi in piglets of different periods[J].AMB Express, 2020, 10(1):76.
[6] WANG W W, CHEN J A, ZHOU H, et al.Effects of microencapsulated Lactobacillus plantarum and fructooligosaccharide on growth performance, blood immune parameters, and intestinal morphology in weaned piglets[J].Food and Agricultural Immunology, 2018, 29 (1):84-94.
[7] ZHANG J H,DENG J, WANG Z S, et al.Modulatory effects of Lactobacillus salivarius on intestinal mucosal immunity of piglets[J].Current Microbiology, 2011, 62(5):1623-1631.
[8] WANG J, JI H F, WANG S X, et al.Probiotic Lactobacillus plantarum promotes intestinal barrier function by strengthening the epithelium and modulating gut microbiota[J].Frontiers in Microbiology, 2018, 9:1953.
[9] YANG J, QIU Y, HU S, et al.Lactobacillus plantarum inhibited the inflammatory response induced by enterotoxigenic Escherichia coli K88 via modulating MAPK and NF-κB signalling in intestinal porcine epithelial cells[J].Journal of Applied Microbiology, 2021, 130(5):1684-1694.
[10] 李晶, 沈雪梅, 刘丽慧, 等.獭兔肠黏膜乳杆菌的分离鉴定及其体外益生特性研究[J].西北农林科技大学学报(自然科学版), 2017, 45(4):24-30.
LI J, SHEN X M, LIU L H, et al.Identification and in vitro probiotic potential of Lactobacillus strains isolated from small intestinal mucosa of rex rabbit[J].Journal of Northwest A &F University (Natural Science Edition), 2017, 45(4):24-30.
[11] 李嘉文, 刘达, 刘党生, 等.乳酸菌胞外多糖产生菌的筛选与初步研究[J].中国微生态学杂志, 2019, 31(9):1027-1033.
LI J W, LIU D, LIU D S.et al.Screening of and preliminary research on exopolysaccharides producing strain[J].Chinese Journal of Microecology, 2019, 31(9):1027-1033.
[12] 蔡红梅, 田子玉.苯酚-硫酸法测定草莓中总糖含量[J].吉林农业, 2019(4):46.
CAI H M, TIAN Z Y.Determination of total sugar content in strawberry by phenol sulfuric acid method[J].Agriculture of Jilin, 2019(4):46.
[13] 胡丹丹. 植物乳杆菌LP17-1对小鼠结肠炎缓解作用的研究及其胞外多糖分离提取[D].长沙:中南林业科技大学,2021.
HU D D.Study on the alleviating effect of Lactobacillus plantarum LP17-1 on colitis in mice and the isolation and extraction of extracellular polysaccharide[D].Changsha:Central South University of Forestry &Technology, 2021.
[14] 占萌. 高黏附乳酸菌的筛选及其对RAW264.7细胞的免疫调节作用[D].哈尔滨:东北农业大学, 2019.
ZHAN M.Screening of high adhesive lactic acid bacteria and its immunomodulatory activity against RAW264.7 macrophages[D].Harbin:Northeast Agricultural University, 2019.
[15] 韩璐. 益生菌发酵茯苓药渣制备饲料添加剂及其生物活性研究[D].北京:北京中医药大学, 2022.
HAN L.Study on preparation of feed additive from Poria cocos residue fermented by probiotics and its biological activity[D].Beijing:Beijing University of Traditional Chinese Medicine, 2022.
[16] NOH H J, PARK J M, KWON Y J, et al.Immunostimulatory effect of heat-killed probiotics on RAW264.7 macrophages.[J].Journal of Microbiology and Biotechnology, 2022, 32(5):638-644.
[17] ZHAO W W, WANG X, ZHAO C, et al.Immunomodulatory mechanism of Bacillus subtilis R0179 in RAW 264.7 cells against Candida albicans challenge[J].Microbial Pathogenesis, 2021, 157:104988.
[18] SINGH S, BHATIA R, SINGH A, et al.Probiotic attributes and prevention of LPS-induced pro-inflammatory stress in RAW264.7 macrophages and human intestinal epithelial cell line (Caco-2) by newly isolated Weissella cibaria strains[J].Food &Function, 2018, 9(2):1254-1264.
[19] 赵丹, 曹慧莹, 孙梦, 等.假肠膜明串珠菌HDL-3胞外多糖的分离纯化及结构性质分析[J].食品工业科技, 2022, 43(21):115-122.ZHAO D, CAO H Y, SUN M, et al.Isolation, purification and structural properties analysis of exopolysaccharide from Leuconostoc pseudoenterica HDL-3[J].Science and Technology of Food Industry, 2022, 43(21):115-122.
[20] RUAS-MADIEDO P, HUGENHOLTZ J, ZOON P.An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J].International Dairy Journal, 2002, 12(2-3):163-171.
[21] 郭润晴, 鄢梦洁, 杨玲, 等.一株嗜热链球菌S131及其在免疫调节领域中的应用:中国, CN113736715B[P].2022-03-29.
GUO R Q, YAN M J, YANG L, et al.A Streptococcus thermophilus S131 strain and its application in the field of immune regulation:China, CN113736715B[P].2022-03-29.
[22] ADESULU-DAHUNSI A T, JEYARAM K, SANNI A I, et al.Production of exopolysaccharide by strains of Lactobacillus plantarum YO175 and OF101 isolated from traditional fermented cereal beverage[J].PeerJ, 2018, 6:e5326.
[23] 晏永新, 张丽, 贾海芳, 等.党参多糖口服液对小鼠免疫功能的影响[J].中国兽药杂志, 2013, 47(3):18-20.
YAN Y X, ZHANG L, JIA H F, et al.Effects of Codonopsis pilosula polysaccharide oral liquids on the immunity function of mice[J]. Chinese Journal of Veterinary Drug, 2013, 47(3):18-20.
[24] FOO N P, YANG H O, CHIU H H, et al.Probiotics prevent the development of 1,2-Dimethylhydrazine (DMH)-induced colonic tumorigenesis through suppressed colonic mucosa cellular proliferation and increased stimulation of macrophages[J].Journal of Agricultural and Food Chemistry, 2011, 59(24):13337-13345.
[25] 王琳琳. 乳杆菌热致死菌体对RAW264.7巨噬细胞炎症反应的调控作用研究[D].哈尔滨:哈尔滨工业大学, 2016.
WANG L L.Regulation of heat-killed Lactobacillus body on RAW264.7 cell inflammation[D].Harbin:Harbin Institute of Technology, 2016.
[26] LIU C F, TSENG K C, CHIANG S S, et al.Immunomodulatory and antioxidant potential of Lactobacillus exopolysaccharides[J].Journal of the Science of Food and Agriculture, 2011, 91(12):2284-2291.
[27] 吴彤, 房晓彬, 闵伟红, 等.乳酸菌胞外多糖的理化特性及免疫调节机制研究进展[J].中国乳品工业, 2018, 46(5):36-38;42.
WU T, FANG X B, MIN W H, et al.Research advances on physicochemical characterization and immunoregulatory mechanism of exopolysaccharides from lactic acid bacteria[J].China Dairy Industry, 2018, 46(5):36-38;42.
[28] 许磊. 抗结核药物强化期治疗对肝功能影响及益生菌补充改善效果研究[D].青岛:青岛大学, 2021.
XU L.Effect of the intensive phase of anti-tuberculosis treatment on liver function and the improvement effect of probiotic supplementation[D].Qingdao:Qingdao University, 2021.
[29] CROTTI A, RANSOHOFF R M.Microglial physiology and pathophysiology:Insights from genome-wide transcriptional profiling[J].Immunity, 2016, 44(3): 505-515.