莲藕(Nelumbo nucifera Gaertn)为睡莲科莲属,多年水生草本植物,其地下根状茎是我国最主要的水生蔬菜[1]。莲藕富含蛋白质、淀粉、纤维素、脂肪、维生素、矿物质等多种成分,其中淀粉含量很高,占其鲜重的10%~20%[2]。另外,莲藕中还含有丰富的槲皮素、芦丁等黄酮类物质以及原花色素、儿茶素、绿原酸、咖啡酸、白藜芦醇等多酚类物质[3-4]。因此,莲藕具有很强的清除自由基和抗氧化能力,是提取天然抗氧化剂的优良原料。
近年来,抗生素等抑菌剂的长期滥用导致多重耐药性细菌不断产生,临床治疗和水产养殖等抑菌领域面临无药可用的局面[5]。随着纳米技术的不断发展,具有小尺寸和高比表面积的纳米银(silver nanoparticles,AgNPs)被广泛用于抑菌领域[6]。AgNPs抗菌谱广、抑菌效果显著、生物安全性高,更为重要的是其抑菌机制与传统抗生素不同,不易产生耐药性,被誉为新一代的抗菌剂[7-8]。AgNPs的经典合成方法为物理学方法和化学方法,但这两种方法存在诸多弊端,如对仪器要求高、能耗大、需要添加有害化学试剂、产品粒径较大且分布范围宽泛等,这势必会影响AgNPs的批量生产与开发利用[9-10]。另外,AgNPs易发生团聚,导致抑菌活性降低,也极大的限制其在抑菌方面的实际应用[11]。一项生物合成AgNPs的新技术是利用植物、藻类、细菌和真菌等生物中的活性成分作为还原剂将AgNO3前体转化成AgNPs制剂,同时利用生物提取物中的活性分子作为稳定剂在AgNPs表面形成保护层,阻止AgNPs的团聚和沉降[6,12]。该方法绿色环保、原料价格低廉、产品高效稳定,符合新技术向低成本、低能耗、低污染发展的趋势[6,13]。在诸多生物材料中,植物材料以其生物量大、便于采集加工、便于中试放大等优势成为生物合成AgNPs技术中一个重要的研究领域。目前,人们已利用生姜、蓝莓叶、橄榄和迷迭香等多种植物材料介导AgNPs的生物合成[14-15],并取得了良好的效果。但由于不同的植物材料中蕴含的活性物质存在较大差别,其制备的AgNPs在形状、大小及其表面附着的生物分子方面都存在较大差异,导致其在抑菌活性和稳定性等方面存在差异[16]。因此,筛选并挖掘新的植物材料用于制备更为理想的AgNPs抑菌剂将成为纳米生物技术重要的研究内容。
本文利用莲藕中富含的多种天然抗氧化成分为还原剂,同时利用提取液中的多糖、氨基酸、蛋白质等作为稳定剂,生物合成AgNPs抑菌剂。通过探讨不同合成条件对制备AgNPs的影响,并对优化后的产物进行理化表征以及抑菌活性和稳定性分析,为提升莲藕的综合利用度和附加值提供新的途径,同时为生物合成AgNPs的推广应用奠定基础。
1 材料与方法
1.1 材料和设备
莲藕购于山东省烟台市当地超市。
4种临床病原菌:金黄色葡萄球菌(Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli);4种水产病原菌:副溶血弧菌(Vibrio parahaemolyticus)、鳗弧菌(Vibrio anguillarum)、点状气单胞菌(Aeromonas punctata)、哈维氏弧菌(Vibrio harveyi),均由本实验室保藏。
1.2 试剂与培养基
NaCl、AgNO3,均为分析纯,国药集团化学试剂有限公司;酵母提取物、蛋白胨、琼脂,上海生工生物工程有限公司。
LB固体培养基(g/L):酵母提取物5,蛋白胨10,氯化钠5,琼脂粉15,pH值调至7.4,120 ℃高压灭菌20 min;以上成分不加琼脂粉配制成LB液体培养基。用于临床病原菌的培养。
2216E固体培养基:蛋白胨5 g,酵母膏1 g,磷酸高铁0.01 g,琼脂粉15 g,陈海水定容至1 000 mL,用1 mol/L的NaOH调节pH值至7.6~7.8,120 ℃高压灭菌20 min;以上成分不加琼脂粉配制2216E液体培养基。用于水产病原菌的培养。
1.3 仪器与设备
LDZX-50FB型高压灭菌锅,上海申安医疗器械有限公司;SW-CJ-2F型超净工作台,苏州净化设备有限公司;HZQ-C型恒温培养摇床,哈尔滨东明医疗仪器厂;PYX-DHS型恒温培养箱,上海跃进医疗器械厂;U-5100型紫外-可见分光光度计,日本日立公司;JEM-1230型透射电子显微镜,日本电子株式会社;XRD-7000 型X射线衍射仪,日本岛津公司。
1.4 实验方法
1.4.1 AgNPs的生物合成
莲藕提取液的制备:取完整的莲藕块茎用去离子水洗净,60 ℃烘干,研磨成粉末。称取5 g,用50 mL 40%(体积分数)乙醇提取,经60 ℃加热回流2 h后,提取液提取物用Whatman No.1滤纸过滤,再经10 000 r/min离心10 min后,收集上清液,4 ℃备用。
AgNPs的制备为了优化合成条件,设计单因素试验。初始条件为:将2 mL 10 mmol/L的AgNO3溶液与上述莲藕提取液1 mL混合,定容至20mL,在磁力搅拌下90 ℃加热回流1 h,12 000 r/min离心10 min,收集沉淀,用双蒸水重悬,得到AgNPs溶液,4 ℃避光保存。单因素试验反应条件:其他条件不变的情况下,分别改变AgNO3浓度(0.5、0.75、1.0、1.5、2.0 mmol/L)、提取液用量(0.25、0.5、1、2、3 mL)、合成温度(50、60、70、80、90 ℃)、合成时间(3、5、7、10、15、20、30 min)。
1.4.2 AgNPs的化学合成
为了评价莲藕生物合成AgNPs的效果,利用柠檬酸钠为还原剂化学合成AgNPs[17]。AgNO3浓度、合成温度、合成时间等实验条件均采用上述生物合成AgNPs的最终优化参数,莲藕提取液用2 mg/mL的柠檬酸钠代替。
1.4.3 AgNPs表征
紫外-可见吸收光谱分析:采用UV-Vis分光光度计对制备的AgNPs溶液进行吸收光谱扫描,扫描范围为300~800 nm。
透射电镜(transmission electron microscope,TEM)分析:取5 μL样品滴加在覆炭铜网上,室温干燥,于100 kV电压下观察制备AgNPs的形态、粒径及分散状况。
X射线衍射(X-ray diffraction,XRD)分析:通过XRD分析仪以Cu、Kα为辐射源,λ=0.154 06 nm,电压40 kV,电流200 mA,2θ的扫描范围30°~80°,扫描速度0.02°/s,对样品干燥粉末进行的晶型结构分析。
1.4.4 抑菌性实验
抑菌圈实验:采用牛津杯扩散法检测AgNPs对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌和铜绿假单胞菌等临床病原菌以及副溶血弧菌、鳗弧菌、点状气单胞菌和哈维氏弧菌等水产病原菌的抑菌活性。采用牛津杯扩散法测定供试样品的抑菌圈直径[18],分别向牛津杯中依次加入20 μL生物合成AgNPs(100 μg/mL)、化学合成AgNPs(100 μg/mL)、柠檬酸钠(2 mg/mL)、莲藕提取液和生理盐水,每组设置3个平行。将培养平皿置于恒温培养箱中培养24 h,测量抑菌圈直径。
最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)的测定:以金黄色葡萄球菌为指示菌,将培养至对数期的菌液稀释至1×106 CFU/mL,将化学合成AgNPs和生物化学合成AgNPs调整至同一浓度,采用二倍稀释法测定其MIC和MBC[18],实验各重复3次。
抑菌动力学实验:以金黄色葡萄球菌作为指示菌,培养至对数增长期后稀释至1×106 CFU/mL,分别加入10 μg/mL和25 μg/mL的生物合成AgNPs、10 μg/mL的化学合成AgNPs,并以加入生理盐水的供试菌组为对照,37 ℃ 150 r/min培养,在0~36 h中的各个时间段内取样,采用分光光度计测定OD600值,绘制生长动力学曲线。
1.4.5 稳定性实验
长期稳定性实验:将生物合成和化学合成的AgNPs在4 ℃避光条件下放置2个月后观察其外观,通过UV-Vis分光光度计检测AgNPs的吸收光谱,并以金黄色葡萄球菌作为指示菌进行抑菌圈实验,研究其长期稳定性。
热稳定性实验:分别将化学和生物合成的AgNPs在50、70、90 ℃下热处理3 h,以金黄色葡萄球菌为供试菌进行抑菌圈实验,观察热处理对AgNPs的影响。
1.5 数据统计分析
使用Origin软件进行数据统计与分析,采用单因素方差(ANOVA)对数据进行显著性分析(P<0.05)。所有实验数据均测定3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 AgNPs制备参数优化
由图1-a可知,AgNPs吸收峰随着AgNO3浓度增加逐渐升高。当浓度由0.75 mmol/L变为1 mmol/L时,吸收峰有显著升高并且峰形变窄,但当AgNO3浓度继续增加时,吸收峰无明显提高。典型的AgNPs由于特征性的表面等离子体共振,在波长400~500 nm有强吸收,出现特征吸收峰[19]。因此,根据UV-vis光谱可以推断莲藕生物合成AgNPs的最佳AgNO3浓度为1 mmol/L。

a-AgNO3浓度的影响;b-莲藕提取液添加量的影响;c-反应温度的影响;d-反应时间的影响
图1 纳米银反应条件的优化
Fig.1 Optimization of AgNPs reaction conditions
研究莲藕提取液加入量对AgNPs合成的影响,结果如图1-b所示,随着莲藕提取液加入量的增加,AgNPs的最大吸收峰逐渐增强。当提取液加入量为0.25、0.5 mL时,吸收峰较宽,当莲藕提取液加入量为1 mL时,半峰宽减小,说明AgNPs颗粒的粒径分布变窄[20]。当莲藕提取液加入量为2 mL时,最高吸收峰由436 nm移至458 nm,发生红移,吸收峰变宽,这表明随着AgNPs生成的增加,部分AgNPs发生团聚,粒径变大,粒径大小不均一[21]。当提取液加入量增至3 mL后,吸收峰进一步红移,峰形因粒径不均匀分布变得不对称。因此,提取液浓度不宜过高,莲藕提取液加入量以1 mL为宜。
合成温度对AgNPs合成的影响结果如图1-c所示,随着温度增加AgNPs的吸收峰逐渐上升,温度越高,反应速率越快。当加热温度升至70 ℃时,AgNPs吸收峰有显著提高,且峰形变窄且高,最高吸收峰由442 nm发生蓝移至434 nm,说明此温度下合成效率较高,合成的AgNPs颗粒较小、粒径较为均匀[22]。加热温度为80 ℃时,AgNPs峰值无明显改变,但在90 ℃时吸光度值却呈现下降的趋势。这是由于当温度升高的一定程度后,溶液中AgNPs粒子布朗运动聚类加剧,大量AgNPs撞击产生聚集沉淀,导致溶液中AgNPs的浓度降低[23]。因此,莲藕生物合成AgNPs的最佳合成温度确定为70 ℃。
反应时间对AgNPs的影响结果如图1-d所示,反应进行5 min时开始出现AgNPs吸收峰,随着反应时间的增加吸收峰逐渐升高,反应进行30 min时吸收峰值较高且吸收峰较窄,表明合成的AgNPs状态较为理想。若继续延长加热时间,纳米银溶液的颜色和吸收峰在短期内均不再发生显著变化,因此确定30 min为生物合成AgNPs的反应时间。
综上所述,莲藕提取液生物合成AgNPs的最佳制备条件为1 mmol/L 的AgNO3,1 mL的莲藕提取液,70 ℃加热回流30 min。
2.2 AgNPs的表征分析
2.2.1 紫外吸收光谱
对最佳合成条件制备的AgNPs进行颜色观察和紫外-可见吸收光谱表征,AgNPs因浓度和粒径大小的不同在等离子共振下呈现金黄至棕褐色的特征颜色,并形成特征吸收光谱[24]。由图2-a可知,莲藕提取液为无色透明,合成产物为金黄色,可初步判定AgNPs的产生。由图2-b可知,AgNPs在432 nm左右显现出显著的特征吸收峰,而莲藕提取液无吸收峰,进一步验证了AgNPs的成功制备。
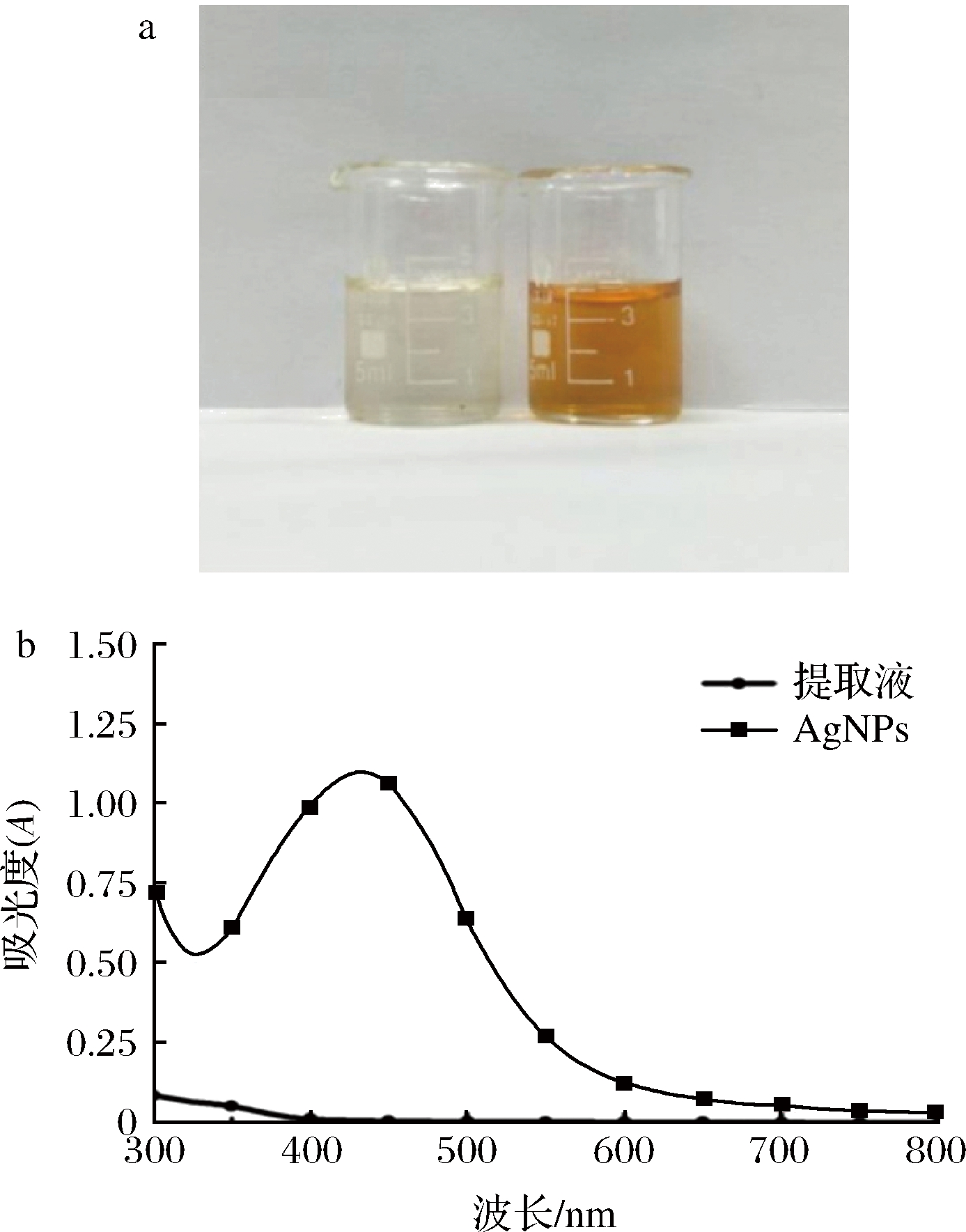
a-照片;b-紫外-可见吸收光谱
图2 莲藕提取液和生物合成的纳米银照片及紫外-可见吸收光谱
Fig.2 Photos and UV-VIS absorption spectra of lotus root extract and biosynthesized AgNPs
2.2.2 TEM分析
AgNPs的粒径、形貌和分散性可以使用TEM直接有效地观察。如图3-a所示,AgNPs多为球形,粒径均匀,分散状态良好,无明显团聚。AgNPs粒径范围在2~21 nm,平均粒径为8.2 nm,58%的AgNPs粒径为10 nm左右,粒径分布较为集中(图3-b)。研究表明AgNPs的抑菌活性与其粒径呈反比,粒径越小,比表面积越大,越有利于更多的AgNPs结合并穿透细菌细胞膜,发挥抑菌作用[25]。本研究方法制备的AgNPs粒径较小,适于开发成抑菌剂。

a-透射电镜照片;b-粒径分布图
图3 生物合成纳米银透射电镜照片与粒径分布图
Fig.3 TEM images of the biosynthesized AgNPs and their particle size distribution diagram
2.2.3 XRD分析
通过XRD对生物合成AgNPs的晶型结构进行表征,XRD图谱如图4所示。制备的AgNPs在2θ角为38.16°、44.36°、64.56°和76.80°的4个位置产生明显衍射峰,依次与标准银晶态的(111)、(200)、(220)和(311)的晶面相对应(参照JCPDS卡编号04-0783),表明生物合成的AgNPs具有面心立方晶型结构。此外,产物还在32.32°、46.36°、54.96°、57.68°和74.60 °等位置(*标注)有AgCl的衍射峰(参照JCPDS卡编号31-1238),是因为莲藕提取液中存在Cl-与AgNO3发生反应导致的,这在其他关于AgNPs生物合成的研究中很常见[26]。
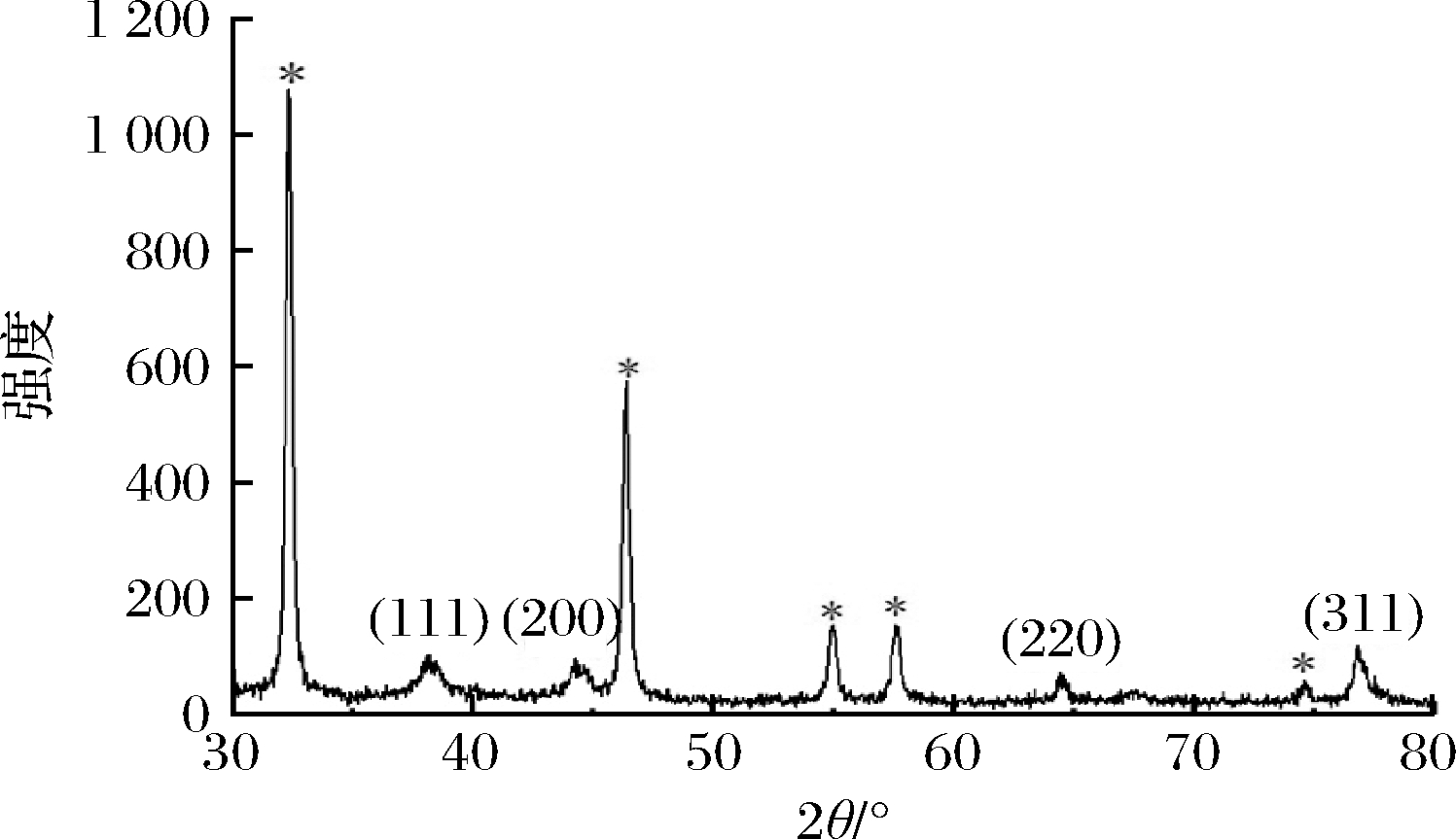
图4 纳米银的XRD图谱
Fig.4 XRD patterns of AgNPs
注:*表示AgCl的衍射峰。
2.3 抑菌活性实验
2.3.1 抑菌圈实验
采用琼脂扩散法检测AgNPs对8种典型多重耐药病原菌的抑菌效果。由图5可知,作为对照的柠檬酸钠、莲藕提取液和生理盐水对应的牛津杯中仍有菌落生长,表明这3种物质不具备抑菌活性。生物合成AgNPs和化学合成AgNPs对8种耐药菌均产生明显的抑菌圈,表明AgNPs具有广谱抑菌活性。结合表1可知,生物合成和化学合成的AgNPs产生的抑菌圈因病原体的不同而产生差异,表明病原菌的不同导致对抑菌剂敏感度的差异性。另外,生物合成AgNPs比化学合成AgNPs产生的抑菌圈直径更大,表明生物合成的AgNPs具有更强的抑菌活性。研究表明,AgNPs大的比表面积容易附着在细菌细胞膜上,并具有超强的渗透性可迅速进入菌体中,使细菌细胞膜破裂、内容物泄露[27-28]。AgNPs还可与氧代谢酶的巯基结合,使酶失活,阻断呼吸代谢,并干扰DNA复制,使细菌停止分裂增殖[29]。AgNPs独特而多重的杀菌机制,使其对普通细菌、耐药细菌及真菌均有良好的杀菌作用。
表1 纳米银对8种病原菌的抑菌圈直径(n=3)
Table 1 Inhibitory zone diameter of AgNPs against 8 pathogens(n=3)
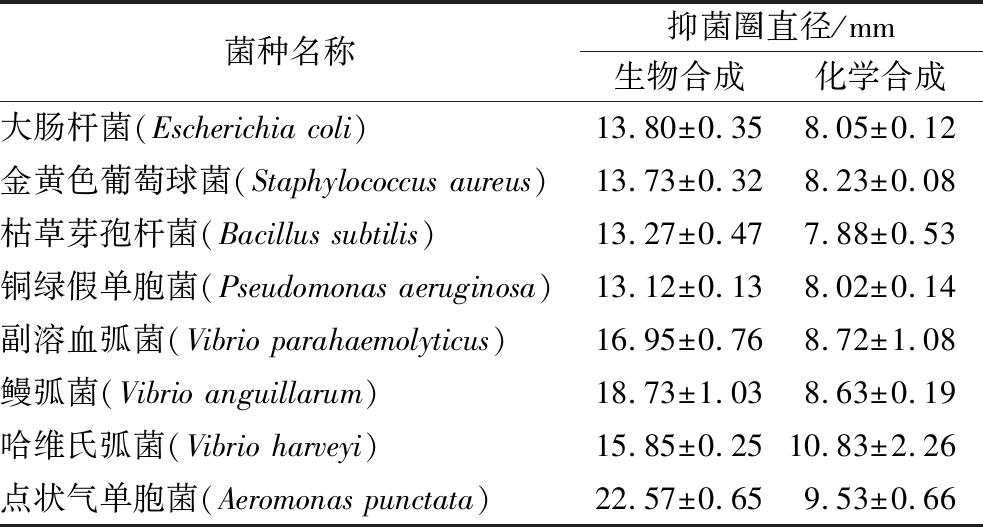
菌种名称抑菌圈直径/mm生物合成化学合成大肠杆菌(Escherichia coli)13.80±0.358.05±0.12金黄色葡萄球菌(Staphylococcus aureus)13.73±0.328.23±0.08枯草芽孢杆菌(Bacillus subtilis)13.27±0.477.88±0.53铜绿假单胞菌(Pseudomonas aeruginosa)13.12±0.138.02±0.14副溶血弧菌(Vibrio parahaemolyticus)16.95±0.768.72±1.08鳗弧菌(Vibrio anguillarum)18.73±1.038.63±0.19哈维氏弧菌(Vibrio harveyi)15.85±0.2510.83±2.26点状气单胞菌(Aeromonas punctata)22.57±0.659.53±0.66

1-生物合成AgNPs;2-化学合成AgNPs;3-柠檬酸钠;4-莲藕提取液;5-生理盐水
图5 纳米银对8种病原菌的抑菌效果
Fig.5 Antibacterial activity of AgNPs against 8 different pathogens
2.3.2 MIC和MBC测定
以金黄色葡萄球菌为供试菌,采用二倍稀释法测定AgNPs的MIC和MBC。3次重复实验结果均一致,如表2所示,当莲藕生物合成AgNPs质量浓度大于11.25 μg/mL时,试管内的溶液开始浑浊,则11.25 μg/mL即为该生物合成AgNPs的MIC。澄清试管内的菌悬液分别取100 μL涂布于LB固体培养基上,培养24 h后记录平板内菌落的生长情况,最终确定22.5 μg/mL为生物合成AgNPs的MBC。化学合成法制备的AgNPs的MIC和MBC分别为22.5、45.0 μg/mL。由此可见,与化学合成AgNPs相比,莲藕生物合成AgNPs具有较高的抑菌和杀菌活性,这与KORA等[30]利用橄榄生物合成AgNPs的研究结果一致。化学合成的AgNPs在粒径小于40 nm或者浓度较高的情况下容易发生团聚、沉淀,使AgNPs抑菌活性降低。而生物合成AgNPs由于其表面有生物分子的结合,保持较好的分散状态,从而维持较大的比表面积和抑菌活性[6]。
表2 纳米银对金黄色葡萄球菌最小抑菌浓度和最小杀菌浓度的测定
Table 2 MIC and MBC tests of AgNPs against S.aureus
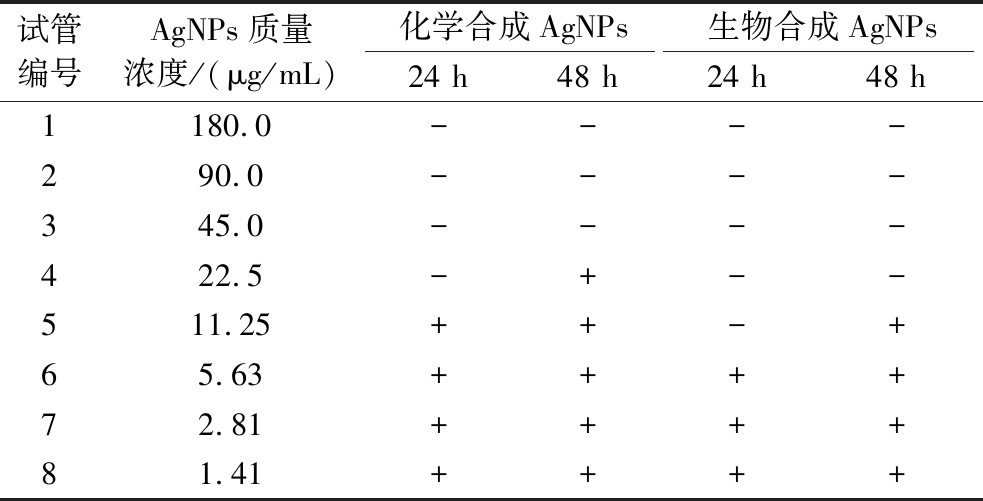
注:“-” 表示无菌生长;“+”表示有菌生长
试管编号AgNPs质量浓度/(μg/mL)化学合成AgNPs生物合成AgNPs24 h48 h24 h48 h1180.0----290.0----345.0----422.5-+--511.25++-+65.63++++72.81++++81.41++++
2.3.3 生长曲线
细菌的增殖速度可以由细菌培养液的吸光值反映,以金黄色葡萄球菌为指示菌,研究生物合成AgNPs的不同浓度对金黄色葡萄球菌的抑制作用。从图6中可看出,对照组为细菌的正常增殖速度:1.5 h之前为延滞期,1.5 h之后金黄色葡萄球菌进入对数增长期,12 h以后其进入稳定期。在高于MBC下,25 μg/mL 的生物合成AgNPs对金黄色葡萄球菌的增殖完全抑制,36 h内该处理组菌液的OD值基本没有波动。10 μg/mL的生物合成AgNPs和10 μg/mL的化学合成AgNPs可以将金黄色葡萄球菌的迟滞期由1.5 h分别延长到9 h和6 h,这说明两种AgNPs都能对供试菌产生抑制作用,其中生物合成AgNPs可将金黄色葡萄球菌对数增长期的滞后时间更长,并使分裂速率下降,比化学合成AgNPs具有更强的抑菌效果,与抑菌圈实验和MIC实验的结果相一致。
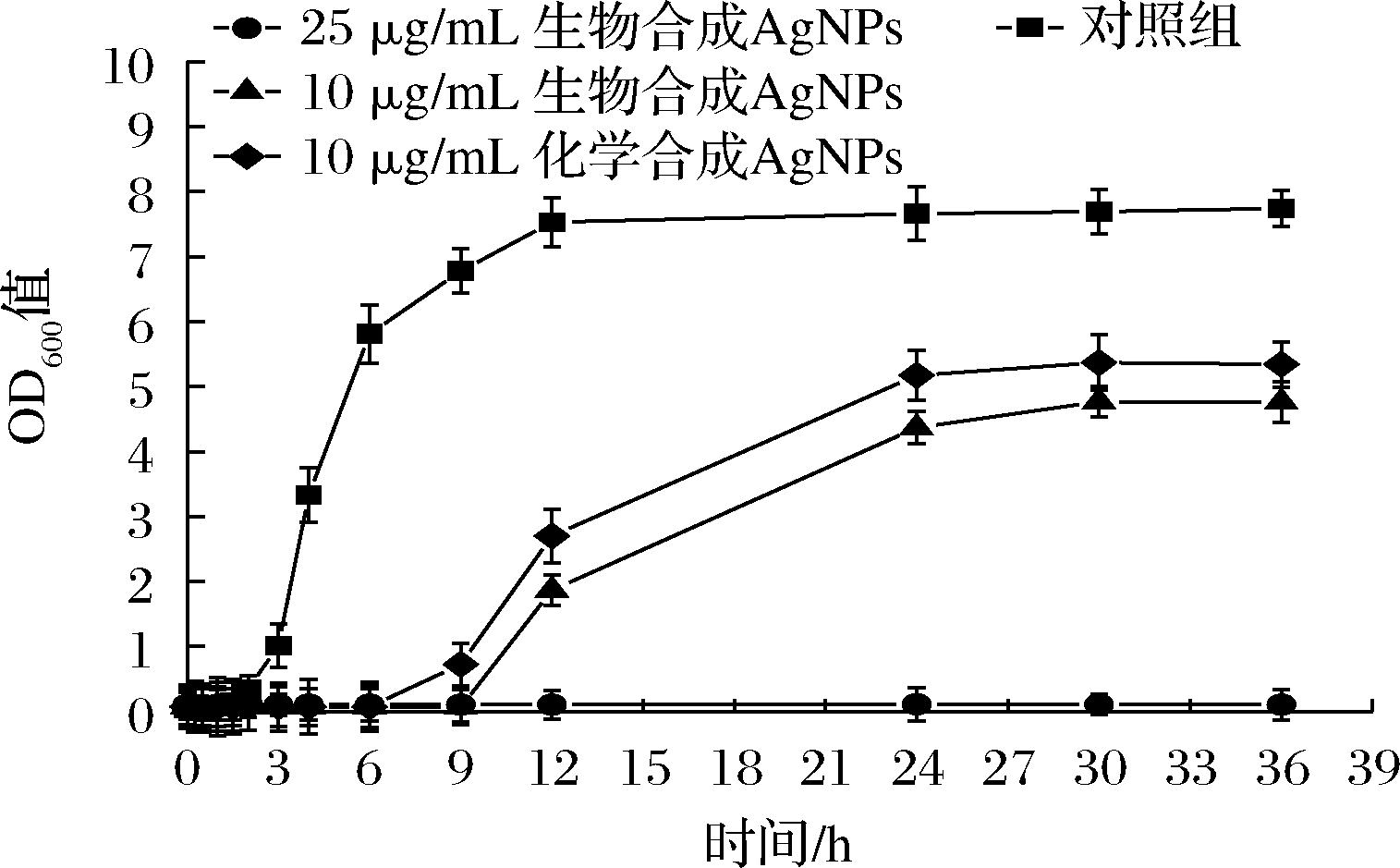
图6 纳米银对金黄色葡萄球菌生长曲线的影响
Fig.6 Effect of AgNPs on the growth curve of S.aureus
2.4 稳定性分析
2.4.1 长期稳定性分析
生物合成的AgNPs溶液在低温避光环境下保存60 d后,没有沉淀,颜色无明显变化;化学合成的AgNPs溶液有沉淀生成。进一步UV-vis分光光度计表征,结果如图7所示,表明生物合成的AgNPs在放置2个月后其吸收峰略有下降,但峰形依旧较窄,表明该AgNPs没有团聚,粒径均匀分布,具有良好的稳定性。而化学合成的AgNPs的最大吸收峰发生了明显红移,并且吸光度明显下降,表明团聚沉淀造成溶液中AgNPs含量的下降。
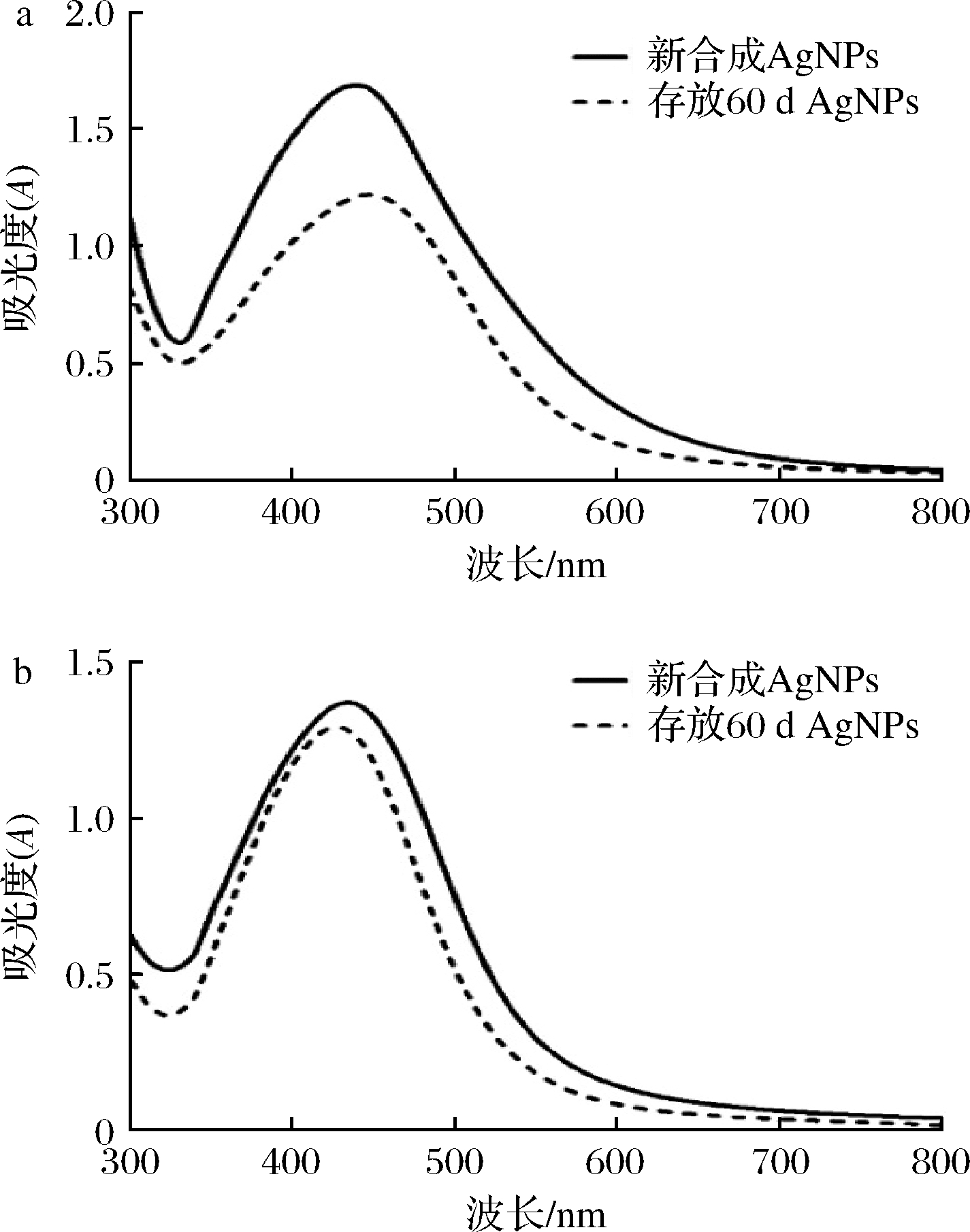
a-化学合成的AgNPs;b-生物合成的AgNPs
图7 存放不同时间的纳米银的紫外吸收光谱图
Fig.7 UV-Vis absorption spectra of AgNPs at different storage times
2.4.2 抑菌活性的耐热稳定性分析
将AgNPs在50、70、90 ℃ 3种不同温度下分别热处理3 h,再通过对金黄色葡萄球菌的抑菌圈实验检测AgNPs的热稳定性。图8结果显示,经过3种不同温度热处理后的AgNPs均有较大的抑菌圈,进一步说明AgNPs具有较好的热稳定性。其中70 ℃处理后的AgNPs的抑菌圈直径最大,相关研究表明,温度升高会增加分子的热运动,从而促进AgNPs粒子的扩散[27]。
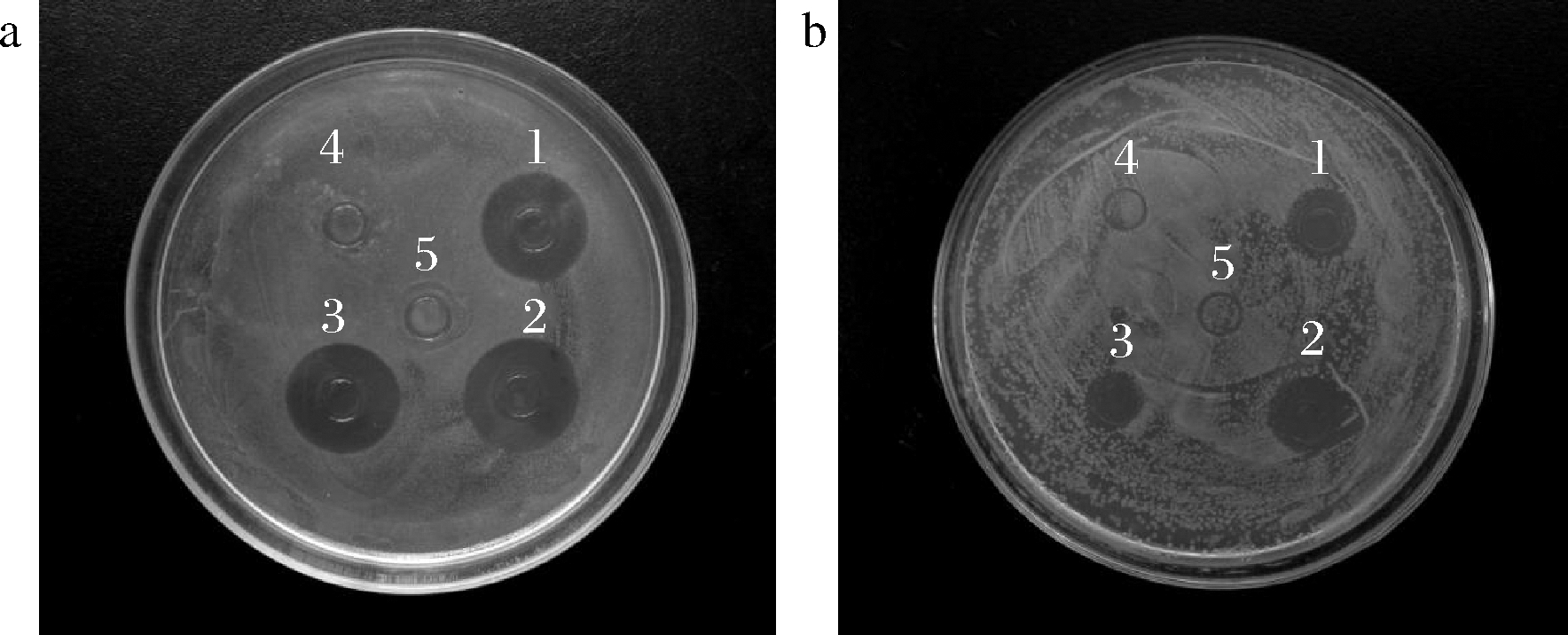
1-50 ℃处理AgNPs;2-70 ℃处理AgNPs;3-90 ℃处理AgNPs;4-常温莲藕提取液对照;5-常温生理盐水对照
a-生物合成AgNPs;b-化学合成AgNPs
图8 纳米银抑菌活性的耐热稳定性实验
Fig.8 Thermostability experiment of antibacterial activity of AgNPs
化学还原法因设备简单、成本低廉的优势成为目前制备AgNPs的主要方法,但Ag+因其纳米尺寸而具有很高的表面能,当AgNPs粒径小于40 nm或者浓度较高时,粒子间的布朗运动会导致AgNPs易发生沉降团聚[19]。因此,稳定性差成为化学法制备AgNPs制剂的短板,也成为AgNPs抑菌剂开发利用的重要障碍。上述稳定性实验表明,利用莲藕生物合成AgNPs能够显著提高AgNPs的稳定性,具有良好的开发前景。
3 结论
本研究成功利于莲藕提取物通过一步法生物合成AgNPs抑菌剂,经70 ℃加热回流30 min即可完成反应,合成迅速高效、绿色环保,表明利用莲藕提取物生物合成AgNPs具有可行性。实验结果表明制备的AgNPs粒径较小且均匀、分散性良好。对供试的临床和水产耐药病原菌均具有显著的抑菌活性,且抑菌活性的耐热稳定性良好,并具有较好的长期稳定性。因此,利于莲藕提取物生物合成的AgNPs是一种理想的抑菌产品。AgNPs因抑菌效果显著、抗菌广谱、无耐药性等优点,已作为抗生素的替代品成为抑菌领域的研究热点。本研究将为AgNPs的绿色合成及莲藕的高效利用提供新的途径,同时为AgNPs在临床、水产等抑菌领域的应用奠定基础。
[1] 麻玉莹, 杨忍忍, 高蔚娜, 等.莲藕活性成分及其生物学功能研究进展[J].营养学报, 2020, 42(5):509-513.
MA Y Y, YANG R R, GAO W N, et al.Research progress on components and biological functions of lotus root[J].Acta Nutrimenta Sinica, 2020, 42(5):509-513.
[2] 顾晓敏, 童川, 韩延超, 等.不同品种莲藕游离氨基酸多样性分析[J].食品科学, 2022, 43(4):183-189.
GU X M, TONG C, HAN Y C, et al.Diversity of free amino acids among different lotus rhizomes[J].Food Science, 2022, 43(4):183-189.
[3] 雷丹, 李军胜, 李书艺, 等.莲藕可溶性膳食纤维与多酚复合物的稳定性及脂肪吸附活性研究[J].中国食品学报, 2022, 22(2):31-39.
LEI D, LI J S, LI S Y, et al.Stability and fat adsorption activity of the complex of soluble dietary fiber and polyphenols from lotus root[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(2):31-39.
[4] 李晓萌, 李佳惠, 王雨行, 等.响应面优化莲藕多酚提取工艺及其生物活性研究[J].食品科技, 2022, 47(1):203-211.
LI X M, LI J H, WANG Y H, et al.Optimization of extraction process and bioactivities of polyphenols from lotus root by response surface method[J]. Food Science and Technology, 2022, 47(1):203-211.
[5] JINDAL P, BEDI J, SINGH R, et al.Phenotypic and genotypic antimicrobial resistance patterns of Escherichia coli and Klebsiella isolated from dairy farm milk, farm slurry and water in Punjab, India[J].Environmental Science and Pollution Research International, 2021, 28(22):28556-28570.
[6] SUN Q, CAI X, LI J W, et al.Green synthesis of silver nanoparticles using tea leaf extract and evaluation of their stability and antibacterial activity[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2014, 444:226-231.
[7] GURUNATHAN S, CHOI Y J, KIM J H.Antibacterial efficacy of silver nanoparticles on endometritis caused by Prevotella melaninogenica and Arcanobacterum pyogenes in dairy cattle[J].International Journal of Molecular Sciences, 2018, 19(4):1210.
[8] AGNIHOTRI S, MUKHERJI S, MUKHERJI S.Size-controlled silver nanoparticles synthesized over the range 5-100 nm using the same protocol and their antibacterial efficacy[J].RSC Advances, 2014, 4(8):3974-3983.
[9] BAGHAYERI M, MAHDAVI B, HOSSEINPOR-MOHSEN ABADI Z, et al.Green synthesis of silver nanoparticles using water extract of Salvia leriifolia:Antibacterial studies and applications as catalysts in the electrochemical detection of nitrite[J].Applied Organometallic Chemistry, 2018, 32(2):e4057.
[10] BEYENE H D, WERKNEH A A, BEZABH H K, et al.Synthesis paradigm and applications of silver nanoparticles (AgNPs), a review[J].Sustainable Materials and Technologies, 2017, 13:18-23.
[11] TONG C Y, ZHONG X H, YANG Y J, et al.PB@PDA@Ag nanosystem for synergistically eradicating MRSA and accelerating diabetic wound healing assisted with laser irradiation[J].Biomaterials, 2020, 243:119936.
[12] 姜宇, 李福艳, 刘冲冲, 等.山楂提取物生物合成纳米银对四种常见水产病原菌的抑制作用[J].海洋与湖沼, 2016, 47(1):253-260.
JIANG Y, LI F Y, LIU C C, et al.Biosynthezied silver nanopaticles using hawthorn fruit extract and their antibacterial activity against four common aquatic pathogens[J].Oceanologia et Limnologia Sinica, 2016, 47(1):253-260.
[13] MUDE N, INGLE A, GADE A, et al.Synthesis of silver nanoparticles using callus extract of Carica papaya—a first report[J].Journal of Plant Biochemistry and Biotechnology, 2009, 18(1):83-86.
[14] YANG N, LI F Y, JIAN T C, et al.Biogenic synthesis of silver nanoparticles using ginger (Zingiber officinale) extract and their antibacterial properties against aquatic pathogens[J].Acta Oceanologica Sinica, 2017, 36(12):95-100.
[15] LI K, MA C Y, JIAN T C, et al.Making good use of the byproducts of cultivation:Green synthesis and antibacterial effects of silver nanoparticles using the leaf extract of blueberry[J].Journal of Food Science and Technology, 2017, 54(11):3569-3576.
[16] SUBRAMANIAN M, ALIKUNHI N M, KANDASAMY K.In vitro synthesis of silver nanoparticles by marine yeasts from coastal mangrove sediment[J].Advanced Science Letters, 2010, 3(4):428-433.
[17] 姜苗苗, 丁颖, 徐丽慧, 等.纳米银材料的合成及其应用研究进展[J].化工新型材料, 2022, 50(6):245-249.
JIANG M M, DING Y, XU L H, et al.Research progress on synthesis and application of nano-Ag material[J].New Chemical Materials, 2022, 50(6):245-249.
[18] 魏亚楠, 马新冉, 齐珈俪, 等.纳米银/聚乙烯醇复合物的生物合成及其对6种水产病原菌的抑菌活性[J].复合材料学报, 2021, 38(11):3808-3817.
WEI Y N, MA X R, QI J L, et al.Biosynthesis of silver nanoparticles/polyvinyl alcohol composite and its antibacterial activity against six aquatic pathogens[J].Acta Materiae Compositae Sinica, 2021, 38(11):3808-3817.
[19] SADEGHI B, GHOLAMHOSEINPOOR F.A study on the stability and green synthesis of silver nanoparticles using Ziziphora tenuior (Zt) extract at room temperature[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2015, 134:310-315.
[20] TRIPATHI R M, KUMAR N, SHRIVASTAV A, et al.Catalytic activity of biogenic silver nanoparticles synthesized by Ficus panda leaf extract[J].Journal of Molecular Catalysis B Enzymatic, 2013, 96(12):75-80.
[21] 薛海燕, 张颖, 张宝艳, 等.安石榴苷还原壳聚糖/纳米银溶胶制备表征及其抑菌性能[J].农业工程学报, 2018, 34(4):306-314.
XUE H Y, ZHANG Y, ZHANG B Y, et al.Preparation characterization and bacteriostatic properties of punicalagin reducing chitosan/nano silver Sol[J].Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(4):306-314.
[22] ALVAREZ M M, KHOURY J T, SCHAAFF T G, et al.Optical absorption spectra of nanocrystal gold molecules[J].The Journal of Physical Chemistry B, 1997, 101(19):3706-3712.
[23] 陈杨, 陈志刚, 李霞章, 等.超声场对醇/水反应体系制备纳米CeO2粉体影响研究[J].化学工程, 2007, 35(4):57-60.
CHEN Y, CHEN Z G, LI X Z, et al.Effect of ultrasonic radiation on preparation of nano-sized CeO2 powder in alcohol/water reaction system[J].Chemical Engineering (China), 2007, 35(4):57-60.
[24] 张曼莹, 刘姿铔, 邬艳君.生物纳米银稳定性及抗菌性能研究[J].现代化工, 2018, 38(10):109-113.
ZHANG M Y, LIU Z Y, WU Y J.Study on stability and antibacterial property of biogenic silver nanoparticles[J].Modern Chemical Industry, 2018, 38(10):109-113.
[25] PANACEK A, KVíTEK L, PRUCEK R, et al.Silver colloid nanoparticles:Synthesis, characterization, and their antibacterial activity[J].The Journal of Physical Chemistry B, 2006, 110(33):16248-16253.
[26] MIRI A, SARANI M, REZAZADE BAZAZ M, et al.Plant-mediated biosynthesis of silver nanoparticles using Prosopis farcta extract and its antibacterial properties[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2015, 141:287-291.
[27] 胡烈海, 朱新根, 余双, 等.纳米银抗菌应用的研究进展[J].中国抗生素杂志, 2020, 45(8):745-750.
HU L H, ZHU X G, YU S, et al.Research progress in antibacterial application of nano-silver in antibacteria[J].Chinese Journal of Antibiotics, 2020, 45(8):745-750.
[28] MOHSEN E, EL-BORADY O M, MOHAMED M B, et al.Synthesis and characterization of ciprofloxacin loaded silver nanoparticles and investigation of their antibacterial effect[J].Journal of Radiation Research and Applied Sciences, 2020, 13(1):416-425.
[29] JHA M, SHIMPI N G.Green synthesis of zero valent colloidal nanosilver targeting A549 lung cancer cell:In vitro cytotoxicity[J].Journal of Genetic Engineering and Biotechnology, 2018, 16(1):115-124.
[30] KORA A J, SASHIDHAR R B, ARUNACHALAM J.Aqueous extract of gum olibanum (Boswellia serrata):A reductant and stabilizer for the biosynthesis of antibacterial silver nanoparticles[J].Process Biochemistry, 2012, 47(10):1516-1520.