痤疮 (acne) 是一种基于毛囊皮脂腺单位的慢性炎症性疾病,多见于青少年时期,其中有15%~20%的人患有中度至重度的痤疮[1]。痤疮会对患者皮肤造成伤害,增加患者产生焦虑、抑郁的风险[2]。痤疮丙酸杆菌是引发痤疮的重要因素之一,它可以通过定植产生脂肪酶/酯酶、蛋白酶等酶类造成皮肤损伤,促进白细胞及角质形成细胞产生促炎因子等一系列过程诱导痤疮发病[3-4]。因此,限制痤疮丙酸杆菌的定植和增殖是痤疮治疗的关键。目前,局部或全身的抗生素使用是治疗痤疮的主要方法之一。然而,抗生素的长期使用会导致痤疮丙酸杆菌耐药性的增加[5]。此外,其他药物的使用例如异维A酸和过氧苯甲酰等存在部分副作用,包括呕吐、皮肤脱落、皮肤产生刺痛和灼烧感等[6-7]。基于以上问题,寻找可以有效地抑制痤疮丙酸杆菌的生长,同时减少副作用的新型抗菌剂越来越受到关注。
微生物在自然界中广泛存在、种类繁多,是探索和开发新型抗菌剂的重要来源。AGRAWAL等[8]从西海岸和印度安达曼岛的样本中筛选出35种海洋真菌并检测它们的抗菌活性,其中14株真菌 (42%) 对痤疮丙酸杆菌表现出不同水平的抗菌活性。CHA等[9]从传统泡菜中分离出副植物乳杆菌 (Lactobacillus paraplantarum)THG-G10,并证实其对痤疮丙酸杆菌具有抑菌作用,抑菌圈直径达到15.00 mm。ONEILL等[10]研究发现,从人体皮肤微生物组中分离出的头状葡萄球菌(Staphylococcus capitis)E12可以抑制痤疮丙酸杆菌的生长。虽然目前已有部分痤疮丙酸杆菌拮抗微生物得到分离和纯化,但已发现的拮抗菌对痤疮丙酸杆菌抑菌活性不高。因此,本研究从酸菜中筛选能高效拮抗痤疮丙酸杆菌的菌株,通过生理生化和16S rDNA测序比对分析对菌株进行鉴定。采用发酵优化的方法提升其抑菌活性,使用体外安全评价的方法评估菌株的安全性。以期能进一步丰富痤疮丙酸杆菌拮抗菌资源库,为该菌株作为抗菌剂在痤疮治疗、化妆品和护肤品行业的应用提供一定的研究基础。
1 材料与方法
1.1 样品与培养基
样品:酸菜样品购于碧水农场(产自四川宜宾,品名为老坛酸菜),痤疮丙酸杆菌(Cutibacterium acnes)ATCC 6919购于广东省微生物保藏中心。
RCM(reinforced clostridium medium)液体培养基(g/L):蛋白胨10.0,牛肉粉10.0,酵母粉3.0,葡萄糖5.0,可溶性淀粉1.0,氯化钠5.0,醋酸钠3.0,L-半胱氨酸盐酸盐0.5,琼脂 0.5,调节pH 6.7~6.9,121 ℃灭菌15 min。
MRS液体培养基(g/L):K2HPO4 10.0,乙酸钠5.0,MgSO4·7H2O 0.5,MnSO4·H2O 0.25,柠檬酸氢二铵2.0,葡萄糖5.0,蛋白胨10.0,吐温80 1.0,牛肉膏10.0,酵母膏5.0,调节pH 5.5~5.9,115 ℃灭菌20 min。
LB液体培养基(g/L):酵母膏5.0,胰蛋白胨10.0,NaCl 10.0,调节pH 6.9~7.1,121 ℃灭菌15 min。
NB(nutrient broth)培养基(g/L):牛肉膏3.0,胰蛋白胨10.0,NaCl 5.0,调节pH 7.0~7.4,121 ℃灭菌15 min。
TSB(trypticase soy broth)培养基(g/L):胰酪蛋白胨17.0,大豆蛋白胨3.0,葡萄糖2.5,NaCl 5.0,K2HPO4 2.5,调节pH 7.1~7.5,121 ℃灭菌15 min。
BPY(beef peptone yeast)培养基(g/L):牛肉膏5.0,蛋白胨10.0,酵母膏5.0,NaCl 5.0,葡萄糖5.0,调节pH 7.0,121 ℃灭菌15 min。
Landy培养基(g/L):葡萄糖20.0,L-谷氨酸钠5.0,蛋白胨10.0,MgSO4 0.5,KCl 0.5,KH2PO4 1.0,MnSO4 0.005,FeSO4 0.000 15,CuSO4 0.000 16,调节pH 7.0,121 ℃灭菌15 min。
NYD培养基(g/L):牛肉膏8.0,酵母膏5.0,葡萄糖10.0,调节pH 7.2,121 ℃灭菌15 min。
所有固体培养基在其液体培养基的基础上加入20 g/L的琼脂粉。
1.2 主要试剂与仪器
血琼脂平板,广东环凯生物科技有限公司;药敏纸片,杭州滨河微生物试剂有限公司;小型质粒抽提试剂盒、细菌基因组DNA抽提试剂盒,上海生物工程有限公司;研究中引物合成与DNA测序均由上海生工生物工程有限公司完成。
HDPN-II-55电热恒温培养箱,上海跃进医疗器械有限公司;5810R台式高速离心机,德国Eppendorf公司;DYY-6D琼脂糖凝胶电泳仪,北京六一生物科技有限公司。
1.3 实验方法
1.3.1 菌株的分离纯化
取购买的酸菜样品10 g,放入50 mL无菌离心管中,加入玻璃珠以及25 mL无菌生理盐水,220 r/min,37 ℃摇床振荡30 min混匀。取1 mL混合液进行梯度稀释至10-4,涂布于LB和MRS平板,置于37 ℃培养24 h,根据菌落形态的不同,挑取单菌落进行划线分离,分离后得到的单菌落用LB或MRS液体培养基置于37 ℃,220 r/min培养24 h,获取菌株发酵液,用于后续初筛实验。抑菌效果较好的菌株将置于-80 ℃冰箱进行甘油管保存。
1.3.2 菌株的筛选
痤疮丙酸杆菌的培养:挑取RCM平板上痤疮丙酸杆菌单菌落,接种至RCM液体培养,37 ℃厌氧培养48 h至对数末期,用培养基调至其OD600值为1,用于菌株筛选实验。
初筛:采用琼脂扩散法进行菌株抑菌活性的检测,参照文献方法[11],稍作修改。用镊子夹取牛津杯置于RCM固体平板上,上层倾注含5%(体积分数)痤疮丙酸杆菌的RCM培养基10 mL。待凝固后夹出牛津杯,形成样孔,向样孔内加入100 μL各菌株发酵液,置37 ℃厌氧培养48 h后,测量抑菌圈直径。每个实验组设置3个平行,取平均值。选取抑菌圈直径较大的菌株进行复筛。
复筛:使用菌株过膜发酵上清液进行复筛。菌株发酵液8 000 r/min离心10 min去除菌体保留上清液,上清液用0.22 μm滤膜进行除菌处理,得到菌株过膜发酵上清液,采用琼脂扩散法测定抑菌圈直径,条件与初筛一致。选取抑菌活性最高的菌株进行鉴定及后续分析。
1.3.3 菌株的鉴定
形态学观察:对菌株HA2进行平板划线,LB平板置于37 ℃恒温培养箱培养12 h,观察并记录菌落形态特征。同时对菌株HA2进行革兰氏染色,用光学显微镜进行观察。
生化特征:参照《常见细菌系统鉴定手册》[12],对菌株HA2进行生化实验。
分子生物学特征:使用细菌基因组抽提试剂盒提取菌株HA2基因组DNA,以细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGT TACGACTT-3′)进行PCR扩增。PCR产物经电泳验证并纯化回收后送往上海生工生物工程有限公司进行测序。测序序列提交至NCBI进行BLAST比对,获取同源性较高的菌株的16S rDNA序列,通过软件MEGA-7.0进行序列相似性分析,并构建系统发育树。
1.3.4 菌株的培养基优化
初始培养基的筛选:用接种环挑取平板上HA2单菌落,接种至LB培养基,37 ℃、220 r/min培养24 h得到拮抗菌株HA2种子液,种子液以3%的比例接种于50 mL的初始培养基 (LB、NB、BPY、Landy、TSB、NYD培养基),30 ℃、220 r/min培养48 h,测定其过膜发酵上清液抑菌圈直径,选定最佳初始培养基。
培养基成分优化:以最佳初始培养基LB作为出发培养基,培养基的成分和浓度作为初始水平,进行培养基成分优化。选择不同的碳源(葡萄糖、蔗糖、半乳糖、麦芽提取物、果糖、糊精、可溶性淀粉)替换LB培养基中的碳源(酵母粉)确定最佳碳源种类,对碳源质量浓度(2.5~25 g/L麦芽提取物)进行优化,确定最佳碳源浓度。在最佳碳源基础上,选择不同氮源种类(大豆分离蛋白、硫酸铵、脱脂奶粉、酪蛋白水解物、无氨基酵母氮源、牛肉膏和玉米浆)替换LB培养基中氮源(胰蛋白胨)确定最佳氮源种类,对氮源质量浓度(5~30 g/L胰蛋白胨)进行优化,确定最佳氮源浓度。在最佳碳氮源的基础上,选择不同种类无机盐[MgSO4·7H2O、ZnSO4、CaCl2、KCl、FeSO4·7H2O、CuSO4·5H2O、Fe2(SO4)3·7H2O]替换LB培养基中无机盐(NaCl),确定最佳无机盐种类,对无机盐质量浓度(5~40 g/L CaCl2)进行优化,确定最佳无机盐浓度。以上培养基优化实验中的发酵条件均与初始培养基的筛选实验条件保持一致。
正交试验:以最佳碳源、氮源和无机盐为自变量,进行正交试验。选用三因素三水平试验正交表进行,因素及水平设计见表1。
表1 正交试验的因素和水平
Table 1 Factors and levels of orthogonal experiments
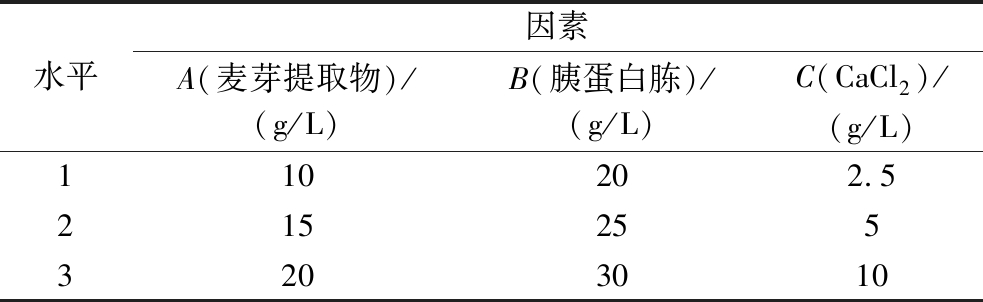
水平因素A(麦芽提取物)/(g/L)B(胰蛋白胨)/(g/L)C(CaCl2)/(g/L)110202.52152553203010
1.3.5 菌株的发酵条件优化
挑取平板上HA2单菌落,接种至LB培养基,37 ℃、220 r/min培养24 h得到菌株HA2种子液。种子液按照3%的比例接入优化后培养基中,30 ℃,220 r/min摇床培养。对发酵时间(12~96 h)、发酵温度(20~40 ℃)、发酵液初始pH值(5.0~9.0)、接种量(1%~9%)、装液量(10%~60%) 进行优化。后续发酵条件优化实验均基于上一个最佳发酵条件的基础上进行,测定菌株HA2过膜发酵上清液的抑菌活性。
1.3.6 四环素效价曲线及发酵优化验证
分别配制质量浓度为8、16、32、64、128 μg/mL四环素溶液并使用0.22 μm滤膜进行除菌处理,按照1.3.2 节方法测定不同浓度四环素溶液对痤疮丙酸杆菌的抑菌活性。以抑菌圈直径大小为纵坐标,以四环素效价的lg对数值为横坐标(四环素的效价为950 U/mg),建立四环素效价曲线。
接种环挑取平板上HA2单菌落,接种至LB培养基,37 ℃、220 r/min培养24 h得到菌株HA2种子液。将种子液分别接种至优化前和优化后的培养基中,对菌株HA2进行优化前和优化后培养条件下的发酵,比较两种条件下菌株HA2过膜发酵上清液的抑菌活性,并进行效价换算。
1.3.7 菌株体外安全性评价
溶血性测定:参照文献[13]方法,稍作修改。吸取5 μL菌株HA2菌悬液点板于血平板上,以金黄色葡萄球菌ATCC 6538作为阳性对照,以植物乳杆菌D8作为阴性对照,LB培养基作为空白对照。37 ℃培养12~18 h,观察菌落周围是否产生溶血圈。若菌落四周出现透明溶血环,为β-溶血,若菌落四周出现草绿色环,为α-溶血;若菌落四周无任何变化,则为γ-溶血,即不溶血。
耐药性测定:采用药敏纸片扩散法[14]测定菌株HA2对各类抗生素的耐药性。抗生素种类为氯霉素、卡那霉素、链霉素、氨苄青霉素、庆大霉素、红霉素、强力霉素、四环素。
耐药质粒检测及耐药基因定位:参照文献[15]方法,稍作修改。使用小型质粒抽提试剂盒对菌株HA2进行质粒提取,以不含质粒的大肠杆菌DH5α为阴性对照,以含质粒的大肠杆菌pESC-URA为阳性对照,使用1%的琼脂糖凝胶电泳检测质粒存在情况。参照文献方法中的引物设计[16],以菌株HA2的DNA为模板,根据表2的引物进行红霉素耐药基因ermD/K1、ermD/K2和链霉素耐药基因str的扩增,用1%琼脂糖凝胶电泳检测PCR产物,判定有无特异性目的条带。
表2 耐药基因引物信息
Table 2 Information on primers for resistance genes
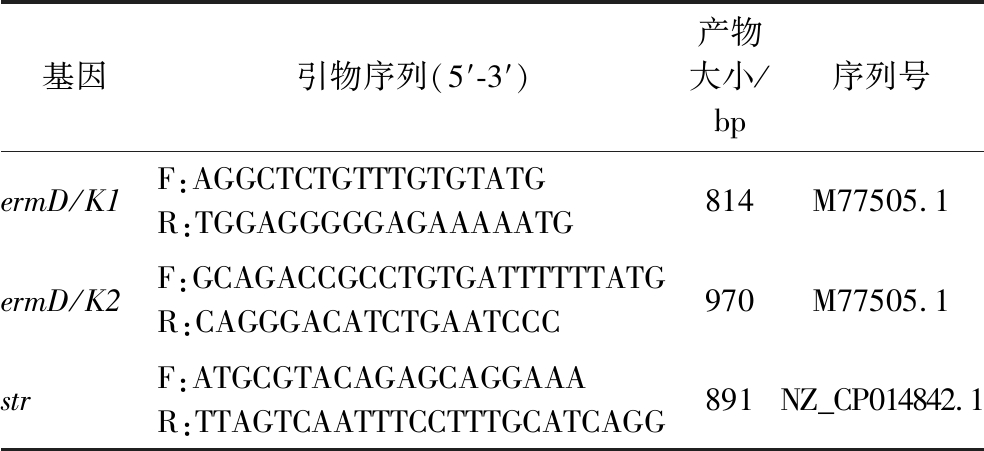
基因引物序列(5′-3′)产物大小/bp序列号ermD/K1F:AGGCTCTGTTTGTGTATGR:TGGAGGGGGAGAAAAATG814M77505.1ermD/K2F:GCAGACCGCCTGTGATTTTTTATGR:CAGGGACATCTGAATCCC970M77505.1strF:ATGCGTACAGAGCAGGAAAR:TTAGTCAATTTCCTTTGCATCAGG891NZ_CP014842.1
多种毒力基因的PCR检测:采用刘纯等[17]的方法,参考文献中芽孢杆菌毒力基因的引物信息。分别提取菌株HA2和阳性对照组蜡样芽孢杆菌的基因组,以DNA为模板,根据特定的引物分别特异性扩增溶血性肠毒素hbl(hblA、hblB、hblC、hblD)基因、非溶血性肠毒素nhe(nheA、nheB、nheC)基因、肠毒素T(bceT)基因、细胞毒素K(cytK)、和呕吐毒素(ces)等10种毒力基因,用1%琼脂糖凝胶电泳检测PCR产物,引物信息见表3。
表3 毒力基因引物信息
Table 3 Information on primers for virulence gene

注:—表示未查到。
基因引物序列 (5’-3’)产物大小/bp序列号hblAF:AAGCAATGGAATACAATGGGR:AGAATCTAAATCATGCCACTGC1 154AJ007794hblBF:AAGCAATGGAATACAATGGGR:AATATGTCCCAGTACACCCG2 684AJ007794hblCF:GATACTAATGTGGCAACTGCR:TTGAGACTGCTCGTTAGTTG740AJ007794hblDF:ACCGGTAACACTATTCATGCR:GAGTCCATATGCTTAGATGC829AJ007794nheAF:GTTAGGATCACAATCACCGCR:ACGAATGTAATTTGAGTCGC755Y19005nheBF:TTTAGTAGTGGATCTGTACGCR:TTAATGTTCGTTAATCCTGC743Y19005nheCF:TGGATTCCAAGATGTAACGR:ATTACGACTTCTGCTTGTGC683Y19005bceTF:CGTATCGGTCGTTCACTCGGR:TTTCTTTCCCGCTTGCCTTT924D17312cytKF:ACAGATATCGGGCAAAATGCR:GAACTGGAAACTGGGTTGGA809AJ277962cesF:GGTGACACATTATCATATAAGGTGR:GTAAGCGAACCTGTCTGTAACAACA1 271—
1.3.8 数据处理
用SPSS 26.0进行数据分析,其中差异显著性通过单因素方差分析,置信度为95% (P<0.05),采用分子生物学软件MEGA-7.0构建系统发育树。
2 结果与分析
2.1 菌株的筛选与鉴定
从酸菜样品中共分离纯化出187株菌株。通过琼脂扩散法筛选得到12株抑菌圈直径在20 mm以上的菌株,其中菌株HA2拮抗效果最佳,过膜发酵上清液抑菌圈直径达到35 mm,选取菌株HA2进行后续实验。对菌株HA2进行形态学观察,结果显示,菌株HA2的菌落形态呈圆形、边缘不规则,表面光滑,白色不透明 (图1-a);革兰氏染色呈阳性,菌体呈杆状 (图1-b)。
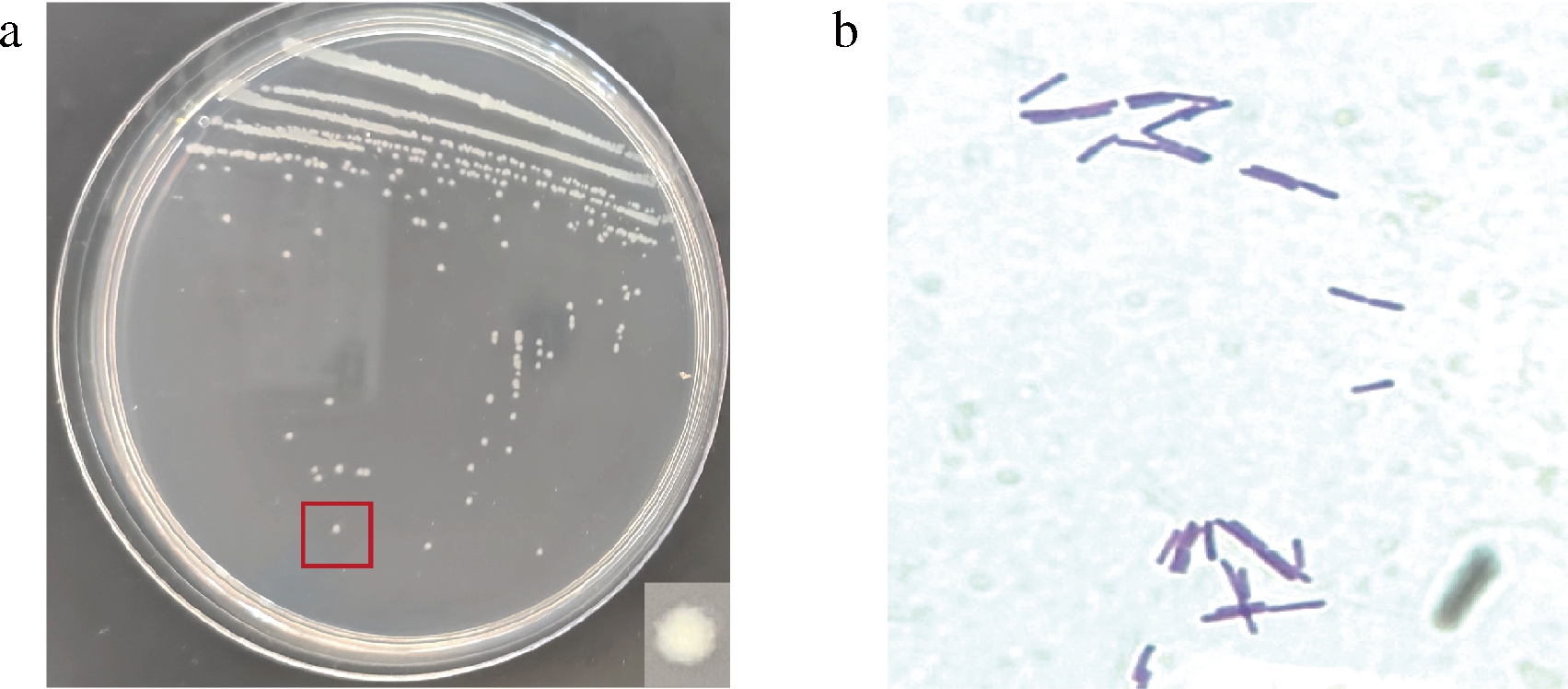
a-菌落形态;b-革兰氏染色(10×100)
图1 菌株HA2形态特征
Fig.1 Morphological characteristics of strain HA2
生化鉴定结果表明菌株HA2兼性厌氧生长,不耐受100 g/L NaCl,淀粉水解、V-P实验、接触酶实验、硝酸盐还原结果均呈阳性、苯丙氨酸脱氨酶、甲基红、水解明胶、丙酸盐和柠檬酸盐利用结果为阴性。菌株HA2可利用葡萄糖、甘露糖、半乳糖、蔗糖、麦芽糖,不能利用木糖、果糖。在糖醇发酵产酸实验中麦芽糖、蔗糖、甘露糖、阿拉伯糖、葡萄糖、甘露醇结果呈阳性,半乳糖、山梨糖、乳糖结果为阴性 (表4)。
表4 菌株HA2的生化实验
Table 4 Biochemical experiments with strain HA2
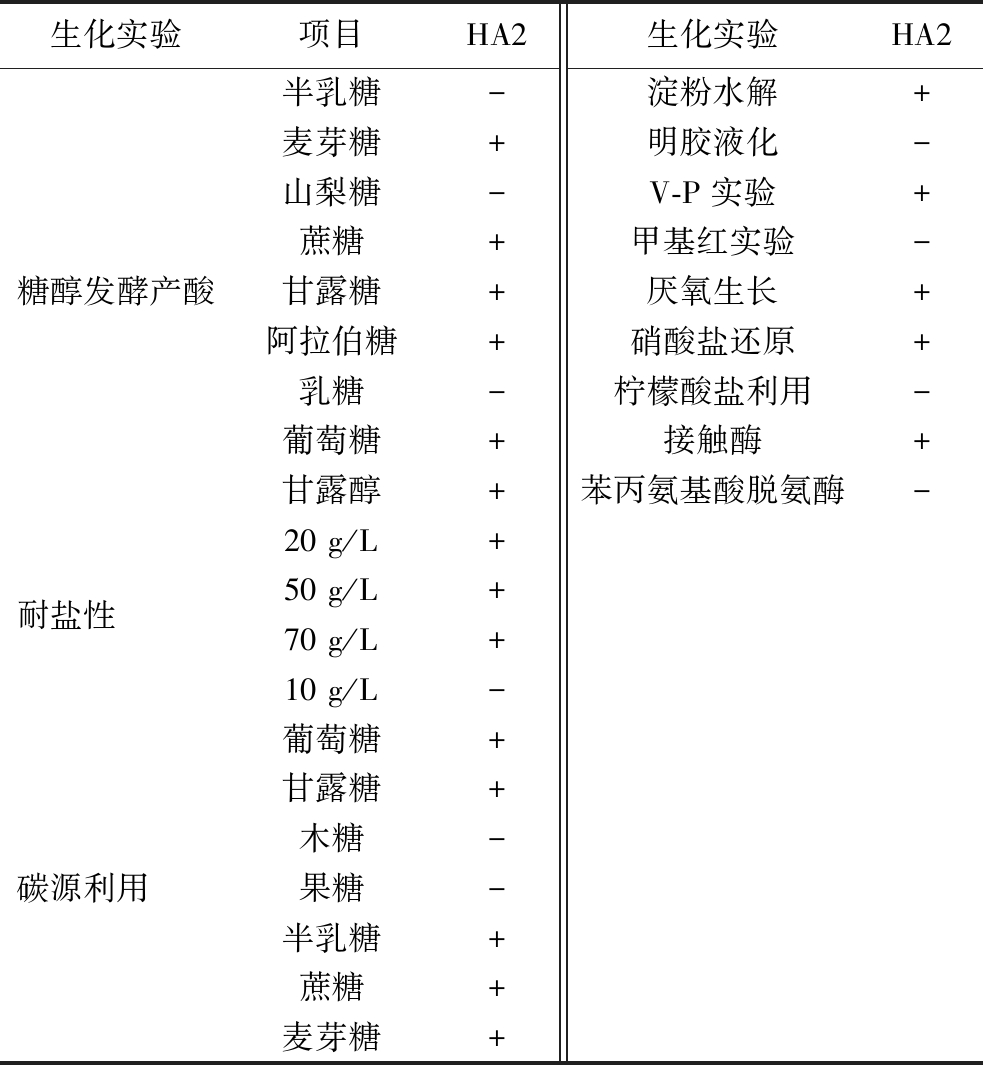
注:+表示阳性;-表示阴性。
生化实验项目HA2生化实验HA2糖醇发酵产酸半乳糖-淀粉水解+麦芽糖+明胶液化-山梨糖-V-P实验+蔗糖+甲基红实验-甘露糖+厌氧生长+阿拉伯糖+硝酸盐还原+乳糖-柠檬酸盐利用-葡萄糖+接触酶+甘露醇+苯丙氨基酸脱氨酶-耐盐性 20 g/L+50 g/L+70 g/L+10 g/L-碳源利用 葡萄糖+甘露糖+木糖-果糖-半乳糖+蔗糖+麦芽糖+
将菌株HA2的16S rDNA基因进行序列分析及相似度比对,构建系统发育树(图2)。菌株HA2(登录号为OQ430809)与海恩西芽孢杆菌(Bacillus haynesii)NRRL B-41327(登录号为NR_157609)在同一分支上,且相似性最高,达99.65%。结合形态学和菌株的生理生化特征,初步鉴定菌株HA2为海恩西芽孢杆菌。根据文献报道,芽孢杆菌可以产生多种抗菌物质,例如细菌素、抗菌脂肽、聚酮类物质等[18]。海恩西芽孢杆菌HA2过膜发酵上清液抑菌圈直径可达35 mm,抗菌效果显著,推测其可以产生至少一种以上的抑菌物质,具有一定的开发潜力。
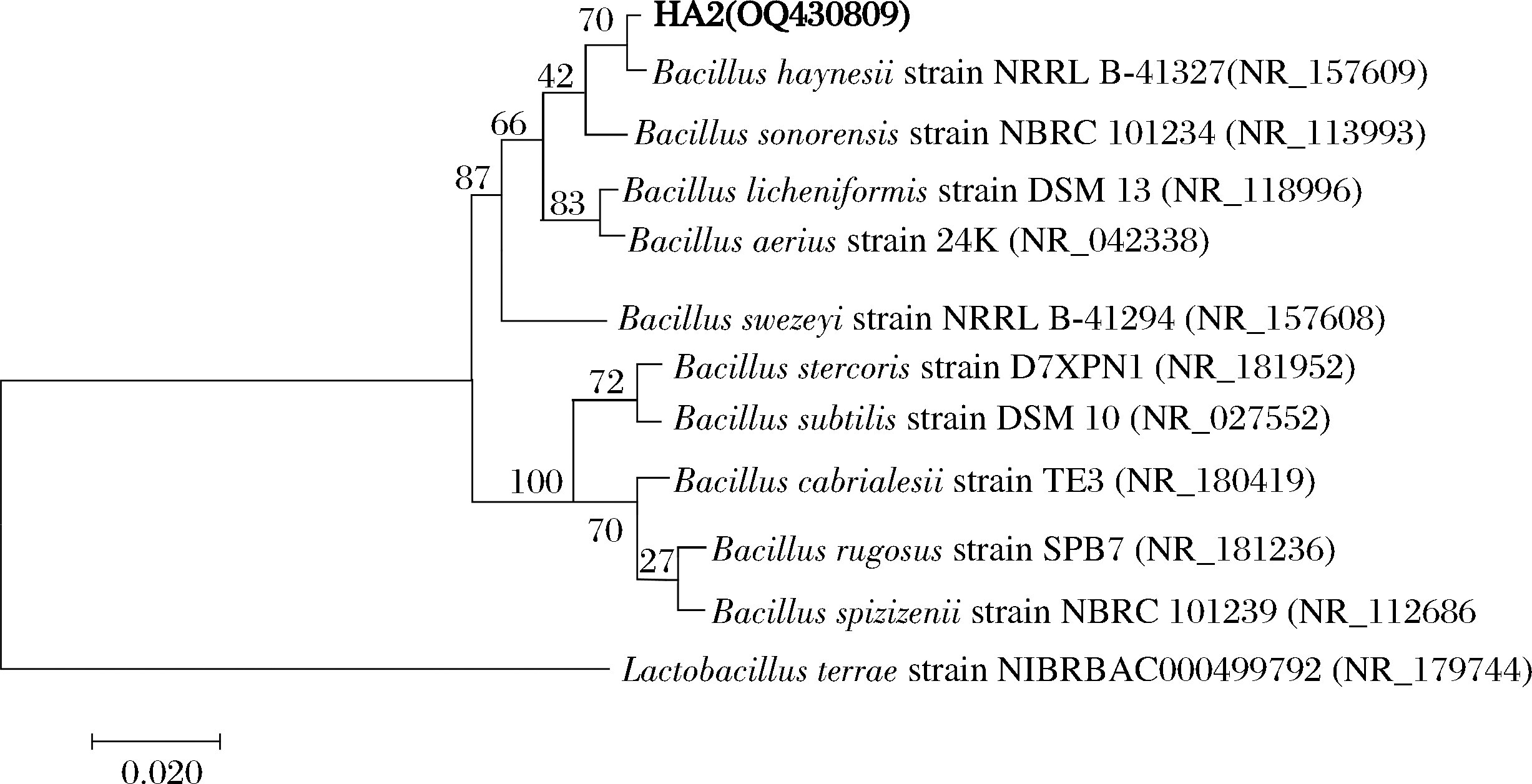
图2 菌株HA2基于16S rDNA序列构建的系统发育树
Fig.2 Phylogenetic tree of strain HA2 based on 16S rDNA sequences
注:分支处数值表示bootstrap值;括号内数值为GenBank登录号;标尺代表进化距离。
2.2 培养基优化
初始培养基筛选实验结果表明,以LB为初始培养基时抑菌圈直径最大,为28.50 mm。以LB为出发培养基,进行培养基成分优化。以酵母粉为对照,筛选不同的碳源。结果显示,最佳碳源为麦芽提取物。当质量浓度为15 g/L时,抑菌圈直径已达到最佳(图3-a、图3-b);在最佳碳源的基础上进行氮源种类优化,图3-c结果显示,最佳氮源为胰蛋白胨,当胰蛋白胨质量浓度为25 g/L时,抑菌圈直径最大,为38.75 mm(图3-d);在此基础上,进一步进行无机盐种类优化。结果显示,除Fe2(SO4)3·7H2O以外,其余无机盐均能被菌株HA2利用,其中CaCl2的拮抗促进作用最明显,质量浓度为5 g/L时,抑菌圈直径达到42.16 mm(图3-e、图3-f)。
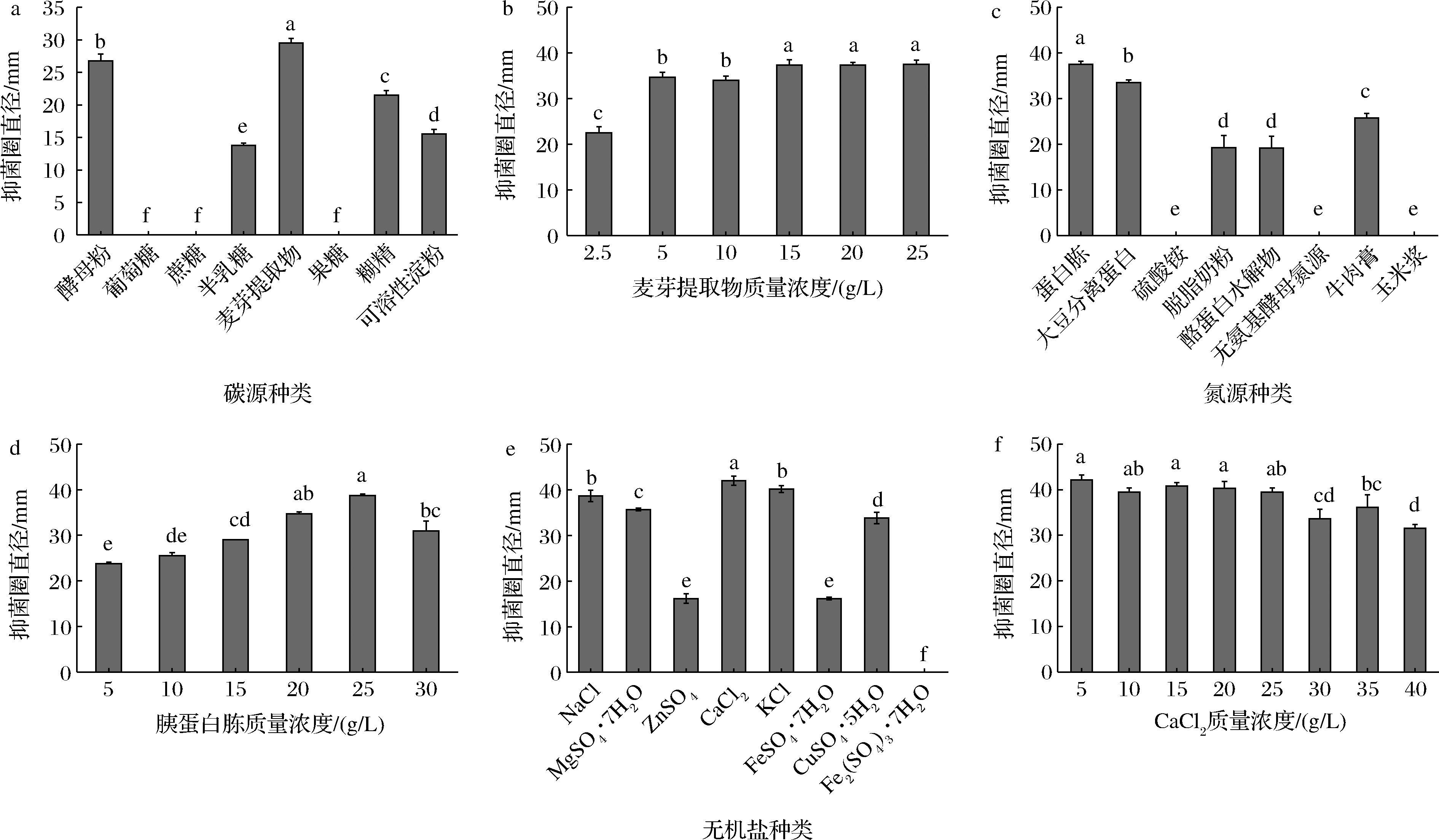
a-碳源种类;b-麦芽提取物浓度;c-氮源种类;d-胰蛋白胨浓度;e-无机盐种类;f-CaCl2浓度
图3 菌株HA2的培养基优化
Fig.3 Optimisation of the culture medium for strain HA2
注:不同的小写字母表示在P<0.05水平差异显著 (下同)。
正交优化试验结果显示,最佳培养基配方为A2B3C1,即麦芽提取物(15 g/L)、胰蛋白胨(30 g/L)和CaCl2(2.5 g/L),此时抑菌圈直径达到(43.33±1.15) mm。极差分析的结果显示,对菌株HA2抑菌活性的影响由大到小的顺序为B>A>C,因素B即胰蛋白胨浓度,对菌株HA2抑菌活性影响最为显著(表5)。
表5 正交优化试验结果
Table 5 Results of orthogonal optimization experiments
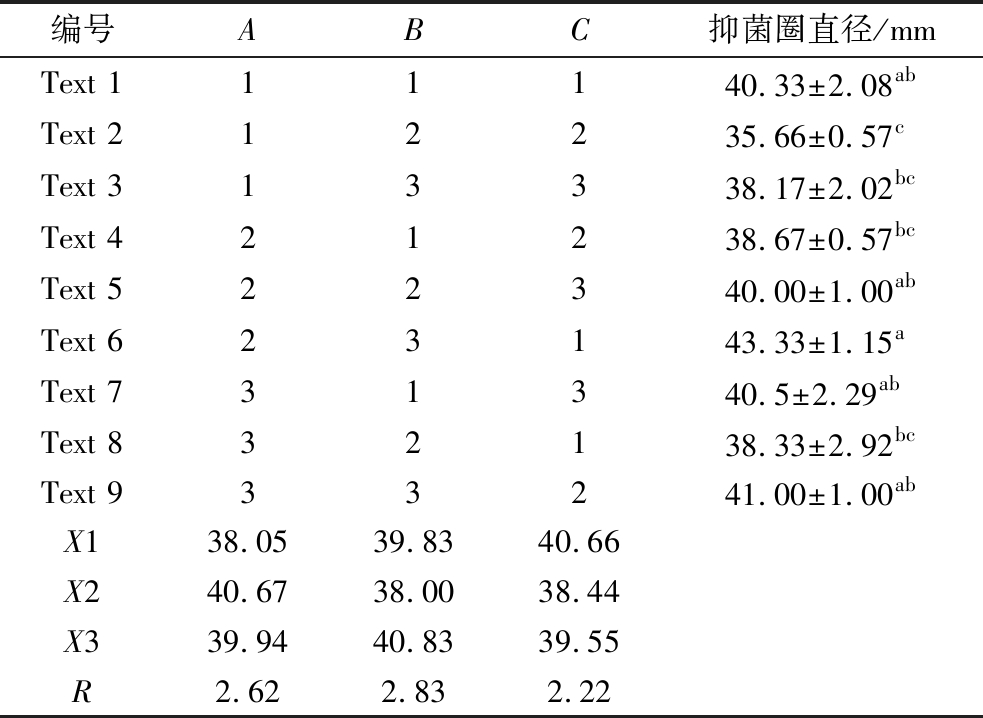
注:不同的小写字母表示在P<0.05水平差异显著。
编号ABC抑菌圈直径/mmText 111140.33±2.08abText 212235.66±0.57cText 313338.17±2.02bcText 421238.67±0.57bcText 522340.00±1.00abText 623143.33±1.15aText 731340.5±2.29abText 832138.33±2.92bcText 933241.00±1.00abX138.0539.8340.66X240.6738.0038.44X339.9440.8339.55R2.622.832.22
2.3 发酵条件优化
发酵优化是有效提高菌株抑菌活性的方式之一。叶云峰等[19]通过单因素试验和正交优化,将枯草芽孢杆菌(Bacillus subtilis) B47无菌滤液抑菌圈直径从15.23 mm提升至27.67 mm。高宇洁等[20]采用单因素试验和响应面分析法优化伯氏致病杆菌(Xenorhabdus bovienii)445培养条件,将抑菌效价提高39.16%。为此,本研究从5个方面(发酵时间、发酵温度、发酵液初始pH值、接种量、装液量)对菌株HA2发酵条件进行优化。如图4所示,菌株HA2在12 h时开始产生抑菌物质,并在72 h时达到最高,此时抑菌圈直径为48.33 mm(图4-a)。35 ℃培养时,HA2的无细胞发酵上清液抑菌活性最强(图4-b)。在pH值为5时,抑菌活性达到最大(图4-c),为最佳发酵液初始pH。在3%和9%的接种量的条件下,抗菌活性均达到最佳,考虑到实验成本,选择3%为最佳接种量(图4-d)。装液量为50%时最佳,抑菌圈直径达到50.00 mm(图4-e)。综上,菌株HA2的最佳发酵培养基为麦芽提取物15 g/L、胰蛋白胨30 g/L和CaCl2 2.5 g/L,最佳发酵条件为发酵温度35 ℃、发酵液初始pH 5、接种量3%、装液量50%和发酵时间72 h。
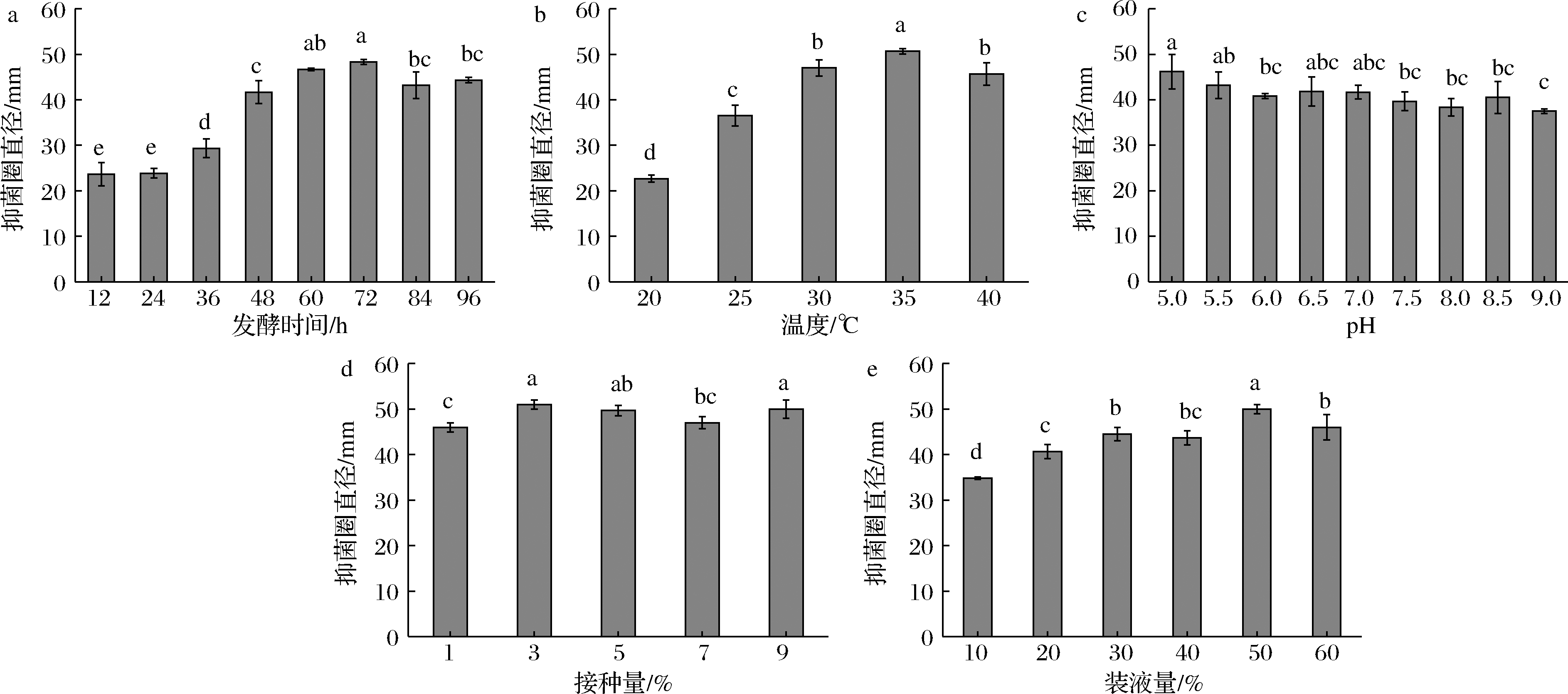
a-发酵时间;b-温度;c-pH;d-接种量;e-装液量
图4 菌株HA2的发酵条件优化
Fig.4 Optimization of fermentation conditions for strain HA2
2.4 发酵优化验证
四环素是痤疮丙酸杆菌常用抑制药物,根据不同浓度四环素溶液对痤疮丙酸杆菌抑菌活性的不同建立四环素效价曲线。图5-a结果显示,抑菌圈直径与四环素效价的方程为y=20.131x-48.718,R2达到0.993 9,效价曲线建立成功。对菌株HA2进行发酵优化验证,图5-b结果显示,优化后HA2菌株发酵过膜上清液抑菌圈直径(53 mm)大于优化前发酵过膜上清液抑菌圈直径(38 mm)。根据四环素效价曲线进行换算,优化前菌株HA2发酵过膜上清液效价为20 308.6 U,优化后效价为112 927.6 U,效价提升5.56倍。结果表明,优化后的发酵培养基组分和培养条件更加有利于菌株HA2合成抑菌物质。
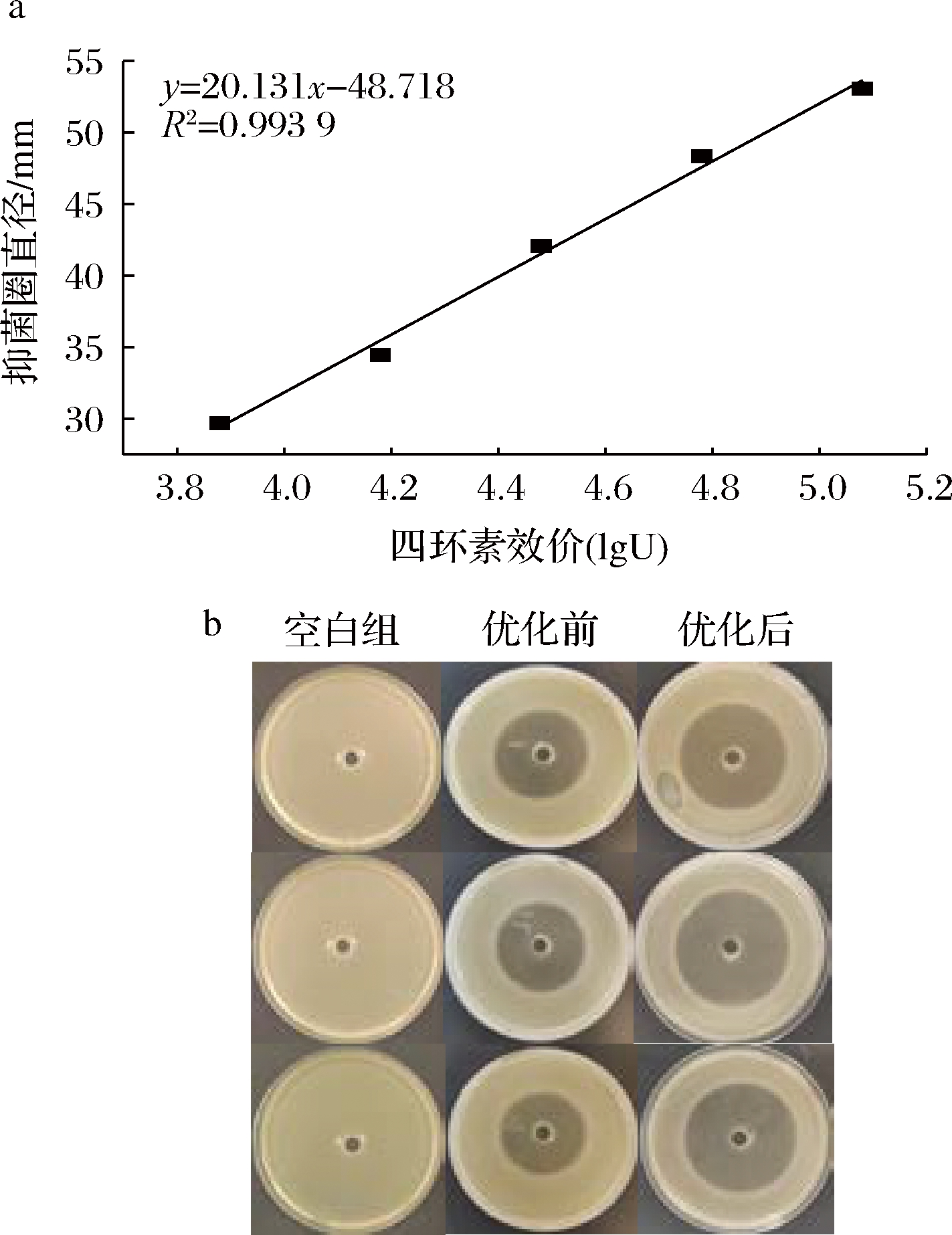
a-四环素效价曲线;b-发酵优化验证
图5 菌株HA2的发酵优化验证
Fig.5 Validation of the fermentation optimization of strain HA2
2.5 体外安全评价
2.5.1 菌株溶血性
溶血性是评价菌株安全性的重要指标之一。菌株溶血性结果如图6所示,阳性对照组的金黄色葡萄球菌ATCC 6538周围产生透明溶血环,为β-溶血。阴性对照组的植物乳杆菌D8和空白对照组的LB培养基无透明圈,为γ-溶血,即不溶血。菌株HA2菌落周围无透明圈,表明菌株HA2为γ-溶血,无溶血性。
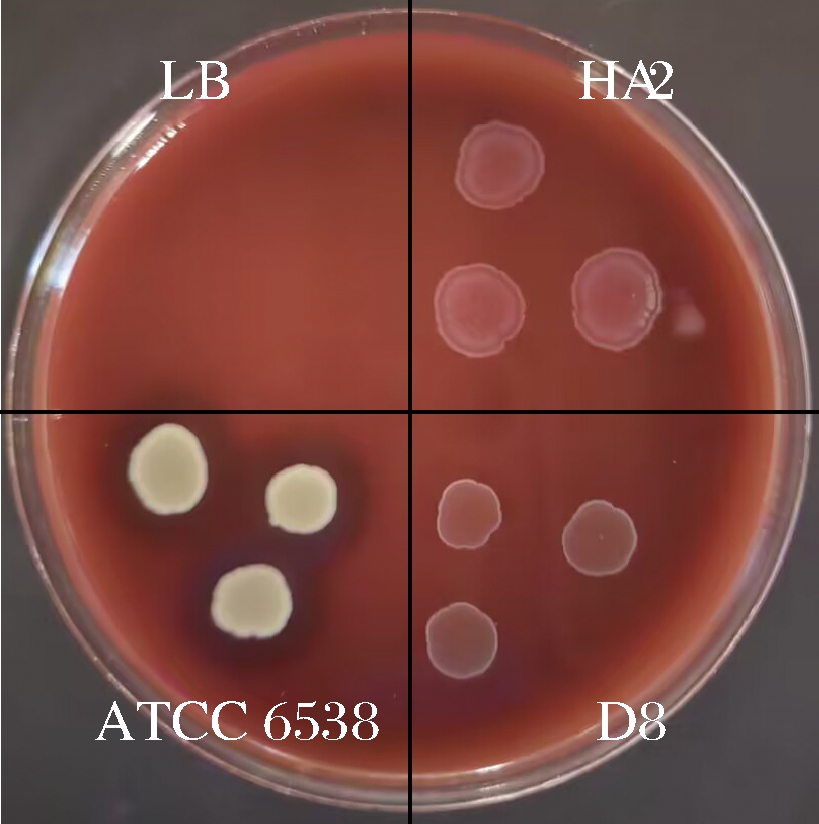
图6 菌株的溶血性检测
Fig.6 Haemolytic testing of strains
2.5.2 菌株耐药性
耐药性检测结果如表6所示,菌株HA2对大多数抗生素敏感,对氯霉素、卡那霉素、庆大霉素、强力霉素高度敏感,抑菌圈直径在20 mm以上;对氨苄青霉素和四环素中度敏感、抑菌圈直径在15~20 mm;对链霉素和红霉素耐药,抑菌圈直径在15 mm以下。
表6 耐药性测定结果
Table 6 Results of antimicrobial resistance determination

注:R表示抑菌圈直径在15 mm以下;++表示抑菌圈直径在15~20 mm;+++表示抑菌圈直径在20 mm以上。
抗生素药敏纸片浓度/(μg/片)抑菌圈直径/mm氯霉素30+++卡那霉素30+++链霉素10R氨苄青霉素10++庆大霉素10+++红霉素15R强力霉素30+++四环素30++
2.5.3 耐药质粒和耐药基因检测
耐药质粒检测结果如图7所示,菌株HA2的泳道3没有出现任何条带,表明菌株HA2无质粒存在(图7-a)。对菌株HA2所耐药的链霉素、红霉素的抗性基因进行检测,发现链霉素抗性基因str和红霉素抗性基因ermD/K1与ermD/K2在菌株HA2的基因组DNA上(图7-b)。

a-耐药质粒检测(M1-10 000 bp的DNA Marker;1-含有pESC-URA质粒的大肠杆菌;2-不含质粒的大肠杆菌;3-菌株HA2);b-耐药基因定位(M2-2 000 bp的DNA Marker;4-链霉素抗性基因str;5-红霉素抗性基因ermD/K1;6-红霉素抗性基因ermD/K2)
图7 菌株HA2的耐药质粒检测和耐药基因定位
Fig.7 Detection of drug-resistant plasmids and localization of drug-resistant genes in strain HA2
耐药性是目前临床所面临的重要难题之一。据报道,芽孢杆菌可通过质粒等移动元件的方式转移自身耐药基因,存在风险[21]。因此,对菌株进行质粒检测和耐药基因定位具有必要性。实验结果显示,菌株HA2虽然对链霉素和红霉素耐药,但菌株本身并不含有质粒,且链霉素的抗性基因str及红霉素抗性基因ermD/K1与ermD/K2位于菌株HA2的染色体上,保证了菌株HA2在耐药基因转移方面的低风险。
2.5.4 毒力基因的PCR检测
芽孢杆菌中是否携带毒力基因是判断菌株安全性的另一个重要方面。经检测,菌株HA2无常见毒力基因,包括溶血性肠毒素hbl(hblA、hblB、hblC、hblD)基因、非溶血性肠毒素nhe(nheA、nheB、nheC)基因、肠毒素T(bceT)基因、细胞毒素K(cytK)、和呕吐毒素(ces)等10种毒力基因(图8-a),阳性对照组的蜡样芽孢杆菌检测到nheC、hblD和cytK基因(图8-b)。在毒力基因方面,可初步判断菌株HA2较安全。

M-2 000 bp的DNA Marker;1-nheA;2-nheB;3-nheC;4-hblA;5-hblB;6-hblC;7-hblD;8-bceT;9-cytK;10-ces
a-菌株HA2;b-蜡样芽孢杆菌
图8 毒力基因的PCR检测
Fig.8 PCR detection of virulence genes
3 结论
本研究从酸菜样品中筛选到1株能高效拮抗痤疮丙酸杆菌的海恩西芽孢杆菌HA2,其过膜发酵上清液抑菌圈直径可达35 mm。通过培养基和培养条件的优化,菌株HA2过膜发酵上清液抑菌圈直径从38 mm提升至53 mm。根据四环素效价曲线进行换算,效价从20 308.6 U提升至112 927.6 U,提升5.56倍。确定了菌株HA2的最佳发酵条件:培养基为麦芽提取物15 g/L、胰蛋白胨30 g/L、CaCl2 2.5 g/L;培养条件为接种量3%、装液量50%、发酵液初始pH 5、发酵温度35 ℃和发酵时间72 h。从溶血性、耐药性和是否含有毒力基因三方面对菌株HA2进行体外安全评价。结果表明,菌株HA2不具有溶血性,耐药基因转移风险较低,无毒力基因。因此,可初步判断菌株HA2具有一定的生物安全性。菌株HA2能高效拮抗痤疮丙酸杆菌,并通过体外安全评价。因此,在痤疮治疗方面具有一定的应用前景。
[1] BURTON J L, CUNLIFFE W J, STAFFORD I, et al.The prevalence of acne vulgaris in adolescence[J].British Journal of Dermatology, 1971, 85(2):119-126.
[2] LAW M P M, CHUH A A T, LEE A, et al.Acne prevalence and beyond:Acne disability and its predictive factors among Chinese late adolescents in Hong Kong[J].Clinical and Experimental Dermatology, 2010, 35(1):16-21.
[3] ACHERMANN Y, GOLDSTEIN ELLIE J C, COENYE T, et al.Propionibacterium acnes:From commensal to opportunistic biofilm-Associated implant pathogen[J].Clinical Microbiology Reviews, 2014, 27(3):419-440.
[4] LIU P F, HSIEH Y D, LIN Y C, et al.Propionibacterium acnes in the pathogenesis and immunotherapy of acne vulgaris[J].Current Drug Metabolism, 2015, 16(4):245-254.
[5] DESSINIOTI C, KATSAMBAS A.Propionibacterium acnes and antimicrobial resistance in acne[J].Clinics in Dermatology, 2017, 35(2):163-167.
[6] GOLLNICK H P M.From new findings in acne pathogenesis to new approaches in treatment[J].Journal of the European Academy of Dermatology and Venereology, 2015, 29:1-7.
[7] VALLERAND I A, LEWINSON R T, FARRIS M S, et al.Efficacy and adverse events of oral isotretinoin for acne:A systematic review[J].The British Journal of Dermatology, 2018, 178(1):76-85.
[8] AGRAWAL S, ADHOLEYA A, BARROW C J, et al.In-vitro evaluation of marine derived fungi against Cutibacterium acnes[J].Anaerobe, 2018, 49:5-13.
[9] CHA H, KIM S K, KOOK M, et al.Lactobacillus paraplantarum THG-G10 as a potential anti-acne agent with anti-bacterial and anti-inflammatory activities[J].Anaerobe, 2020, 64:102243.
[10] O′NEILL A M, NAKATSUJI T, HAYACHI A, et al.Identification of a human skin commensal bacterium that selectively kills Cutibacterium acnes[J].Journal of Investigative Dermatology, 2020, 140(8):1619-1628.
[11] 赵林森, 贾晓蒙, 赵永娇, 等.乳酸菌在抑制痤疮丙酸杆菌中的应用及用其制成的护肤品:中国, CN110507598A[P]. 2019-11-29.
ZHAO L S, JIA X M, ZHAO Y J, et al.The use of lactic acid bacteria in the inhibition of Cutibacterium acnes and skin care products made from them:Chnia, CN110507598A[P]. 2019-11-29.
[12] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.
DONG X Z, CAI M Y.Common Bacterial System Identification Manual[M].Beijing:Science Press, 2001.
[13] 黄芷珊, 任红, 黄炜健, 等.糯米酒源贝莱斯芽孢杆菌的体外安全性评价[J].食品与发酵工业, 2022, 48(18):95-100.
HUANG Z S, REN H, HUANG W J, et al.In vitro safety evaluation of Bacillus velezensis from glutinous rice wine[J].Food and Fermentation Industries, 2022, 48(18):95-100.
[14] JOSEPH N M, SISTLA S, DUTTA T K, et al.Reliability of Kirby-Bauer disk diffusion method for detecting meropenem resistance among non-fermenting gram-negative bacilli[J].Indian Journal of Pathology and Microbiology, 2011, 54(3):556-560.
[15] 甘永琦, 汪辉, 陈向东, 等.克劳芽孢杆菌体外益生特性初步研究[J].药物生物技术, 2010, 17(4):321-325.
GAN Y Q, WANG H, CHEN X D, et al.Preliminary study on the probiotic characteristics of two strains of Bacillus Clausii in-vitro[J].Pharmaceutical Biotechnology, 2010, 17(4):321-325.
[16] ADIMPONG D B, SØRENSEN K I, THORSEN L, et al.Antimicrobial susceptibility of Bacillus strains isolated from primary starters for African traditional bread production and characterization of the bacitracin operon and bacitracin biosynthesis[J].Applied and Environmental Microbiology, 2012, 78(22):7903-7914.
[17] 刘纯, 方莹, 龙祝, 等.商用益生芽孢杆菌的安全性分析[J].中国畜牧杂志, 2020, 56(8):203-208.
LIU C, FANG Y, LONG Z, et al.Safety analysis of commercial probiotic Bacillus[J].Chinese Journal of Animal Science,2020, 56(8):203-208.
[18] CAULIER S, NANNAN C, GILLIS A, et al.Overview of the antimicrobial compounds produced by members of the Bacillus subtilis group[J].Frontiers in Microbiology, 2019, 10:302.
[19] 叶云峰, 黎起秦, 袁高庆, 等.枯草芽孢杆菌B47菌株高产抗菌物质的培养基及发酵条件优化[J].微生物学通报, 2011, 38(9):1339-1346.
YE Y F, LI Q Q, YUAN G Q, et al.Optimization of culture medium and fermentation conditions for high production of antimicrobial substance by Bacillus subtilis strain B47[J].Microbiology China, 2011, 38(9):1339-1346.
[20] 高宇洁, 詹发强, 陈澄, 等.黑曲霉拮抗菌Xenorhabdus bovienii 445筛选、鉴定及发酵优化[J].新疆农业科学, 2022, 59(5):1203-1215.
GAO Y J, ZHAN F Q, CHEN C, et al.Screening, identification and optimization of fermentation conditions of antagonistic Xenorhabdus bovienii 445 against Aspergillus niger[J].Xinjiang Agricultural Sciences, 2022, 59(5):1203-1215.
[21] DAI M H, LU J J, WANG Y L, et al.In vitro development and transfer of resistance to chlortetracycline in Bacillus subtilis[J].Journal of Microbiology, 2012, 50(5):807-812.