花椒,属于芸香科、花椒属,是一种落叶小乔木。其果实是一种重要的食品添加剂和中草药,尤其在川菜中具有独特的麻木味道,具有温中行气、逐寒、止痛、杀虫等功效[1-2]。近年来,花椒产业快速发展,种植面积已达50万hm2以上,产量已达10万t以上,是我国西南地区最主要的经济作物之一[3]。然而,花椒在种植过程中极易受到病虫害的侵袭,会导致产量和品质严重下降[4]。花椒生产上遇到的最大挑战为病虫害问题:主要病害如根腐病、锈病、溃疡病、黑茎腐病、果实黑腐病等,主要害虫如蚜虫和凤蝶等。
为了防治病虫害,人们会在花椒生长期间施用杀虫剂和杀菌剂等多种农药,这会导致花椒中农药残留的污染[2]。长期或短期食用受农药污染的食品可能对人类健康造成潜在危害,导致各种症状,如头痛、恶心、生殖功能下降、内分泌系统紊乱等[3]。因此,食品中的污染物含量是否超过相关机构设定的最大残留限量(maximum residue limit,MRL),已引起公众和科学界的关注。遗憾的是,国内外明确的花椒农药残留MRL标准甚少。在我国,花椒上只登记了2种农药,分别是40%环丙唑悬浮剂和40%丙环唑水乳剂。目前,人们对杀虫剂、杀菌剂等农药在花椒上残留消解状况及其膳食风险的报道甚少:ZHOU等[5]开展了花椒四地田间试验,以QuEChERS结合超高效液色谱-二级质谱分别测定干、鲜花椒中吡虫啉及其5种代谢物残留量,并进行了膳食风险评估;唐光辉等[6]研究了树干注药后戊唑醇在花椒树不同组织中的分布残留动态;范金平等[7]开展了烯效唑在冷冻条件下花椒贮藏稳定性研究;杨双昱等[8]评价戊唑醇、肟菌酯和吡唑醚菌酯3种杀菌剂在青花椒中的残留消解行为。
作为一种高效杀菌剂,60%百泰水分散粒剂是德国巴斯夫公司研制的新型复配杀菌剂,有效成分为5%吡唑醚菌酯和55%代森联,可有效防治真菌性病害,并且对非靶标生物和环境安全,为果蔬、油料作物等农作物的品质和产量都起着积极的作用。国内外陆续报道了百泰在葡萄[9]、苹果[10]、柑桔[11]、荔枝[12]、花生[13]、棉花[14]等上的使用状况,但未报道在花椒等香辛料中的使用现状和残留现状。而在GB 2763—2021食品安全国家标准食品中农药最大残留限量中,仅制定了部分香辛料中的MRL(香辛料允许使用的灭菌剂如毒菌酚MRL为0.01 mg/kg、乐杀螨MRL为0.05 mg/kg、氯苯甲醚MRL为0.05 mg/kg和乙烯菌核利MRL为0.05 mg/kg,代森联在胡椒、茴香和豆蔻中MRL均为0.1 mg/kg),但花椒中代森联和香辛料中吡唑醚菌酯的MRL尚无明确标准。此外国外已评估了百泰的遗传毒性,结果表明百泰能够损伤DNA,并毒害细胞[15]。因此有必要通过田间试验,探明百泰在花椒上的残留消解规律,并探讨其可能产生的膳食健康风险,为制定其在花椒中的MRL提供数据支撑。
本研究以花椒为对象,采用超高效液相色谱-串联质谱法和气相色谱-火焰光度检测器(gas chromatography coupled with flame photometric detector, GC-FPD)检测技术,分析了代森联和吡唑醚菌酯在花椒中的消解与残留分布,并对其可能产生的人群膳食风险进行评估,以期为我国花椒安全生产、监测和消费引导提供重要的技术依据和参考。
1 材料与方法
1.1 材料与试剂
代森联(纯度≥75%),上海源叶生物科技有限公司;二硫化碳(纯度≥99%)、甲酸(色谱纯)和氯化亚锡二水合物(分析纯),上海麦克林生化科技有限公司;吡唑醚菌酯(纯度≥98%)和乙撑硫脲(ethylene thiourea, ETU)(纯度≥99.5%),德国Dr.Ehrenstorfer GmbH公司;乙腈、甲醇和正己烷(色谱纯),美国Sigma-Aldrich公司;抗坏血酸(分析纯),上海国药化学试剂有限公司;无水硫酸镁和氯化钠(均为分析纯),江苏强盛化工有限公司;盐酸(分析纯),重庆川东化工有限公司;氨水(分析纯)、乙二胺基-N-丙基(40~63 μm,6 nm)和石墨化碳黑(120~400目),上海安谱科学仪器有限公司;60%代森联·吡唑醚菌酯水分散粒剂,上海悦联化工有限公司。
1.2 仪器与设备
Agilent 7890B气相色谱仪,配FPD 检测器(含硫滤光片)、DB-1(30 m×0.25 mm×1.0 μm)气相色谱柱、Agilent 1290-6495A液相色谱串联质谱仪,美国Agilent公司;Acquity UPLC BEH C18超液相色谱柱(2.1 mm×10 cm,1.7 μm),美国Waters公司;CL31/CL31R冷冻离心机,美国Thermo Fisher公司;CK2000高通量研磨仪,北京托摩根公司;Milli-Q 超纯水器,美国Millipore公司;THZ-C恒温振荡器,苏州培英实验设备有限公司;有机相针式滤器(0.22 μm),上海安谱科学仪器有限公司。
1.3 实验方法
1.3.1 田间试验和样品采集
花椒于2020年4~5月在重庆市江津区(消解和终残)、重庆市忠县(消解和终残)、山东省济南市(终残)、四川省资阳市(终残)四地采集。施药方法:60%吡唑醚菌酯·代森联水分散粒剂于花椒叶斑病发生初期喷雾施药,推荐施药剂量400~800 mg a.i./kg(稀释倍数750~1 500倍),用水量1 500~2 250 L/hm2;施药次数:2~3次;施药间隔7~10 d,安全间隔期:14 d。施药器具:背负式电动喷雾器。
最终残留量试验设置4个试验点。每个试验点设1个处理小区,小区面积50 m2(约6~8棵花椒树),以800 mg a.i./kg(750倍稀释液)的有效剂量,用水量为2.5 L/棵树(即处理小区每次施药称取26.67 g 60%吡唑醚菌酯·代森联水分散粒剂,用20 L水勾兑配制而成),于花椒成熟前28 d进行第一次施药,分别间隔7 d再进行第2次、第3次施药。每个试验点在末次施药后间隔14、21 d分别采集,每小区每次均采集2个独立样品。对照区:另外设置,不施药。采集处理小区时,应同时采集对照小区。
残留消解试验设置2个试验点。在最终残留试验小区中开展,无需额外设置小区。每个试验点在末次施药后间隔2 h、7 d和28 d分别采集,每小区每次均采集2个独立样品。对照区:另外设置,不施药。第一次和最后一次采集时,应同时采集对照小区。
样品采集:应戴一次性手套,先采对照区,再采集处理小区。按设计方案要求,采用随机法在树的不同方向及上、下、中、外、里、向阳和背阴面等不同部位采集不少于2 kg无明显病害、正常生长、成熟的果实样品,装入容器中,包扎妥当,容器内外各加上标签。处理小区需分2次采集2个独立样品。样品运输:采集后在8 h内进行处理,并冷冻保存。样品在冷冻状态下运输,并记录运输过程中的温度。
将田间采集的花椒的每个独立样品在实验室内均分别制备鲜花椒150 g样品2份、干花椒150 g样品2份,分别装入封口袋中,贴好标签,-18 ℃低温保存。干花椒制备,参照相关标准GH/T 1289—2020 干花椒流通规范和GB/T 30391—2013 花椒。
1.3.2 样品前处理
1.3.2.1 代森联的样品前处理
代森联样品前处理采用衍生方法,在加热的密闭顶空瓶中,样品中代森联遇氯化亚锡盐酸溶液反应生成的二硫化碳气体被瓶中的正已烷吸收,形成二硫化碳的正已烷溶液,GC-FPD测定有机相中的二硫化碳的量,用二硫化碳定量代森联的含量。
具体步骤参考相关文献[16-17],并做了一定改进,如下:称取样品10.00 g(精确到0.01 g)于100 mL顶空瓶中,加入50 mg抗坏血酸、40 mL氯化亚锡盐酸溶液、10.00 mL水、10.00 mL正已烷,迅速将瓶口密封,放入恒温振荡器中85 ℃下2 h,时间到后拿出冷却至室温,吸取上层有机相,0.22 μm有机相滤头过滤,经GC-FPD测定。
1.3.2.2 吡唑醚菌酯和ETU的样品前处理
吡唑醚菌酯和ETU样品前处理采用优化的QuEChERS法提取净化,液相色谱-三重四极杆质谱联用仪检测。
具体步骤如下:准确称取2 g(精确到0.01 g)样品于50 mL离心管中,加入20.00 mL 1%(体积分数)氨水乙腈和2.00 mL去离子水,于高通量组织研磨仪上以1 000 r/min振荡提取10 min;加入2.0 g无水硫酸镁和0.5 g NaCl,振荡2 min;10 000 r/min离心5 min,吸取1.00 mL上清液于含有50 mg乙二胺基-N-丙基、30 mg石墨化磷黑的离心管中,再加入1.00 mL乙腈稀释,涡旋2 min;3 000 r/min离心5 min,取上清液过0.22 μm有机滤膜,待测。
1.3.3 标准工作液的配制
二硫化碳的标准母液:25 mL容量瓶中加入5 mL正已烷,向其中加入25.00 mg二硫化碳,用正已烷定容至刻度,即为1 000 mg/L的母液,于-50 ℃避光保存。
二硫化碳的标准工作溶液:用正己烷将标准母液逐级稀释配成30、20、10、5、2、1、0.5、0.2、0.1 mg/L系列标准溶液,测试前现配。
吡唑醚菌酯和ETU的标准母液:分别称取吡唑醚菌酯和ETU标准品10.00 mg于10 mL棕色容量瓶中,用乙腈定容,摇匀,配制成1 000 mg/L标准母液,转移到带盖棕色试剂瓶中,置于-50 ℃超低温冰箱中待用。
吡唑醚菌酯和ETU的标准工作溶液:各取1 mL 1 000 mg/L吡唑醚菌酯和ETU标准母液,乙腈定容至10 mL,配制成100 mg/L的混合标准溶液,用花椒基质空白将混合标准溶液逐级稀释配成1、0.5、0.1、0.05、0.01、0.005、0.002 mg/L系列标准溶液,测试前现配。
1.3.4 仪器条件
1.3.4.1 气相条件
色谱柱:DB-1(30 m×0.25 mm×1.0 μm);流速:0.8 mL/min;柱温:50 ℃(1 min),以20 ℃/min升温至120 ℃(1 min);进样口温度:120 ℃;检测器:200 ℃,载气:氮气,30 mL/min;空气:60 mL/min;氢气:50 mL/min;进样量:1 μL。
1.3.4.2 高效液相色谱-串联质谱条件
色谱柱:Acquity UPLC BEH C18(2.1 mm×10 cm),1.7 μm;柱温:40 ℃;进样量:1 μL;流动相A:0.1%(体积分数)甲酸水溶液;流动相B:乙腈;流速:0.25 mL/min。梯度洗脱条件见表1。
表1 流动相梯度洗脱
Table 1 Gradient elution of mobile phase

时间/min流动相A流动相B—9550.209552.0010903.0010904.009556.00955
离子源:AJS-ESI+;扫描方式:MRM模式;干燥气温度:250 ℃;干燥气流速:14 L/min;氮气压力:30 psi;鞘气温度:375 ℃;鞘气流速:12 L/min;毛细管电压:4 000 V;喷嘴电压:500 V。MRM质谱条件见表2。
表2 MRM监测条件参数
Table 2 Monitoring condition parameters of MRM
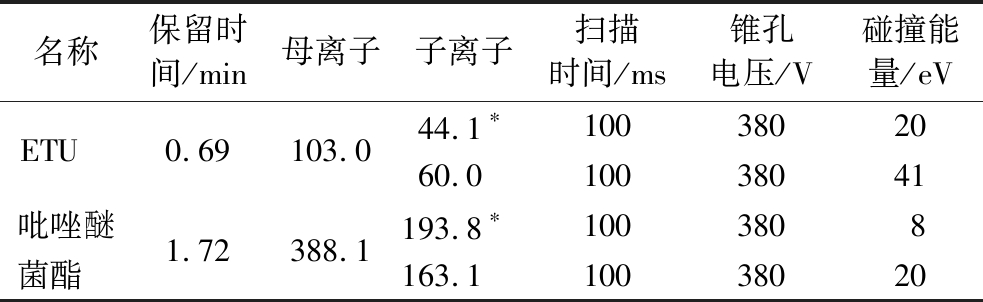
注:标*为定量离子。
名称保留时间/min母离子子离子扫描时间/ms锥孔电压/V碰撞能量/eVETU 0.69103.044.1∗1003802060.010038041吡唑醚1.72388.1193.8∗1003808菌酯 163.110038020
1.3.5 定性和定量方法
代森联测定采用GC-FPD进行定性定量,其中代森联的衍生物二硫化碳定性采用其相对保留时间,定量采用代森联的衍生物二硫化碳标准曲线法。用二硫化碳的含量[ω(二硫化碳)]定量代森联的含量,单位以毫克每千克(mg/kg)表示,按公式(1)计算:
ω(代森联)=1.79×ω(二硫化碳)
(1)
式中:ω(代森联),代森联质量浓度,mg/kg;ω(二氧化硫),二氧化硫质量浓度,mg/kg。
吡唑醚菌酯和ETU采用液相色谱-三重四级杆串联质谱仪进行定性定量,如表2所示。根据《农药登记残留试验待测残留物和植物源性食品膳食风险评估残留物目录(2021版)》的要求,代森联与ETU的残留量之和计算如公式(2)所示:
总残留量=ω(代森联)+7.5×ω(ETU)
(2)
式中:ω(代森联),代森联质量浓度,mg/kg;ω(ETU),ETU质量浓度,mg/kg。
当代森联或ETU质量浓度小于其定量限(limits of quantitation,LOQ)时,以LOQ计算总残留量。
1.3.6 降解动态方程
按照一级反应动力学方程拟合代森联和吡唑醚菌酯在花椒中的残留降解动态,消解系数K通过公式(3)计算,半衰期通过公式(4)计算:
CT=C0e-KT
(3)
T1/2=ln(2/K)
(4)
式中:CT,T时间目标农药的残留浓度(mg/kg);C0,施药后目标农药的初始沉积量(mg/kg);K,消解系数;T1/2,降解半衰期,d;T,施药后时间,d。
1.3.7 加工因子
采用加工因子(processing factor,PF)表示鲜花椒加工成干花椒过程对农药残留的影响,其计算如公式(5)所示:
加工因子=干花椒中的农药残留量/鲜花椒中的农药残留量
(5)
1.3.8 膳食评估
根据WHO规定的方法,花椒中农药残留慢性膳食风险(chronic risk quotient,RQc)按公式(6)和公式(7)计算,急性膳食风险(acute risk quotient,RQa)按公式(8)和公式(9)计算,风险值<1时,健康风险在可接受范围内;而风险值>1时,存在不可接受的健康风险。
NEDI=(STMR×F)/bw
(6)
RQc=NEDI/ADI
(7)
NESTI=(LP×HR)/bw
(8)
RQa=NESTI/ARfD
(9)
式中:NEDI,每日估计摄入量(the national estimated daily intake), mg/kg bw/d;STMR,农药残留试验中值(the supervised trials median residue), mg/kg;F,花椒人均消费量(the average fruit consumption), kg/d;bw,人群体重(the average body weight), kg;ADI,每日允许摄入量(the acceptable daily intake of pesticide), mg/(kg bw·d);NESTI,短期估计摄入量(the national estimated short term intake), mg/(kg bw·d);LP, 花椒消费大份餐(the large portion), kg/d;HR,最终残留试验得到的最高残留浓度(the highest residue in available samples), mg/kg;ARfD,急性参考剂量(the acute reference dose of pesticide), mg/(kg bw·d)。代森联的ADI为0.03 mg/(kg bw·d),吡唑醚菌酯的ADI和ARfD分别为0.03和0.05 mg/(kg bw·d)[18]。
2 结果与分析
2.1 方法验证
二硫化碳的标准色谱图见图1-A,ETU和吡唑醚菌酯的总离子色谱图见图1-B。
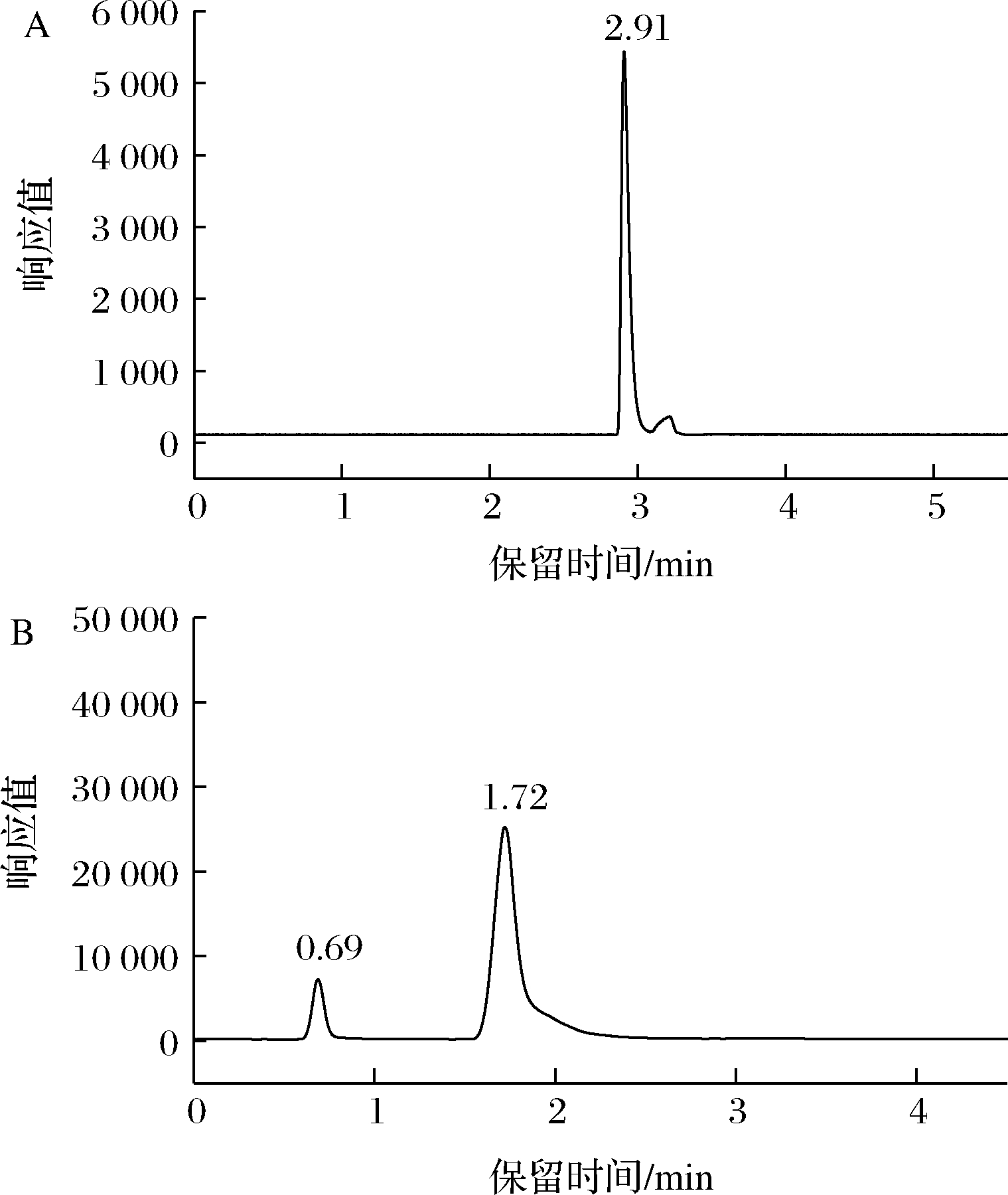
A-二硫化碳;B-ETU和吡唑醚菌酯
图1 二硫化碳的标准色谱图和ETU、吡唑醚菌酯的总离子色谱图
Fig.1 Standard chromatogram for CS2 and total ion chromatogram for the mixed standard solution of ETU and pyraclostrobin
注:二硫化碳的质量浓度为5 mg/L,ETU和吡唑醚菌酯在鲜花椒基质中,浓度为0.1 mg/L。
二硫化碳的峰面积Y对数与其质量浓度X(0.1~30 mg/L)对数呈现正相关,决定系数(R2)为0.997 2,标准曲线方程为:lgY=2.317 4×lgX+2.771 2,这与文献吻合[22]。鲜花椒、干花椒均不存在较强的基质效应,因此样品检测采用正己烷配标定量。
吡唑醚菌酯和ETU的峰面积Y均与其质量浓度X(0.002~1 mg/L)呈现正相关,标准曲线方程分别为:吡唑醚菌酯:鲜花椒Y=1 583 872.991 3X-3 374.619 9,R2=0.999 9,干花椒Y=747 048.453 9X-3 102.174 2,R2=0.999 7;ETU:鲜花椒Y=295 622.614 4X+44.255 6,R2=0.999 9,干花椒Y=165 530.301 7X-1 578.354 8,R2=0.996 7。可以看出,标准曲线相关性良好,决定系数均在0.996以上。
分别在空白鲜花椒、干花椒中添加4档质量浓度的代森联标准溶液,3档质量浓度的吡唑醚菌酯和ETU混合标准溶液,每档加标质量浓度水平均重复5次,结果见表3。代森联回收率为85.5%~106.7%,RSD为1.0%~4.2%;ETU回收率为81.2%~93.1%,RSD为1.6%~9.5%;吡唑醚菌酯回收率为83.4%~91.3%,RSD为2.3%~4.6%。
表3 代森联、ETU和吡唑醚菌酯添加回收率结果
Table 3 Recoveries for metiram, ETU and pyraclostrobin

注:-表示无数据(下同)。
基质代森联ETU吡唑醚菌酯加标水平/(mg/kg)平均回收率/%RSD/%加标水平/(mg/kg)平均回收率/%RSD/%加标水平/(mg/kg)平均回收率/%RSD/%鲜花椒0.0588.63.5------0.5102.62.50.0593.06.50.0586.02.65102.32.2189.05.3189.12.350103.24.21093.13.11091.34.0干花椒0.0585.52.8------0.5107.31.00.0582.39.50.0587.33.95106.11.6189.95.6183.42.650106.72.11081.21.61089.04.6
代森联、ETU和吡唑醚菌酯在鲜花椒、干花椒中的定量限均为0.05 mg/kg。
由上可见,采用的方法具有良好的准确度和精密度,根据农作物中农药残留试验准则(NY/T 788—2018),可满足所选农药残留检测分析要求。
2.2 降解动态曲线
施药2 h后,吡唑醚菌酯在2个产地鲜花椒上的初始沉积量为3.96~5.80 mg/kg,在干花椒上的初始沉积量为8.97~9.20 mg/kg(图2)。施药28 d时,吡唑醚菌酯在鲜花椒中的消解率可达94.1%~96.9%,在干花椒中的消解率可达97.3%~97.5%。消解规律均符合一级动力学方程,消解曲线决定系数(R2)为0.840 7~0.992 2,指数关系良好。吡唑醚菌酯在鲜花椒中的半衰期为5.59~6.93 d,在干花椒中的半衰期为5.87~6.13 d。
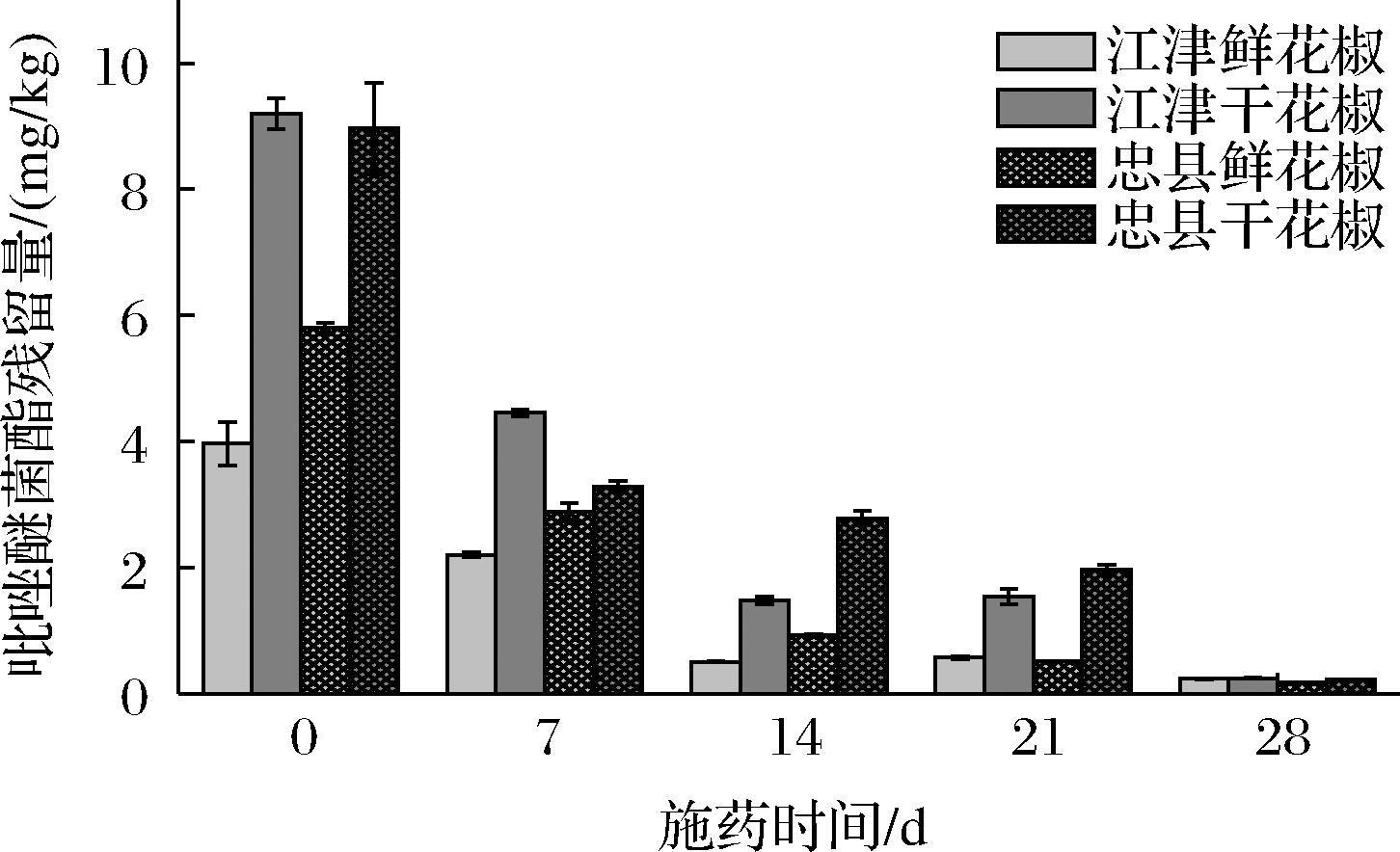
图2 吡唑醚菌酯在花椒中的残留消解变化
Fig.2 Dissipation for pyraclostrobin during the growth and development of prickly ash
施药2 h后,代森联、ETU在2个产地鲜花椒上的初始沉积量分别为15.44~32.68 mg/kg和2.87~8.03 mg/kg,在干花椒上的初始沉积量分别为6.88~18.16、2.26~4.77 mg/kg(图3)。施药28 d时,代森联在鲜花椒中的消解率分别可达95.3%~97.7%,在干花椒中的消解率分别可达92.4%~96.2%。代森联消解规律均符合一级动力学方程,消解曲线决定系数(R2)为0.916 0~0.993 8,指数关系良好。代森联在鲜花椒中的半衰期为5.10~6.86 d,在干花椒中的半衰期为5.63~7.37 d。可见,代森联和吡唑醚菌酯在花椒上的消解速度都比较快。

A-鲜花椒重庆市江津区;B-干花椒重庆市江津区;C-鲜花椒重庆市忠县;D-干花椒重庆市忠县
图3 代森联、ETU及总残留量在花椒中的变化规律
Fig.3 Dissipation for metiram, ETU and total residue during the growth and development of prickly ash
2.3 最终残留
表4显示,14 d鲜花椒中代森联、吡唑醚菌酯残留量分别为4.31~11.33 mg/kg、0.25~0.94 mg/kg,干花椒中代森联、吡唑醚菌酯残留量分别为2.17~9.09 mg/kg、0.30~2.86 mg/kg;21 d鲜花椒中代森联、吡唑醚菌酯残留量分别为2.29~4.41 mg/kg、0.11~0.59 mg/kg,干花椒中代森联、吡唑醚菌酯残留量分别为1.87~3.63 mg/kg、0.21~2.02 mg/kg。
表4 代森联和吡唑醚菌酯在花椒上的最终残留量
Table 4 Final residues of metiram and pyraclostrobin in prickly ash
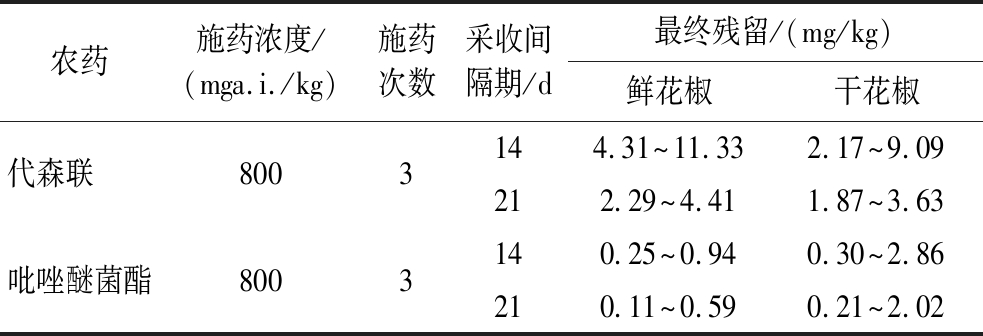
农药施药浓度/(mga.i./kg)施药次数采收间隔期/d最终残留/(mg/kg)鲜花椒干花椒代森联 8003144.31^11.332.17^9.09212.29^4.411.87^3.63吡唑醚菌酯8003140.25^0.940.30^2.86210.11^0.590.21^2.02
2.4 加工因子
由表5可知,干花椒中代森联的残留量均低于鲜花椒中的残留量,加工因子均小于1(0.47~0.83),而干花椒中吡唑醚菌酯的残留量均高于鲜花椒中的残留量,加工因子均大于等于1(1.00~3.86)。加工后能显著降低代森联在干花椒中的残留,而吡唑醚菌酯在干花椒中发生了显著的富集效应。
表5 代森联、吡唑醚菌酯在花椒中的加工因子
Table 5 Processing factor of metiram and pyraclostrobin in prickly ash
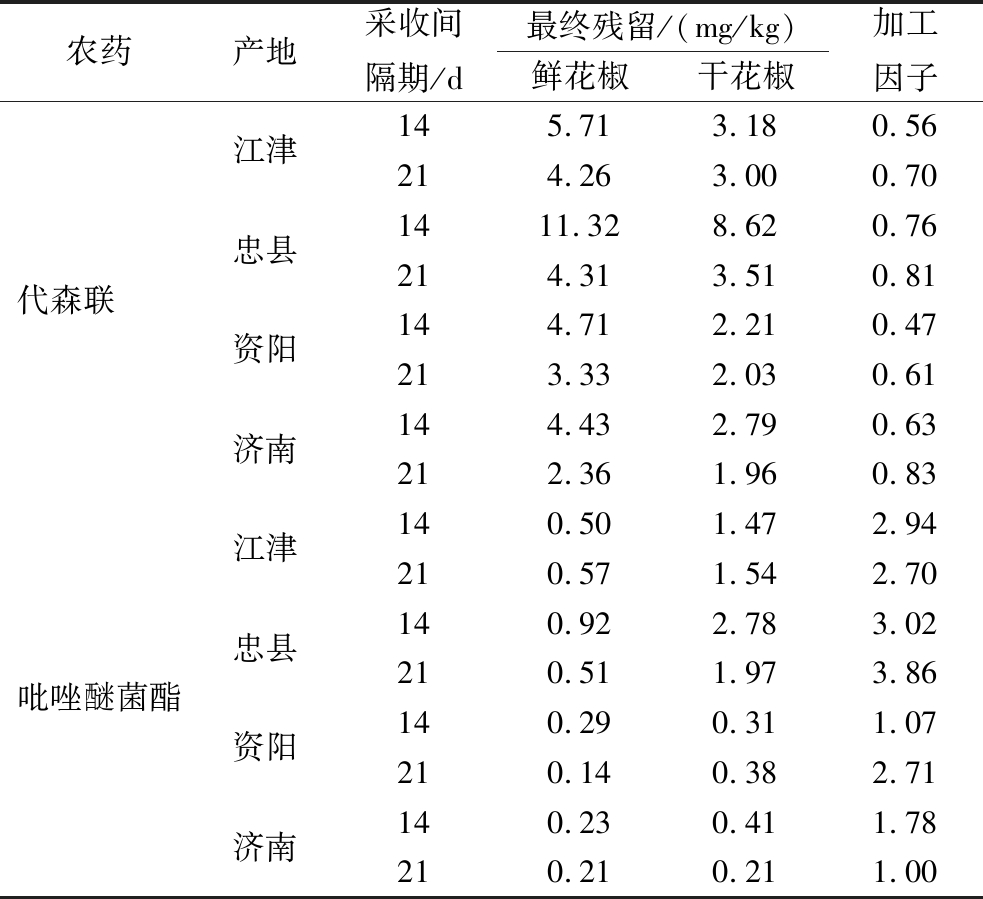
农药产地采收间隔期/d最终残留/(mg/kg)鲜花椒干花椒加工因子代森联 江津忠县资阳济南145.71 3.18 0.56 214.26 3.00 0.70 1411.32 8.62 0.76 214.31 3.51 0.81 144.712.21 0.47 213.332.03 0.61 144.432.79 0.63 212.361.96 0.83 吡唑醚菌酯江津忠县资阳济南140.50 1.472.94 210.57 1.54 2.70 140.92 2.78 3.02 210.51 1.97 3.86 140.29 0.31 1.07 210.14 0.38 2.71 140.23 0.41 1.78 210.21 0.21 1.00
2.5 膳食评估
膳食暴露风险评估是农产品质量安全评估的重要组成部分,也是衡量产品安全性的手段之一。由表6可知,慢性和急性暴露风险值随安全间隔期延长而降低,均低于安全界限1。慢性暴露风险表现为代森联>吡唑醚菌酯,吡唑醚菌酯的分布范围为0.000 26~0.000 67,代森联的分布范围为0.001 8~0.003 8;急性暴露风险,吡唑醚菌酯的分布范围为0.000 37~0.001 8。由于代森联缺乏ARfD值,故暂不考虑其急性暴露风险。与加工因子相似,对代森联而言,鲜花椒的慢性暴露风险>干花椒的慢性暴露风险;对吡唑醚菌酯而言,干花椒的慢性暴露风险>鲜花椒的慢性暴露风险,干花椒的急性暴露风险>鲜花椒的急性暴露风险。因此,按照良好农业规范在花椒上施用代森联·吡唑醚菌酯农药后,间隔14、21 d,花椒中代森联和吡唑醚菌酯的急性和慢性膳食暴露风险均在可接受范围内。
表6 代森联和吡唑醚菌酯残留对我国消费者的慢性和急性膳食风险
Table 6 The chronic and acute dietary risk assessment of metiram and pyraclostrobin for Chinese consumers
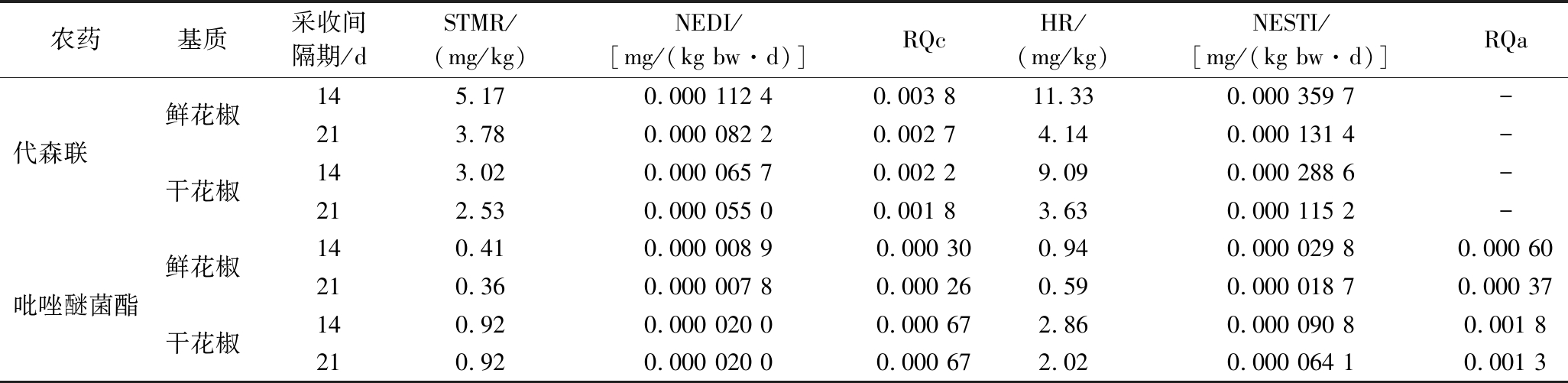
农药基质采收间隔期/dSTMR/(mg/kg)NEDI/[mg/(kg bw·d)]RQcHR/(mg/kg)NESTI/[mg/(kg bw·d)]RQa代森联 鲜花椒干花椒145.170.000 112 4 0.003 8 11.330.000 359 7 -213.780.000 082 2 0.002 74.140.000 131 4 -143.020.000 065 7 0.002 2 9.090.000 288 6 -212.530.000 055 0 0.001 8 3.630.000 115 2 -吡唑醚菌酯鲜花椒干花椒140.410.000 008 9 0.000 30 0.94 0.000 029 8 0.000 60210.360.000 007 8 0.000 26 0.59 0.000 018 7 0.000 37140.920.000 020 0 0.000 67 2.86 0.000 090 8 0.001 8210.920.000 020 0 0.000 67 2.02 0.000 064 1 0.001 3
利用GB 2763—2021中代森联和吡唑醚菌酯在不同食物中的MRL,结合19种食物的人均膳食量,通过公式(6)和公式(7),评估了代森联和吡唑醚菌酯在19种食物中的慢性暴露风险,如表7所示。代森联和吡唑醚菌酯在不同食物中的慢性暴露风险贡献率差异较大,累计慢性暴露风险均超过了100%,代森联和吡唑醚菌酯在酱油类食物的慢性暴露风险贡献率占总比仅分别为0.83%和0.47%。再结合表6中农药最高残留值,估算出代森联在鲜花椒和干花椒的风险阈值分别为15、10 mg/kg,吡唑醚菌酯在鲜花椒和干花椒的风险阈值分别为1、3 mg/kg。
表7 代森联和吡唑醚菌酯残留在不同食物中的慢性膳食风险
Table 7 The chronic dietary risk assessment of metiram and pyraclostrobin in different food
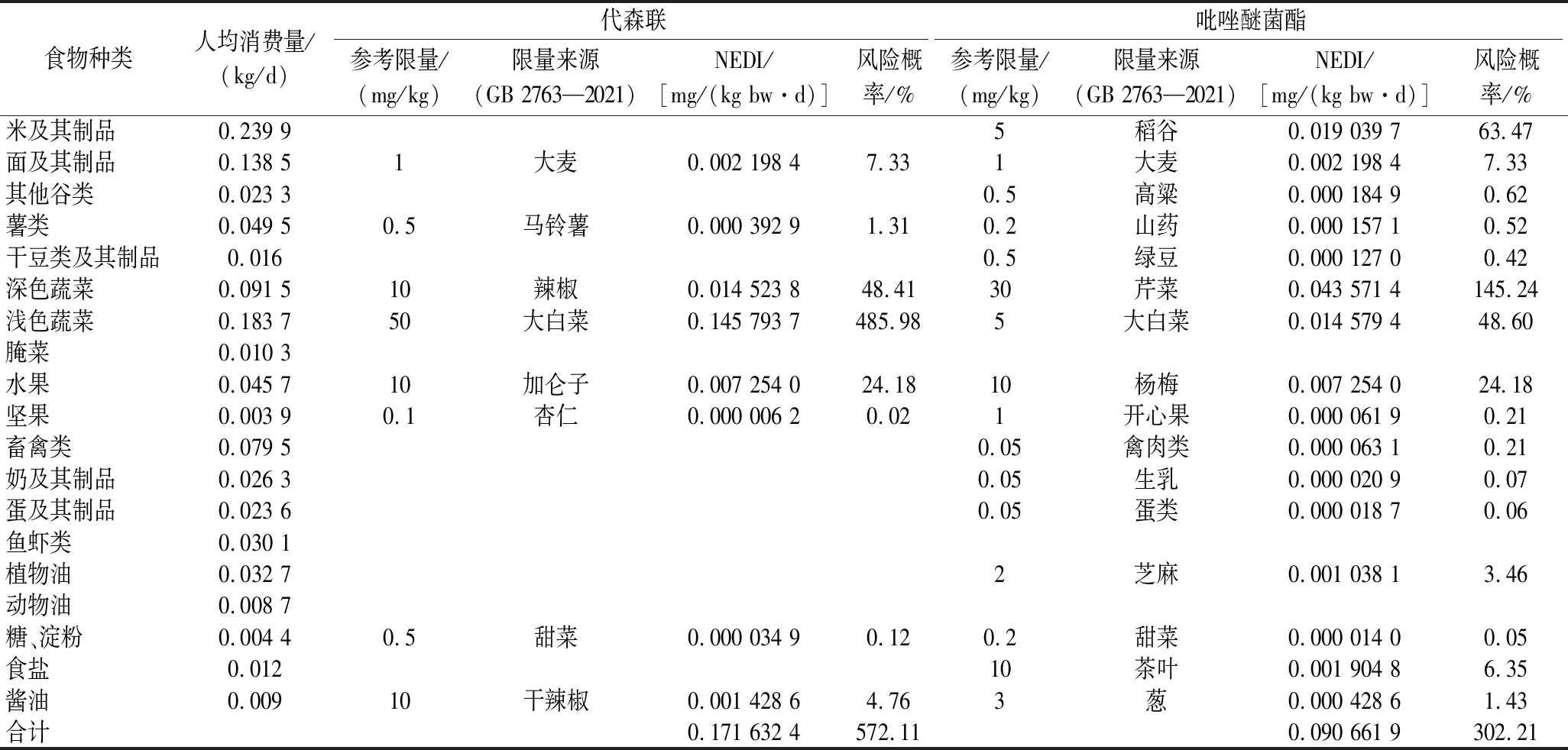
注:参考限量选择该类食物中最大的MRL;茶叶作物分类在饮料中,但风险评估食物归类为食盐;葱、姜、蒜作物分类在蔬菜中,但风险评估食物归类为酱油。
食物种类人均消费量/(kg/d)代森联吡唑醚菌酯参考限量/(mg/kg)限量来源(GB 2763—2021)NEDI/[mg/(kg bw·d)]风险概率/%参考限量/(mg/kg)限量来源(GB 2763—2021)NEDI/[mg/(kg bw·d)]风险概率/%米及其制品0.239 95稻谷0.019 039 7 63.47面及其制品0.138 51大麦0.002 198 47.331大麦0.002 198 4 7.33 其他谷类0.023 30.5高粱0.000 184 9 0.62 薯类0.049 50.5马铃薯0.000 392 91.310.2山药0.000 157 1 0.52 干豆类及其制品0.0160.5绿豆0.000 127 0 0.42 深色蔬菜0.091 510辣椒0.014 523 848.4130芹菜0.043 571 4 145.24 浅色蔬菜0.183 750大白菜0.145 793 7485.985大白菜0.014 579 4 48.60 腌菜0.010 3水果0.045 710加仑子0.007 254 024.1810杨梅0.007 254 0 24.18 坚果0.003 90.1杏仁0.000 006 20.021开心果0.000 061 9 0.21 畜禽类0.079 50.05禽肉类0.000 063 1 0.21 奶及其制品0.026 30.05生乳0.000 020 9 0.07 蛋及其制品0.023 60.05蛋类0.000 018 7 0.06 鱼虾类0.030 1植物油0.032 72芝麻0.001 038 1 3.46 动物油0.008 7糖、淀粉0.004 40.5甜菜0.000 034 90.120.2甜菜0.000 014 0 0.05 食盐0.01210茶叶0.001 904 8 6.35 酱油0.00910干辣椒0.001 428 64.763葱0.000 428 6 1.43 合计0.171 632 4572.110.090 661 9 302.21
3 结论
花椒样品分别经QuEChERS方法处理和衍生化,再分别采用高效液相色谱-串联质谱法和气相色谱-火焰光度检测器检测代森联和吡唑醚菌酯。结果表明该方法操作简单,具有良好的准确度和精密度,可满足试验农药残留检测分析要求。在花椒生长发育过程中,代森联和吡唑醚菌酯均快速消解。按照良好农业规范在花椒上施用代森联和吡唑醚菌酯后,花椒中代森联和吡唑醚菌酯的急性或慢性膳食暴露风险均在可接受范围内。
[1] ZHANG M M, WANG J L, ZHU L, et al.Zanthoxylum bungeanum Maxim.(Rutaceae):A systematic review of its traditional uses, botany, phytochemistry, pharmacology, pharmacokinetics, and toxicology[J].International Journal of Molecular Sciences,2017, 18(10):2172-2203.
[2] 任媛媛, 翟晓巧, 张晨.我国花椒产业发展现状及存在问题和发展前景[J].河南林业科技, 2020, 40(4):31-34.
REN Y Y, ZHAI X Q, ZHANG C.Development status, problems and prospects of Zanthoxylum bungeanum industry in China[J].Journal of Henan Forestry Science and Technology, 2020, 40(4):31-34.
[3] KE J X, QU Y A, SHEN G H, et al.Edible quality and safety evaluation of Zanthoxylum from western China[C].International Conference Series:Materials Science and Engineering.2019.
[4] 吉波, 张耀华, 银航, 等.花椒病虫害生物防治的研究综述[J].陕西农业科学, 2020, 66(10):72-75;104.
JI B, ZHANG Y H, YIN H, et al.Review on biological control of Zanthoxylum bungeanum diseases and pests[J].Shaanxi Journal of Agricultural Sciences, 2020, 66(10):72-75;104.
[5] ZHOU J, DONG C, AN W J, et al.Dissipation of imidacloprid and its metabolites in Chinese prickly ash (Zanthoxylum) and their dietary risk assessment[J].Ecotoxicology and Environmental Safety, 2021, 225:112719.
[6] 唐光辉, 冯超, 冯俊涛, 等.戊唑醇在花椒体内的残留动态研究[J].西北林学院学报, 2013, 28(5):124-127.
TANG G H, FENG C, FENG J T, et al.Residue dynamics of tebuconazole in Chinese prickly ash tissues[J].Journal of Northwest Forestry University, 2013, 28(5):124-127.
[7] 范金平, 张盈, 魏进, 等.QuEChERS结合超高效液相色谱串联质谱法测定花椒中烯效唑残留量及贮藏稳定性[J].食品与发酵工业, 2021, 47(8):230-235.
FAN J P, ZHANG Y, WEI J, et al.Determination of uniconazole and storage stability in Zanthoxylum bungeanum Maxim by QuEChERS-UHPLC-MS/MS[J].Food and Fermentation Industries, 2021, 47(8):230-235.
[8] 杨双昱, 何志强, 曾全, 等.戊唑醇、肟菌酯和吡唑醚菌酯在青花椒中的残留行为[J].现代农药, 2022, 21(3):54-57.
YANG S Y, HE Z Q, ZENG Q, et al.Residual behavior of tebuconazole, trifloxystrobin and pyraclostrobin in Zanthoxylum schinifolium[J].Modern Agrochemicals, 2022, 21(3):54-57.
[9] SAMUELIAN S K, GREER L A, SAVOCCHIA S, et al.Application of Cabrio (a.i.pyraclostrobin) at flowering and veraison reduces the severity of bitter rot (Greeneria uvicola) and ripe rot (Colletotrichum acutatum) of grapes[J].Australian Journal of Grape and Wine Research.2014, 20(2):292-298.
[10] 曹欣然, 邹宗峰, 任强, 等.60%百泰对苹果主要病害的防治效果试验[J].落叶果树, 2015, 47(4):16-18.
CAO X R, ZOU Z F, REN Q, et al.Experiment on the control effect of 60% Baitai on main apple diseases[J].Deciduous Fruits, 2015, 47(4):16-18.
[11] 徐苏贵, 许焕明, 刘柳娇.60%百泰水分散粒剂防治柑橘疮痂病田间药效试验[J].广西植保, 2012, 25(3):6-8.
XU S G, XU H M, LIU L J. Field efficacy test of 60% Baitai water dispersible granule for controlling citrus scab[J]. Guangxi Plant Protection, 2012, 25(3): 6-8.
[12] 彭埃天, 宋晓兵, 习平根, 等.百泰对荔枝霜疫霉病的生物活性测定与防治试验[J].广东农业科学, 2009, 36(8):137-139.
PENG A T, SONG X B, XI P G, et al.Biological activity determination and control test of 60% Cabrio Top WG against Peronophythora litchii[J].Guangdong Agricultural Sciences, 2009, 36(8):137-139.
[13] 段瑞华, 韩方胜, 史明武, 等.百泰、Opera防治花生叶斑病田间药效试验[J].安徽农学通报, 2008, 14(17):204.
DUAN R H, HAN F S, SHI M W, et al. Field efficacy test of Baitai and Opera in controlling peanut leaf spot[J]. Anhui Agricultural Science Bulletin, 2008, 14(17): 204.
[14] 曹琦, 董红强, 刘振亚, 等.百泰不同喷施浓度对棉花叶绿素、养分含量的影响[J].中国农学通报, 2018, 34(10):115-119.
CAO Q, DONG H Q, LIU Z Y, et al.Different spray concentrations of cabrio top:Effect on chlorophyll and nutrient content of cotton[J].Chinese Agricultural Science Bulletin, 2018, 34(10):115-119.
[15] ÇAYIR A, CO KUN M, CO
KUN M, CO KUN M. Genotoxicity of commercial fungicide Cabrio Plus on human cell[J]. Cytotechnology, 2016, 68(5): 1697-1704.
KUN M. Genotoxicity of commercial fungicide Cabrio Plus on human cell[J]. Cytotechnology, 2016, 68(5): 1697-1704.
[16] 李亮亮. 60%吡唑醚菌酯·代森联WG在大蒜及辣椒中的残留动态研究[D]. 泰安: 山东农业大学, 2013.
LI L L. Study on residual dynamics of Pyraclostrobin·Metiram60%WG in garlic and pepper[D]. Taian: Shandong Agricultural University, 2013.
[17] 张爱娟, 冯义志, 齐晓雪, 等. 代森联及其代谢物乙撑硫脲在番茄中的残留及膳食风险评估[J]. 农药科学与管理, 2020, 41(10): 17-23;28.
ZHANG A J, FENG Y Z, QI X X, et al. Residue and dietary risk assessment of metiram and its metabolite ethylene thiourea in tomato[J]. Pesticide Science and Administration, 2020, 41(10): 17-23;28.
[18] LI Z X, ZHANG Y H, ZHAO Q Y, et al. Determination, distribution and potential health risk assessment of insecticides and acaricides in citrus fruits of China[J]. Journal of Food Composition and Analysis, 2022, 111: 104645.
[19] 常继乐, 王宇. 中国居民营养与健康状况监测2010—2013年综合报告[M]. 北京: 北京大学医学出版社, 2016: 61.
CHANG J L, WANG Y. Comprehensive Report on Nutrition and Health Status Monitoring of Chinese Residents from 2010 to 2013[M]. Beijing: Peking University Medical Press, 2016: 61.
[20] TAO X B, PENG W, YU X Q, et al. Determination of heavy metals in Chinese prickly ash from different production areas using inductively coupled plasma-mass spectrometry[J]. Tropical Journal of Pharmaceutical Research, 2016, 15(8): 1767.
[21] 付卓锐, 欧亚非, 黄伊嘉, 等. 四川主产地花椒铅(Pb)累积特性及残留量检测与风险评估[J]. 四川林业科技, 2018, 39(1): 10-16.
FU Z R, OU Y F, HUANG Y J, et al. The accumulation characteristics, residues detection and risk assessment of lead(Pb) in Chinese prickly ash from main production areas in Sichuan[J]. Journal of Sichuan Forestry Science and Technology, 2018, 39(1): 10-16.
[22] 钟伟燕, 尹江伟, 李行方, 等. GC-FPD测定二硫化碳的计算方法及用于空气检测的探讨[J]. 职业与健康, 2013, 29(15): 1903-1905;1908.
ZHONG W Y, YIN J W, LI X F, et al. Discussion on calculation method of carbon disulfide and determination in workplace air with GC-FPD[J]. Occupation and Health, 2013, 29(15): 1903-1905;1908.