前列腺素(prostaglandin,PG)是一类有生理活性的不饱和脂肪酸,由五环及侧链构成的二十碳花生四烯酸脂肪酸,按其结构分为A、B、C、D、E、F等类型。人体的很多组织细胞都可以产生,但是最先是从人的精液中发现的,当时以为是由前列腺释放的,所以命名为前列腺素。PG参与了人体很多的生命活动,尤其是在生理和病变的调节方面。在环氧酶的作用下,前列腺受体相互作用,在机体组织中维持血管、胃、肠道、肾脏等的生理稳态平衡,还可以调节女性生殖及分娩。尤其在血管疾病调节方面发挥着重要作用,可以有效调节血压、血管重构、消除炎症等。近些年来通过临床试验发现,PG可以有效治疗眼部淋巴管疾病、治疗糖尿病下肢血管病变、预防新生儿黄疸、预防高危妊娠剖宫产产后出血、治疗老年失代偿期乙型肝炎肝硬化、治疗肿瘤免疫、治疗男性勃起功能障碍、预防老年冠心病患者介入治疗后造影剂肾病、治疗骨关节炎。
洋葱(Allium cepa L.) 是百合科葱属多年生草本植物,又称为葱头、圆葱、球葱、玉葱,中国南北均有广泛栽培[1]。由于所在产地的气候环境、土壤以及种植品种等因素的影响,所产洋葱的品质各异。洋葱中含有前列腺素、槲皮素、大蒜素、丙基二硫等硫化物[2]、黄酮类[3-4]、蒜氨酶[5]等酶类、皂苷物[6]、含氮化合物[7]、糖类[8]等多种活性成分。尤其,洋葱是极少数富含PG的蔬菜之一[9]。洋葱中的PG主要包括前列腺素A1、前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a等[10],能降低外周血管阻力,降低血黏度,具有降低血压[11-12]、提神醒脑、抗炎、抗氧化、杀菌、降血糖、缓解压力、预防感冒、心脑血管疾病等作用[13-14]。目前,对洋葱活性成分的研究主要集中在黄酮、多糖、含硫化合物等[15-16],PGAl更多被应用于临床治疗[17],而对洋葱中的PG的研究比较少,尤其对洋葱中前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a含量尚不清楚。
目前已报道的对洋葱中前列腺素A1的含量检测主要是HPLC法[18-20],对注射液中前列腺素A1的检测方法有采用LC-MS/MS法[21],对洋葱中PG的其他4种主要成分(前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a)的检测以及这5种PG同时检测的相关方法没有报道。王晓婷等[1]将新鲜洋葱50 ℃干燥后用甲醇超声提取后,采用超高液相色谱以七氟丁酸水溶和甲醇为流动相在254 nm波长处检测了云南、黑龙江两地洋葱中的前列腺素A1。常海民等[19]采用高效液相色谱法柱后衍生在278 nm波长处对直接稀释的前列地尔注射液中的前列腺素A1进行了检测。赵晓玲等[20]用RP-HPLC对前列地尔尿道栓中的前列腺素A1和前列腺素E1在210 nm波长处进行检测。曹晴等[21]采用LC-MS/MS对前列地尔注射液加入5 μg/mL地塞米松溶液内标溶液后检测前列腺素A1。现已报道的HPLC法和LC-MS/MS法检测PG普遍存在的问题是提取效果不理想,检测的准确性不高,并且也只是对前列腺素A1和前列腺素E1进行了研究分析,并没有对前列腺素A2、前列腺素B1、前列腺素F1a的检测进行研究。
本研究用乙醇溶液将洋葱浸泡提取,用旋转蒸发仪浓缩后用甲醇+乙腈(1+1)混合溶液定容,对前列腺素A1、前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a的全扫描监测MRM条件研究,建立了提取效果良好、科学准确的液相色谱-串联质谱同时测定洋葱中5种PG的方法。通过与现有文献方法对比,本方法前处理简便、灵敏度高、重现性好,能科学准确地分析分析检测洋葱中的前列腺素A1、前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a含量,对洋葱的深加工研究具有重要的实际意义。
1 材料与方法
1.1 材料与试剂
洋葱,市购。
甲醇、乙腈(HPLC),赛默飞fisher公司;乙醇(HPLC)、七氟丁酸、无水硫酸镁、无水硫酸钠、无水乙酸钠、无水乙酸镁(AR),国药集团化学试剂有限公司;甲酸铵、乙酸铵(均为for LC-MS,≥99.0%),上海阿拉丁生化科技股份有限公司;前列腺素A1(C20H32O4,CAS号:14152-28-4,纯度≥99.9%)、前列腺素A2(C20H30O4,CAS号:13345-50-1,纯度≥99.9%)、前列腺素B1(C20H32O4,CAS号:13345-51-2,纯度≥99.9%)、前列腺素E1(C20H34O5,CAS号:745-65-3,纯度≥99.9%),TORONTO RESEARCH CHEMICALS INC;前列腺素F1a(C20H34O6,CAS号:58962-34-8,纯度≥99.9%),Avanti POLAR LIPIDS INC.。
1.2 仪器与设备
Agilent 1290高效液相色谱仪、Agilent 6460电喷雾-串联四极杆质谱仪,美国Agilent公司;A2S-T-1024-BE型超纯水机,美国艾科浦国际有限公司;KH-600型超声波清洗机,昆山禾创超声仪器有限公司;GL21M型高速冷冻离心机,长沙英泰仪器有限公司;Vortex-Genie2型涡旋混合器,美国Scientific Industries公司;MS105型十万分之一电子天平,瑞士梅特勒-托利多仪器(中国)有限公司;Quintix2 102-1CN型百分之一电子天平,德国赛多利斯公司;RE100-Pro型旋转蒸发仪, 大龙兴创实验仪器(北京)股份公司。
1.3 实验方法
1.3.1 液相色谱条件
Agilent Eclipse Plus C18 RRHD色谱柱(1.8 μm,50 mm×2.1 mm);流动相A:5 mmol/L甲酸铵溶液,流动相B:甲醇+乙腈(1+1)混合溶液。梯度洗脱:0.0~1.0 min,60% A,1.0~2.0 min,30% A;3.0~4.0 min,10% A,4.0~6.0 min,2% A;6.0~7.0 min,60% A。流速:0.2 mL/min;柱温:35 ℃;进样量:2 μL。
1.3.2 质谱条件
离子源类别:电喷雾离子源;扫描方式:负离子扫描;电喷雾电压:-3 500 V;离子源温度:200 ℃;雾化气:15 psi;多反应监测:每种前列腺素物质选择2个子离子。
1.3.3 标准曲线溶液的配制
分别称取1 mg前列腺素A1、前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a于10 mL棕色容量瓶中,用甲醇+乙腈(1+1)混合试剂溶解并定容,配制成100 μg/mL的标准溶液;用甲醇+乙腈(1+1)混合试剂稀释成5、10、20、50、100、200 ng/mL的标准系列混合溶液。
1.3.4 试样制备及提取
使用制样机将样品破碎并均质,装入无菌密封袋中并标识,放于-18 ℃环境中存放。
称取样品10.00 g于50 mL具塞离心管中,加入20.0 mL乙醇涡旋2 min,之后,加入8.5 g无水硫酸镁后再次涡旋2 min。在高速冷冻离心机中,设置3 ℃条件下以12 000 r/min的转速,离心5 min。吸取乙醇层于100 mL旋转蒸发瓶中旋转蒸发至近干,用甲醇+乙腈(1+1)混合溶液溶洗到5 mL容量瓶中,过0.22 μm有机系滤膜后上机测定。
1.3.5 定性、定量方法
以前列腺素A1、前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a保留时间定性,以外标法对前列腺素A1、前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a进行定量分析。
2 结果与分析
2.1 提取方式的选择
洋葱中前列腺素A1的文献报道提取方法为甲醇超声提取,前列地尔尿道栓中的前列腺素A1用直接用甲醇稀释提取,也有在前列地尔尿道栓中的前列腺素A1加甲醇、30%(体积分数)过氧化氢、0.1 mol/L的氢氧化钠溶液提取,通过综合以上方法的基础上,进一步对甲醇+30%过氧化氢+0.1 mol/L氢氧化钠、乙腈法、甲醇法、甲醇+乙腈法、乙醇法实验对比,实验结果表明提取效果均不理想,达不到完全提取。本研究方法在先加入乙醇提取后,再加入无水乙酸镁吸收水分,在高速冷冻离心机上离心后在旋转蒸发仪上蒸发近干,最后用甲醇+乙腈复溶。通过对各种方法的试验,表明乙醇能够有效地提取PG,无水乙酸镁的吸水性比较强,能够最大程度吸取样品中的水分。高速冷冻离心机上离心和旋转蒸发仪低压低温浓缩,可以有效提取洋葱中的PG。对同一样品等量称取30份,分别用以上文献报道的方法及本方法处理提取后分析,每一方法处理的样品平行提取进样5次,以上方法及本实验的PG总量标准差分别为0.68、0.59、0.61、0.52、0.42、0.30,其各方法对PG的相对提取率见图1。通过试验结果表明本法明显优于已报道的提取方法。
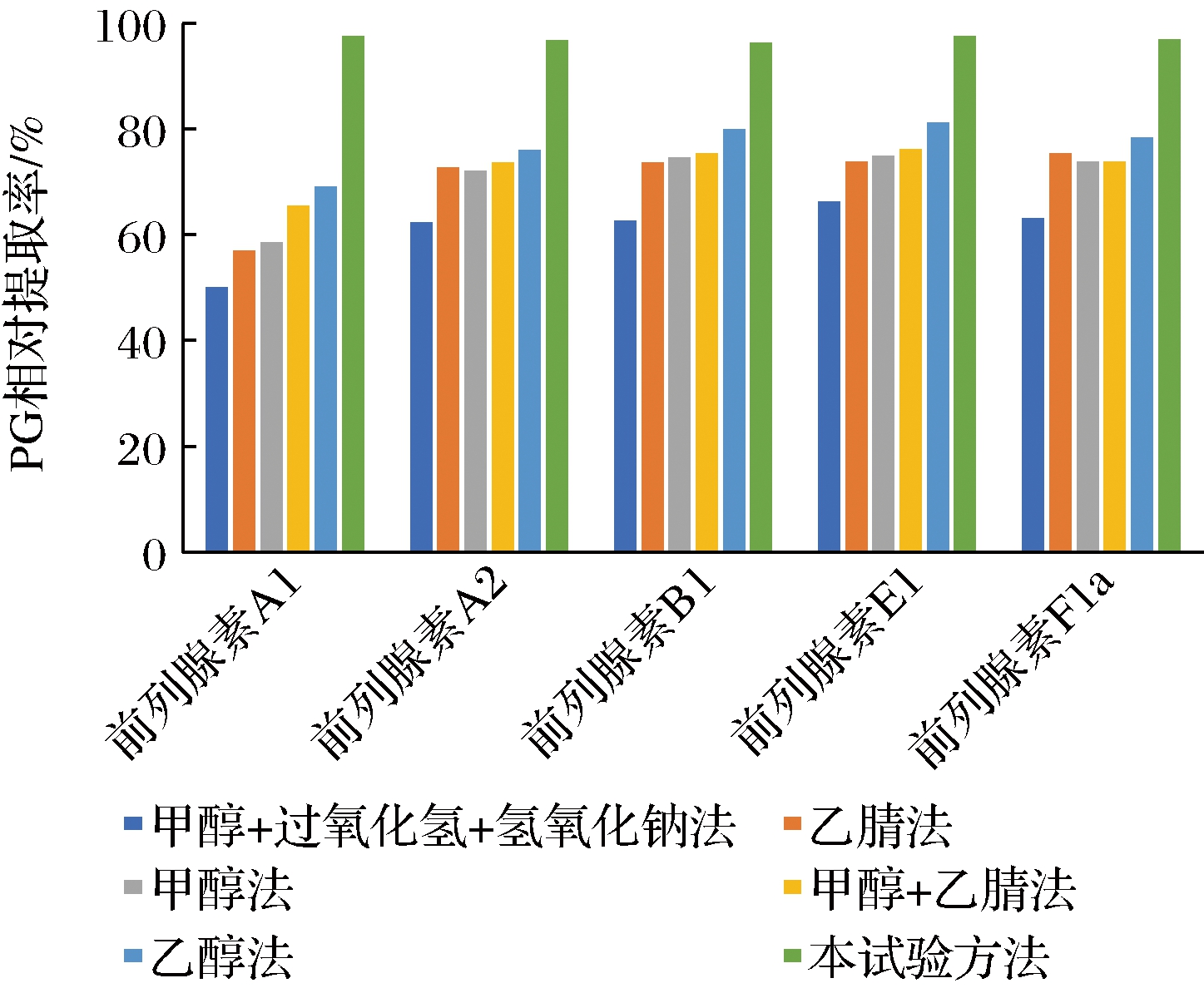
图1 不同方法的提取效果
Fig.1 Extraction effect of different methods
2.2 仪器条件的选择
2.2.1 质谱条件的选择
分别通过对前列腺素A1、前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a的正模式和负式扫描,发现5种PG均在负模式状态下失去1个H有最大响应信号,在扫描得出最佳裂解电压后分别扫描得出每种PG的子离子,同时并对裂解电压和碰撞能进行了优化选择。在负离子模式下,对前列腺素A1、前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a进行母离子和子离子扫描,优化的质谱参数见表1。
表1 前列腺素PGA1、PGA2、PGB1、PGE1、PGF1a的质谱参数
Table 1 Mass spectrometric parameters of prostaglandins PGA1, PGA2, PGB1, PGE1, and PGF1a
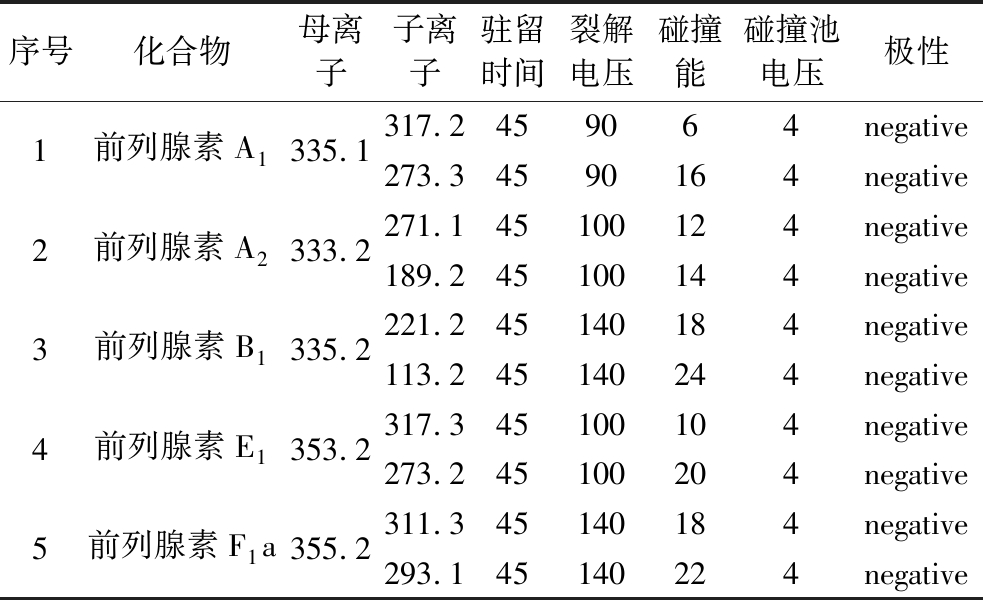
序号化合物母离子子离子驻留时间裂解电压碰撞能碰撞池电压极性1前列腺素A1335.1317.2459064negative273.34590164negative2前列腺素A2333.2271.145100124negative189.245100144negative3前列腺素B1335.2221.245140184negative113.245140244negative4前列腺素E1353.2317.345100104negative273.245100204negative5前列腺素F1a355.2311.345140184negative293.145140224negative
2.2.2 色谱柱的选择
分别对Agilent Eclipse Plus C18 RRHD色谱柱(1.8 μm,50 mm ×2.1 mm)、ZORBAX Eclipse XDB-C18 (1.8 μm,50 mm×2.1 mm)、ACQUITY UPLC BEH C18 (1.7 μm,100 mm×3 mm)、COTECS Shield RP18 (2.7 μm,100 mm×2.1 mm)、AtlantisTM T3(5 μm,50 mm×2.1 mm)5种色谱柱进行了对比,前列腺素A1、前列腺素A2、前列腺素B1、前列腺素E1、前列腺素F1a在Agilent Eclipse Plus C18 RRHD(50 mm×2.1 mm,1.8 μm)色谱柱上相较于其他4种色谱柱的分离效果好,主要是稳定性好,分析速度快,分离效率高,灵敏度和柱效高。
2.2.3 流动相体系的选择
根据前列腺素(PGA1、A2、B1、E1、F1a)的物质特性,分别对七氟丁酸甲醇水溶液、乙腈水溶液、甲醇水溶液、5 mmol/L乙酸铵甲醇溶液、5 mmol/L甲酸铵甲醇溶液、5 mmol/L乙酸铵乙腈溶液、5 mmol/L甲酸铵乙腈溶液、5 mmol/L甲酸铵溶液+甲醇+乙腈、5 mmol/L 乙酸铵溶液+甲醇+乙腈等流动相体系在分析检测前列腺素(PGA1、A2、B1、E1、F1a)的分离效果进行了实验考察,试验表明5 mmol/L甲酸铵溶液+乙腈+甲醇为流动相体系时色谱的分离达到了最好的效果。
2.2.4 流动相淋洗方式的选择
对常规的淋洗方式进行了试验比对,前列腺素(PGA1、A2、B1、E1、F1a)5种物质在采用等度淋洗时无法分离开来,出现了色谱峰重叠的现象。试验表明梯度淋洗比等度淋洗的分离效果好,并且试验验证当为流动相A为5 mmol/L甲酸铵溶液,流动相B为甲醇+乙腈(1+1)混合溶液,程序0.0~1.0 min,60% A;1.0~2.0 min,30% A;3.0~4.0 min,10% A;4.0~6.0 min,2% A;6.0~7.0 min,60% A梯度洗脱时分离效果最佳。
2.2.5 流动相流速的选择
在0.10~0.50 mL/min内分别设置不同的流速,对其不同流速的分析结果进行比较。试验表明,流速越大,保留时间越短,5种前列腺素(PGA1、A2、B1、E1、F1a)的保留时间越接近。综合柱效、保留时间、分离度、分析检测效率、响应值等因素,流动相流速为0.2 mL/min时适宜。在本方法的条件下,前列腺素(PGA1、A2、B1、E1、F1a)的多反应监测色谱图见图2~图6。
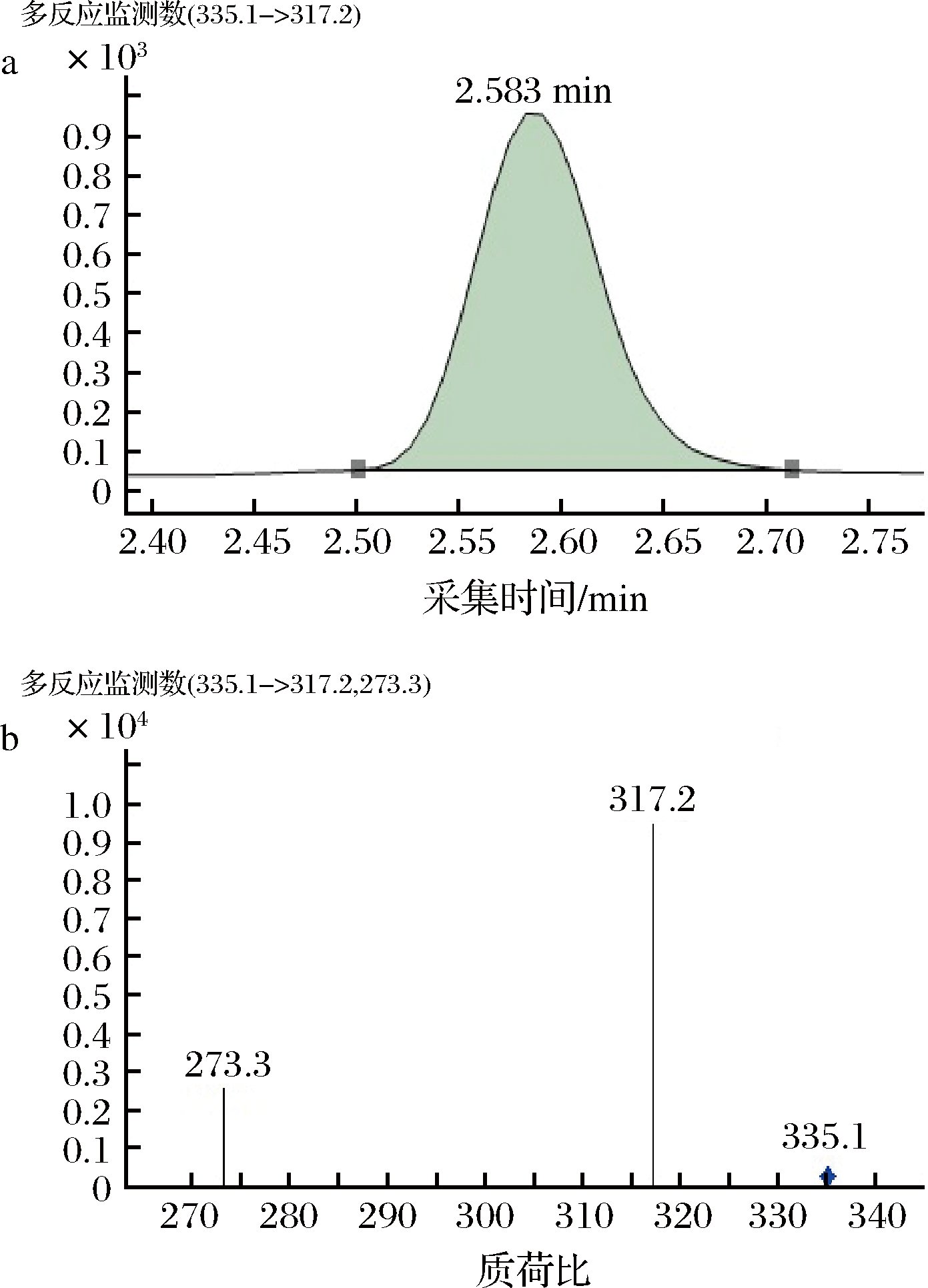
a-多反应监测定量离子提取图;b-多反应监测质量色谱图
图2 前列腺素PGA1的多反应监测质量色谱图
Fig.2 Multiple reaction monitoring quality chromatogram of prostaglandin PGA1
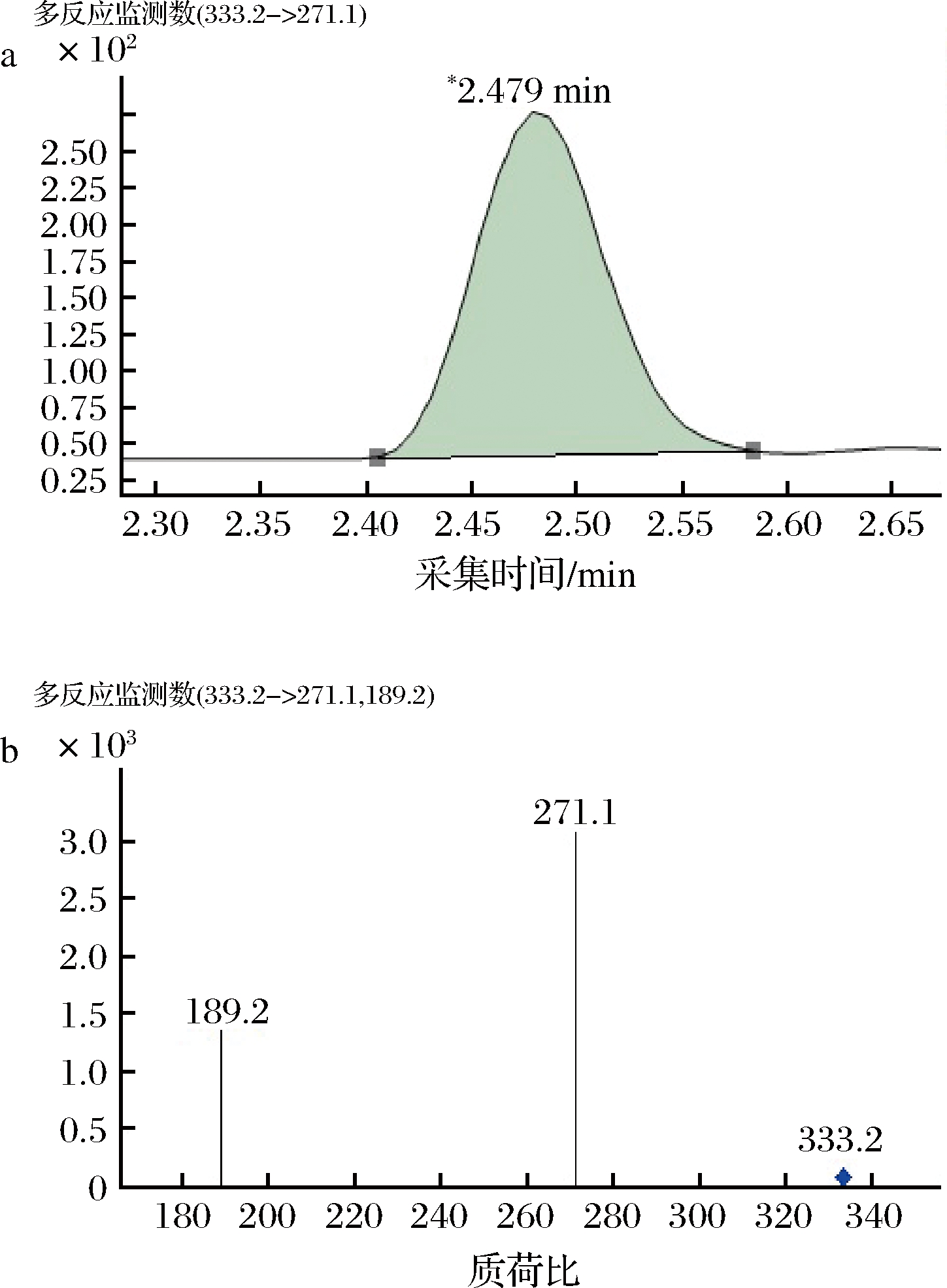
a-多反应监测定量离子提取图;b-多反应监测质量色谱图
图3 前列腺素PGA2的多反应监测质量色谱图
Fig.3 Multiple reaction monitoring quality chromatogram of prostaglandin PGA2

a-多反应监测定量离子提取图;b-多反应监测质量色谱图
图4 前列腺素PGB1的多反应监测质量色谱图
Fig.4 Multiple reaction monitoring quality chromatogram of prostaglandin PGB1
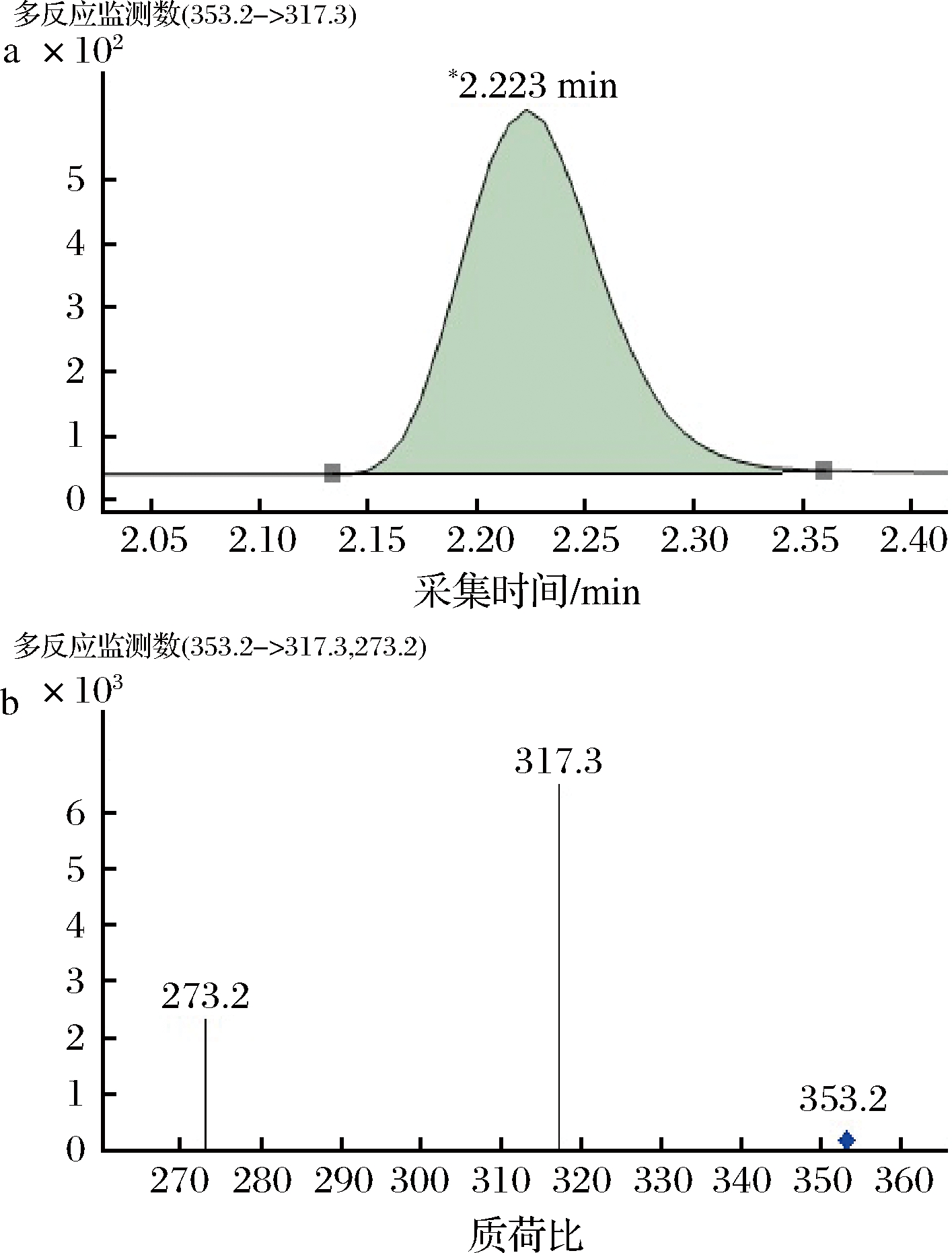
a-多反应监测定量离子提取图;b-多反应监测质量色谱图
图5 前列腺素PGE1的多反应监测质量色谱图
Fig.5 Multiple reaction monitoring quality chromatogram of prostaglandin PGE1

a-多反应监测定量离子提取图;b-多反应监测质量色谱图
图6 前列腺素PGF1a的多反应监测质量色谱图
Fig.6 Multiple reaction monitoring quality chromatogram of prostaglandin PGF1a
2.3 标准曲线与检出限
方法的标准曲线以物质量浓度(X,ng/mL)为横坐标、离子响应强度值(Y)为纵坐标,前列腺素(PGA1、A2、B1、E1、F1a)的线性方程及其相关系数见表2,在浓度5.0~200 ng/mL内,前列腺素(PGA1、A2、B1、E1、F1a)的线性相关系数(R2)为0.999 7~0.999 9,完全符合仪器定量分析的要求。
表2 前列腺素(PGA1、A2、B1、E1、F1a)的保留时间、线性方程、相关系数(R2)
Table 2 Retention time, linear equation, and correlation coefficient (R2) of prostaglandins PG (A1, A2, B1, E1, F1a)

化合物保留时间线性方程相关系数(R2)前列腺素PGA12.583y=39.450 114x-33.985 9310.999 9前列腺素PGA22.479y=10.385 693x-12.953 2640.999 7前列腺素PGB12.614y=14.150 601x-24.193 4480.999 7前列腺素PGE12.223y=26.429 245x-21.207 2910.999 8前列腺素PGF1a2.165y=22.296 298x-30.246 0620.999 6
在空白基质新鲜洋葱中加入前列腺素(PGA1、A2、B1、E1、F1a),按照本方法进行提取和分析,以3倍、10倍信噪比计算得到本方法中前列腺素(PGA1、A2、B1、E1、F1a)的检出限均为1.0 μg/kg,定量限均为2.5 μg/kg。和报道的分析方法相比,本方法的灵敏度较高。
2.4 回收率和精密度
向已分析检测前列腺素(PGA1、A2、B1、E1、F1a)含量的洋葱中分别添加10.0、20.0、40.0 ng/mL低、中、高3个浓度水平的前列腺素(PGA1、A2、B1、E1、F1a)混合标准溶液,按照本方法进行前处理和分析检测,对每个加标样品在相同条件下平行分析6次,加标回收率为96%~109%,相对标准偏差为0.26%~1.81%,具体结果见表3,试验表明,本方法的准确度和精密度较高,对洋葱中的前列腺素(PGA1、A2、B1、E1、F1a)能够进行准确的分析检测。
表3 前列腺素(PGA1、A2、B1、E1、F1a)的回收率和精密度
Table 3 Recoeries and RSDs of prostaglandins PG (A1, A2, B1, E1, F1a)
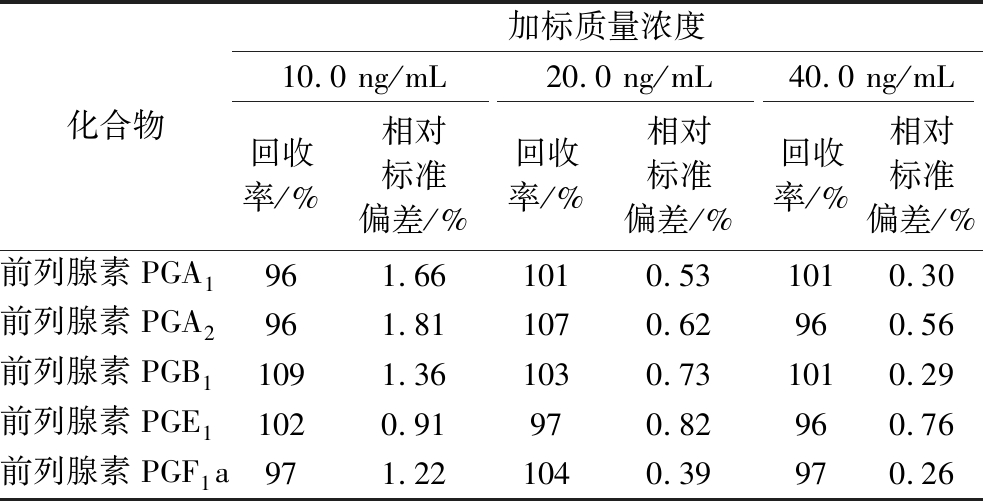
化合物加标质量浓度10.0 ng/mL20.0 ng/mL40.0 ng/mL回收率/%相对标准偏差/%回收率/%相对标准偏差/%回收率/%相对标准偏差/%前列腺素PGA1961.661010.531010.30前列腺素PGA2961.811070.62960.56前列腺素PGB11091.361030.731010.29前列腺素PGE11020.91970.82960.76前列腺素PGF1a971.221040.39970.26
2.5 基质效应评价
通过对洋葱的筛选,选出均未检出前列腺素(PGA1、A2、B1、E1、F1a)的洋葱作为样品基质,向样品基质中加入5种PG的混合标准溶液,按照1.3.4节提取,配制成同1.3.3节一样的5~200 ng/mL的标准系列混合溶液,线性相关系数(R2)均也在0.999 7~0.999 9。同时,在样品基质中分别添加10.0、20.0、40.0 ng/mL 3个质量浓度水平,加标回收率为96%~106%,并且对加到样品基质中的标准溶液与相对应的未加到基质中的标准溶液的响应强度进行对比,相对标准偏差为0.32%~0.96%。通过实验表明在对洋葱中5种PG的分析检测中基质效应的影响非常小。
2.6 洋葱样品分析
采用本方法对任意选取的洋葱外层皮、中心部、根部样品中前列腺素(PGA1、A2、B1、E1、F1a)进行分析检测,结果洋葱外层皮中前列腺素的总含量为68.6 μg/kg,洋葱中心部前列腺素中的总含量为66.2 μg/kg,洋葱根部前列腺素的总含量为60.8 μg/kg,从分析检测结果可知,洋葱中的前列腺素(PGA1、A2、B1、E1、F1a)含量是非常低的,从洋葱外层皮、中心部、根部依次降低。
2.7 与已报道方法的对比
分别用本方法和已报道的王晓婷等[1]将新鲜洋葱50 ℃干燥后用甲醇超声提取后,采用超高液相色谱检测洋葱中前列腺素A1的分析检测方法对白洋葱、紫洋葱、黄洋葱中的前列腺素(PGA1)处理及分析检测,具体分析检测的结果见表4,很明显本方法测得的含量比报道方法测得的含量高得多,同时在紫洋葱中添加20 ng/mL浓度水平的PGA1标准溶液后前处理及分析检测,本方法的加标回收率为97%,报道文献方法的加标回收率为69%,通过试验证明本方法更优于已报道的方法。因为前列腺素(PGA2、B1、E1、F1a)的分析检测暂时目前无报道的方法,无法进行对比。
表4 本方法与报道方法检测结果的对比
Table 4 Comparison of test results between this method and the reported method
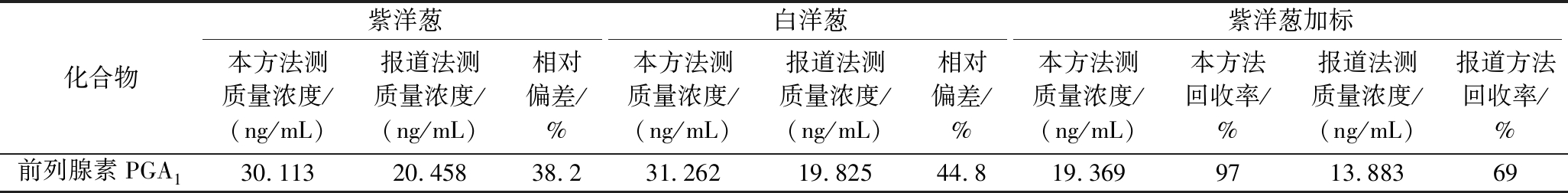
化合物紫洋葱白洋葱紫洋葱加标本方法测质量浓度/(ng/mL)报道法测质量浓度/(ng/mL)相对偏差/%本方法测质量浓度/(ng/mL)报道法测质量浓度/(ng/mL)相对偏差/%本方法测质量浓度/(ng/mL)本方法回收率/%报道法测质量浓度/(ng/mL)报道方法回收率/%前列腺素PGA130.11320.45838.231.26219.82544.819.3699713.88369
3 结论
本研究建立了液相色谱-串联质谱分析检测洋葱中的前列腺素(PGA1、A2、B1、E1、F1a)的方法。用乙醇提取后,再加入无水乙酸镁吸收水分,在高速冷冻离心机上离心后在旋转蒸发仪上蒸发近干,最后用甲醇+乙腈复溶,在电喷雾负离子模式下,采用四级杆质谱仪进行多反应分析。与现有报道的方法相比,本法科学、准确、全面、操作简便,非常适合洋葱中的前列腺素(PGA1、A2、B1、E1、F1a)的分析研究,对于洋葱的功能性成分分析研究和深加工产业发展提供一定的技术支撑,对保障农民增收、促进乡村振兴具有重要的实际意义。
[1] 王晓婷, 谭超, 王燕华, 等.两个产地洋葱的UHPLC图谱分析及前列腺素A1含量测定[J].食品与机械, 2022, 38(1):44-51.
WANG X T, TAN C, WANG Y H, et al.UHPLC profiling of onions from two origins and the determination of prostaglandin A1 content[J].Food and Machinery, 2022, 38(1):44-51.
[2] 王辉, 李景明, 马钊, 等.洋葱中含硫化合物的生理功效[J].食品工业科技, 2005,26(5):187-189.
WANG H, LI J M, MA Z, et al.Physiological effects of sulfur compounds in onion[J].Science and Technology of Food Industry, 2005,26(5):187-189.
[3] HIROTA S, SHIMODA T, TAKAHAMA U.Tissue and spatial distribution of flavonol and peroxidase in onion bulbs and stability of flavonol glucosides during boiling of the scales[J].Journal of Agricultural &.Food Chemistry, 1998,46(9):3497-3502.
[4] ZHANG S L, DENG P, XU Y C, et al.Quantification and analysis of anthocyanin and flavonoids compositions, and antioxidant activities in onions with three different colors[J].Journal of Integrative Agriculture, 2016, 15(9):2175-2181.
[5] 梁雪岩. 洋葱在功能食品中的应用及发展前景[J].现代食品, 2020(13):106-108.
LIANG X Y.Application and development prospects of onion in functional foods[J].Modern Food, 2020(13):106-108.
[6] 李莎莉, 吴悠, 吴琦, 等.洋葱生物活性及其在食品开发中的研究进展[J].中国调味品, 2018, 43(2):184-187.
LI S L, WU Y, WU Q, et al.Biological activity of onion and its research progress in food development[J].China Condiment, 2018, 43(2):184-187.
[7] 赵靖, 宋述尧, 赵春波, 等.分蘖洋葱营养成分的保健作用与药用价值研究进展[J].食品工业科技, 2013, 34(23):365-367;372.
ZHAO J,SONG S Y, ZHAO C B, et al.Research progress in health function and medicinal value of nutrient composition for tillered-onion[J].Science and Technology of Food Industry, 2013, 34(23):365- 367;372.
[8] SCHNABL H.Isolation and identification of soluble polysaccharides in epidermal tissue of Allium cepa[J].Planta, 1977, 135(3):307-311.
[9] 陈亦辉, 王卫东, 孙月娥.洋葱中活性物质及生理药理作用研究进展[J].中国调味品, 2015, 40(4):129-132;140.
CHEN Y H, WANG W D, SUN Y E.Research progress of physiological and pharmaceutical effects and active materials in onion[J].China Condiment, 2015, 40(4):129- 132;140.
[10] 刘世馨, 杜咏梅, 侯小东, 等.洋葱皮不同溶剂提取物的体外抗氧化、抑制α-糖苷酶活性研究[J].食品工业科技, 2018, 39(9):33- 39.
LIU S X, DU Y M, HOU X D, et al.Study on antioxidant and inhibition of α-glucosidase activities in vitro of different solvent extracts from onion skin (Allium cepa L.)[J].Science and Technology of Food Industry, 2018, 39(9):33-39.
[11] KERINS D M, MURRAY R, FITZGRALD G A.Prostacyclin and prostaglandinE:M-olecular mechanisms and therapeutic utility[J].Prog.Hemost.Thromb, 1991, 10:307-337.
[12] MICHAEL G, PRISCILLA Z, MASAYOSHI M, et al.Metabolism of Prgstaglandis A1 and E1 in man[J].The Journal of Clinical in Vestigation, 1975, 56:1404-1410.
[13] 刘世馨. 洋葱皮多酚、黄酮提取及其体外抗氧化等活性研究[D].北京:中国农业科学院, 2018:19-23.
LIU S X.Study on extraction and antioxidant activitiy in vitro and others of polyphenols, flavonoids from onion skin[D].Beijing:Chinese Academy of Agricultural Sciences, 2018:19-23.
[14] 江成英, 郭宏文, 张文学, 等.洋葱的营养成分及其保健功效研究进展[J].食品与机械, 2014, 30(5):305-309.
JIANG C Y, GUO H W, ZHANG W X, et al.Research progress on nutrition and health function of onion[J].Food &.Machinery, 2014, 30(5):305-309.
[15] 何畅. 分蘖洋葱黄酮的提取及微胶囊加工技术研究[D].长春:吉林农业大学, 2020:5-10.
HE C.Study on extraction and microencapsulation of flavonoids from tillering onion[D].Changchun:Jilin Agricultural University, 2020:5-10.
[16] 何运辉. 洋葱皮多糖提取、结构表征及抗氧化研究[D].沈阳:沈阳农业大学, 2019:5-20.
HE Y H.Studies on extraction, characterization and antioxidan tactivities of polysaccharides from onion skin[D].Shenyang:Shenyang Agricultural University, 2019:5-20.
[17] 赵萍, 张子豪, 连晓峰.洋葱硫醇类化合物与开发生物农药潜力的研究综述[C].中国生物工程学会第十二届学术年会暨2018年全国生物技术大会论文集. 长沙:中国生物工程学会, 2018:345-355.
ZHAO P, ZHANG Z H, LIAN X F, et al.A review of studies on onion thiol compounds and the potential of developing biological pesticides[C].Proceedings of the 12th Annual Acadermic Conference of the Chinese Society of Biological Engineering and the 2018 National Bitechnology Conference.Changsha:China Bioengineering Society, 2018:345-355.
[18] XU G B, GUAN P P, WANG P.Prostaglandin Al decreases the phosphorylation of tau by activating protein phosphatase 2A via a michael addition mechanism at cysteine 377[J].Molecular Neurobiology, 2021, 58(3):1114-1127.
[19] 常海民, 石玉, 游欢欢, 等.直接稀释法测定前列地尔注射液中前列地尔与前列腺素A1含量[J].中国处方药, 2020, 18(8):35-37.
CHANG H M, SHI Y, YOU H H, et al.Determination of alprostadil and prostaglandin A1 in alprostadil injection by direct dilution method [J].Journal of China Prescription Drug, 2020, 18(8):35-37.
[20] 赵晓玲, 曲建国.RP- HPLC测定前列地尔尿道栓中前列腺素A1及其有关物质[J].药物分析杂志, 2006, 26(6):836-839.
ZHAO X L, QU J G. HPLC determination of the prostaglandin A1 and other related substances of the alprostadil urethral suppository[J].Chinese Journal of Pharmaceutical Analysis, 2006, 26 (6):836-839.
[21] 曹晴, 刘志东, 代文兵, 等.LC-MS/MS法测定前列地尔注射液中前列腺素Al[J].现代仪器与医疗, 2014, 20(1):60-63.
CAO Q, LIU Z D, DAI W B, et al.Determination of prostaglandin Al in alprostadil injection by LC-MS/MS[J].Modern Instruments and Medical Treatment, 2014, 20(1):60-63.