蜜饯类食品作为一种典型的果蔬类干制品,因其口感香甜、食用方便、色彩斑斓的视觉刺激以及一定的保健功效等特性而备受喜爱,已成为人们茶余饭后、约会待客的休闲食品[1]。为进一步改善蜜饯的色泽,一些食品生产商通常会在蜜饯的腌制过程中加入着色剂,即色素[2]。色素可分为天然色素和人工色素,天然色素一般提取自新鲜的水果或蔬菜等[3],具有生理活性高、吸收效率好、健康威胁低等特点[4],但其制作成本高,且稳定性较差[5]。人工合成色素主要是以苯、甲苯、萘等化工产品为原料,经过磺化、硝化、卤化、偶氮化等一系列有机反应化合而成[6],易实现大批量生产,具有成本低廉、着色能力强、抗氧化和抗酸碱性好、性质稳定等优势,已在食品加工工艺中广泛使用[7-8]。但是,人工合成色素的过量摄入会引起DNA损伤、代谢紊乱、行为异常等不良生长发育后果,进而诱发神经、心血管系统等多种疾病,具有致癌、致畸、致突变的“三致”作用[9]。研究表明,某些偶氮类色素经人体新陈代谢后会转变成萘胺类致癌物质[10-11]。因此,国内外管理部门对人工合成色素的使用范围和添加量都做了明确而严苛的限值规定[12-13],如GB 2760—2014《食品安全国家标准 食品添加剂使用标准》。然而,为使蜜饯的色泽愈发博人眼球而达到牟取更多利润的目的,一些食品生产商仍在蜜饯的制作过程中非法添加过量的人工合成色素。因摄入过量的人工合成色素而导致的食品安全事故频发,为确保食品安全和维护人体健康,对蜜饯类食品中人工合成色素的高效检测以及安全风险评估至关重要。
迄今为止,食品中人工合成色素的检测方法主要有示波极谱法[14]、电化学法[15-16]、薄层色谱法[17]、毛细管电泳法[18]、高效液相色谱法[19-20]、高效液相色谱-串联质谱法[21-23]、分光光度法[24]等。这些分析方法各有利弊,如示波极谱法具有操作简便、灵敏度高的优点,但其需在特定的缓冲溶液中进行测定,且只能对目标物之间不存在相互干扰的合成色素体系进行定量分析[25];高效液相色谱-串联质谱法在定性和定量分析中表现出极高的灵敏度和准确度,但因仪器设备昂贵、体积庞大、操作难度高等特点而在普适性方面面临巨大挑战。高效液相色谱法具有灵敏度高、重现性好、操作简单、仪器价格适中以及普适性高等性质,是GB/T 5009.35—2016《食品安全国家标准 食品中合成着色剂的测定》中推荐使用的检测技术。然而目前利用高效液相色谱法检测蜜饯类食品中人工合成色素的研究较少,且其检测效率也有待进一步提高。因此,基于高效液相色谱法实现对蜜饯类食品中多种人工合成色素的高效检测以及进一步开展风险评估极具探究意义。
鉴于此,本研究以蜜饯中7种人工合成色素(柠檬黄、苋菜红、胭脂红、日落黄、诱惑红、亮蓝、酸性红)为研究对象,基于GB/T 5009.35—2016中的高效液相色谱技术进行了方法优化,包括提取、净化以及检测方式3个方面,显著提高了分析效率,成功实现蜜饯样品的大批量检测。本研究进一步对成都及周边地区市售多批次蜜饯类样品进行了检测,并开展了风险评估分析,研究表明蜜饯样品中人工合成色素的检出率较高,且过量添加人工合成色素的现象依然存在,因而亟需加强市场监管。本研究构建的方法具有准确度和灵敏度高、操作简单、普适性强、利于大批量样品的高效检测等特性,结合风险评估分析,可为政府管理部门的监管工作提供科学依据,以期为人体健康保驾护航。
1 材料与方法
1.1 材料与试剂
本研究中的565批次蜜饯类样品均随机采购于成都及周边地区的批发市场、农贸市场、大型商场等。
标准品:柠檬黄(1 000 μg/mL),曼哈格科技公司;苋菜红、胭脂红(1 000 μg/mL),北京坛墨质检科技有限公司;日落黄(500 μg/mL),上海安谱实验科技有限公司;诱惑红、酸性红(1 000 μg/mL),北京海岸鸿蒙标准物质技术有限责任公司;亮蓝(500 μg/mL),中国计量科学研究院;甲醇(色谱纯),安徽时联特种溶剂股份有限公司;无水乙醇、乙酸铵、柠檬酸、甲酸(分析纯),成都科隆化学品有限公司;氨水(25%),广东光华科技股份有限公司;聚酰胺固相萃取柱(500 mg/6 mL),逗点生物科技有限公司;聚酰胺粉(200目),国药集团化学试剂有限公司;0.45 μm水系滤膜(聚醚砜),天津市津腾实验设备有限公司;0.45 μm有机系滤膜(尼龙),天津市津腾实验设备有限公司;一级水;G3垂融漏斗。
1.2 仪器与设备
Ultimate 3000高效液相色谱仪(配置二极管阵列检测器),美国Thermo Fisher Scientific公司;BSA223 s电子天平(感量0.001 g),赛多利斯科学仪器有限公司;Shimadzu Shim-pack GIST C18色谱柱(4.6 mm×250 mm, 5.0 μm),日本岛津公司;Milli-Q超纯水发生器,美国Millipore公司;FJ300高速均质机,上海标本模型厂;5804R台式高速离心机,德国eppendorf公司;BC-1000多管涡旋混合仪,逗点生物科技有限公司;410HT数控超声波清洗器,深圳市洁拓超声波清洗设备有限公司;N1-50多孔氮吹仪,屹尧科技有限公司;MJ-PT51破壁机,美的电器股份有限公司;HH-8电热恒温水浴锅,北京中兴伟业仪器有限公司。
1.3 实验方法
1.3.1 试剂的配制
配制5%(体积分数)氨水溶液、60%(体积分数)甲醇溶液、0.02 mol/L乙酸铵溶液、1.0 mol/L柠檬酸溶液、甲醇-甲酸混合溶液(6∶4, 体积比);无水乙醇-氨水混合溶液[无水乙醇、5%(体积分数)氨水溶液和水按体积比7∶2∶1混匀]、甲醇-氨水混合溶液[甲醇和25%(体积分数)氨水按体积比9∶1混匀]。
1.3.2 标准溶液的配制
混合标准中间液:分别准确移取柠檬黄、苋菜红、胭脂红、日落黄、诱惑红、亮蓝、酸性红标准溶液至25 mL容量瓶中,加水定容至刻度,配制成质量浓度为50 μg/mL的混合标准中间液。
混合标准工作液:分别准确移取上述步骤中的混合标准中间液,加水稀释后,配制成质量浓度为0.1、0.5、2.0、5.0、10.0、20.0、50.0 μg/mL的系列标准工作液。
1.3.3 样品的检测
1.3.3.1 样品前处理
当蜜饯类样品无核时,则可直接用破壁机进行破碎处理;若蜜饯类样品有核,则应先去其核,再取其可食用部分经破壁机进行破碎处理。然后,称取5 g破碎后的样品至50 mL离心管中,加入20 mL无水乙醇-氨水混合溶液,经高速均质机均质,于60 ℃水浴下超声提取5 min,最后经离心处理。重复上述提取步骤2次,合并提取液,将其经水浴挥发至小于10 mL后,用柠檬酸溶液调节pH值至3.0~4.0,待后续净化处理。
1.3.3.2 样品净化
采用聚酰胺固相萃取柱法进行样品的纯化。聚酰胺固相萃取柱先分别用5 mL甲醇和5 mL水进行活化,再将待净化样品全部转移至小柱上,控制流速低于2 mL/min, 于60 ℃下分别用10 mL水(pH=4)和10 mL甲醇-甲酸混合溶液淋洗小柱,再用10 mL水冲洗柱体,抽干后用10 mL甲醇-氨水混合溶液进行洗脱。收集洗脱液,于60 ℃水浴下用氮气吹至近干状态,再用60%(体积分数)甲醇溶液定容至 5 mL,最后经0.45 μm水系微孔滤膜过滤后用高效液相色谱仪进行分析。
1.3.3.3 样品检测条件
色谱柱:Shimadzu Shim-pack GIST C18(4.6 mm×250 mm,5.0 μm);流动相:甲醇-0.02 mol/L乙酸铵溶液;流速:0.7 mL/min;柱温:40 ℃;进样量:20 μL;检测波长:428 nm,带宽4 nm,步长0.2 s。梯度洗脱程序见表1。
表1 梯度洗脱程序表
Table 1 Table of gradient elution procedures

时间/min甲醇(体积分数)/%乙酸铵溶液(体积分数)/%0.0110905.00208011.00802015.00802016.00109019.001090
1.4 数据处理
本研究所采用的数据均以上机测试而来的原始数据为基础,平行试验数据取平均值,数据用Microsoft Excel软件处理,在Origin软件中进行绘图。
2 结果与分析
2.1 提取方法的优化
本研究在对蜜饯样品进行前处理的过程中发现,若直接采用GB/T 5009.35—2016中的提取方法对蜜饯样品进行处理,即仅使用纯水作为样品的提取液,样品中人工合成色素的提取不充分且效率极低,进而导致分析结果严重偏低(表2),并且还会使样品呈浑浊的黏稠状态,即使在抽滤的条件下也难以将提取液分离出来。简言之,该方法操作步骤繁琐、提取效率较低、可行性不高,难以适用于应急检测或者大批量样品检测。鉴于此,本研究对蜜饯样品的提取溶剂和提取步骤进行了优化。本文中7种人工合成色素均为苯磺酸钠结构,一般地,含有酸性基团的色素更容易被碱性溶液提取。因此,本研究以无水乙醇/氨水碱性混合溶液作为蜜饯样品的提取液,其具体实施步骤为:将样品在60 ℃条件下进行超声提取,经离心后得到澄清的样品溶液。研究表明,优化后的提取方法可有效实现样品混合物的固液分离,并展现出较高的多组分人工合成色素提取效率,各组分的回收率也得到了显著提升,如表2所示。该方法使得后续的净化处理过程更加便捷,同时也为批量蜜饯样品的检测提供了保障。
表2 两种不同提取溶剂的提取效果及回收率
Table 2 Extracting property and recovery of different solvents
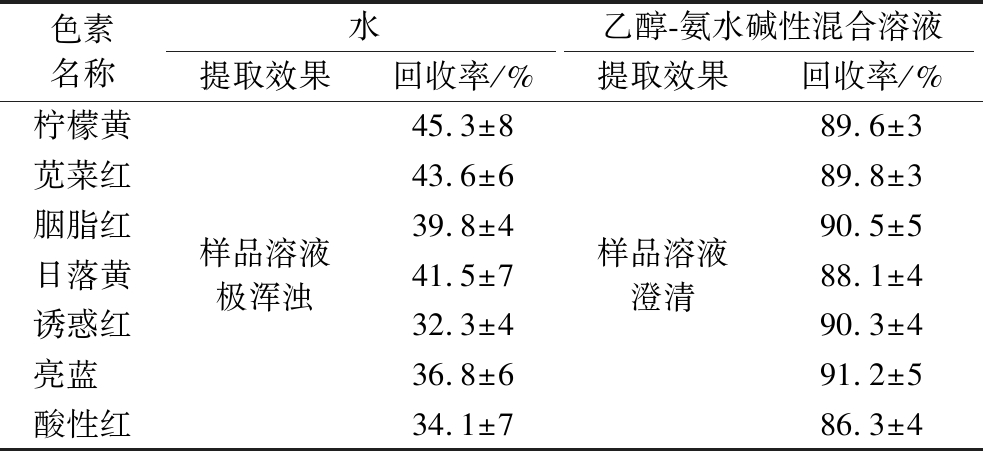
色素名称水乙醇-氨水碱性混合溶液提取效果回收率/%提取效果回收率/%柠檬黄苋菜红胭脂红日落黄诱惑红亮蓝 酸性红样品溶液极浑浊45.3±843.6±639.8±441.5±732.3±436.8±634.1±7样品溶液澄清89.6±389.8±390.5±588.1±490.3±491.2±586.3±4
2.2 净化方法的优化
在实验过程中,首先根据GB/T 5009.35—2016中的净化方法即聚酰胺粉吸附法对上述提取的样品溶液进行处理,但该净化方式需要大量的洗脱液,使得后续蒸发浓缩处理步骤耗时较长。该法不符合绿色化学的理念,也不利于批量蜜饯样品的高效检测。为了减少对环境不友好的有机试剂或药品的使用量以及提高检测效率,本研究提出一种基于聚酰胺固相萃取柱的高效净化方式,将提取的样品溶液经活化的聚酰胺固相萃取柱处理后,先用甲醇-甲酸混合溶液冲洗天然色素,再用甲醇/氨水混合溶液进行洗脱,然后氮吹至近干,溶解定容,最后经水系微孔滤膜过滤后上机检测。对比2种净化方法发现,虽然其定量分析结果没有显著性差异,但是本研究采用的基于聚酰胺固相萃取柱的净化方法更为简单便捷,且耗时较少,有利于实现大批量蜜饯样品的高效检测。
此外,在本研究所提出的方法中,样品溶液经水系微孔滤膜过滤后再上机检测。对水系微孔滤膜和有机系微孔滤膜的色素透过率进行了对比,如图1所示。研究表明,水系微孔滤膜对色素展现出更好的透过性能,其透过率接近100%,对7种人工合成色素均无明显吸附。
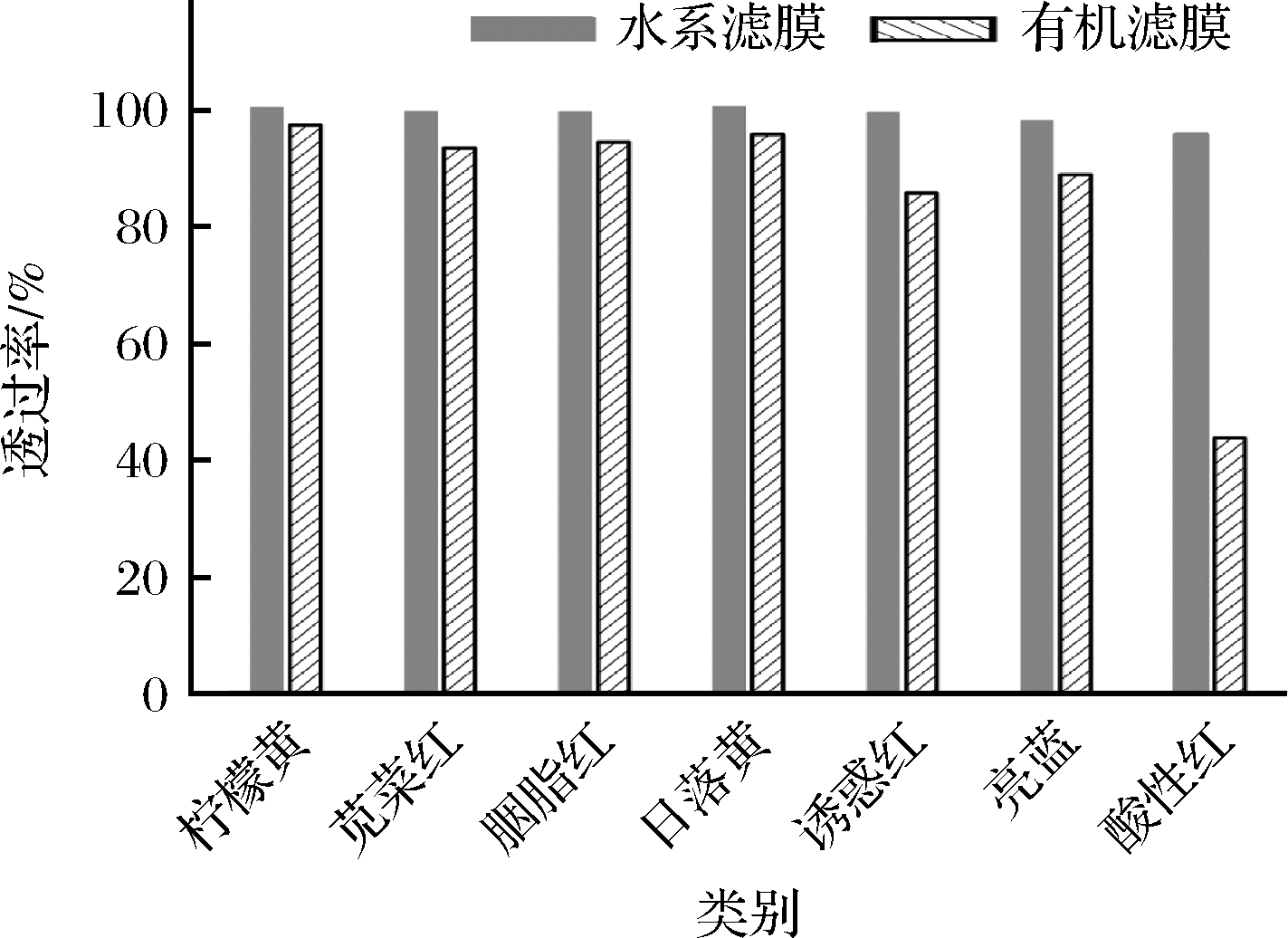
图1 不同滤膜对7种人工合成色素的吸附影响
Fig.1 The adsorption effect of different filter membranes for seven kinds of synthetic colorants
2.3 检测波长的优化
GB/T 5009.35—2016中采用紫外光区的254 nm作为人工合成色素的检测波长,各组分的响应值均较高,但在此紫外波长下的目标物检测容易受到其他因素干扰,如一些杂质也可在此紫外波长下产生吸收,导致出现假峰的可能性较高,从而影响检测结果的准确性。为提高目标物质检测的抗干扰能力,增加检测结果的准确性,选择可见光区的检测波长是一种有效的解决方式。本研究首先对7种人工合成色素进行了全波段扫描,其定性光谱图如图2所示,据此选择428、508、625 nm 3种代表性检测波长开展后续实验。

a-柠檬黄;b-苋菜红;c-胭脂红;d-日落黄;e-诱惑红;f-亮蓝;g-酸性红
图2 七种人工合成色素的定性光谱图
Fig.2 Qualitative spectra of seven kinds of synthetic colorants
本研究进一步对比了样品中各人工合成色素组分分别在428、508、625 nm 3个检测通道下的响应强度,如图3所示。在508 nm波长下,苋菜红、胭脂红、日落黄、诱惑红以及酸性红的响应值较高,但柠檬黄和亮蓝的响应值非常低;在625 nm波长下,亮蓝具有极高的响应值,但其余组分几乎无响应;而在428 nm波长下,各组分均展现出优异的响应性能,其中柠檬黄的响应强度最高,并且各色素具有良好的分离性能,如表3所示。综合考虑抗干扰能力、检测准确性、检测效率以及便捷性等因素,本研究选择可见光区的428 nm作为后续实验的检测波长。
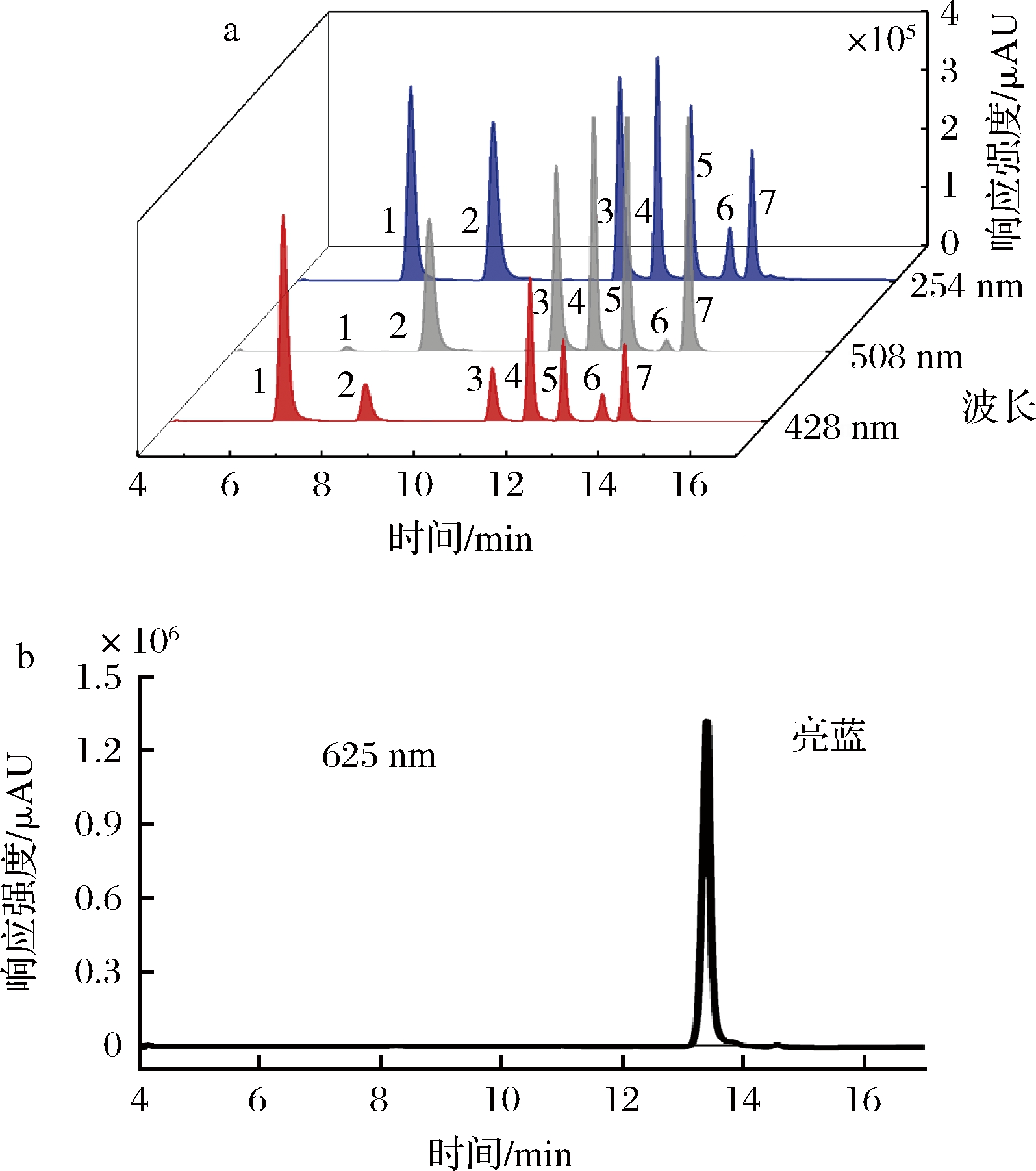
1-柠檬黄;2-苋菜红;3-胭脂红;4-日落黄;5-诱惑红;6-亮蓝;7-酸性红
a-在428、508、254 nm波长下的色谱图;b-在625 nm波长下的色谱图
图3 七种人工合成色素在不同检测波长下的色谱图
Fig.3 The chromatograms of seven kinds of synthetic colorants at different detection wavelengths
表3 七种人工合成色素的保留时间和分离度
Table 3 Retention time and resolution of seven kinds of synthetic colorants
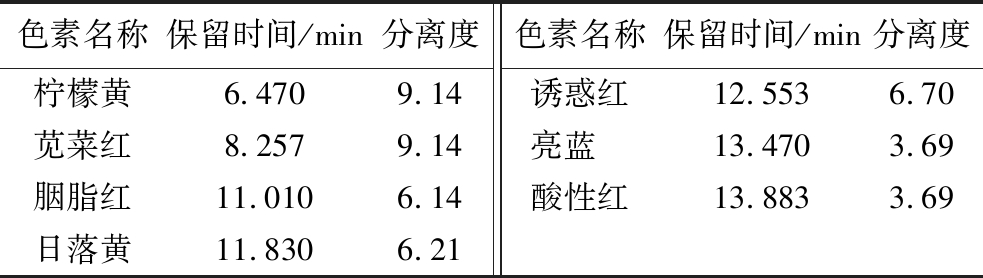
色素名称保留时间/min分离度色素名称保留时间/min分离度柠檬黄6.4709.14诱惑红12.5536.70苋菜红8.2579.14亮蓝 13.4703.69胭脂红11.0106.14酸性红13.8833.69日落黄11.8306.21
2.4 线性范围与检出限
以各分析物的质量浓度X(μg/mL)和峰面积Y(μAU)分别为横、纵坐标绘制标准工作曲线,得到的回归方程和线性相关系数如表4所示。各组分均在0.1~50 μg/mL质量浓度内具有良好的线性关系,线性相关系数均在0.999 0以上。本研究进一步以国标要求的最低检出限0.2 mg/kg作为本方法检出限的考察标准,如图4所示,各人工合成色素组分均展现出明显的响应。因此,本研究所构建的分析方法完全能满足国标的检测要求。
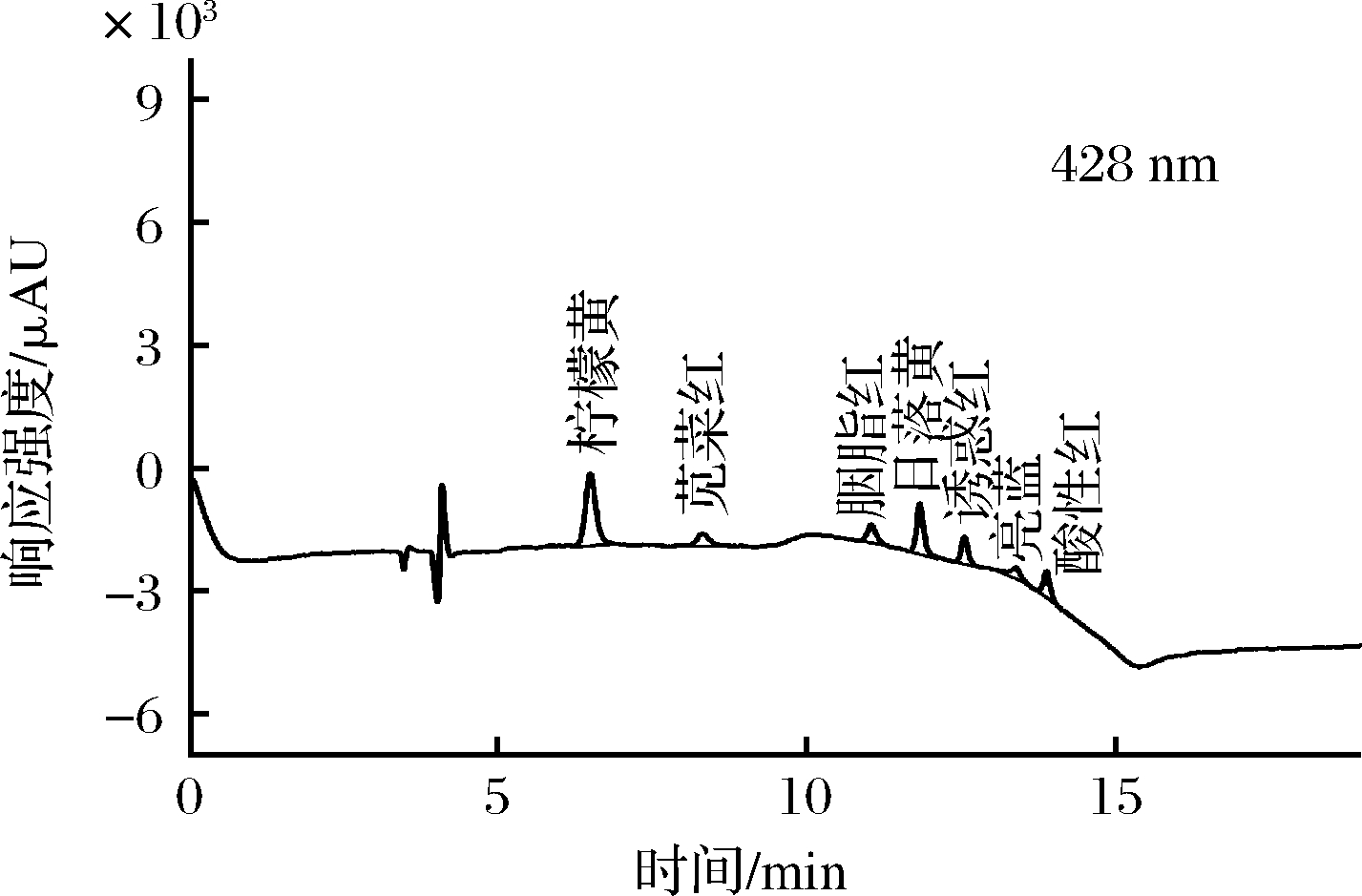
图4 空白样品加标回收色谱图(0.2 mg/kg)
Fig.4 The chromatogram of blank sample recovery at 0.2 mg/kg
表4 蜜饯样品中7中人工合成色素检测方法的线性关系、回收率和精密度
Table 4 The linear relationship, recoveries, and precision of this proposed detection method for seven kinds of synthetic colorants in preserved fruits
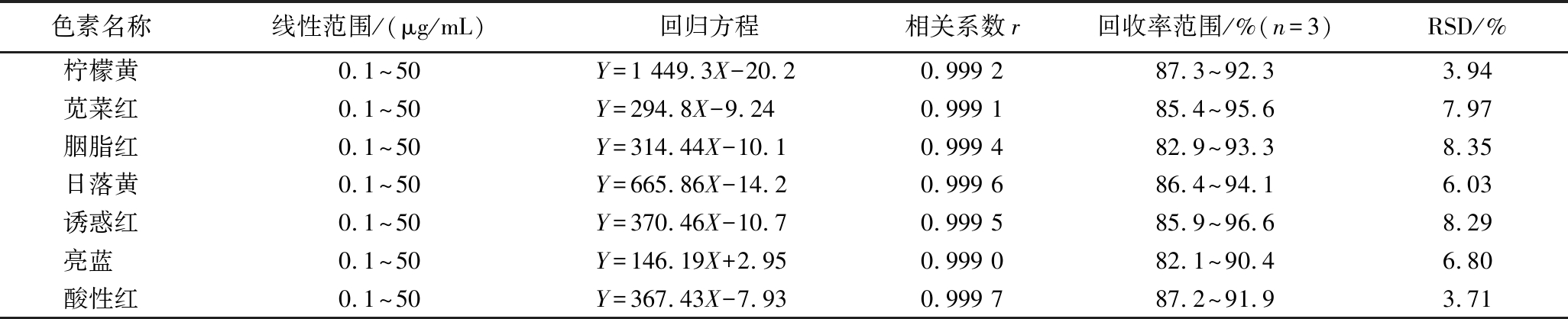
色素名称线性范围/(μg/mL)回归方程相关系数r回收率范围/%(n=3)RSD/%柠檬黄0.1^50Y=1 449.3X-20.20.999 287.3^92.33.94苋菜红0.1^50Y=294.8X-9.240.999 185.4^95.67.97胭脂红0.1^50Y=314.44X-10.10.999 482.9^93.38.35日落黄0.1^50Y=665.86X-14.20.999 686.4^94.16.03诱惑红0.1^50Y=370.46X-10.70.999 585.9^96.68.29亮蓝 0.1^50Y=146.19X+2.950.999 082.1^90.46.80酸性红0.1^50Y=367.43X-7.930.999 787.2^91.93.71
2.5 回收率与精密度
选取各色素组分均未检出的阴性样品分别做3倍、10倍、20倍检出限浓度水平的加标实验,同时加入7种色素,每个浓度水平平行进行3次试验。7种人工合成色素的回收率范围和相对标准偏差(relative standard deviation, RSD)结果见表4,表明本方法具有较好的分析性能。
2.6 风险分析
基于本研究建立的方法对成都及周边地区随机购买的蜜饯类样品(共计565批次)进行人工合成色素检测,包括乌梅、半边梅、情人梅、金桔、猕猴桃干、地瓜干、冬瓜条、桑葚干等,其检测结果详见表5。除诱惑红和酸性红外,柠檬黄、苋菜红、胭脂红、日落黄、亮蓝均有不同程度的检出。亮蓝的检出率较低,仅为0.53%。然而,柠檬黄、苋菜红、胭脂红、日落黄的检出率普遍偏高,其检出率分别达到35.0%、9.4%、20.0%、47.3%,尤其是柠檬黄和日落黄较为显著。特别地,仍有10批次不合格蜜饯样品超过GB 2760—2014中的限值规定,其不合格添加的色素主要是苋菜红、胭脂红、日落黄。
表5 批量蜜饯样品中人工合成色素的检出情况
Table 5 Detection results of synthetic colorants in batches of preserved fruits
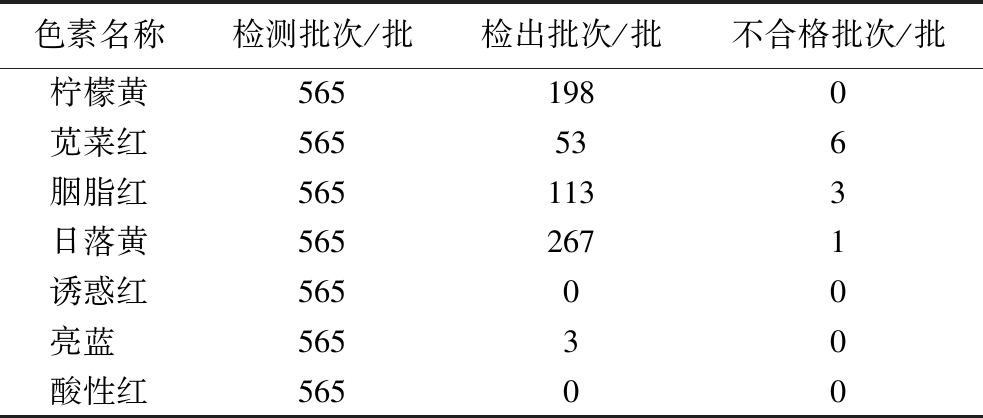
色素名称检测批次/批检出批次/批不合格批次/批柠檬黄5651980苋菜红565536胭脂红5651133日落黄5652671诱惑红56500亮蓝 56530酸性红56500
商家违规添加人工合成色素主要是为了改善蜜饯的色泽,以激发消费者的购买欲。本研究共检测400余批次梅子类蜜饯如乌梅、半边梅、情人梅等,其人工合成色素检出率高达60%;其他种类的蜜饯如猕猴桃干、地瓜干、冬瓜条、桑葚干等食品共检测100余批次,其人工合成色素的检出率较低,约为14.0%。值得注意的是,很多蜜饯样品中往往不止添加一种人工合成色素,如半边梅中就同时检出了柠檬黄和日落黄,如图5所示。一些商家会采取按需调配的方式,在蜜饯食品的制作过程中同时添加多种人工合成色素,这些蜜饯食品的表面更加光滑,色泽也更为艳丽,更易受到消费者的青睐。
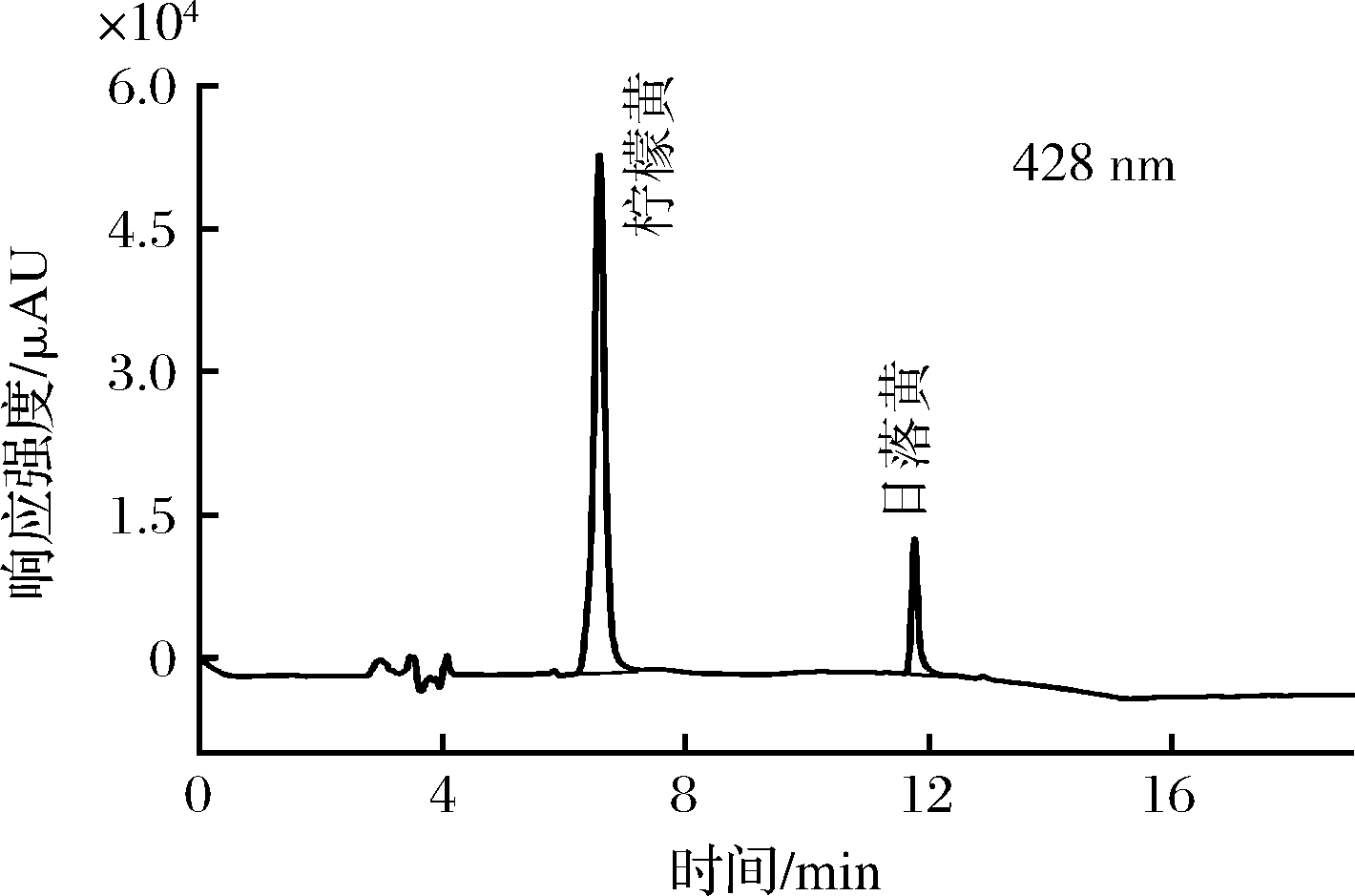
图5 实际样品检测色谱图
Fig.5 The chromatogram of real samples
此外,本研究检测出10批次超限量添加的不合格蜜饯样品,其中1批次为金桔,超标项目为胭脂红;其余不合格9批次均为乌梅,超标项目分别为苋菜红(6批次)、胭脂红(2批次)和日落黄(1批次)。研究表明,蜜饯类食品中人工合成色素的检出率较高,且存在违规添加的现象。过量食用蜜饯食品会对身体健康造成威胁,因而加强市场监管对于确保食品安全以及维护人体健康具有重要意义。
3 结论与讨论
本研究以蜜饯类食品中7种人工合成色素为研究对象,从样品提取、净化和检测方式进行了方法优化,建立了一种适用于批量样品中多种人工合成色素同时检测的高效液相色谱分析技术。结果表明,该方法具有准确度和灵敏度高、线性关系良好、操作便捷、普适性强等特点,其检出限为0.2 mg/kg,相关系数均在0.999 0以上,平均回收率和RSD分别为82.1%~96.6%和3.71%~8.35%。此外,本研究进一步基于该方法对来自成都及周边地区多批次市售蜜饯类样品进行了检测,研究表明,人工合成色素在蜜饯类食品中频繁检出,且过量添加现象依然存在,因此为保障人体健康,加强市场监管具有重要意义。
[1] SILVA M M, REBOREDO F H, LIDON F C.Food colour additives:A synoptical overview on their chemical properties, applications in food products, and health side effects[J].Foods, 2022, 11(3):379.
[2] WU W L, LIU S Y, GUO T R, et al. Rapid screening of 70 colorants in dyeable foods by using ultra-high-performance liquid chromatography-hybrid quadrupole-Orbitrap mass spectrometry with customized accurate-mass database and mass spectral library[J].Food Chemistry, 2021, 356:129643.
[3] ![]() R.Recent trends in methods used to obtain natural food colorants by freeze-drying[J].Trends in Food Science &Technology, 2020, 102:39-50.
R.Recent trends in methods used to obtain natural food colorants by freeze-drying[J].Trends in Food Science &Technology, 2020, 102:39-50.
[4] ZHANG J F, HOU X, AHMAD H, et al. Assessment of free radicals scavenging activity of seven natural pigments and protective effects in AAPH-challenged chicken erythrocytes[J].Food Chemistry, 2014, 145:57-65.
[5] 高波, 周志军, 苏记.天然食用色素的特性、应用、安全性评价及安全控制[J].食品安全导刊, 2019(24):55.
GAO B, ZHOU Z J, SU J.Characteristics, application, safety evaluation and safety control of natural edible pigment[J].China Food Safety Magazine, 2019(24):55.
[6] FENG J H, CERNIGLIA C E, CHEN H Z.Toxicological significance of azo dye metabolism by human intestinal microbiota[J].Frontiers in Bioscience (Elite Edition), 2012, 4(2):568-586.
[7] PRABOWO C P S, EUN H, YANG D, et al. Production of natural colorants by metabolically engineered microorganisms[J].Trends in Chemistry, 2022, 4(7):608-626.
[8] FRIED R, OPREA I, FLECK K, et al. Biogenic colourants in the textile industry-a promising and sustainable alternative to synthetic dyes[J].Green Chemistry, 2022, 24(1):13-35.
[9] CAO Y, LIU H L, QIN N B, et al. Impact of food additives on the composition and function of gut microbiota:A review[J].Trends in Food Science &Technology, 2020, 99:295-310.
[10] AXON A, MAY F E B, GAUGHAN L E, et al. Tartrazine and sunset yellow are xenoestrogens in a new screening assay to identify modulators of human oestrogen receptor transcriptional activity[J].Toxicology, 2012, 298(1-3):40-51.
[11] WANG H, ZHANG G B, MIA R, et al. Bioreduction (Ag+ to Ag0) and stabilization of silver nanocatalyst using hyaluronate biopolymer for azo-contaminated wastewater treatment[J].Journal of Alloys and Compounds, 2022, 894:162502.
[12] OZDEMIR OLGUN F A, OZTURK B D, APAK R.Determination of synthetic food colorants in powder beverage samples by on-line HPLC-cupric reducing antioxidant capacity (CUPRAC) assay with post-column detection[J].Chromatographia, 2016, 79(3-4):199-208.
[13] ZHANG C E, LIAO R Y, LIU X B, et al. Application of sodium bicarbonate in extraction and determination of synthetic colorant in processed grain products[J].Journal of Food Science and Technology, 2022, 59(5):1855-1864.
[14] 胡晴晴. 化学修饰电极在食用色素中的研究与应用[D].淮北:淮北师范大学, 2017.
HU Q Q.Investigation and application of electrochemical behavior of edible pigment using modified electrode [D].Huaibei:Huaibei Normal University, 2017.
[15] GEORGESCU STATE R, VAN STADEN J K F, STADEN R I S V.Review-Recent trends on the electrochemical sensors used for the determination of tartrazine and sunset yellow FCF from food and beverage products[J].Journal of the Electrochemical Society, 2022, 169(1):017509.
[16] DARABI R, SHABANI-NOOSHABADI M, KARIMI-MALEH H, et al. The potential of electrochemistry for one-pot and sensitive analysis of patent blue V, tartrazine, acid violet 7 and ponceau 4R in foodstuffs using IL/Cu-BTC MOF modified sensor[J].Food Chemistry, 2022, 368:130811.
[17] 夏立娅, 韩媛媛, 匡林鹤, 等.薄层色谱扫描法同时检测豆制品中碱性橙、皂黄、柠檬黄和日落黄以及辣椒粉中酸性橙Ⅱ、丽春红2R和罗丹明B[J].分析试验室, 2010, 29(6):15-18.
XIA L Y, HAN Y Y, KUANG L H, et al.Simultaneous determination of basic orange2,metanil yellow, tartrazine, sunset yellow in bean product and acid orange Ⅱ, ponceau 2R, rhodanmine B in chili powder by thin-layer chromatographic scanning[J].Chinese Journal of Analysis Laboratory, 2010, 29(6):15-18.
[18] YI J, ZENG L W, WU Q Y, et al. Sensitive simultaneous determination of synthetic food colorants in preserved fruit samples by capillary electrophoresis with contactless conductivity detection[J].Food Analytical Methods, 2018, 11(6):1608-1618.
[19] CHEN H X, LU M, HUANG X J.Task specific adsorbent based on porous monolith for efficient capture of synthetic colorants in beverages and preserved fruits prior to chromatographic analysis[J].SSRN Electronic Journal, 2022, 1675:463144.
[20] 郭晓雷, 刘涛, 林兆盛, 等.高效液相色谱法测定市售茶叶中8种人工合成色素及风险分析[J].食品安全质量检测学报, 2020, 11(23):8874-8879.
GUO X L, LIU T, LIN Z S, et al.Determination of 8 kinds of synthetic pigments in teas by high performance liquid chromatography and risk analysis[J].Journal of Food Safety &Quality, 2020, 11(23):8874-8879.
[21] QI P, ZHOU Q Q, LIN Z H, et al. Qualitative screening and quantitative determination of multiclass water-soluble synthetic dyes in foodstuffs by liquid chromatography coupled to quadrupole Orbitrap mass spectrometry[J].Food Chemistry, 2021, 360:129948.
[22] 刘益锋, 李蓉, 张朋杰, 等.超高效液相色谱-串联质谱法同时测定焙烤食品中9种水溶性添加剂的研究[J].中国食品添加剂, 2019, 30(2):137-141.
LIU Y F, LI R, ZHANG P J, et al.Simultaneous determination of nine water-soluble food additives in bakery products by UHPLC-MS[J].China Food Additives, 2019, 30(2):137-141.
[23] 胡文彦, 刘新梅, 刘其南, 等.超声辅助提取-液相色谱-串联质谱法同时测定马卡龙中人工合成色素与天然色素[J].食品安全质量检测学报, 2019, 10(9):2678-2683.
HU W Y, LIU X M, LIU Q N, et al.Simultaneous determination of synthetic and natural pigments in macaron with ultrasound-assisted extraction-liquid chromatography-electrospray ionization tandem mass spectrometry[J].Journal of Food Safety &Quality, 2019, 10(9):2678-2683.
[24] WU H, GAO N N, ZHANG L Z, et al. Automated magnetic solid-phase extraction for synthetic food colorant determination[J].Food Analytical Methods, 2016, 9(3):614-623.
[25] 方益, 戴意飞, 何鹏飞, 等.人工合成色素检测方法研究进展[J].山东化工, 2020, 49(20):44-45.
FANG Y, DAI Y F, HE P F, et al.Research progress of synthetic pigment detection methods[J].Shandong Chemical Industry, 2020, 49(20):44-45.