氟喹诺酮类抗生素(fluoroquinolones, FQs)是第三代喹诺酮类药物,是对细菌DNA旋转酶具有活性抑制作用的一类抗生素,其结构通式如图1所示[1]。FQs因其高效、低毒等特点被广泛应用于畜牧和水产养殖行业中[2]。但研究表明,FQs在动物源食品中残留易引起腹痛、头痛等胃肠道或中枢系统症状,以及QT间期延长、主动脉瘤等不良反应[3]。为了更好监控动物源食品中FQs含量,美国已禁止在动物源食品加工过程中使用FQs[4],日本、欧盟以及我国严格规定了其在动物源食品中最大残留限量(maximum residue limit,MRL),如牛奶和畜禽肌肉组织中恩诺沙星(enrofloxacin,ENR)的MRL均为100 μg/kg,二氟沙星的MRL为400 μg/kg,达氟沙星的MRL分别为200 μ/kg和30 μg/kg;2015年我国农业部第2292号公告禁止在食品动物中使用包括诺氟沙星(norfloxacin,NFX)在内的4种FQs。但《农村农业部办公厅公布的关于2020年度动物及动物产品兽药残留监控结果的通报》中显示,猪肉、鸡蛋等畜禽产品及蜂产品中FQs残留超标现象仍存在,猪肉中检出ENR残留609 μg/kg,高出限量6倍;蜂产品中检出NFX 163 μg/kg(临时限量10 μg/kg)。为满足市场监管需求,相关行业须不断研究便携、准确检测食品中FQs残留的技术。
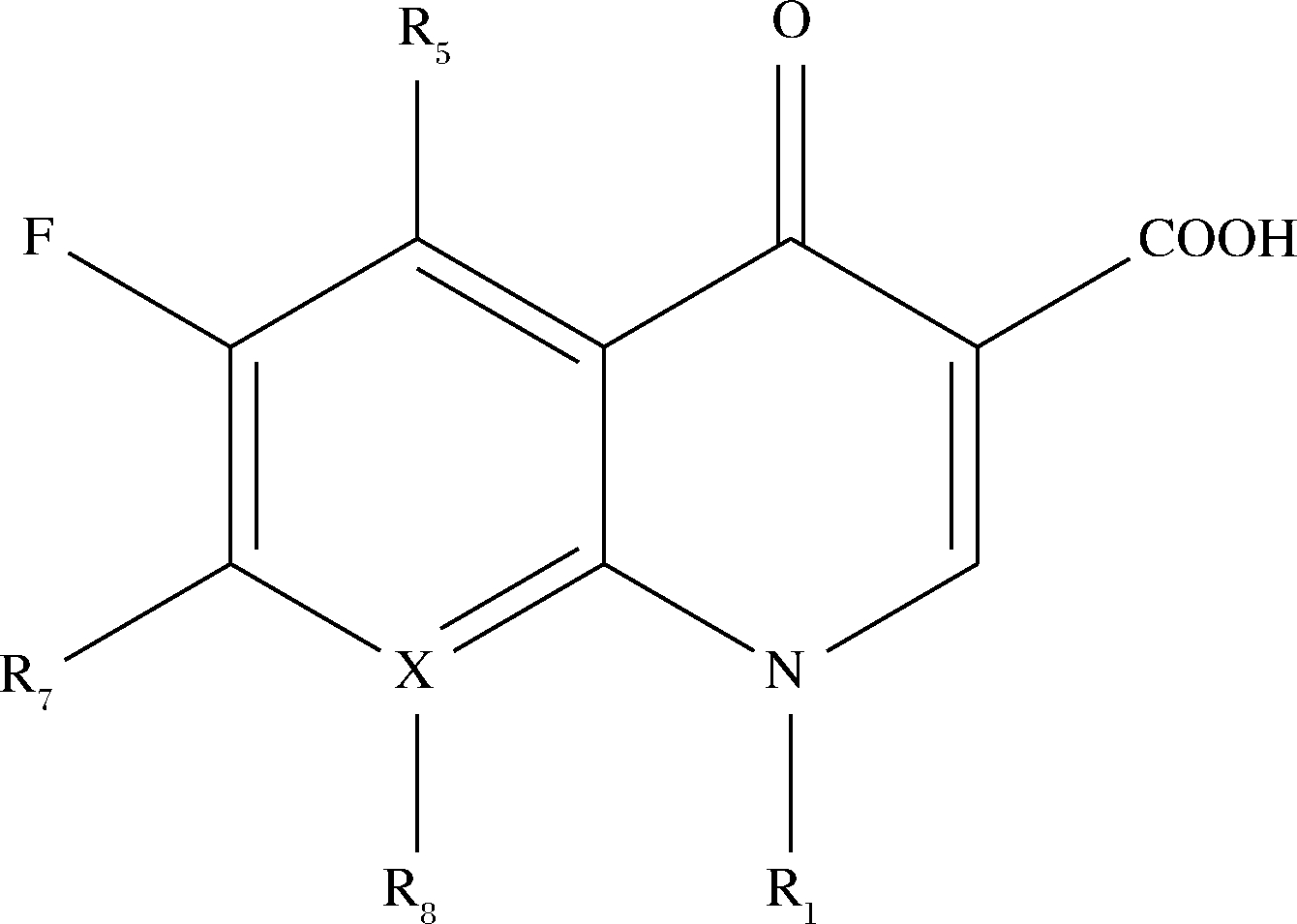
图1 FQs的结构通式[1]
Fig.1 General formula of the structure of FQs
注:其中当X=C时为喹诺酮类;当X=N时为萘啶酮类。
目前,FQs的常规检测主要包括微生物分析法[5]、酶联免疫法[6]、高效液相色谱法(HPLC)[7]、高效液相色谱-质谱法(HPLC/MS)[8]等。HPLC以及HPLC/MS是检测动物源食品中FQs残留的国家标准方法,这类检测方法优势是灵敏度和准确度高,但它存在分析时间较长、预处理步骤繁琐以及残留大量有机溶剂等不足,限制其在快速现场检测中的应用。
近年来,电化学传感器具有便携、快速经济,易实现在线检测等优势,在食品质量安全检测方面拥有广阔的发展前景。
本文回顾了近年来运用电化学传感器在FQs残留检测中的研究进展,分析不同类型电化学传感器的机理和优缺点,重点介绍电化学传感器检测技术在动物源食品(如牛奶、畜禽肉及水产品等)中的应用,并展望了该领域的挑战和发展前景,可为我国动物源食品中FQs残留的防控、检测提供参考。
1 电化学传感器
电化学传感器是利用电化学分析技术对目标物质进行定量检测的装置,包括识别元件和转换元件。其工作原理是通过转换元件将目标物质与敏感元件作用产生的化学信号转变为电信号,由电化学工作站转换为数字信号显示于微机,如图2所示。不同电信号(如电流、电阻及电势等)与目标物质的浓度呈线性关系,可进行定性或定量分析[9]。电化学检测通过三电极[工作电极(working electrode,WE),参比电极(reference electrode,RE)以及对电极(counter electrode,CE)]体系来实现,其中WE的性能决定了电化学传感器的灵敏度。电化学传感器根据转换元件响应信号不同可分为电流型、电位型、电导型[10],其中电流型电化学传感器测试方法多样,如循环伏安法(cyclic voltammetry,CV)、差分脉冲伏安法(differential pulse voltammetry,DPV)、方波脉冲伏安法(square wave voltammetry,SWV)、电化学交流阻抗法(electrochemical impedance spectroscopy,EIS)及线性扫描伏安法(linear sweep voltammetry,LSV)等,是目前应用最广泛的一类电化学传感器。

图2 电化学传感器的工作原理[9]
Fig.2 Principle of operation of electrochemical sensors[9]
FQs的氧化还原行为可使其直接进行电化学研究。FQs电化学氧化机理存在2种情况,均发生在哌嗪基上:第一种氧化机理是一步氧化,即C-7位上哌嗪基末端N原子被氧化成N—OH,如NFX、左氧氟沙星(levofloxacin,LEV)、环丙沙星(ciprofloxacin,CIP)等。YE等[11]研究发现NFX的电化学氧化是位于C-7位上的哌嗪基末端氮原子氧化形成羟基,NFX氧化机理如图3-A所示。第二种氧化机理特指ENR的两步氧化。ANTILÉN等[12]学者研究发现ENR哌嗪基末端氮上的乙基被氧化,形成等量CIP,再次被氧化,最终形成一个三羟基衍生物,其氧化机理如图3-B所示。任何一种情况下,FQs的氧化过程都会在阳极电位范围内呈现不对称伏安曲线图,这是不可逆反应的典型特征。
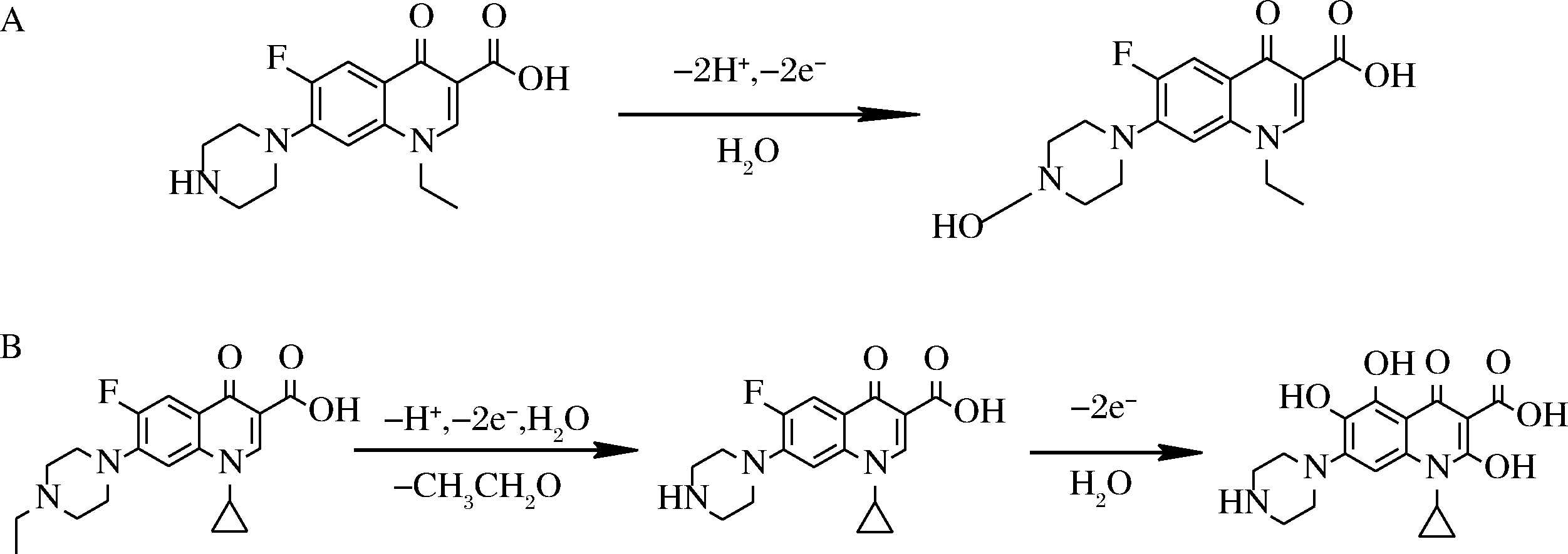
A-NFX的氧化机理[11];B-ENR的氧化机理[12]
图3 FQs两类典型的电化学氧化机理
Fig.3 Typical electrochemical oxidation mechanisms for two types of FQs
2 电化学传感器在FQs检测的应用研究进展
2.1 纳米材料无识别元件电化学传感器
随着纳米技术和纳米科学的发展,纳米材料因其特殊的物理化学特性,具有许多与传统材料不同的性能,如催化活性高、比表面积大、吸附能力强等,因而在电化学传感界面构筑方面具有重要应用。碳纳米材料、金属纳米颗粒和纳米金属氧化物等多种性能独特、导电性优异、信号放大能力强的纳米材料逐渐被引入电化学传感器中。
电化学领域中使用最多的大致可分两类:生物质衍生炭材料和碳纳米材料。
生物质衍生炭材料(biomass-derived carbon,BC)是利用生物质为碳源,通过高温碳化和活化后得到的多功能材料,具有比表面积大、孔隙多、吸附性好及来源丰富等优势[13],通常BC的粒径可分为微孔(<2 nm)、中孔或介孔(2~50 nm)和大孔(>50 nm),后衍生出纳米孔(<100 nm)、次微孔(0.7~100 nm)和超微孔(<0.7 nm)。介孔可提供丰富的离子通道,微孔可以作为物质催化反应的场所,是制备电化学传感器理想的新型电极材料[14],如MADHU等[15]用香蕉茎高温下制备含氮硫等杂原子的活性炭。
碳纳米材料已被广泛用于电化学传感器的制备。其中,碳纳米管和石墨烯更是当前的研究热点。
碳纳米管(carbon nanotubes,CNTs)是由石墨烯片层卷曲形成的管状结构碳材料,按层数不同可分为单壁碳纳米管(single-walled carbon nanotubes,SWCNTs)和多壁碳纳米管(multi-walled carbon nanotubes,MWCNTs)。功能化的CNTs克服易团聚、分散性差等缺陷,增强了导电性和特异性吸附能力[16]。MORAES等[17]制备了一种利用π-π堆积作用将单链DNA(single-stranded DNA,ssDNA)与SWCNTs进行杂化后,自组装于金电极表面的电化学传感器。对LEV的电氧化行为展现了良好的选择性和电催化活性,检测限可达75.2 nmol/L。石墨烯(graphene,GR)是以单层石墨形式存在的二维sp2杂化的六方晶系材料,具有机械强度强以及高载流子速率等优势,是目前应用广泛的二维材料[18]。FARIA等[19]应用化学还原氧化石墨烯(chemical reduction of graphene oxide,CRGO)修饰玻碳电极,检测牛奶中的CIP,检出限达到0.21 μmol/L。相比未修饰电极,由于CRGO的多孔结构,CIP的电氧化电流增强5倍。石墨烯由于制备方法简单、快速,现已成为构建免疫传感器的首选纳米材料之一。
然而单一组分的碳纳米材料无法完全满足电化学检测的需求﹐其在溶剂中的分散性也限制了应用。因此,需对碳纳米材料进行改性和功能化,或者与其他功能性纳米材料复合,改善碳纳米材料的电化学性质,拓展其在电化学传感领域的应用[20]。
2.2 电化学生物传感器
电化学生物传感器是以生物活性物质作为识别元件,与FQs发生特异性结合产生的生物信号转换为电信号,根据检测电信号的变化来定量FQs浓度的装置[21]。根据识别元件的不同可将电化学生物传感器大致分为电化学酶传感器,电化学免疫传感器、电化学微生物传感器、电化学适配体传感器。
2.2.1 电化学酶传感器
电化学酶传感器是利用酶的氧化还原活性中心直接在电极上发生电催化或因抗生素抑制酶活性而改变电信号强弱的传感器[22]。检测FQs的研究较少,大多用于检测青霉素[23]。FQs的抑菌性是由于它能与DNA促旋酶形成复合物,而CARDOSO等[24]利用这一特性,将DNA促旋酶作为识别元件在羧化碳纳米管修饰的丝网印刷碳电极(screen printed carbon electrode,SPCE)上的固定化,成功开发出新型的检测盐酸环丙沙星传感器,并通过对NFX和氨苄青霉素的检测,证实了DNA促旋酶能选择性检测FQs,如图4所示。羧化碳纳米管的添加可显著增强电流信号,且经活化后的羧化碳纳米管表面形成胺化层,增加DNA促旋酶的附着,提高检测灵敏度。

图4 使用DNA促旋酶检测CIP的检测原理图[24]
Fig.4 Schematic diagram of the detection of ciprofloxacin using DNA gyrase[24]
2.2.2 电化学免疫传感器
电化学免疫传感器是采用竞争性免疫反应的原理,使电位发生变化,将某物质浓度信号转化为电信号输出的装置[25]。此综合了电化学传感器的高灵敏度和抗体的高选择性,是检测抗生素残留的良好分析工具。PINACHO等[25]首次以辣根过氧化物酶(horseradish peroxidase,HRP)作为酶示踪剂,将抗FQs抗体(Ab171抗体)固定到磁珠上,磁吸作用下附着到磁性石墨-环氧复合材料电极(magnetic graphite epoxy composite electrode,m-GEC)上,加入CIP标准品后,激活FQs半抗原与Ab171抗体发生免疫应答,通过电极上HBP催化酶促反应产生的电流强度变化进行CIP定量分析,检测原理如图5所示。该传感器无需样品前处理,可直接用于检测牛奶中的CIP,检出限低至2.72×10-2 nmol/L。其中磁珠的使用不仅可以保证竞争性免疫反应与酶促反应高效进行,还可以在磁场作用下快速富集到电极表面,且检测后利用磁场将磁珠分离,达到缩短检测时间,实现电极表面快速更新等效果。

图5 m-GEC检测CIP的检测原理图[25]
Fig.5 Schematic diagram of the detection of ciprofloxacin using m-GEC[25]
2.2.3 电化学微生物传感器
电化学微生物传感器通过化学方法(共价结合或交叉耦合)和物理方法(如吸附或包埋)将微生物(细菌、真菌等)固定在电极上,利用FQs对微生物的抑制作用,通过检测微生物的代谢、基因表达或产生的蛋白质导致电信号变化,实现抗生素的定量检测[26]。姜晓瑜等[27]利用凡纳滨对虾携带的副溶血弧菌构建了一种微生物生长传感器AST法用于检测ENR的最低抑菌浓度(minimal inhibitory concentration,MIC),相比于标准的微量肉汤稀释法,其操作更简便,失误率更低且可以实现自动化。PELLEGRINI等[28]利用与抑制敏感细菌生长相关的二氧化碳生产率,选择大肠杆菌ATCC 11303作为传感器的识别元件,检测牛奶中包括ENR、NFX、单诺沙星等喹诺酮类抗生素和四环素类抗生素,检出限低于25 μg/L。
电化学微生物传感器的优点是检测速度快,灵敏度高,无需样品预处理,样品用量小,但是微生物细胞容易受到pH和温度等生长环境条件的影响,细胞数量难以控制,造成重复性差,稳定性差。
2.2.4 电化学适配体传感器
核酸适配体是运用指数富集方法(systematic evolution of ligands by exponential enrichment,SELEX)从随机寡核苷酸库中筛选出的ssDNA、双链RNA(double-stranded RNA,dsRNA)等能与靶向物质类似抗原抗体间特异性结合的寡核苷酸序列,靶向物质可以是小分子物质(如燃料、药物、氨基酸等)、大分子(如蛋白质)到细胞[29]。与传统抗体相比,适配体可保证与靶向物质之间的高亲和力,且成本低、性能稳定。电化学适配体传感器是通过与目标物质间的相互作用导致固定在电极上的适配体构象改变的传感器,体现在氧化还原电流的增加或减少[30]。因而可以通过体外扩增亲和力高的适配体制备电化学适配体传感器,应用于动物源食品中FQs的检测。SONG等[31]选取具有混合金属价态、良好的生物相容性和电化学活性的钴镍双金属有机骨架材料(2D metal-organic frameworks,2D MOFs)[CoxNi3-x(HITP)2]作为电信号放大装置,体外筛选出ENR 靶向适体序列作为识别元件,制得检测牛奶中痕量ENR残留的电化学适配体传感器,检出限可达5.56×10-5 nmol/L,检测范围为2.78×10-6~2.78×10-3 nmol/L,该传感器具有选择性好、重现性高、稳定性好的优点,2D MOFs具有超薄纳米片结构、粗糙表面、富含氨基的功能和丰富的缺陷,该传感器与其他检测ENR的适配体电化学传感器相比,检测稳定性能最佳。
2.3 分子印迹电化学传感器
分子印迹聚合物(molecularly imprinting polymers,MIPs)是通过模板分子与功能单体间形成复合体,再选用交联剂、引发剂等拓展复合体结构,经洗脱模板分子后生成特定识别模板分子的聚合物空腔。MIPs因其合成简单、重复性好以及识别能力强,广泛应用于食品、医药检测领域[32]。分子印迹电化学传感器是利用模板分子与功能单体间的共价或非共价作用通过电聚合方式制备MIPs的传感器,基本原理如图6所示。相比于传统的MIPs制备方法,电化学制备MIPs过程简单、用时短、可直接在电极上聚合并且聚合物厚度可控等优点[33]。YAN等[34]以ENR为模板分子,将邻苯二胺和吡咯作为功能单体通过一步电聚合法在铅笔石墨电极(pencil graphite electrode,PGE)表面形成能识别ENR的MIPs的分子印迹电化学传感器。对牛奶中ENR残留进行检测,检出限为6.50×10-4 nmol/L,加标回收率为89.7%~97.5%。
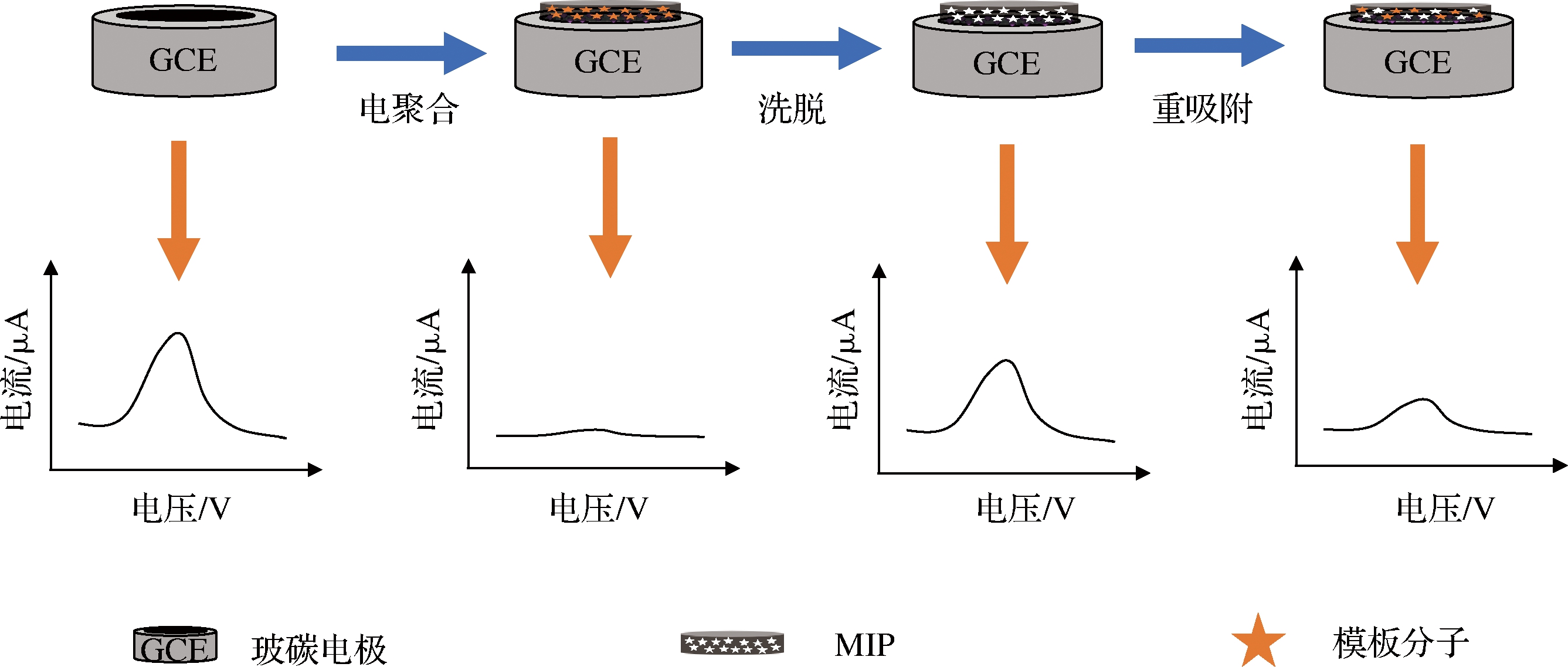
图6 分子印迹电化学传感器的检测原理图
Fig.6 Detection principal diagram of molecularly imprinted electrochemical sensor
不同种类电化学传感器检测FQs的优势与局限性如表1所示。
表1 不同种类电化学传感器检测FQs的优缺点
Table 1 Advantages and disadvantages of different types of electrochemical sensors for the detection of FQs

种类优势局限性纳米材料无识别元件增加电极表面积和电子传输速率,可显著增加灵敏度精密度,选择性差电化学酶传感器制备简单,检测迅速,对待测物专一性强酶易受射线、高温、剧烈 pH 变化等理化因素的影响,使其活性降低甚至失活,稳定性相对较低电化学免疫传感器仪器简易便携,检测效率、灵敏度高电极表面易钝化,长期使用稳定性差电化学微生物传感器操作简单,无需复杂分析仪器,样品用量少微生物细胞易受生长环境条件如pH、温度等影响,且细胞数量难控制,灵敏度,选择性相对较低电化学适配体传感器适配体具有高亲和力和特异性,易化学合成与修饰,无免疫原性稳定性差,易受样品基质干扰分子印迹电化学传感器MIPs 具有类似生物抗体的特异性,制备简单,耐有机溶剂,可重复使用功能单体选择较少,受洗脱条件(洗脱剂、洗脱时间等)影响较大
3 不同电化学传感器在检测动物源食品中FQs的应用
3.1 牛奶监测
牛奶中FQs残留会导致使易感人群出现过敏反应、激素障碍,并造成鲜奶品质下降,影响奶制品产出等危害,已成为奶制品安全问题中消费者、奶农等关注的焦点[35]。电化学传感器应用于牛奶中FQs的监测,已取得良好效果,具体应用见表2。
表2 2011年—2021年中用于检测牛奶中FQs的电化学传感器代表性实例
Table 2 Representative examples of electrochemical sensors used to detect FQs in milk from 2011 to 2021

注:玻碳电极(glassy carbon electrode,GCE);丝网印刷金电极(screen printed gold electrode,SPGE);铅笔石墨电极(pencil graphite electrode,PGE);还原氧化石墨烯(reduced graphene oxide,RGO);共价有机骨架(covalent-organic framework,COF);炭黑(carbon black,CB);聚多巴胺(polydopamine,PDA);聚邻氨基苯酚(poly-o-aminophenol;PoAP);3,5-三(4-氨基苯基)和对苯二醛复合材料[3,5-Tris(4-aminophenyl) and p-phenylenedial,TAPB];聚酰胺-胺包裹的金纳米粒子(polyamide-amine dendritic macromolecules- Au,PAMAM-Au);对氨基苯甲酸(p-aminobenzoic acid,p-ABA);裸磁珠(magnetic bead,MB)。
传感器类型目标物修饰电极电分析技术检出限/(nmol/L)检测范围/(nmol/L)参考文献电化学 传感器 (无识别元件)CIPCRGO/GCESWV2.00×1026.00×103^4.00×104[19]CIPRGO/GCEFLA-AD1.00×1021.00×103^1.00×105[36]CIPAu/C3N4/GN/GCECV/SWV4.20×1026.00×102^1.20×105[37]CIPSUPRAS /AuNPs/activated carbon/GCECV/EIS/DPV0.200.50^25.00[38]CIPCOF@CB@MPDA/GCECV95.35.00×10-2^1.00×105[39]CIPLEVRGO/GCEBIA-AD1.60×1023.00×1021.00×103^5.00×1043.00×103^5.00×104[40]LEVPoAP/graphene quantum dots/GCELSV/DPV10.0050.00^1.00×105[41]ENRTAPB-PDA-COFs/AuNPs/GCESWV41.0050.00^1.00×104,1.00×104^1.20×105[42]电化学生物传感器酶传感器CIP/NFXDNA gyrase/C-SPCECV/EIS/SWV1.5230.20^3.02×104[24]免疫传感器NFXantibody/PAMAM-Au/p-ABA/GCEDPV1.203.13^3.13×104[43]适配体传感器CIPaptamer/ssDNA-binding protein/SPGEDPV0.35-[44]CIPssDNA/CNT-V2O5-CS/SPCECV/EIS1.511.51^24.14[45]CIPMB-aptamer-MB/SPCECV/DPV0.100.30^4.50×102[46]ENRaptamer/CoxNi3-x(HITP)2/Gold electrodeCV/EIS/DPV5.56×10-52.78×10-6^2.78×10-3[31]分子印迹传感器CIPCh-Au MIPs/GCEDPV2.10×1021.00×103^1.00×105[47]CIPBiO4/GO-MMIPs/PGESWSV1.211.18×102^2.23×103[48]ENRp(Py-co-OPD)/PGECV/SWV6.50×10-410.00^1.00×107[34]NFXMIPs/CoFe-MOFs/AuNPs/GCECV1.31×10-45.00×10-3^0.10,0.10^1.00,1.00-6.00[11]
由表2可知,当前应用于牛奶中FQs残留检测的电化学传感器种类全面。无识别元件的电化学传感器依靠纳米材料的传感优势和FQs的电化学氧化行为来实现对FQs的直接检测。金属[38,42]和碳基材料[40-41,43]可增强导电性,多孔或框架结构[39]则可提高对FQs的吸附性,有利于传感器的高灵敏化。此外,基于超分子溶剂(supramolecular solvents,SUPRASs)的电化学传感器鲜有报道。GISSAWONG等[38]将SUPRASs引入电化学传感器,应用于生牛奶、UHT牛奶以及零脂肪牛奶中CIP的残留检测,使检测限比AuNPs/AC修饰的传感器降低约50倍,可为动物源食品中其他类别抗生素监测提供绿色高效的新思路[49]。
电化学酶传感器可提供较好的检测灵敏度,但易受环境因素影响。CARDOSO等[24]以CIP和NFX为检测对象,构建了电化学酶传感器,并与相应免疫传感器比较(以Ab-ENRO/CIPRO为识别元件)。以CIP为例,该传感器的检出限为1.52 nmol/L,相应免疫传感器的检出限为11.3 nmol/L。该研究通过DNA促旋酶传感层增加结合位点,增强了检测方法的准确性,但监测温度会影响读数准确性,需进行温度优化测试。而分子印迹电化学传感器通过改善MIPs的制备方法,进一步提升其检测性能。KUMAR等[48]制备的磁性分子印迹电化学传感器易于磁分离,可实现传感器的重复使用,且样品基质不易造成干扰,在复杂食品样品中具有潜在应用前景,但制备耗时长的问题有待解决。此外,电化学适配体传感器在检测牛奶中FQs残留方面表现出极佳的检测性能。HU等[45]研究了基于SSDNA的电化学传感器,用于评估牛奶中的CIP,即使在结构类似物存在的情况下,也显示出高选择性,且贮存两周性能依旧,但适配体筛选过程复杂且重复率高的问题仍需解决。未来可利用适配体或MIPs与SUPRASs复合修饰电极,实现绿色环保地检测牛奶中FQs残留。
3.2 畜禽肉及副产物监测
我国属于肉类生产和消费大国,肉类总产量占世界总产量33%左右,其中猪肉占到50%以上[50]。畜禽肉中抗生素残留问题受到研究者们的关注。表3中汇总了近年来电化学传感器在畜禽肉及副产物中检测FQs的应用。
表3 2011年-2021年中用于检测畜禽肉及副产物中FQs的电化学传感器代表性实例
Table 3 Representative examples of electrochemical sensors used to detect FQs in livestock and poultry meat and by-products from 2011 to 2021

注:盐酸二氟沙星(difluoxacin hydrochloride,DIF);邻氨基苯酚(o-aminophenol,OAP);免疫磁珠(immunomagnetic beads,IMBs);牛血清白蛋白(bovine serum albumin,BSA)。
传感器类型目标物修饰电极样品基质检出限/(nmol/L)检测范围/(nmol/L)参考文献电化学传感器DIFCuO/CDs/GCE 猪肝3.300.10^1.00×105[51](无识别元件)DIFZnS QDs/GR/Nafion/GCE猪肉2.4040.00^7.00×103[52]电化学免疫NFXantibody/PAMAM-Au/p-ABA/GCE猪肉、鸡蛋1.203.13^3.13×104[43]传感器 ENRIMBs-BSA-ENR/SPGE鸡肉0.0560.28^2.78×103[53]分子印迹电化学传感器ENRp(OPD-OAP)/GCE鸡肉、猪肉、鸡蛋7.00×1022.00×103^4.00×104[54]
由表3可见,基于复合纳米材料的无识别元件电化学传感器,能有效提高其检测效果。胡玥等[51]结合纳米氧化CuO和碳点(carbon dots,CDs),用于猪肝中的盐酸二氟沙星残留的检测,其检出限为3.30 nmol/L,其加标回收率为97.1%~101.2%,RSD为1.2%~2.9%,该方法准确可靠。双功能单体的分子印迹电化学传感器可有效增加结合位点,进一步提升印迹效率。秦思楠等[54]以邻苯二胺和邻氨基苯酚为双功能单体,采用循环伏安法在玻碳电极表面制备MIPs,通过双功能单体印迹产生了多点协同作用,增强结合力的同时也提高了印迹膜的选择性,该传感器已成功应用于鸡蛋、鸡肉及猪肉等畜产品中ENR残留检测。同时,电极基底的改进有助于电化学传感器的发展。何雅雯[53]将磁珠结合3D打印技术制备电化学转化电极,再在此电极上修饰ENR的抗体,实现鸡肉样品中ENR检测。该工作中用丝网印刷电极替换传统电极体系,3D打印电化学池代替电化学工作站,只需滴加100 μL样品(约2滴),即可完成电化学分析,有望实现家禽供应链中抗生素残留的快速检测。此外,该研究选取磺基水杨酸作为提取试剂,利用磺基水杨酸根与蛋白质氨基结合形成不溶性蛋白质盐沉淀的原理,再通过双层滤膜过滤实现固液分离,能基本消除样品基质效应,有利于节省样品前处理时间,为猪肉、羊肉等复杂样品的前处理提供参考。
3.3 水产品监测
水产品作为蛋白质的优质来源,其所含的不饱和脂肪酸对人体大脑发育有益,在城乡居民的食品消费结构中占有十分重要的地位。FQs易在水产品养殖和生产过程中被滥用。近年来电化学传感器在水产品中检测FQs的具体应用见表4。
表4 2011—2021年中用于检测水产品中FQs的电化学传感器代表性实例
Table 4 Representative examples of electrochemical sensors for the detection of FQs in aquatic products from 2011 to 2021
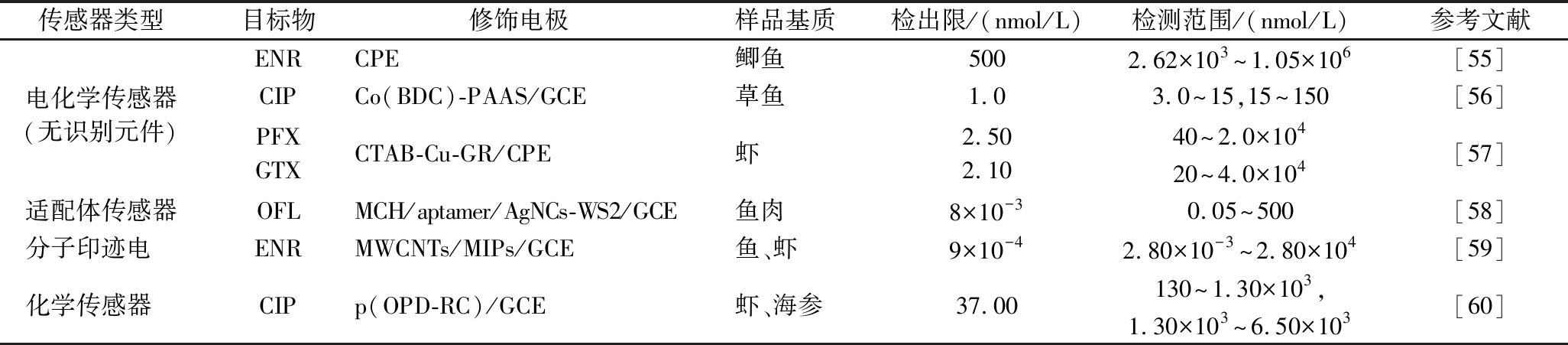
注:碳糊电极(carbon paste electrode,CPE);对苯二甲酸(benzene-p-dicarboxylic acid,BDC);聚丙烯酸钠(sodium polyacrylate,PAAS);十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB);培氟沙星(pefloxacin,PFX);加替沙星(gatifloxacin,GTX)。
传感器类型目标物修饰电极样品基质检出限/(nmol/L)检测范围/(nmol/L)参考文献电化学传感器(无识别元件)ENRCPE鲫鱼5002.62×103^1.05×106[55]CIPCo(BDC)-PAAS/GCE草鱼1.03.0^15,15^150[56]PFXGTXCTAB-Cu-GR/CPE虾2.502.1040^2.0×10420^4.0×104[57]适配体传感器OFLMCH/aptamer/AgNCs-WS2/GCE鱼肉8×10-30.05^500[58]分子印迹电 ENRMWCNTs/MIPs/GCE鱼、虾9×10-42.80×10-3^2.80×104[59]化学传感器 CIPp(OPD-RC)/GCE虾、海参37.00130^1.30×103,1.30×103^6.50×103[60]
由于水产品种类众多,组成成分复杂,其基质效应的探究是提高电化学检测方法准确性的重要保证。杨阿喜等[55]和ZHU等[57]选取了常见的阳离子(如Na+、Ca2+)以及尿素、抗坏血酸等小分子物质进行考察,但基质中的脂质与糖类对检测也存在背景干扰,未有学者对此进行探究。因此,对水产品中FQs的基质效应的探究将是下一个研究热点和难点。
电化学传感器通常仅检测单一目标物,但对能同时检测多种目标物的电化学传感器研究较少。ZHU等[57]开发了基于一种阳离子表面活性剂的电化学传感器,用于同时检测虾中PFX与GTX残留,两者的峰电位相差约400 mV,电流峰不重叠,同时测定时互不干扰。该传感器与现有单独测定PFX或GTX的电化学传感器相比,仅需30 s便可完成检测,其检测限更低,检测范围更宽,为构筑高性能多目标同时检测的电化学传感器提供了一种有效方法和途径。传统分子印迹电化学传感器存在传感信号不稳定、重现性等问题。基于此,CHEN等[59]采用溶胶-凝胶法构建分子印迹电化学传感器,并将其成功应用于鱼和虾中ENR的检测,其检测限可低至0.9 pmol/L,RSD仅为0.38%(n=9),该方法具有良好的灵敏度和精密度,可实现对水产品中超痕量ENR残留的准确检测。
目前,水产品中多种FQs残留能否采用电化学传感器实现同时检测还需深入探讨,基质干扰机理还不明确,对传感识别过程的影响还需进一步分析。今后,可通过使用分子印迹、磁分离固相萃取柱减弱水产品基质的干扰,开发更高效、便携的水产品中FQs的直接监测技术。
4 结语
电化学传感器相较传统FQs检测方法而言更利于实现现场快速检测,如今已在食品检测领域有所突破并日趋成熟。虽然电化学传感器已用于不同类别动物源食品中FQs的高灵敏监测,但许多方法仍处于实验室阶段,在实际应用方面存在着一些挑战:样品基质中最常见的干扰因素是蛋白质,但脂质、糖类以及无机盐等也存在潜在干扰,样品基质效应仍需进一步研究;制备作为信号放大元件的纳米材料的溶剂大多对人体有害;识别元件的选择性需进一步提高。
今后,可在以下几个方面有所突破:第一,可针对不同类别的动物源食品基质探究合适的提取溶剂,研制重复性好的特异性吸附材料用于样品前处理,减少样品基质干扰影响。第二,探索超分子溶剂、低共熔溶剂以及离子液体等绿色溶剂在信号放大方面的作用,开发出绿色、环保的电极修饰材料。第三,创新MIPs的功能单体种类以及合成方法,提升分子印迹电化学传感器的稳定性和重现性。第四,动物源食品中会同时共存多种FQs,开发用于多种FQs无交叉同时检测的电化学传感器可提高检测效率、降低样品消耗和检测成本。第五,与智能技术(如3D打印技术、微流控技术等)联用,设计并研制便携、高效的商业化电化学传感器。只有不断改进和完善电化学检测动物源食品中FQs残留的技术,才能确保消费者健康和动物源食品安全。
[1] PHAM T D M, ZIORA Z M, BLASKOVICH M A T. Quinolone antibiotics[J]. Medicinal Chemistry Communication, 2019, 10(10):1719-1739.
[2] MARIS A S, MODY P, BREWER D J, et al. The fluoroquinolones: An update for the clinical microbiologist[J]. Clinical Microbiology Newsletter, 2021, 43(12):97-107.
[3] VOUGA RIBEIRO N, GOUVEIA MELO R, GUERRA N C, et al. Fluoroquinolones are associated with increased risk of aortic aneurysm or dissection: Systematic review and meta-analysis[J]. Seminars in Thoracic and Cardiovascular Surgery, 2021, 33(4):907-918.
[4] 李倩, 王甲, 张玉洁, 等. 动物性食品中喹诺酮类药物残留检测方法研究进展[J]. 食品安全质量检测学报, 2021, 12(8):3016-3022.
LI Q, WANG J, ZHANG Y J, et al. Research progress on determination methods of quinolone residues in animal food[J]. Journal of Food Safety &Quality, 2021, 12(8):3016-3022.
[5] KANDA M, KUSANO T, KANAI S, et al. Rapid determination of fluoroquinolone residues in honey by a microbiological screening method and liquid chromatography[J]. Journal of Aoac International, 2010, 93(4):1331-1339.
[6] JEON M, PAENG I R. Quantitative detection of tetracycline residues in honey by a simple sensitive immunoassay[J]. Analytica Chimica Acta, 2008, 626(2):180-185.
[7] WENG R, SUN L S, JIANG L P, et al. Electrospun graphene oxide-doped nanofiber-based solid phase extraction followed by high-performance liquid chromatography for the determination of tetracycline antibiotic residues in food samples[J]. Food Analytical Methods, 2019, 12(7):1594-1603.
[8] ZOU W, WEN X K, XIE C H, et al. LC-Q-TOF-MS based plasma metabolomic profile of subclinical pelvic inflammatory disease: A pilot study[J]. Clinica Chimica Acta, 2018, 483:164-169.
[9] KIMMEL D W, LEBLANC G, MESCHIEVITZ M E, et al. Electrochemical sensors and biosensors[J]. Analytical Chemistry, 2012, 84(2):685-707.
[10] 饶钧玥, 吴任之, 曹芸榕, 等. 基于酶的电化学生物传感器在食品检测中应用的研究进展[J]. 食品与发酵工业, 2022, 48(18):337-344.
RAO J Y, WU R Z, CAO Y R, et al. Research progress on the application of enzyme-based electrochemical biosensors in food detection[J]. Food and Fermentation Industries, 2022, 48(18):337-344.
[11] YE C Z, CHEN X G, ZHANG D, et al. Study on the properties and reaction mechanism of polypyrrole@norfloxacin molecularly imprinted electrochemical sensor based on three-dimensional CoFe-MOFs/AuNPs[J]. Electrochimica Acta, 2021, 379:138174.
[12] ANTILÉN M, VALENCIA C, PERALTA E, et al. Enrofloxacin behavior in presence of soil extracted organic matter: An electrochemical approach[J]. Electrochimica Acta, 2017, 244:104-111.
[13] MA Z W, LIU H Q, LÜ Q F. Porous biochar derived from tea saponin for supercapacitor electrode: Effect of preparation technique[J]. Journal of Energy Storage, 2021, 40:102773.
[14] ROSE M, KORENBLIT Y, KOCKRICK E, et al. Hierarchical micro- and mesoporous carbide-derived carbon as a high-performance electrode material in supercapacitors[J]. Small, 2011, 7(8):1108-1117.
[15] MADHU R, VEERAMANI V, CHEN S M. Heteroatom-enriched and renewable banana-stem-derived porous carbon for the electrochemical determination of nitrite in various water samples[J]. Scientific Reports, 2014, 4:4679.
[16] PHAM V L, KIM D G, KO S O. Catalytic degradation of acetaminophen by Fe and N Co-doped multi-walled carbon nanotubes[J]. Environmental Research, 2021, 201:111535.
[17] MORAES F C, SILVA T A, CESARINO I, et al. Antibiotic detection in urine using electrochemical sensors based on vertically aligned carbon nanotubes[J]. Electroanalysis, 2013, 25(9):2092-2099.
[18] YILDIZ G, BOLTON-WARBERG M, AWAJA F. Graphene and graphene oxide for bio-sensing: General properties and the effects of graphene ripples[J]. Acta Biomaterialia, 2021, 131:62-79.
[19] FARIA L, PEREIRA J, AZEVEDO G, et al. Square-wave voltammetry determination of ciprofloxacin in pharmaceutical formulations and milk using a reduced graphene oxide sensor[J]. Journal of the Brazilian Chemical Society, 2019, 30(9): 1947-1954.
[20] SANT’ANNA M V S, CARVALHO S W M M, GEVAERD A, et al. Electrochemical sensor based on biochar and reduced graphene oxide nanocomposite for carbendazim determination[J]. Talanta, 2020, 220:121334.
[21] KAYA H O, CETIN A E, AZIMZADEH M, et al. Pathogen detection with electrochemical biosensors: Advantages, challenges and future perspectives[J]. Journal of Electroanalytical Chemistry, 2021, 882:114989.
[22] MONTEIRO T, ALMEIDA M G. Electrochemical enzyme biosensors revisited: Old solutions for new problems[J]. Critical Reviews in Analytical Chemistry, 2019, 49(1):44-66.
[23] 韩志钟, 吴月婷, 周莹, 等. 青霉素酶-氧化苏木精修饰Au/ZnO/石墨烯基青霉素电化学传感器的研制[J]. 分析化学, 2016, 44(3):377-384.
HAN Z Z, WU Y T, ZHOU Y, et al. A low detection limit penicillin electrochemical biosensor based on penicillinase-hematein Au/ZnO/single graphene nanosheets[J]. Chinese Journal of Analytical Chemistry, 2016, 44(3):377-384.
[24] CARDOSO A R, CARNEIRO L P T, CABRAL-MIRANDA G, et al. Employing bacteria machinery for antibiotic detection: Using DNA gyrase for ciprofloxacin detection[J]. Chemical Engineering Journal, 2021, 409:128135.
[25] PINACHO D, S NCHEZ-BAEZA F, PIVIDORI M I, et al. Electrochemical detection of fluoroquinolone antibiotics in milk using a magneto immunosensor[J]. Sensors, 2014, 14(9):15965-15980.
NCHEZ-BAEZA F, PIVIDORI M I, et al. Electrochemical detection of fluoroquinolone antibiotics in milk using a magneto immunosensor[J]. Sensors, 2014, 14(9):15965-15980.
[26] HAO S A, SUN X X, ZHANG H, et al. Recent development of biofuel cell based self-powered biosensors[J]. Journal of Materials Chemistry B, 2020, 8(16):3393-3407.
[27] 姜晓瑜, 张旭志, 杨倩倩, 等. 微生物生长传感器药敏试验方法与微量肉汤稀释法的对比研究[J]. 渔业科学进展, 2021, 42(1):38-46.
JIANG X Y, ZHANG X Z, YANG Q Q, et al. A comparative study of microbial growth sensor and broth microdilution for antibiotic susceptibility testing[J]. Progress in Fishery Sciences, 2021, 42(1):38-46.
[28] PELLEGRINI G E, CARPICO G, CONI E. Electrochemical sensor for the detection and presumptive identification of quinolone and tetracycline residues in milk[J]. Analytica Chimica Acta, 2004, 520(1-2):13-18.
[29] SHEN J W, LI Y B, GU H S, et al. Recent development of sandwich assay based on the nanobiotechnologies for proteins, nucleic acids, small molecules, and ions[J]. Chemical Reviews, 2014, 114(15):7631-7677.
[30] LI F Q, YU Z G, HAN X D, et al. Electrochemical aptamer-based sensors for food and water analysis: A review[J]. Analytica Chimica Acta, 2019, 1051:1-23.
[31] SONG Y P, XU M R, LIU X, et al. A label-free enrofloxacin electrochemical aptasensor constructed by a semiconducting CoNi-based metal-organic framework (MOF)[J]. Electrochimica Acta, 2021, 368:137609.
[32] MA Y, LI J Y, WANG L S. Porous carbon derived from ZIF-8 modified molecularly imprinted electrochemical sensor for the detection of tert-butyl hydroquinone (TBHQ) in edible oil[J]. Food Chemistry, 2021, 365:130462.
[33] KARTHIKA P, SHANMUGANATHAN S, VISWANATHAN S, et al. Molecularly imprinted polymer-based electrochemical sensor for the determination of endocrine disruptor bisphenola in bovine milk[J]. Food Chemistry, 2021, 363:130287.
[34] YAN C L, ZHANG R X, CHEN Y J, et al. Electrochemical determination of enrofloxacin based on molecularly imprinted polymer via one-step electro-copolymerization of pyrrole and o-phenylenediamine[J]. Journal of Electroanalytical Chemistry, 2017, 806:130-135.
[35] 张建伟, 孟蕾, 吴志明, 等. 牛奶中兽药残留检测前处理技术研究进展[J]. 食品安全质量检测学报, 2021, 12(22):8745-8751.
ZHANG J W, MENG L, WU Z M, et al. Research progress of pretreatment technology for detection of veterinary drug residues in milk[J]. Journal of Food Safety &Quality, 2021, 12(22):8745-8751.
[36] FARIA L V, LISBOA T P, ALVES G F, et al. Electrochemical study of different sensors for simple and fast quantification of ciprofloxacin in pharmaceutical formulations and bovine milk[J]. Electroanalysis, 2020, 32(10):2266-2272.
[37] YUAN Y H, ZHANG F F, WANG H Y, et al. A sensor based on Au nanoparticles/carbon nitride/graphene composites for the detection of chloramphenicol and ciprofloxacin[J]. ECS Journal of Solid State Science and Technology, 2018, 7(12): M201-M208.
[38] GISSAWONG N, SRIJARANAI S, BOONCHIANGMA S, et al. An electrochemical sensor for voltammetric detection of ciprofloxacin using a glassy carbon electrode modified with activated carbon, gold nanoparticles and supramolecular solvent[J]. Microchimica Acta, 2021, 188(6):208.
[39] 孙玉奉. 纳米材料基电化学传感器的构建及其对抗生素的检测方法与机理研究[D]. 泰安: 山东农业大学, 2021.
SUN Y F. Studying on the construction of electrochemical sensors based on nanomaterial for antibiotics detection and mechanism[D]. Taian: Shandong Agricultural University, 2021.
[40] FARIA L V, FARIAS D M, LISBOA T P, et al. Batch injection analysis with amperometric detection for fluoroquinolone determination in urine, pharmaceutical formulations, and milk samples using a reduced graphene oxide-modified glassy carbon electrode[J]. Analytical and Bioanalytical Chemistry, 2022, 414(18):5309-5318.
[41] HUANG J Y, BAO T, HU T X, et al. Voltammetric determination of levofloxacin using a glassy carbon electrode modified with poly(o-aminophenol) and graphene quantum dots[J]. Microchimica Acta, 2017, 184(1):127-135.
[42] LU S Y, WANG S L, WU P, et al. A composite prepared from covalent organic framework and gold nanoparticles for the electrochemical determination of enrofloxacin[J]. Advanced Powder Technology, 2021, 32(6):2106-2115.
[43] LIU B, LI M, ZHAO Y S, et al. A sensitive electrochemical immunosensor based on PAMAM dendrimer-encapsulated Au for detection of norfloxacin in animal-derived foods[J]. Sensors, 2018, 18(6):1946.
[44] ABNOUS K, DANESH N M, ALIBOLANDI M, et al. A novel electrochemical aptasensor for ultrasensitive detection of fluoroquinolones based on single-stranded DNA-binding protein[J]. Sensors and Actuators B: Chemical, 2017, 240:100-106.
[45] HU X B, GOUD K Y, KUMAR V S, et al. Disposable electrochemical aptasensor based on carbon nanotubes-V2O5-chitosan nanocomposite for detection of ciprofloxacin[J]. Sensors and Actuators B: Chemical, 2018, 268:278-286.
[46] TAGHDISI HEIDARIAN S M, TAVANAEE SANI A, DANESH N M, et al. A novel electrochemical approach for the ultrasensitive detection of fluoroquinolones based on a double-labelled aptamer to surpass complementary strands of aptamer lying flat[J]. Sensors and Actuators B: Chemical, 2021, 334:129632.
[47] SURYA S G, KHATOON S, LAHCEN A A, et al. A chitosan gold nanoparticles molecularly imprinted polymer based ciprofloxacin sensor[J]. RSC Advances, 2020, 10(22):12823-12832.
[48] KUMAR S, KARFA P, MAJHI K C, et al. Photocatalytic, fluorescent BiPO4@Graphene oxide based magnetic molecularly imprinted polymer for detection, removal and degradation of ciprofloxacin[J]. Materials Science and Engineering: C, 2020, 111:110777.
[49] 陈萌, 刘艺静, 郭兴洲, 等. 超分子溶剂在样品前处理与检测技术中的应用研究进展[J]. 分析测试学报, 2022, 41(1):22-31.
CHEN M, LIU Y J, GUO X Z, et al. Advances on applications of supramolecular solvents in sample pretreatment and analytical techniques[J]. Journal of Instrumental Analysis, 2022, 41(1):22-31.
[50] 刘九生. 国际禽肉消费市场需求分析[J]. 中国畜牧业, 2020(10):42-44.
LIU J S. Analysis on international demand of poultry meat consumption market[J]. China Animal Industry, 2020(10):42-44.
[51] 胡玥, 王月, 吴可心, 等. 纳米氧化铜修饰电极的制备及对盐酸二氟沙星检测[J]. 分子科学学报, 2020, 36(5):412-416.
HU Y, WANG Y, WU K X, et al. Preparation of nano-copper oxide modified electrode and detection of difluoxacin hydrochloride[J]. Journal of Molecular Science, 2020, 36(5):412-416.
[52] 赖木深. 基于量子点的抗菌药电化学和荧光传感研究[D]. 广州: 广东药科大学, 2019.
LAI M S. Studies on electrochemical and fluorescence sensing of antibacterial agents based on quantum dots[D]. Guangzhou: Guangdong Pharmaceutical University, 2019.
[53] 何雅雯. 磁性纳米材料电化学转化方法在家禽产品抗生素残留检测的应用[D]. 杭州: 浙江大学, 2020.
HE Y W. Magnetic nanoparticle based electrochemical conversion method for detection of antibiotic residues in poultry products[D]. Hangzhou: Zhejiang University, 2020.
[54] 秦思楠, 唐录华, 高文惠. 恩诺沙星分子印迹电化学传感器的制备及其在食品快速检测中的应用[J]. 中国生物工程杂志, 2019, 39(3):65-74.
QIN S N, TANG L H, GAO W H. Preparation of enrofloxacin molecular imprinting electro-chemical sensor and its application to rapid detection of foods[J]. China Biotechnology, 2019, 39(3):65-74.
[55] 杨阿喜, 胡效亚. 鲫鱼体内恩诺沙星的伏安法测定[J]. 食品科技, 2011, 36(12):302-305; 309.
YANG A X, HU X Y. Determination of enrofloxacin in crucian samples by voltametry[J]. Food Science and Technology, 2011, 36(12):302-305; 309.
[56] 陈宏, 王悦, 张文婷, 等. 金属有机骨架材料构建环丙沙星电化学传感器的研究[J]. 化学通报, 2021, 84(2):167-171.
CHEN H, WANG Y, ZHANG W T, et al. Determination of ciprofloxacin by electrochemical sensor based on metal organic framework material[J]. Chemistry, 2021, 84(2):167-171.
[57] ZHU M F, LI R, LAI M S, et al. Copper nanoparticles incorporating a cationic surfactant-graphene modified carbon paste electrode for the simultaneous determination of gatifloxacin and pefloxacin[J]. Journal of Electroanalytical Chemistry, 2020, 857:113730.
[58] 王倩倩. 新型电化学适配体传感器的制备及其在食品安全检测中的应用研究[D]. 济南: 山东师范大学, 2019.
WANG Q Q. Preparation of novel electrochemical aptamer sensor and its application in food safety detection[D]. Jinan: Shandong Normal University, 2019.
[59] CHEN J L, TAN L J, QU K M, et al. Novel electrochemical sensor modified with molecularly imprinted polymers for determination of enrofloxacin in marine environment[J]. Microchimica Acta, 2022, 189(3):95.
[60] 张羽. 修饰电极电化学方法检测水产品中渔药残留[D]. 锦州: 渤海大学, 2017.
ZHANG Y. Determination of fishery drugs residues in aquatic products by modified electrode electrochemical method[D]. Jinzhou: Bohai University, 2017.