蛋白质凝胶性、乳化性、起泡性等重要功能因多糖的参与得以改善,进而改变食品质构及加工特性,可用于提高乳液状食品货架期和改善食品品质。蛋白质-多糖相互作用在食品行业及生命体信号传导、免疫应答、细胞黏附、病菌感染等许多细胞识别过程中发挥重要作用,蛋白质和多糖的相互作用引起许多科学领域的广泛兴趣。蛋白质和多糖之间的关联相互作用是连续相和界面处的络合及凝胶形成的主要基础,传统上用于改善食品制造中各种食品胶体(分散体、乳液、泡沫、凝胶及其混合变体)的物理稳定性和结构特征。开菲尔胞外多糖(Kefiran)与各种微生物形成了开菲尔粒结构的骨架,并可以保护开菲尔粒免受外部微生物的危害。与其他多糖相比,Kefiran具有显著的抗菌和抗真菌特性、抗肿瘤、抗氧化、抗炎、减少血清胆固醇水平和调节肠道免疫系统等功能特性。经过许多学者研究发现,体系中乳清蛋白(whey protein,WP)的聚集与乳清蛋白和多糖之间的相互作用有关[1]。HUAN等[2]研究了不同多糖对冷凝乳清蛋白凝胶性质的影响。DE JONG等[3]和曾令鹤等[4]研究了不同多糖与乳清蛋白混合体系微观结构的影响。谢建华等[5]研究得出一定比例的乳清蛋白-魔芋葡甘聚糖混合体系表现出协同作用。微生物多糖被用作食品添加剂在食品工业中被广泛应用。所以对Kefiran与乳清蛋白相互作用的研究对食品工业的发展及Kefiran的开发研究具有重要意义。
1 材料与方法
1.1 材料与试剂
WP,恒天然合作社集团有限公司;Kefiran,本实验室提取自开菲尔发酵乳[6]。
1.2 仪器与设备
Nano-ZS90激光粒度仪,英国马尔文公司;TM400SEM扫描电镜,日立高新技术那珂事业所;FL970Plus荧光分光光度计,上海天美有限公司;T6-新世纪紫外-可见分光光度仪,北京普析通用仪器有限责任公司;DHR-2 DHR流变仪,美国TA Instruments公司。
1.3 实验方法
1.3.1 Kefiran/WP混合溶液的制备
WP溶液为10%(质量分数);Kefiran/WP溶液是含有10%(质量分数)的WP和2%(质量分数)的Kefiran。28 ℃的恒温磁力搅拌水浴1.5 h后取出。及时进行以下试验。
1.3.2 粒径测定
将样品在通用分析模式下进行粒径测定。条件为分散剂为水的折射率为1.333,样品颗粒的折射率为1.520,波长为633 nm,每个样品测定3次,得到平均粒径。
1.3.3 Zeta-电位测定
将样品稀释后置于激光粒度仪中进行Zeta-电位的测定。温度25 ℃,每个样品进行3次平行试验。
采用体积分布进行数据统计,分别选取d(0.1)、d(0.5)、d(0.9)及峰的分布宽度[7]进行表示。分布宽度的计算如公式(1)所示:
分布宽度![]()
(1)
式中:d(0.1)、d(0.5)、d(0.9)分别表示样品的累计粒径分布数达到10%、50%、90%时所对应的粒径。
1.3.4 紫外/可见光谱扫描
将样品置于石英比色皿中用紫外分光光度计进行全波长扫描。温度25 ℃,扫描波长220~400 nm,采样间隔1 nm,每个样品进行3次平行试验。
1.3.5 内源性荧光光谱的测定
将样品置于专用比色皿中用荧光分光光度计进行测定。温度25 ℃,激发波长295 nm,扫描范围310~440 nm,扫描速率240 nm/min,采样间隔1 nm,每个样品进行3次平行试验。
1.3.6 流变学特性研究
采用DHR流变仪对不同样品溶液进行流变学特性研究。通过在10~1 000 s-1剪切速率下测定黏度的变化。通过应力扫描观察储能模量(G′)和损耗模量(G″)的变化。通过0.1~100 Hz剪切振荡频率下测定表观黏度的变化。
1.3.7 数据分析
本实验用Design-Expert 13分析软件进行响应面分析,所有数据通过SPSS 23统计软件进行方差分析,之后用origin 2019b软件进行做图。
2 结果与分析
2.1 粒径测定
粒径分布情况可以反映溶液中多糖和蛋白质的相互作用,也是判断溶液是否均一的重要指标[8]。粒度的累积分布图表示颗粒从最小到某一代表粒径值范围内的颗粒占总的颗粒的百分比含量。d(0.1)表示粒度累积分布(0~100%)中10%所对应的直径,d(0.5)和d(0.9)同理,其中d(0.5)是中值粒径,是粒度大小的典型值。D[3,2]表面积加权平均粒径,D[4,3]体积加权平均粒径,两者差值表明颗粒的规则度及分布状态。均匀性系数越高说明颗粒越集中,粒度分布范围越窄,表示样品中颗粒分布的均匀性越好,反之则越分散。
从图1、表1和表2中可以看出,Kefiran粒径<0.57 μm的占到10%;<0.76 μm的占到50%;<1 μm的占到90%;WP粒径<0.08 μm的占到10%;<0.17 μm的占到50%;<0.75 μm的占到90%;Kefiran/WP(1∶5)粒径<0.12 μm的占到10%;<7 μm的占到50%;<69.9 μm的占到90%,且7组实验样品中,d(0.1),d(0.5)和d(0.9)的含量均存在显著差异(P<0.05)。Kefiran D[3,2]和D[4,3]的差值为0.037 μm,峰分布宽度为0.558,d(0.5)为0.765 μm,说明2% Kefiran溶液中多糖颗粒的形状相对比较规则,50%的颗粒粒径集中于 0.765 μm左右。与Kefiran相比,10% WP溶液和2% WP溶液中蛋白颗粒粒度分布较宽,50%的颗粒粒径分别集中于0.173 μm和0.167 μm左右,相差不大。但考虑10% WP溶液残差值<3%,理论光强和实际光强信号良好匹配<1%,因此,后期混合样品采用10% WP溶液。
表1 不同溶液粒径累计分布结果
Table 1 Cumulative particle size distribution results of different solutions
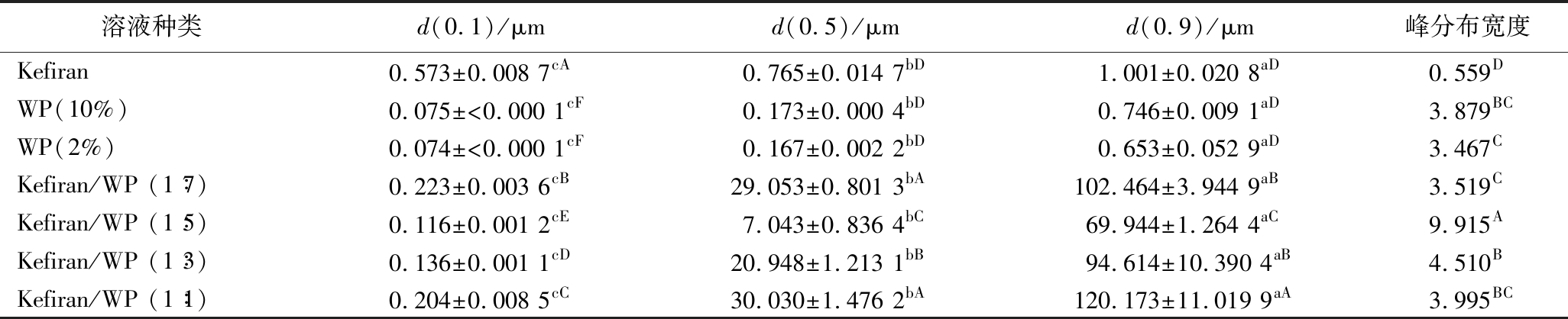
注:小写字母(a~c)代表组内具有显著性差异(P<0.05),大写字母(A~F)代表组间具有显著性差异(P<0.05)(下同)。
溶液种类d(0.1)/μmd(0.5)/μmd(0.9)/μm峰分布宽度Kefiran0.573±0.008 7cA0.765±0.014 7bD1.001±0.020 8aD0.559DWP(10%)0.075±<0.000 1cF0.173±0.000 4bD0.746±0.009 1aD3.879BCWP(2%)0.074±<0.000 1cF0.167±0.002 2bD0.653±0.052 9aD3.467CKefiran/WP (1∶7)0.223±0.003 6cB29.053±0.801 3bA102.464±3.944 9aB3.519CKefiran/WP (1∶5)0.116±0.001 2cE7.043±0.836 4bC69.944±1.264 4aC9.915AKefiran/WP (1∶3) 0.136±0.001 1cD20.948±1.213 1bB94.614±10.390 4aB4.510BKefiran/WP (1∶1)0.204±0.008 5cC30.030±1.476 2bA120.173±11.019 9aA3.995BC
表2 不同溶液的表面积和体积的加权平均粒径及均匀性系数
Table 2 The weighted average particle size of surface area and volume and uniformity coefficient of different solutions
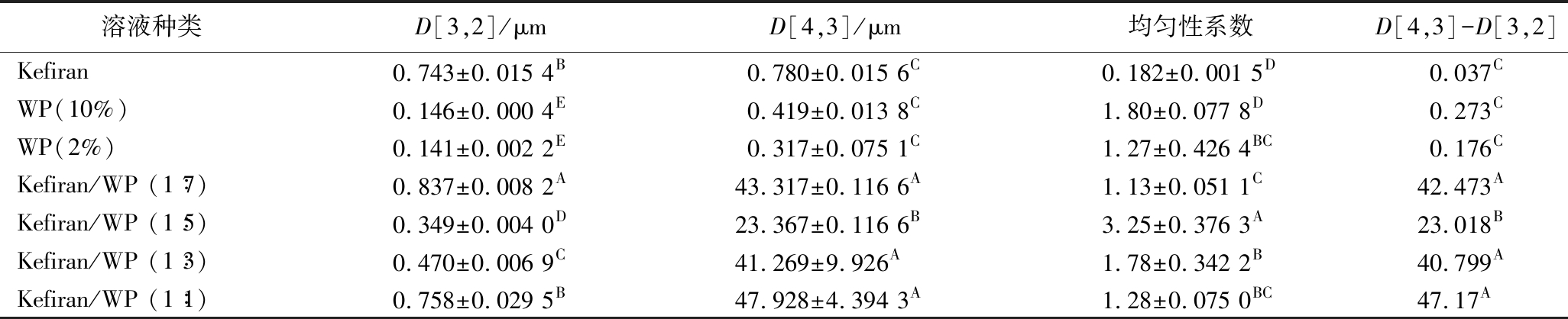
溶液种类D[3,2]/μmD[4,3]/μm均匀性系数D[4,3]-D[3,2]Kefiran 0.743±0.015 4B0.780±0.015 6C0.182±0.001 5D0.037CWP(10%) 0.146±0.000 4E0.419±0.013 8C1.80±0.077 8D0.273CWP(2%) 0.141±0.002 2E0.317±0.075 1C 1.27±0.426 4BC0.176CKefiran/WP (1∶7)0.837±0.008 2A43.317±0.116 6A 1.13±0.051 1C42.473AKefiran/WP (1∶5)0.349±0.004 0D 23.367±0.116 6B 3.25±0.376 3A 23.018BKefiran/WP (1∶3)0.470±0.006 9C 41.269±9.926A1.78±0.342 2B 40.799AKefiran/WP (1∶1)0.758±0.029 5B 47.928±4.394 3A 1.28±0.075 0BC47.17A
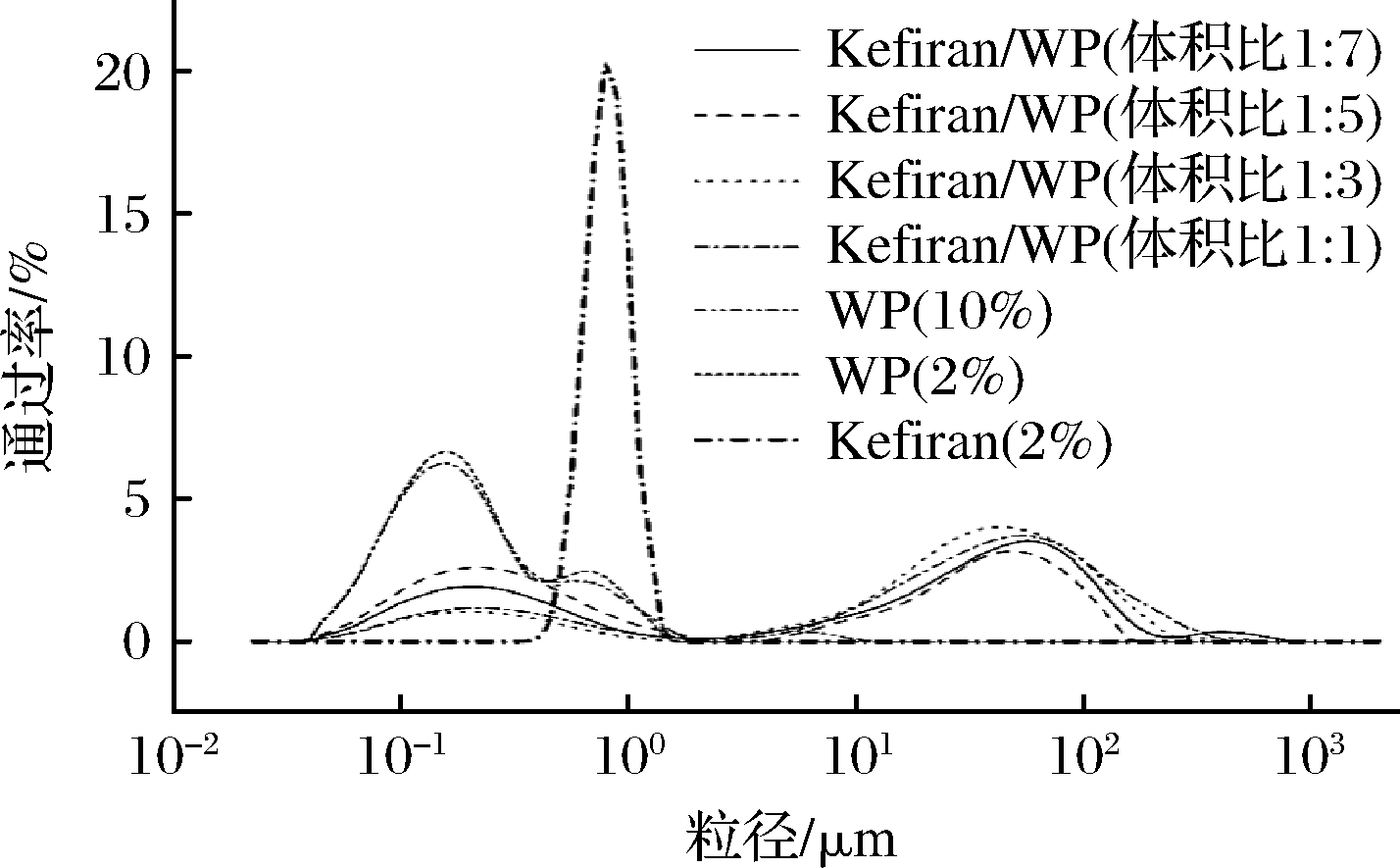
图1 不同溶液的粒径分布
Fig.1 Particle size distribution of various solutions
WP与Kefiran带相同电荷,由于热力不相容现象[9],混合溶液中形成了WP分散相和Kefiran分散相,蛋白质肽链和暴露出来的疏水基团由于静电相互作用和疏水相互作用形成聚集体,导致Kefiran/WP溶液粒径增大。因此,2% Kefiran溶液与10% WP混合后,粒度分布较2% Kefiran溶液和10% WP溶液变大。其中,Kefiran/WP(1∶5)粒度分布大于其他3种混合样品,峰的分布宽度较其他3种混合样品宽(P<0.05),50%粒径集中于7.043 μm左右。且Kefiran/WP(1∶5)均匀性系数明显高于其他3种混合样品(P<0.05),说明Kefiran/WP(1∶5)混合样品中颗粒分布的均匀性较好。因此,后期以Kefiran/WP(1∶5)混合样品为研究对象,进行Kefiran和WP互作关系的进一步研究。
2.2 Zeta-电位测定
Zeta-电位用来测定样品的表面电荷密度以及带电性质,也可以用来反映WP和多糖之间的静电作用程度,进一步反映溶液的稳定性[10]。Kefiran电位值为-2.09 mV,WP的Zeta电位值约为-30.37 mV,混合溶液Kefiran/WP的Zeta-电位均处于Kefiran与WP之间,为-24.47 mV,混合溶液的Zeta电位值为-20 ~-30 mV(图2),属于比较稳定的溶液,这一现象与MA等[11]的研究结果类似。
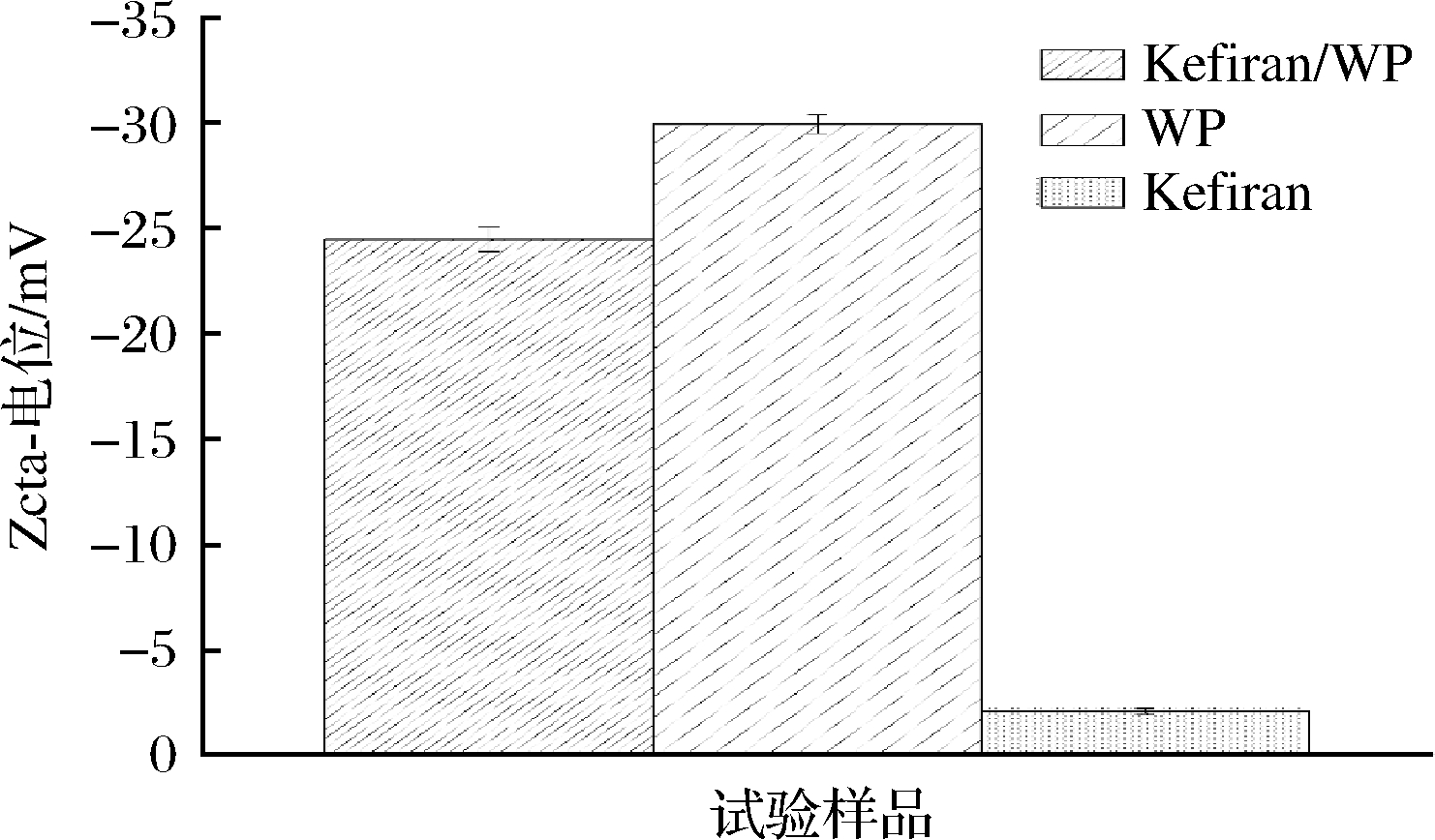
图2 不同溶液的Zeta-电位的影响
Fig.2 Effects on the Zeta potential of various solutions
2.3 紫外/可见光谱扫描
为了进一步分析乳蛋白与多糖之间的相互作用,分别测定了不同样品溶液的紫外光谱图,如图3所示,紫外-可见吸收光谱在280 nm处可观察到特征吸收峰,吸收峰主要由芳香族氨基酸生色团(色氨酸吲哚环和酪氨酸苯环)的π-π*跃迁所致。从图3和图4可以看出,不同样品溶液的最大吸收波长以及紫外吸收强度均发生了变化,可能是由于蛋白质肽链展开,含有共轭双键的酪氨酸、色氨酸等芳香族氨基酸暴露出来导致发生了变化[12]。在Kefiran/WP混合体系中,Kefiran/WP混合溶液的吸收峰强度降低,最大吸收峰相比于WP发生红移,这可能是因为加入的Kefiran与蛋白质结合,导致疏水氨基酸基团被包裹[13]。
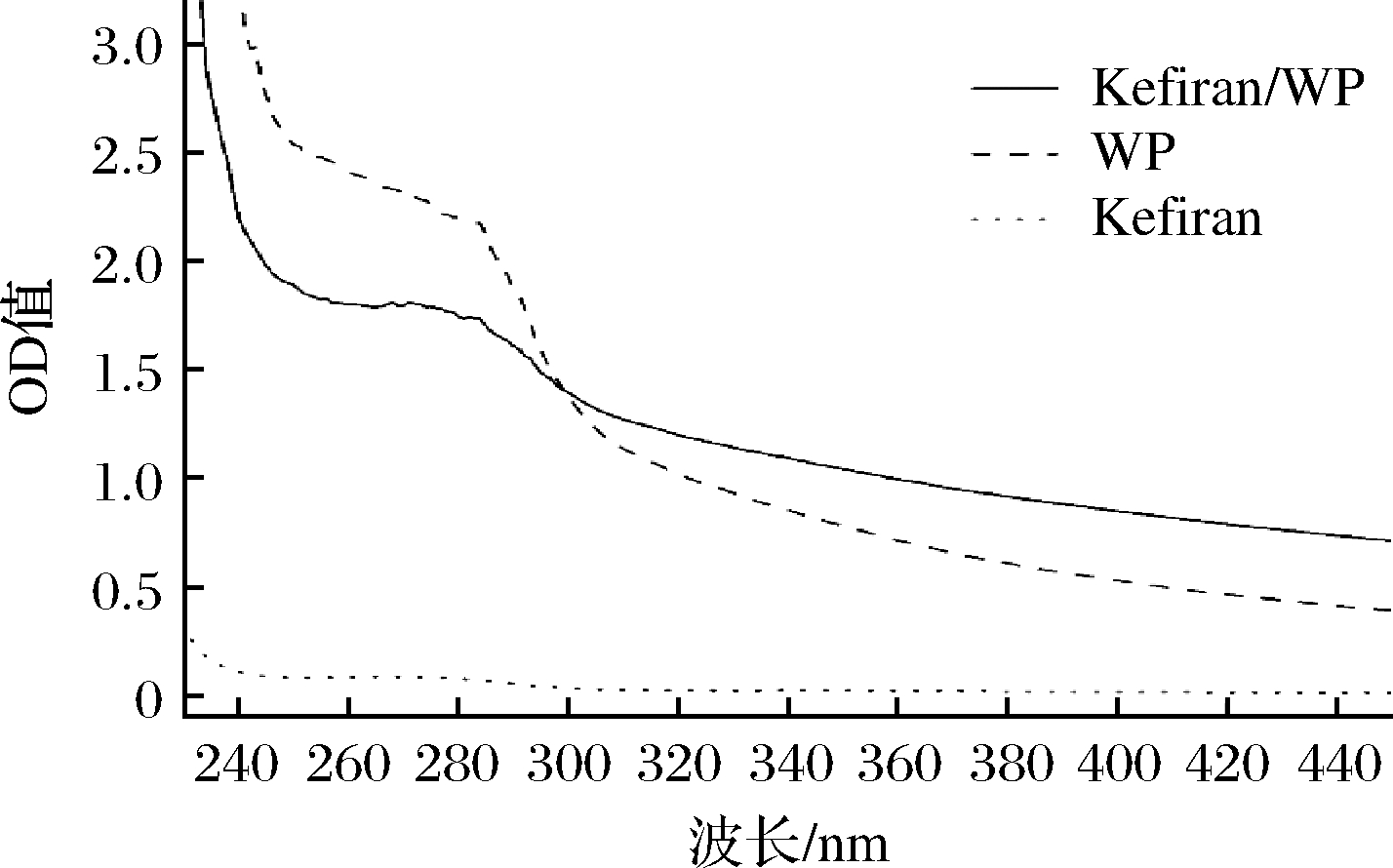
图3 不同溶液的紫外光谱图
Fig.3 Effects on the Ultraviolet spectra of various solutions
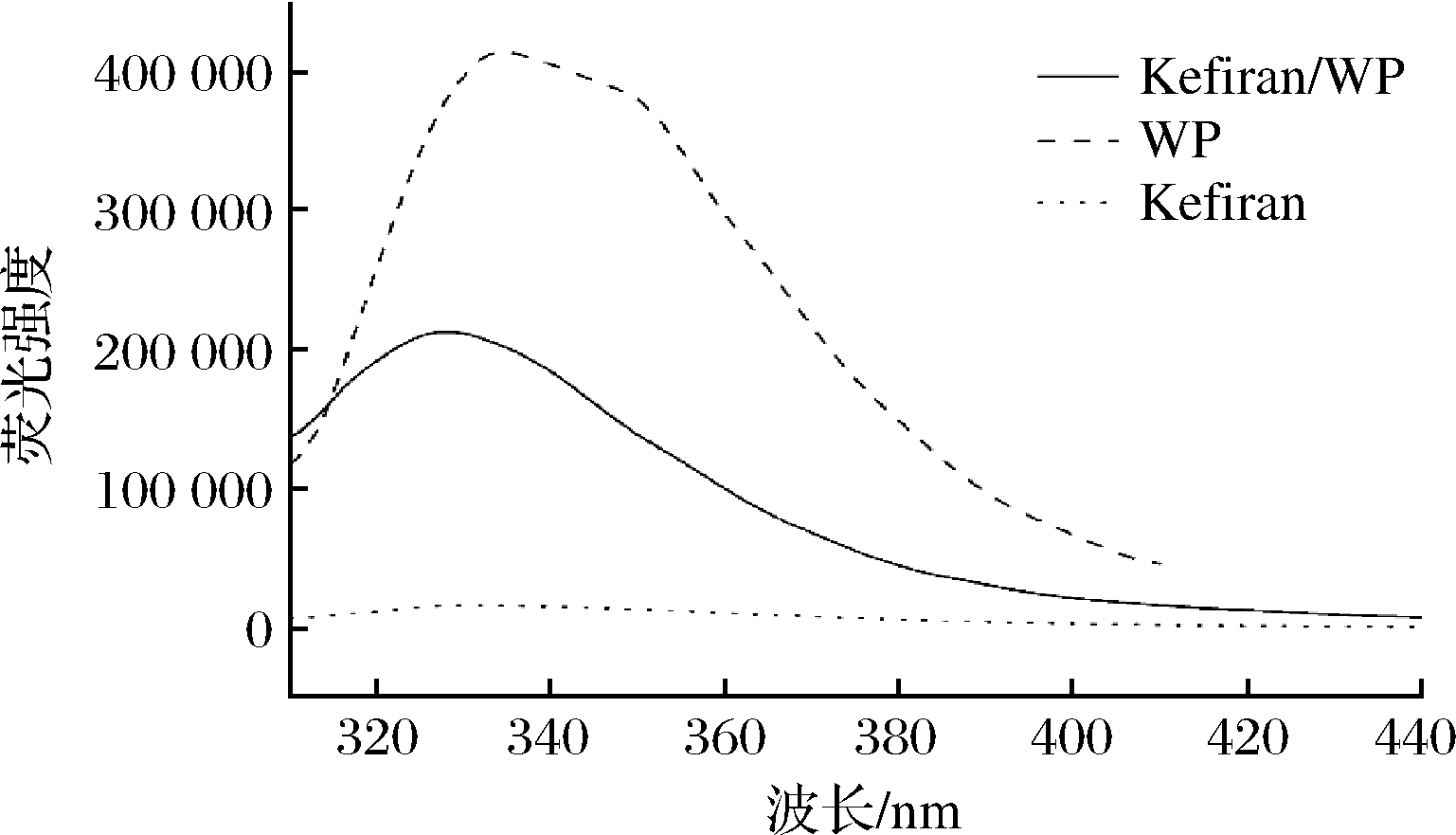
图4 不同溶液的内源性荧光光谱图
Fig.4 Effects on the intrinsic fluorescence spectra of various solutions
2.4 内源性荧光光谱的测定
内源性荧光光谱可以通过分析蛋白质的荧光基团酪氨酸残基和色氨酸残基微环境的变化,观察荧光强度及最大发射波长的变化,反应出蛋白质和多糖结合后三级结构和极性发生的变化[14]。
在Kefiran/WP混合体系中,WP溶液的荧光强度最强,Kefiran的加入减弱了WP中色氨酸残基的疏水作用[15],导致Kefiran/WP混合溶液的荧光强度显著降低,Kefiran/WP混合溶液的最大发射波长比WP向低波段移动了5 nm。
由图4可知,WP的最大荧光峰出现在326 nm处,表明色氨酸存在于蛋白质内部的疏水基团中,被非极性氨基酸包围[16]。与WP溶液相比,Kefiran/WP混合溶液最大发射波长荧光强度降幅明显,且最大发射波长向低波段波长方向移动,表明蛋白质色氨酸残基附近的疏水作用逐渐减弱,使荧光强度降低。
2.5 扫描电镜结果
不同样品冻干后微观结构如图5所示,WP的微观结构为大小较为均一、表面粗糙疏松的颗粒状结构(图5-a),与Kefiran表面光滑具有薄膜特点、结构疏松(图5-b)、间或呈网状结构相比,通过电镜图片观察到Kefian-WP的结构呈碎片状、表面紧密光滑(图5-c)。同样,ZHAO等[15]发现阴离子多糖可以通过共价相互作用使WP的不同球状颗粒转变为更紧密和光滑的结构。说明Kefiran与WP在中性水相介质中可形成聚合物结构。

a-WP;b-Kefiran;c-Kefiran/WP
图5 不同溶液的微观结构
Fig.5 The microstructure of various solutions
2.6 流变学特性
2.6.1 剪切性质分析
图6显示了在剪切速率范围(10~1 000 s-1)内,不同样品溶液的黏度与剪切速率的关系。当剪切速率较低时,Kefiran/WP混合溶液和WP溶液的黏度随着剪切速率的增加而减小,体现出假塑性和剪切稀释的流动特征;剪切速率较高时,随着剪切速率的增加表现为恒定的理想牛顿流体行为。Kefiran/WP混合溶液的黏度值高于单一WP体系的黏度值,这是因为Kefiran可以增加溶液的黏度,这与PIERMARIA等[17]和MORADI等[18]的结果一致。
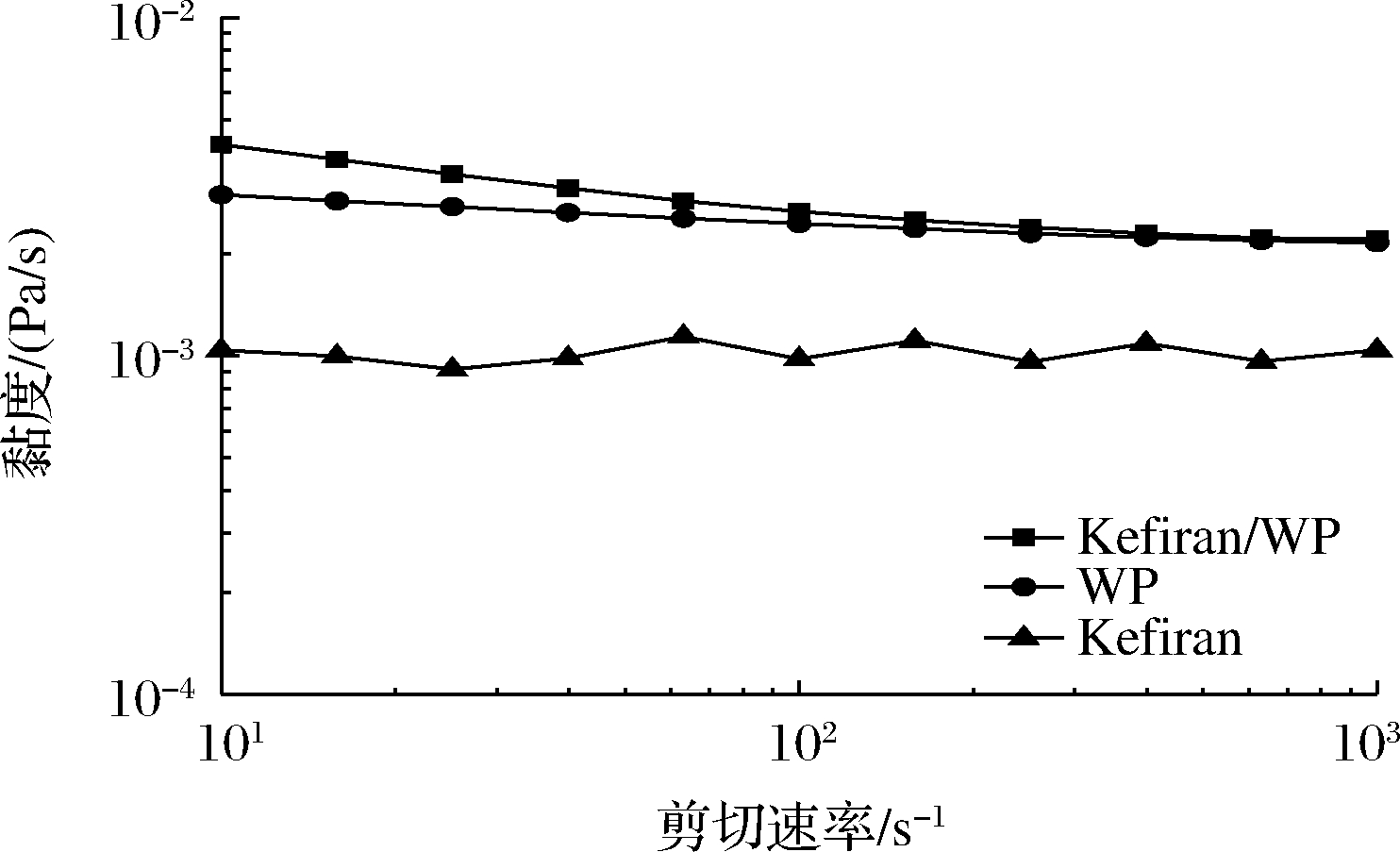
图6 不同溶液剪切速率与黏度的关系
Fig.6 Relationship between shear rate and viscosity of various solutions
稳定状态下测量不同溶液表观黏度如图7所示。在混合体系中,Kefiran/WP比WP的表观黏度更高,溶液表观黏度由于Kefiran的加入而增加,这一事实表明多糖在混合体系中起主导作用[19]。这有利于乳状液产品贮藏、运输及货架期期间的稳定性。
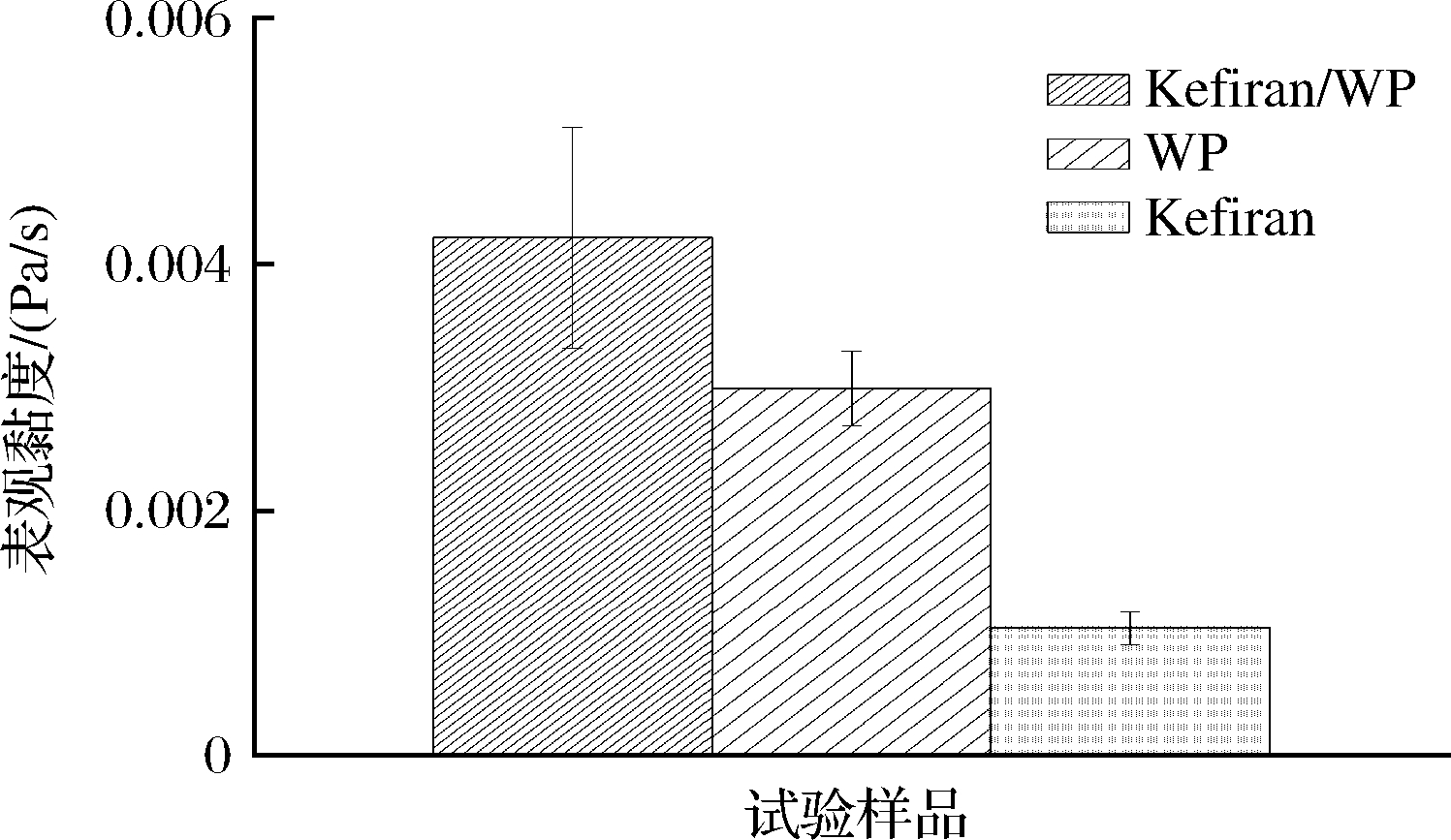
图7 不同溶液表观黏度变化
Fig.7 Comparison of apparent viscosity of various solutions
2.6.2 动态力学分析
2.6.2.1 应变扫描
图8显示对不同样品进行应变扫描测试的结果。G′是用于表示剪切过程中样品中贮存的可逆能量,表示样品的弹性尺度[20];G″表示不可逆的衰减的剪切能部分,表示样品的黏性行为。可以观察到2个不同区域:G′和G″保持恒定的是线性黏弹性区域,此范围内结构中的变形是可逆的;G′和G″发生变化的是非线性区域[21]。所有溶液在线性黏弹性区都表现出G′值大于G″值的弱黏弹性凝胶特征,这与SUN等[19]和PRASANNA等[22]的结果相一致。在Kefiran/WP混合体系中,Kefiran-WP混合溶液的应变值略高于WP的应变值,是因为在Kefiran/WP混合溶液中存在耗尽(depletion)相互作用[17]。耗尽力是胶体系统中一种广泛存在的相互作,指尺寸不同的球体相混时,存在促进大球聚集的体积排除熵。通过增强耗尽效应来促使高分子达到预定的有序排列。因此,Kefiran可能会使蛋白质聚集体之间产生新的相互作用,促使凝胶性增强。从剪切性质分析结果也可以看出(图6),随着多糖的加入,体系黏度增强,这在一定程度上可以提高食品体系的凝胶稳定性,增强体系的保水性,从而改善食品的口感和组织特性及发酵乳产品运输期或货架期乳清析出问题。
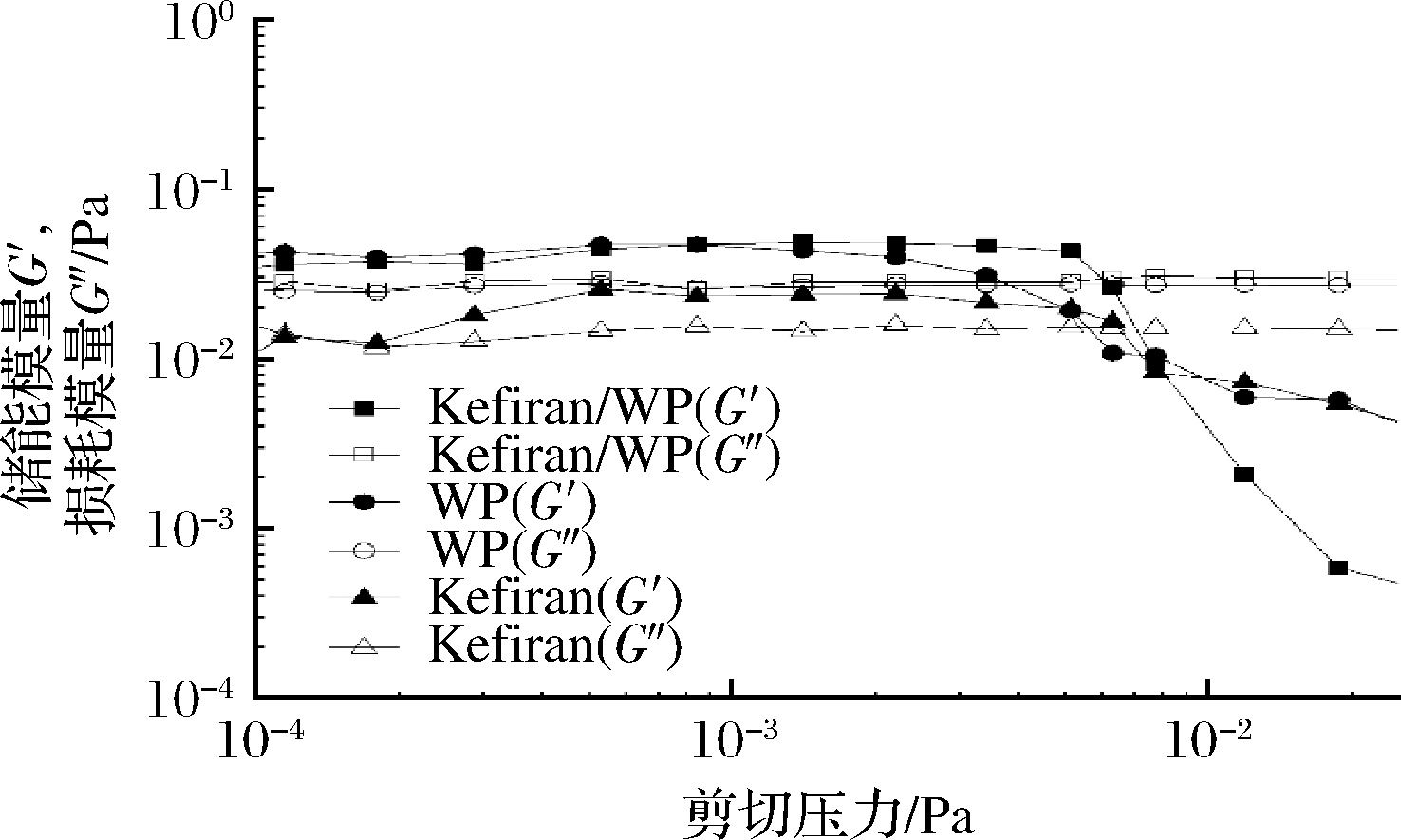
图8 应变对不同溶液黏弹性的影响
Fig.8 Effect of strain on viscoelastic properties of various solutions
2.6.2.2 频率扫描
图9为测试了不同样品溶液不同振动频率时的黏弹性,可以进一步从微观结构运动的角度了解不同溶液体系的性能。随着剪切振荡频率的增加不同溶液的G′和G″都表现出不同程度的升高。在Kefiran/WP混合体系中,WP和Kefiran/WP混合溶液均表现出在低频率时G′均低于其G″,随着频率的升高出现G″高于G′的变化,G″与G′相同时的频率称为交叉频率[23]。频率低于交叉频率时,表现为黏性性质(G″>G′);频率高于交叉频率时,表现为弹性性质(G″<G′)[24-25]。Kefiran/WP混合溶液比WP更早出现黏性行为向弹性行为的转变,这可能是由于混合体系中分子链间发生交互作用、Kefiran与WP通过耗尽或结合的相互作用形成聚集体[26],使体系形成稳定的网络结构[27],表现出弹性性质。与此相似的研究指出,将乳酸菌的胞外多糖添加到乳液、酪蛋白胶束分散体或乳清蛋白胶体中会导致出现耗尽相互作用现象[28]。Kefiran/WP混合溶液和WP溶液明显更依赖于频率,2个模量都具有高斜率,表明其在频率变化时稳定性较弱。
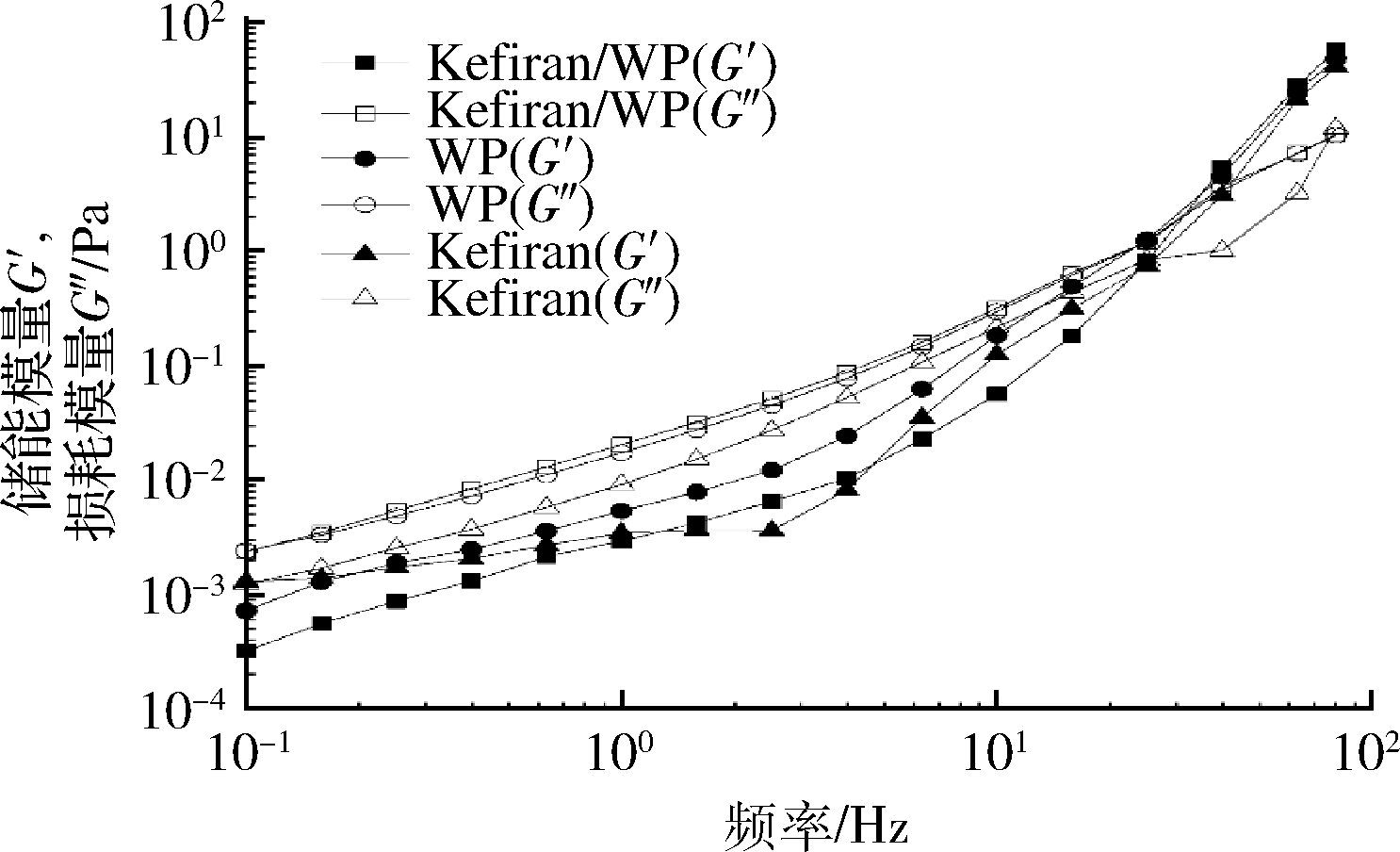
图9 频率对不同溶液黏弹性的影响
Fig.9 Effect of frequency on viscoelastic properties of various solutions
3 结论
在Kefiran/WP混合体系中加入Kefiran均使体系的粒径增大,结构呈碎片状、表面紧密光滑。电位的绝对值减小,表观黏度增加以及黏弹性的增强。Kefiran/WP混合体系中,Kefiran与WP的相互作用导致粒径的增大以及电位绝对值减小。Kefiran本身不可忽略的增稠作用导致表观黏度的增加。Kefiran与WP之间的耗尽作用使黏弹性及凝胶特性增强,而在频率变化时表现出明显的频率依赖性。通过调节或增强Kefiran与WP的耗尽力,可以广泛用于改善或提高产品品质。
目前,除蛋白-多糖复合物的凝胶性、乳化性、起泡性等特性在食品加工等方面的研究之外,研究者以蛋白-多糖复合体系作为载体进行功能因子包埋和保护及生物活性物质的递送;利用蛋白-多糖复合来制备可食用薄膜和涂层,以期在食品保护和贮藏中实现创新应用等方面也已广泛开展研究。因此通过调节蛋白质和多糖之间的共价和非共价相互作用制备功能优异的复合物,在食品与医药等领域有着广阔的应用前景。
[1] 王翠娜. 聚合乳清蛋白与多糖相互作用对其凝胶特性影响及应用[D].长春:吉林大学, 2015.
WANG C N.Interactions between polymerized whey protein and polysaccharides and its impact on the gelation properties and application[D].Changchun:Jilin University, 2015.
[2] HUAN Y, ZHANG S, VARDHANABHUTI B.Effect of CMC molecular weight on acid-Induced gelation of heated WPI-CMC soluble complex[J].Journal of Food Science, 2016, 81(2):N502-N507.
[3] DE JONG S, KLOK H J, VAN DE VELDE F.The mechanism behind microstructure formation in mixed whey protein-polysaccharide cold-set gels[J].Food Hydrocolloids, 2009, 23(3):755-764.
[4] 曾令鹤, 钱方, 姜淑娟, 等.酸乳体系中乳酸菌胞外多糖与蛋白相互作用研究进展[J].食品与机械, 2013, 29(2):246- 249.
ZENG L H, QIAN F, JIANG S J, et al.Research development on proteins and lactic acid bacterium exopolysaccharides interaction in yogurt[J].Food &Machinery, 2013, 29(2):246- 249.
[5] 谢建华, 谢丙清, 庞杰, 等.魔芋葡甘聚糖与乳清蛋白的相互作用[J].食品科学, 2017, 38(5):98-103.
XIE J H, XIE B Q, PANG J, et al.Interactions between konjac gum and whey protein[J].Food Science, 2017, 38(5):98-103.
[6] 王纯玮, 白英.开菲尔胞外多糖理化性质及其抗氧化特性[J].食品与发酵工业, 2022, 48(21):104-110.
WANG C W, BAI Y.Physicochemical properties and antioxidant properties of kefiran[J].Food and Fermentation Industries, 2022, 48(21):104-110.
[7] 吴伟都, 朱慧, 欧凯, 等.激光粒度仪测定搅拌型酸奶粒径的研究[J].粮食与饲料工业, 2018(8):18-20;23.
WU W D, ZHU H, OU K, et al.Particle size of stirred yoghurt with laser particle sizer[J].Cereal &Feed Industry, 2018(8):18-20;23.
[8] KREUß M, STRIXNER T, KULOZIK U.The effect of glycosylation on the interfacial properties of bovine caseinomacropeptide[J].Food Hydrocolloids, 2009, 23(7):1818-1826.
[9] 齐宝坤, 赵城彬, 江连洲, 等.不同热处理温度下大豆11S球蛋白Zeta电位、粒径和红外光谱分析[J].食品科学, 2018, 39(24):54-58.
QI B K, ZHAO C B, JIANG L Z, et al.Analysis of Zeta potential, particle size and infrared spectroscopy of 11S glycinin at different heat treatment temperatures[J].Food Science, 2018, 39(24):54-58.
[10] ZHANG S, VARDHANABHUTI B.Effect of initial protein concentration and pH on in vitro gastric digestion of heated whey proteins[J].Food Chemistry, 2014, 145:473-480.
[11] MA X B, YAN T Y, HOU F R, et al.Formation of soy protein isolate (SPI)-citrus pectin (CP) electrostatic complexes under a high-intensity ultrasonic field:Linking the enhanced emulsifying properties to physicochemical and structural properties[J].Ultrasonics Sonochemistry, 2019, 59:104748.
[12] 王银平. 玉木耳多糖的制备、结构表征及其与乳清蛋白相互作用研究[D].长春:吉林大学, 2020.
WANG Y P.Preparation and structural characterization of polysaccharides from Auricularia cornea Var.Li.and their interactions with whey protein[D].Changchun:Jilin University, 2020.
[13] SHINGEL K I.Determination of structural peculiarities of dexran, pullulan and gamma-irradiated pullulan by Fourier-transform IR spectroscopy[J].Carbohydrate Research, 2002, 337(16):1445-1451.
[14] CHANG C, WANG T R, HU Q, et al.Caseinate-zein-polysaccharide complex nanoparticles as potential oral delivery vehicles for curcumin:Effect of polysaccharide type and chemical cross linking[J].Food Hydrocolloids, 2017, 72:254-262.
[15] ZHAO Y, WANG X, LI D, et al.Effect of anionic polysaccharides on conformational changes and antioxidant properties of protein-polyphenol binary covalently-linked complexes[J].Process Biochemistry, 2020, 89:89-97.
[16] NIU F G, DONG Y T, SHEN F, et al.Phase separation behavior and structural analysis of ovalbumin-gum arabic complex coacervation[J].Food Hydrocolloids, 2015, 43:1-7.
[17] PIERMARIA J, L PEZ-CASTEJ
PEZ-CASTEJ N M L, BENGOECHEA C, et al.Prebiotic emulsions stabilised by whey protein and kefiran[J].International Journal of Food Science &Technology, 2021, 56(1):76-85.
N M L, BENGOECHEA C, et al.Prebiotic emulsions stabilised by whey protein and kefiran[J].International Journal of Food Science &Technology, 2021, 56(1):76-85.
[18] MORADI Z, KALANPOUR N.Kefiran, a branched polysaccharide:Preparation, properties and applications:A review[J].Carbohydrate Polymers, 2019, 223:115100.
[19] SUN C H, GUNASEKARAN S, RICHARDS M P.Effect of xanthan gum on physicochemical properties of whey protein isolate stabilized oil-in-water emulsions[J].Food Hydrocolloids, 2007, 21(4):555-564.
[20] KAZAZI H, KHODAIYAN F, REZAEI K, et al.Rheology and microstructure of kefiran and whey protein mixed gels[J].Journal of Food Science and Technology, 2017, 54(5):1168-1174.
[21] TAN T C, FOO W T, LIONG M T, et al.Comparative assessment of dynamic oscillatory measurements on network development and mechanical spectra of gelatine or gellan in maize starch-egg white composite gels[J].Food Hydrocolloids, 2015, 45:93-101.
[22] PRASANNA P H P, GRANDISON A S, CHARALAMPOPOULOS D.Microbiological, chemical and rheological properties of low fat set yoghurt produced with exopolysaccharide (EPS) producing Bifidobacterium, strains[J].Food Research International, 2013, 51(1):15-22.
[23] 陈志娜, 杨希娟, 师俊玲.西藏灵菇发酵乳胞外多糖的流变学特性[J].食品科学, 2016, 37(5):1-5.
CHEN Z N, YANG X J, SHI J L.Rheological properties of exopolysaccharide produced by tibetan kefir[J].Food Science, 2016, 37(5):1-5.
[24] SENGKHAMPARN N, SAGIS L M C, DE VRIES R, et al.Physicochemical properties of pectins from okra (Abelmoschus esculentus (L.) Moench)[J].Food Hydrocolloids, 2010, 24(1):35-41.
[25] RIMADA P S, ABRAHAM A G.Kefiran improves rheological properties of glucono-d-lactone induced skim milk gels[J].International Dairy Journal, 2006, 16(1):33-39.
[26] DEMETRIADES K, MCCLEMENTS D J.Flocculation of whey protein stabilized emulsions as influenced by dextran sulfate and electrolyte[J].Journal of Food Science, 1999, 64(2):206-210.
[27] DICKINSON E.Strategies to control and inhibit the flocculation of protein-stabilized oil-in-water emulsions[J].Food Hydrocolloids, 2019, 96:209-223.
[28] PIERMAR A J, BENGOECHEA C, ABRAHAM A G, et al.Shear and extensional properties of kefiran[J].Carbohydrate Polymers, 2016, 152:97-104.
A J, BENGOECHEA C, ABRAHAM A G, et al.Shear and extensional properties of kefiran[J].Carbohydrate Polymers, 2016, 152:97-104.