食用碱(碱及碱性盐)在传统米面制品加工及其品质形成过程中发挥着重要作用。例如,在面条生产中经常使用碳酸钠、碳酸钾、碳酸氢钠等来增强面团筋力、改善烹饪特性、赋予产品独特风味和色泽[1]。在湿面生产中,食用碱还具有稳定产品质地和保鲜的作用[2]。研究发现,在荞麦馒头[3]和荞麦饸饹[4]的制作中添加碳酸钠或碳酸氢钠可改善荞面团的加工性能以及制成品的品质。在泰国,以米粉为原料制作Thai Lod-Chong(一种甜品)时澄清石灰水是不可或缺的材料,其特有的颜色和质地有赖于Ca(OH)2的添加。在墨西哥玉米煎饼Masa或薄饼Tortilla制作中,需用石灰对原料玉米进行预处理,这样加工出的产品才呈现特有的质地、风味、颜色和口感[5]。Ca(OH)2对玉米粉加工适性的改善,其作用的关键位点在淀粉[6]。研究发现[7],绿豆淀粉膜对风味物质的包埋效果受碱添加的影响,添加Ca(OH)2的绿豆淀粉膜比添加NaOH的膜能更好地包埋1,8-桉叶醇、薄荷酮等化合物,甚至优于未添加碱的淀粉膜,这主要在于Ca2+与淀粉分子之间的“交联”作用提高了膜中淀粉的结晶度,提高了对风味化合物的截留能力。Ca(OH)2还能影响制品的营养特性。研究发现,玉米淀粉经0.2%(质量分数)Ca(OH)2预处理后,其抗性淀粉比例未发生显著变化,但快消化淀粉含量显著增加(33%→64%),而慢消化淀粉含量显著降低(63%→30%)[8]。
淀粉是传统米面制品加工原料的主要成分。食用碱主要通过对淀粉的成糊性、凝胶性及老化等特性产生不同程度的调节作用,从而改善原料的加工适性和产品的品质。研究发现[9],淀粉糊化性能的改变与Ca(OH)2添加量有关,其添加量达到0.5%时,玉米淀粉的糊化更为容易,这时Ca2+主要通过范德华力与淀粉分子的羟基发生相互作用,其添加量达到1.0%后,糊化曲线始终呈现上升态势,这时体系的碱性环境诱导淀粉分子上的羟基电离,继而与Ca2+或Ca(OH)+发生交联作用,增强了淀粉颗粒在烹煮时的机械强度,提升了成糊性。米豆腐是以大米和石灰为主要原料加工的传统淀粉凝胶食品,在加工时石灰遇水生成Ca(OH)2,Ca(OH)2与大米淀粉互作是米豆腐品质形成的关键[10]。基于传统米豆腐制作工艺,本研究以适宜米豆腐加工的大米为材料,从中提取大米淀粉,通过考察Ca(OH)2对大米淀粉的热特性、糊化、流变、凝胶质构、淀粉短程有序度及水分子状态等的影响,研究其对大米淀粉凝胶特性的影响规律,以期为揭示米豆腐品质形成机制及设计开发具有期望质地特征的淀粉凝胶食品提供参考。
1 材料与方法
1.1 材料与试剂
大米(早籼米),陕西省汉中市洋县镇江玉其米厂;熟石灰(食品级),重庆广辉化工公司;盐酸、氢氧化钠、硫酸、硫酸钠、硫酸铜(五水)、硫酸钾、乙酸铅、乙酸镁,均为分析纯,成都科龙化工试剂厂;无水乙醇、无水乙醚、石油醚(30~60 ℃)、甲基红、溴甲酚绿等,均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
DL-BL16PP-C多乐搅拌机,广州隆特电子有限公司;DHG-9140电热恒温鼓风干燥箱、HWS-26数显恒温水浴锅,上海齐欣科学仪器有限公司;Mastersizer 2000激光粒度分析仪,英国马尔文仪器有限公司;BX53荧光正置显微镜,日本OLYMPUS公司;D2 X-射线衍射仪,德国Bruker AXS有限公司;DSC4000差示扫描量热仪、Spectrum 100傅里叶红外光谱仪,美国Perkin Elmer公司;TechMaster RVA快速黏度分析仪,北京波通瑞华科学仪器有限公司;DHR-2旋转流变仪,美国TA公司;TA.XT plus质构仪,英国Stable Micro System公司;ALPHA1-4LSC冷冻干燥机,美国FEI公司;NMI20核磁共振成像分析仪,上海纽迈电子科技有限公司。
1.3 实验方法
1.3.1 大米淀粉的制备
称取500 g大米于去离子水中(料液比1∶4)浸泡(4 ℃)12 h后匀浆5 min,在4 ℃静置12 h后倒掉上清液。沉淀物加入去离子水洗涤(料液比1∶4),离心(4 528×g,20 min),重复以上操作4次后,将沉淀物于40 ℃烘箱干燥24 h,过100目筛得到大米淀粉。经测定,大米淀粉的水分含量为5.94 g/100 g,总淀粉、灰分、蛋白质和脂肪的含量(以干基记)分别为93.07、1.58、1.43、0.73 g/100 g。
1.3.2 大米淀粉基本特性测定
直链淀粉含量的测定:参照GB/T 15683《大米直链淀粉含量的测定》。经测定,大米淀粉中直链淀粉含量(以干基记)为31.98 g/100 g。
用Mastersizer 2000激光粒度仪测定大米淀粉颗粒的粒径分布。取适量淀粉样品加入到装有500 mL去离子水的样品杯中,在2 500 r/min的转速下搅拌,保持淀粉颗粒分散均匀。测试条件参数:激光波长632.8 nm,分散剂水的折射率为1.33,颗粒的折射率和吸收率分别设置为1.52和0.1。
显微形貌及偏光十字观测[11]:取少许淀粉样品用V(甘油)∶V(水)= 1∶1混合均匀,制成质量分数(下同)为6%的淀粉悬液,滴加于载玻片上,盖上盖玻片,分别在白光和偏振光模式下观测。为考察Ca(OH)2对大米淀粉偏光十字特性的影响,分别向6%大米淀粉悬液中添加0.4%、0.8%、1.2%、1.6%(质量分数,以淀粉干基计)的Ca(OH)2,搅拌均匀,室温(25 ℃)静置4 h后观测。
1.3.3 大米淀粉的X-射线衍射分析及热特性分析
向6%大米淀粉悬液中添加不同质量分数(以淀粉干基计,0%、0.4%、0.8%、1.2%、1.6%)的Ca(OH)2,室温(25 ℃)静置4 h,离心(4 528×g,20 min),将湿淀粉于40 ℃烘箱干燥24 h,过100目筛,得到预处理大米淀粉,备用。
X-射线衍射分析:采用X-射线衍射仪对经预处理的大米淀粉进行晶体结构测定,电压40 kV,电流40 mA,扫描范围为2θ=4~40 °,扫描速率2 °/min,扫描步长0.02 °。采用MDI Jade 6计算大米淀粉的相对结晶度(relative crystallinity,RC)。
热特性分析:称取3 mg经预处理的大米淀粉(干基),加入10 μL去离子水,密封在铝盘中,平衡水分(25 ℃,12 h)。在20~120 ℃以10 ℃/min的升温速度测量样品,以空铝盘作为对照。利用TRIOS 4.4.0版本软件分析起始糊化温度(To)、峰值糊化温度(Tp)、终止糊化温度(Tc)和糊化焓(ΔH)。
1.3.4 大米淀粉的糊化特性测定
称取3 g大米淀粉(干基)于RVA测量铝桶内,加入相对于大米淀粉质量分数0%、0.4%、0.8%、1.2%、1.6%的Ca(OH)2,注入去离子水,搅拌均匀后,迅速上机测试。最初10 s以960 r/min搅拌悬浊液,接着保持160 r/min转速至实验结束。初始温度为50 ℃保持1 min,然后在3.75 min内提高到95 ℃,在95 ℃保持2.5 min,再在3.75 min内降至50 ℃并保持2 min。
1.3.5 大米淀粉凝胶的制备
分别向大米淀粉(3 g,干基)中添加质量分数为0%、0.4%、0.8%、1.2%、1.6%的Ca(OH)2粉末,加入去离子水,搅拌,制成质量分数为6%的淀粉悬液。置于95 ℃的水浴锅中持续搅拌30 min,得到糊化的大米淀粉,自然冷却至室温制成大米淀粉凝胶,备用。
1.3.6 大米淀粉凝胶流变学特性分析
在DHR-2旋转流变仪上完成测定,采用平板-平板测量系统,平板直径40 mm,设置平板间距1 000 μm,测定温度保持在25 ℃。确定样品的线性黏弹区后,选择振荡模式,扫描应变值为0.1%,每10倍角频率范围内测试10个点,测定大米淀粉凝胶贮能模量(G′)、损耗模量(G″)和损耗角正切值(tanδ)随角频率(0.1~100 rad/s)的变化。
1.3.7 大米淀粉凝胶质构特性测定
将大米淀粉凝胶样品放于4 ℃贮存24 h后取出进行测试。选择TPA模式;探头:P36R;测定参数为:测前速度1 mm/s,测中速度5 mm/s,测后速度5 mm/s;触发力:45 g;压缩比:40%。
1.3.8 傅里叶红外光谱(Fourier transform infrared spectrometer, FT-IR)测定[12]
将大米淀粉凝胶样品放于-80 ℃的冰箱中冷冻6 h,然后放入真空冷冻干燥机,48 h后取出冻干样品,研磨过100目筛,用于测试。先采集空气背景,然后将冻干样品置于样品池中进行波长扫描。测定条件设置为:分辨率4 cm-1,扫描次数64,记录600~4 000 cm-1范围内扫描结果。
1.3.9 低场脉冲核磁共振分析
将大米淀粉凝胶样品在室温下密封存放4、12、24 h,取样测量。利用多脉冲回波序列(carr-purcell-meiboom-gill, CPMG)进行横向弛豫时间(T2)的测定,测定前选用Q-FID程序进行校零,每个样品重复采集3次信号,结果取平均值。检测参数:主频率SF=21 MHz,偏移频率Q1=134 457.02 Hz,90°脉冲时间P1=12.00 μs,180°脉冲时间P2=23.04 μs,采样点数TD=800 046,累加次数NS=32,回波时间TE=0.400 ms。对指数衰减曲线进行反演后即可得到T2(横向)弛豫时间图谱。
1.4 数据分析
所有测定至少重复3次,结果以平均值±标准偏差表示。采用Origin 2021绘图,SPSS 20.0进行统计分析,用LSD法进行显著性检验(P<0.05)。
2 结果与分析
2.1 Ca(OH)2对大米淀粉颗粒形态的影响
由图1-A可知,大米淀粉呈多角形或不规则形。在粒度分布图上,大米淀粉的粒度呈现单峰分布,样品累积通过率为10%、50%、90%时的粒径值分别为2.81 μm(D10)、4.99 μm(D50)、8.27 μm(D90)。ZHOU等[13]采用碱提法得到的大米淀粉颗粒D50为4.8 μm,本研究结果与之接近。淀粉颗粒形状及粒度主要与品种和生长条件有关。FAN等[14]报道3个品种籼稻淀粉颗粒形貌受籽粒生长期气温的影响,正常气温下淀粉颗粒主要呈多角形且轮廓清晰,而较高气温下合成的淀粉颗粒轮廓近圆形、粒度减小。大米淀粉在偏振光模式下有双折射现象,因为淀粉粒的结晶结构和无定型结构具有不同的密度和折光率[15]。由图1-B可知,粒度较大的淀粉颗粒具有典型的偏光十字,十字交叉点位于淀粉颗粒中心;而粒度较小的淀粉颗粒的偏光亮度较为黯淡,偏光十字变得模糊欠完整。相同视野下淀粉颗粒的偏光亮度与其大小、形貌和结构有序程度相关[11]。ZHANG等[16]将小麦AB淀粉分离后放在偏振光下观测,结果表明A淀粉的偏光亮度强于B淀粉,这主要是由于呈圆盘状的A淀粉在粒度、结晶度、短程有序度等指标上均高于呈球形或不规则形的B淀粉。经Ca(OH)2处理后,大米淀粉偏光十字仍然清晰(图1-B~图1-F)。这与KARIM等[17]的研究结果一致。Ca(OH)2使大米淀粉颗粒的形貌几乎无影响,但质量分数为0.4%、0.8%、1.2%的Ca(OH)2处理组可观测到大米淀粉颗粒发生了一定程度团聚,这表明Ca(OH)2引起了大米淀粉颗粒表面特性的变化。

A-大米淀粉在白光背景下的显微形貌;B~F-依次为Ca(OH)2添加量0%、0.4%、0.8%、1.2%、1.6%的大米淀粉偏光镜照片
图1 Ca(OH)2对大米淀粉颗粒显微形貌和偏光十字的影响(×1 000)
Fig.1 Effect of Ca(OH)2 on the microscopic morphology and polarizing cross observation of rice starch granules(×1 000)
2.2 Ca(OH)2对大米淀粉结晶特性及热特性的影响
如图2所示,大米淀粉为典型的A-型淀粉结晶峰,在15.0°和23.0°(2θ)各呈一个强衍射峰,在17.0°和18.0°间呈现双峰;在20.0°(2θ)处有一个弱衍射峰,这提示本研究采用的淀粉中可能存在直链淀粉-脂质复合物[18]。经计算,大米淀粉的相对结晶度为23.69%。CAI等[19]报道4个品种籼米淀粉的相对结晶度为25.0%~30.6%,其相对结晶度与直链淀粉含量显著负相关。本研究制备的大米淀粉的直链淀粉含量为31.98 g/100 g(以淀粉计),属于高直链淀粉型大米淀粉[20]。经Ca(OH)2处理的大米淀粉,各衍射峰的位置未发生变化,这表明大米淀粉晶型不因Ca(OH)2改变;随着Ca(OH)2添加量的增加,淀粉的相对结晶度下降,并且各衍射峰强度的变化呈现差异,这显示在某些微晶区域中,大米淀粉长程有序性发生了改变。
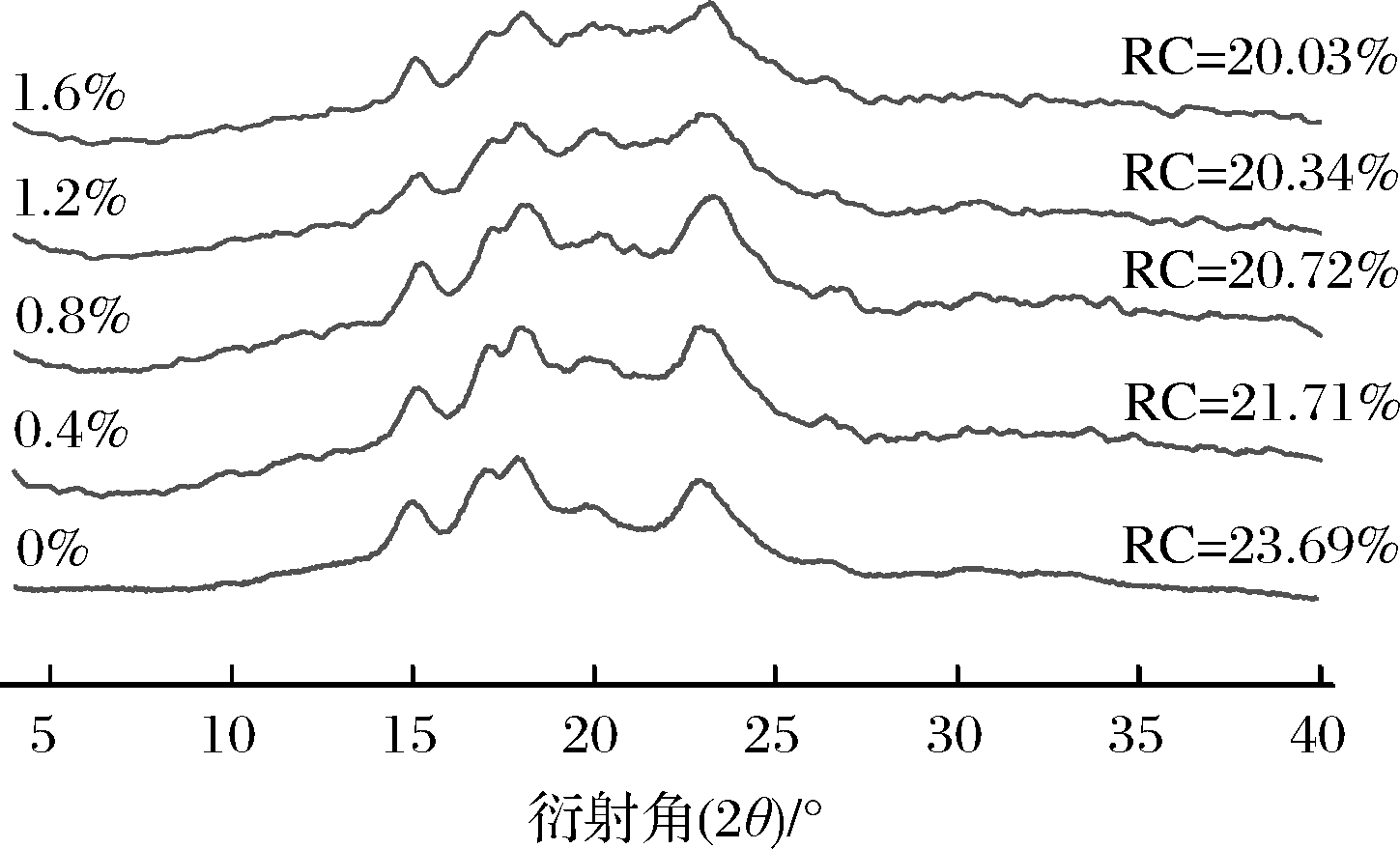
图2 Ca(OH)2对大米淀粉颗粒的结晶特性的影响
Fig.2 Effect of Ca(OH)2 on the crystallization properties of rice starch
大米淀粉的热特性参数如表1所示。大米淀粉的Tp为77.34 ℃。不同来源大米淀粉的热特性存在较大差异,并受淀粉的结晶度、粒度等因素影响。YANG等[21]报道籼米淀粉Tp为72.7 ℃,其相对结晶度为20.4%,而结晶度更高的粳米及糯米淀粉具有更高的Tp。添加Ca(OH)2的样品与对照组的Tp无组间差异(P>0.05)。BRYANT等[9]报道玉米淀粉的Tp随着Ca(OH)2添加量(0.0%→1.0%)增加而增大,CONTRERAS-JIMÉNEZ等[22]研究发现Ca(OH)2添加0.15%~0.3%到豆薯淀粉中,同样导致Tp增大,研究认为其升高主要是Ca2+与淀粉分子之间的交联作用所致。本研究中,添加Ca(OH)2的样品与对照组的To和Tc同样没有组间差异(P>0.05),其显著性变化主要表现在ΔH。ΔH随着Ca(OH)2添加增加而降低,这与相对结晶度的下降趋势一致。由于ΔH主要反映淀粉糊化时结晶区破坏所需吸收的能量,因此ΔH与结晶结构的数量呈现负相关性。
表1 大米淀粉的热特性参数
Table 1 The thermal characteristics parameters of the rice starch

注:同列不同小写字母表示差异显著(P<0.05)(下同)。
Ca(OH)2添加量/%To/℃Tp/℃Tc/℃ΔH/(J/g)072.30±0.15ab77.34±0.01ab83.18±0.23a13.18±0.72a0.472.57±0.19ab77.53±0.54ab82.50±1.17a10.20±0.22b0.871.36±0.13b76.84±0.03b84.14±2.62a8.88±0.31c1.273.12±0.03a77.86±0.11a83.07±0.62a6.44±0.44d1.671.67±1.03b77.45±0.21ab84.38±1.05a6.40±0.01d
2.3 Ca(OH)2对大米淀粉糊化特性的影响
由图3可知,Ca(OH)2以剂量依赖方式使大米淀粉的峰值时间、糊化温度、峰值黏度、热糊黏度、冷糊黏度等性质发生不同程度的改变。首先,Ca(OH)2加速了淀粉糊化进程,Ca(OH)2添加量1.2%(质量分数)的样品与对照样相比,到达峰值黏度时间缩短了24.3%;大米淀粉糊化温度则随着Ca(OH)2添加量增加呈现先降低后升高的特征。这说明Ca2+和OH-在发挥不同作用。有研究报道Ca(OH)2可通过促进直链淀粉溶出使体系黏度迅速增加[23],另一项研究表明1%(质量分数)Na2CO3或NaOH可使小麦、玉米、大米等的淀粉峰值时间提前,且NaOH比Na2CO3效果更显著,这表明淀粉粒的膨胀和直链淀粉溶出主要是热碱液的促进作用[20]。但是,BRYANT等[9]报道熟石灰添加量1.0%时延缓了脱脂玉米粉中淀粉颗粒膨胀和破裂,而熟石灰添加量从0%增加到0.5%的过程中则观测得到脱脂玉米粉的糊化温度呈逐渐下降趋势,这也说明碱液渗透作用使淀粉颗粒易吸水膨胀,而Ca2+通过与部分解离的淀粉羟基间互作来维持淀粉颗粒的完整性。其次,随着Ca(OH)2添加量增加(0%→1.6%),峰值黏度呈现先升高后降低的特征(表2)。BRENDA等[24]报道玉米粉在浸泡预处理阶段添加Ca(OH)2,其相对黏度随着添加量(0%→2%)增加而增加,研究认为这主要与碱液破坏淀粉分子间氢键、促进水合作用有关,使淀粉颗粒更加膨胀,从而增加峰值黏度。与之相反,CONTRERAS-JIMÉNEZ等[22]研究发现,Ca(OH)2添加(0.15%、0.20%、0.30%)使墨西哥地瓜(Pachyrhizus spp.)淀粉的峰值黏度降低。Ca(OH)2对大米淀粉热糊黏度的影响同样存在剂量效应。在Ca(OH)2添加量0.4%时其热糊黏度达到最大值,添加量继续增加其热糊黏度快速下降;Ca(OH)2添加量1.2%时,大米淀粉的崩解值达到最大值,为对照样的3.08倍,这主要是因为碱加速了淀粉颗粒的解体[25]。结果表明,冷糊黏度随Ca(OH)2添加量的增加先升后降,在0.8%添加量下达到最大值,添加量超过1.2%后,其冷糊黏度反而低于对照样。这也说明Ca2+和OH-对淀粉短期回生具有不同影响。OH-增强其水合能力,抑制淀粉回生[17];而Ca2+通过与淀粉分子中氧原子的相互作用和结合水分子来促进淀粉回生并增加体系黏度。HEDAYATI等[26]研究发现对于预糊化淀粉和冷水溶胀淀粉体系,CaCl2使其冷糊黏度增加,而NaCl导致冷糊黏度降低。随后的研究[27]再次确认CaCl2使冷水溶淀粉的冷糊黏度和回升值增加而NaCl具有相反的效果。本研究结果表明,Ca(OH)2添加可作为调节大米淀粉冷糊黏度的有效手段。
表2 大米淀粉的糊化特性参数
Table 2 The pasting parameters of the rice starch
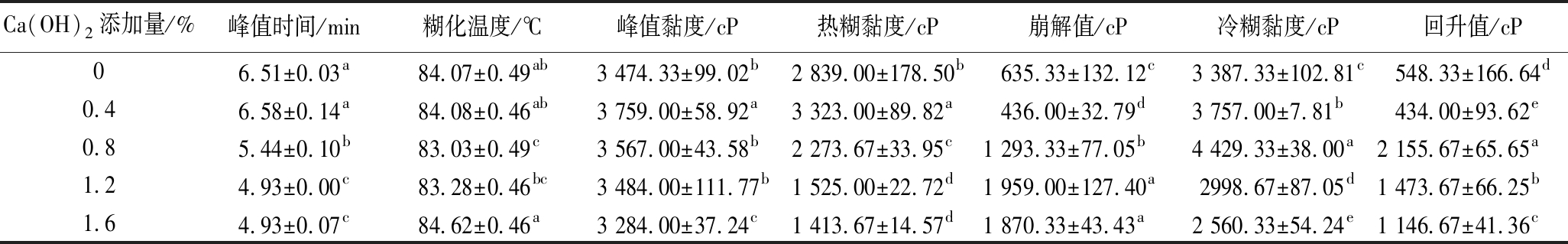
Ca(OH)2添加量/%峰值时间/min糊化温度/℃峰值黏度/cP热糊黏度/cP崩解值/cP冷糊黏度/cP回升值/cP06.51±0.03a84.07±0.49ab3 474.33±99.02b2 839.00±178.50b635.33±132.12c3 387.33±102.81c548.33±166.64d0.46.58±0.14a84.08±0.46ab3 759.00±58.92a3 323.00±89.82a436.00±32.79d3 757.00±7.81b434.00±93.62e0.85.44±0.10b83.03±0.49c3 567.00±43.58b2 273.67±33.95c1 293.33±77.05b4 429.33±38.00a2 155.67±65.65a1.24.93±0.00c83.28±0.46bc3 484.00±111.77b1 525.00±22.72d1 959.00±127.40a2998.67±87.05d1 473.67±66.25b1.64.93±0.07c84.62±0.46a3 284.00±37.24c1 413.67±14.57d1 870.33±43.43a2 560.33±54.24e1 146.67±41.36c
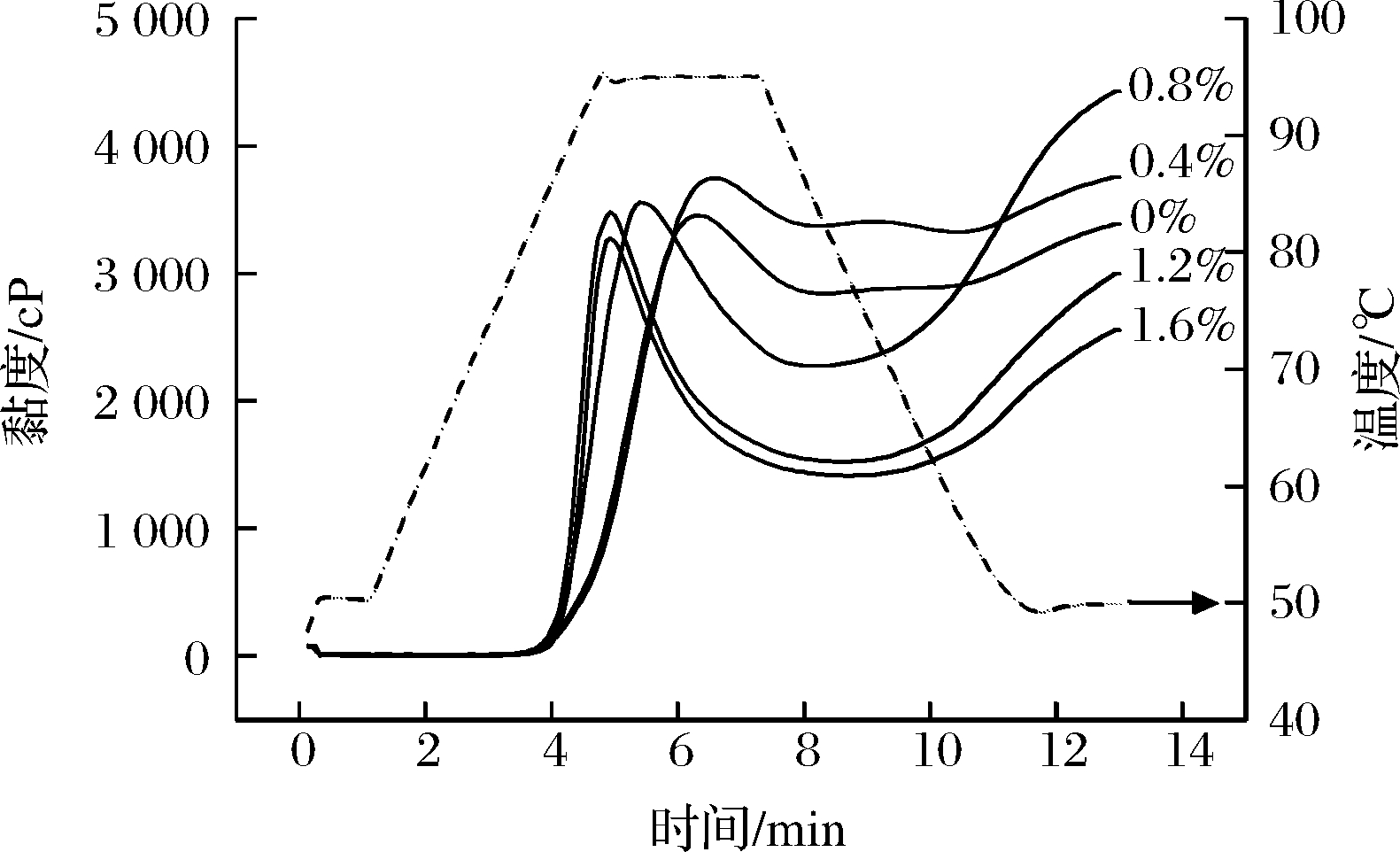
图3 Ca(OH)2对大米淀粉糊化特性的影响
Fig.3 Effects of Ca(OH)2 on the pasting properties of rice starch
2.4 Ca(OH)2对大米淀粉流变特性的影响
在动态流变学测试中,G′和G″分别反映样品的弹性和黏性,损耗因子(tanδ)通过G″与G′的比值得出,比值越小,体系的弹性越大,比值越大,体系的黏性越强;而当tanδ=1时,可判定为大米淀粉样品的临界凝胶点[28]。添加Ca(OH)2后,大米淀粉体系G′、G″及tanδ随频率变化见图4。由图4可知,在测试频率范围(0.1~100 rad/s)内,G′远大于G″且tanδ值小于1,说明体系表现出典型的凝胶动态流变学特性;随着扫描频率的增加,G′、G″及tanδ总体呈上升趋势,并且G″和tanδ的频率依赖性更加明显。Ca(OH)2添加量为0.4%~1.6%的样品tanδ曲线均在对照样曲线的下方(图4-C),这表明添加Ca(OH)2可增强体系的弹性;样品G′在Ca(OH)2添加量为0.4%时无显著变化,而Ca(OH)2添加量为0.8%时,样品G′达到最大值,随后逐步下降(图4-A)。由此可见,Ca(OH)2在体系中发挥作用受其添加量的影响。ZHANG等[28]研究发现,在低盐浓度(0.6%)时,蜡质、普通及高直链玉米淀粉体系G′及G″要大于高盐浓度(2.0%),这可能与不同浓度下盐离子对淀粉分子与水分子之间相互作用的影响程度不同有关。MONDRAG N等[29]研究发现,熟石灰可改变玉米淀粉凝胶动态流变学特性,且与熟石灰的添加量密切相关,适量添加(0.2%)可使体系G′值达到最大增幅,而0.4%~0.6%的添加量使增幅有所降低但仍高于零添加的体系。研究认为,当熟石灰向体系中引入的Ca2+在低浓度时,Ca2+与直链淀粉分子之间通过范德华力发生“交联”,增强了溶胀淀粉颗粒的机械强度,从而形成具有更高弹性或贮能模量的淀粉凝胶网络[23];而Ca2+在高浓度时,多余的Ca2+分布于溶胀淀粉颗粒表面,这使得凝胶化进程中淀粉分子重结晶受阻,导致淀粉凝胶弹性相对降低[29]。此外,Ca(OH)2添加量较高时体系黏弹性降低,可能是因为OH-促进淀粉糊化并抑制老化,阻碍大米淀粉凝胶化,导致体系G′和G″降低[6,8]。CONTRERAS-JIMÉNEZ等[22]研究发现,Ca(OH)2添加使豆薯淀粉凝胶从纯弹性转变为塑性-弹性状态。因此,可通过改变Ca(OH)2添加量调控大米淀粉凝胶的动态流变学特性。
N等[29]研究发现,熟石灰可改变玉米淀粉凝胶动态流变学特性,且与熟石灰的添加量密切相关,适量添加(0.2%)可使体系G′值达到最大增幅,而0.4%~0.6%的添加量使增幅有所降低但仍高于零添加的体系。研究认为,当熟石灰向体系中引入的Ca2+在低浓度时,Ca2+与直链淀粉分子之间通过范德华力发生“交联”,增强了溶胀淀粉颗粒的机械强度,从而形成具有更高弹性或贮能模量的淀粉凝胶网络[23];而Ca2+在高浓度时,多余的Ca2+分布于溶胀淀粉颗粒表面,这使得凝胶化进程中淀粉分子重结晶受阻,导致淀粉凝胶弹性相对降低[29]。此外,Ca(OH)2添加量较高时体系黏弹性降低,可能是因为OH-促进淀粉糊化并抑制老化,阻碍大米淀粉凝胶化,导致体系G′和G″降低[6,8]。CONTRERAS-JIMÉNEZ等[22]研究发现,Ca(OH)2添加使豆薯淀粉凝胶从纯弹性转变为塑性-弹性状态。因此,可通过改变Ca(OH)2添加量调控大米淀粉凝胶的动态流变学特性。

A-G′;B-G″;C-tanδ
图4 Ca(OH)2对大米淀粉凝胶流变特性的影响
Fig.4 Effect of Ca(OH)2 on rheological properties of rice starch gel
2.5 Ca(OH)2对大米淀粉凝胶质构特性的影响
添加Ca(OH)2后大米淀粉凝胶质构特性的变化见表3。结果显示,Ca(OH)2使凝胶质地改善,特别是硬度、胶黏性和咀嚼性显著增加。硬度反映大米淀粉凝胶的刚性。咀嚼性是模拟咀嚼食物所需要的所需要的能量,与样品的硬度相关。当Ca(OH)2添加量为0.8%时,大米淀粉凝胶的硬度和咀嚼性达到最大值,分别为对照样的1.44倍和1.78倍;继续增大Ca(OH)2添加量,样品硬度及咀嚼性降低但仍显著高于对照样,降低的原因主要在于高浓度OH-对淀粉凝胶形成的阻碍作用。弹性反映因受力发生形变样品在撤去外力后恢复原来状态的比率,而内聚性与分子内相互作用有关[30]。研究认为,Ca2+有助于增强淀粉分子之间的相互作用,而OH-可破坏淀粉分子之间的氢键作用[22]。由此可见,当Ca(OH)2添加适量(0.8%)时,淀粉凝胶的弹性和弹性均达到最大值,且内聚性增加17.39%。胶黏性指半固体食品咀嚼成可以吞咽的状态所需要的能量,该值等于硬度与内聚性的乘积[27]。故而大米淀粉凝胶的胶黏性在Ca(OH)2添加量0.8%时达到最大值。总体上,Ca(OH)2添加量0.8%时有助于改善大米淀粉凝胶的质构特性。
表3 Ca(OH)2对大米淀粉凝胶质构特性的影响
Table 3 Effect of Ca(OH)2 on the textural properties of rich starch gel
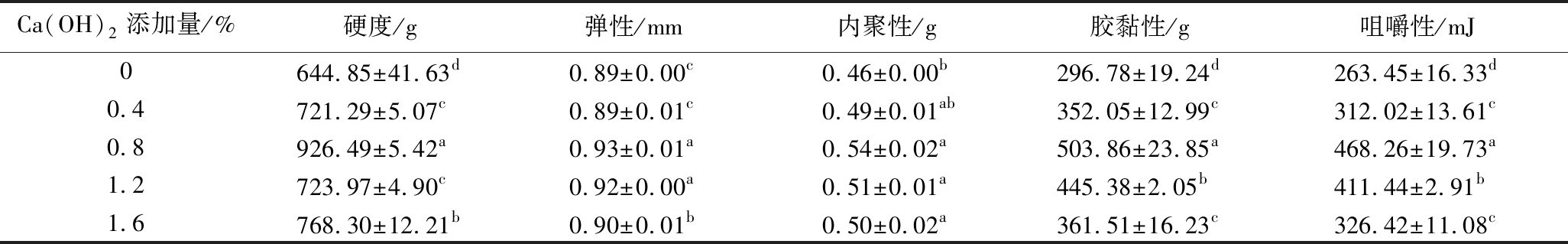
Ca(OH)2添加量/%硬度/g弹性/mm内聚性/g胶黏性/g咀嚼性/mJ0644.85±41.63d0.89±0.00c0.46±0.00b296.78±19.24d263.45±16.33d0.4721.29±5.07c0.89±0.01c0.49±0.01ab352.05±12.99c312.02±13.61c0.8926.49±5.42a0.93±0.01a0.54±0.02a503.86±23.85a468.26±19.73a1.2723.97±4.90c0.92±0.00a0.51±0.01a445.38±2.05b411.44±2.91b1.6768.30±12.21b0.90±0.01b0.50±0.02a361.51±16.23c326.42±11.08c
2.6 Ca(OH)2对大米淀粉凝胶短程有序结构的影响
淀粉短程有序结构可采用红外光谱900~1 200 cm-1区域内的谱带进行表征。通常,该区域峰与峰之间相互重叠,需通过傅里叶去卷积处理来提高特征峰的分辨率。不同添加量下大米淀粉凝胶的红外光谱图如图5-A所示。与对照组相比,这些吸收峰的位置没有发生明显的变化,无新的或者缺失的谱带,但吸收峰强度呈现差异。这表明没有新化学键形成或破坏原有基团,但淀粉的短程有序结构发生了变化。研究认为,995 cm-1、1 022 cm-1、1 047 cm-1分别反映水合碳水化合物的螺旋结构,无定型结构和有序结构[8]。通常采用1 047 cm-1/1 022 cm-1和1 022 cm-1/995 cm-1吸光度比值表征淀粉的短程有序程度,当1 047 cm-1/1 022 cm-1值越大,1 022 cm-1/995 cm-1值越小,淀粉的短程有序程度越高[31]。由图5-B和图5-C可知,与零添加的样品相比,Ca(OH)2添加量为0.4%时,吸光度比值1 047 cm-1/1 022 cm-1和1 022 cm-1/995 cm-1分别增加6.49%和降低5.60%,淀粉的短程有序程度显著增加(P<0.05);但是继续增加其添加量却导致吸光度比值1 047 cm-1/1 022 cm-1显著下降而1 022 cm-1/995 cm-1显著升高,这表明在较高Ca(OH)2添加量下(0.8%~1.6%)淀粉短程有序结构遭到破坏。LOBATO-CALLEROS等[6]研究发现,随着熟石灰添加量增加(0%→0.40%),吸光度比值1 047 cm-1/1 022 cm-1逐渐降低,这表明Ca(OH)2对玉米淀粉的短程有序结构起破坏作用且存在剂量效应。RODR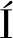 GUEZ等[32]研究发现,在墨西哥玉米饼制作中适量添加Ca(OH)2(0.1%~0.2%)可增加产品中淀粉的相对结晶度,而过量添加(0.3%~0.5%)时相对结晶度回到零添加的水平,研究认为这主要是Ca2+与淀粉分子之间的“交联”作用增强了糊化过程在淀粉颗粒及结晶结构的稳定性。ROLDAN-CRUZ等[8]的结果表明显示,在相同添加量下,CaCl2能最大限度提升玉米淀粉短程有序性,CaCO3次之,而Ca(OH)2最次,可见Ca2+的作用受阴离子影响。在本研究中,凝胶产品中大米淀粉的短程有序性可通过改变Ca(OH)2添加量来调节。
GUEZ等[32]研究发现,在墨西哥玉米饼制作中适量添加Ca(OH)2(0.1%~0.2%)可增加产品中淀粉的相对结晶度,而过量添加(0.3%~0.5%)时相对结晶度回到零添加的水平,研究认为这主要是Ca2+与淀粉分子之间的“交联”作用增强了糊化过程在淀粉颗粒及结晶结构的稳定性。ROLDAN-CRUZ等[8]的结果表明显示,在相同添加量下,CaCl2能最大限度提升玉米淀粉短程有序性,CaCO3次之,而Ca(OH)2最次,可见Ca2+的作用受阴离子影响。在本研究中,凝胶产品中大米淀粉的短程有序性可通过改变Ca(OH)2添加量来调节。
A-FT-IR图谱;B-1 047 cm-1和1 022 cm-1的吸光度比值;C-1 022 cm-1和995 cm-1的吸光度比值
图5 添加了不同质量分数Ca(OH)2的大米淀粉凝胶的FT-IR波谱和吸光度比值
Fig.5 FT-IR spectra and absorbance ratio of rice starch gels with different addition amounts of Ca(OH)2
2.7 Ca(OH)2对大米淀粉凝胶水分分布的影响
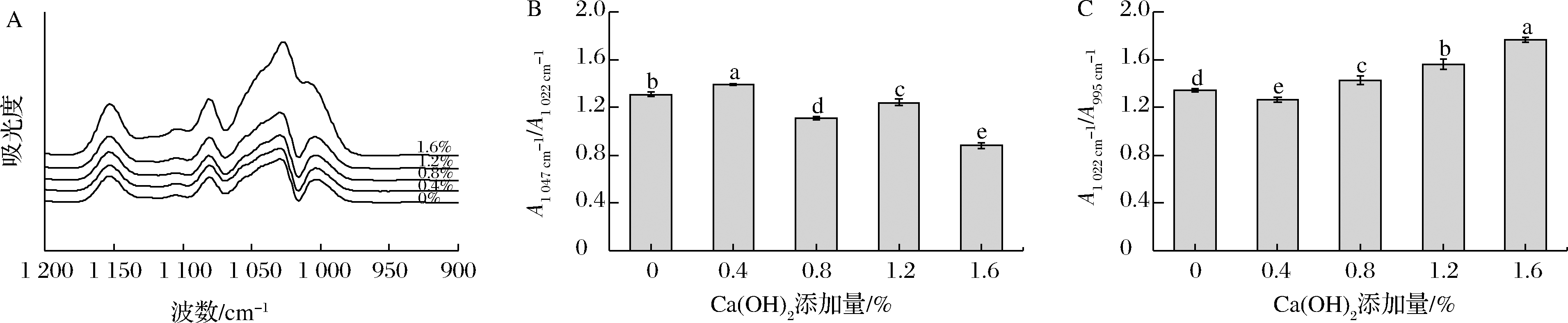
低场核磁共振技术可在不破坏样品结构的情况下,利用氢质子在磁场中的自旋弛豫特性,分析大米淀粉凝胶中水分状态及迁移情况。在弛豫时间(T2)图谱(图6)中,T21峰(0.16~1.75 ms)表征与淀粉分子结合最紧密的水;T22峰(2.31~18.74 ms)表征与淀粉分子结合相对较弱的水,其流动性介于强结合水和自由水之间;T23峰(24.77~932.60 ms)表征自由水,是大米淀粉凝胶中流动性最强的水[33]。如图6所示,T23的信号强度最大,该峰为主峰,这表明自由水在大米淀粉凝胶中占主导地位。与对照组相比,添加Ca(OH)2的淀粉凝胶T23峰发生了明显右移,表明淀粉凝胶中水的流动性降低。这可能是因为电荷密度高的Ca2+与水发生静电相互作用使水紧密结合在凝胶内部,降低了水分子的流动性[26]。各峰的峰面积(A2)反映不同状态水分的相对含量。结合水(T21)、不易流动水(T22)和自由水(T23)对应的峰面积分别用A21、A22和A23表示[12]。各个贮藏时间的样品的结果(表4)表明,添加Ca(OH)2使大米淀粉凝胶中自由水的比例(A23)增加,特别是对于较高添加量(1.6%)和较长时间贮藏(12 h)的样品。对于不易流动水(A22),添加Ca(OH)2使其呈现不断降低的趋势,尤其在Ca(OH)2添加量为1.6%时,与对照组存在显著性差异(P<0.05)。结合水(A21)在大米淀粉凝胶中的占较小比例,总体上Ca(OH)2的加入对结合水的比例无显著影响。由此可见,添加Ca(OH)2使大米淀粉凝胶中的半结合水向自由水转变,尤其是在较高添加量下这种转变更加显著。这可能是因为OH-破坏了淀粉分子与水分子间的氢键,导致水的流动性增加[34]。
表4 Ca(OH)2对大米淀粉凝胶的水分迁移谱图波峰面积百分比A2的影响
Table 4 Effects of Ca(OH)2 on the peak area percentage A2 of the water migration spectrum of rice starch gel

注:同行不同小写字母表示差异显著(P<0.05)。
贮藏时间指标Ca(OH)2添加量/%00.40.81.21.6A210.70±0.20a1.17±0.96a1.22±0.33a0.96±0.64a1.47±0.10a4 hA226.16±0.28a4.06±0.63b3.60±0.01b6.05±0.01a3.98±0.21bA2393.14±0.08c93.43±0.32bc95.10±0.44a94.05±0.86abc94.55±0.11abA211.52±1.12a3.60±0.59a2.78±1.72a1.77±0.28a1.91±0.05a12 hA226.33±0.12a3.76±0.11b3.66±0.01b3.78±0.12b3.47±0.31bA2392.15±1.00b92.62±0.73ab93.61±1.66ab94.44±0.16ab94.58±0.20aA211.63±0.15a0.88±0.11b1.75±0.55ab1.32±0.06ab1.90±0.56a24 hA225.97±0.07a3.98±0.57b3.60±0.11b3.52±0.01b3.55±0.36bA2392.41±0.22b95.13±0.46a94.63±0.63a95.16±0.06a94.55±0.93a
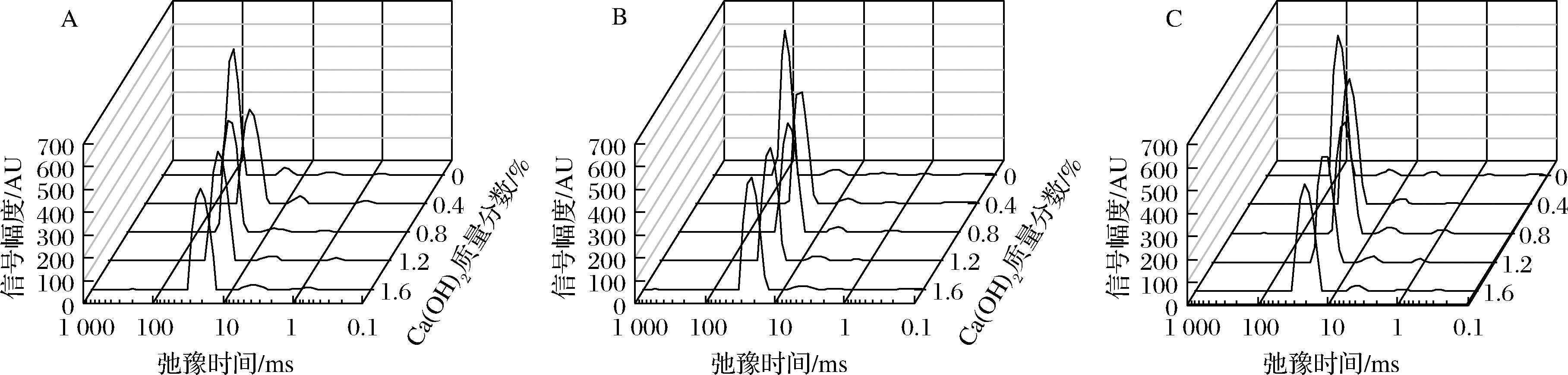
A-贮藏4 h;B-贮藏12 h;C-贮藏24 h
图6 Ca(OH)2对大米淀粉凝胶的横向弛豫时间T2波谱图的影响
Fig.6 Effects of Ca(OH)2 on the transverse relaxation time T2 spectrum of rice starch gel
3 结论
研究发现,Ca(OH)2添加改变了大米淀粉的糊化特性。在较低添加量(<0.8%,质量分数)下,Ca(OH)2可提高冷糊黏度,改善回生性能。与对照组相比,Ca(OH)2添加量为0.8%可使大米淀粉的回升值提高3.93倍。当Ca(OH)2添加量高于0.8%(质量分数)时,大米淀粉的回升值仍显著高于对照组但冷糊黏度低于对照组(P<0.05)。Ca(OH)2可改善大米淀粉的流变学及质构特性。Ca(OH)2添加量为0.8%(质量分数)时,可使大米淀粉凝胶体系达到最大贮能模量(G′)、硬度、胶黏性和咀嚼性。研究还发现,随着Ca(OH)2添加量增加,凝胶样品中淀粉的短程有序程度呈现先增加后降低的趋势。大米淀粉凝胶中主要为自由水(约为93%),添加Ca(OH)2使自由水的比例显著增加(P<0.05),增加部分主要由不易流动的水转化而来;结合水的比例不受Ca(OH)2的影响,但从反演峰的位置看,Ca(OH)2添加使凝胶中水的流动性有所下降。总之,Ca(OH)2能影响大米淀粉的加工性能,因其添加量的不同,大米淀粉在糊化、凝胶、质地等特性上发生不同程度的改变。本研究可为Ca(OH)2在大米淀粉凝胶制品加工中应用开发提供参考。
[1] 申倩, 陆启玉.盐、碱的添加对面条品质的影响[J].粮食与油脂, 2017(3):31-32.
SHEN Q, LU Q Y.Effect of salt and alkali on quality of noodle[J].Cereals &Oils, 2017(3):31-32.
[2] 田宇, 刘伯业, 陈复生, 等.碱性盐在生鲜湿面保鲜和品质调控中的应用[J].食品科学, 2022, 43(16): 26-35.
TIAN Y, LIU B Y, CHEN F S, et al.Application of alkaline salt in freshness preservation and quality control of fresh wet noodles[J].Food Science, 2022, 43(16): 26-35.
[3] GUO X N, YANG S, ZHU K X.Influences of alkali on the quality and protein polymerization of buckwheat Chinese steamed bread[J].Food Chemistry, 2019, 283:52-58.
[4] HAN L H, LU Z H, HAO X L, et al.Impact of calcium hydroxide on the textural properties of buckwheat noodles[J].Journal of Texture Studies, 2012, 43(3):227-234.
[5] RUIZ-GUTIÉRREZ M G, QUINTERO-RAMOS A, MELÉNDEZ-PIZARRO C O, et al.Nixtamalization in two steps with different calcium salts and the relationship with chemical, texture and thermal properties in masa and tortilla[J].Journal of Food Process Engineering, 2012, 35(5):772-783.
[6] LOBATO-CALLEROS C, HERNANDEZ-JAIMES C, CHAVEZ-ESQUIVEL G, et al.Effect of lime concentration on gelatinized maize starch dispersions properties[J].Food Chemistry, 2015, 172:353-360.
[7] CHANJARUJIT W, HONGSPRABHAS P, CHAISERI S.Physicochemical properties and flavor retention ability of alkaline calcium hydroxide-mungbean starch films[J].Carbohydrate Polymers, 2018, 198:473-480.
[8] ROLDAN-CRUZ C, GARCIA-DIAZ S, GARCIA-HERNANDEZ A, et al.Microstructural changes and in vitro digestibility of maize starch treated with different calcium compounds used in nixtamalization processes[J].Starch-Stärke, 2020, 72(9-10):1900303.
[9] BRYANT C M, HAMAKER B R.Effect of lime on gelatinization of corn flour and starch[J].Cereal Chemistry, 1997, 74(2):171-175.
[10] 石庆楠. 米豆腐的研究现状及进展[J].中国食品, 2021(6):132-134.
SHI Q N.Research status and development of rice tofu[J].China Food, 2021(6):132-134.
[11] LIU K, HAO Y C, CHEN Y, et al.Effects of dry heat treatment on the structure and physicochemical properties of waxy potato starch[J].International Journal of Biological Macromolecules, 2019, 132:1044-1050.
[12] ZHANG Y F, CHEN C, CHEN Y, et al.Effect of rice protein on the water mobility, water migration and microstructure of rice starch during retrogradation[J].Food Hydrocolloids, 2019, 91:136-142.
[13] ZHOU W X, SONG J J, ZHANG B, et al.The impacts of particle size on starch structural characteristics and oil-binding ability of rice flour subjected to dry heating treatment[J].Carbohydrate Polymers, 2019, 223:115053.
[14] FAN X L, LI Y Q, ZHU Y, et al.Characterization of physicochemical qualities and starch structures of two indica rice varieties tolerant to high temperature during grain filling[J].Journal of Cereal Science, 2020, 93:102966.
[15] XIAO H X, WANG S Y, XU W Z, et al.The study on starch granules by using darkfield and polarized light microscopy[J].Journal of Food Composition and Analysis, 2020, 92:103576.
[16] ZHANG B J, LI X X, LIU J, et al.Supramolecular structure of A- and B-type granules of wheat starch[J].Food Hydrocolloids, 2013, 31(1):68-73.
[17] KARIM A A, NADIHA M Z, CHEN F K, et al.Pasting and retrogradation properties of alkali-treated sago (Metroxylon sagu) starch[J].Food Hydrocolloids, 2008, 22(6):1 044-1 053.
[18] WANG H W, LIU Y F, CHEN L, et al.Insights into the multi-scale structure and digestibility of heat-moisture treated rice starch[J].Food Chemistry, 2018, 242:323-329.
[19] CAI J W, MAN J M, HUANG J, et al.Relationship between structure and functional properties of normal rice starches with different contents[J].Carbohydrate Polymers, 2015, 125:35-44.
[20] BAO J S, SHEN S Q, SUN M, et al.Analysis of genotypic diversity in the starch physicochemical properties of nonwaxy rice:Apparent amylose content, pasting viscosity and gel texture[J].Starch-Stärke, 2006, 58(6):259-267.
[21] YANG Y T, XU X J, WANG Q.Effects of potassium sulfate on swelling, gelatinizing and pasting properties of three rice starches from different sources[J].Carbohydrate Polymers, 2021, 251:117057.
[22] CONTRERAS-JIMÉNEZ B, V ZQUEZ-CONTRERAS G, DE LOS
ZQUEZ-CONTRERAS G, DE LOS  NGELES CORNEJO-VILLEGAS M, et al.Structural, morphological, chemical, vibrational, pasting, rheological, and thermal characterization of isolated jicama (Pachyrhizus spp.) starch and jicama starch added with Ca (OH)2[J].Food Chemistry, 2019, 283:83-91.
NGELES CORNEJO-VILLEGAS M, et al.Structural, morphological, chemical, vibrational, pasting, rheological, and thermal characterization of isolated jicama (Pachyrhizus spp.) starch and jicama starch added with Ca (OH)2[J].Food Chemistry, 2019, 283:83-91.
[23] DE LOS  NGELES CORNEJO-VILLEGAS M
NGELES CORNEJO-VILLEGAS M  , RINC
, RINC N-LONDO
N-LONDO O N, DEL REAL-L
O N, DEL REAL-L PEZ A, et al.The effect of Ca2+ ions on the pasting, morphological, structural, vibrational, and mechanical properties of corn starch-water system[J].Journal of Cereal Science, 2018, 79:174-182.
PEZ A, et al.The effect of Ca2+ ions on the pasting, morphological, structural, vibrational, and mechanical properties of corn starch-water system[J].Journal of Cereal Science, 2018, 79:174-182.
[24] BRENDA C J, MARCELA G M, JUAN DE DIOS F C, et al.Effect of steeping time and calcium hydroxide concentration on the water absorption and pasting profile of corn grits[J].Journal of Food Engineering, 2014, 122:72-77.
[25] LAI L N, KARIM A A, NORZIAH M H, et al.Effects of Na2CO3 and NaOH on pasting properties of selected native cereal starches[J].Journal of Food Science, 2004, 69(4):249-256.
[26] HEDAYATI S, MAJZOOBI M, SHAHIDI F, et al.Effects of NaCl and CaCl2on physicochemical properties of pregelatinized and granular cold-water swelling corn starches[J].Food Chemistry, 2016, 213:602-608.
[27] HEDAYATI S, SHAHIDI F, MAJZOOBI M, et al.Structural, rheological, pasting and textural properties of granular cold water swelling maize starch:Effect of NaCl and CaCl2[J].Carbohydrate Polymers, 2020, 242:116406.
[28] ZHANG X D, GUO D W, XUE J Q, et al.The effect of salt concentration on swelling power, rheological properties and saltiness perception of waxy, normal and high amylose maize starch[J].Food Function, 2017, 8(10):3792-3802.
[29] MONDRAG N M, MENDOZA-MART
N M, MENDOZA-MART NEZ A M, BELLO-PÉREZ L A, et al.Viscoelastic behavior of nixtamalized maize starch gels[J].Carbohydrate Polymers, 2006, 65(3):314-320.
NEZ A M, BELLO-PÉREZ L A, et al.Viscoelastic behavior of nixtamalized maize starch gels[J].Carbohydrate Polymers, 2006, 65(3):314-320.
[30] ZHANG H H, SUN B H, ZHANG S K, et al.Inhibition of wheat starch retrogradation by tea derivatives[J].Carbohydrate Polymers, 2015, 134:413-417.
[31] KUO C H, SHIEH C J, HUANG S M, et al.The effect of extrusion puffing on the physicochemical properties of brown rice used for saccharification and Chinese rice wine fermentation[J].Food Hydrocolloids, 2019, 94:363-370.
[32] RODR GUEZ M E, Y
GUEZ M E, Y
 EZ-LIM
EZ-LIM N M, ALVARADO-GIL J J, et al.Influence of the structural changes during alkaline cooking on the thermal, rheological, and dielectric properties of corn tortillas[J].Cereal Chemistry, 1996, 73(5):593-600.
N M, ALVARADO-GIL J J, et al.Influence of the structural changes during alkaline cooking on the thermal, rheological, and dielectric properties of corn tortillas[J].Cereal Chemistry, 1996, 73(5):593-600.
[33] LIU X, CHAO C, YU J L, et al.Mechanistic studies of starch retrogradation and its effects on starch gel properties[J].Food Hydrocolloids, 2021, 120:106914.
[34] 陈政, 陈培琳, 林炎, 等.pH对莲子淀粉糊化特性影响的研究[J].食品科技, 2020, 45(3):259-266.
CHEN Z, CHEN P L, LIN Y, et al.Effect of pH on gelatinization properties of lotus seed starch[J].Food Science and Technology, 2020, 45(3):259-266.