有些细菌在不利于生存的环境下,可能会进入活的非可培养(viable but non-culturable,VBNC)状态[1]。细菌处于该生理状态下,不能在常规培养基上生长繁殖,但仍然保持一定的代谢活性,当给予适宜的条件时,又会恢复到可培养状态,被认为是细菌躲避不利环境的一种特殊存活形式[1-2]。细菌进入VBNC态后细胞形态特征会发生变化,有的细胞表面出现褶皱,菌体体积变小或菌体聚集等变化[3-4]。目前报道能进入VBNC态的微生物有100多种[1],如大肠杆菌[5]、鼠伤寒沙门氏菌[6]、金黄色葡萄球菌[7]、短乳杆菌[8]和德式乳杆菌保加利亚亚种ND02[3]等。大多数都为革兰氏阴性致病菌,少数为革兰氏阳性非致病菌。不同细菌在不同条件下VBNC态的诱导、检测方法、形成和复苏机理等研究方向被深入探究[9]。
乳酸菌(lactic acid bacteria,LAB)是能利用可发酵碳水化合物产生大量乳酸的一类革兰氏阳性细菌的统称[10]。乳酸菌在发酵过程中产生大量酸性代谢产物,使发酵液pH值降低,抑制了致病菌生长,延长了产品货架期,提供了诱人风味[11]。同时,乳酸的累积也一定程度抑制了乳酸菌的生长,所以酸胁迫是乳酸菌发酵后期面临的最大不利生存环境之一。乳酸菌在生产、贮藏过程中,除酸胁迫外,还不可避免地受到低温等多种不利生长的环境胁迫[12-13]。在这些不利生存的条件下,有些乳酸菌可能会进入VBNC态,目前报道能进入VBNC态的乳酸菌有肠球菌、双歧杆菌、保加利亚乳杆菌、短乳杆菌等[1,3,8]。乳酸菌进入VBNC态有利有弊,如果啤酒中存有杂菌短乳杆菌VBNC态,一旦复苏会使其产品质量不稳定[8]。也可以将不利变成有利,如果乳酸菌从VBNC态转为可培养态,将会增加活菌数量、利于挖掘各种生境中大量不可培养的乳酸菌资源等[9]。
干酪乳酪杆菌Zhang(Lacticaseibacillus casei Zhang)是一株分离筛选自内蒙古地区传统酸马奶中的具有耐酸、耐胆盐、改善肠道菌群、提高免疫力等多种优良特性的益生菌,已被广泛应用到发酵乳、饲料和医药等领域[14-15]。益生乳酸菌在酸胁迫下进入VBNC态鲜有报道。由于在实验室条件下诱导细菌VBNC态时,常常采用多个条件复合诱导[16],所以本研究以L.casei Zhang为研究对象,在酸和低温复合条件下胁迫,定期取样检测,通过对诱导过程中菌体细胞的活性、细胞完整性及形态的测定,初步探究L.casei Zhang是否能够在酸和低温胁迫条件下形成VBNC态。
1 材料与方法
1.1 菌株来源
干酪乳酪杆菌Zhang(Lacticaseibacillus casei Zhang),由内蒙古农业大学乳品生物技术与工程教育部重点实验室保藏并提供。
1.2 主要试剂
MRS培养基(pH 6.8,g/L):无水葡萄糖20.0、牛肉膏10.0、大豆蛋白胨10.0、酵母浸粉5.0、无水乙酸钠5.0、无水磷酸氢二钾2.0、柠檬酸钠2.0、七水硫酸镁0.2、五水硫酸锰0.05,混和均匀,于121 ℃下灭菌15 min。
PBS缓冲溶液(0.01 mol/L,pH 7.2):氯化钠0.8 g,磷酸二氢钾0.02 g,磷酸氢二钠0.115 g,100 mL蒸馏水、充分搅拌至溶解后于121 ℃灭菌15 min。
食品级乳酸购自天津鑫铂特有限公司;LIVE/DEAD®BacLightTM Bacterial Viability试剂盒(L7012)购自美国Molecular probes公司。
1.3 仪器与设备
DHP-9272恒温培养箱,上海一恒科技有限公司;AR2202CN电子天平, 奥豪斯仪器上海有限公司;R5810高速冷冻离心机,德国Eppendorf公司;DMi8荧光显微镜、DM4000B荧光显微镜,德国Leica公司;CytoFLEX流式细胞仪,美国贝克曼库尔特有限公司;GE4852T PCR仪,杭州 BIO-GENER公司。
1.4 实验方法
1.4.1 L.casei Zhang VBNC态的诱导
将L.casei Zhang接种于5 mL MRS液体培养基中,在37 ℃恒温静置培养,培养3代,扩培后镜检为纯的L.casei Zhang后,取对数生长末期的菌悬液4 000×g离心5 min,弃上清液,用PBS缓冲溶液洗涤2次。将菌液按2%的接种量接种到5种不同pH值(用乳酸调节MRS液体培养基pH值至2.5、3、4、5、6)的诱导液中,置于4 ℃进行酸和低温胁迫,不同时间点取样,采用3种方法检测细胞活性和完整性。
1.4.2 L.casei Zhang的可培养数检测
在诱导L.casei Zhang VBNC态过程中阶段性取0.5 mL样品,用4.5 mL的灭菌生理盐水按10倍梯度稀释,选择合适梯度采用平板倾注法利用MRS固体培养基进行可培养菌数计数。每次试验3个平行。
1.4.3 L.casei Zhang细胞完整性的检测
LIVE/DEAD BacLightTM试剂盒已被广泛应用在细菌完整性的检测中。将试剂盒中两种染料SYTO 9和碘化丙啶染料(propidium iodide,PI)各稀释至浓度0.1 mmol/L和0.2 mmol/L于-20 ℃保存,取1 mL的液体样品离心,用PBS缓冲液洗2次,并用200 μL PBS缓冲液回溶,加入PI和 SYTO 9各5 μL,振荡均匀后避光染色15 min。在荧光显微镜下观察其细胞完整性,有完整细胞膜结构(活的可培养和VBNC态)的细胞呈绿色,细胞膜结构被破损(死细胞)的细胞呈红色。
1.4.4 L.casei Zhang细胞活性检测
利用流式细胞仪与荧光染料相结合的非培养方法检测L.casei Zhang在不同胁迫下的细胞活性。取1 mL的诱导菌悬液4 000×g离心5 min,弃上清液,用PBS缓冲液洗涤2次后回溶,将菌浓度稀释至106 CFU/mL左右,然后加入两种荧光染料(0.1 mmol/L SYTO 9和0.2 mmol/L PI)各10 μL,充分混合,避光染色15 min后,采用CytoFLEX流式细胞仪检测其细胞活性。
1.4.5 L.casei Zhang VBNC态纯度鉴定与细胞形态观察
为避免在诱导过程中进行阶段性取样时杂菌污染而影响检测结果,每次实验都做革兰氏染色观察其细胞形态,并每隔一段时间取适量样本,采用16S rDNA序列分析法进行细菌鉴定以检验样本纯度。
2 结果与分析
2.1 L.casei Zhang可培养活菌数的变化
L.casei Zhang在不同pH MRS液体培养基诱导VBNC态过程中可培养细胞数的变化如图1所示。
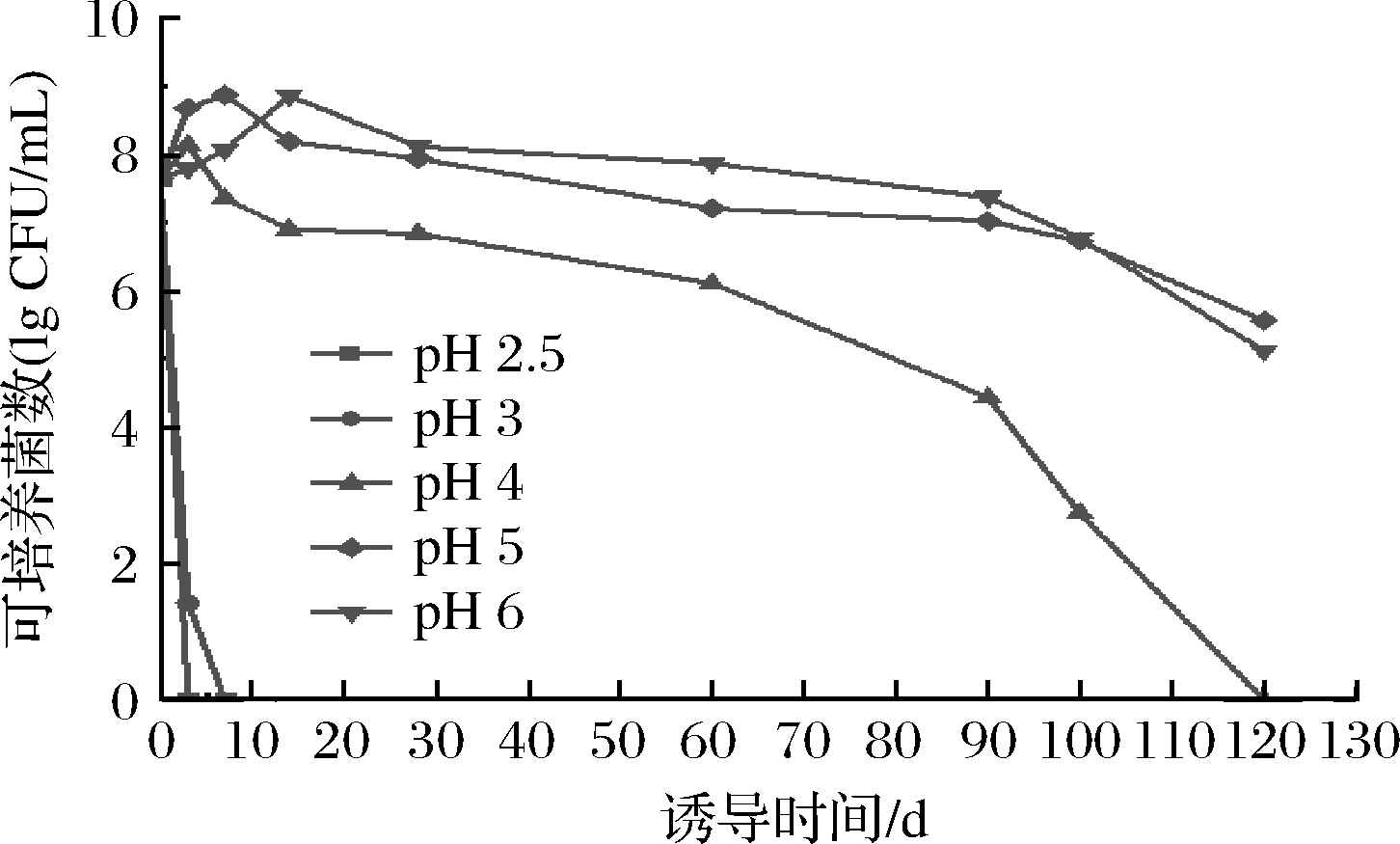
图1 不同胁迫条件下L.casei Zhang可培养细胞数的变化
Fig.1 Changes of the culturable counts of L.casei Zhang under different stress conditions
由图1可知,不同胁迫条件下L.casei Zhang的可培养数随着诱导时间而降低。当细胞被置于pH 2.5和pH 3的MRS液体培养基时,菌体的可培养数分别在第3天和第7天降为0;当L.casei Zhang被置于pH 4 的MRS液体培养基时,菌体的可培养数先增加后降低,从初始3.4×107 CFU/mL先升高到3 d的1.36×108 CFU/mL,随后下降,其中3~28 d内呈缓慢下降趋势,28 d后下降速度加快,直到120 d活菌数降为0;当L.casei Zhang被置于pH 5和pH 6的诱导培养基中,菌体的可培养数先上升后下降,下降速度较pH 4条件缓慢。
2.2 L.casei Zhang细胞完整性检测
VBNC态的细胞膜保持着完整性和被检测性[17]。LIVE/DEAD BacLightTM试剂盒结合荧光显微镜在检测细菌完整性方面已被广泛应用[18]。荧光染料SYTO 9可以透过所有细胞膜与DNA结合,在荧光显微镜下呈绿色荧光;而荧光染料PI只能透过破损的细胞膜与SYTO 9竞争结合位点,在荧光显微镜下产生红色荧光[19]。当平板菌落计数法检测的可培养菌数为0,且荧光显微镜视野中仍然存在完整性的绿色荧光细胞时,认为菌体在诱导条件下可以获得VBNC态[20]。
L.casei Zhang在可培养数为0时的细胞完整性部分检测结果如图2所示。L.casei Zhang被pH 2.5和pH 3的MRS液体培养基处理第7天,在荧光显微镜视野中细胞全部均为红色,如图2-a所示,说明在此条件下细胞直接进入了死亡态,未进入VBNC态。L.casei Zhang被pH 4的MRS液体培养基处理120 d时,从图2-b可以看出当可培养菌数为0时,荧光显微镜视野中存在绿色细胞,说明绿色细胞是VBNC态细胞,在此诱导条件下,L.casei Zhang能够进入VBNC态。
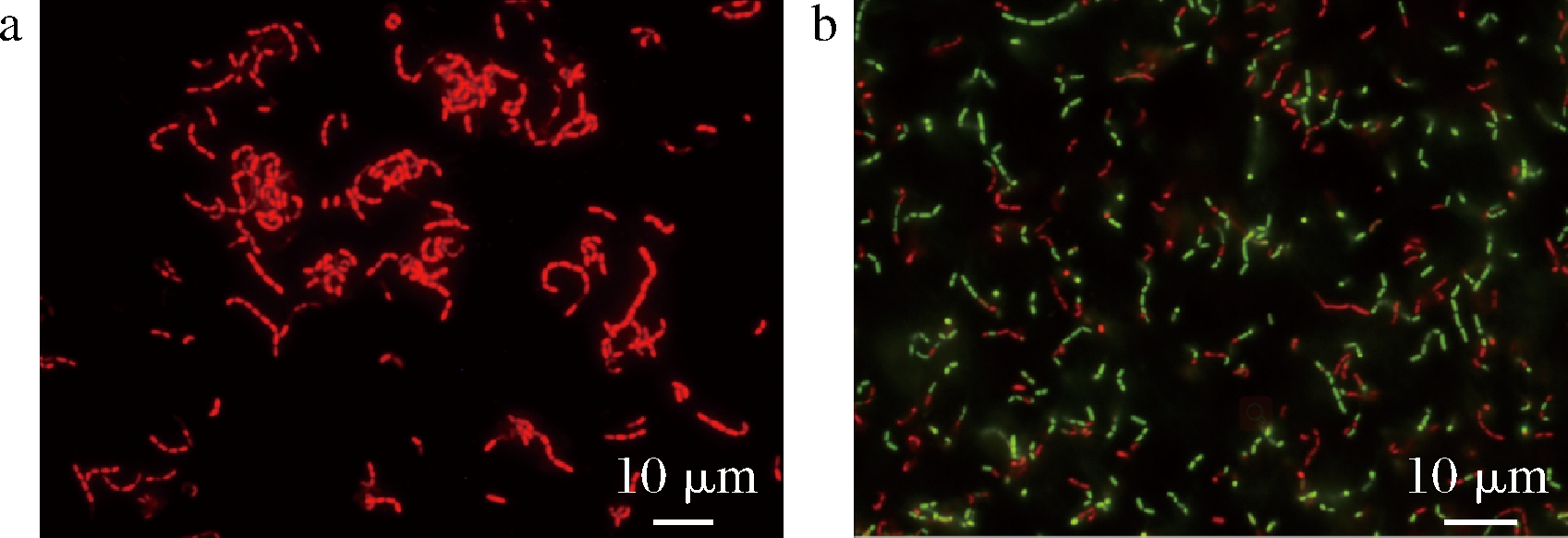
a-死菌;b-pH 4.0
图2 L.casei Zhang诱导过程中荧光显微镜图
Fig.2 Fluorescence microscopy results during induction of L.casei Zhang
2.3 流式细胞术检测L.casei Zhang细胞活性
近几年,利用流式细胞仪(flow cytometer, FCM)与荧光染料相结合的非培养方法在检测细胞活性方面被广泛应用,常用的检测细菌活性的荧光染料有PI与SYTO 9,当采用SYTO 9处理样品时,SYTO 9会使具有完整细胞膜的细胞发出绿色荧光,当采用PI处理样品时,PI只能透过死菌发出红色荧光[21-22]。
在不同pH的MRS液体培养基诱导L.casei Zhang VBNC态过程中,采用流式细胞仪检测L.casei Zhang的细胞活性,结果如图3所示。图3是以FITC(SYTO 9)为x轴,PE(PI)为y轴。其中Q1为未染色区域,Q2为死菌区域,Q3为活菌区域,Q4为VBNC态区域。
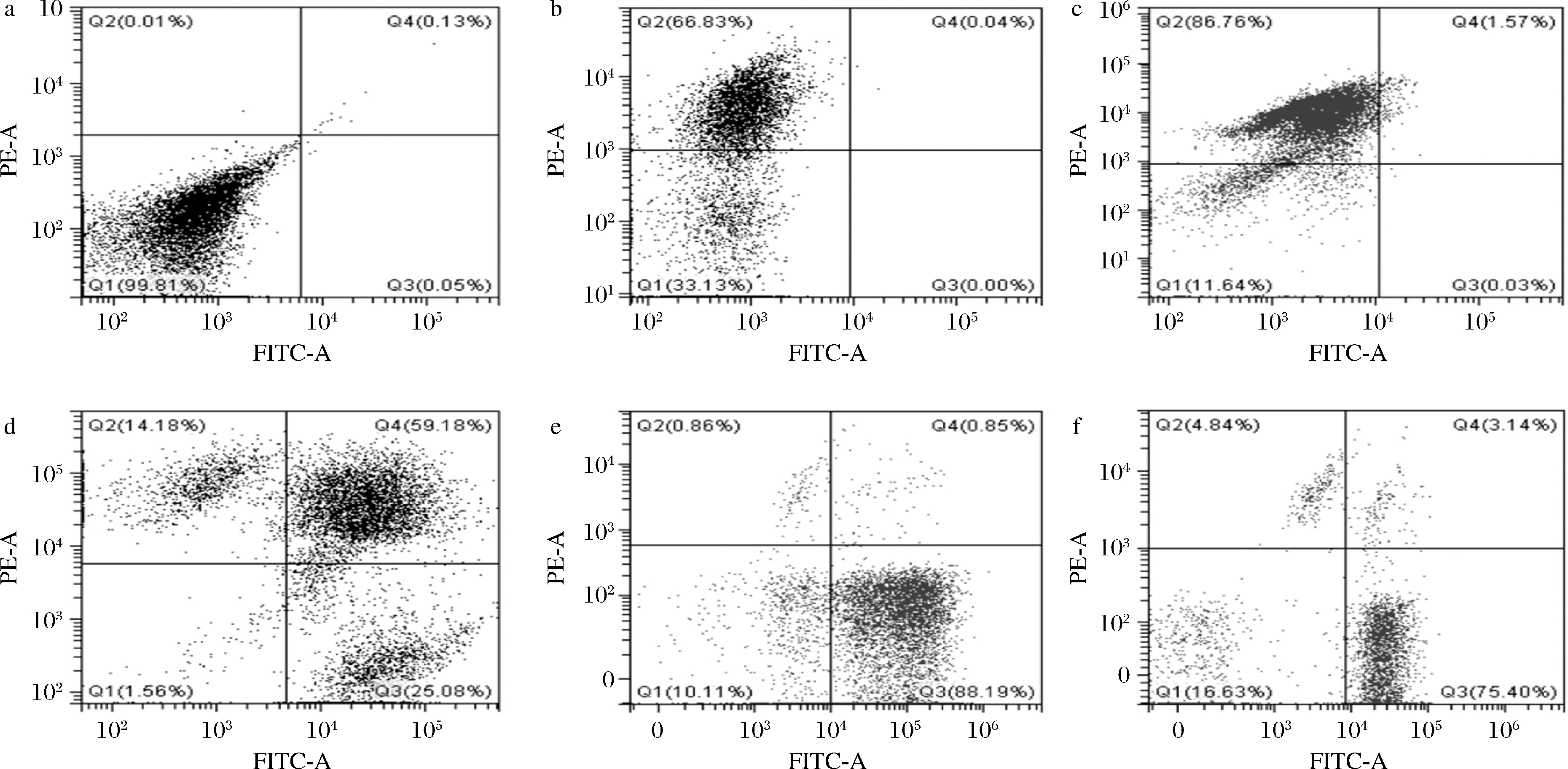
a-空白对照组;b-pH 2.5;c-pH 3.0;d-pH 4.0;e-pH 5.0;f-pH 6.0
图3 L.casei Zhang VBNC态诱导过程中流式细胞图
Fig.3 Flow cytometry fluorescence dot plot of L.casei Zhang during the induction
L.casei Zhang被pH 2.5和pH 3的MRS液体培养基分别诱导第3天和第7天时,大部分细胞处于死菌区域(图3-b、图3-c),表明细胞未进入VBNC态,而是直接进入死亡;L.casei Zhang被pH 5和pH 6的MRS液体培养基诱导120 d,Q3区域细胞颗粒数分别为88.19%和75.40% (图3-e、图3-f),表明处于活性状态的细胞大于75%,结合图1结果,推断这2个条件和120 d的时间节点未能获得VBNC态。
采用流式细胞术检测L.casei Zhang被pH 4的MRS液体培养基诱导120 d的结果见图3-d,Q4区域细胞颗粒数(VBNC态)占59.18%,Q2区域细胞颗粒数占14.18%,说明细胞此时大部分处于VBNC态,少数细胞进入了死亡态。该结果和前文的可培养数与细胞膜完整性结果相结合,完全符合细胞进入VBNC态的特征。PALOMA等[23]通过使用流式细胞术也检测到了大量常规平板计数法无法检测到的阪崎肠杆菌受损细胞,并且能够将VBNC态细胞与活细胞和死细胞区分开。
综上所述,L.casei Zhang在pH 4的MRS液体培养基作为诱导液时可以获得VBNC态。
2.4 L.casei Zhang VBNC态的纯度鉴定与细胞形态观察
2.4.1 纯度鉴定
为了排除诱导过程中对L.casei Zhang进行阶段性取样时引入杂菌污染菌体影响检测结果。部分实验样本采用16S rDNA进行细菌鉴定。所测样本的16S rDNA序列单一、无双峰,经BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,与L.casei Zhang的基因组序列同源性为100%,说明菌体在诱导过程中未发生污染。
2.4.2 细胞形态观察
采用显微镜观察L.casei Zhang正常态(对数期细胞)和VBNC态(酸和低温诱导120 d的细胞)细胞形态,革兰氏染色结果如图4所示。从图4-a可以看到L.casei Zhang对数期细胞呈直杆状且成链状排列;L.casei Zhang VBNC态细胞的细胞长度变短变弯曲,且大部分细胞呈聚式排列(图4-b)。这一结果与许多研究[24-25]的结果相似,其中金磊等[25]在MRS液体培养基中-20 ℃有氧条件诱导植物乳杆菌,发现进入VBNC态细胞的体积变小,菌体较聚集,且细胞结构完整。

a-L.casei Zhang正常态细胞;b-L.casei Zhang VBNC态细胞
图4 L.casei Zhang正常态和VBNC态的革兰氏染色图
Fig.4 Gram staining of L.casei Zhang normal and VBNC states
3 结论与讨论
本研究通过低温和酸的不同条件对L.casei Zhang进行VBNC态诱导,诱导过程中采用平板计数法、荧光显微镜观察法和流式细胞术3种方法对L.casei Zhang的细胞活性和完整性进行检测。结果表明L.casei Zhang在pH 4的MRS液体培养基4 ℃低温胁迫菌体120 d时能够形成VBNC态。革兰氏染色观察到VBNC态细胞长度变短变弯曲。
乳酸菌具有很高的耐酸性,在低浓度的酸胁迫下,为了维持细胞内的酸平衡,保护细胞免受损伤,细胞会产生许多应激反应来应对酸胁迫,譬如通过改变细胞膜通透性、胞内pH和产生应激蛋白等[26-27]。本研究L.casei Zhang在pH 4的低温胁迫条件下,细胞会通过进入VBNC态躲避酸胁迫。研究发现乳酸可能也是一个促进乳酸菌进入VBNC态的条件,可能由于乳酸是一种弱酸,其pKa为3.86,大多数弱酸是以分子状态存在于pKa的酸性中,分子态的弱酸很容易通过细胞膜进入细胞,随着乳酸浓度的增加,细胞内游离有机阴离子的积累可能会由于渗透压和压力的增加而导致细胞受损[28]。所以导致L.casei Zhang进入了VBNC态。该研究为益生菌L.casei Zhang进入VBNC态的条件及菌体活力提升提供了一定的参考依据。
[1] DONG K, PAN H X, YANG D, et al.Induction, detection, formation, and resuscitation of viable but non-culturable state microorganisms[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(1):149-183.
[2] WAGLEY S, MORCRETTE H, KOVACS-SIMON A, et al.Bacterial dormancy:A subpopulation of viable but non-culturable cells demonstrates better fitness for revival[J].PLoS Pathogens, 2021, 17(1):e1009194.
[3] 包秋华, 马学波, 任艳, 等.应用拉曼光谱对比分析德式乳杆菌保加利亚亚种ND02及其VBNC态细胞成分[J].食品科学, 2022, 43(10):114-118.
BAO Q H, MA X B, REN Y, et al.Comparative analysis of cellular components of Lactobacillus delbrueckii subsp.bulgaricus ND02 in normal and viable but non-culturable state by Raman spectroscopy[J].Food Science, 2022, 43(10):114-118.
[4] ULTEE E, KARINA R, RAMIJAN K, et al.Stress-induced adaptive morphogenesis in bacteria[J].Advances in Microbial Physiology, 2019, 74:97-141.
[5] SE J, FU Y L, XIE Y A, et al.Proteomic changes of viable but nonculturable (VBNC) Escherichia coli O157:H7 induced by low moisture in an artificial soil[J].Biology and Fertility of Soils, 2021, 57(2):219-234.
[6] 蒋丽芬. 低温辅助超声波诱导鼠伤寒沙门氏菌的VBNC态及其复苏研究[D].无锡:江南大学, 2017.
JIANG L F.Study on VBNC state and resuscitation of Salmonella typhimurium induced by cryogenically assisted ultrasound[D].Wuxi:Jiangnan University, 2017.
[7] YAN H Y, LI M, MENG L L, et al.Formation of viable but nonculturable state of Staphylococcus aureus under frozen condition and its characteristics[J].International Journal of Food Microbiology, 2021, 357:109381.
[8] LIU J Y, DENG Y, SOTEYOME T, et al.Induction and recovery of the viable but nonculturable state of hop-resistance Lactobacillus brevis[J].Frontiers in Microbiology, 2018, 9(10):2076.
[9] 包秋华, 刘倩宇.基于Web of Science细菌活但非可培养态研究文献的可视化分析[J].食品科学, 2023, 44(5): 248-256.
BAO Q H, LIU Q Y.Visual analysis of bacterial viable but non-culturable state research literatures based on Web of Science[J].Food Science, 2023, 44(5): 248-256.
[10] ABEDI E, HASHEMI S M B.Lactic acid production-producing microorganisms and substrates sources-state of art[J].Heliyon, 2020, 6(10):e04974.
[11] PUNIA BANGAR S, SURI S, TRIF M, et al.Organic acids production from lactic acid bacteria:A preservation approach[J].Food Bioscience, 2022, 46:101615.
[12] 杨婕, 郭金凤, 李宝坤, 等.酸-冷交互胁迫对保护冷冻干燥发酵乳杆菌活性的作用[J].食品科学, 2020, 41(2):101-106.
YANG J, GUO J F, LI B K, et al.Cryoprotective effect of acid-cold cross stress on Lactobacillus fermentum[J].Food Science, 2020, 41(2):101-106.
[13] 张猛, 贾星, 张和平, 等.干酪乳杆菌Zhang在逆境条件下基因表达的差异分析[J].中国食品学报, 2021, 21(6):62-69.
ZHANG M, JIA X, ZHANG H P, et al.Analysis of differential gene expression of Lactobacillus casei Zhang under adverse circumstances[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(6):62-69.
[14] 张勇. 从单菌株组学到宏基因组学: Lactobacillus casei Zhang益生功能[J].科学通报, 2019, 64(3):307-314.
ZHANG Y.Probiotic effects of Lactobacillus casei Zhang:From single strain omics to metagenomics[J].Chinese Science Bulletin, 2019, 64(3):307-314.
[15] 张和平, 武婷.干酪乳酪杆菌Zhang的益生特性及其在发酵乳制品中的应用研究[J].中国食品学报, 2022, 22(5):1-7.
ZHANG H P, WU T.Beneficial properties of Lacticaseibacillus casei Zhang and its application in fermented dairy products[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(5):1-7.
[16] 王亚利, 包秋华, 王俊国, 等.乳酸菌活的非可培养态的研究进展[J].中国乳品工业, 2016, 44(3):41-45.
WANG Y L, BAO Q H, WANG J G, et al.Progress on the viable but non-culturable (VBNC) state of lactic acid bacteria[J].China Dairy Industry, 2016, 44(3):41-45.
[17] XAVIER R N, MORGAN H W, MCDONALD I R, et al.Effect of long-term starvation on the survival, recovery, and carbon utilization profiles of a bovine Escherichia coli O157:H7 isolate from New Zealand[J].Applied and Environmental Microbiology, 2014, 80(14):4383-4390.
[18] KASSEM I I, CHANDRASHEKHAR K, RAJASHEKARA G.Of energy and survival incognito:A relationship between viable but non-culturable cells formation and inorganic polyphosphate and formate metabolism in Campylobacter jejuni[J].Frontiers in Microbiology, 2013, 4(7):183.
[19] STIEFEL P, SCHMIDT-EMRICH S, MANIURA-WEBER K, et al.Critical aspects of using bacterial cell viability assays with the fluorophores SYTO 9 and propidium iodide[J].BMC Microbiology, 2015, 15:36.
[20] 李影, 魏忠彬, 钱爱东, 等.乳酸杆菌活的非可培养状态诱导条件的筛选与荧光观察[J].中国兽医科学, 2008, 38(10):878-883.
LI Y, WEI Z B, QIAN A D, et al.Screening of conditions inducing Lactobacillus lactis to be viable but nonculturable state and fluorescence observation of VBNC L.lactis[J].Chinese Veterinary Science, 2008, 38(10):878-883.
[21] SUO Y Z, GU Z Q, WEI X B.Advances of in vivo flow cytometry on cancer studies[J].Cytometry Part A, 2019, 97(1):15-23.
[22] MAJEED M, MAJEED S, NAGABHUSHANAM K, et al.Rapid assessment of viable but non-culturable Bacillus coagulans MTCC 5856 in commercial formulations using flow cytometry[J].PLoS One, 2018, 13(2):e0192836.
[23] PALOMA C S, IRMA C, MARIA J C, et al.Flow cytometry to assess the counts and physiological state of Cronobacter sakazakii cells after heat exposure[J].Foods, 2019, 8(12):688.
[24] 许婷. 双歧杆菌活的非可培养状态的研究[D].吉林:吉林农业大学, 2008.
XU T.Study on viable non-culturable state of Bifidobacterium[D].Jilin:Jilin Agricultural University, 2008.
[25] 金磊, 王丽,钟青萍.植物乳杆菌活的非可培养状态的初步研究[J].食品工业科技, 2013, 34(16):187-190.
JIN L, WANG L, ZHONG Q P.Preliminary study on the viable but non-culturable state of Lactobacillus plantarum[J].Science and Technology of Food Industry, 2013, 34(16):187-190.
[26] ZHANG H, KONG B, LIU H T, et al.Physiology and antioxidant activity of Pediococcus pentosaceus R1 and Lactobacillus fermentum R6 in response to lactic acid stress[J].LWT-Food Science and Technology, 2021, 149:111878.
[27] BROADBENT J R, LARSEN R L, DEIBEL V, et al.Physiological and transcriptional response of Lactobacillus casei ATCC 334 to acid stress[J].Journal of Bacteriology, 2010, 192(9):2445-2458.
[28] CARPENTER C E, BROADBENT J R.External concentration of organic acid anions and pH:Key independent variables for studying how organic acids inhibit growth of bacteria in mildly acidic foods[J].Journal of Food Science, 2009, 74(1):12-15.