γ-氨基丁酸(γ-aminobutyric acid,GABA),是一类非蛋白质氨基酸[1],作为一种重要的抑制性神经递质[2],被用来减轻癫痫[3]、改善运动能力[4]和抑制哮喘[5]等,提高茶叶中GABA含量及其品质,对人类健康有着重要意义。黄金芽是一个黄色系变异的白化稀有品种,被大面积推广种植,其氨基酸含量是普通茶树品种的2~3倍,其中谷氨酸是合成GABA的前体物质[6],为合成GABA提供了充足的物质基础。
张金玉等[7]运用同种加工工艺处理福鼎大白茶、黄金芽和白叶1号,结果发现黄金芽的GABA含量最高。DAI等[8]研究表明,厌氧处理使茶叶GABA含量增加了16倍;WU等[9]研究了GABA分流和多胺(polyamine,PA)降解途径对新鲜茶叶GABA积累的影响,发现厌氧能积累GABA,好氧处理GABA积累减少,再次厌氧,GABA的积累又有所提升。邵文韵[10]研究发现谷氨酸溶液处理茶叶的效果略好于谷氨酸钠溶液,喷洒处理的效果好于浸泡处理。目前,可通过厌氧和外源喷施谷氨酸钠等方法富集GABA[11],且这方面的研究已经取得十分可观的进展,但厌氧处理和喷施谷氨酸钠等方法均会使成品茶产生不愉悦气味,导致大众接受度不高,影响其市场推广。
利用具备高安全性可食用微生物生产GABA的研究有很多,如酵母菌[12]和短乳杆菌[13]等,但将微生物运用到茶叶生产中的很少,尤其是运用到绿茶加工工艺中的更是鲜有报道。本研究以高氨基酸含量的黄金芽为原料,以保加利亚乳杆菌、嗜热链球菌、植物乳杆菌、酵母菌YA200和酿酒酵母共5种可食用菌为试验菌种,结合绿茶加工工艺,通过感官审评和理化分析,探求不同菌种对黄金芽GABA的富集效果和对茶叶品质的影响,为生产高品质高GABA黄金芽绿茶提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
黄金芽一芽二、三叶,10月份采摘自贵州省瓮安鑫产园茶叶有限公司茶园。
1.1.2 主要试剂
GABA、茶氨酸(Thea)、谷氨酸(Glu)等19种氨基酸标品(纯度≥98%),成都克洛玛生物科技有限公司;保加利亚乳杆菌、嗜热链球菌、植物乳杆菌、酿酒酵母冻干粉,贵州慕为美科技有限公司;YA200酵母菌,安琪酵母股份有限公司;儿茶素(catechinic acid,C)、表儿茶素(epicatechin,EC)、没食子儿茶素(epigallocatechin,GC)、儿茶素没食子酸酯(catechin gallate,CG)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和咖啡碱(caffeine,CAF)标品(纯度≥98%)、2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)、NaHCO3、KH2PO4、NaAc、HAc(分析纯,纯度≥99.5%)、四氢呋喃(tetrahydrofuran,THF)、乙腈、甲醇(HPLC级),北京索莱宝科技有限公司。
1.2 仪器与设备
6CSF-110超高温热风茶叶滚筒杀青机、6CR-65全自动茶叶揉捻机,浙江上洋机械股份有限公司;6CFJ-8B红茶发酵机,贵州双木农机有限公司;WGL-45B电热恒温鼓风干燥箱,天津泰斯特仪器有限公司;UItiMate 3000高效液相色谱仪、X1R通用台式离心机,ThermoFisher Scientific。
1.3 实验方法
1.3.1 不同菌种处理茶样制备
工艺流程:鲜叶→杀青→揉捻→接菌→干燥;具体操作如下:黄金芽鲜叶统一经350 ℃滚筒杀青,按轻-重-轻先后揉捻,共揉捻40 min。称取揉捻叶每份 500 g 共6份。参考李亚莉等[14]的方法,结合实际情况,分别配制浓度为10%的不同菌液100 mL,将100 mL纯净水(CK)和不同菌液分别喷施在揉捻叶上,保加利亚乳杆菌、嗜热链球菌和植物乳杆菌放在37 ℃发酵箱,酵母菌YA200和酿酒酵母室温放置,均放置4 h,于干燥箱80 ℃烘2 h,制成干茶。纯净水、保加利亚乳杆菌、嗜热链球菌、植物乳杆菌、酵母菌YA200、酿酒酵母处理的样品,其编号分别用CK、1、2、3、4、5表示。
1.3.2 感官审评
依照GB/23776—2018《茶叶感官审评方法》中的绿茶审评方法,结合DB32/T 3210—2017《黄金芽茶质量分级》中的黄金芽审评方法,由5位审评专家对样品的外形、汤色、香气、滋味和叶底进行密码审评。计分时按外形15%、汤色10%、香气30%、滋味35%、叶底10%的权重进行加权平均计算。
1.3.3 检测方法
1.3.3.1 GABA含量测定
参考邵文韵[10]的方法,略做改动。样品测定:茶样磨碎,过100目筛,称取各茶样3份,每份0.3 g(感量0.000 1 g)于100 mL离心管中,加50 mL 50%(体积分数)乙醇,放入70 ℃水浴锅浸提30 min(隔10 min摇动1次),取出冷却至室温,分别吸取上清液1 mL放入2 mL离心管内,于12 000 r/min,4 ℃条件下离心10 min。离心后各取200 μL上清液加入20 μL 10 g/L的DNFB,100 μL 0.5 mol/L NaHCO3(pH 9.0)和180 μL超纯水,密封混匀,于60 ℃水浴锅暗反应1 h后冷却至室温,加入400 μL 0.01 mol/L KH2PO4(pH 7.0),摇匀后放置15 min,离心,过0.22 μm滤头,待测。
建立标曲:配制质量浓度为1.0 mg/mL的GABA标准溶液,分别吸取5、10、20、40、80、160 μL标准溶液于1 mL离心管中,定容至1 mL混匀。取200 μL加入20 μL 10 g/L的FDBN,100 μL 0.5 mol/L NaHCO3(pH 9.0)和180 μL超纯水,密封混匀,于60 ℃水浴锅暗反应1 h后冷却至室温,加入400 μL 0.01 mol/L KH2PO4(pH 7.0),摇匀放置15 min,过0.22 μm滤头,待测。
色谱条件:A:称取0.680 4 g NaAc,加入50 mL THF,定容至1 L;B:甲醇。色谱柱:HITACHI LACHROM C18(4.6 mm×250 mm,5 μm);柱温:35 ℃;检测波长:360 nm;流速:1 mL/min;进样量:20 μL;梯度洗脱程序如表1所示。
表1 GABA 测定梯度洗脱程序
Table 1 Gradient elution procedure for GABA determination

时间/minA/%B/%0802035406035.18020408020
1.3.3.2 主要品质成分测定
儿茶素组分和CAF检测参考杨金川等[15]方法,略做改动;样品制备:准确称取0.200 0 g过100目筛的茶粉于15 mL离心管,加10 mL 70%(体积分数)甲醇,70 ℃水浴锅提取10 min(每5 min摇1次),4 ℃,8 000 r/min离心5 min,将上清液移到25 mL容量瓶。残渣用5 mL 70%甲醇重复提取1次,合并上清液,并用稳定溶液(25 mL 10 g/L EDTA+25 mL 10 g/L维生素C+50 mL甲醇+400 mL超纯水)定容,摇匀,过0.22 μm滤头,待测。
色谱条件:色谱柱:HITACHI LACHROM C18(4.6 mm×250 mm,5 μm);检测波长:275 nm,流速1 mL/min,柱温30 ℃,进样量10 μL,梯度洗脱程序如表2。
表2 儿茶素组分和咖啡碱测定梯度洗脱程序
Table 2 Gradient elution procedure for catechin component and caffeine determination
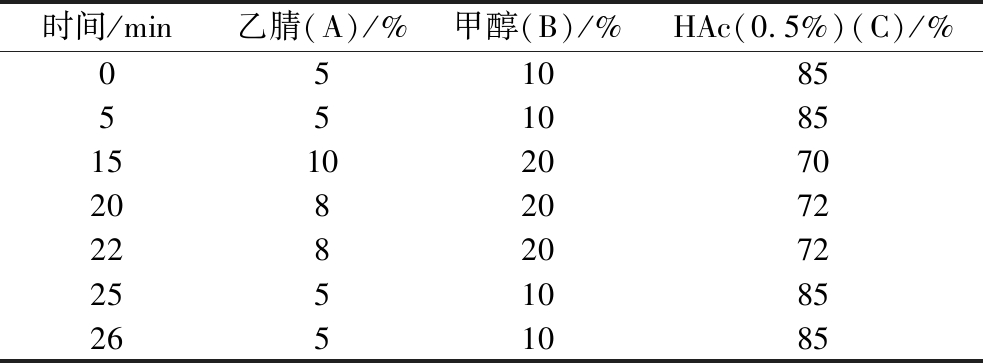
时间/min乙腈(A)/%甲醇(B)/%HAc(0.5%)(C)/%051085551085151020702082072228207225510852651085
氨基酸组分测定参考叶玉龙[16]的测定方法,略作改动;茶汤制备称取0.300 0 g过100目筛茶粉于50 mL离心管中,加沸蒸馏水45 mL,立即转入沸水浴浸提45 min(每10 min摇1次),8 000 r/min离心10 min,将上清液转入50 mL容量瓶,冷却后用水定容,摇匀。吸取40 μL茶汤、200 μL 1% DNFB、200 μL NaHCO3(0.5 mol/L,pH 9.0)和360 μL超纯水于2 mL 离心管中混匀,60 ℃暗水浴60 min,冷却至室温后加入800 μL KH2PO4(0.01 mol/L,pH 7.0),窝旋1 min,暗条件放置15 min,过0.22 μm滤头,待测。
色谱条件:流动相A:色谱柱:Agilent C18色谱柱(4.6 mm×250 mm,5 μm);检测波长:360 nm,流速0.9 mL/min,柱温35 ℃,进样量10 μL,梯度洗脱程序如表3。流动相:A:V[NaAc(4 mmol/L,pH 5.5)]∶V(THF)=96∶4;B:V(乙腈)∶V(水)=80∶20;梯度程序如表3所示。
表3 氨基酸测定梯度洗脱程序
Table 3 Gradient elution procedure for amino acid component determination
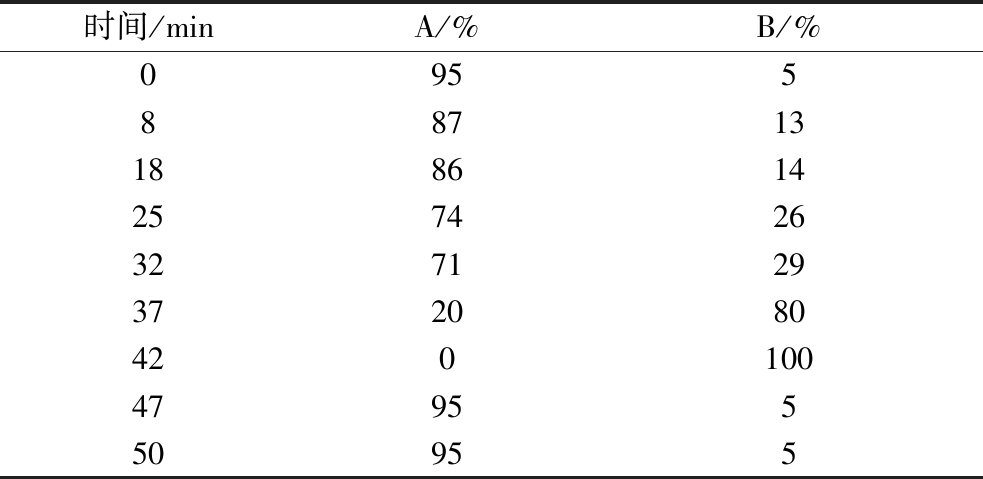
时间/minA/%B/%0955887131886142574263271293720804201004795550955
1.4 数据处理
运用SPSS对接菌样和CK样的数据进行处理,运用TBtools、SIMCA和Origin 2018绘图。
2 结果与分析
2.1 不同菌种对黄金芽绿茶感官品质影响
感官审评结果如图1所示,不同菌种处理对茶样的外形没有显著影响,对汤色影响较大。具体见表4。菌种处理的茶样中,1和4处理茶样汤色黄绿较明亮,5汤色黄绿尚明亮,评分较低,在90.17~90.33分;2和3汤色绿黄明亮,和CK没有显著差别,评分较高,在90.67~91.83分。

图1 不同菌种处理茶样感官审评图片
Fig.1 Photos of sensory evaluation of tea samples treated with different strains
表4 不同菌种处理茶样感官审评结果
Table 4 Sensory evaluation results of tea samples treated with different strains
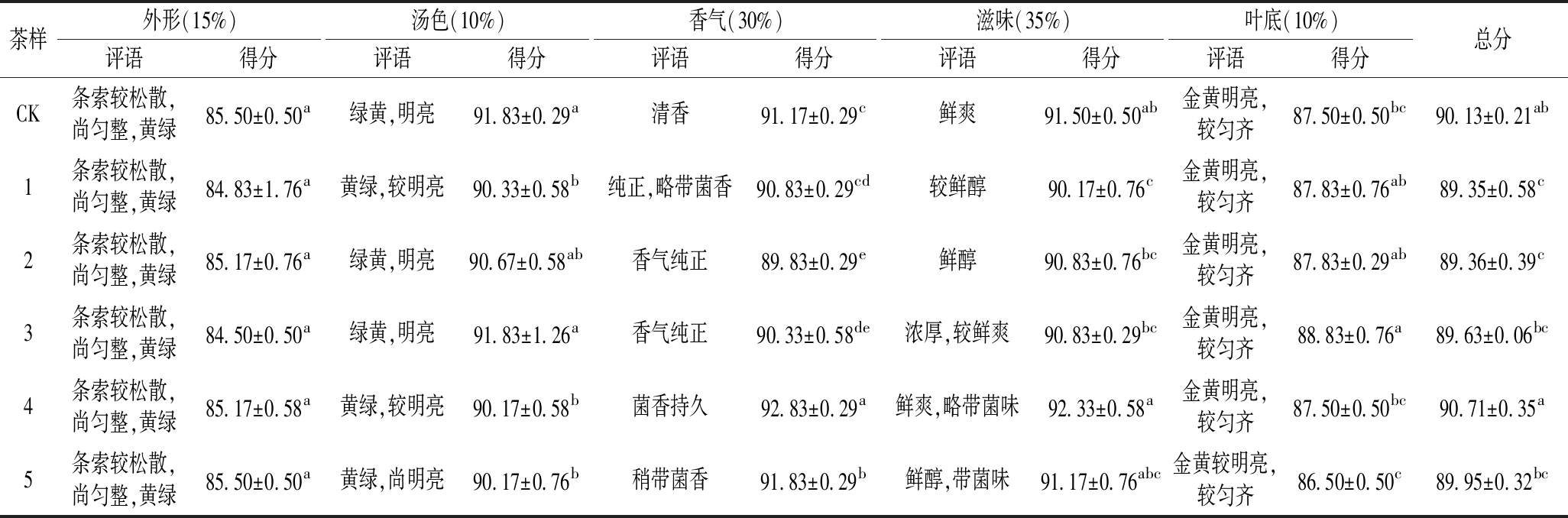
注:不同小写字母代表显著差异(P<0.05)(下同)。
茶样外形(15%)汤色(10%)香气(30%)滋味(35%)叶底(10%)评语得分评语得分评语得分评语得分评语得分总分CK条索较松散,尚匀整,黄绿85.50±0.50a绿黄,明亮91.83±0.29a清香91.17±0.29c鲜爽91.50±0.50ab金黄明亮,较匀齐87.50±0.50bc90.13±0.21ab1条索较松散,尚匀整,黄绿84.83±1.76a黄绿,较明亮90.33±0.58b纯正,略带菌香90.83±0.29cd较鲜醇90.17±0.76c金黄明亮,较匀齐87.83±0.76ab89.35±0.58c2条索较松散,尚匀整,黄绿85.17±0.76a绿黄,明亮90.67±0.58ab香气纯正89.83±0.29e鲜醇90.83±0.76bc金黄明亮,较匀齐87.83±0.29ab89.36±0.39c3条索较松散,尚匀整,黄绿84.50±0.50a绿黄,明亮91.83±1.26a香气纯正90.33±0.58de浓厚,较鲜爽90.83±0.29bc金黄明亮,较匀齐88.83±0.76a89.63±0.06bc4条索较松散,尚匀整,黄绿85.17±0.58a黄绿,较明亮90.17±0.58b菌香持久92.83±0.29a鲜爽,略带菌味92.33±0.58a金黄明亮,较匀齐87.50±0.50bc90.71±0.35a5条索较松散,尚匀整,黄绿85.50±0.50a黄绿,尚明亮90.17±0.76b稍带菌香91.83±0.29b鲜醇,带菌味91.17±0.76abc金黄较明亮,较匀齐86.50±0.50c89.95±0.32bc
CK样香气清香,接菌样香气纯正带菌香,4和5香气和滋味都带特殊菌味,显著优于其他茶样;其中4的菌香持久,香气得分为92.83±0.29,显著高于其他茶样,滋味鲜爽,略带菌味,得分为92.33±0.58,略高于CK和5,显著高于1、2和3,表明酵母菌YA200对茶样的香气和滋味影响最大。所有茶样叶底金黄明亮,较匀齐,外观差别不大。茶样感官审评综合评分结果为:4(90.71)>CK(90.13)>5(89.95)>3(89.63)>2(89.36)>1(89.35)。综上,酵母菌YA200处理的茶样香气、滋味和感官审评综合评分最高,所有茶样中整体表现最好。
2.2 不同菌种对黄金芽绿茶GABA含量影响
不同菌种对黄金芽绿茶GABA的含量影响如图2所示,与CK相比,接菌均能显著提高黄金芽中的GABA含量。1、2和3的GABA含量显著低于4和5。所有茶样中CK的GABA含量最低,为(0.228±0.02)mg/g,接菌样中,1的GABA含量最低,为(0.396±0.01) mg/g,4的GABA含量为(1.478±0.047) mg/g,显著高于其他茶样,是CK的6.48倍,1的3.73倍,2的2.44倍,3的2.14倍,5的1.48倍;5的GABA含量为(0.999±0.06) mg/g,仅次于4。
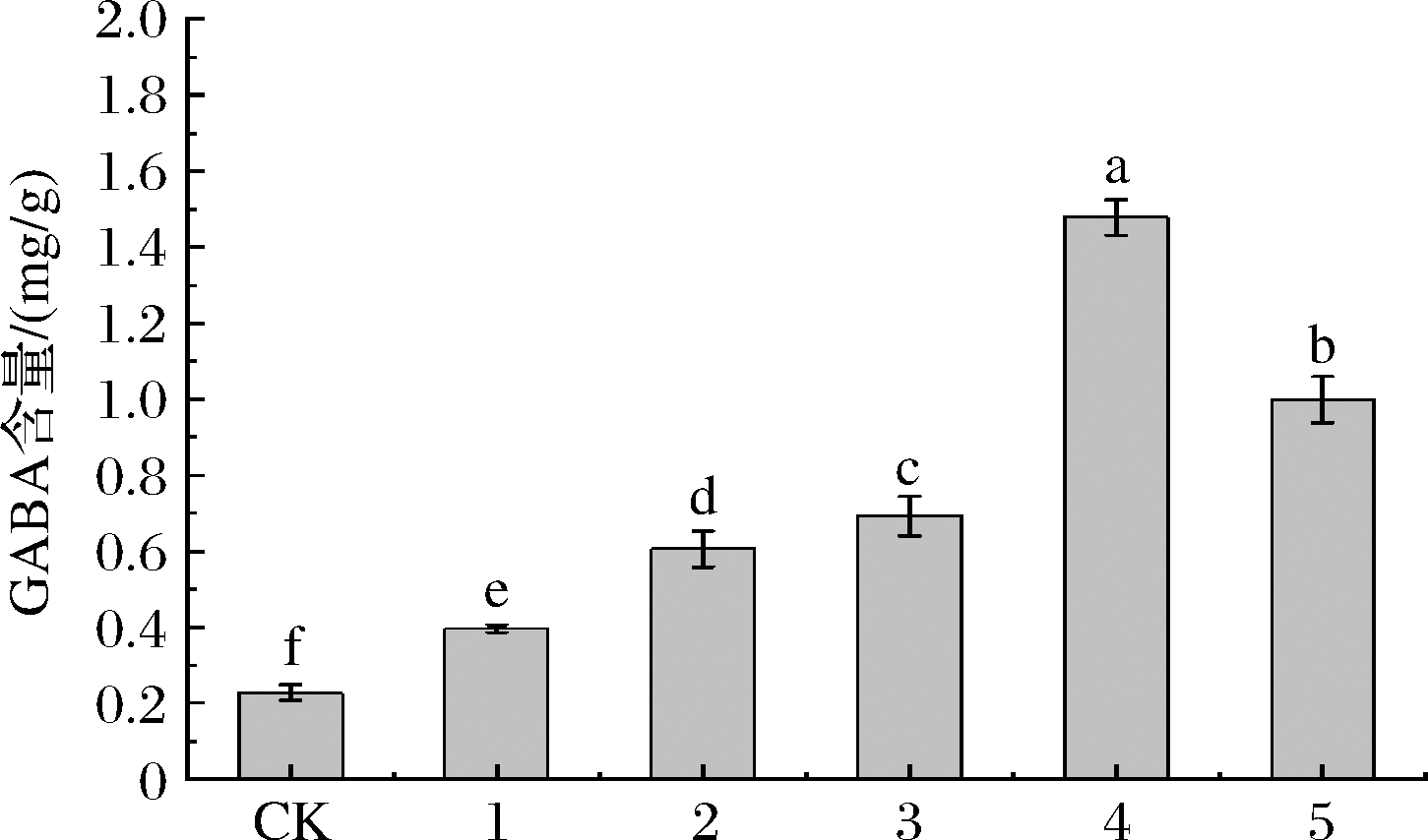
图2 不同菌种处理茶样GABA含量
Fig.2 GABA content of tea samples treated with different strains
注:不同小写字母代表显著差异(P<0.05)(下同)。
2.3 不同菌种对黄金芽绿茶儿茶素组分和咖啡碱含量影响
不同菌种对黄金芽儿茶素组分影响如表5所示,接菌茶样儿茶素总量显著高于CK,EGCG在儿茶素组分中含量最高,在所有茶样中,EGCG占儿茶素总量的42.12%~47.20%。C、EC、EGC和GC属于简单儿茶素,EGCG、CG、GCG和ECG属于酯型儿茶素[17]。与CK相比,接菌样品的简单儿茶素均呈增加趋势,增幅为34.38%~45.45%;其中,1的简单儿茶素的含量最高;不同菌种对茶样酯型儿茶素的影响不同,2增加了4.72%,3增加了0.24%,1、4和5的酯型儿茶素则呈下降趋势,分别降低了1.56%、9.33%和10.00%。不同菌种处理均显著降低茶样CAF含量,4和 5的CAF分别下降了18.55%和24.38%。
表5 不同菌种处理茶样儿茶素组分和咖啡碱含量
Table 5 Catechin components and caffeine contents of tea samples treated with different strains
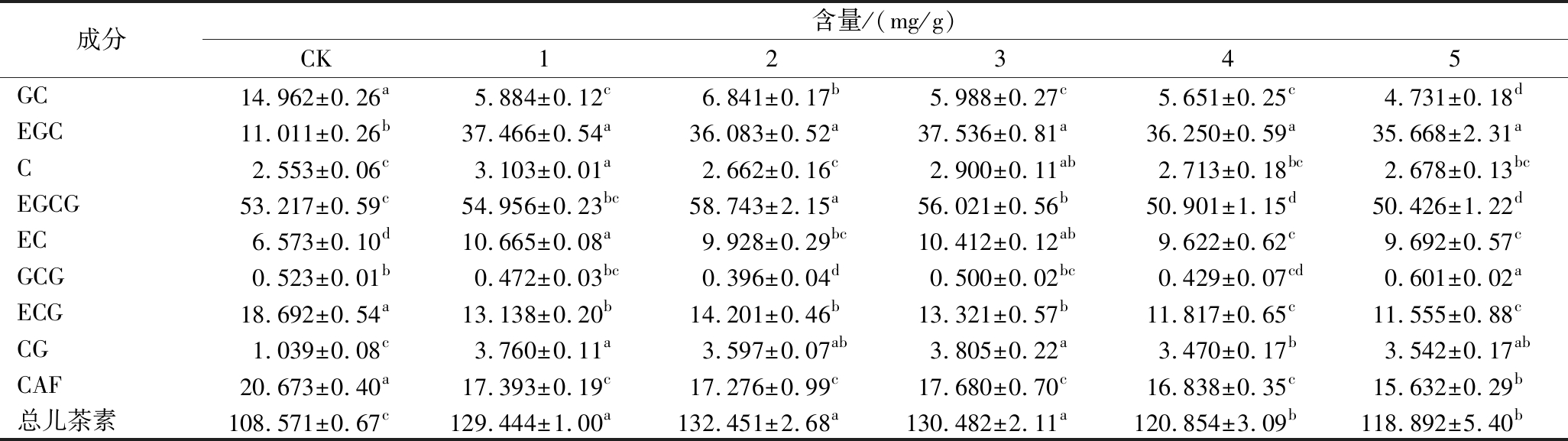
成分含量/(mg/g)CK12345GC14.962±0.26a5.884±0.12c6.841±0.17b5.988±0.27c5.651±0.25c4.731±0.18dEGC11.011±0.26b37.466±0.54a36.083±0.52a37.536±0.81a36.250±0.59a35.668±2.31aC2.553±0.06c3.103±0.01a2.662±0.16c2.900±0.11ab2.713±0.18bc2.678±0.13bcEGCG53.217±0.59c54.956±0.23bc58.743±2.15a56.021±0.56b50.901±1.15d50.426±1.22dEC6.573±0.10d10.665±0.08a9.928±0.29bc10.412±0.12ab9.622±0.62c9.692±0.57cGCG0.523±0.01b0.472±0.03bc0.396±0.04d0.500±0.02bc0.429±0.07cd0.601±0.02aECG18.692±0.54a13.138±0.20b14.201±0.46b13.321±0.57b11.817±0.65c11.555±0.88cCG1.039±0.08c3.760±0.11a3.597±0.07ab3.805±0.22a3.470±0.17b3.542±0.17abCAF20.673±0.40a17.393±0.19c17.276±0.99c17.680±0.70c16.838±0.35c15.632±0.29b总儿茶素108.571±0.67c129.444±1.00a132.451±2.68a130.482±2.11a120.854±3.09b118.892±5.40b
如图3所示,4和5的儿茶素组分和CAF聚为一类,CK单独为一类,1、2和3聚为一类。表明不同菌种对茶样的儿茶素组分和CAF含量影响显著,其中4与 5的影响相似,1、2和3的影响相似。

图3 不同菌种处理茶样儿茶素组分和咖啡碱聚类热图
Fig.3 Cluster heat diagram of catechin components and caffeine in tea samples treated with different strains
2.4 不同菌种对黄金芽绿茶氨基酸组分影响
茶叶中常见的氨基酸有20多种,其中脯氨酸(Pro)、苏氨酸(Thr)、甘氨酸(Gly)、丝氨酸(Ser)和丙氨酸(Ala)属于甜味氨基酸;苯丙氨酸(Phe)、精氨酸(Arg)、组氨酸(His)、蛋氨酸(Met)、异亮氨酸(Ile)、缬氨酸(Val)和亮氨酸(Leu)属于苦味氨基酸;天冬氨酸(Asp)、茶氨酸(Thea)和谷氨酸(Glu)属于鲜味氨基酸[18];不同菌种对黄金芽氨基酸组分影响如表6所示,接菌会显著降低黄金芽的氨基酸总量,1、2和3的降幅尤为明显,4的氨基酸总量虽然降低了4.91%,但降幅最小;此外,4的Asp、His和Gly等呈味氨基酸含量显著高于其他茶样。不同菌种处理均使茶样的甜味氨基酸、苦味氨基酸和鲜味氨基酸有不同程度的降低,接菌茶样的甜味氨基酸下降了10.83%~35.46%,苦味氨基酸下降了9.89%~22.57%,鲜味氨基酸下降了3.57%~30.49%。
表6 不同菌种处理茶样氨基酸组分含量
Table 6 Amino acid component contents of tea samples treated with different strains

注:-表示无数据。
成分含量 /(mg/g)CK12345Asp3.160±0.10c3.550±0.08b3.091±0.09c3.576±0.09b3.956±0.07a3.603±0.04bGlu5.304±0.07a3.615±0.17d5.151±0.09a4.084±0.03c4.502±0.05b4.766±0.35bSer5.238±0.06a2.492±0.09e2.788±0.15d2.524±0.11e4.707±0.03b4.324±0.10cGly0.160±0.00b0.137±0.01c0.151±0.01bc0.156±0.01b0.19±0.00a0.150±0.01bcThr0.470±0.01c0.421±0.02d0.441±0.00d0.645±0.02a0.442±0.00d0.521±0.02bPro3.853±0.17b5.296±0.36a2.713±0.01d5.436±0.23a3.481±0.07c3.327±0.06cGABA0.228±0.02f0.396±0.01e0.606±0.05d0.692±0.05c1.478±0.05a0.999±0.06bThea23.871±0.46a15.312±1.20c14.323±0.07c15.794±0.55c22.721±0.66ab22.182±1.37bAla0.278±0.01b0.076±0.06c0.361±0.01a0.069±0.05c0.097±0.01c0.409±0.01aArg0.033±0.00b0.028±0.01b0.034±0.00b0.058±0.01a0.051±0.00a0.051±0.00aVal0.203±0.02d0.275±0.01b0.384±0.00a0.241±0.01c0.220±0.01d0.279±0.01bMet0.771±0.01a0.561±0.02c0.708±0.01b0.421±0.03e0.553±0.01c0.484±0.01dCys0.699±0.01b0.842±0.14a-0.635±0.12bc0.564±0.02bc0.500±0.05cIle1.828±0.09a1.285±0.07b1.199±0.01b1.248±0.08b1.196±0.03b1.063±0.04cLeu-0.049±0.03c0.252±0.01a-0.119±0.03b0.015±0.01dHis1.185±0.01b1.195±0.04b1.200±0.01b1.052±0.03c1.263±0.01a1.173±0.03bPhe1.005±0.09b1.118±0.12ab0.754±0.01c1.224±0.10a1.082±0.07ab0.827±0.10cLys13.879±0.41a6.496±0.48c2.805±0.19d6.148±0.43c12.815±0.22b12.512±0.48bTyr0.339±0.03b-0.286±0.02c0.043±0.02d0.433±0.02a0.447±0.02a总氨基酸62.507±0.09a43.128±2.54c37.246±0.51d44.047±1.69c59.869±0.63ab57.633±2.11b
不同菌种对黄金芽绿茶氨基酸组分影响各异,如图4所示,2的氨基酸组分单独为一类,1和3聚为一类,4和5则与CK聚为一类。表明保加利亚乳杆菌、嗜热链球菌和植物乳杆菌对茶样的氨基酸组分影响显著,其中保加利亚乳杆菌和植物乳杆菌对茶叶的氨基酸组分影响相似,酵母菌YA200和酿酒酵母对茶叶的氨基酸组分影响不显著。
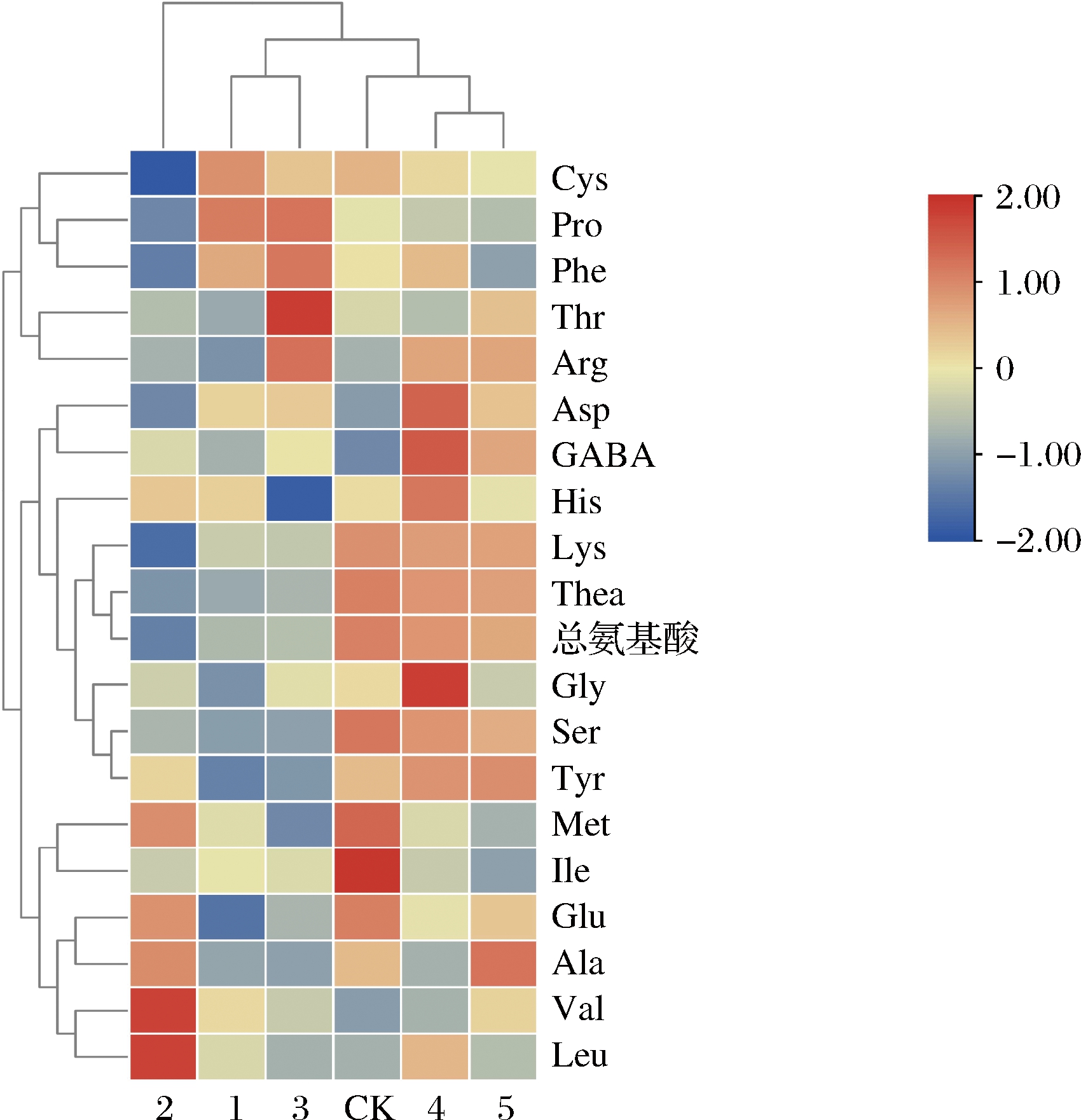
图4 不同菌种处理茶样氨基酸组分聚类热图
Fig.4 Clustering heat diagram of amino acid components of tea samples treated with different strains
2.5 不同菌种处理黄金芽绿茶特征性成分分析
利用主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)对CK和接菌样的儿茶素组分、CAF和氨基酸组分进行可视化处理,PCA得分如图5-A所示,接菌样与CK分布区域明显不同,证明不同菌种处理对茶样的儿茶素组分、CAF和氨基酸组分影响显著。保加利亚乳杆菌和植物乳杆菌对黄金芽的儿茶素组分、CAF和氨基酸组分影响效果接近,酵母菌YA200和酿酒酵母对黄金芽的儿茶素组分、CAF和氨基酸组分影响效果接近。
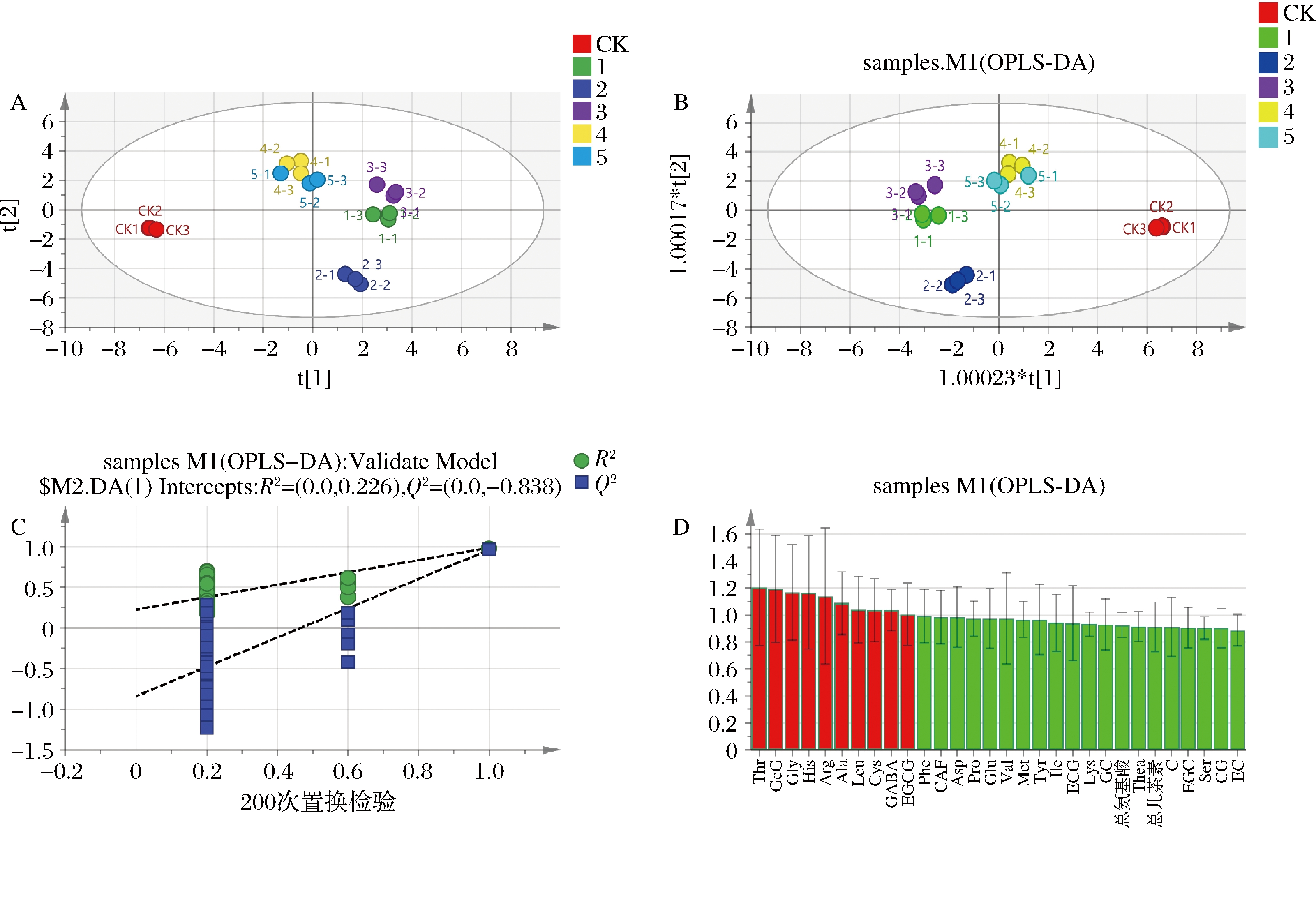
A-PCA得分图;B-OPLS-DA得分图;C-OPLS-DA模型置换检验图;D-OPLS-DA VIP值图
图5 不同菌种处理茶样儿茶素组分、咖啡碱和氨基酸组分PCA及OPLS-DA分析
Fig.5 PCA and OPLS-DA analysis of catechin components, caffeine and amino acid components of tea samples treated with different strains
在PCA的基础上,对不同菌种处理茶样的儿茶素组分、CAF和氨基酸组分进行OPLS-DA分析,由图5-B可知,OPLS-DA模型中所有茶样都在95%置信区间内,证明模型稳定可靠。设置分类Y矩阵变量随机排列200次做置换检验(图5-C),R2拟合直线在Y坐标轴上的截距为0.226,小于0.3,Q2拟合直线在Y坐标轴上的截距为-0.838,小于0,证明OPLS-DA模型不存在过度拟合现象,稳定可靠。
由OPLS-DA模型中的变量权重值(variable importance in projection,VIP)(图5-D)可知,共有10种成分的VIP值大于1,包括8种氨基酸组分和2种儿茶素组分,分别为:Thr(VIP=1.20)、Gly(VIP=1.17)、His(VIP=1.16)、Arg(VIP=1.14)、Ala(VIP=1.09)、Leu(VIP=1.04)、Cys(VIP=1.04)、GABA(VIP=1.03)、GCG(VIP=1.19)、EGCG(VIP=1.00)。结合表3和表4,发现Thr、GABA、Ala是CK与接菌样的差异代谢产物,GABA在接菌样中的含量显著高于CK样,是接菌样与CK样的标志性成分。
3 结论与讨论
微生物被用于发酵食品、提高食物的GABA含量和GABA的工业生产中[19-20],为探明微生物是否能提高茶叶的GABA含量和品质,本研究分别用浓度为100 g/L的保加利亚乳杆菌、嗜热链球菌、植物乳杆菌、酵母菌YA200和酿酒酵母处理黄金芽揉捻叶4 h,检测烘干样发现,5种菌都能显著提高黄金芽的GABA含量,趋势与RAMOS等[19]和ASUN等[20]的研究一致。许多微生物能产GABA是因为微生物本身富含谷氨酸脱羧酶[21-22],4的GABA含量最高可能是因为酵母菌YA200的谷氨酸脱羧酶含量或活性比其他菌种高,但微生物能提高茶叶GABA含量的真正原因还有待下一步的深入研究。
酯型儿茶素和CAF是茶汤滋味苦涩的主要影响因素,欧惠算[23]研究发现,对六堡茶的茶汤进行发酵,发现某些微生物可降低酯型儿茶素含量,而简单儿茶素随发酵时间呈先增加后降低趋势。本研究发现,1、4和5的酯型儿茶素含量显著降低,趋势与欧惠算的研究结果一致;2和3的酯型儿茶素含量有所增加,可能是因为嗜热链球菌和植物乳杆菌的特性与其他菌不一样。接菌处理4 h均导致黄金芽中的简单儿茶素含量有不同程度增加,与欧惠算的发酵前期趋势一致,接菌样品简单儿茶素含量高可能是因为微生物发酵过程中菌株分泌的水解酶和氧化酶将酯型儿茶素分解为简单儿茶素。许多研究表明,微生物可降解CAF[24-25],本研究发现,与CK相比,接菌茶样的CAF含量显著降低,与前人研究结果一致。简单儿茶素的增加和CAF降低会使接菌样的茶汤苦涩程度大大降低,该结果与本实验茶样感官审评中接菌样茶汤滋味均无苦涩味一致。
氨基酸是茶汤鲜味、甜味的重要组成部分,接菌处理不仅显著降低了茶样的总氨基酸含量,还使茶样的甜味、苦味和鲜味氨基酸有不同程度的降低;前人研究发现,氨基酸是微生物发酵过程中的主要可同化含氮物[26],这可能是接菌样氨基酸总量以及甜味、鲜味和苦味氨基酸含量比CK低的原因。接菌样氨基酸组分及总量的降低会使接菌样鲜爽味不足,该结果与本实验茶样感官审评中除酵母菌YA200处理的茶样外,其他菌种处理的茶样茶汤滋味鲜爽味均低于CK一致。
基于菌种本身的特性,接菌样的干茶外形、汤色和叶底的色泽均受到一定的负面影响;但接菌茶样不仅有绿茶特有的清香,还有菌自带的菌香;由于酯型儿茶素和CAF含量降低,在减轻茶汤的滋味苦涩味的同时赋予了茶汤特有的菌味。
本实验结果表明,接菌能显著提高黄金芽绿茶的GABA和简单儿茶素含量,降低CAF和总氨基酸含量,接菌茶样香气纯正,菌香持久,滋味鲜醇带菌味;酵母菌YA200处理的茶样GABA含量显著最高,香气和滋味显著最好,感官审评综合评分最高,可作为黄金芽绿茶加工过程中提高功能成分GABA和提升茶叶品质的最佳菌种。
[1] KAMJIJAM B, SUWANNAPORN P, BEDNARZ H, et al.Elevation of gamma-aminobutyric acid (GABA) and essential amino acids in vacuum impregnation mediated germinated rice traced by MALDI imaging[J].Food Chemistry, 2021, 365:130399.
[2] RANJBAR EKBATAN M, CAIRNS B E.Attenuation of sensory transmission through the rat trigeminal ganglion by GABA receptor activation[J].Neuroscience, 2021, 471:80-92.
[3] KANDEDA A K, TAIWE G S, AYISSI R E M, et al.An aqueous extract of Canarium schweinfurthii attenuates seizures and potentiates sleep in mice:Evidence for involvement of GABA pathway[J].Biomedicine &Pharmacotherapy, 2021, 142:111973.
[4] GONG C Z, ZHENG X L, GUO F L, et al.Human spinal GABA neurons alleviate spasticity and improve locomotion in rats with spinal cord injury[J].Cell Reports, 2021, 34(12):108889.
[5] PIAO X, JIANG S H, WANG J N, et al.Pingchuan formula attenuates airway mucus hypersecretion via regulation of the PNEC-GABA-IL13-Muc5ac axis in asthmatic mice[J].Biomedicine &Pharmacotherapy, 2021, 140:111746.
[6] MOLDOVAN N, BLAGA I I, BILLA S, et al.Brain-implantable multifunctional probe for simultaneous detection of glutamate and GABA neurotransmitters[J].Sensors and Actuators-B,Chemical, 2021, 337:129795.
[7] 张金玉, 李美凤, 郜秋艳, 等.不同厌氧时间对绿茶和红茶加工品质的影响[J].茶叶学报, 2021, 62(2):78-84.
ZHANG J Y, LI M F, GAO Q Y, et al.Effect of anaerobic treatment time on quality of green and black teas[J].Acta Tea Sinica, 2021, 62(2):78-84.
[8] DAI W D, XIE D C, LIN Z Y, et al.A nontargeted and targeted metabolomics study on the dynamic changes in metabolite levels during the anaerobic treatment of γ-aminobutyric acid (GABA) tea[J].LWT, 2020, 126:109313.
[9] WU Q Y, MA S Z, ZHANG W W, et al.Accumulating pathways of γ-aminobutyric acid during anaerobic and aerobic sequential incubations in fresh tea leaves[J].Food Chemistry, 2018, 240:1081-1086.
[10] 邵文韵. 提高茶叶 γ-氨基丁酸含量的方法优化及其在速溶茶产品开发中的应用[D].杭州:浙江大学,2014.
SHAO W Y.An optimization method of increasingγ-aminobutvric acid in tea leaves and its application to instant tea processing[D].Hangzhou:Zhejiang University, 2014.
[11] 许凡凡, 司辉清, 沈强, 等.GABA 茶的生理功能及富集技术研究进展[J].食品工业科技, 2016, 37(10):381-385.
XU F F, SI H Q, SHEN Q, et al.Research progress on the physiological functions and enrichment technique of GABA tea[J].Science and Technology of Food Industry, 2016, 37(10):381-385.
[12] 赵炜彤. 高产 γ-氨基丁酸酵母菌菌株的筛选、诱变及发酵条件优化[D].长春:吉林农业大学, 2015.
ZHAO W T.The study on screening and mutation breeding of high-yieldγ-aminobutyric acid yeast strains and optimization of its fermentation conditions[D].Changchun:Jilin Agricultural University, 2015.
[13] MA W Y, ZHANG J, SHU L, et al.Optimization of spray drying conditions for the green manufacture of γ-aminobutyric acid-rich powder from Lactobacillus brevis fermentation broth[J].Biochemical Engineering Journal, 2020, 156:107499.
[14] 李亚莉, 秘鸣,魏珍珍, 等.近平滑假丝酵母(Candida parapsilosis)发酵普洱茶初探[J].茶叶科学, 2013, 33(5):436-442.
LI Y L, MI M, WEI Z Z, et al.Application of Candida parapsilosis GPT-5-11 for Pu-erh tea fermentation[J].Journal of Tea Science, 2013, 33(5):436-442.
[15] 杨金川, 白雪梅.HPLC 法同时测定茶叶中儿茶素类和咖啡因的含量[J].贵州农业科学, 2020, 48(2):99-102.
YANG J C, BAI X M.Simultaneous determination of catechins and caffeine content in tea by HPLC[J].Guizhou Agricultural Sciences, 2020, 48(2):99-102.
[16] 叶玉龙. 萎凋/摊放对茶叶在制品主要理化特性的影响[D].重庆:西南大学, 2018.
YE Y L.Effects of withering on the main physical and chemical properties of manufactured tea leaves[D].Chongqing:Southwest University, 2018.
[17] QIN J H, LI N, TU P F, et al.Change in tea polyphenol and purine alkaloid composition during solid-state fungal fermentation of postfermented tea[J].Journal of Agricultural and Food Chemistry, 2012, 60(5):1213-1217.
[18] KIRIMURA J, SHIMIZU A, KIMIZUKA A, et al.Contribution of peptides and amino acids to the taste of foods[J].Journal of Agricultural and Food Chemistry, 1969, 17(4):689-695.
[19] RAMOS I M, POVEDA J M.Fermented sheep’s milk enriched in gamma-amino butyric acid (GABA) by the addition of Lactobacilli strains isolated from different food environments[J].LWT, 2022, 163:113581.
[20] ASUN A C, LIN S T, NG H S, et al.Production of gamma-aminobutyric acid (GABA) by Bacillus subtilis BBEL02 fermentation using nitrogen-rich industrial wastes as crude feedstocks[J].Biochemical Engineering Journal, 2022, 187:108654.
[21] LIU S J, WEN B T, DU G M, et al.Coordinated regulation of Bacteroides thetaiotaomicron glutamate decarboxylase activity by multiple elements under different pH[J].Food Chemistry, 2023, 403:134436.
[22] YARABBI H, ALI MORTAZAVI S, YAVARMANESH M, et al.Molecular cloning, gene overexpression and characterization of glutamate decarboxylase from Enterococcus faecium DO[J].LWT, 2021, 148:111699.
[23] 欧惠算. 六堡茶微生物的分离鉴定及优势菌对茶叶成分的影响研究[D].广州:华南农业大学, 2017.
OU H S.Isolation and identification of microbial from liupao tea and study on the influence of superiority strains of tea compounds[D].Guangzhou:South China Agricultural University, 2017.
[24] GOKULAKRISHNAN S, CHANDRARAJ K, GUMMADI S N.Microbial and enzymatic methods for the removal of caffeine[J].Enzyme and Microbial Technology, 2005, 37(2):225-232.
[25] 余佳熹, 张佳琪, 何贵平, 等.可降解咖啡碱的酵母菌菌种筛选及其培养条件的优化[J].食品研究与开发, 2021, 42(8):146-152.
YU J X, ZHANG J Q, HE G P, et al.Selection of caffeine degrading yeast and optimization of culture conditions[J].Food Research and Development, 2021, 42 (8):146-152.
[26] SCOTT T A, VEREST M, FARNUNG J, et al.Widespread microbial utilization of ribosomal β-amino acid-containing peptides and proteins[J].Chem, 2022, 8(10):2659-2677.