苹果酸-乳酸发酵(malolactic fermentation, MLF)是葡萄酒在酒精发酵(alcoholic fermentation, AF)结束后,利用乳酸菌(lactic acid bacteria, LAB)将L-苹果酸降解为L-乳酸和CO2的过程[1]。不仅可以降低酸度、提高微生物稳定性,还可以改善口感、增加风味复杂性[2],是优质葡萄酒酿造中不可缺少的工艺技术。在自然条件下,启动和完成MLF依赖于葡萄酒中存在的酿酒乳酸菌,但这会导致MLF时间延长、无法预测发酵过程、葡萄酒变质等一系列问题。因此,筛选具有优良性能的乳酸菌对葡萄酒的酿造具有重要意义。
酒类酒球菌,因其对高乙醇体积分数(>10%)、低pH值(pH<3.5)的葡萄酒环境有更好的耐受性而成为葡萄酒进行MLF的主导菌[3],研究发现它在MLF过程中会释放次级代谢产物,如酯类、高级醇、羰基化合物、挥发性脂肪酸和硫磺化合物[4]等,从而影响葡萄酒的香气和口感。目前,国内多数酒厂采用接种商业乳酸菌发酵剂以确保MLF正常、有效地完成。但这些商业发酵剂多来自国外,会造成国内葡萄酒同质化严重,不利于国产葡萄酒的发展[5]。此外,研究表明本土微生物菌株有助于展现葡萄酒独特的风土特色[6],本土微生物菌群、发酵性能和葡萄酒特征之间存在特定的联系[7]。因此,筛选具有区域特色的本土苹果酸乳酸发酵剂,能更好地适应产区、特定产品和生产技术,对呈现和塑造具有中国葡萄酒区域特色的葡萄酒有积极的影响。
宁夏贺兰山东麓产区是我国酿酒葡萄的主要种植区之一,具有优越的地理位置、独特的气候与丰富的本土微生物群落,有待科研人员与葡萄酒酿造师的开发与利用。本试验采用胁迫酸性番茄(acid tomato juice medium,ATB)培养基从宁夏贺兰山东麓中部产区处于自然苹乳发酵的葡萄酒中分离得到优良抗逆葡萄酒乳酸菌,对其进行分子生物学鉴定、苹果酸降解试验和菌株安全性分析,并以商业菌株酒类酒球菌(Oenococcus oeni)31-DH与优良自筛菌株O.oeni SD-2a为对照进行MLF,分析筛选菌株的苹果酸代谢能力及对葡萄酒基本理化指标和香气成分等品质的影响,进而探讨优良抗逆葡萄酒乳酸菌在葡萄酒酿造中的应用潜力,为宁夏贺兰山东麓产区酿造具有本土特色的葡萄酒提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
本试验所用葡萄酒样采样于2020年10月宁夏贺兰山东麓中部子产区,酿造实验所用葡萄采摘自张裕摩塞尔十五世酒庄,2021年赤霞珠,含糖量约为25.4~25.8°Brix。
1.1.2 药品与试剂
酿酒酵母(CECA),安琪酵母股份有限公司;对照乳酸菌2株:商业菌株O.oeni 31-DH,中国食品工业研究院;优良自筛菌株O.oeni SD-2a,西北农林科技大学葡萄酒学院实验室保存;放线菌酮,北京Solarbio科技有限公司;万古霉素,上海源叶生物公司;果胶酶(Cuvee Blanc),法国Lallemand公司;2-辛醇(色谱纯),美国Sigma公司;L-苹果酸测定试剂盒,阿拉丁试剂(上海)有限公司;蛋白胨、酵母浸粉等其他试剂,西陇科学股份有限公司;Gel signalTM Red核酸染料,上海勤翔科学仪器有限公司;2×Taq Master Mix酶、Lysis Buffer、DL2000 DNA marker,大连TaKara公司。
1.2 仪器与设备
Cary 60 UV-Vis紫外分光光度计,美国Agilent Technologies公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;pH计,上海仪电科学仪器股份有限公司;Bio-Rad C1000基因扩增仪,美国Bio-Rad公司;MIKRO-200R台式高速离心机,德国Hettich科学仪器公司;ChampGel 500 plus全自动凝胶成像系统,北京赛智创业科技有限公司;JY-300HC电泳仪,北京君意东方电泳设备有限公司;SX-500高压蒸汽灭菌锅,日本TOMY公司;Y15葡萄酒全自动分析仪,西班牙BioSystems S.A.公司;QP2020气象色谱-质谱联用仪、色谱柱DB-WAX(60 m×0.25 mm×0.25 μm),日本岛津公司。
1.3 实验方法
1.3.1 抗逆葡萄酒乳酸菌的分离筛选
1.3.1.1 培养基的配制
ATB液体培养基[8]:葡萄糖10 g/L,蛋白胨10 g/L,酵母浸粉5 g/L,苹果酸1 g/L,硫酸镁0.2 g/L,硫酸锰0.05 g/L,L-盐酸半胱氨酸0.5 g/L,番茄汁25%(体积分数),加水定容至1 L,用1 mol/L NaOH调pH值至4.8,115 ℃灭菌30 min。ATB固体培养基:在ATB液体培养基基础上加入20 g/L琼脂。ATB分离固体培养基:将灭菌后的ATB固体培养基放置至60 ℃左右,添加100 mg/L放线菌酮和50 mg/L万古霉素,摇晃均匀。
1.3.1.2 葡萄酒乳酸菌的分离
将酒精发酵后的葡萄酒酒样放置在20 ℃培养箱中进行MLF,同时利用纸层析法[9]监测MLF过程。每3 d取酒样10 mL,将酒样以梯度10-1~10-7用生理盐水稀释后,吸取100 μL于ATB分离固体培养基涂布培养,26 ℃条件下培养9~11 d。挑取白色、菌落直径小于1 mm的单菌落进行划线纯化培养[10]。将纯化后的单菌落转接至ATB液体培养基中培养至对数生长期,甘油管保存于-80 ℃冰箱备用。
1.3.1.3 葡萄酒乳酸菌抗逆筛选
将筛选出的所有原始菌株活化两次至对数生长期,并接种至ATB胁迫培养基中培养72 h并测定OD600值,筛选在胁迫条件中OD600≥0.3的菌株,即获得具有一定抗逆性的葡萄酒乳酸菌,而OD600<0.3或无法在胁迫培养基中生长的菌株被视为无抗逆性乳酸菌。
ATB胁迫培养基:在ATB液体培养基基础上调整pH值与乙醇体积分数,分别为:(1)pH 3.2,乙醇体积分数10%;(2)pH 3.2,乙醇体积分数11%;(3)pH 3.4,乙醇体积分数10%;(4)pH 3.4,乙醇体积分数11%。
1.3.2 分子生物学鉴定
抗逆优良菌株的分子生物学鉴定采用种属特异性聚合酶链反应(sequence specific polymerase chain reaction,SSP)进行扩增[11],引物分别为:上游OE1(5′-TAATGTGGTTCTTGAGGAGAAAAT-3′),下游OE2(5′-ATCATCGTCAAACAAGAGGCCTT-3′),并使用单一引物3R(3′-ACGCAGGCAC-5′)进行随机扩增多态性(random amplified polymorphic DNA polymerase chain reaction, RAPD-PCR)分析[12]。
1.3.3 菌株安全性鉴定
抗逆优良菌株的生物胺(biogenic amine,BA)功能性基因的鉴定:参考COTON等[13]和赵艳卓等[14]方法进行扩增,特异性引物分别为:组氨酸脱羧酶(hdc):上游(F-GATGGTATTGTTTCKTATGA),下游(R-CCAAACACCAGCATCTTC);鸟氨酸脱羧酶(odc):上游(F-GTNTTYAAYGCNGAYAARACNTAYTTYGT),下游(R-TACRCARAATACTCCNGGNGGRTANGG);酪氨酸脱羧酶(tdc):上游(F-CCRTARTCNGGNATAGCRAARTCNGTRTG),下游(R-GAYATNATNGGNATNGGNYTNGAYCARG)。
上述PCR产物送至北京奥克鼎盛生物公司进行测序,测序后其结果提交https://blast.ncbi.nlm.nih.gov/Blast.cgi进行比对分析以验证PCR产物的特异性。
1.3.4 低pH与高乙醇浓度模拟环境发酵试验
1.3.4.1 模拟酒的配制[15]
葡萄汁10 mL/L;D-葡萄糖2 g/L;D-果糖2 g/L;NaCl 0.2 g/L;(NH4)2SO4 1 g/L;K2HPO4 2 g/L;MnSO4·H2O 0.05 g/L;MgSO4·7H2O 0.2 g/L;酵母浸粉4 g/L;L-苹果酸 3 g/L;用1 mol/L NaOH或HCl调整pH值,115 ℃灭菌30 min,灭菌后加入无水乙醇。高乙醇体积分数模拟酒:pH 3.8,乙醇体积分数14%;低pH模拟酒:pH 3.2,乙醇体积分数10%。
1.3.4.2 L-苹果酸含量的测定
分别使用优良抗逆菌株和对照菌株31-DH与SD-2a在上述两种模拟酒中进行MLF,同时采用纸层析法[9]监测L-苹果酸分解情况。每隔2 d取样,然后将样品置于80 ℃水浴锅中15 min后10 000 r/min离心3 min,取上清液用于后续L-苹果酸测定。根据L-苹果酸试剂盒说明书,使用Y15葡萄酒全自动分析仪检测。
1.3.4.3 乳酸菌生物量监测
分别将优良抗逆菌株和对照菌株31-DH与SD-2a以107 CFU/mL接种至上述两种模拟酒中,采用平板计数法[10]进行活菌计数。每隔2 d取样,用生理盐水稀释为10-1~10-7菌悬液,吸取100 μL 10-4~10-7菌液涂布于ATB固体培养基上,26 ℃培养5~7 d后进行菌落总数计数,以菌落形成单位(CFU/mL)表示。
1.3.5 酿造试验
将上述筛选的优良抗逆菌株和对照菌株31-DH与SD-2a以108 CFU/mL、5%的接种量接种至酒精发酵结束的赤霞珠葡萄酒中进行MLF,发酵温度 20 ℃,同时采用纸层析法对发酵过程中L-苹果酸代谢情况进行监测,待层析纸上L-苹果酸斑点消失表明MLF完毕。
1.3.5.1 L-苹果酸代谢能力的测定
在赤霞珠葡萄酒中接种优良抗逆菌株和对照菌株进行MLF的过程中,每隔1 d取酒样直至MLF发酵结束。然后将样品按照1.3.4.2节的方法进行处理后,根据L-苹果酸试剂盒说明书,使用Y15葡萄酒全自动分析仪检测。
1.3.5.2 葡萄酒基本理化指标的测定
葡萄酒的酒精度、残糖、总酸、挥发酸、pH值等基本理化指标采用GB/T 15038—2006 《葡萄酒、果酒通用分析方法方法》。
1.3.5.3 葡萄酒香气成分的测定
参照余东亮[8]的方法稍作修改测定葡萄酒香气成分。
固相微萃取(solid-phase microextraction,SPME)香气富集:取8 mL酒样于顶空瓶,加2.0 g的NaCl和20 μL 2-辛醇(质量浓度为0.016 g/L),在恒温磁力搅拌器40 ℃条件下搅拌30 min,然后将萃取头插入玻璃瓶进行30 min顶空萃取,进入GC-MS分析仪进行挥发性化合物检测。
定性分析:采用NIST17质谱库检索、标准香气成分保留时间比对与手动检索矫正相结合,进行定性分析。
定量分析:将2-辛醇作为内标,采用内标-标准曲线法进行定量。
1.4 数据处理与分析
数据采用Excel 2019进行计算,GraphPad Prism 9进行相关图表绘制,SPSS 25.0软件进行统计分析、单因素方差分析、主成分分析(principal component analysis, PCA)等。
2 结果与分析
2.1 抗逆葡萄酒乳酸菌的分离筛选
利用涂布法将稀释后的葡萄酒样品涂布于ATB分离固体培养基上,经划线纯化后最终从酒样中分离出了388个菌株,并根据不同葡萄品种和酒庄进行编号,见表1。菌株形态为白色表面光滑且直径小于1 mm 的菌落,符合文献[16]描述。
表1 酒样来源及菌株编号
Table 1 Wine resources and number of strains
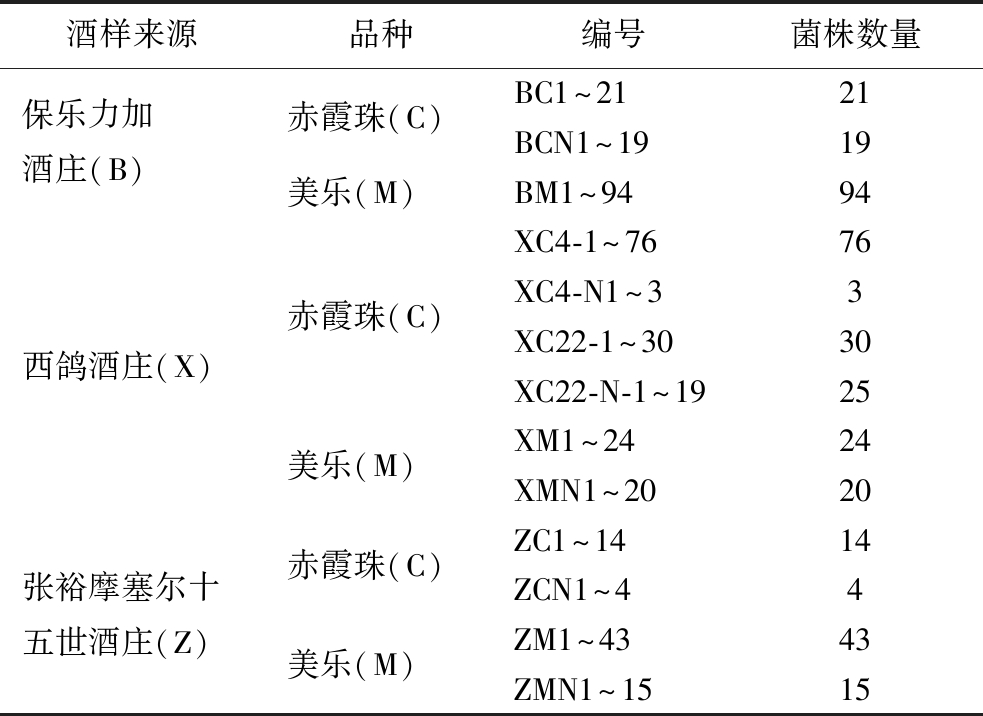
注:N表示酒泥;4~22表示葡萄树龄。
酒样来源品种编号菌株数量保乐力加酒庄(B)赤霞珠(C)美乐(M)BC1^2121BCN1^1919BM1^9494西鸽酒庄(X)赤霞珠(C)美乐(M)XC4-1^7676XC4-N1^33XC22-1^3030XC22-N-1^1925XM1^2424XMN1^2020张裕摩塞尔十五世酒庄(Z)赤霞珠(C)美乐(M)ZC1^1414ZCN1^44ZM1^4343ZMN1^1515
将上述初步分离筛选的388株菌株接种至4种ATB胁迫培养基中进行菌株抗逆性筛选,结果发现,培养72 h后仅有8株菌株的OD600≥0.3,分别是XMN18、XM12、XM16、BM43、BM68、BM79、XC22-N-3、XC22-N-19(数据未显示)。
2.2 菌株的分子生物学鉴定
对上述筛选获得的8株优良抗逆乳酸菌进行分子生物学鉴定。
2.2.1 SSP鉴定
凝胶电泳检测8株菌株的PCR扩增产物,结果如图1所示,所有乳酸菌均能扩增出单一条带(1 025 bp),初步鉴定8株抗逆乳酸菌均为酒类酒球菌。
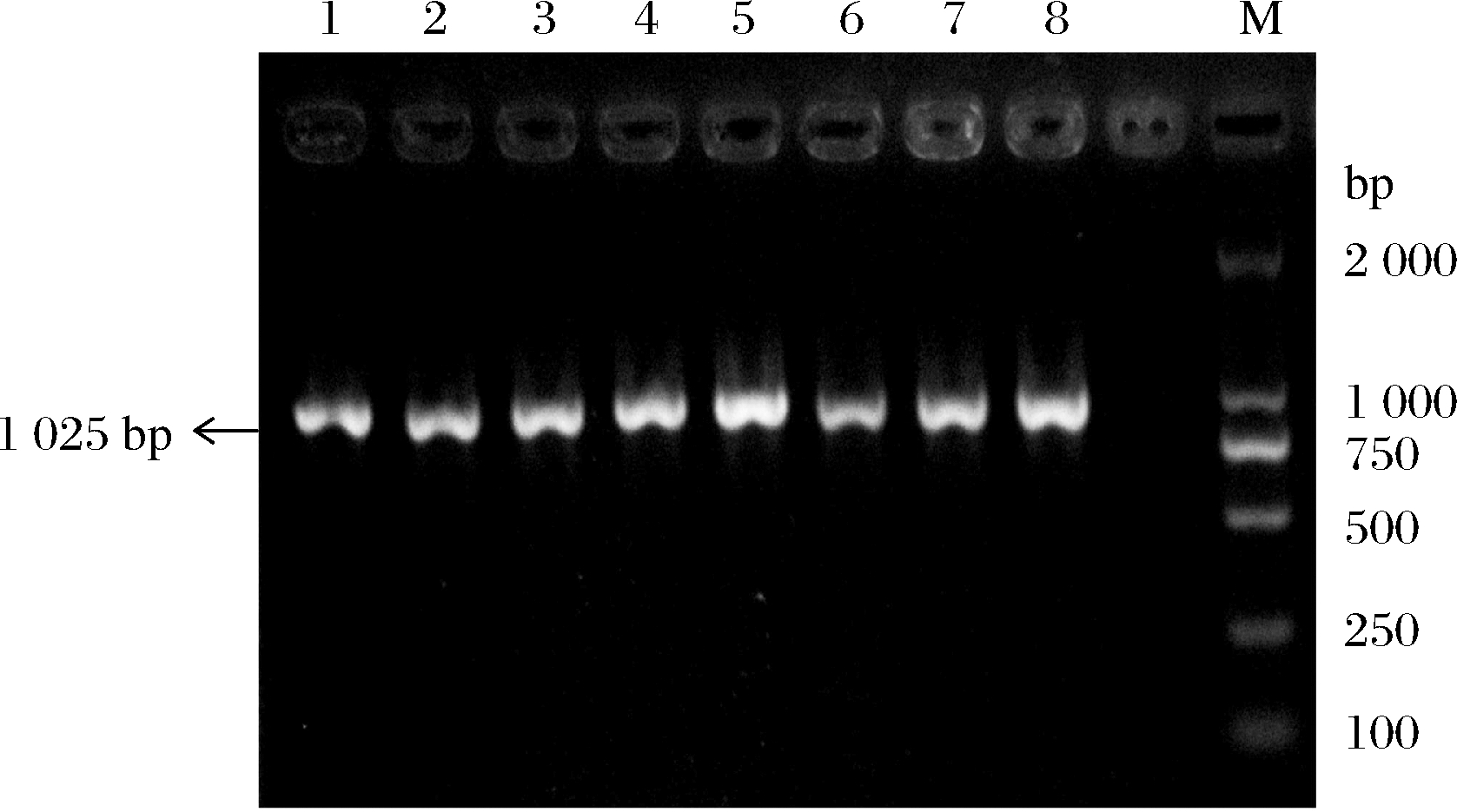
1-XMN18;2-XM12;3-XM16;4-BM43;5-BM68;6-BM79;7-XC22-N-3;8-XC22-N-19;M-DL2000 DNA Marker
图1 八株优良抗逆菌株的Species-specific PCR扩增结果
Fig.1 Species-specific PCR amplification results of the 8 excellent stress-resistant isolates
2.2.2 RAPD-PCR分析
选用3R引物,对8株优良抗逆酒类酒球菌和2株对照菌株进行了RAPD-PCR分析,如图2所示,菌株的扩增片段数量各不相同,BM79与XC22-N-3扩增到5条片段,XMN18与XM16扩增得到4条片段,XC22-N-19扩增到3条片段,XM12与BM68扩增到2条片段,BM43扩增到1条片段。所有菌株扩增得到的片段长度在500~2 000 bp,且10株菌株之间扩增片段大小各不相同,XMN18和XM16虽然均扩增出4条片段,但XMN18其中的3条集中在750~1 000 bp,而XM16集中在500~750 bp,说明这些菌株的基因组DNA具有多态性。
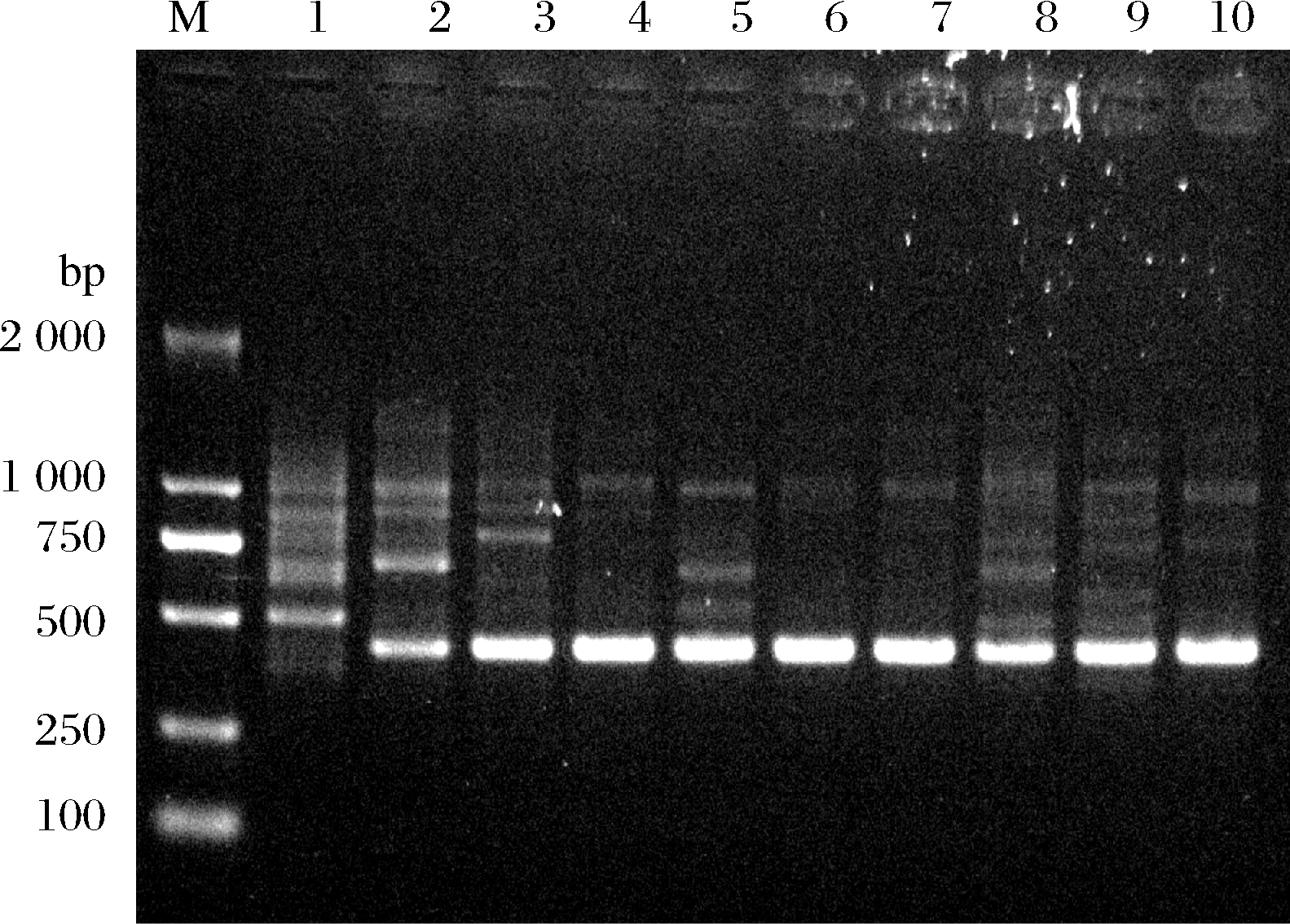
1-SD-2a;2-31-DH;3-XMN18;4-XM12;5-XM16;6-BM43;7-BM68;8-BM79;9-XC22-N-3;10-XC22-N-19;M-DL2000 DNA Marker
图2 八株优良抗逆菌株与2株对照菌株的RAPD-PCR扩增结果
Fig.2 RAPD-PCR amplification results of the 8 excellent stress-resistant isolates and 2 control strains
2.3 菌株产生物胺风险分析
葡萄酒中最常见的生物胺是腐胺、组胺和酪胺,这些化合物主要由它们各自的氨基酸前体(鸟氨酸、组氨酸和酪氨酸)经特异性脱羧酶作用而形成[17]。研究发现,乳酸菌的生长代谢是葡萄酒中生物胺的主要来源,产生生物胺的能力可能与菌株相关,而不是某种物种特有的[18]。优良抗逆菌株的生物胺相关基因分析结果如图3所示,通过检测合成组胺、酪胺和腐胺的功能性基因(hdc、tdc、odc)结果如图3所示,优良抗逆酒类酒球菌均未扩增出生物胺相关功能性基因条带,表明菌株不具有产生生物胺的能力。

M-DL5000 DNA Marker;1-XMN18;2-XM12;3-XM16;4-BM43;5-BM68;6-BM79;7-XC22-N-3;8-XC22-N-19
A-hdc;B-odc;C-tdc
图3 优良抗逆菌株的hdc、odc和tdc扩增结果
Fig.3 Amplification results of hdc, odc, and tdc of the excellent stress-resistant strains
2.4 低pH与高乙醇浓度模拟环境MLF能力分析
葡萄酒中乙醇的浓度是抑制乳酸菌生长主要因素,研究发现当乙醇体积分数大于10%时对菌株有抑制作用[19]。优良抗逆菌株在pH 3.8、乙醇体积分数14%模拟酒中的L-苹果酸代谢能力和活菌数变化如图4-A、图4-C所示,与优良自筛菌株SD-2a(第4天)和商业菌株31-DH(第6天)比较,XMN18和BM68在发酵的第4天均完成MLF,且活菌数维持在107 CFU/mL。前期L-苹果酸代谢速度最快的是XMN18,在0~2 d时降解了1.76 g/L,其次BM68降解了1.48 g/L,两者发酵速度较SD-2a(1.33 g/L)和31-DH(0.99 g/L)显著快。另外,XM12和XM16表现相似,在0~2 d时降解了0.85 g/L,但在发酵的第6天L-苹果酸含量仍维持在1 g/L,且活菌数仅维持在104 CFU/mL。BM43、BM79、XC22-N-3、XC22-N-9对酒精的耐受性较差,在发酵第6天菌株的活菌数均低于105 CFU/mL,特别是BM43,在发酵的第6天L-苹果酸含量仅减少了1.07 g/L。说明菌株对乙醇的耐受能力有所不同,这与学者研究一致,研究内容表明高乙醇浓度对菌株的生长有一定的抑制作用[19]。除此之外,优良抗逆菌株在pH 3.2、乙醇体积分数10%模拟酒中的L-苹果酸代谢能力和活菌数变化如图4-B、图4-D所示,与优良自筛菌株SD-2a(第4天)和商业菌株31-DH(第4天)比较,所有优良抗逆菌株均能完成MLF,且活菌数维持在106~107 CFU/mL。其中,XM12发酵速度最快,其次是BM68,在发酵的第2天均完全代谢L-苹果酸。除XC22-N-3之外,其余优良抗逆菌株在发酵的第2天可代谢L-苹果酸至0.4 g/L以下。另外,在发酵初期只有XMN18和BM68活菌数升高,说明相比于其他菌株,XMN18和BM68更耐低酸环境。总之,筛选获得的优良抗逆菌株均能在低酸胁迫环境中快速代谢L-苹果酸完成MLF,而只有XMN18和BM68才能较好的适应高乙醇浓度的胁迫环境。

A-pH 3.8、14%(乙醇体积分数)下菌株的L-苹果酸代谢;B- pH 3.2、10%(乙醇体积分数)下菌株的L-苹果酸代谢;C-pH 3.8、14%(乙醇体积分数)下菌株的活菌数变化;D-pH 3.2、10%(乙醇体积分数)下菌株的活菌数变化
图4 优良抗逆菌株在模拟酒中的L-苹果酸代谢与活菌数变化
Fig.4 L-malic acid metabolism and viable counts of the excellent stress-resistant strains in synthetic wine
注:图中不同小写字母表示差异显著(P<0.05)。
2.5 优良菌株酿造试验分析
2.5.1 L-苹果酸代谢能力
将8株优良抗逆酒类酒球菌接种至葡萄酒(L-苹果酸含量为1.34 g/L)中,在整个MLF过程中对菌株代谢L-苹果酸的能力进行监测。由图5可知,葡萄酒中L-苹果酸的含量随着发酵时间的延长而逐渐减少,8株优良抗逆酒类酒球菌均可以完全代谢L-苹果酸(<0.2 g/L)完成MLF。与优良自筛菌株SD-2a(第4天)和商业菌株31-DH(第4天)比较,XMN18和BM68代谢L-苹果酸最快,在发酵的第3天完成MLF,其次是XM12在发酵的第4天完成MLF,接着是XM16在发酵的第5天完成MLF,剩余菌株则是在发酵的第6天完成MLF。结果表明,优良抗逆酒类酒球菌在葡萄酒中具有较好的L-苹果酸代谢能力。此外,与上述pH 3.8、乙醇体积分数14%模拟酒中优良抗逆菌株的L-苹果酸代谢能力比较,虽然模拟酒和葡萄酒的pH值与乙醇浓度相同,但在模拟酒中XM12、XM16、BM43、BM79、XC22-N-3、XC22-N-9没有完全代谢L-苹果酸而在葡萄酒中均完成了MLF,可能是由于葡萄酒中存在酵母产生的多糖等次级代谢物及葡萄自身含有的微量元素和能量物质等增强了乳酸菌的生长能力,进而提升了其对胁迫环境的耐受能力[20]。
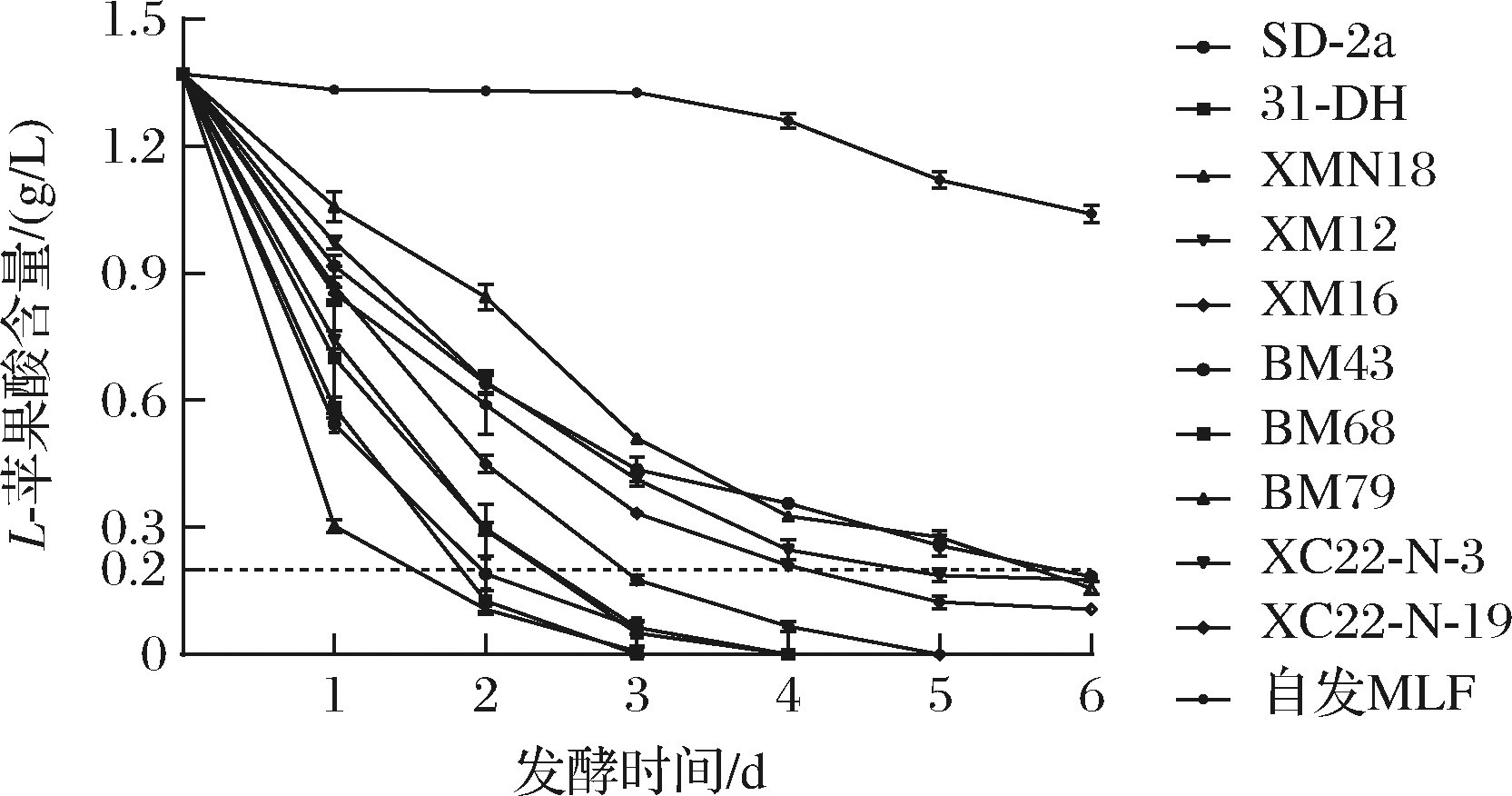
图5 优良抗逆菌株在葡萄酒中进行MLF的L-苹果酸代谢能力
Fig.5 The ability of L-malic acid metabolism by excellent stress-resistant strains in wines during MLF
2.5.2 葡萄酒基本理化指标分析
表2显示了MLF后葡萄酒的基本理化指标的变化。与未MLF的葡萄酒比较,MLF后的葡萄酒的pH值随着总酸的下降而升高0.4~0.6个单位,残糖量均有下降,挥发酸含量低于1.20 g/L,符合国家标准。综上,表明采用8株优良抗逆酒类酒球菌进行MLF后的葡萄酒的基本理化指标符合国家标准,菌株在酿造本土特色葡萄酒中具有十分广阔的应用潜力。
表2 葡萄酒的基本理化指标
Table 2 The physical and chemical indexs of wines
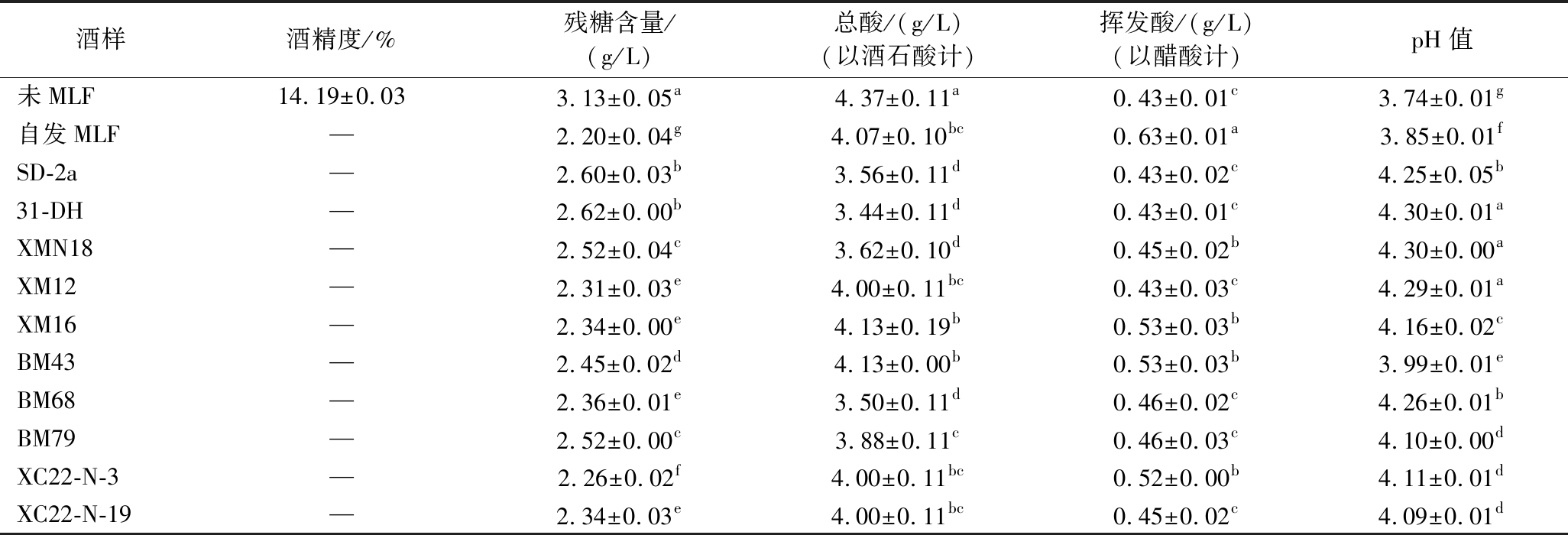
注:酒精度以体积分数计;数值以平均值±标准差表示;—表示与未MLF酒样酒精度相同;同一列数据后不同字母表示在 P<0.05 水平上的显著性差异。
酒样酒精度/%残糖含量/(g/L) 总酸/(g/L)(以酒石酸计)挥发酸/(g/L)(以醋酸计)pH值未MLF 14.19±0.033.13±0.05a4.37±0.11a0.43±0.01c3.74±0.01g自发MLF—2.20±0.04g4.07±0.10bc0.63±0.01a3.85±0.01fSD-2a—2.60±0.03b3.56±0.11d0.43±0.02c4.25±0.05b31-DH—2.62±0.00b3.44±0.11d0.43±0.01c4.30±0.01aXMN18—2.52±0.04c3.62±0.10d0.45±0.02b4.30±0.00aXM12—2.31±0.03e4.00±0.11bc0.43±0.03c4.29±0.01aXM16—2.34±0.00e4.13±0.19b0.53±0.03b4.16±0.02cBM43—2.45±0.02d4.13±0.00b0.53±0.03b3.99±0.01eBM68—2.36±0.01e3.50±0.11d0.46±0.02c4.26±0.01bBM79—2.52±0.00c3.88±0.11c0.46±0.03c4.10±0.00dXC22-N-3—2.26±0.02f4.00±0.11bc0.52±0.00b4.11±0.01dXC22-N-19—2.34±0.03e4.00±0.11bc0.45±0.02c4.09±0.01d
2.5.3 菌株对葡萄酒香气成分的影响
2.5.3.1 葡萄酒的香气成分分析
采用GC-MS对筛选得到的优良抗逆酒类酒球菌MLF后的葡萄酒进行了检测分析。结果见附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.034093),共检出45种香气化合物,包括乙酸酯类(5种)、乙酯类(12种)、其他酯类(3种)、高级醇类(8种)、脂肪酸类(5种)、萜烯类(5种)、醛类(4种)、挥发性酚(2种)、呋喃类(1种),并将对葡萄酒香气具有贡献的香气成分即气味活性值(odor activity values,OAV)大于0.1的香气成分进行分析,见表3。结果表明,不同优良抗逆菌株发酵酒样的香气物质含量有所差异,与未MLF(酯类66 605.62 μg/L;醛类70.65 μg/L)相比,经MLF后酯类物质总含量(88 259.86~143 642.88 μg/L)显著升高,但醛类物质总含量(15.61~42.56 μg/L)显著降低,尤其是乳酸乙酯(乳香,黄油;0.1
表3 葡萄酒的OAV(>0.1)及香气物质描述
Table 3 OAV(>0.1) and odor description of aroma components in wines
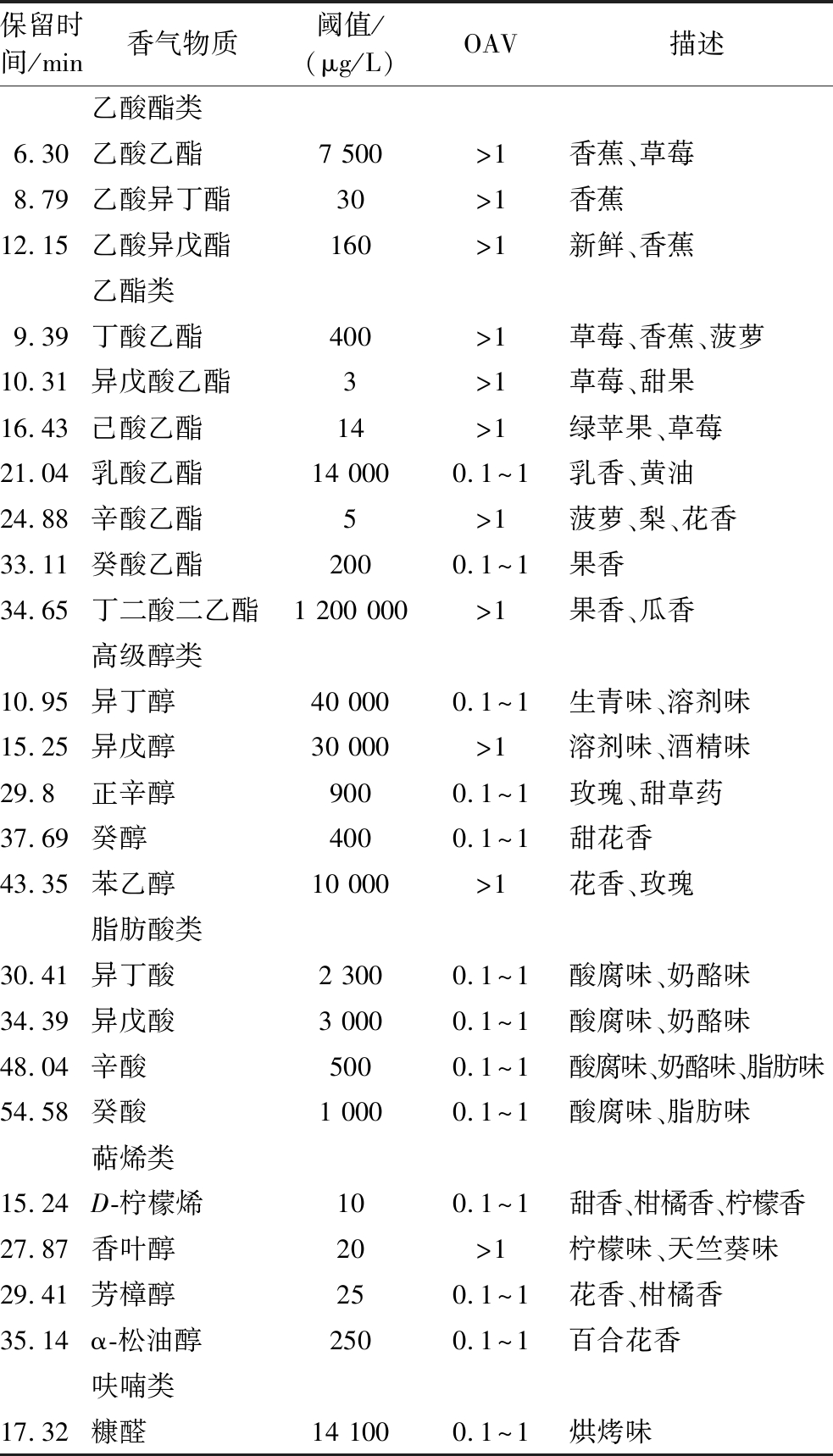
注:OAV指的是挥发性化合物含量与其气味感知阈值的比值,OAV>1表明挥发性化合物对香气有显著作用,0.1 保留时间/min香气物质阈值/(μg/L)OAV描述乙酸酯类6.30乙酸乙酯7 500>1香蕉、草莓8.79乙酸异丁酯30>1香蕉12.15乙酸异戊酯160>1新鲜、香蕉乙酯类9.39丁酸乙酯400>1草莓、香蕉、菠萝10.31异戊酸乙酯3>1草莓、甜果16.43己酸乙酯14>1绿苹果、草莓21.04乳酸乙酯14 0000.1^1乳香、黄油24.88辛酸乙酯5>1菠萝、梨、花香33.11癸酸乙酯2000.1^1果香34.65丁二酸二乙酯1 200 000>1果香、瓜香高级醇类10.95异丁醇40 0000.1^1生青味、溶剂味15.25异戊醇30 000>1溶剂味、酒精味29.8正辛醇9000.1^1玫瑰、甜草药37.69癸醇4000.1^1甜花香43.35苯乙醇10 000>1花香、玫瑰脂肪酸类30.41异丁酸2 3000.1^1酸腐味、奶酪味34.39异戊酸3 0000.1^1酸腐味、奶酪味48.04辛酸5000.1^1酸腐味、奶酪味、脂肪味54.58癸酸1 0000.1^1酸腐味、脂肪味萜烯类15.24D-柠檬烯100.1^1甜香、柑橘香、柠檬香27.87香叶醇20>1柠檬味、天竺葵味29.41芳樟醇250.1^1花香、柑橘香35.14α-松油醇2500.1^1百合花香呋喃类17.32糠醛14 1000.1^1烘烤味
2.5.3.2 主成分分析
为了进一步探究优良抗逆菌株与香气化合物之间关系及对葡萄酒香气成分的整体差异,将上述OAV>0.1的香气物质进行PCA,如图6所示,其中PC1占53.69%,PC2占21.97%,两个主成分的累计方差贡献率为75.66%,基本可以解释原变量大多数的变异信息。优良抗逆酒类酒球菌发酵酒样香气成分与未MLF酒样和对照菌株发酵酒样很好的分离开,未MLF酒样处于PC2的负向端,这个区域没有呈现相关物质。对照菌株31-DH和SD-2处于PC1的负向端,主要与乙酸乙酯、丁酸乙酯、苯乙醇、异戊醇、D-柠檬烯的香气相关,呈现更多香蕉、柑橘、玫瑰花香、溶剂的香气。而XMN18、XM12、XM16、BM79、XC22-N-3、XC22-N-19分布于PC1和PC2的正向端,主要为酯类(乙酸异戊酯、癸酸乙酯、己酸乙酯、乳酸乙酯、丁二酸二乙酯)和萜烯类(α-松油醇和芳樟醇),使葡萄酒表现更多草莓、香蕉、菠萝、柑橘、黄油等果香和奶香。此外,BM43和BM68的香气表现相似,分布于PC1的正向端和PC2的负向端,与香叶醇、癸酸和糠醛相关性较大,主要使葡萄酒呈现更多烘烤味和酸奶酪味,香气表现单一。

图6 优良抗逆菌株MLF后葡萄酒香气化合物主成分分析
Fig.6 Principal component analysis of aroma components in wines after MLF with the excellent stress-resistant strains
本试验通过ATB胁迫培养基筛选的优良抗逆菌株均为酒类酒球菌,这与目前的研究结果一致,酒类酒球菌是在葡萄酒进行MLF过程中存在的主要菌株,它具有优良的抗胁迫能力,如抗低pH值,高乙醇体积分数,高SO2等[8]。另外,本试验针对宁夏贺兰山东麓产区葡萄原料面临的问题:高糖度(即高酒精度)和高酸度(即低pH值)分别设计两种模拟酒胁迫环境以筛选适合宁夏贺兰山东麓不同子产区葡萄原料的本土优良抗逆乳酸菌,其中XMN18和BM68表现出较好的抗高乙醇体积分数的能力,而XM12表现出较好的抗低pH能力。酒类酒球菌除了可以代谢L-苹果酸使葡萄酒的酸涩口感变得柔和,而且在MLF过程中可以产生次级代谢物来提升葡萄酒香气的复杂性,赋予葡萄酒烘烤味、奶油味和蜂蜜味等香气[23]。本试验结果表明,筛选获得的优良抗逆酒类酒球菌发酵酒样的香气物质总含量均高于未MLF酒样,主要是乙酸异戊酯、癸酸乙酯、己酸乙酯、乳酸乙酯、丁二酸二乙酯、α-松油醇和芳樟醇等香气物质,可赋予葡萄酒更多草莓、香蕉、菠萝、柑橘、黄油等果香和奶香香气。综上所述,8株优良抗逆酒类酒球菌具有良好的抗胁迫能力、L-苹果酸代谢能力和产香能力,为建立宁夏贺兰山东麓产区菌种资源及遗传多样性提供了菌株样本,同时为发展我国本土优良乳酸菌、呈现和塑造特色葡萄酒具有重要意义。
3 结论
采用ATB分离培养基从宁夏贺兰山东麓葡萄酒产区分离筛选获得388株乳酸菌,经抗逆筛选、分子生物学、菌株安全性等鉴定,得到其中8株具有优良抗逆性能的酒类酒球菌。
8株优良抗逆酒类酒球菌对高乙醇体积分数(14%)、低pH值(3.2)环境具有良好的耐受性,可快速代谢L-苹果酸完成葡萄酒的苹乳发酵。
优良抗逆酒类酒球菌在葡萄酒中进行MLF,表现出L-苹果酸代谢速度快,发酵酒样香气含量高,酒香丰盈,有助于本土优良乳酸菌的发展和产区特色葡萄酒的酿造。
[1] BARTOWSKY E, COSTELLO P, FRANCIS IL, et al.Oenococcus oeni and Lactobacillus plantarum:Effects of MLF on red wine aroma and chemical properties[J].Practical Winery &Vineyard Journal, 2012, 33:57-59.
[2] SUMBY K M, GRBIN P R, JIRANEK V.Microbial modulation of aromatic esters in wine:Current knowledge and future prospects[J].Food Chemistry, 2010, 121(1):1-16.
[3] CARLA V, KRISTA S, EVELINE B, et al.Lactic acid bacteria in wine:Technological advances and evaluation of their functional role[J].Frontiers in Microbiology, 2021, 11:612118.
[4] COSTELLO P J, SIEBERT T E, SOLOMON M R, et al.Synthesis of fruity ethyl esters by acyl coenzyme A:Alcohol acyltransferase and reverse esterase activities in Oenococcus oeni and Lactobacillus plantarum[J].Journal of Applied Microbiology, 2013, 114(3):797-806.
[5] BARTOWSKY E J.Oenococcus oeni and malolactic fermentation-moving into the molecular arena[J].Australian Journal of Grape and Wine Research, 2005, 11(2):174-187.
[6] PINTO C, PINHO D, CARDOSO R, et al.Wine fermentation microbiome:A landscape from different Portuguese wine appellations[J].Frontiers in Microbiology, 2015, 6(905):1-13.
[7] BOKULICH N A, COLLINS T S, MASARWEH C, et al.Associations among wine grape microbiome, metabolome, and fermentation behavior suggest microbial contribution to regional wine characteristics[J].mBio, 2016, 7(3):e00631-e00616.
[8] 余东亮. 昌黎、银川产区酒酒球菌遗传多样性分析及优良菌株筛选[D].杨凌:西北农林科技大学, 2019.
YU D L.Genetic diversity analysis of Oenococcus oeni strains isolated from Changli and Yinchuan regions and screening of promising strains[D].Yangling:Northwest A &F University, 2019.
[9] HENICK-KLING T, SANDINE W E, HEATHERBELL D A.Evaluation of malolactic bacteria isolated from Oregon wine[J].Applied and Environmental Microbiology, 1989, 55(8):2010-2016.
[10] 李平兰, 贺稚非.食品微生物学实验原理与技术[M].北京:中国农业出版社, 2014.
LI P L, HE Z F.Experimental Principles and Techniques of Food Microbiology[M].Beijing:China Agriculture Press, 2014.
[11] ZAPPAROLI G, TORRIANI S, PESENTE P, et al.Design and evaluation of malolactic enzyme gene targeted primers for rapid identification and detection of Oenococcus oeni in wine[J].Letters in Applied Microbiology, 1998, 27(5):243-246.
[12] 赵美静. 植物乳杆菌细菌素基因座遗传分析与基因plnEF外源表达研究[D].杨凌:西北农林科技大学, 2017.
ZHAO M J.The genetic analysis of plantaricin locus of Lactobacillus plantarum and heterologous expression of genes plnEF[D].Yangling:Northwest A &F University, 2017.
[13] COTON M, ROMANO A, SPANO G, et al.Occurrence of biogenic amine-forming lactic acid bacteria in wine and cider[J].Food Microbiology, 2010, 27(8):1078-1085.
[14] 赵艳卓, 刘树文.酒酒球菌中生物胺相关基因的检测[J].中国酿造, 2011,30(12):40-42.
ZHAO Y Z, LIU S W.Detection of biogenic amines relative genes in Oenococcus oeni[J].China Brewing, 2011,30(12):40-42.
[15] DIEZ-OZAETA I, LAVILLA M, AM RITA F.Wine aroma profile modification by Oenococcus oeni strains from Rioja Alavesa region:Selection of potential malolactic starters[J].International Journal of Food Microbiology, 2021, 356(2021):109324.
RITA F.Wine aroma profile modification by Oenococcus oeni strains from Rioja Alavesa region:Selection of potential malolactic starters[J].International Journal of Food Microbiology, 2021, 356(2021):109324.
[16] BUCHANAN R E.伯杰细菌鉴定手册[M].中国科学院微生物研究所译.北京:科学出版社,1984.
BUCHANAN R E.Berger Handbook for Bacterial Identification[M].Translated by Institute of Microbiology,Chinese Academy of Sciences.Beijing:Science Press, 1984.
[17] MORENO-ARRIBAS M V, SMIT A Y, DU TOIT M.Biogenic amines and the winemaking process[J].Managing Wine Quality, 2010(27):494-522.
[18] SMIT A Y, DU TOIT W J, DU TOIT M.Biogenic amines in wine:Understanding the headache[J].South African Journal of Enology &Viticulture, 2016, 29(2):109-127.
[19] BORDAS M, ARAQUE I, ALEGRET J, et al.Isolation, selection, and characterization of highly ethanol-tolerant strains of Oenococcus oeni from south Catalonia[J].International Microbiology:The Official Journal of the Spanish Society for Microbiology, 2013, 16(2):113-123.
[20] RIZK Z, EL RAYESS Y, GHANEM C, et al.Impact of inhibitory peptides released by Saccharomyces cerevisiae BDX on the malolactic fermentation performed by Oenococcus oeni Vitilactic F[J].International Journal of Food Microbiology, 2016, 233:90-96.
[21] LEE J E, HONG Y S, and LEE C H.Characterization of fermentative behaviors of lactic acid bacteria in grape wines through 1H NMR- and GC-based metabolic profiling[J]. Journal of Agricultural and Food Chemistry, 2009, 57(11):4810-4817.
[22] FRANCIS I L, NEWTON J L.Determining wine aroma from compositional data[J].Australian Journal of Grape and Wine Research, 2005, 11(2):114-126.
[23] MATEO J J, JIMÉNEZ M.Monoterpenes in grape juice and wines[J].Journal of Chromatography A, 2000, 881(1-2):557-567.
