卟啉(porphyrin)是一类由4个吡咯类亚基互联而成的大分子杂环化合物,主要包括血红素、叶绿素、维生素B12等,普遍存在于自然界的各种生物体中[1]。血红素,即铁原卟啉Ⅸ(Fe-protoporphyrin Ⅸ,Fe-PPⅨ),在生物体内发挥着多种生物学功能[2-3],它在转录和翻译水平上调节基因表达,作为多种酶与蛋白分子的辅因子参与生化反应,同时是电子传递链蛋白的重要组成部分,也是许多生物体的优质铁源[4-6]。因此,血红素在食品、医疗保健、疾病诊断与治疗等方面都有广泛应用[7-9]。目前通过化学合成、以生物材料为原料进行有机提取或酶水解制备血红素的工艺[10-12],涉及的步骤多、产量低、时间长,且环境不友好。利用重组细菌如大肠杆菌生物合成血红素是大规模生产血红素最有前途的方法[13-14],但是目前产量低,不适合工业化生产,因此通过代谢工程改造提升重组菌的血红素合成能力非常有必要。
大肠杆菌通过C5途径合成血红素(图1),强化代谢途径的关键酶基因可提高关键前体物的产量,如过表达hemA编码的谷氨酰t-RNA还原酶,可提高胞内5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)的合成,同时也促进了细胞向外排出5-ALA[15];通过敲除5-ALA 的转运蛋白(如RhtA、EamA)减少5-ALA外泌可提高胞内血红素的含量[16-17],但涉及其他前体转运蛋白对血红素合成影响的研究非常有限。

图1 大肠杆菌血红素合成代谢途径
Fig.1 Metabolic pathway of heme in Escherichia coli
注:加粗箭头:过表达;虚线箭头:部分代谢过程被省略;×:基因被敲除。
在革兰氏阴性菌中,TolC具有向胞外排出蛋白质、毒素、抗微生物剂的功能[18]。有研究表明,在外源添加5-ALA的情况下,tolC基因缺失会导致大肠杆菌细胞积累大量粪卟啉III[19];也有研究指出MacAB-TolC 流出泵与大肠杆菌中PPⅨ的流出有关[20]。这些研究表明tolC缺失菌具有积累卟啉化合物的能力,但后续向血红素转化的研究未见报道。
hemH基因编码的亚铁螯合酶催化Fe2+与PPⅨ结合形成血红素,是血红素合成的最后一步[21]。因此,本研究通过敲除tolC,并在敲除菌株中过表达hemH与hemA,结合外源添加Fe2+促进卟啉向血红素的转化(图1),为大肠杆菌血红素产量提升提供新的策略。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
实验中所用到的菌株和质粒相关信息见表1。
表1 本研究中使用的菌株与质粒
Table 1 Strains and plasmids used in this study

菌株/质粒特性来源/参考文献菌株BL21(DE3)/WTExpression strain[22]WT-AHWT transformed with pEAH本研究WTΔTWT deleted tolC本研究WTΔT-pET28aWTΔT transformed with pET28a本研究WTΔT-AWTΔT transformed with pEA本研究WTΔT-AHWTΔT transformed with pEAH本研究质粒pKD46、pKD4、pCP20Red homologous recombina-tion knockout plasmids[23]pET22bExpression plasmid,AmpRTaKaRapEUTDpET22b inserted with UtolC,kan2,DtolC本研究pET28aExpression plasmid,KanRTaKaRapEApET28a inserted with hemA本实验室保存pEAHpET28a inserted with hemA、hemH本实验室保存
1.1.2 主要试剂与仪器
质粒提取、纯化试剂盒、限制性内切酶、T4连接酶, TaKaRa公司;氯高铁血红素及草酸,Sigma公司;尿卟啉III盐酸盐(uroporphyrin III dihydrochloride,UIII)、粪卟啉III盐酸盐(coproporphyrin III dihydrochloride,CIII)标准品,Frontier Scientific公司;原卟啉IX(protoporphyrin IX, PPIX)标准品,源叶生物公司;异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、硫酸卡那霉素(kanamycin sulfate,Kan)、氨苄青霉素(ampicillin,Amp)、氯霉素,生工生物工程(上海)股份有限公司;七水合硫酸亚铁(FeSO4·7H2O),国药沪试。
分光光度计,尤尼柯(上海)仪器有限公司;PowerPacTMHC核酸电泳仪、C1000梯度PCR仪、MicroPulser电转仪、Gel DocEZ凝胶成像仪,Bio-Rad公司;Synergy H4多功能酶标仪,美国伯腾仪器有限公司。
1.1.3 培养基
LB液体培养基(固体培养基加入1.5%~2%琼脂),抗性固体培养基在LB培养基灭菌温度降至60 ℃后再加入抗生素 (终质量浓度为50 μg/mL)。
1.2 实验方法
1.2.1 tolC缺失菌株构建
以NCBI上公布的E.coli BL21(DE3)基因组序列(https://www.ncbi.nlm.nih.gov/nuccore/AM946981.2)为模板,设计敲除tolC上下游同源序列的引物。引物UtolCF/R、DtolCF/R分别扩增出tolC基因上下游500 bp左右的同源序列基因 UtolC,分别经Xba I、EcoRI 与 Xho I、Hind III 双酶切。以 pKD4质粒为模板设计引物 tkanF/R,扩增含两端 FRT位点的Kan抗性基因kan2,经EcoRI和Hind III双酶切,质粒pET22b经Xba I和Xho I双酶切,使用T4连接酶,将3个基因片段与线性化质粒进行连接,将连接产物转化入E.coli JM109中,在Kan和Amp双抗平板上筛选阳性转化子,得到质粒pEUTD。以质粒pEUTD为模板,利用引物KtolCF/R进行PCR扩增,得到线性打靶片段,用于敲除tolC基因。
大肠杆菌tolC基因的敲除参考DATSENKO等[23],将上述打靶片段(2 493 bp)电转入含pKD46质粒的菌株中37 ℃,200 r/min旋转振荡过夜复苏后,37 ℃筛选阳性单克隆菌落。利用引物 tkanF/R进行 PCR扩增,验证条带大小正确后,再导入pCP20质粒,涂布至氯霉素抗性平板上,30 ℃过夜培养后,挑转化子,利用引物QtolCF/R进行PCR扩增验证后,送至华大基因有限公司测序验证,测序正确的转化子,再通过42 ℃摇床培养,得到没有任何抗性的菌株。
1.2.2 过表达菌株构建
使用TaKaRa质粒提取试剂盒提取实验室保存的质粒pEA、pEAH,使用引物hemAF/R、hemHF/R对质粒进行验证,验证正确后导入WTΔT感受态细胞中,获得菌株WTΔT-A、WTΔT-AH。本研究中使用的引物序列见表2。
表2 本研究中使用的引物
Table 2 Primers used in this study

引物名称序列(5'-3')UtolCFCTAGTCTAGAATCTCCAGTAGCCAGGGGGTTTUtolCRCTAGTCTAGATCCTTGTGGTGAAGCAGTATTDtolCFCCCAAGCTTTGAACGTAAGGCAACGTA-AAGATACGDtolCFCCGCTCGAGGGCATCCAGAAACTCCCGCtkanFCCGGAATTCATTGTGTAGGCTGGAGCTGCTTCtkanRCCCAAGCTTGACATGGGAATTAGCCATGGTCCKtolCFATCTCCAGTAGCCAGGGGGTTTKtolCRGGCATCCAGAAACTCCCGCQtolCFATGCCCACTCATTTTTTAACGCTTGQtolCFTTTTGGTGCCATTGCCGTChemAFATGACCCTTTTAGCACTCGGhemARTATTCAGGCGTTCGTTATCCCChemHFATGCGTCAGACTAAAACCGGhemHRTTAGCGATACGCGGCAACAAG
注:加粗为保护碱基,加下划线为酶切位点。
1.2.3 培养方法
各菌株接种于含有50 mL LB液体培养基的摇瓶中,在37 ℃、200 r/min的摇床中过夜活化后,以2%(体积分数)接种量接种至150 mL LB液体培养基,37 ℃、200 r/min摇床培养12 h,含质粒菌株加入Kan抗生素,需要添加诱导剂的菌株,在培养2 h后加入终浓度0.2 mmol/L的IPTG诱导10 h。
1.2.4 血红素浓度检测
参考文献[22]和文献[24]的方法检测血红素浓度。取8/OD600 mL菌体量(3个平行)于4 ℃、12 000×g离心5 min后弃上清液,10 mL超纯水重悬后4 ℃、12 000×g离心5 min后弃上清液,每管加入500 μL的20 mmol/L草酸溶液重悬后转移至棕色离心管,4 ℃冰箱放置16 h后加入2 mol/L草酸溶液,混匀后均分至棕色离心管,一份室温放置,另一份95 ℃水浴30 min。冷却后于4 ℃、12 000×g离心5 min后在激发波长400 nm、发射波长620 nm下检测其荧光值。计算测定的荧光差值后由血红素标准曲线得到相应血红素浓度。
血红素标准曲线绘制方法为:称取一定量的氯高铁血红素溶解于0.25%(质量分数)Na2CO3作为血红素母液,将血红素母液稀释为不同浓度的血红素标准液后各取50 μL加入500 μL的20 mmol/L草酸溶液,后续操作与样品测定方法相同,计算测定的荧光差值后与血红素浓度绘制标准曲线。
1.2.5 PPⅨ荧光检测
PPⅨ检测方法同1.2.4节,其中室温放置样品在激发波长400 nm、发射波长620 nm下的荧光值作为胞内PPⅨ的积累量。
2 结果与分析
2.1 重组菌株的验证
2.1.1 缺失与过表达基因的验证
以质粒pEUTD为模板,利用引物KtolCF和KtolCR扩增得到长度为2 493 bp的打靶片段。将打靶片段电转进WT-pKD46后,利用引物tkanF/R对获得的转化子进行菌落PCR鉴定,同源重组成功后理论上可获得1 533 bp片段,而BL21(DE3)则无法扩增出片段。转入pCP20质粒后,利用引物QtolCF/R对阳性菌进行菌落PCR鉴定,tolC基因敲除成功的菌落理论上PCR结果为1 503 bp,而WT菌株PCR结果为3 022 bp,图2-a结果表明Kan抗性基因被成功消除,对验证正确的敲除菌进行测序,结果正确,表明tolC基因被成功敲除,42 ℃高温培养后消除质粒,并将敲除菌命名为 WTΔT。

图2 tolC缺失菌株与过表达质粒验证
Fig.2 Verification of tolC-deleted strain and overexpression plasmids
注:M:DNA marker,1~2:tolC基因敲除验证(引物为QtolCF/R);3~6:hemA基因扩增(引物为hemAF/R);7:hemH基因扩增(引物为hemHF/R)。
将提取的pEA、pEAH质粒进行PCR验证,hemA、hemH基因大小片段分别为1 257和963 bp,PCR扩增产物的电泳位置在理论值附近,表明质粒正确(图2-b)。将验证正确的质粒导入WTΔT感受态中,涂布至Kan抗性平板筛选阳性转化子,进一步进行菌落PCR和测序验证,验证正确的菌株分别命名为WTΔT-A、WTΔT-AH。
2.1.2 HemA与HemH的蛋白表达
WTΔT-A、WTΔT-AH菌株过夜活化后转接至150 mL的LB液体培养基培养12 h(2 h时加入诱导剂)后收集菌体,破碎、离心,收集上清液与沉淀进行SDS-PAGE蛋白电泳验证。
HemA、HemH分别由419和321个氨基酸构成,理论计算分子质量大小为46.3和35.9 kDa,SDS-PAGE蛋白电泳验证结果显示,HemA、HemH蛋白在上清液与沉淀中均有表达,且与计算值相符(图3-a)。

图3 HemA与HemH的SDS-PAGE验证
Fig.3 SDS-PAGE verification of HemA and HemH
注:M:蛋白marker;1:WTΔT-AH破碎沉淀;2:WTΔT-AH破碎上清液;3:WTΔT破碎上清液;4:WTΔT-A破碎上清液图中箭头指向HemA与HemH蛋白。
由于HemA和HemH的分子质量较为接近,进一步使用分子质量范围为14.3~97.2 kDa的Marker并与WTΔT菌株对比,进一步表明重组蛋白表达成功(图3-b),后续卟啉与血红素含量的分析也证实了这一点。
2.2 tolC缺失对大肠杆菌生长的影响
各菌株每间隔2 h测定其OD600,检测了各菌株12 h内的生长趋势,并绘制成相应的生长曲线(图4)。

a-未添加诱导剂;b-添加诱导剂
图4 各菌株生长曲线
Fig.4 Growth curve of each strain
如图4所示,tolC的缺失对大肠杆菌的前期生长无影响,在4 h后敲除菌OD600略高于野生菌,说明tolC的缺失对于大肠杆菌生长无不利影响。将空载质粒pET28a、过表达质粒pEA、pEAH导入敲除菌,在未添加诱导剂IPTG时也显示对生长无不利影响,但在添加IPTG后,相较于WTΔT菌株,WTΔT-A菌株OD600有较明显提升,而WTΔT-AH菌株OD600则有所下降。其原因可能是hemA单独过表达使得血红素产量增加,血红素在细胞内作为多种酶的辅因子[4](如呼吸链中的细胞色素c)在生命活动中作用较大,因此hemA过表达有利于细胞生长;而由于胞内游离铁离子的缺乏,且hemH的共同过表达将耗费更多的能量,因此使得生长受到了一定的抑制。
2.3 在tolC缺失菌中过表达hemA对卟啉和血红素合成的影响
tolC缺失大肠杆菌可在胞内积累卟啉用于血红素的合成,之前的报道表明外源添加5-ALA可在tolC缺失大肠杆菌中积累大量卟啉,因此过表达hemA基因用于增加内源5-ALA,进一步积累卟啉并转化为血红素。
相较于野生菌,WTΔT菌株胞内卟啉增加了64%,而血红素产量略有下降,为8.35 μmol/L;WTΔT-A菌株胞内卟啉大幅增加,血红素产量为WT菌株的2.62倍,达到26.47 μmol/L(图5)。表明hemA的过表达大幅提升了胞内卟啉与血红素产量,这与之前的报道一致[19,25]。
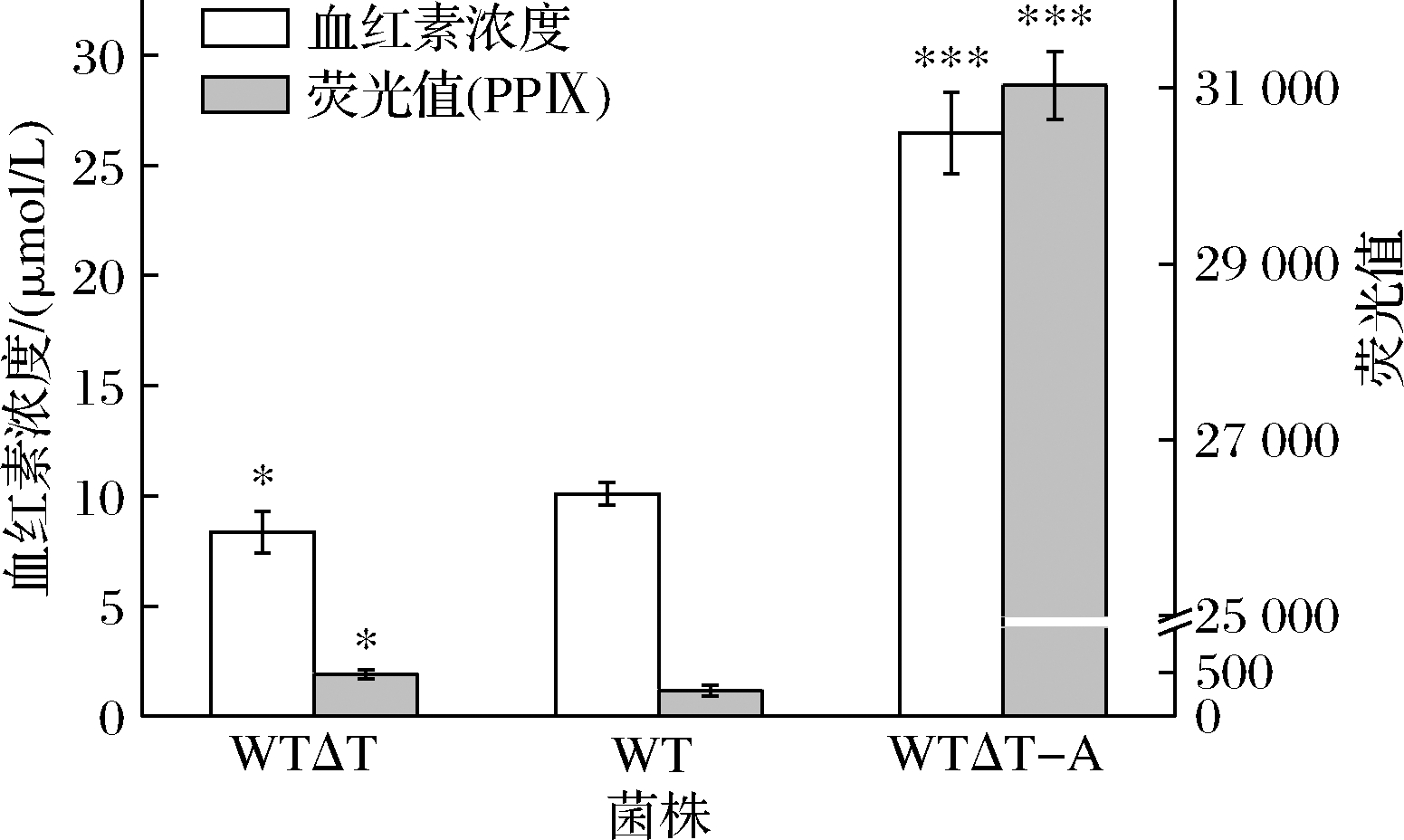
图5 hemA过表达对tolC缺失菌PPIX与血红素含量的影响
Fig.5 Effect of hemA over-expression on PPIX and heme contents in tolC-deleted strain
注:以WT菌株为对照;*表示P<0.05,**表示P<0.01,***表示P<0.001。
2.4 在tolC缺失菌中过表达hemA与hemH对卟啉和血红素合成的影响
考虑到大肠杆菌自身卟啉转化能力有限,较多的卟啉积累而未转化为血红素,因此在过表达hemA的同时过表达hemH,以促进卟啉向血红素的转化。
如图6所示,hemH与hemA的过表达使得OD600减少了32%,胞内血红素为WTΔT菌株的4.15倍,为WT菌株的3.44倍,达到34.69 μmol/L。该结果表明,hemH的过表达虽然在一定程度上降低了大肠杆菌的生长,但hemH基因编码的亚铁螯合酶催化Fe2+与PPⅨ结合形成血红素,对于卟啉向血红素的转化有积极作用[21]。

图6 hemA、hemH共表达对TolC缺失菌生长及血红素含量的影响
Fig.6 Effect of co-expression of hemA and hemH on growth and heme content of tolC-deleted strain
注:以WT-ΔT菌株为对照;*表示P<0.05,**表示P<0.01,***表示P<0.001。
2.5 Fe2+对胞内血红素含量的影响
hemH与hemA共表达促进了卟啉向血红素的转化,但考虑到胞内Fe2+供应可能不足,因此设置了终浓度0、40、80、160、240 μmol/L的FeSO4梯度,进一步促进血红素的合成。
首先比较了野生菌与WTΔT菌株添加不同浓度Fe2+后生长与胞内血红素浓度差异,结果显示,在不添加Fe2+时,野生菌血红素浓度(10.09 μmol/L)略高于敲除菌(8.35 μmol/L),生长状况一致;在添加一定浓度的Fe2+后,敲除菌生长状况好于野生菌,且血红素浓度高于野生菌,在添加浓度80 μmol/L时,获得了最高的血红素浓度15.46 μmol/L(图7),表明在适当浓度的Fe2+存在下,tolC缺失菌中积累的卟啉转化为血红素,因而与野生菌相比更适合作为血红素的生产菌株。

图7 Fe2+对菌株生长和血红素含量的影响
Fig.7 Effect of Fe2+ on growth and heme content of strains
注:以未添加Fe2+菌株为对照,对添加80 μmol/L的Fe2+菌株进行显著性分析;*表示P<0.05,**表示P<0.01,***表示P<0.001。
对于WTΔT-AH菌株,添加不同浓度Fe2+后OD600也有所提升,并且同样在80 μmol/L的添加浓度获得了最高的血红素浓度,达到40.18 μmol/L(图8),是WT菌株血红素含量(10.09 μmol/L)的3.98倍。

图8 Fe2+对WTΔT-AH菌株生长与血红素的影响
Fig.8 Effect of Fe2+ on growth and heme content of WTΔT-AH
3 结论
目前,对于增强血红素合成代谢的研究多集中于关键前体5-ALA含量的提升,例如:促进C5途径中前体谷氨酸的合成与向5-ALA的转化[25]、过表达内源hemA基因[25-26]、异源表达C4途径中5-ALA合成酶基因[21]等,而5-ALA之后的下游中间代谢物向血红素转化的研究相对较少。尽管有研究表明tolC缺失可导致卟啉化合物的积累[19-20],但后续向血红素转化的研究未见报道。本研究以tolC缺失菌为出发菌株,过表达hemA基因,积累了大量卟啉;再对hemH进行过表达,并添加Fe2+以确保铁源充足,使卟啉与血红素螯合。与野生菌对比,结果显示tolC缺失菌在添加Fe2+能积累更多的血红素,表明缺失菌更适合作为血红素生产的出发菌株,在tolC缺失菌中共表达hemA和hemH,并外源添加80 μmol/L的Fe2+,血红素水平达到40.18 μmol/L,是野生菌的3.98倍。以上结果为进一步通过发酵优化控制,提高血红素的生产水平,进而利用重组大肠杆菌发酵生产血红素奠定了一定的基础。
[1] BRYANT D A, HUNTER C N, WARREN M J.Biosynthesis of the modified tetrapyrroles-the pigments of life[J].The Journal of Biological Chemistry, 2020, 295(20):6888-6925.
[2] 邓晔, 郭瑶雪, 李春, 等.血红素合成中间体:卟啉类化合物作为生物标记物的研究进展[J].中南药学, 2015, 13(5):509-512.
DENG Y, GUO Y X, LI C, et al.Research progress on the porphyrin compounds as a biological marker[J].Central South Pharmacy, 2015, 13(5):509-512.
[3] FRANKENBERG N, MOSER J, JAHN D.Bacterial heme biosynthesis and its biotechnological application[J].Applied Microbiology and Biotechnology, 2003, 63(2):115-127.
[4] MÖBIUS K, ARIAS-CARTIN R, BRECKAU D, et al.Heme biosynthesis is coupled to electron transport chains for energy generation[J].Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(23):10436-10441.
[5] HAMZA I.Intracellular trafficking of porphyrins[J].ACS Chemical Biology, 2006, 1(10):627-629.
[6] FRUNZKE J, G TGENS C, BROCKER M, et al.Control of heme homeostasis in Corynebacterium glutamicum by the two-component system HrrSA[J].Journal of Bacteriology, 2011, 193(5):1212-1221.
TGENS C, BROCKER M, et al.Control of heme homeostasis in Corynebacterium glutamicum by the two-component system HrrSA[J].Journal of Bacteriology, 2011, 193(5):1212-1221.
[7] 李志钊, 叶春华.血红素的应用与生产技术研究进展[J].食品研究与开发, 2000, 21(5):12-14.
LI Z Z, YE C H.Research progress on application and production technology of heme[J].Food Research and Development, 2000, 21(5):12-14.
[8] 祝霞, 李颍, 付文力, 等.碱性蛋白酶酶解提取羊血血红素工艺条件优化[J].食品工业科技, 2014, 35(18):199-202.
ZHU X, LI Y, FU W L, et al.Process optimization of the alkaline enzymatic extracting heme from sheep blood[J].Science and Technology of Food Industry, 2014, 35(18):199-202.
[9] 瞿桂香, 黄耀江, 董明盛.血红素制备工艺研究进展[J].中央民族大学学报(自然科学版), 2007, 16(1):19-22.
QU G X, HUANG Y J, DONG M S.Reseach development of heme preparation techniques[J].Journal of the Central University for Nationalities (Natural Sciences Edition), 2007, 16(1):19-22.
[10] FISCHER H, ZEILE K.Synthese des Hämatoporphyrins, protoporphyrins und Hämins[J].Justus Liebig’s Annalen Der Chemie, 1929, 468(1):98-116.
[11] ESPINAS N A, KOBAYASHI K, TAKAHASHI S, et al.Evaluation of unbound free heme in plant cells by differential acetone extraction[J].Plant and Cell Physiology, 2012, 53(7):1344-1354.
[12] IN M J, KIM D C, CHAE H J, et al.Effects of degree of hydrolysis and pH on the solubility of heme-iron enriched peptide in hemoglobin hydrolysate[J].Bioscience, Biotechnology, and Biochemistry, 2003, 67(2):365-367.
[13] LUO Z S, LIU N, LAZAR Z, et al.Enhancing isoprenoid synthesis in Yarrowia lipolytica by expressing the isopentenol utilization pathway and modulating intracellular hydrophobicity[J].Metabolic Engineering, 2020, 61:344-351.
[14] ROMANOWSKI S, EUST QUIO A S.Synthetic biology for natural product drug production and engineering[J].Current Opinion in Chemical Biology, 2020, 58:137-145.
QUIO A S.Synthetic biology for natural product drug production and engineering[J].Current Opinion in Chemical Biology, 2020, 58:137-145.
[15] KANG Z, WANG Y, GU P F, et al.Engineering Escherichia coli for efficient production of 5-aminolevulinic acid from glucose[J].Metabolic Engineering, 2011, 13(5):492-498.
[16] 杨燕, 郑珂, 潘梅, 等.大肠杆菌rhtA缺失对血红素合成的影响[J].微生物学通报, 2019, 46(12):3216-3224.
YANG Y, ZHENG K, PAN M, et al.The effect of rhtA deletion on heme synthesis in Escherichia coli[J].Microbiology China, 2019, 46(12):3216-3224.
[17] 潘梅. 大肠杆菌血红素合成调节及其对血红素过氧化物酶的影响[D].无锡:江南大学, 2020.
PAN M.Regulation of heme synthesis and its effect on heme peroxidase in Escherichia coli[D].Wuxi:Jiangnan University, 2020.
[18] VEGA D E, YOUNG K D.Accumulation of periplasmic enterobactin impairs the growth and morphology of Escherichia coli tolC mutants[J].Molecular Microbiology, 2014, 91(3):508-521.
[19] TATSUMI R, WACHI M.TolC-dependent exclusion of porphyrins in Escherichia coli[J].Journal of Bacteriology, 2008, 190(18):6228-6233.
[20] TURLIN E, HEUCK G, SIM ES BRAND
ES BRAND O M I, et al.Protoporphyrin (PPIX) efflux by the MacAB-TolC pump in Escherichia coli[J].Microbiology Open, 2014, 3(6):849-859.
O M I, et al.Protoporphyrin (PPIX) efflux by the MacAB-TolC pump in Escherichia coli[J].Microbiology Open, 2014, 3(6):849-859.
[21] PRANAWIDJAJA S, CHOI S I, LAY B W, et al.Analysis of heme biosynthetic pathways in a recombinant Escherichia coli[J].Journal of Microbiology and Biotechnology, 2015, 25(6):880-886.
[22] 陈丹园, 沈云杰, 杨燕, 等.关键酶基因的过表达与环境因素对大肠杆菌血红素合成的调控[J].食品与发酵工业, 2018, 44(11):7-14.
CHEN D Y, SHEN Y J, YANG Y, et al.Regulation of heme synthesis in Escherichia coli by overexpression of genes for the key enzymes and environmental factors[J].Food and Fermentation Industries, 2018, 44(11):7-14.
[23] DATSENKO K A, WANNER B L.One-step inactivation of chromosomal genes in Escherichia coliK-12 using PCR products[J].Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12):6640-6645.
[24] SASSA S.Sequential induction of heme pathway enzymes during erythroid differentiation of mouse Friend leukemia virus-infected cells[J].Journal of Experimental Medicine, 1976, 143(2):305-315.
[25] 潘梅, 刘爽欣, 唐蕾.谷氨酸代谢调控及hemA过表达促进大肠杆菌血红素合成[J].微生物学通报, 2021, 48(3):701-709.
PAN M, LIU S X, TANG L.Enhancing heme synthesis in Escherichia coli by regulating glutamic acid metabolism and over-expressing hemA[J].Microbiology China, 2021, 48(3):701-709.
[26] 朱子薇, 张健, 王倩, 等.卟啉代谢途径高价值产物及其微生物合成研究进展[J].中国科学:生命科学, 2020, 50(12):1405-1417.
ZHU Z W, ZHANG J, WANG Q, et al.Recent advances in the production of high-value products of porphyrin metabolism pathways and their microbial synthesis[J].Scientia Sinica (Vitae), 2020, 50(12):1405-1417.