酸马奶是一种传统发酵乳制品,在吉尔吉斯斯坦、乌兹别克斯坦、哈萨克斯坦等中亚各国和东亚的蒙古国以及我国内蒙古和新疆等地区备受游牧民族欢迎,其具有悠久的历史,且在一些地区常常作为功能性发酵乳饮料用于辅助治疗一些慢性疾病[1]。已有研究表明乳酸菌在发酵和益生功效方面发挥着非常重要的作用[2],因此分离鉴定酸马奶的乳酸菌具有重要的研究意义和应用价值。
近些年来,随着酸马奶来源益生菌研究的深入和酸马奶在传统饮食疗法中的应用,国内外对酸马奶中乳酸菌的研究正成为传统乳制品研究的热点。早在1997年,ISHII[3]使用纯培养方法分离出蒙古国部分地区酸马奶中优势菌为植物乳杆菌(Lactobacillus plantarum)。2004年,孟和毕力格等[4]分别从我国锡林浩特和蒙古国采集了21份酸马奶样品进行分离鉴定,优势菌种分别为高温性的瑞士乳杆菌(Lactobacillus helveticus)和中温性的干酪乳杆菌(Lacticaseibacillus casei)。莫蓝馨[5]通过Pacbio SMRT平台对内蒙古锡林郭勒盟的酸马奶中细菌菌种进行检测,发现其中优势菌种为副乳房链球菌(Streptococcus parauberis,62.82%)和L.helveticus,德氏乳杆菌(Lactobacillus delbrueckii)、高加索酸奶乳杆菌(Lentilactobacillus kefiri)、马乳酒样乳杆菌(Lactobacillus kefiranofaciens)次之。ZHOU等[6]从新疆传统酸马奶中分离获得6株乳酸菌,分别为肠球菌(Enterococcus)、溶胆链球菌(Streptococcus gallolyticus)、发酵乳杆菌(Lactobacillus fermentum)、德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.Bulgaricus)、蜡样芽胞杆菌(Bacillus cereus)、杜兰肠球菌(Enterococcus durans)。RAKHMANOVA等[7]自哈萨克斯坦的酸马奶中采集分离获得了52株乳酸菌和20株酵母菌。筛选出KZLAB13和KZY10两株优良菌株菌可用于发酵牛奶。也有研究报道对内蒙古传统酸马奶的细菌和真菌群落结构进行分析,结果表明,在11份酸马奶样品中共检出6个细菌门126属49种,乳杆菌属为优势菌属[8]。ISPIRLI等[9]从哈萨克斯坦和吉尔吉斯斯坦传统酸马奶样品中分离出L.fermentum、粪肠球菌(Enterococcus faecalis)、屎肠球菌(Enterococcus feces)和L.helveticus等。以上结果表明,不同的研究者所得结果存在一定的差异,不同国家或同一国家不同地区和时间的酸马奶中乳酸菌的组成也存在异同。
本研究对国内外不同地区传统酸马奶中的乳酸菌进行分离鉴定,并从中筛选具有潜在益生菌特性和良好发酵特性的乳酸菌,以期为酸马奶等发酵乳制品的工业化生产提供优良的菌种。
1 材料与方法
1.1 样品及其来源
本研究中用于乳酸菌分离鉴定的酸马奶样品共44份。其中,8份样品采集自中亚的吉尔吉斯斯坦、乌兹别克斯坦的部分地区;4份样品采集于蒙古国乌兰巴托郊区;11份样品为我国锡林郭勒盟巴音锡勒地区;21份样品采集自新疆昭苏县和尼勒克县。以上样品均为牧民家庭以传统工艺自然发酵酸马奶样品,发酵温度随环境温度而变化但均低于25 ℃室温。
样品采集时,用无菌吸管吸取2~5 mL酸马奶于加有保护剂(淀粉∶CaCO3=50∶1,质量比)的无菌采样管中,用冰袋降温运送至实验室,立即进行乳酸菌的分离和鉴定。
1.2 试验方法
1.2.1 乳酸菌的分离与鉴定
采用10倍梯度稀释法[10]对酸马奶样品进行稀释。待菌落形成后经革兰氏染色镜检呈阳性、H2O2阴性的分离株视为疑似乳酸菌,于MRS液体培养基中富集培养,离心收集菌体分装于2 mL冻存管中置-80 ℃冷藏备用[11]。乳酸菌基因组DNA的提取使用天根细菌基因组DNA提取试剂盒。浓度和纯度的检测使用紫外分光光度计,若OD260/OD280范围保持在1.8~2.0即视为纯DNA样品。PCR扩增参照史迪等[12]等的操作,将扩增成功的PCR产物进行16S rRNA基因测序,用于菌种鉴定。
1.2.2 乳酸菌在牛乳中的生长及其凝乳特性初步筛选
用MRS液体培养基活化乳酸菌分离株,待活菌数达到108 CFU/mL以上后按体积分数2%的量接种至10%脱脂乳中,置于37 ℃培养至凝乳,期间观察并记录凝乳时间,测定记录其pH值和滴定酸度。
1.2.3 乳酸菌人工胃肠液耐受性及耐酸特性分析
将获得的分离株接种于MRS液体培养基中于37 ℃培养20 h,进行3次传代后,离心收集菌体细胞加入40 mL PBS制备供试菌液。人工胃肠液的制备及其耐受性试验参照LIU等[13]所用方法进行。
0 h原菌液活菌数:将供试菌液10倍梯度稀释,选取10-4、10-5、10-6梯度进行计数即为0 h原菌液活菌数。将500 μL供试菌液与4.5 mL的人工胃液均匀混合后置于37 ℃、厌氧培养3 h,记录其活菌数。再将500 μL已培养3 h的含菌人工胃液与4.5 mL人工肠液混合,37 ℃厌氧培养,分别在4和8 h记录活菌数,随后计算存活率[14-15]。
1.2.4 乳酸菌发酵温度适应性分析
将乳酸菌菌株培养至活菌数达108 CFU/mL以上后以体积分数2%的量接种至MRS液体培养基中,分别在4、15、20、25、28、30 ℃培养24 h,并测定OD600nm。
1.3 数据分析
利用Excel、Origin、Mega 6.0等软件进行数据分析和图形绘制。
2 结果与分析
2.1 酸马奶中乳酸菌的分离鉴定
2.1.1 乳酸菌的分离、DNA的提取及PCR扩增结果
从44份酸马奶样品中共分离获得264株革兰氏阳性、H2O2阴性的疑似乳酸菌菌株,其基因组DNA提取后质量浓度均在100~300 ng/μL,DNA纯度值在1.8~2.0;琼脂糖凝胶电泳结果表明,在bp 1 500处可见清晰、完整性好的条带且无拖尾现象,说明264株乳酸菌分离株成功获得16S rRNA基因扩增产物,满足基因测序的要求。
2.1.2 乳酸菌16S rRNA序列同源性比较及其鉴定结果
分离获得的264株乳酸菌经16S rRNA序列分析比对后归属于5个属16个种,其每个乳酸菌种及其数量如表1所示。
表1 不同地区乳酸菌分离鉴定结果
Table 1 Results of isolation and identification of LABs from different regions
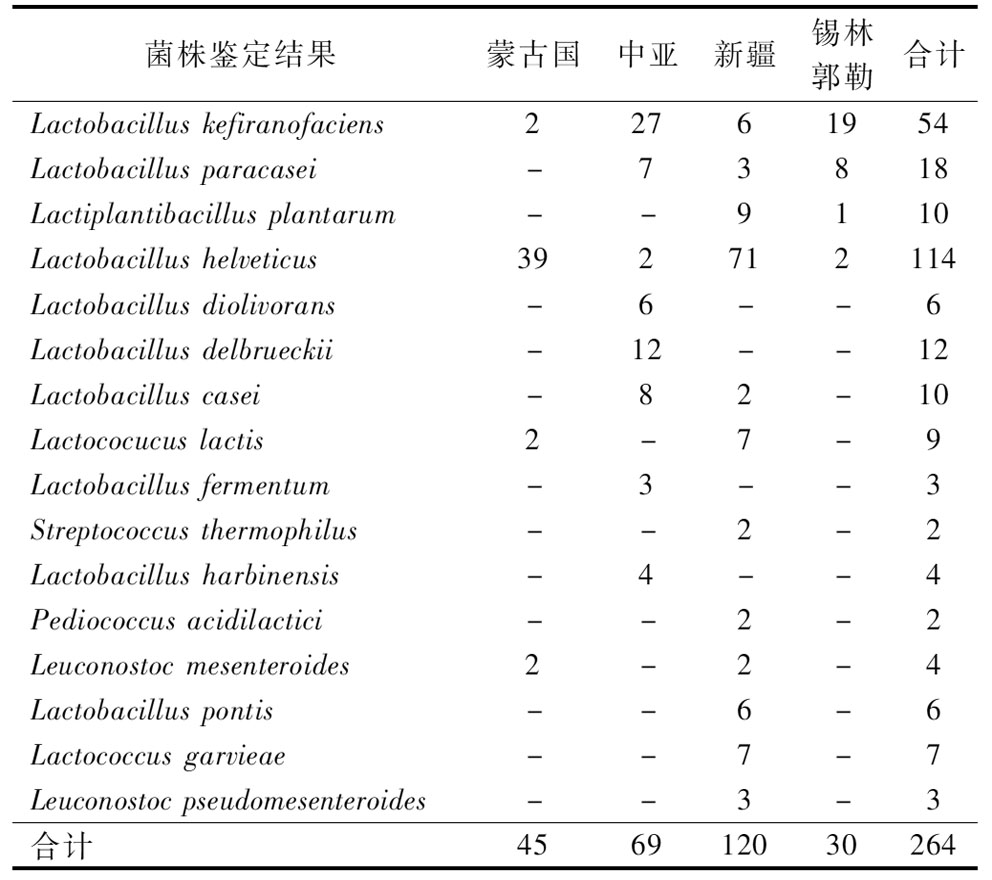
菌株鉴定结果蒙古国中亚新疆锡林郭勒合计Lactobacillus kefiranofaciens22761954Lactobacillus paracasei-73818Lactiplantibacillus plantarum --9110Lactobacillus helveticus392712114Lactobacillus diolivorans-6--6Lactobacillus delbrueckii-12--12Lactobacillus casei-82-10Lactococucus lactis2-7-9Lactobacillus fermentum-3--3Streptococcus thermophilus--2-2Lactobacillus harbinensis -4--4Pediococcus acidilactici--2-2Leuconostoc mesenteroides2-2-4Lactobacillus pontis--6-6Lactococcus garvieae--7-7Leuconostoc pseudomesente-roides--3-3合计456912030264
注:-表示该菌种未分离鉴定到。
其中,分离得到最多的为L.helveticus,占总分离株的43%,L.kefiranofaciens次之,占总分离株的20%,其余菌种占37%。而L.helveticus同时也是蒙古国和新疆的优势菌种,分别占样品分离菌株数量的87%和59%。L.kefiranofaciens是中亚和锡林郭勒的优势菌种,分别占样品分离菌株数量的39%和63%。
经拼接和整理测序得到16S rRNA基因序列并进行同源性比对[16],在每个菌种中选取1~2株与模式株构建系统发育树,如图1所示。菌株SL2-5与模式株Lactobacillus paracasei ATCC 25302(TD79212)聚为一类,相似性为99%,故鉴定为L.paracasei。菌株Q15-6、Q11-6与模式株Lactobacillus casei ATCC 393(NR 041893.1)聚为一类,相似性为99%,故鉴定为L.casei。菌株KG17-9与模式株Lactobacillus diolivorans JKD6(NR 037004.1)聚为一类,相似性为100%,故鉴定为L.diolivorans。菌株KG18-6与模式株Lactobacillus harbinensis NBRC100982(AB681318)聚为一类,相似性为100%,故鉴定为L.harbinensis。菌株Z5-8与模式株Pediococcus acidilactici NGRI 0510Q(NR 041640.1)聚为一类,相似性为100%,故鉴定为 P.acidilactici。菌株Z5-3与模式株L.plantarum DK022(AJ640078)聚为一类,相似性为100%,故鉴定为L.plantarum。菌株Q24-5与模式株Lactobacillus pontis LTH 2587(NR 036788.2)聚为一类,相似性为99%,故鉴定为L.pontis。菌株C7-1与模式株L.fermentum CIP 102980(NR 104927.1)聚为一类,相似性为100%,故鉴定为L.fermentum。菌株MGR1-9、14-7与模式株Leuconostoc pseudomesenteroides NRIC 1777(NR 040814.1) 聚为一类,相似性为99%,故鉴定为L.pseudomesenteroides。菌株MGR10-6-2与模式株Leuconostoc mesenteroides ATCC 8393T(CP000414)聚为一类,相似性为100%,故鉴定为L.mesenteroides。菌株Q1-1与模式株Streptococcus thermophilus DSMZ 20617(X68418)聚为一类,相似性为100%,故鉴定为S.thermophilus。Z7-1与模式株Lactococcus lactis ATCC 19435T(AB100803)聚为一类,相似性为100%,故鉴定为L.lactis。菌株Q11-4与模式株Lactococcus garvieae BSN(KM261818)聚为一类,相似性为100%,故鉴定为L.garvieae;菌株UZ22-4与模式株L.delbrueckii YIT 11221(AB641833)聚为一类,相似性为99%,故鉴定为L.delbrueckii;菌株MGR1-44、SL2-6、Z3-1与模式株L.kefiranofaciens ATCC 43761(AJ575259)聚为一类,相似性为100%,故鉴定为L.kefiranofaciens;菌株MGR9-6、UZ29-9、Q6-2与模式株L.helveticus ATCC 15009(FR683085)聚为一类,且同源性为100%,故鉴定为L.helveticus。

图1 部分乳酸菌分离株16S rRNA基因序列系统发育树
Fig.1 Phylogenetic relationship of 16S rRNA gene sequence of some LABs
2.2 酸马奶源乳酸菌在脱脂乳中的生长及凝乳特性
为了解分离乳酸菌菌株在乳基料中的生长发酵性能,将分离获得的264株菌接种于10%的脱脂乳培养基中,37 ℃恒温培养观察其12~24 h期间的凝乳状态。结果如图2所示,所测试的5个时间点(12、15、18、21、24 h)共有148株菌凝乳,剩余116株乳酸菌生长缓慢,在24 h时仍未能使脱脂乳凝乳。

图2 不同时间凝乳的乳酸菌数量
Fig.2 Number of LABs of curd at different time
将凝乳情况良好的148株乳酸菌进行发酵,测定pH和滴定酸度,结果如图3所示。148株乳酸菌发酵终点pH在3.74~6.47,滴定酸度在22.05~153.45,其中44%的菌株pH集中在5.01~5.50、滴定酸度集中在35~65。有9株菌的pH<4.0、滴定酸度>120。通过测定发现菌株Q16-3、Q16-4、Q18-3、Q18-5、Q20-6、Q27-5、Q27-6、C7-4、C7-6产酸能力较强,菌株MGR1-9产酸能力最弱,因此,将产酸能力较强的9株乳酸菌进行后续研究。

a-pH;b-滴定酸度
图3 不同pH值范围和滴定酸度范围的乳酸菌数量
Fig.3 The number of LABs in different pH range and titrated acidity range
如图4所示,4个地区所分离获得的乳酸菌持有不同范围的pH和滴定酸度。新疆分离获得的乳酸菌pH值和滴定酸度分别主要集中在4.30~5.30、45~90,锡林郭勒分离获得的乳酸菌pH和滴定酸度分别主要集中在4.47~5.88、30~70,蒙古国分离获得的乳酸菌pH值和滴定酸度分别主要集中在5.11~5.40、50.96~54.00,中亚分离获得的乳酸菌pH值和滴定酸度分别主要集中在4.90~5.85、39~75,其中新疆地区乳酸菌的pH值相比于蒙古国和中亚差异显著(P<0.05),滴定酸度在新疆和中亚之间差异显著(P<0.05),表明在不同地点和不同时期采集的样品中乳酸菌特性有一定的差异。

a-pH;b-滴定酸度
图4 不同地区乳酸菌pH值及滴定酸度的范围
Fig.4 The range of pH and titratable acidity of LABs in different regions
2.3 酸马奶源乳酸菌的耐酸性分析结果
传统发酵食品中乳酸菌的另一个重要特征是其在胃肠道通道中的生存能力,通过产酸性能分析结果,筛选出9株产酸性能良好的菌株,进行人工胃肠液耐受性试验,人工胃液耐受性分析结果可知(表2),菌株C7-4、C7-6在人工胃液(pH 2.5)培养3 h后存活率低于10%,菌株Q16-3、Q16-4、Q20-6、Q27-5存活率在10%~40%,耐受能力较弱。而菌株Q18-3、Q18-5、Q27-6存活率分别为89.26%、86.94%、71.43%,在人工胃液中表现出较高的存活能力,耐受能力较强。
表2 筛选菌株对人工胃液耐受力
Table 2 Tolerance to artificial gastric juice of selected strains

菌株编号0 h活菌数/(CFU/mL)3 h活菌数/(CFU/mL)3 h存活率/%Q16-3(3.23±0.02)×109(5.55±0.01)×10817.18Q16-4(1.32±0.01)×109(4.98±0.03)×10837.73Q18-3(7.45±0.02)×109(6.65±0.04)×10989.26Q18-5(9.95±0.05)×109(8.65±0.01)×10986.94Q20-6(1.16±0.01)×108(1.34±0.01)×10711.55Q27-5(4.51±0.01)×108(1.14±0.01)×10825.28Q27-6(4.55±0.01)×109(3.25±0.01)×10971.43C7-4(2.29±0.06)×108(1.75±0.03)×1077.64C7-6(1.94±0.04)×108(1.72±0.01)×1078.66
在人工肠液中活菌数变化如表3所示,菌株Q18-3、Q18-5和Q27-6在人工肠液消化8 h后的存活率分别为52.18%、32.02%和8.15%。还有其他6株菌Q16-3、Q16-4、Q20-6、Q27-5、C7-4和C7-6在人工肠液的存活率低于1%,基本上不耐受人工肠液。益生菌在胃肠道通道中的存活率会受胃液的pH值、在胃液中停留的时间以及菌株本身的一些优异特性。
表3 筛选菌株对人工肠液耐受力
Table 3 Tolerance to artificial intestinal juice of selected strains

菌株编号0 h活菌数/(CFU/mL)8 h活菌数/(CFU/mL)8 h存活率/%Q16-3(5.55±0.01)×108<106<1.00Q16-4(4.98±0.03)×108<106<1.00Q18-3(6.65±0.04)×109(3.47±0.01)×10952.18Q18-5(8.65±0.01)×109(2.77±0.01)×10932.02Q20-6(1.34±0.01)×107<106<1.00Q27-5(1.14±0.01)×108<106<1.00Q27-6(3.25±0.01)×109(2.65±0.01)×1088.15C7-4(1.75±0.03)×107<106<1.00C7-6(1.72±0.01)×107<106<1.00
综上分析,通过产酸能力获得的9株乳酸菌中有2株(22.2%)对人工胃肠液均不耐受,占总分离株的0.8%,不适合于进行下一步分析。9株乳酸菌在人工胃肠液条件下有不同程度的存活率,其中有3株(33.3%)L.plantarum Q18-3、L.paracasei Q18-5、L.helveticus Q27-6在人工胃肠液中表现出较强的存活能力,占总分离株的1.1%,适合于进行下一步的发酵温度适应性分析。
2.4 乳酸菌发酵温度适应性分析结果
由于传统酸马奶通常在较低温度条件下进行自然发酵,因此发酵温度对乳酸菌的增殖有一定的影响力。经过人工胃肠液耐受性分析,获得的3株乳酸菌在不同温度下生长情况见图5,4 ℃条件下基本上不生长,而在15、20、25、28、30 ℃的条件下生长良好。Q18-5在30 ℃发酵的菌体密度相比其他温度差异显著。3株乳酸菌30 ℃下的菌体密度均高于其他温度,表明30 ℃条件下生长速度快,促进菌株生长。说明30 ℃适合低温发酵,而4 ℃保藏时抑制3株乳酸菌的生长。

图5 不同温度对乳酸菌菌体密度的影响
Fig.5 Effect of different temperatures on the density of LABs
注:“*”表示与4 ℃相比,P<0.05,“#”表示与15 ℃相比,P<0.05,“△”表示与20 ℃相比,P<0.05,“◇”表示与25 ℃相比,P<0.05,“☆”表示与28 ℃相比,P<0.05。
3 讨论与结论
从中亚的吉尔吉斯斯坦和乌兹别克斯坦的部分地区以及蒙古国和我国新疆、锡林郭勒盟采集的酸马奶样品中共分离和鉴定出264株乳酸菌菌株,其中L.helveticus占分离率较高,其次为L.kefiranofaciens。乳杆菌属的菌株是通常自然发酵酸马奶中的优势菌株,这与酸马奶在发酵后酸度和贮藏时间有着一定的关系[17]。布仁其其格等[18]使用454焦磷酸测序方法对不同发酵时期的酸马奶细菌群落结构进行分析,发现不同发酵时段以乳杆菌属为优势细菌属,乳球菌属次之。酸马奶随着发酵的延续酸度逐渐增加,耐酸性的乳杆菌属菌株占据优势,但是有时随地点和采集样品时间的原因样品中优势菌种也会有所变化,例如戊糖乳杆菌呈优势菌种[19]。我们首次从中亚地区采集酸马奶样品与我国和蒙古国样品一起分析,中亚和蒙古的样品中没有分离到L.plantarum,而L.casei只出现我国新疆和中亚的酸马奶样品中。这与SUN等[20]报道的酸马奶中乳酸菌分离鉴定结果有相似之处。凌空等[21]对新疆酸马奶样品分析认为L.helveticus是其优势菌种。
乳酸菌能否在乳基质中良好的生长,取决于其在乳中的产酸能力和凝乳特性。具有良好产酸能力和凝乳特性的乳酸菌比较适合于发酵乳的生产。本研究通过脱脂乳中的产酸发酵试验、脱脂乳中pH和滴定酸度测定以及体外人工胃肠液耐受性和生长温度测定试验筛选出3株乳酸菌,即L.plantarum Q18-3、L.paracasei Q18-5和L.helveticus Q27-6等,它们在pH 2.5人工胃液中的存活率分别为89.26%、86.94%和71.43%,在pH 8.0的人工肠液中活菌数达到108 CFU/mL以上,具有足够的耐酸、耐胆盐性,具备益生菌特性,但其益生特性还需要进一步的比较分析并评定适合应用于哪些发酵乳制品。目前,类似的益生菌筛选研究比较多[22],有些菌株被研究的比较深入和已经产业化应用[23]。酸马奶是一种特种发酵乳制品,虽然具有明显的区域性特点,但消费群体也比较多,为满足大众化消费需求,产业化生产和发酵品质日益提高,从酸马奶中分离并筛选具有一定益生特性和良好发酵性能的乳酸菌菌株作为发酵剂应用于酸马奶的集中工业化生产意义重大。
本研究从中亚的吉尔吉斯斯坦和乌兹别克斯坦、蒙古国,以及我国锡林郭勒盟的西乌旗和巴音郭勒牧场、新疆的尼勒克县和昭苏县等不同地点、不同时间采集的酸马奶样品中共分离获得264株乳酸菌,而且多数酸马奶源乳酸菌可以在牛乳基料中发酵,且有一定的益生性能,在15~30 ℃下生长良好,可应用于酸马奶等地方特色的发酵乳制品。
[1] AFZAAL M, SAEED F, ANJUM F, et al.Nutritional and ethnomedicinal scenario of koumiss:A concurrent review[J].Food Science &Nutrition, 2021, 9(11):6421-6428.
[2] LIU B H, XIAO X, ZHOU X R, et al.Effects of Lactobacillus plantarum CQPC01-fermented soybean milk on activated carbon-induced constipation through its antioxidant activity in mice[J].Food Science &Nutrition, 2019, 7(6):2068-2082.
[3] ISHII S.Microbiol study of traditional fermented dairy products Haruha and Buriat in Mongolia [J].Milk Science, 2001, 50(6):25-30.
[4] 孟和毕力格, 乌日娜, 王立平, 等.不同地区酸马奶中乳杆菌的分离及其生物学特性的研究[J].中国乳品工业, 2004, 32(11):6-11.
MENG H, WU R N, WANG L P, et al.Isolation and identification of Lactobacillus from koumiss collected in Inner Mongolia and People’s Republic of Mongolia[J].China Dairy Industry, 2004, 32(11):6-11.
[5] 莫蓝馨. 内蒙古锡林郭勒盟和蒙古国巴彦洪格尔省传统发酵乳制品中细菌多样性研究[D].呼和浩特:内蒙古农业大学, 2019.
MO L X.Investigation of bacterial diversity in traditional fermented dairy products from Xilingol of Inner Mongolia and Bayankhonger of Mongolia [D].Hohhot:Inner Mongolia Agricultural University, 2019.
[6] ZHOU H Y, WU L R, HU P, et al.Isolation and identification of lactic acid bacteria from koumiss in Xinjiang, China[J].IOP Conference Series:Earth and Environmental Science, 2020, 565(1):012054.
[7] RAKHMANOVA A, WANG T, XING G, et al.Isolation and identification of microorganisms in Kazakhstan koumiss and their application in preparing cow-milk koumiss[J].Journal of Dairy Science, 2021, 104(1):151-166.
[8] GUO L, YA M, GUO Y S, et al.Study of bacterial and fungal community structures in traditional koumiss from Inner Mongolia[J].Journal of Dairy Science, 2019, 102(3):1972-1984.
[9] ISPIRLI H, DERTLI E.Isolation and characterisation of lactic acid bacteria from traditional koumiss and kurut[J].International Journal of Food Properties, 2017, 20(3):S2441-S2449.
[10] YU J, WANG W H, MENGHE B L G, et al.Diversity of lactic acid bacteria associated with traditional fermented dairy products in Mongolia[J].Journal of Dairy Science, 2011, 94(7):3229-3241.
[11] HOLZAPFEL W H, HABERER P, GEISEN R, et al.Taxonomy and important features of probiotic microorganisms in food and nutrition[J].The American Journal of Clinical Nutrition, 2001, 73(2):365s-373s.
[12] 史迪, 党娜, 武岳, 等.阿尤恩地区自然发酵牛乳中乳酸菌分离鉴定及多样性研究[J].中国乳品工业, 2021, 49(3):4-9;41.
SHI D, DANG N, WU Y, et al.Isolation and identification and biodiversity analysis of lactic acid bacteria in naturally fermented cow milk from laayoune, Morocco[J].China Dairy Industry, 2021, 49(3):4-9;41.
[13] LIU W J, CHEN M X, DUO L N, et al.Characterization of potentially probiotic lactic acid bacteria and bifidobacteria isolated from human colostrum[J].Journal of Dairy Science, 2020, 103(5):4013-4025.
[14] BAO Y, ZHANG Y C, ZHANG Y, et al.Screening of potential probiotic properties of Lactobacillus fermentum isolated from traditional dairy products[J].Food Control, 2010, 21(5):695-701.
[15] DA SILVA FERNANDES M, SANCHES LIMA F, RODRIGUES D, et al.Evaluation of the isoflavone and total phenolic contents of kefir-fermented soymilk storage and after the in vitro digestive system simulation[J].Food Chemistry, 2017, 229:373-380.
[16] ALTSCHUL S F, MADDEN T L, SCH FFER A A, et al.Gapped BLAST and PSI-BLAST:A new generation of protein database search programs[J].Nucleic Acids Research, 1997, 25(17):3389-3402.
FFER A A, et al.Gapped BLAST and PSI-BLAST:A new generation of protein database search programs[J].Nucleic Acids Research, 1997, 25(17):3389-3402.
[17] 刘文俊, 多拉娜, 刘亚华, 等.基于纯培养方法和PacBio三代测序技术研究蒙古国传统酸马奶中乳酸菌多样性[J].中国食品学报, 2019, 19(4):27-37.
LIU W J, DUO L N, LIU Y H, et al.Lactic acid bacteria diversity in Mongolia traditional koumiss based on culture-dependent and PacBio sequencing technology[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(4):27-37.
[18] 布仁其其格, 高雅罕, 包艳青, 等.酸马奶发酵过程中理化指标与细菌相的动态变化[J].食品工业科技, 2016, 37(11):118-121.
BURENQIQIGE, GAO Y H, BAO Y Q, et al.Analysis of physicochemical parameters and bacteria community structure in the Koumiss’ s fermentation process[J].Science and Technology of Food Industry, 2016, 37(11):118-121.
[19] 斯木吉德, 敖日格乐, 王纯洁, 等.新鲜酸马奶中乳酸菌的分离鉴定与多样性分析[J].饲料研究, 2021, 44(15):79-82.
SI M J D, AO R G L, WANG C J, et al.Isolation, identification and diversity analysis of lactic acid bacteria in fresh koumiss[J].Feed Research, 2021, 44(15):79-82.
[20] SUN Z H, LIU W J, ZHANG J C, et al.Identification and characterization of the dominant lactobacilli isolated from koumiss in China[J].The Journal of General and Applied Microbiology, 2010, 56(3):257-265.
[21] 凌空, 翟磊, 姚粟, 等.新疆传统发酵食品中乳酸菌的分离鉴定及其生长代谢特性[J].食品与发酵工业, 2017, 43(3):123-129.
LING K, ZHAI L, YAO S, et al.Isolation, identification and characterization of lactic acid bacteria from traditionally fermented foods in Xinjiang[J].Food and Fermentation Industries, 2017, 43(3):123-129.
[22] 张和平, 孟和毕力格, 王俊国, 等.分离自内蒙古传统发酵酸马奶中L.casei Zhang潜在益生特性的研究[J].中国乳品工业, 2006, 34(4):4-10.
ZHANG H P, MENG H, WANG J G, et al.Assessment of potential probiotic properties of L.casei Zhang strain isolated from traditionally home- made Koumiss in Inner Mongolia of China[J].China Dairy Industry, 2006, 34(4):4-10.
[23] CHOI S H.Characterization of airag collected in Ulaanbaatar, Mongolia with emphasis on isolated lactic acid bacteria[J].Journal of Animal Science and Technology, 2016, 58:10.