辣椒(Capsicum spp.)是一种蔬菜,也是一种调味品,因营养价值丰富、口感独特受到消费者的喜爱和欢迎。我国是世界上辣椒栽培面积最大的国家,“十三五”以来,我国辣椒年播种面积占全国蔬菜总播种面积的8%~10%,产值约2 500亿元,播种面积和产值均居蔬菜首位[1]。但辣椒采后损失巨大,常见的病害有果腐病(Fusarium sp.引起)、软腐病(Erwinia引起)、炭疽病(Colletotrichum gloeosporioides引起)、黑斑病(Alternaria alternata引起)、疫病(Phytophthor acapsici引起)和灰霉病(Botrytis cinerea引起)。其中,软腐病是辣椒采后最具毁灭性的细菌性病害[2]。果胶杆菌(Pectobacterium)是引发辣椒软腐病的主要病原菌,它通过产生多种细胞壁降解酶导致蔬菜腐烂[3]。病原菌通过伤口或自然孔道侵染植物组织,采收和物流运输中产生的机械损伤能够促进病原菌的侵染,从而加重软腐病造成的经济损失。控制辣椒采后软腐病的发生是辣椒产业急需解决的问题。
目前,由微生物侵染引起的辣椒病害主要通过化学杀菌剂进行防治。然而,化学杀菌剂控制软腐病具有持久性差、环境污染、细菌菌群可产生耐药性等问题[4],使得人们不断地探索新型杀菌剂。拮抗微生物及其代谢产物被认为有望代替传统化学杀菌剂[5]。乳酸菌可以通过产生大量的有机酸、细菌素等抑菌物质来抑制食物腐败微生物和致病微生物[6-7],且具有“一般被认为是安全的(generally recognized as safe,GRAS)”安全等级[8]。此外,它们具有“合格的安全推定(qualified presumption of safety,QPS)”,能够有选择地对食品细菌性病原菌进行纳米级的抗菌防御,从而保障消费者的安全[9]。因此,乳酸菌在食品贮藏保鲜中具有巨大的应用潜力。乳酸菌及其代谢产物在果蔬贮藏领域已经有了初步的应用研究。VOIDAROU等[10]利用乳酸菌及其代谢产物对梨、苹果、桃、西红柿、黄瓜、红辣椒、白菜和胡萝卜的致病微生物进行了有效的控制。YI等[11]利用戊糖乳杆菌MS031对鲜切果蔬中食源性致病菌进行了控制,对大肠杆菌、沙门氏菌和单核增生李斯特菌显示出较好的抑菌活性。蔡文韬等[12]利用解淀粉芽孢杆菌发酵液对辣椒进行保鲜,可以延缓果实内还原糖、可溶性固形物、蛋白和维生素C含量的降低,保持了辣椒较稳定的色泽和质地。目前,乳酸菌对辣椒软腐病控制还鲜有报道。实验室前期从辣椒果实上分离得到了一株胡萝卜软腐病果胶杆菌胡萝卜亚种(Pectobacterium carotovorum subsp.carotovorum, Pcc)CBJ3菌株,本文旨在探究该软腐病病原菌在不同贮藏温度下对辣椒的致病性,进一步利用拮抗菌L.plantarum LAB2控制辣椒软腐病,并探究其对辣椒贮藏品质的影响,本研究可为减少辣椒软腐病害以延长贮藏期提供新的技术方法。
1 材料与方法
1.1 主要材料与试剂
辣椒采自重庆市北碚区(本文辣椒均指辣椒果实);果胶杆菌Pcc CBJ3、L.plantarum LAB2保藏于西南大学食品科学学院食品贮藏与物流实验室。
胰蛋白胨、酵母提取物、琼脂粉,北京奥博星生物技术有限公司;(NH4)2SO4、NaClO,成都科隆化学品有限公司;丙酮、三氯乙酸、甲醇、NaCl,重庆跃翔化工有限公司;MRS培养基,金克隆生物试剂有限公司;细菌基因组DNA提取试剂盒、质粒抽提试剂盒,上海生工生物工程有限公司。
1.2 主要仪器
灭菌锅,厦门致微仪器有限公司;生化培养箱,上海跃进医疗器械有限公司;摇床,上海旻泉仪器有限公司;Avanti J-30I高速冷冻离心机,美国Beckman公司;SIGMA 1-15PK小型台式离心机,德国SIGMA公司;超净台,苏州安泰空气技术有限公司;PCR仪、电转仪,上海伯乐生命医学产品有限公司;扫描电镜,上海复纳科学仪器有限公司;硬度计GS-15,北京阳光亿事达科技有限公司;UV 1000紫外可见分光光度计,上海天美公司;WYT0-80%数显手持式折光仪,成都兴晨光光学仪器有限公司。
1.3 不同贮藏温度下果胶杆菌对辣椒的致病性
1.3.1 25 ℃贮藏下的致病性
用2%(体积分数)NaClO对新鲜完好的辣椒进行浸泡2 min消毒,清水洗净,自然晾干,无菌打孔器打2个孔,待用。果胶杆菌Pcc CBJ3在LB肉汤中培养至对数期,离心收集菌体,并重新悬浮于无菌生理盐水至OD600nm=0.5(1×108 CFU/mL),随后将其10倍逐级稀释至浓度为10 CFU/mL。取30 μL各稀释度菌悬液分别接种于辣椒孔中,晾干后放置于25 ℃贮藏,每天记录发病率和病斑直径[13]。以无菌水代替菌悬液作为对照。每个浓度3个重复,每个重复10个辣椒。
1.3.2 4 ℃贮藏下的致病性
消费者在购买辣椒后,通常贮存在常温或家用冷藏冰箱中,因此本文还探究了在4 ℃下贮藏时,不同浓度果胶杆菌Pcc CBJ3对辣椒的致病力。处理过程同1.3.1节,除了辣椒贮藏在4 ℃冷库中。每天记录发病率和病斑直径。
1.4 拮抗菌对软腐病菌的体外控病活性
1.4.1 拮抗菌的筛选
将实验室从辣椒上分离得到的108株细菌作为筛选对象,以果胶杆菌Pcc CBJ3为指示菌,采用双层划线法[14]筛选具有抑菌活性的拮抗菌。
1.4.2 拮抗菌不同组分的控病活性
将筛选得到的拮抗菌在MRS液体培养基中37 ℃摇瓶培养24 h,离心获得的菌体沉淀用无菌生理盐水重悬至OD600nm=0.1。拮抗菌摇瓶培养48 h,离心,上清液用0.22 μm滤膜过滤,得到无细胞发酵液(cell-free supernatant,CFS)。采用(NH4)2SO4沉淀法[15],在100 mL CFS中加入80%(质量分数)饱和(NH4)2SO4溶液,4 ℃放置24 h,离心,沉淀溶解于1 mL磷酸缓冲液(pH 6.0)即得细菌素粗样。参考XU等[16]的方法,以果胶杆菌Pcc CBJ3为指示菌,利用琼脂孔扩散法进行体外抑菌实验,并记录抑菌圈直径。每个处理3个重复。
1.5 拮抗菌基因组草图测序
将拮抗菌培养至对数期,基因组DNA提取、DNA文库构建及Illumina HiSeq 4000平台测序由北京诺禾致源科技股份有限公司完成。将拮抗菌草基因组序列应用到细菌素数据库BAGEL4(http://bagel4.molgenrug.nl/index.php)进行细菌素的鉴定。
1.6 拮抗菌对辣椒软腐病的体内控病活性
拮抗菌不同组分的制备过程同1.4.2节。果胶杆菌Pcc CBJ3重悬于无菌生理盐水至浓度约为103 CFU/mL,随后按照1.3.1节处理辣椒。辣椒每孔中分别加入30 μL拮抗菌菌悬液、CFS、粗细菌素,并以无菌生理盐水作为对照。晾干后贮藏于25 ℃,每天记录发病率和病斑直径。每个处理3个重复,每个重复10个辣椒。
1.7 扫描电镜观察
按照1.6节步骤在辣椒孔中接种病原菌Pcc CBJ3和进行CFS处理。取辣椒伤口附近的植物组织,取样面积约为5 mm×5 mm。随后,将样品在4 ℃下2.5%(体积分数)戊二醛溶液中进行过夜浸泡固定,次日分别用20%、30%、40%、50%、70%、90%(体积分数)的乙醇进行脱水,再用100%的乙醇脱水2遍,每次脱水时间为30 min。样品干燥后,用扫描电镜以5 000×的放大倍数进行观察。
1.8 CFS对辣椒中绿色荧光标记Pcc CBJ3生长的影响
为了追踪病原菌在辣椒上的生长情况,果胶杆菌Pcc CBJ3使用绿色荧光蛋白进行标记。Pcc CBJ3于新鲜的LB液体培养基中,37 ℃培养至OD600 nm=0.3~0.5。随后,利用预冷的CaCl2溶液制备Pcc CBJ3感受态细胞。接着,参考董爱菊等[17]的方法,将实验室前期研究已构建的绿色荧光蛋白重组质粒pCR2.1-TOPO- GFP电转化至Pcc CBJ3感受态细胞。在含有卡那霉素的LB平板培养后,挑取带有绿色荧光的菌落并进行甘油保藏。
按照1.6节步骤在辣椒孔中接种绿色荧光标记Pcc CBJ3和进行CFS处理。每天取果实伤口处植物组织样品进行微生物计数。无菌生理盐水代替CFS作为对照。每个处理5个重复。
1.9 CFS对辣椒贮藏品质的影响
按照1.6节步骤在辣椒孔中接种病原菌Pcc CBJ3和进行CFS处理。无菌生理盐水代替CFS作为对照。每个处理3个重复,每个重复30个辣椒。伤口附近1 cm内进行辣椒组织取样,用液氮迅速冷冻后,样品存于-80 ℃冰箱,待用。
1.9.1 硬度
使用硬度计测定辣椒伤口附近组织的硬度。
1.9.2 可溶性固形物(soluble solids content,SSC)
不同处理取等质量的样品,研磨后过滤,用手持式糖度计测定滤液中的SSC质量分数。
1.9.3 失重率
每天对辣椒称重。失重率=(起始辣椒重量-当天辣椒重量)/起始辣椒重量。
1.9.4 丙二醛(malondialdehyde,MDA)含量
参考SHU等[18]的方法测定MDA含量并进行一定的修改。取0.5 g辣椒样品,加入5 mL 5%(体积分数)三氯乙酸,研磨后所得匀浆转移至离心管中,接着用5 mL三氯乙酸洗研钵,并将洗液收集于同一离心管中。离心,取上清液2 mL,加硫代巴比妥酸(thiobarbituric acid,TBA)2 mL,混合后在100 ℃水浴中煮沸30 min,分别测450、532、600 nm吸光度值,并按以下公式计算MDA浓度。MDA的含量以每克果蔬组织鲜重中所含MDA的物质的量(μmol/g FW)表示。
c/(μmol/L)=6.45×(A532-A600)-0.56×A450
(1)
式中:A532、A600、A450,分别为上述反应液在532、600、450 nm处的吸光值;c,MDA的浓度,μmol/L。
1.10 数据处理
所有实验进行3次重复,数据结果的表示均为平均值±标准差。使用GraphPad Prism 8.3.0制图,采用SPSS 22.0软件进行数据分析。使用单因素AVOVA检验和独立样本T检验进行显著性分析。
2 结果与分析
2.1 不同贮藏温度下果胶杆菌对辣椒的致病性
2.1.1 25 ℃贮藏下的致病性
如图1-a所示,在25 ℃下,接种不同浓度病原菌后的辣椒随贮藏时间延长,腐烂程度加重,且不同浓度下腐烂率有明显差异。如图1-b所示,接种浓度≥3 lg CFU/mL果胶杆菌Pcc CBJ3时,贮藏至第3天,辣椒软腐病发病率均达到100%。此时辣椒完全腐烂,呈水滞状,散发出恶臭(图1-a,第3天)。当病原菌接种浓度为2 lg CFU/mL时,贮藏第3天,辣椒腐烂率仍达到(85±13.22)%。当病原菌接种浓度为1 lg CFU/mL时,在第3天保持较低的发病率(8.3%)。AKBAR等[19]将浓度为8 lg CFU/mL软腐病菌Pcc接种至不同的植物宿主中,在室温下放置1~2 d,Pcc对辣椒的致病力最强,其次是番茄,马铃薯;它们的软腐病病斑直径分别为22.3、7.9、7.8 mm。在本研究中,果胶杆菌Pcc CBJ3浓度低至3 lg CFU/mL时仍能够导致辣椒腐烂率达到100%,这也证明了Pcc对辣椒具有较强的致病力。

a-病害症状;b-发病率;c-病斑直径
图1 25 ℃下不同浓度Pcc CBJ3对辣椒软腐病的影响
Fig.1 Effects of different concentrations of Pcc CBJ3 on the pepper soft rot at 25 ℃
2.1.2 4 ℃贮藏下的致病性
如图2-a所示,不同浓度果胶杆菌Pcc CBJ3对辣椒的致病力有显著差异。当病原菌接种浓度为8 lg CFU/mL时,辣椒在贮藏第21天时腐烂率达到100%(图2-b)。由图2-b和图2-c可知,当病原菌接种量为7 lg CFU/mL时,辣椒在贮藏第23天时的发病率为(58.33±17.56)%,病斑直径为(44.17±3.82) mm;当病原菌接种量为6 lg CFU/mL时,辣椒在贮藏第23天时的发病率仅为(8.33±16.63)%,病斑直径为(12.67±2.26) mm。这说明在4 ℃贮藏时,高浓度的Pcc CBJ3对辣椒的致病力较强。与常温相比,在低温下Pcc CBJ3的致病能力受到显著抑制。

a-病害症状;b-发病率;c-病斑直径
图2 4 ℃下不同浓度Pcc CBJ3对辣椒软腐病的影响
Fig.2 Effect of different concentrations of Pcc CBJ3 on the pepper soft rot at 4 ℃
2.2 拮抗菌对辣椒软腐病病原菌的体外抑菌活性
从108株细菌中筛选得到了1株细菌LAB2对果胶杆菌Pcc CBJ3有抑菌效果(图3-a),其抑菌圈直径为(45.7±0.58) mm。菌株LAB2经16S rDNA测序鉴定为植物乳杆菌(Lactobacillus plantarum)。为了进一步探究该乳酸菌发挥抑菌效果的有效成分,进行了发酵液不同组分的体外活性实验。结果显示CFS(图3-c)和粗细菌素(图3-d)均对果胶杆菌Pcc CBJ3具有抑菌活性,而菌体(图3-b)无抑菌活性。和粗细菌素相比,CFS显示出更好的抑菌效果,我们推测在CFS中还含有细菌素以外的其他抑菌物质在起作用。L.plantarum被报道可产生多种具有抑菌活性的代谢产物,如有机酸、H2O2、CO2、双乙酰、细菌素等[20]。

a-双层划线法筛选拮抗菌;b-菌体;c-CFS;d-细菌素
图3 L.plantarum LAB2及发酵液不同组分对Pcc CBJ3的抑菌活性
Fig.3 Antibacterial activity of L.plantarum LAB2 and different components of its fermentation against Pcc CBJ3
2.3 L.plantarum LAB2所产细菌素的鉴定
图3表明,L.plantarum LAB2所产细菌素对果胶杆菌Pcc CBJ3具有抑菌活性。细菌素被分泌到细胞外,因此也是L.plantarum LAB2 CFS发挥控病活性的重要成分之一。细菌素为核糖体编码抗菌肽,其编码基因存在于基因组中,故本研究通过基因组测序对其进行鉴定。通过BAGEL4细菌素数据库搜索,鉴定到了1个细菌素基因簇,由32个阅读框组成(图4)。该基因簇中包含4个细菌素结构基因(orf10、orf11、orf18、orf20)。该4个细菌素基因所编码的氨基酸序列与已知细菌素plantaricin_E、plantaricin_F、plantaricin_N和plantaricin_J的相似度分别为100%、100%、100%和94.23%(表1)。其中plantaricin_E和plantaricin_F是一对class Ⅱb类2个多肽细菌素[21]。由此可见,L.plantarum LAB2编码的细菌素中含有一对class Ⅱb细菌素。
表1 L.plantarum LAB2所产细菌素的氨基酸序列
Table 1 Amino acid sequences of bacteriocins from L.plantarum LAB2

细菌素编码基因氨基酸序列相似细菌素相似度/%orf10MLQFEKLQYSRLPQKKLAKISGGFNRGGY-NFGKSVRHVVDAIGSVAGIRGILKSIRPlantaricin_E100orf11MKKFLVLRDRELNAISGGVFHAYSARG-VRNNYKSAVGPADWVISAVRGFIHGPlantaricin_F100orf18MKSLDKIAGLGIEMAEKDLTTVEG-GKNYSKTWWYKSLTLLGKVAEGTSSAWHGLGPlantaricin_N100orf20MTVNKMIKDLDVVDAFAPISNNKLNGV-VGGGAWKNFWSSLRKGFYDGEAGRAIRRPlantaricin_J94.23

图4 L.plantarum LAB2细菌素基因簇
Fig.4 Bacteriocin gene cluster of L.plantarum LAB2
2.4 L.plantarum LAB2不同组分对辣椒软腐病的体内控制效果
由2.2节结果可知,L.plantarum LAB2不同组分对辣椒软腐病病原菌的体外控制能力不同。同时分析了L.plantarum LAB2不同组分对辣椒软腐病的体内控制效果,结果如图5-a所示。在贮藏第3天,对照组几乎完全腐烂,呈水滞状,并且散发出臭味。和对照组相比,菌体、CFS和粗细菌素处理组的病害腐烂情况均得到了一定程度的减轻,其中CFS对辣椒软腐病的控制效果最明显。如图5-b和图5-c所示,在贮藏第1天,对照组的发病率和病斑直径分别为(75±5)%和(4.53±0.50) mm,而CFS处理组未出现腐烂。在贮藏第2天,对照组的发病率和病斑直径分别为(95±5)%和(19.20±0.46) mm,而CFS处理组的发病率和病斑直径分别为(1.67±2.89)%和(0.27±0.46) mm。在贮藏第3天,对照组的发病率已达到100%,而CFS处理组的发病率只有(8.3±5.8)%。由此可见,CFS处理能够显著降低辣椒软腐病的发生。

a-控病效果;b-发病率;c-病斑直径
图5 L.plantarum LAB2发酵液不同组分对辣椒软腐病的体内控制效果
Fig.5 In vivo control effect of different components of L.plantarum LAB2 fermentation on pepper soft rot
注:*P<0.05、**P<0.01和***P<0.001表示对照组与CFS处理组相比,存在显著差异,下同;不同小写字母表示组间存在显著差异,P<0.05。
2.5 微观结构观察
上述体内体外控病实验结果均表明CFS控制辣椒软腐病的能力最强,因此使用扫描电镜进一步观察了CFS处理后的辣椒表皮结构。结果如图6所示,接种果胶杆菌Pcc CBJ3后的对照2因软腐病害的发生,辣椒表皮呈现明显褶皱,且表面附着大量清晰可见的果胶杆菌Pcc CBJ3菌体。然而,CFS处理组辣椒表皮平整无皱褶,与未感染病原菌的对照1的辣椒表皮结构类似。由此可见,CFS处理可以明显保持辣椒表皮结构的完好性。

a-未接种病原菌(对照1);b-只接种病原菌(对照2);c-接种病原菌和CFS处理组
图6 CFS处理对辣椒表皮结构的影响
Fig.6 Effect of CFS treatment on epidermal structure of pepper
2.6 CFS对辣椒果胶杆菌生长的影响
从含有卡那霉素的LB平板上挑选到构建成功的绿色荧光蛋白标记的Pcc CBJ3菌株(Pcc CBJ3-GFP)。使用该荧光标记菌株进行辣椒上病原菌数量分析时,可有效排除辣椒中其他微生物的干扰。如图7所示,对照组辣椒上Pcc CBJ3-GFP的数量在第1天显著上升,随后逐渐平稳上升,这表明当辣椒受到病原菌侵染后,病原菌可以在果实伤口快速定植生长。然而,用CFS处理后,辣椒上的病原菌数量始终显著低于对照组(P<0.05)。在第0天(处理后2 h),Pcc CBJ3-GFP的数量由4.58 lg CFU/mL降低至3.11 lg CFU/mL,这表明CFS处理能够立即降低辣椒上的病原菌。在贮藏第4天,对照组Pcc CBJ3-GFP的数量为9.02 lg CFU/mL,而CFS处理组仅有4.30 lg CFU/mL,即病原菌数量减少了99.99%。以上结果表明CFS处理可显著抑制辣椒中果胶杆菌的生长,从而减缓由软腐病引起的辣椒腐烂损失。
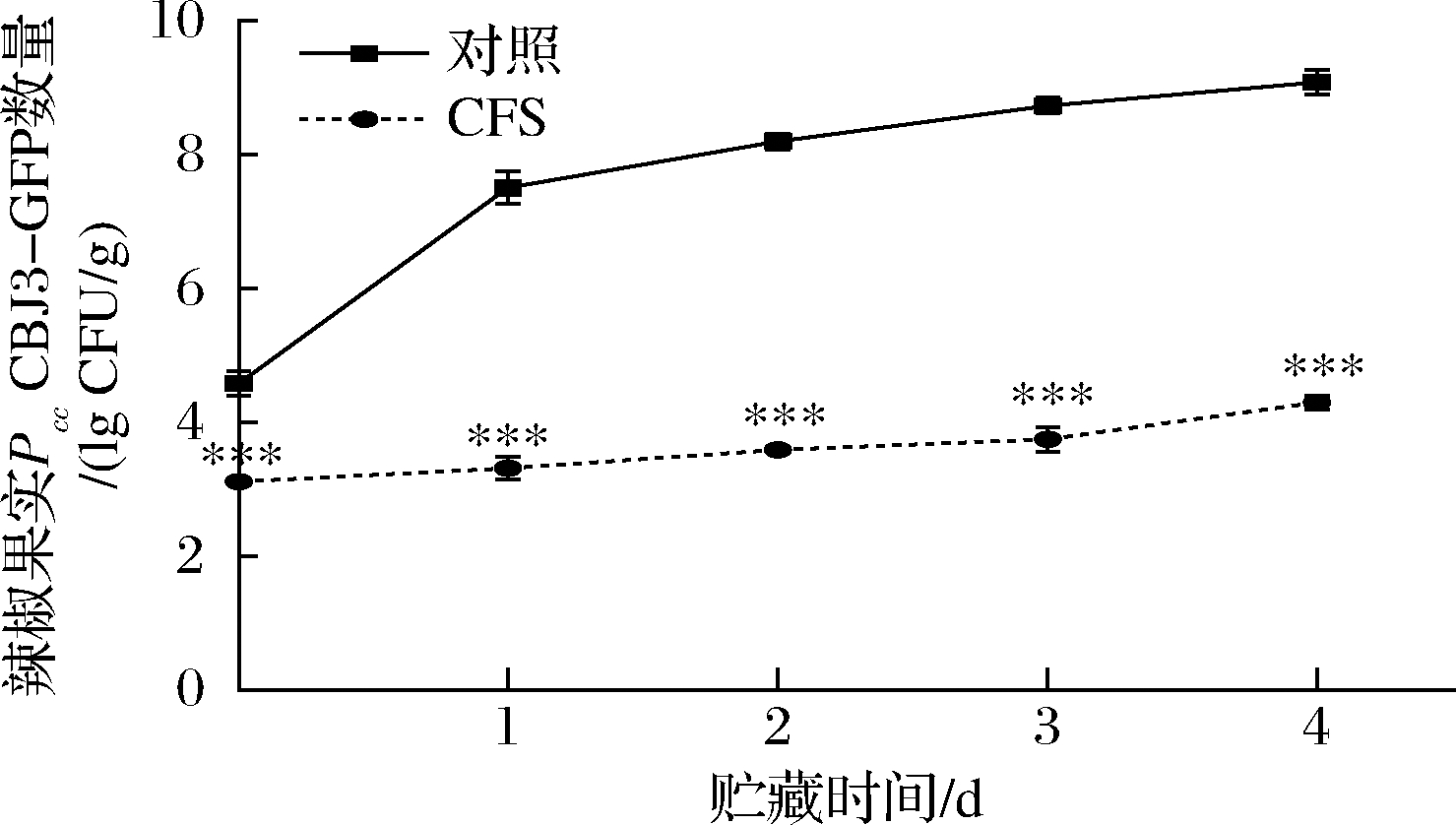
图7 CFS处理对辣椒中Pcc CBJ3 - GFP数量的影响
Fig.7 The effect of CFS treatment on the number of Pcc CBJ3 - GFP in pepper
2.7 CFS处理对辣椒贮藏品质的影响
2.7.1 硬度
如图8-a所示,随着贮藏时间的延长,对照组辣椒的硬度逐渐降低,即果实逐渐软化。CFS处理组辣椒的硬度随贮藏时间延长也在降低,但是和对照组相比,硬度下降的速度受到抑制。其中,在贮藏第2~4天,CFS处理组辣椒的硬度显著大于对照组辣椒的硬度(P<0.05)。该实验结果表明,CFS处理能够延缓辣椒的软化。

a-硬度;b-可溶性固形物含量;c-失重率;d-MDA含量
图8 CFS处理对辣椒贮藏品质的影响
Fig.8 Effect of CFS treatment on storage quality of pepper
2.7.2 可溶性固形物
如图8-b所示,对照组辣椒在贮藏期的可溶性固形物含量先上升,到第2天以后逐渐下降。由图1可知,在贮藏第2天,辣椒的腐烂率约为95%,腐烂面积约占整果面积的50%。推测可溶性固形物含量前2 d升高的原因是辣椒从完好到50%面积腐烂过程中,在病原菌产生的多种细胞壁降解酶的作用下,辣椒细胞内的可溶性固形物流出,可溶性固形物含量升高;而在贮藏2 d以后,辣椒逐渐完全腐烂,细胞内流出的营养物质被大量繁殖的病原菌吸收利用,可溶性固形物的含量出现下降。CFS处理组辣椒可溶性固形物变化趋势与对照组相似,但是可溶性固形物含量出现降低所需的时间比对照组更长。在贮藏第4天,CFS处理组辣椒的可溶性固形物含量高于对照组。由此可见,在贮藏后期,CFS处理能够抑制辣椒可溶性固形物的减少。
2.7.3 失重率
如图8-c所示,随着贮藏时间的延长,对照组和CFS处理组的辣椒重量均减轻,但是CFS处理组辣椒的失重率始终低于对照组。从贮藏第3天开始,CFS处理组辣椒的失重率显著低于对照组。在贮藏第4天,对照组辣椒的失重率为(45.13±6.26)%,而CFS处理组辣椒的失重率为(13.10±1.25)%。该结果表明CFS处理可以延缓辣椒的失水。
2.7.4 MDA含量
MDA含量是植物细胞膜质过氧化程度的体现,可以反应出辣椒在逆境环境下的衰老情况。由图8-d可知,随着贮藏时间的延长,对照组和CFS处理组辣椒的MDA含量均呈上升的趋势。在贮藏第3天和第4天,CFS处理组辣椒的MDA含量均显著低于对照组(P<0.05),这表明用CFS处理可以减缓辣椒细胞膜质过氧化的程度,维持辣椒的品质。
3 结论
本研究探究了辣椒在不同贮藏温度(25 ℃和4 ℃)下,软腐病病原菌对辣椒的致病力。结果表明,在25 ℃下贮藏时,Pcc CBJ3对辣椒的致腐能力远远强于4 ℃下贮藏时。L.plantarum LAB2不同组分的体内体外控病活性结果均表明CFS具有最强的控病能力,其次是细菌素,而菌体本身并无控病活性。细菌素是CFS有效成分之一,从L.plantarum LAB2基因组序列中鉴定到了4个细菌素。其中,plantaricin _E和plantaricin_F是一对class Ⅱb类2个多肽细菌素,且含有1个与plantaricin_J相似度为94.23%的较新细菌素。扫描电子显微镜和荧光标记Pcc CBJ3计数结果也证明了CFS处理能够降低辣椒病原菌的数量,维持辣椒表皮结构的完好性。辣椒贮藏品质结果表明用CFS处理可以显著延缓辣椒软化、失水,减少可溶性固形物的流失,并降低辣椒MDA的积累,从而延长其贮藏期。综上,L.plantarum LAB2可用作生物防治拮抗菌,能够有效控制辣椒软腐病,维持果实品质,在辣椒贮藏及病害防控中具有较大的应用潜力。
[1] 王立浩, 张宝玺, 张正海, 等.“十三五”我国辣椒育种研究进展、产业现状及展望[J].中国蔬菜, 2021(2):21-29.
WANG L H, ZHANG B X, ZHANG Z H, et al.Status in breeding and production of Capsicum spp.in China during‘the thirteenth five-year plan’Period and future prospect[J].China Vegetables, 2021(2):21-29.
[2] 肖晶, 陈维信, 刘爱媛, 等.辣椒采后病害发生情况[J].中国蔬菜, 2008(6):13-16.
XIAO J, CHEN W X, LIU A Y, et al.Situation of post-harvest diseases of pepper[J].China Vegetables, 2008(6):13-16.
[3] DAVIDSSON P R, KARIOLA T, NIEMI O T, et al.Pathogenicity of and plant immunity to soft rot pectobacteria[J].Frontiers in Plant Science, 2013, 4:191.
[4] EL KHAIR HASSAN A, ABDEL GAIED TAREK G, MIKHAIL MAURICE S, et al.Biological control of Pectobacterium carotovorum subsp.carotovorum, the causal agent of bacterial soft rot in vegetables, in vitro and in vivo tests[J].Bulletin of the National Research Centre, 2021, 45(1):37.
[5] CHANDRAKASAN G, RODR GUEZ-HERN
GUEZ-HERN NDEZ A I, DEL ROC
NDEZ A I, DEL ROC O L
O L PEZ-CUELLAR M, et al.Bacteriocin encapsulation for food and pharmaceutical applications:Advances in the past 20 years[J].Biotechnology Letters, 2019, 41(4):453-469.
PEZ-CUELLAR M, et al.Bacteriocin encapsulation for food and pharmaceutical applications:Advances in the past 20 years[J].Biotechnology Letters, 2019, 41(4):453-469.
[6] MOKOENA M P, OMATOLA C A, OLANIRAN A O.Applications of lactic acid bacteria and their bacteriocins against food spoilage microorganisms and foodborne pathogens[J].Molecules, 2021, 26(22):7055.
[7] 张金磊, 陈兴煌.乳酸菌发酵液在食品贮藏保鲜中的应用研究进展[J].中国调味品, 2020, 45(10):158-162.
ZHANG J L, CHEN X H.Application and research progress of lactic acid bacteria fermentation broth in food storage and preservation[J].China Condiment, 2020, 45(10):158-162.
[8] ULLAH N, WANG X J, WU J, et al.Purification and primary characterization of a novel bacteriocin, LiN333, from Lactobacillus casei, an isolate from a Chinese fermented food[J].LWT, 2017, 84:867-875.
[9] GHANBARI M, JAMI M, DOMIG K J, et al.Seafood biopreservation by lactic acid bacteria:A review[J].LWT-Food Science and Technology, 2013, 54(2):315-324.
[10] VOIDAROU C, ALEXOPOULOS A, TSINAS A, et al.Effectiveness of bacteriocin-producing lactic acid bacteria and Bifidobacterium isolated from honeycombs against spoilage microorganisms and pathogens isolated from fruits and vegetables[J].Applied Sciences, 2020, 10(20):7309.
[11] YI L H, QI T, MA J H, et al.Genome and metabolites analysis reveal insights into control of foodborne pathogens in fresh-cut fruits by Lactobacillus pentosus MS031 isolated from Chinese Sichuan Paocai[J].Postharvest Biology and Technology, 2020, 164:111150.
[12] 蔡文韬, 夏菠, 夏延斌, 等.解淀粉芽孢杆菌发酵液处理提高辣椒采后品质[J].农业工程学报, 2013, 29(23):253-261.
CAI W T, XIA B, XIA Y B, et al.Effect of Bacillus amyloliquefaciens fermentation liquid on different types of peppers for biological control of postharvest A.alternate[J].Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(23):253-261.
[13] NANTAWANIT N, CHANCHAICHAOVIVAT A, PANIJPAN B, et al.Induction of defense response against Colletotrichum capsici in chili fruit by the yeast Pichia guilliermondii strain R13[J].Biological Control, 2010, 52(2):145-152.
[14] YI L H, DANG J, ZHANG L H, et al.Purification, characterization and bactericidal mechanism of a broad spectrum bacteriocin with antimicrobial activity against multidrug-resistant strains produced by Lactobacillus coryniformis XN8[J].Food Control, 2016, 67:53-62.
[15] LAHIRI D, CHAKRABORTI S, JASU A, et al.Production and purification of bacteriocin from Leuconostoc lactis SM 2 strain[J].Biocatalysis and Agricultural Biotechnology, 2020, 30:101845.
[16] XU C, FU Y Y, LIU F, et al.Purification and antimicrobial mechanism of a novel bacteriocin produced by Lactobacillus rhamnosus 1.0320[J].LWT, 2021, 137:110338.
[17] 董爱菊, 邱慧珍, 董莉, 等.类芽孢杆菌QHZ11-gfp在马铃薯植株上的定殖特征及促生效果[J].微生物学通报, 2021, 48(11):4075-4086.
DONG A J, QIU H Z, DONG L, et al.The colonization characteristics of Paenibacillus jamilae QHZ11-gfp in potato plants and its growth-promoting effect[J].Microbiology China, 2021, 48(11):4075-4086.
[18] SHU P, MIN D D, AI W, et al.L-Arginine treatment attenuates postharvest decay and maintains quality of strawberry fruit by promoting nitric oxide synthase pathway[J].Postharvest Biology and Technology, 2020, 168:111253.
[19] AKBAR A, AHMAD M, AZRA, et al.Characterization of the causal organism of soft rot of tomatoes and other vegetables and evaluation of its most aggressive isolates[J].American Journal of Plant Sciences, 2015, 6(4):511-517.
[20] DJUKIC-VUKOVI A, MLADENOVIC D, LAKICEVIC B, et al.Lactic acid bacteria:From food preservation to active packaging[J].IOP Conference Series:Earth and Environmental Science, 2021, 854(1):012025.
A, MLADENOVIC D, LAKICEVIC B, et al.Lactic acid bacteria:From food preservation to active packaging[J].IOP Conference Series:Earth and Environmental Science, 2021, 854(1):012025.
[21] HANNY E L L, MUSTOPA A Z, BUDIARTI S, et al.Efficacy, toxicity study and antioxidant properties of plantaricin E and F recombinants against enteropathogenic Escherichia coli K1.1 (EPEC K1.1)[J].Molecular Biology Reports, 2019, 46(6):6501-6512.