腐乳是极具中国特色的大豆发酵食品之一,至今已有1 500年的悠久历史[1]。腐乳滋味鲜美、风味独特,广受消费者喜爱。腐乳按照色泽风味可分为白腐乳、红腐乳、青(臭)腐乳3大类[2]。腐乳的生产环节分为前发酵和后发酵2个阶段。前发酵是通过自然接种或人工接种,培养富含蛋白酶的微生物;后发酵则是腐乳装瓶后酶与微生物协同作用[3],后发酵阶段既是风味物质[4-5]产生的主要阶段,也是有害物质生成的主要阶段[6-7]。
生物胺(biogenic amines,BAs)是一类广泛存在于食品中的低分子质量含氮有机化合物的总称,常见的有组胺、酪胺、腐胺、尸胺、苯乙胺、色胺、精胺以及亚精胺。虽然人体摄入微量的生物胺能促进生长、增强代谢活力、增强免疫力和清除自由基等效用,但过量摄入生物胺则会引起头疼、腹部痉挛、呕吐等不良生理反应[8]。腐乳因富含蛋白质、氨基酸,容易累积生物胺。LI等[9]检测了64种来自15个不同产地腐乳样品中的生物胺,所有样品均检测出腐胺、酪胺、苯乙胺、色胺以及尸胺等常见生物胺,其中白腐乳总生物胺含量高达533.54 mg/kg。根据SANTOS等[10-11]对生物胺的推荐毒性限量(苯乙胺30 mg/kg、组胺100 mg/kg、酪胺100~800 mg/kg),目前从商品腐乳中检测出的苯乙胺(736.64 mg/kg)[12]、组胺(1 186.93 mg/kg)[13]、酪胺(1 730 mg/kg)[14]含量均严重超过推荐毒性限量。本课题组前期对不同商品腐乳的研究也发现不同地区腐乳总生物胺含量差异很大(53.59~5 837.10 mg/kg)[15],8个样品中有5个都超过生物胺推荐最高污染水平1 000 mg/kg[10]。这些结果表明,腐乳中生物胺含量过高已影响腐乳成品质量及食品安全性问题[16]。
生物胺的产生离不开微生物对氨基酸的脱羧反应,以及适合这些微生物合成氨基酸脱羧酶并发挥其作用的理化条件。前期对腐乳产生物胺菌的研究主要集中在微生物群落水平,例如LIANG等[17]研究发现红方腐乳发酵菌群结构的变化会影响生物胺的生成,枯草芽孢杆菌和热带芽孢杆菌会在腐乳后发酵7~28 d时增加组胺、酪胺、腐胺和尸胺的生成量。本课题组基于宏基因组鸟枪测序对我国市场上不同类型商品腐乳中产生物胺的微生物群落及重建物种进行了研究,发现重建物种含有不同种类的脱羧酶基因和丰度[15]。
最近,陆续有从商品腐乳中分离鉴定出产胺菌的报道。梁静静等[18]从24种市售腐乳样品中分离出20株产胺菌,经过16S rDNA鉴定后均为芽孢杆菌属。王维亚等[19]从12种不同品牌的江西腐乳中获取到6株产胺菌(耐热芽孢杆菌、鲁梅利杆菌、耐硼赖氨酸芽孢杆菌和皮脂葡萄球菌),经检测发现这些菌产腐胺和酪胺的量最大。但至今未见从腐乳后发酵环节中分离出产胺菌的报道。
基于此,本研究以广东典型白方腐乳后发酵过程样品为研究对象,对产胺菌进行分离、纯化和鉴定,并对典型菌株的产胺特性进行研究。目的是了解腐乳生产过程中的产胺菌种类和不同条件对产胺菌产胺特性的影响,为控制生物胺的产生提供基础。
1 材料与方法
1.1 试剂与仪器
1.1.1 样品
白方腐乳后发酵样品,广东省江门市恩平县的一家传统腐乳生产厂。
1.1.2 试剂
LB肉汤培养基:蛋白胨1%,酵母浸出粉0.5%,胰蛋白胨1%(均为质量分数)。
产生物胺筛选培养基(g/L):牛肉浸出粉5.0,酵母浸出粉5.0,胰蛋白胨5.0,葡萄糖0.5;吐温-80 1 mL;NaCl 2.5,FeSO4 0.04,MnSO4 0.05,MgSO4 0.2,K2HPO4 2,CaCO3 0.1,柠檬酸铵2,维生素B1 0.01,5-磷酸吡哆醛0.05,溴甲酚紫0.06,琼脂18。色氨酸、苯丙氨酸、酪氨酸、精氨酸、组氨酸、赖氨酸各5,调节pH至5.3;121 ℃灭菌15 min[20]。
标准品:组氨酸、赖氨酸、酪氨酸、色氨酸、苯丙氨酸、精氨酸、磷酸吡哆醛(均为分析纯),美国Sigma公司;组胺、酪胺、腐胺、尸胺、色胺、苯乙胺、精胺、亚精胺(纯度≥98%),上海阿拉丁试剂有限公司;丹磺酰氯(纯度≥98%),分析纯,上海安谱实验科技股份有限公司。
DNA提取试剂盒,湖南艾科瑞生物工程有限公司;引物:27F/1492R,TD2/TD5,上海生工生物工程股份有限公司;dNTPs、Taq DNA聚合酶,TaKaRa;Sepharose 6B琼脂糖,北京索莱宝科技有限公司;核酸染液、DNA Marker、三羟甲基氨基甲烷(Tris)、EDTA,北京鼎国昌盛生物科技有限责任公司;乙酸,天津永大化学试剂有限公司。
1.1.3 仪器设备
FA 2004B电子分析天平,上海佑科仪器仪表有限公司;HCB-900V超净工作台,青岛海尔生物医疗股份有限公司;DSX-24L-I高压灭菌锅,上海申安医疗器械厂;LRH-150F生化培养箱,上海一恒科学仪器有限公司;PB-10酸度计,赛多维斯科学仪器(北京)有限公司;BX53生物显微镜,奥林巴斯(中国)有限公司;ST 8R高速冷冻离心机、MAXQ 4000台式恒温冷冻摇床、2720 thermal cycler PCR仪,赛默飞世尔科技(中国)有限公司;Waters Alliance 2695高效液相色谱系统,苏州市莱顿科学仪器有限公司;DYY-6C电泳仪,北京六一生物科技有限公司;BIO-RAD GelDoc GO凝胶成像系统,伯乐生命医学产品(上海)有限公司;VICTOR Nivo酶标仪,珀金埃尔默企业管理(上海)有限公司。
1.2 实验方法
1.2.1 产胺菌的分离纯化及形态观察
称取25 g腐乳样品,在无菌条件下将腐乳溶于225 mL无菌生理盐水,使用无菌玻璃棒进行研磨,搅拌均质,得到10-1浓度的稀释液。分别从10-1的稀释液中吸取1 mL,按10-2、10-3、10-4和10-5浓度稀释后,再从每个浓度稀释液中吸取100 μL涂布于产生物胺筛选培养基平板上,于37 ℃倒置培养24 h,观察平板颜色变化。挑选不同稀释梯度平板上单个紫色菌落,用生理盐水按10-3、10-4和10-5梯度稀释后得到稀释菌液,再分别从每个梯度的稀释菌液中吸取100 μL涂布于产生物胺筛选培养基平板上,于37 ℃倒置培养24 h,观察平板颜色变化。按上述纯化过程重复2~3次,得到单菌落。对分离菌株用LB肉汤培养基富集后,取单菌液进行革兰氏染色后于显微镜下进行形态学观察。
1.2.2 产胺菌的分子生物学鉴定
DNA提取:按照SteadyPure细菌基因组DNA提取试剂盒说明进行提取。
PCR扩增:采用16S rDNA序列通用引物27F(5′-AGA GTT TGA TCC TGG CTC AG-3′)和1492R(5′-GGT TAC CTT GTT ACG ACT T-3′)进行扩增。PCR扩增体系:45 μL 1×TSE 101 mix、引物27F和引物1492R各2.0 μL(10 μm)、1.0 μL 模板DNA。PCR扩增条件:98 ℃预变性2 min;98 ℃变性10 s,56 ℃复性10 s,72 ℃延伸10 s/kb,共35个循环;72 ℃再延伸5 min;最后于4 ℃保存。
结果检测:将扩增好的PCR产物经琼脂糖凝胶电泳检测后送样至深圳市易科吉生物科技有限公司进行测序,以鉴定产胺菌株种属。
1.2.3 超高效液相色谱法(ultra performance liquid chromatography,UPLC)法分析离菌株发酵液中的生物胺
将上述步骤纯化得到的菌株接种于LB肉汤培养基中富集培养8~10 h(对数期),取1 mL处于对数期菌悬液接种于100 mL LB肉汤培养基中,添加质量分数0.005%的磷酸吡哆醛和质量分数0.1%的氨基酸(组氨酸、苯丙氨酸、精氨酸、色氨酸、酪氨酸和赖氨酸),130 r/min摇床培养2 d,取1 mL发酵液于UPLC分析,平行测定3次。
生物胺含量的测定采用柱前衍生化法。样品前处理方法参考李大伟等[21]的方法稍加修改。取1 mL上述步骤的培养液于15 mL离心管中,加入400 μL 1 mol/L NaOH溶液,然后加入300 μL的缓冲饱和溶液NaHCO3,再加入1 mL提前溶于丙酮的质量浓度10 mg/mL的丹磺酰氯溶液,涡旋1 min,然后在避光条件下42 ℃水浴45 min,取出后加入100 μL氨水终止反应,再于黑暗中静置30 min,最后用乙腈定容至5 mL。10 000 r/min离心5 min,吸取1~1.5 mL的衍生化溶液过0.22 μm的有机滤膜打入样品瓶,用于UPLC检测分析。色谱条件参考HU等[15]的方法。
1.2.4 不同环境因素对产酪胺菌生长研究
取70 μL处于对数期菌悬液接种于7 mL LB肉汤培养基(添加质量分数为0.005%的磷酸吡哆醛和质量分数为0.1%氨基酸,下同)中。37 ℃培养2 d,每12 h取样,除不同pH值环境因素外,其余所有培养基的pH值均控制在5.50。不同环境因素水平:温度15、25、35 ℃;乙醇体积分数0、5%、10%、15%、20%、25%;氨基酸质量分数0、0.1%、0.2%、0.3%、0.4%、0.5%;pH值4.5、5.5、6.5、7.5、8.5、9.5;NaCl质量分数0、3.0%、6.0%、9.0%。每组设置空白对照,分别取样200 μL测定发酵液的OD600nm。
1.2.5 不同环境因素对产酪胺菌产胺特性研究
温度的影响:取1 mL处于对数期菌悬液接种于100 mL LB肉汤培养基中,分别于15、25、35 ℃,130 r/min摇床培养2 d,取1 mL培养液用于UPLC分析,并设空白对照。
氨基酸质量分数的影响:取1 mL处于对数期菌悬液接种于100 mL LB肉汤培养基中,分别添加质量分数为0、0.1%、0.2%、0.3%、0.4%和0.5%的氨基酸,37 ℃、130 r/min摇床培养2 d,取1 mL培养液用于UPLC分析,并设空白对照。
NaCl质量分数的影响:取1 mL处于对数期菌悬液接种于100 mL LB肉汤培养基中,分别添加质量分数为0、3.0%、6.0%和9.0%的NaCl,37 ℃、130 r/min摇床培养2 d,取1 mL培养液用于UPLC分析,并设空白对照。
乙醇体积分数的影响:取1 mL处于对数期菌悬液接种于100 mL LB肉汤培养基中,分别按体积分数0、5%、10%、15%、20%、25%添加乙醇,37 ℃、 130 r/min摇床培养2 d,取1 mL培养液用于UPLC分析,并设空白对照。
pH值的影响:取1 mL处于对数期菌悬液接种于100 mL LB肉汤培养基中,调节pH值依次为4.5、5.5、6.5、7.5、8.5和9.5,37 ℃、130 r/min摇床培养2 d,取1 mL培养液用于UPLC分析,并设空白对照。
1.2.6 数据分析
实验平行测定3次,实验结果表示为平均值±标准偏差。所有数据图表采用Excel 2016和GraphPad Prism 8软件进行制作分析。
2 结果与分析
2.1 产胺菌的筛选及形态学观察
添加溴甲酚紫的产生物胺筛选培养基是一种检测氨基酸脱羧酶阳性微生物的平板筛选方法[22]。产生物胺筛选培养基加入了多种氨基酸和显色剂溴甲酚紫,当微生物利用氨基酸合成碱性的生物胺时,会使培养基菌落周围pH上升从而显紫色。因此挑选培养基菌落周围紫色的菌株进行分离和纯化。
分离和纯化后,从发酵后期45 d的白腐乳样品中初步筛选出8株产生物胺菌,菌株编号S1~S8(表1)。对这些菌进行革兰氏染色和细胞形态观察,发现除了S5为革兰氏阳性球菌,其余菌株均为革兰氏阳性杆菌。
表1 菌株的形态学鉴定
Table 1 Morphological identification of strains

菌株编号生物胺筛选平板菌落形态革兰氏染色结果S1白色,近圆形,表面平坦光滑,边缘不齐革兰氏阳性杆菌S2乳白色,近圆形,表面平坦光滑,边缘不齐革兰氏阳性杆菌S3白色,不规则,表面平坦光滑,边缘不齐革兰氏阳性杆菌S4乳白色,近圆形,表面平坦光滑,边缘整齐革兰氏阳性杆菌S5白色,颗粒状,表面平坦光滑,边缘整齐革兰氏阳性球菌S6无色,圆形,表面平坦光滑,边缘整齐革兰氏阳性杆菌S7白色,圆形,表明干燥褶皱,边缘整齐革兰氏阳性杆菌S8白色,近圆形,表明平坦光滑,边缘不齐革兰氏阳性杆菌
由图1-a可知,S5菌落中心为白色,菌落较小,呈颗粒状,边缘平滑整齐且有紫色物质生成。结合革兰氏染色结果及形态(图1-b)可以初步判断此菌为革兰氏阳性球菌。但是也应该看到,溴甲酚紫的显色反应只能指示微生物生长环境的pH升高[23],并不能完全证实该菌就是产胺菌,因此还需要对初筛的菌株作进一步验证。

a-平板菌落形态;b-光学显微镜图
图1 菌株S5的形态学特征
Fig.1 Morphological characteristics of strain S5
将8个菌株提取DNA及PCR扩增后,进行测序、比对分析。结果显示,S1、S2、S3、S8等4株为拟蕈状芽孢杆菌(Bacillus paramycoides)、S4为热带芽孢杆菌(Bacillus tropicus)、S5为屎肠球菌(Enterococcus faecium)、S6为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、S7为枯草芽孢杆菌(Bacillus subtilis)(表2)。除菌株S1与参考序列相似性较低外(94.49%),其他7个菌株与比对的参考物种的相似性均大于99.7%。
表2 16S rDNA序列 Blast 比对
Table 2 Blast analysis of 16S rDNA sequences
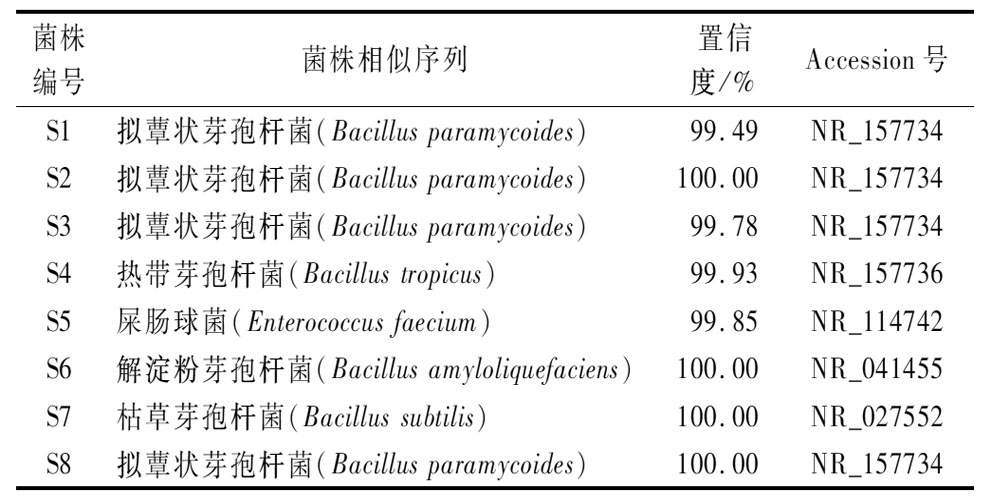
菌株编号菌株相似序列置信度/%Accession号S1拟蕈状芽孢杆菌(Bacillus paramycoides)99.49NR_157734S2拟蕈状芽孢杆菌(Bacillus paramycoides)100.00NR_157734S3拟蕈状芽孢杆菌(Bacillus paramycoides)99.78NR_157734S4热带芽孢杆菌(Bacillus tropicus)99.93NR_157736S5屎肠球菌(Enterococcus faecium)99.85NR_114742S6解淀粉芽孢杆菌(Bacillus amyloliquefa-ciens)100.00NR_041455S7枯草芽孢杆菌(Bacillus subtilis)100.00NR_027552S8拟蕈状芽孢杆菌(Bacillus paramycoides)100.00NR_157734
2.2 菌株培养液中的生物胺含量
2.2.1 生物胺回归方程和混合标准品溶液的色谱图
由图2可知,标准品中的8种生物胺和内标在25 min内得到较好分离,各生物胺单标的回归方程及相关系数如表3所示,其线性回归方程相关系数R2均大于0.997,生物胺含量和峰面积之间呈良好的线性相关,说明结果可信。

图2 生物胺混合标准溶液的UPLC色谱图
Fig.2 UPLC chromatogram of biogenic amines BAs standards
表3 生物胺的保留时间、回归方程和相关系数
Table 3 Retention time, the regression equations and correlation coefficients of biogenic amines
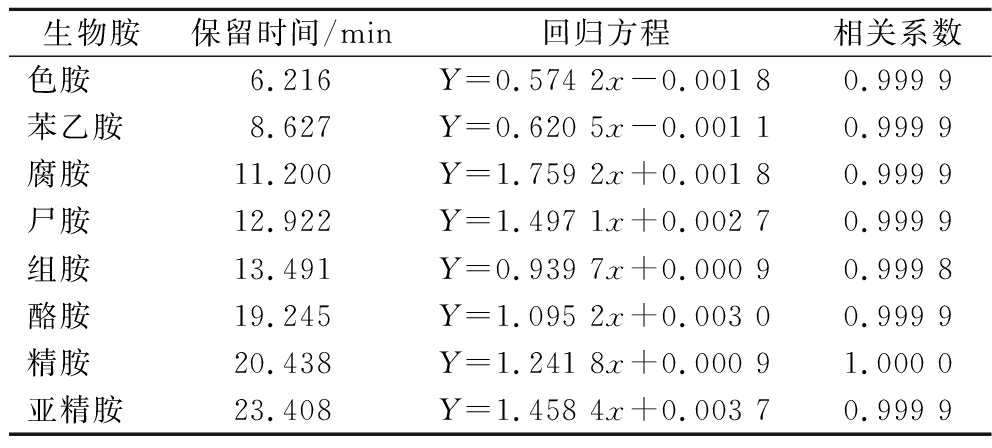
生物胺保留时间/min回归方程相关系数色胺6.216Y=0.574 2x-0.001 80.999 9苯乙胺8.627Y=0.620 5x-0.001 10.999 9腐胺11.200Y=1.759 2x+0.001 80.999 9尸胺12.922Y=1.497 1x+0.002 70.999 9组胺13.491Y=0.939 7x+0.000 90.999 8酪胺19.245Y=1.095 2x+0.003 00.999 9精胺20.438Y=1.241 8x+0.000 91.000 0亚精胺23.408Y=1.458 4x+0.003 70.999 9
2.2.2 产胺菌的产胺情况
由表4可知,分离和纯化出的8株产胺菌都产腐胺、尸胺和酪胺,腐胺生成量在0.68~5.81 mg/L;尸胺生成量在0.53~9.33 mg/L;酪胺生成量在0.45~87.31 mg/L。其中,S1产色胺,S1、S3和S5产亚精胺,所有菌株均不产组胺。梁静静等[18]报道了分离自商品红腐乳中5种产胺菌(枯草芽孢杆菌、巨大芽孢杆菌、赖氨酸芽孢杆菌、蜡样芽孢杆菌、热带芽孢杆菌)的酪胺生成量在11.56~18.22 mg/L,腐胺生产量在11.56~18.22 mg/L。本研究发现S5(屎肠球菌)产生物胺总量最高,高达106.34 mg/L。该菌主要产酪胺和苯乙胺,含量分别占产生物胺总量的82.10%和12.68%。值得注意的是,只有该菌产苯乙胺,含量为13.48 mg/L。菌株S5的生物胺检测色谱图见图3。

图3 产胺菌S5中生物胺的UPLC色谱图
Fig.3 UPLC chromatogram of biogenic amines in strains S5
表4 八株产胺菌中生物胺含量 单位:mg/L
Table 4 Contents of biogenic amines in eight biogenic amine producing strains
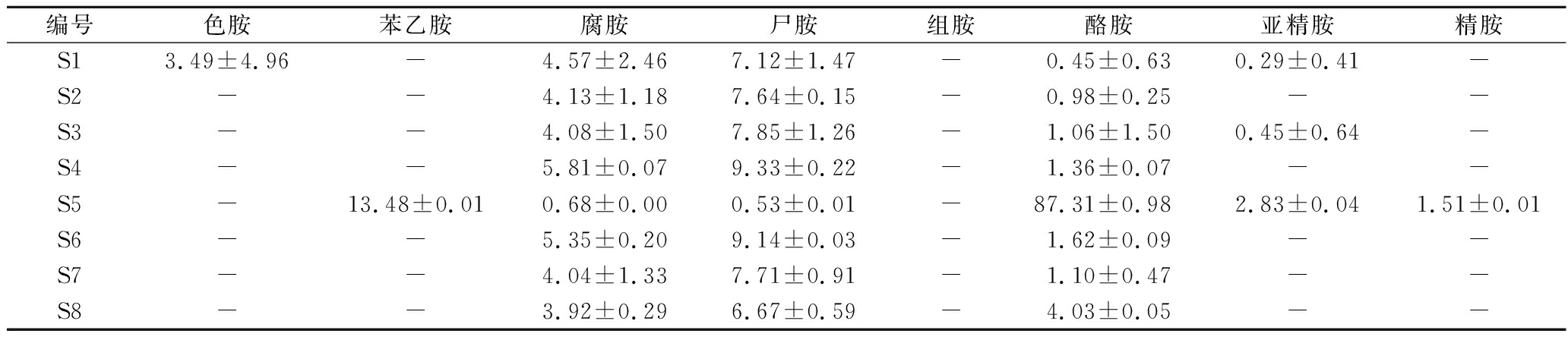
编号色胺苯乙胺腐胺尸胺组胺酪胺亚精胺精胺S13.49±4.96-4.57±2.467.12±1.47-0.45±0.630.29±0.41-S2--4.13±1.187.64±0.15-0.98±0.25--S3--4.08±1.507.85±1.26-1.06±1.500.45±0.64-S4--5.81±0.079.33±0.22-1.36±0.07--S5-13.48±0.010.68±0.000.53±0.01-87.31±0.982.83±0.041.51±0.01S6--5.35±0.209.14±0.03-1.62±0.09--S7--4.04±1.337.71±0.91-1.10±0.47--S8--3.92±0.296.67±0.59-4.03±0.05--
注:“-”代表未检出。
此外,屎肠球菌也从火腿、奶酪中分离得到,被证明具有产酪胺的能力[24-25]。JEONG等[26]从酱曲中分离的屎肠球菌在给与前体物质氨基酸的培养条件下,能产生高达3 397.4 mg/L的酪胺,未产生组胺,这与本研究S5的产胺结果相似。综上,菌株S5产不同种生物胺的含量存在很大差异,除温度、NaCl浓度、pH值等环境因素影响外,还可能与其编码不同氨基酸脱羧酶的基因有关[15]。
2.2.3 不同环境因素对屎肠球菌S5生长与产胺特性的影响
2.2.3.1 不同环境因素对屎肠球菌S5生长的影响
选取产生物胺水平最高的S5为研究对象,测定不同环境因素对其生长活性的影响。结果表明,35 ℃的环境对S5的生长最有利,而15 ℃低温则会抑制S5的生长(图4-a)。当环境中的乙醇体积分数<15%时,S5能正常生长,但随着乙醇体积分数升高,对S5的抑制作用越强(图4-b)。S5在质量分数为0~0.5%的氨基酸中吸光度值变化趋势相近,表明此浓度范围的氨基酸对该菌生长不产生明显影响(图4-c)。而过高(pH>8.5)和过低(pH<5.5)的pH环境都不利于S5的生长(图4-d)。当NaCl质量分数为6.0%时,可对S5的生长产生一些抑制,当NaCl质量分数为9.0%时,该菌的生长明显受到抑制(图4-e)。

a-温度;b-乙醇体积分数;c-氨基酸质量分数;d-pH值;e-NaCl质量分数(下图同)
图4 不同环境因素对屎肠球菌S5生长的影响
Fig.4 Effect of different environmental factors on Enterococcus faecium S5 growth
2.2.3.2 温度对屎肠球菌S5产胺特性的影响
当培养温度15 ℃时,S5的酪胺生成量很低,为11.44 μg/mL。但随着温度持续升高,总胺生成量也持续增加,35 ℃时达到最高值77.78 μg/mL(图5-a)。这可能是由于S5在15 ℃低温环境下48 h的生长明显低于35 ℃下48 h的生长(图4-a),导致15 ℃时S5产胺水平降低。

图5 不同环境因素对屎肠球菌S5产胺特性的影响
Fig.5 Effects of different environmental factors on amine-producing characteristics of E. faecium S5
2.2.3.3 乙醇对屎肠球菌S5产胺特性的影响
从图5-b可知,乙醇体积分数在0~15%时,S5总胺含量从119.52 μg/mL增加到123.39 μg/mL,可能是低浓度的乙醇能提升S5氨基酸脱羧酶的活力,王俊朋等[27]认为少量的酒精对酶活力有促进作用。但是,当添加的乙醇体积分数>15%时,总胺和酪胺含量都呈现下降趋势。高浓度乙醇抑制生物胺的产生,可能与其抑制了菌体的生长有关,因为S5在乙醇体积分数>15%时生长缓慢(图4-b)。
2.2.3.4 氨基酸对屎肠球菌S5产胺特性的影响
图5-c显示当氨基酸质量分数在0.1%~0.5%时,S5的生物胺含量呈先增加后减少的趋势,在氨基酸质量分数0.3%时总胺含量达到峰值120.17 μg/mL,当质量分数达到0.5%时总胺含量降低至101.56 μg/mL。本研究结果与梁静静等[18]研究的氨基酸质量分数对产胺菌产胺特性的影响趋势一致。原因可能与脱羧作用的“临界点”有关,当培养液中的氨基酸质量分数>0.3%后,S5的总胺和酪胺含量不增反减,这反映出氨基酸浓度对S5产胺的有限促进作用[28]。
2.2.3.5 pH对屎肠球菌S5产胺特性的影响
图5-d显示出S5合成生物胺的最佳pH在6.5~7.5,峰值pH 6.5的总胺和酪胺含量分别为110.85和105.93 μg/mL。过低或过高的pH会抑制S5氨基酸脱羧酶的活性,减少其产胺量。一定的酸性条件下可以刺激S5酪胺脱羧酶的活性,已有研究证实酸性条件可诱导编码酪氨酸脱羧酶(tdcA)和编码酪氨酸-酪胺反转运蛋白基因(tyrP)影响产胺菌酪胺的表达量[29]。此外,S5在不同pH值条件下的产胺量趋势,与其在此培养条件下的生长趋势也基本一致(图4-d)。
2.2.3.6 NaCl对屎肠球菌S5产胺特性的影响
NaCl质量分数<3.0%对S5的产胺性能影响较小,随着NaCl质量分数的增大,达到6.0%~9.0%时,S5的产胺量持续下降。当NaCl浓度为9.0%时,S5产总胺和酪胺量最低,分别为75.88、70.12 μg/mL(图5-e)。高NaCl浓度主要通过高浓度的Na+抑制S5酪氨酸脱羧酶活性[30-31],从而影响生物胺的形成。
3 结论
本研究首次从白方腐乳后发酵环节中分离纯化出8株产胺菌,经16S rDNA序列鉴定,4株为拟蕈状芽孢杆菌,其余4株分别为热带芽孢杆菌、屎肠球菌、解淀粉芽孢杆菌以及枯草芽孢杆菌。通过超高效液相色谱技术对这8株产胺菌的产胺特性进行定性定量分析,结果发现菌株S5(屎肠球菌)产胺能力较强(106.34 mg/L),酪胺产生量高达87.31 mg/L。对菌株S5不同环境因素中的生长特性和产胺能力进行系统研究,发现不同的环境因素(如温度、氨基酸、NaCl、乙醇和pH值)对该菌生长活性和产胺能力有很大影响。在温度<15 ℃、乙醇体积分数>15%、氨基酸质量分数<0.5%、pH>7.5、NaCl质量分数>6.0%条件下,S5产胺量降低,进一步提示腐乳生产过程中可以通过对上述环境条件的调节来控制生物胺的产生。
[1] GONG X, WANG X X, QI N L, et al.Determination of biogenic amines in traditional Chinese fermented foods by reversed-phase high-performance liquid chromatography (RP-HPLC)[J].Food Additives &Contaminants:Part A, 2014, 31(8):1431-1437.
[2] 刘振锋. 腐乳和臭干中生物胺的研究[D].杭州:浙江大学, 2011.
LIU Z F.Studies on biogenic amines in fermented soybean products:Sufu (Furu) and stinky tofu (Chougan)[D].Hangzhou:Zhejiang University, 2011.
[3] 万红芳. 自然发酵腐乳微生物群落分析及发酵菌株的筛选应用[D].上海:上海海洋大学, 2020.
WAN H F.Microbial community analyses of naturally fermented sufu and the application and screening of fermentation strains[D].Shanghai:Shanghai Ocean University, 2020.
[4] TAN G L, HU M, LI X Y, et al.High-throughput sequencing and metabolomics reveal differences in bacterial diversity and metabolites between red and white sufu[J].Frontiers in Microbiology, 2020, 11:758.
[5] HUANG X N, YU S Z, HAN B Z, et al.Bacterial community succession and metabolite changes during sufu fermentation[J].LWT, 2018, 97:537-545.
[6] SHI C S, LIU M M, ZHAO H F, et al.Formation and control of biogenic amines in sufu-a traditional Chinese fermented soybean product:A critical review[J].Food Reviews International, 2023, 39(3):1 694-1 715.
[7] LIANG J J, LI D W, SHI R Q, et al.Effects of microbial community succession on volatile profiles and biogenic amine during sufu fermentation[J].LWT, 2019, 114:108379.
[8] 王光强, 俞剑燊, 胡健, 等.食品中生物胺的研究进展[J].食品科学, 2016, 37(1):269-278.
WANG G Q, YU J S, HU J, et al.Progress in research on biogenic amines in foods[J].Food Science, 2016, 37(1):269-278.
[9] LI D W, LIANG J J, SHI R Q, et al.Occurrence of biogenic amines in sufu obtained from Chinese market[J].Food Science and Biotechnology, 2019, 28(2):319-327.
[10] SILLA SANTOS M H.Biogenic amines:Their importance in foods[J].International Journal of Food Microbiology, 1996, 29(2-3):213-231.
[11] TEN BRINK B, DAMINK C, JOOSTEN H M L J, et al.Occurrence and formation of biologically active amines in foods[J].International Journal of Food Microbiology, 1990, 11(1):73-84.
[12] YANG J A, DING X W, QIN Y R, et al.Safety assessment of the biogenic amines in fermented Soya beans and fermented bean curd[J].Journal of Agricultural and Food Chemistry, 2014, 62(31):7947-7954.
[13] QIU S, WANG Y, CHENG Y Q, et al.Reduction of biogenic amines in sufu by ethanol addition during ripening stage[J].Food Chemistry, 2018, 239:1244-1252.
[14] TORO-FUNES N, BOSCH-FUSTE J, LATORRE-MORATALLA M L, et al.Biologically active amines in fermented and non-fermented commercial soybean products from the Spanish market[J].Food Chemistry, 2015, 173:1119-1124.
[15] HU M, DONG J, TAN G L, et al.Metagenomic insights into the bacteria responsible for producing biogenic amines in sufu[J].Food Microbiology, 2021, 98:103762.
[16] 蒋芳芳, 刘嘉, 蒋立文.腐乳品质改善的研究进展[J].中国酿造, 2011, 30(11):1-5.
JIANG F F, LIU J, JIANG L W.The research progress of sufu quality improvement[J].China Brewing, 2011, 30(11):1-5.
[17] LIANG J J, LI D W, SHI R Q, et al.Effects of different co-cultures on the amino acid availability, biogenic amine concentrations and protein metabolism of fermented sufu and their relationships[J].LWT, 2019, 113:108323.
[18] 梁静静, 李大伟, 史瑞琴, 等.腐乳中产生物胺菌株的筛选鉴定及产生物胺能力评价[J].河北农业大学学报, 2019, 42(3):88-93.
LIANG J J, LI D W, SHI R Q, et al.Screening and identification of biogenic amines producing strains from sufu and evaluation of biogenic amines production ability[J].Journal of Hebei Agricultural University, 2019, 42(3):88-93.
[19] 王维亚, 黄瑞钰, 骆瑜, 等.江西产腐乳生物胺水平调查及产胺菌的分离与鉴定[J].食品工业科技, 2022, 43(12):246-252.
WANG W Y, HUANG R Y, LUO Y, et al.Investigation of the biogenic amine content in Jiangxi-made sufu and isolation and identification of amine-producing bacteria[J].Science and Technology of Food Industry, 2022, 43(12):246-252.
[20] COTON M, COTON E, LUCAS P, et al.Identification of the gene encoding a putative tyrosine decarboxylase of Carnobacterium divergens 508.Development of molecular tools for the detection of tyramine-producing bacteria[J].Food Microbiology, 2004, 21(2):125-130.
[21] 李大伟, 李丹丹, 梁静静, 等.高效液相色谱法测定市售腐乳中生物胺的含量[J].食品研究与开发, 2018, 39(16):120-124;129.
LI D W, LI D D, LIANG J J, et al.Determination of biogenic amines in commercially sufu by high performance liquid chromatography[J].Food Research and Development, 2018, 39(16):120-124;129.
[22] BOVER-CID S, HOLZAPFEL W H.Improved screening procedure for biogenic amine production by lactic acid bacteria[J].International Journal of Food Microbiology, 1999, 53(1):33-41.
[23] MØLLER V.Distribution of amino acid decarboxylases in Enterobacteriaceae[J].Acta Pathologica Microbiologica Scandinavica, 1954, 35(3):259-277.
[24] ZHANG Y H, SHAN B, GONG J S, et al.Mechanism of biogenic amine synthesis of Enterococcus faecium isolated from Sanchun ham[J].Food Science &Nutrition, 2022, 10(6):2036-2049.
[25] TSANASIDOU C, ASIMAKOULA S, SAMELI N, et al.Safety evaluation, biogenic amine formation, and enzymatic activity profiles of autochthonous enterocin-producing Greek cheese isolates of the Enterococcus faecium/durans group[J].Microorganisms, 2021, 9(4):777.
[26] JEONG M, JEONG D W, LEE J H.Safety and biotechnological properties of Enterococcus faecalis and Enterococcus faecium isolates from meju[J].Journal of the Korean Society for Applied Biological Chemistry, 2015, 58(6):813-820.
[27] 王俊朋, 吕晓玲, 张颖, 等.环境因素对屎肠球菌产酪胺的影响[J].中国酿造, 2017, 36(4):40-44.
WANG J P, LYU X L, ZHANG Y, et al.Effect of environmental factors on tyramine production by Enterococcus faecalis[J].China Brewing, 2017, 36(4):40-44.
[28] 朱天傲. 酱制品中生物胺及产胺芽孢杆菌的研究[D].无锡:江南大学, 2017.
ZHU T A.Biogenic amines and amines-forming Bacillus species in paste products[D].Wuxi:Jiangnan University, 2017.
[29] LINARES D M, FERN NDEZ M, MART
NDEZ M, MART N M C, et al.Tyramine biosynthesis in Enterococcus durans is transcriptionally regulated by the extracellular pH and tyrosine concentration[J].Microbial Biotechnology, 2009, 2(6):625-633.
N M C, et al.Tyramine biosynthesis in Enterococcus durans is transcriptionally regulated by the extracellular pH and tyrosine concentration[J].Microbial Biotechnology, 2009, 2(6):625-633.
[30] CHIN K D H, KOEHLER P E.Effect of salt concentration and incubation temperature on formation of histamine, phenethylamine, tryptamine and tyramine during miso fermentation[J].Journal of Food Protection, 1986, 49(6):423-427.
[31] ROSEIRO C, SANTOS C, SOL M, et al.Prevalence of biogenic amines during ripening of a traditional dry fermented pork sausage and its relation to the amount of sodium chloride added[J].Meat Science, 2006, 74(3):557-563.