油茶饼是油茶籽榨油后的副产物,茶油的普及造成其产量增加,在中国每年约产生1 000万t[1]。油茶饼含有丰富的蛋白质、多糖和多酚[2],具有很高的经济价值,是潜在的饲料资源。但其因含茶皂素、单宁,会呈现苦、涩味,有刺激性,会影响动物吸收导致饲用价值低[3]。目前关于油茶饼的研究主要是通过溶剂提取酚类、多糖、茶皂素等开发其特性价值,从而实现油茶油工业废弃物的再利用[4-6]。但这对油茶饼的整体利用率极低,耗费溶剂、造成原料营养流失的同时,滤渣也会造成环境污染,于是实现其资源利用最大化应从降解茶皂素的角度出发。
微生物发酵法是目前最为常见的方法,已有研究证明芽孢杆菌属、乳杆菌属、柠檬酸杆菌属等含皂素降解酶,对茶皂素有降解效果[3, 7-8],其中芽孢杆菌的发酵效果良好[9]。CHANG 等[10]用混合培养的枯草芽孢杆菌和黑曲霉固态发酵降解油茶粕中茶皂素,最佳条件发酵4 d降解率为(67.84±0.23)%。黄浦等[11]用地衣芽孢杆菌与铜绿假单胞菌混合发酵降解茶皂素,优化后发酵12.8 d降解率达到(73.76±0.63)%。研究表明,用枯草芽孢杆菌、地衣芽孢杆菌进行液态发酵,最优条件下茶皂素降解率均低于70%[12-13]。鉴于此,本研究旨在研究单菌降解效果更好、发酵时间更短、操作更简便的固态发酵油茶饼的最优条件。
考虑到枯草芽孢杆菌有显著的益生菌潜力[14],会加快肠道对营养物质的吸收、抑制有害菌种及促进禽畜生长等[15-16],故本研究通过单因素、响应面试验优化降解茶皂素的发酵条件,并对比此时发酵终点各物质含量。一是有助于发酵期间菌株良好生长,以达到所需目的,提高茶皂素降解率和降低能耗对于工业生产具有重要意义;二是综合评价最优条件下其营养物质变化规律,为我国油茶饼综合利用提供实际参考。
1 材料与方法
1.1 材料与试剂
油茶饼,贵州恒生源有限公司;枯草芽孢杆菌,自然发酵的油茶饼中筛选所得,菌株保藏编号CCTCCM 2022623。营养琼脂(去除琼脂则为营养肉汤)、茶皂素标品(≥98%),贵州慕为美生物有限公司;无水乙醇、NaCl、香草醛、Na2CO3、HCl、福林酚、AlCl3等化学试剂为国产分析纯。
1.2 仪器与设备
Spectra Max190型光吸收酶标仪,美谷分子仪器有限公司;H2-16KR型冷冻离心机,湖南可成仪器设备有限公司;L-8800氨基酸自动分析仪,日立公司;SCIENTZ-18 N 型冷冻干燥机,宁波新芝生物科技股份有限公司;JK9870型全自动凯氏定氮仪,上海仪电分析仪器有限公司;BSA224S分析天平,北京赛多利斯仪器系统有限公司;HH-6恒温水浴锅,江苏金坛市金城国盛实验仪器厂。
1.3 试验方法
1.3.1 种子液制备
菌种活化后,挑单颗菌落于50 mL的液体培养基,37 ℃、150 r/min摇床培养22 h。
1.3.2 样品前处理
油茶饼干燥粉碎,40目筛,按比例与水拌匀,121 ℃灭菌20 min。
1.3.3 茶皂素含量测定
参照田漫漫等[17]的方法提取茶皂素;用香草醛-硫酸显色法[3]测定茶皂素含量,稍作改动:0.5 mL提取液加0.5 mL 8%香兰素-乙醇溶液,置冰水浴加4 mL 77% H2SO4溶液轻微晃动摇匀,60 ℃水浴10 min,冷却至室温,550 nm记录吸光度。取0、0.1、0.2、0.3、0.4、0.5 mL的1 mg/mL茶皂素标品溶液补水至0.5 mL同上步骤作标准曲线。降解率按公式(1)计算:
(1)
式中:X,茶皂素降解率,%;w0,发酵前油茶饼中茶皂素含量,mg/g;w,发酵后油茶饼中茶皂素含量,mg/g。
1.4 单因素试验
初始条件:发酵时间2 d,温度37 ℃,接种量10%,翻样(间隔12 h)。分别设置初始含水量70%、80%、90%、100%、110%、120%;发酵温度25、28、31、34、37、40 ℃;接种量2%、4%、6%、8%、10%、12%;发酵时间12、24、36、48、60、72、84、96、108、120 h。每确定一个因素再进行下一步试验。
1.5 响应面试验
1.5.1 Box-Behnken响应面优化设计
以单因素试验中得到的对茶皂素降解率影响较大的因素——含水量(A)、接种量(B)和发酵温度(C)进行响应面优化试验。
1.5.2 验证试验
对响应面所得最佳工艺进行验证,判定其结果是否可信。
1.6 成分测定
1.6.1 基本成分
灰分测定参照GB 5009.4—2016《食品安全国家标准 食品中总灰分的测定》;蛋白质测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;脂肪测定参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》;粗纤维测定参照GB/T 5009.10—2003《植物类食品中粗纤维的测定》;单宁测定参照 NY/T 1600—2008《水果、蔬菜及其制品中单宁含量的测定 分光光度法》;还原糖测定使用DNS法[18],稍改动,1 mL待测液加1 mL水、1.5 mL DNS试剂,混匀,沸水浴5 min,冷却加水至10 mL,540 nm测吸光度。
1.6.2 游离氨基酸
样品前处理参照WEN等[19]的方法,稍作修改,样品按体积比1∶50加入0.01 mol/L的盐酸,超声波浸泡30 min,过滤,上清液按体积比1∶1加入8%的磺基水杨酸,摇匀放置10 min,10 000 r/min离心10 min,上清液过膜(0.22 μm),上机测定。
1.6.3 活性成分
总糖参照蒽酮硫酸法[20];多糖参照苯酚硫酸法[21]。
总酚参照Folin-Ciocalteau法[22],稍作修改:0.5 mL提取物按V(样品)∶V(80%甲醇)=1∶10,40 ℃超声波浸提1 h,循环3次,过滤定容到50 mL,加水7.5 mL、福林酚0.5 mL、20%的Na2CO3 1.5 mL混匀黑暗反应30 min,765 nm读数。取0.1 mg/mL的没食子酸标准溶液0、0.2、0.4、0.6、0.8、1.0 mL按1.3.3节的方法作标准曲线。
总黄酮采用硝酸铝比色法[23],1.0 mL提取物按V(样品)∶V(60%乙醇)=1∶30,浸泡过夜,45 ℃超声波45 min,重复提取,定容至100 mL,分别加10%的Al(NO3)3、5%的NaNO2各0.3 mL,摇匀,黑暗放10 min;加4%的NaOH 3.5 mL,定容到10 mL,黑暗放30 min,510 nm测定吸光度。质量浓度为1 mg/mL芦丁标准溶液0、0.2、0.4、0.6、0.8、1.0 mL按1.3.3节的方法作标准曲线。
1.7 数据处理
利用Microsoft Excel和SPSS 26.0软件数据处理,结果以平均值±标准差表示,利用Design-Expert 13软件完成响应面优化,利用Origin 2021软件中的Heat Map with Dendrogram APP进行聚类热图的绘制。各组重复3次, P<0.05表示差异显著。
2 结果与分析
2.1 单因素试验结果
2.1.1 初始含水量对茶皂素降解率的影响
初始含水量是固态发酵的一个重要影响因素,低水分时微生物生长会最小化,高水分时基质会被水占据导致氧气被排出[24]。图1-a中90%含水量时降解率达到66.29%,最适合固态发酵降解茶皂素。高于90%时降解率持续降低,这可能是由于含水量增加使混匀后的油茶饼黏度增加通气量减少的原因引起的,含水量过低也会影响茶皂素的降解,因此初始含水量选择90%。

a-初始含水量;b-发酵温度;c-接种量;d-发酵时间
图1 不同单因素对茶皂素降解率的影响
Fig.1 Effects of different single factors on degradation rate of tea saponin
注:不同小写字母表示差异显著(P<0.05)。
2.1.2 发酵温度对茶皂素降解率的影响
影响微生物生长的所有生态生理参数中最重要的是温度,其通过影响酶活性对微生物生长、代谢产物的积累产生作用[25]。图1-b中随温度升高菌株对茶皂素的降解率呈现先升后降的趋势,这是因为高温会使酶失活,低温会影响菌体生长和产酶速度。37 ℃时茶皂素降解率达到61.06%显著高于其他温度,因此发酵温度选择37 ℃。
2.1.3 菌株接种量对茶皂素降解率的影响
菌株生长速度与接种量直接相关,接种量将影响菌株的降解能力。图1-c中接种量10%时降解率达到最大值63.61%。接种量2%~10%时,降解率随接种量增加而增加,原因是细菌数增加缩短了对数期,其通过种内互助快速适应新环境,生长良好,提高降解率。而超过10%时,营养物质缺乏使得菌株相互竞争,降解率停止增加甚至减少[26]。故选择10%的接种量。
2.1.4 发酵时间对茶皂素降解率的影响
图1-d是发酵时间对菌株茶皂素降解率的影响。发酵前期,随时间推移降解率一直升高,这是因为菌株产生的某些酶类对油茶饼中大分子物质进行分解[8],促进了菌株生长。而60 h后降解率开始逐渐下降,这是营养物质消耗殆尽,后期不足以供菌体正常生长所致。60、72、84 h时,茶皂素降解率均在60%以上且无显著性差异,但实际生产中发酵周期较短为好,故确定发酵时间为60 h,此时降解率为64.99%。
2.2 响应面试验设计和结果
单因素试验中已确定发酵时间为60 h,为进一步优化发酵条件,利用初始含水量(80%~100%)、发酵温度(34~40 ℃)、接种量(8%~12%)进行响应面试验,降解率为响应值,其Box-Bnhnken试验设计与结果分析见表1。
表1 响应面试验设计与结果
Table 1 Design and results of response surface experiment

试验号因素A(初始含水量)/%B(温度)/℃C(接种量)/%茶皂素降解率/%180341065.332100341064.19380401060.274100401053.9158037850.65610037856.35780371264.578100371259.0899034848.37109040845.091190341260.441290401246.901390371069.241490371070.711590371069.571690371068.921790371070.55
回归方程方差分析结果见表2,模型极显著、失拟项不显著、相关系数R2接近于1,表明本试验模型合理、可靠性较高。由F值得各因素对降解率的影响顺序为:发酵温度(B)>接种量(C)>初始含水量(A)。茶皂素降解率(Y)的二次回归方程:Y=69.80-0.91A-4.02B+3.82C-1.31AB-2.80AC-2.57BC-0.71A2-8.17B2-11.43C2。加以软件分析得最佳条件为初始含水量83.669%,发酵温度36.301 ℃,接种量10.535%,降解率预测值71.230%。考虑实际操作,确定初始含水量83.7%、发酵温度36.3 ℃、接种量10.5%进行验证试验,茶皂素降解率为72.18%,接近预测值,证明本试验的优化方法可信。
表2 回归模型方差分析
Table 2 Analysis of variance of regression model

方差来源平方和自由度均方F值P值模型1 205.309133.92 83.74<0.000 1**A-初始含水量6.6416.644.150.080 9B-发酵温度129.281129.2880.84<0.000 1**C-接种量116.511116.5172.85<0.000 1**AB6.8116.814.260.077 9AC31.30131.3019.570.003 1**BC26.32126.3216.460.004 8**A22.0912.091.310.290 1B2280.891280.89175.64<0.000 1**C2550.111550.11343.97<0.000 1**残差11.1971.60失拟项8.6632.894.560.088 3纯误差2.5340.632 9总和1 216.5016
注:![]() 影响极显著(P<0.01);*影响显著(P<0.05)。
影响极显著(P<0.01);*影响显著(P<0.05)。
2.3 基本成分变化
如表3所示,发酵后茶皂素和单宁含量分别显著降低72.18%、27.27%。发酵后仅剩6.24%的茶皂素,含量较低,将其添加于饲料中可能会具有改善动物生长性能的潜力[27]。粗蛋白和粗脂肪增加了26.89%和33.48%,粗蛋白增加是由于微生物会向胞外分泌多肽和酶蛋白等物质[28]。粗脂肪增加是因为油茶饼发酵时某些营养物质可能会降解成小分子物质,如醇和酸发生酯化反应,形成酯类物质,使得乙醚提取物增多[29]。发酵过程中,基本成分比例会发生变化,如油茶饼中某些物质会被菌株当做碳源以供营养所需。而粗纤维和还原糖的变化是由于枯草芽孢杆菌产生纤维素酶,将纤维素降解成低分子还原糖所引起。相比发酵前,油茶饼发酵后不良属性被改善,抗营养因子大量降解使得苦、涩味消失,适口性变好;含有营养价值更高的蛋白、脂肪,可用于生产生物发酵饲料[3],在动物蛋白饲料方面具有一定的应用前景。
表3 油茶饼发酵前后的基本成分
Table 3 Basic components of C. oleifera cake before and after fermentation

项目茶皂素/%单宁/%还原糖/%粗蛋白/%粗脂肪/%粗纤维/%灰分/%发酵前22.43±0.47a1.32±0.02a4.42±0.16b9.15±0.08b9.35±0.22b19.26±0.59a3.53±0.07b发酵后6.24±0.25b0.96±0.01b8.62±0.32a11.61±0.12a12.48±0.67a16.48±0.38b4.16±0.05a
注:同一列不同小写字母表示有显著差异(下同)。
2.4 游离氨基酸变化
发酵前后油茶饼的游离氨基酸变化情况见图2,共16种氨基酸,含7种必需氨基酸。热图表明2个样品的氨基酸含量差异显著,发酵后油茶饼总氨基酸含量显著降低31.42%,必需氨基酸显著增加16.18%,其中蛋氨酸、苯丙氨酸、赖氨酸分别显著增加27倍、1.41倍、1.39倍,这和DAI等[28]用枯草芽孢杆菌进行固态发酵豆粕后必需氨基酸含量增加的研究结果一致。其他氨基酸如天冬氨酸增加(1.17倍)和甘氨酸降低(57.83%)与YAO等[30]研究相似,枯草芽孢杆菌发酵豆粕后其含量会显著增加和减少,这是大分子蛋白质水解所引起的。天冬氨酸由小分子肽(2~20个氨基酸残基)和游离氨基酸组成[31],可直接被动物肠道系统吸收,侧方面也证实发酵油茶饼可作为饲料的潜在可能性。此外,丙氨酸、精氨酸分别急剧下降70.50%和58.97%,造成总氨基酸的整体下降,这是由于最优工艺下菌株长势良好,消耗过多氨基酸所引起。氨基酸可提供微生物生长所需营养,也是重要的呈味物质,与产品风味密切相关。异亮氨酸、组氨酸、精氨酸等是苦味氨基酸[32],其含量降低表明苦味有所减少,这与2.3节中茶皂素大幅度降解相对应,减少了牲畜拒食的可能性。总的来说,微生物发酵会使氨基酸有不同程度的变化,如CHEN等[33]发现纳豆芽孢杆菌在不同发酵时间下大豆粉氨基酸会产生显著差异。

图2 油茶饼发酵前后氨基酸含量的热图
Fig.2 Heatmap of amino acid content in C. oleifera cake before and after fermentation
注:DZB为发酵前,FJB为发酵后。
2.5 活性成分变化
黄酮、总酚和糖类是油茶饼最主要的活性成分。表4中总糖和多糖显著下降28.22%和23.66%,这说明菌株将油茶饼中的糖类当作了自身生长所需的碳源,不断消耗造成了大量减少。这与WAGNER等[34]研究发现枯草芽孢杆菌可以降解或使用碳水化合物作为发酵中自身代谢的能量来源的观点一致。多糖中葡萄糖是主要的组成单糖之一,可用于菌株的生物合成和代谢,这也是造成其含量下降的原因。多酚和类黄酮是科学研究中经常评估的生物活性化合物,由分析可知枯草芽孢杆菌发酵油茶饼后总酚和总黄酮含量分别增加了5.56%和30.88%。这与XU等[35]和DAI等[28]的研究一致,大豆发酵产品与原料的总酚与黄酮含量存在差异;枯草芽孢杆菌发酵豆粕会使总酚和类黄酮含量显著增加。芽孢杆菌能代谢纤维素并释放酚类化合物,因为酚类化合物与纤维素酶和果胶酶的产生之间具有强烈的相关性[36];在发酵时,微生物会产生各种酶类分解植物细胞的细胞壁成分,实现酯键水解,释放酚类物质,使得总酚含量增加。酚类物质是最大的次生代谢物组分之一,也是非必需膳食成分的主要组分,具有广泛的生物特性,如抗氧化、抗炎和抗癌活性[37]。而发酵后活性成分增加,为较高市场价值功能性食品、药物等产品的生产创造了新的契机。
表4 油茶饼发酵前后的活性成分
Table 4 Active components of C. oleifera cake before and after fermentation
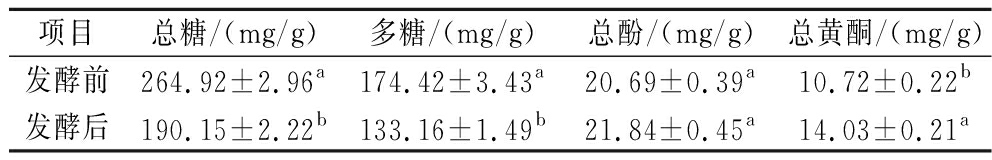
项目总糖/(mg/g)多糖/(mg/g)总酚/(mg/g)总黄酮/(mg/g)发酵前264.92±2.96a174.42±3.43a20.69±0.39a10.72±0.22b发酵后190.15±2.22b133.16±1.49b21.84±0.45a14.03±0.21a
3 结论与讨论
本研究利用枯草芽孢杆菌固态发酵油茶饼,通过响应面优化得到降解茶皂素的最佳工艺为初始含水量83.7%,发酵温度36.3 ℃,接种量10.5%,发酵时间60.0 h,此时降解率达到72.18%。而后对比发酵终点各类物质含量,结果表明:发酵会使油茶饼中茶皂素、单宁等抗营养因子显著降低;粗蛋白、粗脂肪、还原糖、必需氨基酸等营养物质显著增加;黄酮等主要活性成分显著增多,糖类物质显著减少;此外粗纤维、灰分含量也产生变化。综上,本研究证实枯草芽孢杆菌固态发酵可以一定程度提升油茶饼的营养与活性成分含量,有利于其在发酵产品中的应用与发展。
[1] ZHENG T R, YU H L, LIU S J, et al.Achieving high ethanol yield by co-feeding corncob residues and tea-seed cake at high-solids simultaneous saccharification and fermentation[J].Renewable Energy, 2020, 145:858-866.
[2] SARMAH K, DAS P, SAIKIA G K, et al.Biochemical characterization of tea (Camellia spp) seed oil cake[J].Bulletin of Environment, Pharmacology and Life Sciences, 2018, 7(9):45-49.
[3] FU G M, CHEN K D, WANG J T, et al.Screening of tea saponin-degrading strain to degrade the residual tea saponin in tea seed cake[J].Preparative Biochemistry &Biotechnology, 2020, 50(7):697-707.
[4] ZHANG D D, NIE S P, XIE M Y, et al.Antioxidant and antibacterial capabilities of phenolic compounds and organic acids from Camellia oleifera cake[J].Food Science and Biotechnology, 2020, 29(1):17-25.
[5] ZHANG S, LI X Z.Hypoglycemic activity in vitro of polysaccharides from Camellia oleifera Abel.seed cake[J].International Journal of Biological Macromolecules, 2018, 115:811-819.
[6] YU Z L, WU X H, HE J H.Study on the antifungal activity and mechanism of tea saponin from Camellia oleifera cake[J].European Food Research and Technology, 2022, 248(3):783-795.
[7] QIAN B J, YIN L R, YAO X M, et al.Effects of fermentation on the hemolytic activity and degradation of Camellia oleifera saponins by Lactobacillus crustorum and Bacillus subtilis[J].FEMS Microbiology Letters, 2018, 365(7):fny014.
[8] 任泽文, 肖志红, 吴红, 等.高效降解茶皂素菌株的分离鉴定及其发酵优化研究[J].中国粮油学报, 2019, 34(3):99-104.
REN Z W, XIAO Z H, WU H, et al.Isolation and identification of tea saponin strain in a highly efficient degradation and optimization of its fermentation[J].Journal of the Chinese Cereals and Oils Association, 2019, 34(3):99-104.
[9] ZHENG L, LI D, LI Z L, et al.Effects of Bacillus fermentation on the protein microstructure and anti-nutritional factors of soybean meal[J].Letters in Applied Microbiology, 2017, 65(6):520-526.
[10] CHANG M, LIAN J, LIU R J, et al.Production of yellow wine from Camellia oleifera meal pretreated by mixed cultured solid-state fermentation[J].International Journal of Food Science &Technology, 2014, 49(7):1715-1721.
[11] 黄浦, 肖瑜, 覃妍, 等.混菌发酵降解茶皂素的条件优化[J].环境科学与技术, 2016, 39(7):100-104;113.
HUANG P, XIAO Y, QIN Y, et al.Optimum conditions for mixed bacteria degradation on tea saponin[J].Environmental Science &Technology, 2016, 39(7):100-104;113.
[12] 刘以清, 肖瑜, 覃妍, 等.枯草芽孢杆菌液态发酵降解茶皂素[J].环境工程学报, 2016, 10(4):2023-2030.
LIU Y Q, XIAO Y, QIN Y, et al.Bacillus subtilis liquid fermentation and degradation of tea saponin[J].Chinese Journal of Environmental Engineering, 2016, 10(4):2023-2030.
[13] 黄浦, 肖瑜, 覃妍, 等.地衣芽孢杆菌降解茶皂素的研究[J].安徽大学学报(自然科学版), 2016, 40(1):91-97.
HUANG P, XIAO Y, QIN Y, et al.Study on the degradation of tea saponin by Bacillus licheniformis[J].Journal of Anhui University (Natural Science Edition), 2016, 40(1):91-97.
[14] LARSEN N, THORSEN L, KPIKPI E N, et al.Characterization of Bacillus spp.strains for use as probiotic additives in pig feed[J].Applied Microbiology and Biotechnology, 2014, 98(3):1105-1118.
[15] 王永伟, 宋丹, 李爱科, 等.发酵饲料资源开发及应用技术研究进展[J].中国饲料, 2019(11):75-80.
WANG Y W, SONG D, LI A K, et al.Fermentative feed resources:Development and application research[J].China Feed, 2019(11):75-80.
[16] 李龙, 仇薪鑫, 闫红军.肉鸡全价饲料发酵条件优化及其应用效果研究[J].饲料研究, 2019, 42(4):12-15.
LI L, QIU X X, YAN H J.Process optimization of solid-state fermentation of complete feed and its feeding value of broilers[J].Feed Research, 2019, 42(4):12-15.
[17] 田漫漫, 张进芳, 王秋萍, 等.正交试验优化密封加热浸提油茶饼粕中茶皂素工艺的研究[J].中国食品添加剂, 2017(10):61-65.
TIAN M M, ZHANG J F, WANG Q P, et al.Study on optimization of sealing heating extraction of tea saponin from tercake process by orthogonal test[J].China Food Additives, 2017(10):61-65.
[18] KHATRI D, CHHETRI S B B.Reducing sugar, total phenolic content, and antioxidant potential of Nepalese plants[J].BioMed Research International, 2020, 2020:1-7.
[19] WEN A Y, XIE C Z, MAZHAR M, et al.Tetramethylpyrazine from adlay (Coix lacryma-jobi) biotransformation by Bacillus subtilis and its quality characteristics[J].Journal of Food Science and Technology, 2020, 57(11):4092-4102.
[20] 任春春, 贾玉龙, 娄义龙, 等.贵州金佛山方竹笋营养及功能成分剖析[J].食品与发酵工业, 2021, 47(10):214-221.
REN C C, JIA Y L, LOU Y L, et al.Analysis of nutritional and functional components of bamboo shoots in Chimonobambusa utilis, Guizhou[J].Food and Fermentation Industries, 2021, 47(10):214-221.
[21] DUBOIS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[22] KUMARI B, TIWARI B K, HOSSAIN M B, et al.Ultrasound-assisted extraction of polyphenols from potato peels:Profiling and kinetic modelling[J].International Journal of Food Science &Technology, 2017, 52(6):1432-1439.
[23] JAVED M, BELWAL T, ZHANG R Y, et al.Optimization and mechanism of phytochemicals extraction from Camellia oleifera shells using novel biosurfactant nanobubbles solution coupled with ultrasonication[J].Food and Bioprocess Technology, 2022, 15(5):1101-1114.
[24] MEHMOOD T, SAEED S, HUSSAIN N, et al.Biotransformation of wheat straw into biovanillin by solid-state fermentation and optimization of conditions parameters through response surface methodology[J].Biomass Conversion and Biorefinery, 2022:1-10.
[25] FUKUNAGA N, WADA M, HONJO M, et al.Effects of temperature and salt on lipid and fatty acid compositions of a bacterium isolated from the bottom layer of lake vanda, Antarctica[J].The Journal of General and Applied Microbiology, 1995, 41(3):191-205.
[26] XIE Y H, PAN Y H, BAI B, et al.Degradation performance and optimal parameters of two bacteria in degrading nonylphenol[J].Journal of Computational and Theoretical Nanoscience, 2015, 12(9):2657-2663.
[27] 王留幸, 吴沐林, 周佳茵, 等.茶皂素对安徽白山羊断奶羔羊生长性能、血清指标及消化功能的影响[J].扬州大学学报(农业与生命科学版), 2022, 43(1):19-25;48.
WANG L X, WU M L, ZHOU J Y, et al.Effects of tea saponin on growth performance, serum index and digestive function of Anhui white goat lambs[J].Journal of Yangzhou University (Agricultural and Life Science Edition), 2022, 43(1):19-25;48.
[28] DAI C H, MA H L, HE R H, et al.Improvement of nutritional value and bioactivity of soybean meal by solid-state fermentation with Bacillus subtilis[J].LWT, 2017, 86:1-7.
[29] 管瑛, 汪瑨芃, 李文, 等.豆渣固态发酵过程中主要营养成分及抗氧化特性变化[J].食品科学, 2016, 37(21):189-194.
GUAN Y, WANG J P, LI W, et al.Changes in major nutritional components and antioxidant activity of fermented okara[J].Food Science, 2016, 37(21):189-194.
[30] YAO Y H, LI H Y, LI J, et al.Anaerobic solid-state fermentation of soybean meal with Bacillus sp.to improve nutritional quality[J].Frontiers in Nutrition, 2021, 8:706977.
[31] GILBERT E R, WONG E A, WEBB K E.Board-invited review:Peptide absorption and utilization:Implications for animal nutrition and health[J].Journal of Animal Science, 2008, 86(9):2135-2155.
[32] 王泽晗, 陶昱豪, 孙黎明, 等.苗族酸酢鱼发酵过程中微生物群落、氨基酸及水分动态变化规律[J].食品科学, 2021, 42(12):116-122.
WANG Z H, TAO Y H, SUN L M, et al.Dynamic changes of microbial community, amino acid composition and moisture distribution during the fermentation of Miao ethnic Suanzuo fish[J].Food Science, 2021, 42(12):116-122.
[33] CHEN X F, LU Y L, ZHAO A Q, et al.Quantitative analyses for several nutrients and volatile components during fermentation of soybean by Bacillus subtilis natto[J].Food Chemistry, 2022, 374:131725.
[34] WAGNER J R, GUÉGUEN J.Surface functional properties of native, acid-treated, and reduced soy glycinin.1.foaming properties[J].Journal of Agricultural and Food Chemistry, 1999, 47(6):2173-2180.
[35] XU L, DU B, XU B J.A systematic, comparative study on the beneficial health components and antioxidant activities of commercially fermented soy products marketed in China[J].Food Chemistry, 2015, 174:202-213.
[36] KHELIL O, CHOUBANE S, CHEBA B A.Polyphenols content of spent coffee grounds subjected to physico-chemical pretreatments influences lignocellulolytic enzymes production by Bacillus sp.R2[J].Bioresource Technology, 2016, 211:769-773.
[37] LUAN F, ZENG J S, YANG Y, et al.Recent advances in Camellia oleifera Abel:A review of nutritional constituents, biofunctional properties, and potential industrial applications[J].Journal of Functional Foods, 2020, 75:104242.