黑豆也被叫做黑大豆,是豆科大豆属植物大豆的黑色种子,含有丰富的蛋白质、脂肪、维生素、纤维素和微量元素,且热量较低,营养丰富,而且具有多种生理功能[1]。但是由于黑豆中含有植酸等抗营养因子,不仅会降低食物中营养物质的生物利用率,在一定程度上还可能会引起机体的不适[2]。发芽是一个可以有效改变黑豆营养品质的方法,研究表明,发芽过程中蛋白质、多糖和矿物质元素通过酶的活性被释放出来,同时植酸会被分解,从而使黑豆芽中的营养成分更好地被人体吸收和利用。目前用于刺激豆类萌发的物质有:萘乙酸、6-苄基腺嘌呤、多菌灵等,但大多被认为有较低毒性[3]。因此寻找新的安全无毒豆类萌发调节剂至关重要。
壳寡糖(chitooligosaccharides,COS)一般是指2~10个氨基葡萄糖以β-1,4糖苷键连接组成的低聚糖,具有来源广泛、水溶性好的优点,并且容易被吸收和利用,更为重要的是其具有抗炎、增强免疫力、抗肿瘤、抑菌和抗氧化等生理活性。因此,COS在保健食品、医疗、化妆品等领域有较好的应用前景[4]。另外,在农业领域,COS既可作为病原菌抑制剂,又可以促进植物生长[5]。
目前有关COS处理对黑豆萌发后的营养成分以及抗氧化活性的影响未见报道,因此本研究探讨COS浸泡处理对黑豆芽生产的促进作用,以期为改善豆芽生产中添加剂使用不合理的现象奠定基础。
1 材料与方法
1.1 材料与试剂
黑豆,市售;COS(食品级),浙江金壳药业有限公司;甲醇(色谱纯),上海西格玛奥德里奇贸易有限公司;其余试剂均为分析纯,上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
InfiniteF50酶标仪,瑞士Tecan公司;恒温恒湿培养箱,上海分析仪器制造有限公司;台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;PRIMA液相色谱仪,Hitachi公司;超级恒温槽,上海衡平仪器仪表厂。
1.3 实验方法
1.3.1 黑豆芽样品的制备
将1 500和3 000 Da的COS分别配制成0.001、0.01、0.1、1 μg/mL的溶液。精选黑豆用自来水洗净并晾干,称重得到初始质量,以料液比1∶8(g∶mL)分别添加不同分子质量、不同浓度的COS溶液后,置于25 ℃浸泡10 h。然后用自来水冲洗3遍后,30个黑豆一组置于铺有滤纸的平板中,同时在黑豆上覆盖纱布。将平板放置于恒温恒湿培养箱中,在25 ℃、相对湿度90%条件下培养72 h,在此期间每隔12 h补水并且清洗纱布,以防止腐烂。培养结束后黑豆芽鲜样置于4 ℃保存,取一部分鲜样置于烘箱60 ℃烘干至恒重,粉碎后过80目筛,即为干样。
1.3.2 黑豆芽生产性能的测定
以种子的胚根从种皮边缘突破2 mm为发芽判定依据,每24 h记录1次种子发芽数,并计算发芽率。
用吸水纸吸干黑豆芽表面的水分,用电子天平测量每组豆芽的总质量并计算平均值即为鲜重,单位为g。总产率为黑豆芽鲜重与原始黑豆质量的比值。
每组各挑选15个发育正常的黑豆芽,用软尺测量豆芽胚轴顶端至胚轴根部的长度。测量后取平均值,单位为cm。然后将此部分从豆芽中分离后称重,即为芽重,单位为g。
1.3.3 黑豆芽主要营养成分的测定
采用考马斯亮蓝G-250法[6],测定可溶性蛋白的含量。参考时宁宁等[7]的方法,测定植酸的含量。参照JAIN等[8]的方法,测定维生素C的含量。参照刘仙俊等[9]的方法对黑豆芽中的总多酚和总黄酮含量进行测定。
1.3.4 黑豆芽各组分多酚和黄酮含量的测定
使用体积分数1%甲醇盐酸溶液提取黑豆芽干样,离心取上清液,旋干,使用2 mL甲醇复溶,过0.22 μm有机滤膜。采用液相色谱对样品进行检测:ZORBAX SB-C18色谱柱(4.6 mm×150 mm×5 μm),柱温40 ℃,流速0.6 mL/min,进样体积10.0 μL,紫外检测波长254 nm;流动相为:(A)质量分数为0.1%甲酸溶液(B)甲醇;洗脱程序如下:0~50 min,流动相A从95%减少到70%,流动相B从5%增加到30%;50~75 min,流动相A从70%减少到0%,流动相B从30%增加到100%;75~76 min,流动相A从0%增加到95%,流动相B从100%减少到5%;76~86 min,流动相A保持95%,流动相B保持5%。
1.3.5 黑豆芽抗氧化活性的测定
参考刘仙俊等[9]的方法,分别测定黑豆芽提取液对DPPH自由基、·OH和H2O2的清除率。
1.4 数据处理
实验所有处理均重复3次,结果表示为平均值±标准差。数据统计分析采用SPSS 25进行分析,并使用Origin 2018进行绘图。
2 结果与分析
2.1 黑豆芽生产性能
COS作为一种激发子,可以与植物细胞上特定受体结合,激活细胞内某些酶的活性并引起信号转导,进而激活转录因子,调控相关基因的表达,从而活化植物细胞的生长,调节植物生长发育状态,提高产量[10]。本研究发现,使用COS浸泡处理黑豆后,黑豆吸水膨胀的速度加快,子叶突破种皮时间缩短,初始胚根萌发时间也明显提前,如图1所示,黑豆培养至24和48 h时,经过COS浸泡的黑豆发芽率明显高于对照组,并且2种分子质量的COS,均是随着浓度增加,处理组发芽率逐渐增加,达到0.01 μg/mL时,发芽率最高,继续增加浓度,发芽率反而降低;而在相同浓度的条件下,分子质量较低的COS处理效果明显好于分子质量高的COS,可能是因为其更易被细胞表面受体识别。其中,以分子质量1 500 Da、质量浓度为0.01 μg/mL的COS效果最好,24 h时发芽率为41.46%,48 h时为86.07%,分别是对照组的2.3和1.5倍。黑豆培养到72 h,尽管经过COS处理的黑豆发芽率仍高于对照组,但是各处理之间差异并不显著。

图1 壳寡糖对黑豆发芽率的影响
Fig.1 Effects of COS on germination rate of black beans
注:每个柱状图上不同小写字母表示在0.05水平上有差异(P<0.05)(下同)。0为对照组;1 500-0.001为分子质量为1 500 Da,质量浓度为0.001 μg/mL的COS处理组;1 500-0.01为分子质量为1 500 Da,质量浓度为0.01 μg/mL的COS处理组;1 500-0.1为分子质量为1 500 Da,质量浓度为0.1 μg/mL的COS处理组;1 500-1为分子质量为1 500 Da,质量浓度为1 μg/mL的COS处理组;3 000-0.001为分子质量为3 000 Da,质量浓度为0.001 μg/mL的COS处理组;3 000-0.01为分子质量为3 000 Da,质量浓度为0.01 μg/mL的COS处理组;3 000-0.1为分子质量为3 000 Da,质量浓度为0.1 μg/mL的COS处理组;3 000-1为分子质量为3 000 Da,质量浓度为1 μg/mL的COS处理组(下同)。
不同处理黑豆发芽72 h后,测定了黑豆芽的鲜重、总产率以及芽长和芽重(表1)。COS处理的黑豆发芽后其鲜重、总产率及芽长和芽重均有明显的增加。无论何种分子质量,随着COS浓度的增加,黑豆芽各项指标均增加;当COS质量浓度达到0.01 μg/mL时,4个指标分别达到最大值,继续增大COS的浓度,4个指标均逐渐下降。当浓度相同时,分子质量1 500 Da的COS对黑豆芽的促进效果优于分子质量3 000 Da的COS。其中,效果最好的是1 500-0.01处理组,黑豆芽鲜重、总产率及芽长和芽重分别较对照组提高了30.81%、38.50%、42.47%和41.90%。在豆芽生产中,鲜重和总产率是提升利润的关键,而芽长和芽重又是评判一个豆芽品质的标准。COS在豆芽生长中可以作为非生物激活子促进黑豆的萌发,使得初始萌发时间提前,萌发更加充分,进而黑豆芽的鲜重、总产率以及芽长和芽重均表现出明显增加。
表1 壳寡糖对黑豆芽生产性能的影响
Table 1 Effects of COS on production performance of black bean sprouts
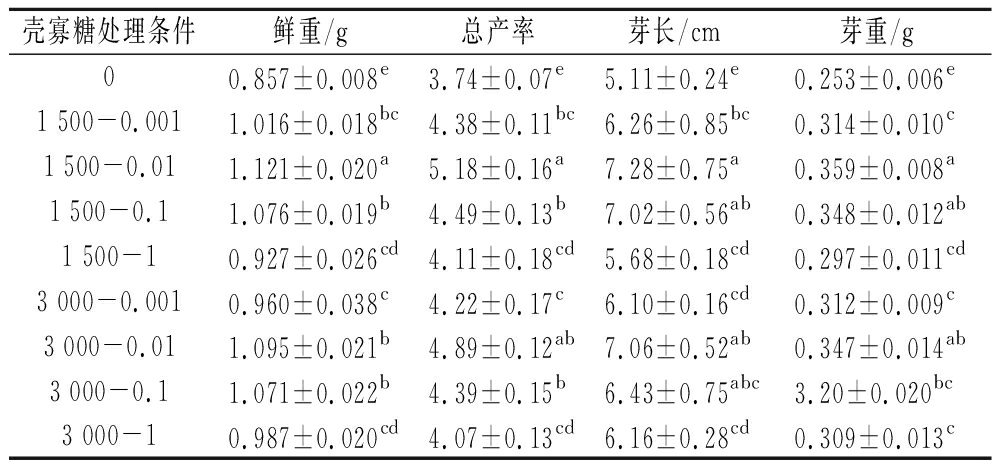
壳寡糖处理条件鲜重/g总产率芽长/cm芽重/g00.857±0.008e3.74±0.07e5.11±0.24e0.253±0.006e1 500-0.0011.016±0.018bc4.38±0.11bc6.26±0.85bc0.314±0.010c1 500-0.011.121±0.020a5.18±0.16a7.28±0.75a0.359±0.008a1 500-0.11.076±0.019b4.49±0.13b7.02±0.56ab0.348±0.012ab1 500-10.927±0.026cd4.11±0.18cd5.68±0.18cd0.297±0.011cd3 000-0.0010.960±0.038c4.22±0.17c6.10±0.16cd0.312±0.009c3 000-0.011.095±0.021b4.89±0.12ab7.06±0.52ab0.347±0.014ab3 000-0.11.071±0.022b4.39±0.15b6.43±0.75abc3.20±0.020bc3 000-10.987±0.020cd4.07±0.13cd6.16±0.28cd0.309±0.013c
注:数据后同列不同小写字母表示在 0.05 水平上有差异(P<0.05)(下同)。
2.2 可溶性蛋白含量
黑豆蛋白质含量十分丰富,是人们获取植物蛋白的重要来源,而在发芽过程中黑豆中的酶系会被激活而将大分子蛋白水解为小分子的可溶性蛋白等,从而更容易被人体吸收利用[11]。通过图2可以看出,经过COS处理后的黑豆芽可溶性蛋白的含量相较于对照组均有所提高。2种分子质量的COS促进效果都随着浓度升高而增大,到0.01 μg/mL时达到最高,浓度继续升高,促进效果下降;而在相同浓度条件下,分子质量1 500 Da的COS效果更好。其中,分子质量为1 500 Da,质量浓度为0.01 μg/mL处理组,含量最高为86.70 mg/g鲜样,比对照组提高了25.99%,并且经过SPSS数据分析可以看出,所有的处理组可溶性蛋白的含量都显著高于对照组。COS在黑豆萌发过程中对可溶性蛋白的转化合成起到一定的促进作用,这一结论也与其他人的研究一致,如狄文伟[12]使用COS喷洒黄瓜幼苗叶片,发现黄瓜中可溶性蛋白的含量最高可以提高39.29%。

图2 壳寡糖对黑豆芽可溶性蛋白含量的影响
Fig.2 Effects of COS on soluble protein content of black bean sprouts
2.3 植酸含量
植酸又被称作肌醇六磷酸,是豆类中的主要成分之一。有研究表明植酸会与消化道中的铁、镁等必需矿物质结合,进而抑制人体对后者的吸收[13]。在豆类发芽过程中,其植酸酶会被激活从而将部分植酸水解为低级的肌醇磷酸,从而有效地降低豆芽中植酸的含量。由图3可知,经过COS处理的黑豆在发芽之后植酸的含量会显著下降,并且均低于对照组。对照组植酸含量为11 mg/(g干样),这与李圆圆等[14]所测得数据相近。随着COS浓度的上升,黑豆芽中的植酸含量逐渐下降,当达到0.01 μg/mL时,黑豆芽植酸含量最低,而且分子质量低的COS效果更好。其中,分子质量1 500 Da,0.01 μg/mL处理组植酸含量最低,为5.99 mg/g干样,相比于对照组下降了45.49%。此结果远高于郭世豪等[3]使用壳聚糖浸泡处理后黑豆芽中植酸下降的11.96%,由此可见,COS对降低黑豆芽中植酸含量的作用效果要优于壳聚糖。

图3 壳寡糖对黑豆芽植酸含量的影响
Fig.3 Effects of COS on phytic acid content of black bean sprouts
2.4 维生素C含量
维生素C在人体胶原蛋白合成过程中起着重要作用,而且人类自身无法合成维生素C,需要外源补充。豆类在萌发过程中,参与维生素C合成的酶类会被激活,从而使豆芽中的维生素C含量不断增加。如图4所示,经过COS处理的黑豆在发芽之后维生素C的含量均高于对照组,而且分子质量为1 500 Da的COS处理组效果较好。其中分子质量为1 500 Da时,质量浓度为0.01 μg/mL处理组维生素C含量最高,达到54.66 mg/(g鲜样),比对照组提高了76.46%。2种分子质量的COS在质量浓度低于或者高于0.01 μg/mL时,促进效果均降低。经过SPSS数据分析,所有处理组维生素C含量都显著高于对照组。有研究表明COS能提高植物中维生素C含量,如HE等[15]在草莓采摘前喷施COS,草莓中的维生素C含量相比于对照组提升了20.02%。

图4 壳寡糖对黑豆芽维生素C含量的影响
Fig.4 Effects of COS on soluble vitamin C content of black bean sprouts
2.5 总多酚含量
多酚类化合物是一种具有抗氧化、抗肿瘤、提高免疫力、清除体内自由基等功效的活性物质[16]。豆芽中富含天然的多酚,因此多酚含量也可以作为评判豆芽好坏的一种指标。由图5可以看出,COS处理后的黑豆芽其总多酚含量均高于对照组,且变化趋势与前面测定的维生素C类似。其中分子质量为1 500 Da时,质量浓度为0.01 μg/mL处理组的含量最高,为30.10 mg GAE/g 干样,相比对照组增加了23.68%。经过SPSS数据分析,所有处理组的总多酚含量均显著高于对照组。

图5 壳寡糖对黑豆芽总多酚含量的影响
Fig.5 Effects of COS on total polyphenols content of black bean sprouts
2.6 总黄酮含量
黄酮是有效的防癌药物,可有效降低各种癌症的患病风险,而种子萌发可以增加其中黄酮类化合物的含量[17]。与总多酚含量类似(图6),经过COS处理的黑豆芽总黄酮含量均高于对照组,而且2种分子质量的COS在浓度相同的条件下作用效果类似。其中分子质量为1 500 Da时,质量浓度为0.01 μg/mL处理组效果最好,为5.94 mg/(g干样)。经过SPSS数据分析,所有经过COS处理的黑豆芽总黄酮含量均显著高于对照组。因此,COS可以有效提高黑豆芽中总黄酮的含量,提升黑豆芽的营养品质。TANG等[18]的研究也证明了COS可以有效地提升黄豆芽中总黄酮的含量。

图6 壳寡糖对黑豆芽总黄酮含量的影响
Fig.6 Effects of COS on total flavonoid content of black bean sprouts
2.7 各组分多酚含量
为了进一步验证COS对黑豆芽中多酚和黄酮类物质含量的影响,选取效果最明显的2组,即分子质量为1 500 Da,质量浓度为0.01 μg/mL的COS和分子质量为3 000 Da,质量浓度为0.01 μg/mL的COS处理黑豆后,测定黑豆芽中已知的6种多酚类和6种黄酮类化合物的含量。
选取没食子酸、原儿茶酸、对羟基苯甲酸、阿魏酸、肉桂酸和香草酸为研究对象。表2为质量浓度为0.01 μg/mL的2种分子质量COS处理后的黑豆芽中6种多酚的含量变化。经过COS处理后,6种多酚的含量相较于对照组均有显著提高,并且分子质量小的COS处理效果更好。其中,经过1 500-0.01 COS处理后的黑豆芽原儿茶酸含量提升的最多,相比对照组提高了33.72%,其次是香草酸,提高了28.90%,没食子酸、对羟基苯甲酸、阿魏酸和肉桂酸也分别提高了18.26%、28.78%、14.12%和19.50%。因此,COS在增加豆芽中的酚类次生代谢物方面非常有效,且结果与总多酚的测定结果一致。
表2 壳寡糖处理对黑豆芽中6种多酚含量的影响 单位:mg/(g干样)
Table 2 Effects of COS treatments on the concentration of six polyphenols in black bean sprouts
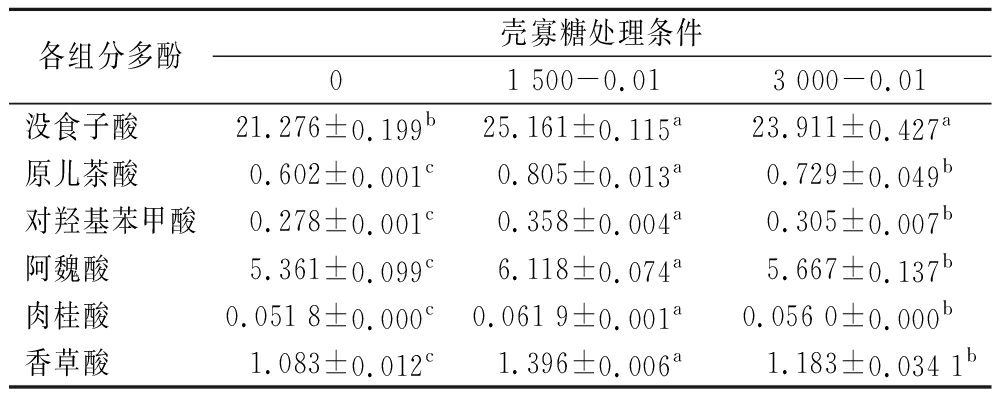
各组分多酚壳寡糖处理条件01 500-0.013 000-0.01没食子酸21.276±0.199b25.161±0.115a23.911±0.427a原儿茶酸0.602±0.001c0.805±0.013a0.729±0.049b对羟基苯甲酸0.278±0.001c0.358±0.004a0.305±0.007b阿魏酸5.361±0.099c6.118±0.074a5.667±0.137b肉桂酸0.051 8±0.000c0.061 9±0.001a0.056 0±0.000b香草酸1.083±0.012c1.396±0.006a1.183±0.034 1b
2.8 各组分黄酮含量
大豆异黄酮主要以两种形式存在:苷元(染料木素、大豆苷元和黄豆黄素)和不同类型的糖苷(染料木苷、大豆苷和黄豆黄苷)。表3是质量浓度为0.01 μg/mL的2种分子质量COS处理后的黑豆芽中6种黄酮的含量变化。经过COS处理后的黑豆芽6种黄酮含量相较于对照均有所提高,并且分子质量1 500 Da的COS效果好于分子质量3 000 Da的COS,这与总黄酮含量的测定结果一致。其中1 500-0.01处理组染料木素的提升量最多,比对照组提高了27.59%,而大豆苷、黄豆黄苷、染料木苷、大豆苷元和黄豆黄素也分别比对照组提高了12.07%、7.22%、10.49%、9.87%和16.53%。实验数据证明COS对黑豆芽中多种黄酮成分的合成也具有显著的促进作用,并且所测得数据与PENG等[19]的结果类似。
表3 壳寡糖处理对黑豆芽中6种黄酮含量的影响 单位:mg/(g干样)
Table 3 Effects of COS treatments on the concentration of six flavonoids in black bean sprouts
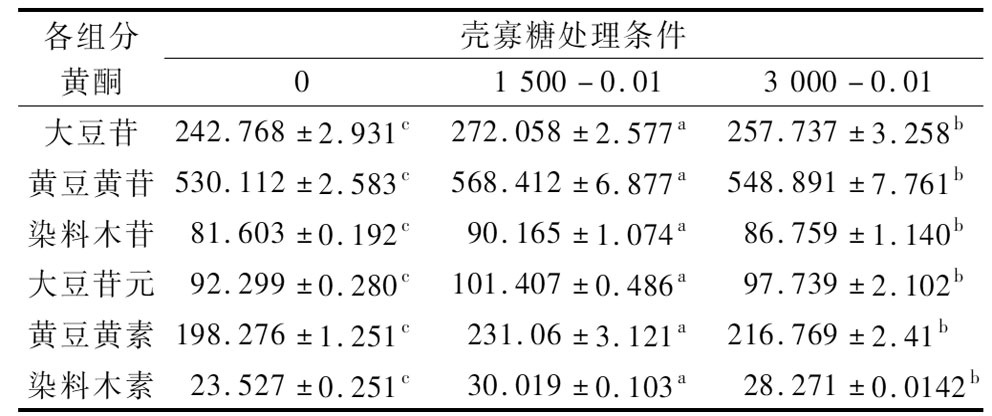
各组分黄酮壳寡糖处理条件01 500-0.013 000-0.01大豆苷242.768±2.931c272.058±2.577a257.737±3.258b黄豆黄苷530.112±2.583c568.412±6.877a548.891±7.761b染料木苷81.603±0.192c90.165±1.074a86.759±1.140b大豆苷元92.299±0.280c101.407±0.486a97.739±2.102b黄豆黄素198.276±1.251c231.06±3.121a216.769±2.41b染料木素23.527±0.251c30.019±0.103a28.271±0.0142b
2.9 DPPH自由基清除率
维生素C、多酚和黄酮作为黑豆芽中的主要的抗氧化物质,其含量在COS处理后有了明显提高,因此推测黑豆芽的抗氧化活性可能会提高。其中,对DPPH自由基的清除能力常被用来评价物质的抗氧化能力。从图7可以看出,经过COS处理后的黑豆芽对DPPH自由基清除率较对照组均有所提升,且影响效果与COS浓度和分子质量有关。随着COS浓度的增加,DPPH自由基清除率表现为先上升后下降,质量浓度为0.01 μg/mL时最大,同时分子质量较小的COS处理后的黑豆芽对DPPH自由基清除率更高。其中,分子质量为1 500 Da时,质量浓度为0.01 μg/mL处理组对DPPH自由基清除率最高,达到了47.00%,而对照组对DPPH自由基清除率为34.53%,与张桂芳等[20]所做实验结果类似。因此,COS处理可以有效提高黑豆芽对DPPH自由基清除率。

图7 壳寡糖对黑豆芽DPPH清除率的影响
Fig.7 Effects of COS on DPPH scavenging rate of black bean sprouts
2.10 ·OH清除率
·OH具有极强的氧化能力,是细胞产生的对人体健康有害的一种活性氧物质。植物中含有的维生素C、黄酮、多酚等生理活性物质对·OH有一定的清除作用[21],从图8可以看出,经过COS处理的黑豆芽对·OH的清除率均高于对照组,且与DPPH自由基清除率变化规律一致。其中分子质量为1 500 Da时,质量浓度为0.01 μg/mL处理组·OH清除率最高,为83.58%,比对照组提高了18.43%。经过SPSS数据分析,所有处理组的清除率均显著高于对照组。TANG等[18]的实验也证明了COS浸泡处理黄豆,能显著提高黄豆芽的·OH清除率。

图8 壳寡糖对黑豆芽·OH清除率的影响
Fig.8 Effects of COS on ·OH scavenging rate of black bean sprouts
2.11 H2O2清除率
H2O2是一种强氧化剂,通过检测黑豆芽提取液对它的清除率可以很好地反映豆芽的抗氧化活性。由图9可知,经过COS处理的黑豆发芽后对H2O2的清除率均高于对照组,并且相对于分子质量而言,COS浓度的影响较大,在相同浓度下,2种分子质量的COS的作用效果差异不大。其中分子质量为1 500 Da时,质量浓度为0.01 μg/mL处理组效果最好,为67.07%,比对照提高了14.08%。通过SPSS数据分析,所有处理组的H2O2清除率都显著高于对照组。H2O2清除率的提升与豆芽中H2O2酶的活力有关,因此推测COS在黑豆发芽过程中会促进过氧化氢酶的合成,进而提高黑豆芽对于H2O2的清除率。

图9 壳寡糖对黑豆芽H2O2清除率的影响
Fig.9 Effects of COS on H2O2 scavenging rate of black bean sprouts
3 结论与讨论
本实验通过不同分子质量、不同浓度的COS浸泡处理黑豆后,测定了萌发的黑豆芽生长状况、豆芽中营养成分的含量以及其抗氧化活性。研究发现,经过COS处理后的黑豆芽初始萌发时间提前,萌发更加充分,因此鲜重和总产率明显提高,芽长和芽重也显著增加。这与市场所需的优质豆芽条件是相吻合的,在保障质量的前提下使用COS处理的豆芽更长并且重量更大。同时COS作为功能性食品无毒,对人体安全。另外,仅仅在浸泡黑豆的过程中添加少量的COS便可起到这种作用,有利于降低工业生产中的成本。
与此同时,黑豆发芽过程中会将自身大分子营养物质在一系列酶的催化下转化为小分子,COS在其中起到了激发子的作用。经过COS处理的黑豆芽中可溶性蛋白的含量明显增加。同时,COS还促进了黑豆芽中植酸的消耗,因为这种抗营养因子不仅不利于人体对营养物质的利用,而且过多食用会使人腹胀气。因此经过COS处理的黑豆芽的品质也得到了提升。此外,COS作为一种非生物激发子,会激活黑豆中某些酶活性,从而提高植物中的抗氧化物质(维生素C、黄酮和多酚)的含量,同时通过信号转导途径激活转录因子,进而提高抗氧化酶的表达水平。最终表现为黑豆芽的抗氧化活性(DPPH自由基清除率、·OH清除率和H2O2清除率)显著提高,黑豆芽营养价值进一步提升。
综上所述,COS在黑豆发芽过程中的使用,可以刺激黑豆萌发并提高黑豆芽产量,增加其营养物质以及降低抗营养因子的含量,同时提高其抗氧化物质含量和抗氧化活性。其中分子质量和剂量是关键影响因素,最终结果表明1 500 Da、质量浓度为0.01 μg/mL的COS处理效果最好。下一步将采用转录组学和蛋白质组学相关技术深入探讨COS在黑豆芽生长和营养物质转变过程中的作用机理,以期为COS的广泛应用提供理论基础。
[1] GANESAN K, XU B J.A critical review on polyphenols and health benefits of black soybeans[J].Nutrients, 2017, 9(5):455.
[2] URBANO G, L PEZ-JURADO M, ARANDA P, et al.The role of phytic acid in legumes:Antinutrient or beneficial function?[J].Journal of Physiology and Biochemistry, 2000, 56(3):283-294.
PEZ-JURADO M, ARANDA P, et al.The role of phytic acid in legumes:Antinutrient or beneficial function?[J].Journal of Physiology and Biochemistry, 2000, 56(3):283-294.
[3] 郭世豪, 杨睿, 修丽丽, 等.壳聚糖浸泡对黑豆芽品质的影响[J].核农学报, 2018, 32(11):2 147-2 154.
GUO S H, YANG R, XIU L L, et al.Effects of chitosan soaking on the quality of black bean sprouts[J].Journal of Nuclear Agricultural Sciences, 2018, 32(11):2 147-2 154.
[4] BENCHAMAS G, HUANG G L, HUANG S Y, et al.Preparation and biological activities of chitosan oligosaccharides[J].Trends in Food Science &Technology, 2021, 107:38-44.
[5] YIN H, FRETTÉ X C, CHRISTENSEN L P, et al.Chitosan oligosaccharides promote the content of polyphenols in Greek oregano (Origanum vulgare ssp.hirtum)[J].Journal of Agricultural and Food Chemistry, 2012, 60(1):136-143.
[6] 刘志国. 生物化学实验[M].武汉:华中科技大学出版社, 2007.
LIU Z G.Biochemical Experiment[M].Wuhan:Huazhong University of Science and Technology Press, 2007
[7] 时宁宁, 阮长青, 李志江, 等.超声辅助法提取黑豆中植酸工艺的研究[J].中国粮油学报, 2021, 36(6):129-135.
SHI N N, RUAN C Q, LI Z J, et al.Ultrasonic-assisted extraction of phytic acid from black bean[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(6):129-135.
[8] JAIN S K, KHURDIYA D S.Vitamin C enrichment of fruit juice based ready-to-serve beverages through blending of Indian gooseberry (Emblica officinalis Gaertn.) juice[J].Plant Foods for Human Nutrition, 2004, 59(2):63-66.
[9] 刘仙俊, 张慧珍, 王潇潇, 等.5种豆类中总多酚、总黄酮含量及抗氧化活性比较研究[J].食品研究与开发, 2020, 41(7):52-57.
LIU X J, ZHANG H Z, WANG X X, et al.Comparative study on total polyphenols, total flavonoids and antioxidant activity in five kinds of legumes[J].Food Research and Development, 2020, 41(7):52-57.
[10] 张付云, 赵小明, 白雪芳, 等.壳寡糖诱导植物抗病性研究进展[J].中国生物防治, 2008, 24(2):174-178.
ZHANG F Y, ZHAO X M, BAI X F, et al.Research progress on plant disease resistance induced by chitosan oligosaccharide[J]. Chinese Journal of Biological Control, 2008, 24(2):174-178.
[11] XUE Z H, WANG C, ZHAI L J, et al.Bioactive compounds and antioxidant activity of mung bean (Vigna radiata L.), soybean (Glycine max L.) and black bean (Phaseolus vulgaris L.) during the germination process[J].Czech Journal of Food Sciences, 2016, 34(1):68-78.
[12] 狄文伟. 不同分子量壳寡糖对黄瓜穴盘苗生长的影响[J].江苏农业科学, 2016, 44(4):196-198.
DI W W.Effects of chitosan oligosaccharides with different molecular weight on the growth of cucumber plug seedlings[J].Jiangsu Agricultural Sciences, 2016, 44(4):196-198.
[13] NISSAR J, AHAD T, NAIK H R, et al.A review phytic acid:As antinutrient or nutraceutical[J].Journal of Pharmacognosy and Phytochemistry, 2017, 6(6):1 554-1 560.
[14] 李圆圆, 田晨颖, 刘晓美, 等.添加微量元素对黑豆发芽过程中成分的影响[J].食品工业科技, 2019, 40(9):98-104.
LI Y Y, TIAN C Y, LIU X M, et al.Effects of trace elements addition on components in germination of black beans[J].Science and Technology of Food Industry, 2019, 40(9):98-104.
[15] HE Y Q, BOSE S K, WANG W X, et al.Pre-harvest treatment of chitosan oligosaccharides improved strawberry fruit quality[J].International Journal of Molecular Sciences, 2018, 19(8):2194.
[16] ABBAS M, SAEED F, ANJUM F M, et al.Natural polyphenols:An overview[J].International Journal of Food Properties, 2017, 20(8):1 689-1 699.
[17] KUMARI S, KRISHNAN V, SACHDEV A.Impact of soaking and germination durations on antioxidants and anti-nutrients of black and yellow soybean (Glycine max.L) varieties[J].Journal of Plant Biochemistry and Biotechnology, 2015, 24(3):355-358.
[18] TANG W Z, LEI X T, LIU X Q, et al.Nutritional improvement of bean sprouts by using chitooligosaccharide as an elicitor in germination of soybean (Glycine max L.)[J].Applied Sciences, 2021, 11(16):7695.
[19] PENG H, LI W T, LI H Y, et al.Extractable and non-extractable bound phenolic compositions and their antioxidant properties in seed coat and cotyledon of black soybean (Glycine max (L.) Merr)[J].Journal of Functional Foods, 2017, 32:296-312.
[20] 张桂芳, 张东杰, 鹿保鑫, 等.不同萌发时间黑豆芽总黄酮含量及DPPH自由基清除能力的测定[J].食品科技, 2020, 45(12):39-45.
ZHANG G F, ZHANG D J, LU B X, et al.Determination of total flavonoid content and DPPH free radical scavenging ability of black bean sprouts at different germination times[J].Food Science and Technology, 2020, 45(12):39-45.
[21] ASADUZZAMAN M.Phytochemicals-Source of Antioxidants and Role in Disease Prevention[M].London:IntechOpen, 2018.