肉桂精油是从肉桂叶和树皮中提取的次级代谢产物,呈黄色黏性状,含有肉桂醛、香芹酚、香叶醇、芳樟醇及α-水芹烯等一系列活性物质,具有抑菌、抗氧化、消炎镇痛、抑制癌细胞生长繁殖等多种生理功能[1]。肉桂精油作为一种天然防腐剂,对食源性致病菌和腐败菌(大肠杆菌、假单胞菌属、沙门氏菌等)的生长表现出良好的抑制作用,此外,精油中的烯萜类、醛类等活性成分亦赋予其较强的抗氧化活性[2]。然而,肉桂精油稳定性和水溶性差、对环境敏感以及伴有强烈的气味,限制了其应用范围[3]。
脂质体是由磷脂分子在水溶性中形成具有双分子层结构的闭合囊泡,可同时包裹疏水性和亲水性物质,具有生物相容性、两亲性、缓释等优点,在食品、医药、化妆品等领域有重要应用前景[4]。作为一种运载体系,脂质体不仅可增强被包封物质的稳定性,还可延长活性物质在体内的保留时间,达到缓释作用。将精油制备成脂质体这一载体形式,不仅可有效降低环境因素(如氧气、光、温度等)对肉桂精油的不利影响,还可掩盖精油的刺激性气味,提高感官属性和精油的生物利用度。
近年来,随着研究的不断深入,学者们对精油脂质体的研究逐步展开。例如,刘玉兰[5]采用乙醇注入法制备了肉桂醛脂质体,通过考察保留率、粒径等理化指标,证明了脂质体的稳定性。李伟[6]通过薄膜超声分散法将肉桂精油/β-环糊精包合物包封于脂质体内,再通过冻融方法制得包埋肉桂精油/β-环糊精的蛋白脂质体,通过体外释放证实了蛋白脂质体运载体系具有控释抗菌作用。高压微射流均质技术制备的脂质体具有粒径小、分散均匀且避免使用有毒试剂的特点,但目前关于采用该技术优化制备肉桂精油脂质体的报道尚未出现。鉴于此,本研究采用薄膜分散-高压均质法制备肉桂精油脂质体,以包埋率和平均粒径为指标对制备工艺进行优化,并对其zeta电位、形貌、热稳定性、红外光谱、体外释放及抑菌性能等理化性质进行考察。研究旨在开发一种包埋率较高、稳定性好、缓释效果好的脂质体运载体系,以扩大肉桂精油的应用范围。
1 材料与方法
1.1 材料与试剂
肉桂精油(纯度85%),上海源叶有限公司;蛋黄卵磷脂(纯度90%)、胆固醇(纯度95%)、吐温-80,上海生工生物工程股份有限公司;磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.2),北京索莱宝科技有限公司;大肠杆菌(ATCC 25922)、金黄色葡萄球菌(ATCC 6538),嘉楚生物工程有限公司。
1.2 主要仪器设备
Nano-ZS马尔文分析仪,英国马尔文仪器有限公司;3001-2207酶标仪,美国赛默飞有限公司;AH-BASIC高压均质机,安拓思纳米技术有限公司;RCD-1A高速均质机,常州越新仪器制造有限公司;Nicolet IS 10傅里叶红外色谱仪,赛默飞世尔科技有限公司;Q200MDSC差示扫描量热仪,美国TA公司;59750气相质谱联用仪,美国Agilent公司。
1.3 实验方法
1.3.1 肉桂精油脂质体的制备
将一定比例的蛋黄卵磷脂、胆固醇、吐温-80、肉桂精油溶于25 mL无水乙醇中,溶解混匀后转移至圆底烧瓶中,置旋转蒸发仪上减压蒸发(45 ℃,40 r/min),除去有机溶剂,形成脂质薄膜,再加入PBS超声水化得到悬浊液,然后利用高速分散机在10 000 r/min下剪切2 min,最后在60 MPa高压均质下循环3~4次得到肉桂精油脂质体。
1.3.2 单因素试验设计
分别探究:(1)在胆固醇与肉桂精油、吐温-80质量比为1∶1∶1的条件下,磷脂与胆固醇质量比(1∶1、2∶1、3∶1、4∶1、5∶1、6∶1);(2)在磷脂与胆固醇、吐温-80质量比为4∶1∶1的条件下,肉桂精油质量浓度(1、1.5、2、2.5、3、3.5 mg/mL);(3)在磷脂与胆固醇、精油质量比为4∶1∶1条件下,吐温-80质量浓度(1、1.5、2、2.5、3、3.5 mg/mL);(4)在磷脂与胆固醇、精油、吐温-80质量比为4∶1∶1∶1的条件下,PBS用量(20、30、40、50、60、70 mL)对肉桂精油脂质体平均粒径和包埋率的影响。单因素试验优化某一参数时,分别固定磷脂与胆固醇质量比4∶1(磷脂质量浓度为10 mg/mL,胆固醇质量浓度为2.5 mg/mL),肉桂精油质量浓度2.5 mg/mL,吐温-80质量浓度2.5 mg/mL,PBS用量40 mL。
1.3.3 响应面优化试验设计
根据单因素试验结果,筛选出磷脂与胆固醇质量比(A)、肉桂精油质量浓度(B)、吐温-80质量浓度(C)作为考察对象,包埋率(Y)为因变量,利用Box-Behnken设计对肉桂精油脂质体的制备工艺参数进行优化,试验因素及编号见表1。
表1 试验因素水平表
Table 1 Table of test factor levels

因素水平-101A磷脂与胆固醇质量比3∶14∶15∶1B肉桂精油质量浓度/(mg/mL)22.53C吐温-80质量浓度/(mg/mL)22.53
1.3.4 肉桂精油脂质体理化性质的表征
1.3.4.1 肉桂精油包埋率的测定
肉桂精油标准曲线的制备:精密称取肉桂精油100 mg置100 mL容量瓶中,无水乙醇稀释定容制得1 mg/mL母液。取母液分别配制100、80、60、40、20、10 μg/mL系列溶液,以无水乙醇为空白参比,在290 nm波长下测吸光度,计算得到标准曲线为:y=0.008 4x+0.066 7,R2=0.998 4,该范围内线性较好。
参考李畅等[7]的方法稍作修改,取1 mL脂质体于10 mL的离心管中,加4 mL石油醚,涡旋混匀后离心(6 000 r/min,10 min),收集上清液,重复操作2次后合并有机相,无水乙醇定容至25 mL,在290 nm处测定吸光度,按上述标准曲线计算游离精油含量A1。另取1 mL脂质体,用无水乙醇稀释定容至25 mL,水浴超声1 h,测定吸光度值并计算肉桂精油总含量A2,按公式(1)得出包封率:
(1)
式中:EE,肉桂精油包埋率,%;A1,游离肉桂精油含量,mg;A2,肉桂精油总含量,mg。
1.3.4.2 透射电镜(transmission electron microscope,TEM)
参考CHAVES等[8]的方法,将少量肉桂精油脂质体滴加于100目铜网上,自然风干后用10 g/L磷钨酸进行负染,晾干后进行TEM分析。
1.3.4.3 粒径、聚合物分散性指数(polymer dispersity index,PDI)及zeta电位的测定
参考郝静梅等[9]的方法,样品用超纯水稀释100倍后,采用马尔文分析仪测定其平均粒径、PDI及zeta电位。
1.3.4.4 差示扫描量热分析(differential scanning calorimetry,DSC)
参考顾家毓等[10]的方法,取5 mg经干燥的样品置于坩埚中,以空白坩埚为对照,N2为载气,10 ℃/min速度从25 ℃加热至100 ℃,研究分析脂质体的热至相变情况。
1.3.4.5 傅里叶红外光谱分析(Fourier transform infrared spectrometer,FTIR)
参考ZHANG等[11]的方法,将样品与KBr混匀压片后,在4 000~500 cm-1红外波段内对肉桂精油、肉桂精油脂质体进行光谱分析。
1.3.4.6 体外释放分析
采用透析法[12]进行,取2 mL脂质体于透析袋(14 ku)中,置于100 mL PBS中并在25 ℃下连续振荡(200 r/min),分别在0.5、2、4、6、8、12、24、36、48、60、72 h定时取样,同时补充等量缓冲液,在290 nm处测定吸光度,计算肉桂精油累计释放量,并对体外释放结果进行动力学拟合分析。
1.3.4.7 肉桂精油脂质体抑菌性能分析
将大肠杆菌和金黄色葡萄球菌活化后,加7.5 g/L生理盐水稀释菌悬液,分别取4 mL肉桂精油脂质体和10 g/L吐温-80稀释的肉桂精油溶液于不同菌悬液中,体积分数为40%,37 ℃振荡培养,每隔1 d取样进行菌落计数。
1.3.5 数据处理与分析
采用Design-Expert 8.0.6.1进行响应面设计与分析,Origin 2018进行数据处理。
2 结果与分析
2.1 单因素试验结果
2.1.1 蛋黄卵磷脂与胆固醇质量比
胆固醇是类脂质的主要成分,常作为脂质体的稳定剂[13],在适宜的浓度下,亲水性羟基基团与磷脂分子极性基团形成氢键,利用氢键间相互作用来调解脂膜的刚性和致密性,能极大地稳定脂质体结构,进而稳定脂质体的负载能力。图1-a结果显示,随着磷脂与胆固醇质量比的增大,包埋率显著增加后降低,平均粒径先减小后增加,当质量比为4∶1时,包埋率达最大(76.23%),平均粒径最小(91.18 nm)。脂质体的浓度与其负载能力均会影响精油的包埋率,当磷脂与胆固醇质量比增加时,形成的脂质体分子增多且平均粒径逐渐减小,结构逐渐趋于稳定,导致包埋率显著增大。当质量比大于4∶1后,包埋率反而呈下降趋势,且平均粒径逐渐增大,这是由于磷脂浓度过高影响了脂质体膜的形成,降低了脂质体电荷之间的静电排斥作用,聚集现象出现导致粒径增大[14],此时的脂质体浓度高但体系不稳定,精油泄露,负载能力显著减弱,致使包埋率降低。本试验研究结果与前人研究结果相似[15]。综合考虑确定磷脂与胆固醇的最佳质量比为4∶1,此时包埋率最大、粒径最小、负载能力较好。

a-磷脂与胆固醇质量比;b-肉桂精油质量浓度;c-吐温-80质量浓度;d-PBS用量
图1 磷脂与胆固醇质量比、肉桂精油质量浓度、吐温-80质量浓度和PBS用量对肉桂精油脂质体包埋率、平均粒径的影响
Fig.1 Effects of mass ratio of phospholipid to cholesterol, mass concentration of cinnamon essential oil, mass concentration of tween 80 and PBS dosage on the embedding efficiency and average particle size of cinnamon essential oil liposomes
2.1.2 肉桂精油质量浓度
图1-b结果表明,肉桂精油质量浓度从1 mg/mL增加到2.5 mg/mL,包埋率从62.48%增加到最大(81.26%),当精油质量浓度超过2.5 mg/mL时,包埋率逐渐降低,证明肉桂精油浓度过低或过高均不利于精油脂质体的形成,同时磷脂形成的脂质体具有一定的空间承载能力[16]。当肉桂精油浓度较低时,包埋率偏低,这可能是精油在低浓度下与脂质体体系接触机率较少所致;随着肉桂精油添加量增多,接触机率增加,包埋率随之增加;当添加量超过脂质体的负载能力时,再添加更多肉桂精油,亦不能被包埋于脂质体,最终导致包埋率降低。而平均粒径随肉桂精油浓度的增加先降低后逐渐增大,当肉桂精油为2 mg/mL时,粒径最小为87.17 nm,出现此现象的原因是精油添加量超出了脂质体空间负荷,干扰磷脂间相互作用力,导致磷脂双分子层结构的柔韧性和致密性减弱,致使双分子层膨胀,粒径增大[17]。综合分析,选择肉桂精油质量浓度为2.5 mg/mL较为理想,此时包埋率最大,粒径相对较小。
2.1.3 吐温-80质量浓度
由图1-c可知,随着吐温-80质量浓度增加平均粒径呈持续下降趋势,包埋率先增大后减小,当吐温-80质量浓度为2.5 mg/mL时,包埋率达最大(79.74%),而当浓度继续增加,包埋率减小。吐温-80是一种呈亲水性长链结构的化合物,通过物理吸附在脂质体膜表面形成一定厚度亲水层,具有空间位阻效应,使得脂质体系统牢固[18];然而过量的吐温-80的加入导致乳化过度,脂质体囊泡被溶解,平均粒径降低,同时造成脂质体内空间受限,不能对肉桂精油进行有效包埋[19]。综合考虑,选择吐温-80质量浓度为2.5 mg/mL进行后续试验。
2.1.4 PBS缓冲液用量
由图1-d可知,平均粒径先降低随后趋于平稳且变化幅度较小,随着缓冲液用量的增加,脂质体体系浓度下降,粒子间更加均匀分布,使得平均粒径减少直到趋于平稳[20]。肉桂精油脂质体包埋率随缓冲液用量增加逐渐升高,但缓冲液用量超过40 mL,包埋率略有下降。但过少的PBS,不利于脂质的水化过程,易产生聚集絮凝,从而导致包埋率较低。同时调查发现,本试验研究契合宋恭帅等[21]的研究结果。综上,PBS的增加引起包埋率和平均粒径的变化并不明显,确定PBS最佳用量为40 mL。
2.2 响应面优化分析
利用Design-Expert软件对包埋率与各因素间的关系进行回归分析,响应面优化试验结果见表2。通过回归拟合得到多元回归方程为:
表2 响应面优化试验结果
Table 2 Response surface optimization test results
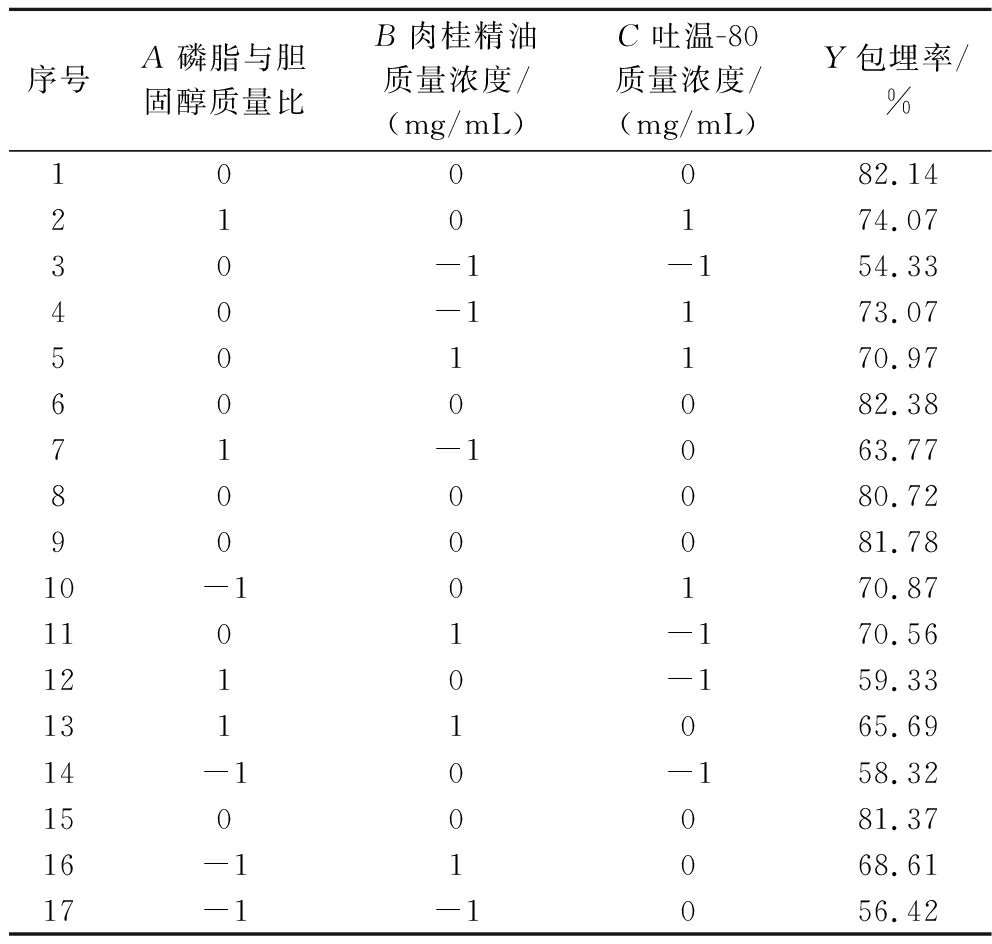
序号A磷脂与胆固醇质量比B肉桂精油质量浓度/(mg/mL)C吐温-80质量浓度/(mg/mL)Y包埋率/%100082.14210174.0730-1-154.3340-1173.07501170.97600082.3871-1063.77800080.72900081.7810-10170.871101-170.561210-159.331311065.6914-10-158.321500081.3716-11068.6117-1-1056.42
Y=81.68+1.08A+3.53B+5.80C-2.57AB+0.55AC-4.58BC-9.82A2-8.24B2-6.21C2
根据表3的方程分析,模型具有极显著性(P<0.000 1);失拟项不显著(P>0.05);R2=0.993 2,可以解释99.32%的总变化,说明该模型拟合情况好,具有统计学意义。
表3 响应面方差分析
Table 3 Response surface analysis of variance

来源平方和自由度均方FP显著性模型1 440.019160.00111.80<0.000 1**A9.3319.336.520.037 9*B99.69199.6969.66<0.000 1**C269.581269.58188.37<0.000 1**AB26.37126.3718.420.003 6*AC1.2011.200.840.390 5BC84.00184.0058.690.000 1**A24 406.051406.05283.73<0.000 1**B2285.561285.56199.53<0.000 1**C2162.391162.39113.47<0.000 1**残差 10.027 1.43失拟项8.2932.76纯误差1.7340.43 6.39 0.052 5总和1 450.0316
注:*表示P<0.05,**表示P<0.01。
此外,线性系数A及相互作用系数AB对Y有显著影响(P<0.05),线性(B、C)、相互作用系数(BC)和二次项系数(A2、B2、C2)对结果达到极显著水平(P<0.01)。根据分析结果,影响包埋率的因素主次为:吐温80质量浓度>肉桂精油质量浓度>磷脂与胆固醇质量比。如表3所示,两两因素之间的相互作用大小依次为:BC>AB>AC。
根据模型试验结果,预测肉桂精油脂质体制备的最佳工艺条件为:磷脂与胆固醇质量比为4.09∶1(磷脂质量浓度为10.23 mg/mL,胆固醇质量浓度为2.5 mg/mL)、肉桂精油质量浓度为2.46 mg/mL、吐温80质量浓度为2.99 mg/mL,此时理论包埋率为83.01%。为验证该模型的可靠性,通过3次重复试验,得出的包埋率平均值为81.95%,相对误差为1.28%,说明理论值与实际值较为符合。
2.3 肉桂精油脂质体的理化性质
2.3.1 微观结构
如图2所示,肉眼下肉桂精油脂质体呈均匀的淡黄色乳液,电镜下肉桂精油脂质体呈亮色的单层囊泡,囊泡周边均出现一层阴影,分布均匀,这与郭嘉斌等[22]制备的香叶木素脂质体形态结构相似。同时观察到存在小囊泡向大囊泡融合的趋势,可能是脂质体囊泡存在熟化行为[23],这使得体系更加稳定。

a-外观;b-微观形态
图2 肉桂精油脂质体的外观及微观形态
Fig.2 Appearance and microscopic morphology of cinnamon essential oil liposomes
2.3.2 粒径与zeta电位分析
粒径和zeta电位是衡量脂质体胶体稳定性的重要指标。如图3所示,肉桂精油脂质体粒径和zeta电位图均为正态分布,其平均粒径为94.21 nm,属于纳米颗粒,与TEM所显示的尺寸基本一致。但动态光散射(dynamic light scattering,DLS)获得的脂质体粒径值不是绝对的,而是表观粒径,这是因为粒径与布朗运动有关[24]。PDI为0.133<0.3,体系分散均匀。张婷等[25]制得蛋清肽脂质体平均粒径为(95.0±0.8) nm,PDI为0.210±0.009,与本结果相似。通常情况下纳米颗粒的zeta电位绝对值大于30 mV时,被认为是稳定的,而本研究结果显示脂质体乳液的zeta电位为-40.4 mV,说明脂质体表面带负电荷,粒子间相互排斥,没有絮凝的倾向,较稳定。

a-粒径;b-zeta电位
图3 肉桂精油脂质体的粒径和zeta电位
Fig.3 Particle size and zeta potential of cinnamon essential oil liposomes
2.3.3 DSC分析
DSC分析可检测脂质体的相变温度和稳定性。当温度升高时,脂质体膜出现层状凝胶相、波动凝胶相和液晶相等状态,其中从层状凝胶态到波动凝胶态过程称为预相变,波动凝胶态到液晶态过程称为主相变。由图4可知,空白脂质体在35.48和71.64 ℃处出现了凝胶态向液晶态的致热相变,其中35.48 ℃为预相变。与空白脂质体相比,肉桂精油脂质体的相变温度(32.85、67.51 ℃)分别降低了2.62、4.13 ℃,表明肉桂精油脂质体的热稳定性降低,这是由于肉桂精油与脂质体的膜材蛋黄卵磷脂的非极性头部之间发生了疏水相互作用,降低了双分子层的致密性和刚性,使得相变温度降低[26],也可能是肉桂精油中的晶体结构和大小发生变化形成精油-磷脂复合物所致[27]。

图4 差示扫描量热分析图
Fig.4 Differential scanning calorimetry analysis
2.3.4 FTIR分析
如图5所示,比较了肉桂精油和肉桂精油脂质体的特征吸收,肉桂精油在波数3 059和1 487 cm-1出现了特征峰,这归因于—CH2的伸缩振动,在3 025、1 673 cm-1处为羰基伸缩振荡吸收峰,在1 290、1 128 cm-1是对应芳族化合物中C![]() O,C
O,C![]() C和—OH基团的伸缩振动吸收峰,分别为醛、酚和酮单体[28]。肉桂精油脂质体的红外光谱显示在3 413 cm-1处是—OH的伸缩振动峰,位于波数2 925 cm-1是C—H拉伸振动引起,1 736 cm-1处是C
C和—OH基团的伸缩振动吸收峰,分别为醛、酚和酮单体[28]。肉桂精油脂质体的红外光谱显示在3 413 cm-1处是—OH的伸缩振动峰,位于波数2 925 cm-1是C—H拉伸振动引起,1 736 cm-1处是C![]() O的吸收振动,在1 242 cm-1处为P
O的吸收振动,在1 242 cm-1处为P![]() O的非对称拉伸振动,964 cm-1的吸收峰归因于磷酸酯P-OR,这与蛋黄卵磷脂材料有关[29]。通过两者对比,肉桂精油的羟基基团(3 494 cm-1)向肉桂精油脂质体的3 384 cm-1出的吸收峰移动,这是由于精油中的—OH与磷脂酰胆碱之间形成氢键,且974 cm-1处C—H非对称振动吸收峰消失,说明肉桂精油与脂质体之间发生相互作用,与上述DSC得到的结果一致,进一步证明肉桂精油成功包埋在脂质体中。
O的非对称拉伸振动,964 cm-1的吸收峰归因于磷酸酯P-OR,这与蛋黄卵磷脂材料有关[29]。通过两者对比,肉桂精油的羟基基团(3 494 cm-1)向肉桂精油脂质体的3 384 cm-1出的吸收峰移动,这是由于精油中的—OH与磷脂酰胆碱之间形成氢键,且974 cm-1处C—H非对称振动吸收峰消失,说明肉桂精油与脂质体之间发生相互作用,与上述DSC得到的结果一致,进一步证明肉桂精油成功包埋在脂质体中。

图5 红外光谱分析图
Fig.5 Infrared spectrum analysis
2.3.5 体外释放分析
以PBS作为释放介质,模拟作为抑菌剂应用场景下的释放,探究肉桂精油脂质体的释放性能,结果如图6所示。肉桂精油脂质体在2、24、48、72 h时的累积释放度分别为5.13%,50.56%,79.23%,81.24%,说明该脂质体可以有效控制和减缓精油释放。然后采用零级方程、一级方程和Higuchi方程对体外释放数据进行拟合,三者得到的拟合结果分别为Mt=1.207 5t+10.555 5(R2=0.896 9),Mt=92.462 6(1-e-0.034 6t)(R2=0.991 1),Mt=11.989 2t1/2-10.938 0(R2=0.972 8),结果显示肉桂精油脂质体的体外释放规律最符合一级动力学方程。
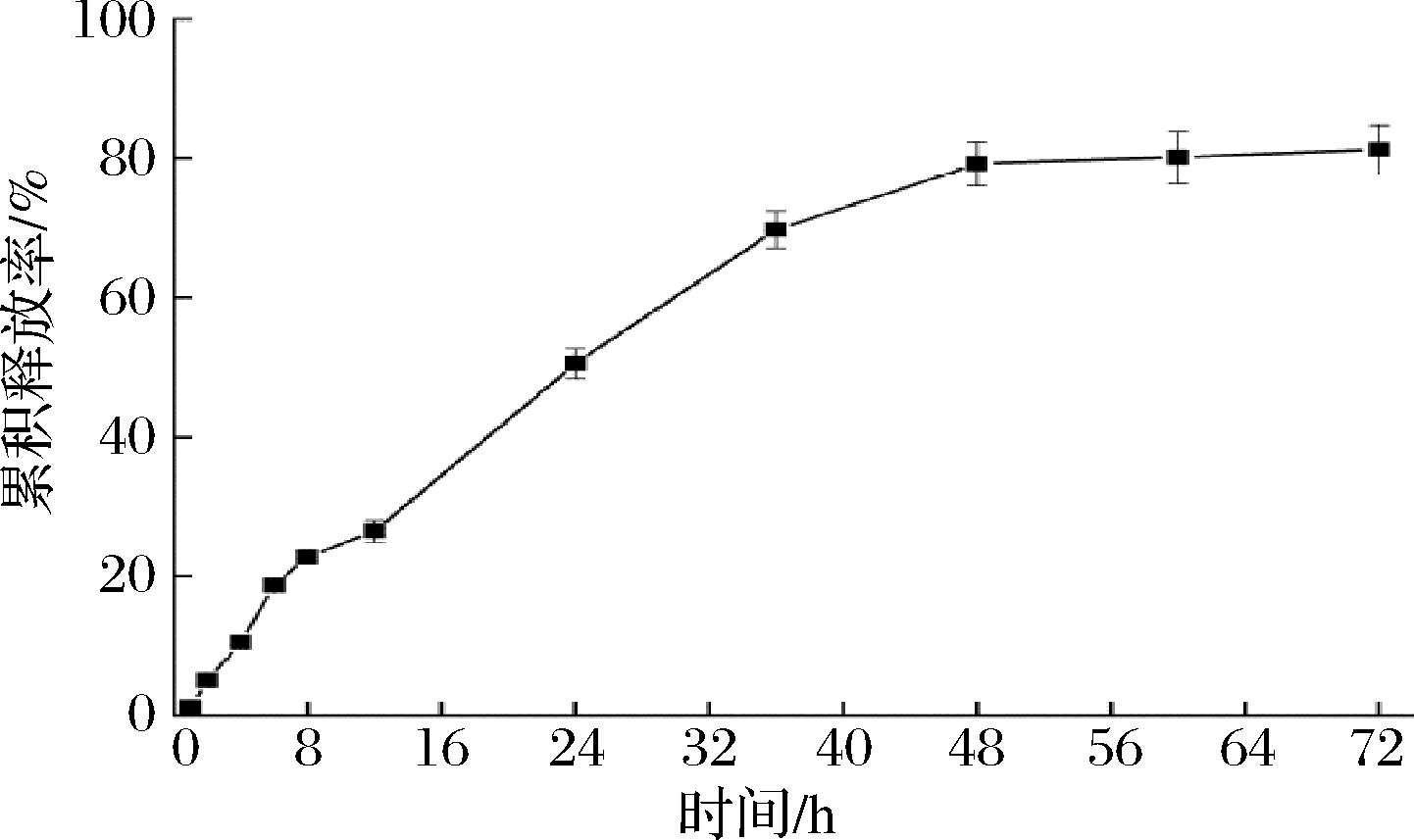
图6 肉桂精油脂质体的累积释放曲线
Fig.6 Cumulative release curve of cinnamon essential oil liposomes
2.3.6 肉桂精油脂质体抑菌性能分析
图7-a和图7-b分别是肉桂精油和肉桂精油脂质体对大肠杆菌和金黄色葡萄球菌的杀菌作用结果。大肠杆菌和金黄色葡萄球菌菌悬液的初始浓度值为7.6×107 lg CFU/mL。在第0天2种菌悬液浓度与初始浓度相比略有上升,这是由于两种菌处于对数生长期所致。图7-a显示肉桂精油对大肠杆菌和金黄色葡萄球菌具有良好的抑菌效果。2 d后由于精油挥发,细菌数分别达到7.08×107和6.87×107 lg CFU/mL,并持续增长。而由图7-b可知,加入肉桂精油脂质体后,培养1 d后2种菌的菌落总数均显著减少(P<0.05),并且菌落数随着时间的延长呈显著持续下降的趋势,表明肉桂精油从肉桂精油脂质体中缓慢释放出来,对大肠杆菌和金黄色葡萄球菌表现出长效抑菌作用。此外,由于革兰氏阳性菌具有特殊的细胞壁结构,观察到肉桂精油脂质体对金黄色葡萄球菌的抗菌活性高于大肠杆菌。革兰氏阴性菌(大肠杆菌)的细胞壁呈现多层结构,其中包括肽聚糖、脂蛋白、磷脂和脂多糖;而革兰氏阳性菌(金黄色葡萄球菌)的细胞壁仅被肽聚糖层包围[30],因此肉桂精油脂质体释放的精油很容易穿过革兰氏阳性菌细胞壁并与其内容物相互作用。

a-肉桂精油;b-肉桂精油脂质体
图7 肉桂精油和肉桂精油脂质体的抑菌性能
Fig.7 Bacteriostatic effect of cinnamon essential oil and cinnamon essential oil liposomes
3 结论
本文以包埋率、平均粒径为指标,采用单因素试验和响应面法优化了肉桂精油脂质体的制备工艺。得到最佳工艺参数为:磷脂与胆固醇质量比4.09∶1(磷脂质量浓度为10.23 mg/mL,胆固醇质量浓度为2.5 mg/mL),肉桂精油质量浓度2.46 mg/mL,吐温-80质量浓度2.99 mg/mL,PBS用量为40 mL(0.01 mol/L,pH 7.2)。在此条件下得到包埋率为81.95%,粒径为94.21 nm,PDI为0.133,zeta电位为-40.4 mV的肉桂精油脂质体。透射电镜结果表明其微观结构呈囊泡状,分布均匀。通过热力学性质和红外光谱分析证实肉桂精油成功包封在脂质体内。此外,体外释放和抑菌性能研究表明肉桂精油脂质体具有控释抗菌作用,能提高肉桂精油杀菌效果。本研究以肉桂精油为切入点,构建了脂质体运载体系,并对肉桂精油脂质体制备工艺关键参数及其理化性质进行研究,成功优化并建立了一种稳定、高效的制备肉桂精油脂质体技术,为肉桂精油脂质体在食品中的进一步开发利用提供技术参考。
[1] YANG Y L, ADEL AL-MAHDY D, WU M L, et al.LC-MS-based identification and antioxidant evaluation of small molecules from the cinnamon oil extraction waste[J].Food Chemistry, 2022, 366:130576.
[2] 赵前, 高永生, 朱丽云, 等.肉桂精油的生理功能及其在畜禽健康中的应用研究进展[J].动物营养学报, 2022, 34(1):68-82.
ZHAO Q, GAO Y S, ZHU L Y, et al.Research progress on physiological function of cinnamon essential oil and its application in livestock and poultry health[J].Chinese Journal of Animal Nutrition, 2022, 34(1):68-82.
[3] HUANG H H, HUANG C X, YIN C, et al.Preparation and characterization of β-cyclodextrin-oregano essential oil microcapsule and its effect on storage behavior of purple yam[J].Journal of the Science of Food and Agriculture, 2020, 100(13):4849-4857.
[4] 董鸿春, 付聪, 杨贤庆, 等.类胡萝卜素脂质体的特性、制备与评价的研究进展[J].食品与发酵工业, 2022, 48(14):303-310.
DONG H C, FU C, YANG X Q, et al.Research progress on characteristics, preparation and evaluation of carotenoid-loaded liposomes[J].Food and Fermentation Industries, 2022, 48(14):303-310.
[5] 刘玉兰. 肉桂醛脂质体的制备及理化性质研究[D].长春:吉林大学, 2019.
LIU Y L.Study on preparation of cinnamaldehyde liposomes and its physicochemical properties[D].Changchun:Jilin University, 2019.
[6] 李伟. 肉桂精油/β-环糊精蛋白脂质体纤维膜的制备及在牛肉保鲜中的应用[D].镇江:江苏大学, 2017.
LI W.Preparation of Cinnamomum cassia essential oil/β-cyclodextrin protein liposome fiber membrane and its application in beef preservation[D].Zhenjiang:Jiangsu University, 2017.
[7] 李畅,薛璐,芦晶,等. 高压微射流均质法制备二十二碳六烯酸藻油脂质体及其性质分析[J]. 食品科学, 2022, 43(19): 110-117.
LI C, XUE L, LU J, et al. Preparation and characterization of docosahexaenoic acid algae-rich oil liposomes by high-pressure microfluidizer homogenization[J]. Food Science, 2022, 43(19): 110-117.
[8] CHAVES M A, OSELIERO FILHO P L, JANGE C G, et al.Structural characterization of multilamellar liposomes coencapsulating curcumin and vitamin D3[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2018, 549:112-121.
[9] 郝静梅, 孙志高, 盛冉, 等.柠檬烯纳米脂质体的制备及其性质测定[J].食品与发酵工业, 2018, 44(4):173-179.
HAO J M, SUN Z G, SHENG R, et al.Preparation and characterization of limonene nanoliposomes[J].Food and Fermentation Industries, 2018, 44(4):173-179.
[10] 顾家毓, 余丹丹, 邬瑞光.吴茱萸碱与脂质体模拟生物膜的相互作用:FTIR和DSC研究[J].光谱学与光谱分析, 2019, 39(6):1757-1762.
GU J Y, YU D D, WU R G.The interaction of evodiamine with liposome mimetic biomembrane:FTIR and DSC study[J].Spectroscopy and Spectral Analysis, 2019, 39(6):1757-1762.
[11] ZHANG L, SONG X W, QI Q T, et al.Interaction of DPPC liposomes with cholesterol and food protein during in vitro digestion using dynamic light scattering and FTIR spectroscopy analysis[J].Food Chemistry, 2022, 375:131893.
[12] WU Z G, ZHOU W, PANG C S, et al.Multifunctional chitosan-based coating with liposomes containing laurel essential oils and nanosilver for pork preservation[J].Food Chemistry, 2019, 295:16-25.
[13] 王俊芝. 胆固醇对脂质体双分子层膜结构、性质及功能的影响[D].上海:华东理工大学, 2011.
WANG J Z. Effect of cholesterol on the structure, properties and function of liposome bilayer membrane[D].Shanghai: East China University of Science and Technology, 2011.
[14] KUMARAGE T, BORDEN W, KATSARAS J, et al.Replacing cholesterol with sterol modified lipids results in improved liposomal stability[J].Biophysical Journal, 2022, 121(3):290a.
[15] 郝静, 涂心怡, 曹诗诺, 等.壳聚糖-核桃多肽脂质体的制备及表征[J].食品与发酵工业, 2022, 48(13):135-140.
HAO J, TU X Y, CAO S N, et al.Preparation and characterization of chitosan-coated nanoliposome loaded with walnut (Juglans regia L.) polypeptide[J].Food and Fermentation Industries, 2022, 48(13):135-140.
[16] PORNPUTTAPITAK W, PANTAKITCHAROENKUL J, TEERANACHAIDEEKUL V, et al.Effect of oil content on physiochemical characteristics of γ-oryzanol-loaded nanostructured lipid carriers[J].Journal of Oleo Science, 2019, 68(8):699-707.
[17] SEBAALY C, JRAIJ A, FESSI H, et al.Preparation and characterization of clove essential oil-loaded liposomes[J].Food Chemistry, 2015, 178:52-62.
[18] WU S Z, WANG G, LU Z, et al.Effects of glycerol monostearate and tween 80 on the physical properties and stability of recombined low-fat dairy cream[J].Dairy Science &Technology, 2016, 96(3):377-390.
[19] 胥传来, 姚惠源.吐温-80与脂质体膜相互作用机理的研究[J].西安石油大学学报(自然科学版), 2005, 20(6):45-48.
XU C L, YAO H Y.Study on the interaction mechanism between tween-80 and liposome membrane[J].Journal of Xi’an Shiyou University (Natural Science Edition), 2005, 20(6):45-48.
[20] ZUCKER D, MARCUS D, BARENHOLZ Y, et al.Liposome drugs’ loading efficiency:A working model based on loading conditions and drug’s physicochemical properties[J].Journal of Controlled Release, 2009, 139(1):73-80.
[21] 宋恭帅, 刘家源, 袁雅雯, 等.栀子黄脂质体的制备、表面修饰及体外消化稳定性研究[J].核农学报, 2021, 35(12):2799-2809.
SONG G S, LIU J Y, YUAN Y W, et al.Study on the preparation, surface modification and in vitro digestion stability of gardenia yellow liposomes[J].Journal of Nuclear Agricultural Sciences, 2021, 35(12):2799-2809.
[22] 郭嘉斌, 徐文霞, 李红莲, 等.香叶木素脂质体的处方优化及其体外释放[J].中国医药工业杂志, 2022, 53(2):225-232.
GUO J B, XU W X, LI H L, et al.Formulation optimization and in vitro release of diosmetin liposomes[J].Chinese Journal of Pharmaceuticals, 2022, 53(2):225-232.
[23] HUGUET-CASQUERO A, MORENO-SASTRE M, L PEZ-MÉNDEZ T B, et al.Encapsulation of oleuropein in nanostructured lipid carriers:Biocompatibility and antioxidant efficacy in lung epithelial cells[J].Pharmaceutics, 2020, 12(5):429.
PEZ-MÉNDEZ T B, et al.Encapsulation of oleuropein in nanostructured lipid carriers:Biocompatibility and antioxidant efficacy in lung epithelial cells[J].Pharmaceutics, 2020, 12(5):429.
[24] SINGH A, ANSARI V A, HAIDER F, et al.A Review on topical preparation of herbal drugs used in liposomal delivery against ageing[J].Research Journal of Pharmacology and Pharmacodynamics, 2020, 12(1):5.
[25] 张婷, 温鹤迪, 宋敬一, 等.基于乙醇注入-高压均质的蛋清肽脂质体制备及体内外缓释效果[J].食品科学, 2021, 42(13):79-86.
ZHANG T, WEN H D, SONG J Y, et al.Preparation and in vivo and in vitro sustained-release characteristics of egg white peptide liposomes by ethanol injection combined with high-pressure homogenization[J].Food Science, 2021, 42(13):79-86.
[26] KEIVANI NAHR F, GHANBARZADEH B, HAMISHEHKAR H, et al.Investigation of physicochemical properties of essential oil loaded nanoliposome for enrichment purposes[J].LWT, 2019, 105:282-289.
[27] KAMI SKI D M, ARCZEWSKA M, POCIECHA D, et al.Antibiotic amphotericin B-DPPC lipid complex:X-ray diffraction and FTIR studies[J].Journal of Molecular Structure, 2015, 1080:57-62.
SKI D M, ARCZEWSKA M, POCIECHA D, et al.Antibiotic amphotericin B-DPPC lipid complex:X-ray diffraction and FTIR studies[J].Journal of Molecular Structure, 2015, 1080:57-62.
[28] BAGHERI L, KHODAEI N, SALMIERI S, et al.Correlation between chemical composition and antimicrobial properties of essential oils against most common food pathogens and spoilers:In-vitro efficacy and predictive modelling[J].Microbial Pathogenesis, 2020, 147:104212.
[29] FAN H F, LIU G Q, HUANG Y Q, et al.Development of a nanostructured lipid carrier formulation for increasing photo-stability and water solubility of Phenylethyl Resorcinol[J].Applied Surface Science, 2014, 288:193-200.
[30] SIRIPATRAWAN U, VITCHAYAKITTI W.Improving functional properties of chitosan films as active food packaging by incorporating with propolis[J].Food Hydrocolloids, 2016, 61:695-702.