钝顶螺旋藻(Spirulina platensis)具有极高的营养价值,含有藻蓝蛋白、必需脂肪酸(如亚油酸、γ-亚麻酸)等多种高附加值活性物质,已被广泛应用于食品、医药、化妆品等领域。MA等[1]研究表明,藻蓝蛋白具有抗肿瘤、抗氧化、免疫调节、降血脂和降血糖、抗血栓、抗病毒、调节肠道微生物群特性等多重功效。同时,食用亚油酸和γ-亚麻酸可降低机体的胆固醇与血脂,具有促进婴幼儿认知、延缓皮肤衰老等生物学功能[2]。因此,利用螺旋藻开发藻蓝蛋白、必需脂肪酸等高附加值制品是螺旋藻深加工研究领域的热点。
YU[3]利用螺旋藻提取藻蓝蛋白的方法有浸泡法、反复冻融法、珠磨法、高压均质法、超声波破碎法、溶菌酶法等。HADIYANTO等[4]采用响应面法优化超声波辅助提取螺旋藻藻蓝蛋白,在温度52.5 ℃、提取时间42 min、超声波频率42 kHz条件下,获得藻蓝蛋白最佳得率为15.7%。K FERBÖCK等[5]运用脉冲电场和反复冻融组合技术成功提取了螺旋藻中的藻蓝蛋白,并获得了高纯度的产品。与传统的珠磨法相比,该方法将藻蓝蛋白的提取率提高了90%。对于提取螺旋藻油脂,RIZWANUL等[6]也研发了有机溶剂提取、超声波辅助提取、微波辅助提取、超临界流萃取等方法。DE SOUSA等[7]使用水作为溶剂,利用微波辅助技术在620 W下连续提取3次,每次持续20 s,获得大约35%的螺旋藻油脂产率。基于现有文献资料,对于螺旋藻这类生物质资源,研究者的提取方法仅提取螺旋藻中的藻蓝蛋白或油脂。这无疑会导致螺旋藻另一种高附加值成份的浪费。为此,亟需研发一种低碳经济的提取方法,实现螺旋藻藻蓝蛋白和油脂的联产提取,解决现有螺旋藻藻蓝蛋白与油脂提取的技术瓶颈。
FERBÖCK等[5]运用脉冲电场和反复冻融组合技术成功提取了螺旋藻中的藻蓝蛋白,并获得了高纯度的产品。与传统的珠磨法相比,该方法将藻蓝蛋白的提取率提高了90%。对于提取螺旋藻油脂,RIZWANUL等[6]也研发了有机溶剂提取、超声波辅助提取、微波辅助提取、超临界流萃取等方法。DE SOUSA等[7]使用水作为溶剂,利用微波辅助技术在620 W下连续提取3次,每次持续20 s,获得大约35%的螺旋藻油脂产率。基于现有文献资料,对于螺旋藻这类生物质资源,研究者的提取方法仅提取螺旋藻中的藻蓝蛋白或油脂。这无疑会导致螺旋藻另一种高附加值成份的浪费。为此,亟需研发一种低碳经济的提取方法,实现螺旋藻藻蓝蛋白和油脂的联产提取,解决现有螺旋藻藻蓝蛋白与油脂提取的技术瓶颈。
众所周知,藻蓝蛋白和油脂属于螺旋藻胞内产物。对于给定的某一提取方法,坚韧的螺旋藻细胞壁会影响其提取性能[8]。已有研究指出,通过物理、化学或生物法破壁螺旋藻,可显著提高提取性能[5]。但是,对于规模化应用上,前处理破壁工艺无疑会增加其提取成本[9]。因此,本研究以未破壁的螺旋藻为原料,选择食品级正己烷为有机溶剂,在室温条件下,研发正己烷和盐介导的提取法联产提取藻蓝蛋白和油脂。同时研究盐类种类、正己烷-盐类浓度、料液比等工艺参数对联产提取藻蓝蛋白和油脂性能的影响,优化工艺参数,以获得最高的提取性能,为工业化联产提取螺旋藻藻蓝蛋白和油脂提供理论依据。
1 材料与方法
1.1 原料与试剂
钝顶螺旋藻(Spirulina platensis)藻粉,福清市新大泽螺旋藻有限公司。螺旋藻藻粉的总蛋白质含量为54.12%,藻蓝蛋白含量为9.91%,糖类化合物含量为18.79%,总油脂含量为13.10%。
CaCl2、NaCl、KCl、NH4Cl、MgCl2(均为分析纯),国药集团化学试剂有限公司;CH3COONa、CH3COOK、(NH4)2SO4、Na2SO4、MgSO4、柠檬酸钠、柠檬酸铵、KH2PO4、K2HPO4、正己烷(均为分析纯),西陇科学股份有限公司。
1.2 仪器设备
SHA-B双功能水浴摇床,江苏中和实验仪器制造有限公司;RE-52A旋转蒸发器,上海亚荣生化仪器厂;SHZ-DⅢ循环水真空泵,巩义市予华仪器有限责任公司;SCION-436气相色谱仪,天美仪拓实验室设备(上海)有限公司;K9840全自动凯氏定氮仪,济南海能仪器股份有限公司;BS224S电子秤,北京赛多利斯系统仪器有限公司;H11650-W湘仪离心机,湖南湘仪实验室仪器开发有限公司;BX-51荧光显微镜,日本奥林巴斯公司。
1.3 正己烷-盐介导法联产提取未破壁的钝顶螺旋藻藻蓝蛋白和油脂
1.3.1 盐类筛选
称取0.5 g钝顶螺旋藻藻粉放入50 mL离心管中,按照料液比1∶40(g∶mL)加入20 mL 50 g/L的CaCl2,再加入20 mL正己烷,在室温条件下恒定转速下反应3 h。然后,将混合体系2 000 r/min离心10 min,以促进相分离。取上层正己烷相,在真空条件下旋转蒸发正己烷,得到钝顶螺旋藻粗油脂。取下层含有藻蓝蛋白的水相,测定可溶性的螺旋藻藻蓝蛋白。评估不同盐类对联产提取螺旋藻藻蓝蛋白和油脂提取率的影响,筛选获得最适合的盐类。
1.3.2 优化工艺参数
在所得最适合的盐类条件下,以藻蓝蛋白和油脂的提取率为指标,优化正己烷-盐介导法联产提取螺旋藻藻蓝蛋白和油脂的工艺参数(盐浓度、正己烷与悬浮液的体积比、料液比和提取时间),获得钝顶螺旋藻胞内生物活性成分的最佳提取率。
1.4 测定方法
1.4.1 钝顶螺旋藻藻粉基本成分的测定
采用SN/T 1113—2002 《进出口螺旋藻粉中藻蓝蛋白、叶绿素含量的测定方法》测定钝顶螺旋藻藻粉中总藻蓝蛋白的含量;采用氯仿-甲醇法测定钝顶螺旋藻藻粉总油脂含量[10];采用硫酸-苯酚法测定钝顶螺旋藻藻粉中总糖含量[11];采用GB/T 6432—2018《饲料中粗蛋白的测定》中凯氏定氮法,测定钝顶螺旋藻藻粉中总蛋白质含量;通过气相色谱仪分析钝顶螺旋藻粗油脂的脂肪酸组成成分。
1.4.2 藻蓝蛋白和油脂提取率的测定
取体系下层水相样品,使用紫外可见分光光度计分别在652和620 nm下测定吸光值,藻蓝蛋白的质量浓度和提取率按公式(1)、公式(2)计算[12-13]:
(1)
(2)
式中:V1,水相的体积,mL;m1,钝顶螺旋藻内藻蓝蛋白的质量,g。
取上层正己烷相在旋转蒸发仪上进行旋蒸,将正己烷完全除去之后得到油脂,对获得的油脂进行称重,其提取率的计算如公式(3)所示:
(3)
式中:m2,提取得到的钝顶螺旋藻内油脂的质量,g;m3,钝顶螺旋藻的总油脂质量,g。
1.4.3 螺旋藻油脂肪酸组成分析
提取的螺旋藻藻油经甲酯化后通过气相色谱仪测定脂肪酸组成。气相色谱条件[14]:色谱柱(30 m×0.25 mm×0.25 μm);载气He;升温程序为100 ℃保持1 min,以40 ℃/min升温至210 ℃,接着以20 ℃/min升温至250 ℃,保持10 min;检测器温度260 ℃;注射口温度250 ℃;分流比1∶40;进样量1 μL。
1.5 数据分析
每个实验均重复3次,数据处理使用Excel软件,图表绘制采用Origin Pro 8.5软件,所有数据以平均值±标准差的形式呈现。差异显著性分析采用SPSS 27.0统计软件,P<0.05表示差异具有显著性。
2 结果与分析
2.1 不同盐类对联产提取未破壁螺旋藻藻蓝蛋白和油脂提取性能的影响
在室温条件下,以未破壁钝顶螺旋藻为原料,选择食品级正己烷为有机溶剂,研究不同盐类对联产提取螺旋藻藻蓝蛋白和油脂性能的影响,结果如表1所示。在所选择的盐类中,由正己烷和CaCl2介导的提取法表现出最高的螺旋藻藻蓝蛋白和油脂的提取率,即62.47%和12.59%。LAUCERI等[15]也发现CaCl2可显著提高藻蓝蛋白的提取率。CaCl2具有较高的渗透活性,可以破坏细胞壁的结构,提高细胞膜的通透性[16-17],有利于胞内藻蓝蛋白油脂的释放。因此,根据表1的结果,选择正己烷-CaCl2介导的提取体系,进一步优化其联产提取未破壁螺旋藻藻蓝蛋白和油脂的工艺参数。
表1 不同盐类联产提取未破壁螺旋藻藻蓝蛋白和油脂提取性能的影响
Table 1 Effect of different salts on the extraction performance of phycocyanin and lipids from S. platensis using salt/n-hexane co-extraction

盐类提取率/%藻蓝蛋白油脂不加盐26.36±0.93h6.03±0.54bNaCl52.98±0.10c12.35±1.94aKCl52.45±0.88cd12.03±1.50aNH4Cl56.40±0.24b10.21±1.30aCaCl262.47±1.13a12.69±0.88aMgCl259.74±1.02a12.32±1.56aCH3COONa49.62±0.24de12.21±0.86aCH3COOK53.57±1.45bc11.50±1.55a(NH4)2SO453.27±0.05c12.52±1.22aNa2SO449.00±1.31e12.06±1.08aMgSO454.69±1.56bc11.91±2.02a柠檬酸钠40.63±0.06f11.49±1.26a柠檬酸铵42.92±0.88f11.79±0.83aKH2PO449.82±1.22de11.90±1.32aK2HPO431.61±1.05g11.30±1.05a
注:同一指标不同字母表示差异显著(P<0.05)(下同)。
2.2 不同CaCl2质量浓度对螺旋藻活性物质联产提取性能的影响
从图1可知,当提取体系的CaCl2质量浓度从0提高到30 g/L,螺旋藻藻蓝蛋白的提取率从32.23%提高到62.48%。但是,当继续提高提取体系的CaCl2浓度时,藻蓝蛋白提取率明显呈现下降趋势。这是因为过高的CaCl2浓度可能使藻蓝蛋白发生盐析沉淀[18],导致其提取率下降。此外,图1还表明,钝顶螺旋藻油脂的提取率随着CaCl2浓度的增加呈现先上升后趋于平稳的趋势。在CaCl2质量浓度为30~70 g/L时,正己烷-CaCl2介导法提取螺旋藻油脂的提取率则无显著差异。因此,最佳提取螺旋藻油脂的CaCl2浓度为30~70 g/L。基于图1的实验结果,选择30 g/L CaCl2质量浓度作为正己烷-CaCl2介导法联产提取藻蓝蛋白和油脂。

图1 CaCl2浓度对提取性能的影响
Fig.1 Influence of CaCl2 content on the extraction performance
2.3 正己烷与悬浮液的体积比对提取性能的影响
由图2可知,随着正己烷用量的增加,正己烷-CaCl2介导法提取螺旋藻藻蓝蛋白的提取率无明显变化(66.26%~68.77%)。这可能是因为,正己烷作为非极性有机溶剂,主要用于溶解中性油脂[19],不会对水相中的藻蓝蛋白产生影响。当正己烷与悬浮液体积比从0.5∶1提高到2∶1时,正己烷-CaCl2介导法提取螺旋藻油脂的提取率从8.35%提高到24.73%(图2);而继续提高提取体系中正己烷的用量(2.5∶1),螺旋藻油脂的提取率无显著变化。因此,选择2∶1作为正己烷与悬浮液的最佳体积比。

图2 正己烷与悬浮液的体积比对提取性能的影响
Fig.2 Influence of ratio of n-hexane to suspension on the extraction performance
2.4 料液比对提取性能的影响
由图3可知,当料液比从1∶10降低到1∶60时,正己烷-CaCl2介导法提取未破壁螺旋藻藻蓝蛋白的提取率从52.19%提高到68.97%,这是因为随着液料比的增加,生物质分子与溶质分子的接触得到了更充分的保证。同时,增加提取液用量还可以提高溶剂分子在细胞中的扩散速率,进一步促进了藻蓝蛋白的有效提取[17]。继续增加提取液用量(1∶80),藻蓝蛋白的提取率呈下降趋势,这可能是在本研究中,固定提取体系的藻粉量后,随着提取溶液量的增加,提取体系中的CaCl2浓度也随之增加,引起提取的藻蓝蛋白产生部分盐析[18],降低了藻蓝蛋白提取率。这些结果与余佳等[20]从葛仙米中提取藻胆蛋白的单因素实验研究结果相吻合。另外,钝顶螺旋藻油脂的提取率随着提取液用量的增加而持续增加,当料液比从1∶10降低到1∶60时,油脂提取率从13.82%提高到22.83%;继续增加提取液用量(1∶80),油脂的提取率无显著变化。基于图3的实验结果,选择1∶60作为正己烷-CaCl2介导法联产提取螺旋藻藻蓝蛋白和油脂的最佳料液比。

图3 料液比对提取性能的影响
Fig.3 Influence of material-to-liquid ratios on the extraction performance
2.5 提取时间对提取性能的影响
提取时间的长短是评判提取方法是否可进行规模化应用的重要参数。由图4可知,当提取时间从1 h增加到3 h时,正己烷-CaCl2介导法提取未破壁螺旋藻藻蓝蛋白的提取率显著增加,从61.73%提高71.03%;随后,提取时间的继续延长导致藻蓝蛋白的提取率呈现下降趋势。这可能是因为,加入30 g/L CaCl2时,随着提取时间的延长,CaCl2盐类与提取的藻蓝蛋白会持续相互作用,导致水相中的藻蓝蛋白发生盐析沉淀,降低水相的藻蓝蛋白的浓度。此外,当提取时间从1 h提高到3 h时,正己烷-CaCl2介导法提取螺旋藻油脂的提取率从15.49%提高到26.19%(图4),继续延长提取时间,螺旋藻油脂的提取率无显著变化。

图4 提取时间对提取性能的影响
Fig.4 Influence of extraction time on the extraction performance
关于油脂的提取率不同于藻蓝蛋白提取率的变化情况,主要是因为:(1)藻蓝蛋白和油脂是2种结构不同的生物活性物质;(2)在所研发的正己烷-CaCl2提取体系中,提取所得的藻蓝蛋白和油脂分别分布在提取体系的水相和有机相中;(3)CaCl2盐类不会溶解于正己烷,因此不会干扰有机相中油脂的沉淀或分布。综上,正己烷-CaCl2介导法最佳联产提取螺旋藻藻蓝蛋白和油脂的提取时间为3 h。
目前,科技工作者已研发了多种用于提取螺旋藻藻蓝蛋白或油脂的提取方法,如反复冻融法、高速匀浆法、高压乙醇提取法、超临界CO2提取法等(表2)。
表2 不同提取方法提取螺旋藻生物活性物质的比较
Table 2 Comparison of extraction methods for bioactive substances from Spirulina biomass

螺旋藻藻种提取方法是否破壁最佳提取条件提取物质生物活性物质提取性能参考文献Arthospira platensis反复冻融法反复冻融破壁藻粉在水中预浸泡2 h后,置于(-40±2) ℃冷冻4 h,然后在室温(27±2) ℃下解冻1 h,反复循环6次藻蓝蛋白62.60%[23]Spirulina platensis 高速匀浆法高速匀浆破壁提取温度30 ℃,液料比为20∶1(mL∶g),提取溶剂为pH 7.0的PBS,匀浆转速10 000 r/min,提取3次,提取时间共计40 min藻蓝蛋白213.32 mg/g[24]Spirulina platensis纳米颗粒法银纳米颗粒破壁提取温度(35±2) ℃,提取溶剂为0.1 mol/L的PBS,提取pH值为6.8,提取温度(35±2) ℃,银纳米颗粒质量浓度10 μg/mL,料液比1∶6(g∶mL),提取时间160 min藻蓝蛋白43.78%[25]Arthrospi-ra Spiruli-na 微波破碎法微波辅助破壁微波时间120 s,料液比16∶100(g∶mL),微波功率1 400 W,微波频率2.450 MHz藻蓝蛋白85.43 mg/g[26]Spirulina platensis高压乙醇法高温高压破壁提取温度60 ℃,提取压力400 bar,乙醇流量7 mL/min,提取时间4 h油脂98.35%[21]Arthospira platensis固体基质载超临界CO2法高温高压破壁提取液料比为3∶1(mL∶g),硅藻土与生物质比为1∶2(质量比),CO2与物质比为2.0 mL/(g·min),温度40 ℃,压力41 MPa,提取时间60 min油脂81.25%[22]Spirulina platensis正己烷与CaCl2介导法未破壁提取温度为室温,CaCl2 30 g/L,V(正己烷)∶V(悬浮液)=2∶1,料液比1∶60(g∶mL),提取时间3 h藻蓝蛋白和油脂71.06%和26.19%本研究
与传统反复冻融法相比,本研究的正己烷和CaCl2介导提取法可更有效地提取螺旋藻藻蓝蛋白,但油脂提取率仅为26.19%,低于PINTO等[21]和YANG等[22]的结果。这可能是因为本研究所选择的有机溶剂为正己烷。今后将进一步研发更有效的提取方法,实现高效地联产提取螺旋藻藻蓝蛋白和油脂。值得注意的是,本研究所研发的正己烷和CaCl2介导提取法,不仅可联产提取螺旋藻藻蓝蛋白和油脂,而且经提取后还可以实现藻蓝蛋白和油脂的分离,对规模化应用具有重要的意义。
2.6 正己烷与CaCl2介导法提取前后细胞破碎对比
提取前的螺旋藻呈现弯月的形状(图5-a),大小约为40 μm。在最优的提取条件下,采用正己烷-CaCl2介导的一步法联产提取螺旋藻藻蓝蛋白和油脂,并对藻细胞进行显微观察,发现提取后的藻细胞呈现不规则的细胞碎片(图5-b),大小约为6 μm。由此可见,正己烷CaCl2介导法所使用的CaCl2和正己烷作为提取介质可有效地使螺旋藻细胞发生破壁作用,进而使胞内的藻蓝蛋白和油脂分别溶解在水溶液和正己烷中,达到提取和分离的效果。

a-提取前;b-提取后
图5 正己烷与CaCl2介导法提取前后螺旋藻细胞的显微结果
Fig.5 Microscopic results of S. platensis cells before and after the extraction method mediated with n-hexane and CaCl2
2.7 提取所得螺旋藻油脂的脂肪酸组成
如表3所示,钝顶螺旋藻藻粉原料的主要脂肪酸是棕榈酸(40.34%)、亚油酸(16.10%)和γ-亚麻酸(21.72%)。YANG等[22]发现,螺旋藻主要脂肪酸含有45.82%的棕榈酸、21.99%的亚油酸和23.99%的γ-亚麻酸略高于本研究结果;而OLIVEIRA等[27]研究表明,螺旋藻干粉中含有32.53%的棕榈酸、13.86%的亚油酸和20.56%的γ-亚麻酸略低于本研究结果。值得注意的是,正己烷CaCl2介导法提取所得的螺旋藻油脂的棕榈酸含量低于原料的值;但是,亚油酸和γ-亚麻酸含量确高于原料的值(表3)。这有可能是,钝顶螺旋藻所合成的亚油酸和γ-亚麻酸主要分布在中性脂中[28]。本研究中,使用的正己烷属于食品级,经蒸馏后收集的正己烷可进行回收,去除正己烷所得的螺旋藻油脂可开发成高附加值的藻油制品,应用于食品、医药等领域。
表3 螺旋藻藻粉和提取所得油脂的脂肪酸组成
Table 3 Fatty acid composition of S. platensis powder and extracted oil
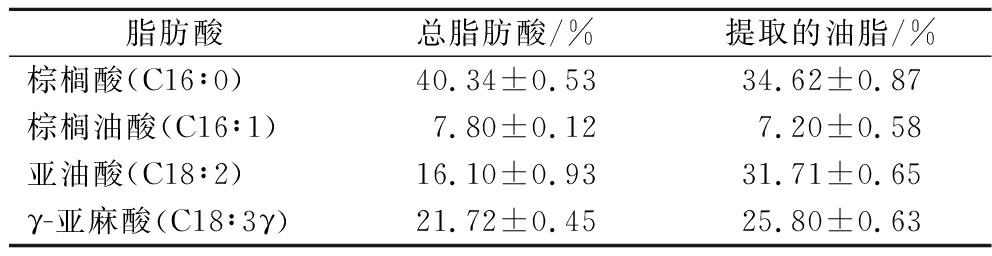
脂肪酸总脂肪酸/%提取的油脂/%棕榈酸(C16∶0)40.34±0.5334.62±0.87棕榈油酸(C16∶1)7.80±0.127.20±0.58亚油酸(C18∶2)16.10±0.9331.71±0.65γ-亚麻酸(C18∶3γ)21.72±0.4525.80±0.63
3 结论
本文率先研发了一种正己烷和CaCl2介导的一步提取法,在室温条件下,可联产提取未破壁螺旋藻中的藻蓝蛋白和富含多不饱和脂肪酸的油脂,并优化其提取工艺。最佳联产提取未破壁螺旋藻藻蓝蛋白和油脂的工艺条件为CaCl2浓度为3%,正己烷和悬浮液的体积比为2∶1,料液比为1∶60,提取时间3 h。在最优的提取工艺条件下,藻蓝蛋白和油脂的最高提取率分别为71.06%和26.19%。正己烷-CaCl2介导的一步提取法可最大程度上联产提取未破壁螺旋藻的藻蓝蛋白和油脂,并达到藻蓝蛋白和油脂的分离,实现螺旋藻生物质的综合利用。研究结果可推动螺旋藻提取藻蓝蛋白和/或油脂的发展,为我国螺旋藻深加工技术提供理论依据。虽然本研究所得的油脂提取率较低,今后将研发更高效的提取螺旋藻油脂的方法,最终达到一步联产低碳高效提取螺旋藻藻蓝蛋白和油脂的目的,突破现有螺旋藻深加工技术的技术瓶颈。
[1] MA H T, XIONG H Y, ZHU X L, et al.Polysaccharide from Spirulina platensis ameliorates diphenoxylate-induced constipation symptoms in mice[J].International Journal of Biological Macromolecules, 2019, 133:1090-1101.
[2] 魏艳丽, 姜国庆, 彭坚, 等.螺旋藻的营养健康功能及在食品中应用研究进展[J].食品工业科技, 2022, 43(8):406-415.
WEI Y L, JIANG G Q, PENG J, et al.A review of nutrition and health functions of Spirulina and its application in food industry[J].Science and Technology of Food Industry, 2022, 43(8):406-415.
[3] YU J F.Application of an ultrafine shearing method for the extraction of C-phycocyanin from Spirulina platensis[J].Molecules, 2017, 22(11):2023.
[4] HADIYANTO H, SUTTRISNORHADI S.Response surface optimization of ultrasound assisted extraction (UAE) of phycocyanin from microalgae Spirulina platensis[J].Emirates Journal of Food and Agriculture, 2016, 28(4):227.
[5] K FERBÖCK A, SMETANA S, DE VOS R, et al.Sustainable extraction of valuable components from Spirulina assisted by pulsed electric fields technology[J].Algal Research, 2020, 48:101914.
FERBÖCK A, SMETANA S, DE VOS R, et al.Sustainable extraction of valuable components from Spirulina assisted by pulsed electric fields technology[J].Algal Research, 2020, 48:101914.
[6] RIZWANUL F I M, NORAINI M Y, MOFIJUR M, et al.Lipid extraction maximization and enzymatic synthesis of biodiesel from microalgae[J].Applied Sciences, 2020, 10(17):6103.
[7] DE SOUSA E S A, MOREIRA L M, DE MAGALH ES W T, et al.Extraction of biomolecules from Spirulina platensis using non-conventional processes and harmless solvents[J].Journal of Environmental Chemical Engineering, 2017, 5(3):2101-2106.
ES W T, et al.Extraction of biomolecules from Spirulina platensis using non-conventional processes and harmless solvents[J].Journal of Environmental Chemical Engineering, 2017, 5(3):2101-2106.
[8] LI Y, ZHANG Z, PACIULLI M, et al.Extraction of phycocyanin-a natural blue colorant from dried spirulina biomass:Influence of processing parameters and extraction techniques[J].Journal of Food Science, 2020, 85(3):727-735.
[9] WANG F, YU X L, CUI Y, et al.Efficient extraction of phycobiliproteins from dry biomass of Spirulina platensis using sodium chloride as extraction enhancer[J].Food Chemistry, 2023, 406:135005.
[10] HE Y J, CHEN L J, ZHOU Y C, et al.Analysis and model delineation of marine microalgae growth and lipid accumulation in flat-plate photobioreactor[J].Biochemical Engineering Journal, 2016, 111:108-116.
[11] LIAO N B, ZHONG J J, YE X Q, et al.Ultrasonic-assisted enzymatic extraction of polysaccharide from Corbicula fluminea:Characterization and antioxidant activity[J].LWT-Food Science and Technology, 2015, 60(2):1113-1121.
[12] MINKOVA K M, TCHERNOV A A, TCHORBADJIEVA M I, et al.Purification of c-phycocyanin from Spirulina (Arthrospira) fusiformis[J].Journal of Biotechnology, 2003, 102(1):55-59.
[13] CHAIKLAHAN R, CHIRASUWAN N, LOHA V, et al.Separation and purification of phycocyanin from Spirulina sp.using a membrane process[J].Bioresource Technology, 2011, 102(14):7159-7164.
[14] 魏登枭, 车丹丹, 陈必链, 等.三相分离法提取裂殖壶藻中油脂、蛋白质和多糖的工艺优化[J].中国油脂, 2023, 48(3):123-129.
WEI D X, CHE D D, CHEN B L, et al.Process optimization of three phase partitioning to extract the lipids, protein and polysaccharide from Schizochytrium sp[J].China Oils and Fats, 2023, 48(3):123-129.
[15] LAUCERI R, CAVONE C, ZITTELLI G C, et al.High purity grade phycocyanin recovery by decupling cell lysis from the pigment extraction:An innovative approach[J].Food and Bioprocess Technology, 2023, 16(1):111-121.
[16] 姜国庆, 闫秋丽, 李东, 等.螺旋藻中藻蓝蛋白提取、纯化及稳态化研究进展[J].食品安全质量检测学报, 2021, 12(6):2332-2338.
JIANG G Q, YAN Q L, LI D, et al.Research progress on separation, purification and stabilization of phycocyanin from Spirulina[J].Journal of Food Safety &Quality, 2021, 12(6):2332-2338.
[17] ![]() LTER I, AKY
LTER I, AKY L S, DEMIREL Z, et al.Optimization of phycocyanin extraction from Spirulina platensis using different techniques[J].Journal of Food Composition and Analysis, 2018, 70:78-88.
L S, DEMIREL Z, et al.Optimization of phycocyanin extraction from Spirulina platensis using different techniques[J].Journal of Food Composition and Analysis, 2018, 70:78-88.
[18] WANG L L, WANG Y B, QIN Y C, et al.Extraction and determination of protein from edible oil using aqueous biphasic systems of ionic liquids and salts[J].Food and Bioprocess Technology, 2022, 15(1):190-202.
[19] HUANG Y F, ZHANG D M, XUE S Z, et al.The potential of microalgae lipids for edible oil production[J].Applied Biochemistry and Biotechnology, 2016, 180(3):438-451.
[20] 余佳, 赵岚, 张瑞华, 等.葛仙米藻胆蛋白的提取工艺优化及其纯化研究[J].食品研究与开发, 2018, 39(2):82-89.
YU J, ZHAO L, ZHANG R H, et al.Research on optimization of phycobiliprotein extraction from Nostoc sphaeroids Kutzing and the purification of phycobiliprotein[J].Food Research and Development, 2018, 39(2):82-89.
[21] PINTO L F R, FERREIRA G F, BEATRIZ F P, et al.Lipid and phycocyanin extractions from Spirulina and economic assessment[J].The Journal of Supercritical Fluids, 2022, 184:105567.
[22] YANG X H, LI Y, LI Y H, et al.Solid matrix-supported supercritical CO2 enhances extraction of γ-linolenic acid from the cyanobacterium Arthrospira (Spirulina) platensis and bioactivity evaluation of the molecule in zebrafish[J].Marine Drugs, 2019, 17(4):203.
[23] TAVANANDI H A, MITTAL R, CHANDRASEKHAR J, et al.Simple and efficient method for extraction of C-phycocyanin from dry biomass of Arthospira platensis[J].Algal Research, 2018, 31:239-251.
[24] 沈向阳, 梁霄, 付云, 等.钝顶螺旋藻藻蓝蛋白的提取工艺研究[J].现代食品科技, 2019, 35(7):198-204;136.
SHEN X Y, LIANG X, FU Y, et al.Study of the extraction process of phycocyanin from Spirulina platensis[J].Modern Food Science and Technology, 2019, 35(7):198-204;136.
[25] AYEKPAM C, HAMSAVI G K,.Efficient extraction of food grade natural blue colorant from dry biomass of Spirulina platensis using eco-friendly methods[J].Food and Bioproducts Processing, 2021, 129:84-93.
[26] LARROSA A P Q, CAMARA  S, MOURA J M, et al.Spirulina sp.biomass dried/disrupted by different methods and their application in biofilms production[J].Food Science and Biotechnology, 2018, 27(6):1659-1665.
S, MOURA J M, et al.Spirulina sp.biomass dried/disrupted by different methods and their application in biofilms production[J].Food Science and Biotechnology, 2018, 27(6):1659-1665.
[27] OLIVEIRA E G, DUARTE J H, MORAES K, et al.Optimisation of Spirulina platensis convective drying:Evaluation of phycocyanin loss and lipid oxidation[J].International Journal of Food Science &Technology, 2010, 45(8):1572-1578.
[28] CRAMPON C, NIKITINE C, ZAIER M, et al.Oil extraction from enriched Spirulina platensis microalgae using supercritical carbon dioxide[J].The Journal of Supercritical Fluids, 2017, 119:289-296.