我国拥有丰富的鱼类资源,随着我国水产养殖及鱼类产品加工产业的不断发展,鱼糜制品的消费量也越来越大。鱼糜制品因其食用简便、营养价值高、保质期长而受到消费者喜爱[1]。我国大连地区盛产鲅鱼,是北方重要的经济鱼,其具有产量高、肉质肥厚、刺少等特点,是鱼糜加工的主要原材料。但由于冷藏保鲜过程中鱼肉蛋白容易变质,从而使鱼肉的保水性、凝胶性等性能下降,影响产品的质量和营养价值[2]。关于开发能够提升鱼糜制品品质添加剂的研究有待进一步深入。
随着水产业的快速发展,水产品生产中的鱼皮、鱼头、鱼鳞等废弃物也随之产生,而国内的鳕鱼产量大,加工时所产生的鱼皮废弃物占总重量的7%~8%,既浪费了资源,又对环境造成了极大的污染。研究表明,鳕鱼皮中胶原蛋白含量占总蛋白含量的70%以上[3]。鳕鱼鱼皮肽由鱼皮经蛋白酶酶解获得,具有保水性等良好的功能特性[4]。卡拉胶是从红海藻的细胞外基质中提取的主要多糖成分,具有优异的稳定性和凝胶形成性能,已广泛应用于食品和化妆品行业。当前用于鱼糜产品加工的卡拉胶类型多是Kappa(κ-型)与Iota(ι-型),而对于Ramota(λ-型)的应用研究较少。其中,κ-卡拉胶已被广泛应用于改善鱼糜凝胶品质。CHEN等[5]研究表明κ-卡拉胶能显著提高鲤鱼鱼糜的凝胶强度。当前对κ-型、ι-型、λ-型3种不同类型卡拉胶之间的性质差异研究并不充分。美拉德反应是由蛋白质的游离氨基和还原糖的羰基发生的非酶促褐变的化学反应,刘建华等[6]研究表明蛋清蛋白与刺槐豆胶和瓜尔豆胶的美拉德产物显著增强鱼糜制品的凝胶特性。许亚彬等[7]研究表明糖基化改性蛋清粉能提高鲢鱼鱼糜凝胶的凝胶强度和白度。何进武等[8]研究表明糖基化大豆分离蛋白能显著提高鲤鱼鱼糜凝胶的硬度、弹性和黏结性。本实验采用干法美拉德反应,将3种不同构型的卡拉胶与鳕鱼鱼皮胶原蛋白肽进行糖基化反应,以鲅鱼鱼糜作为对象,探究3种不同构型的卡拉胶制备的糖基化产物对鱼糜凝胶产生的性能影响,为保障2次成型鱼糜产品的质量提供方法。
1 材料与方法
1.1 材料与试剂
鳕鱼鱼皮胶原蛋白肽,滨州万嘉生物科技有限公司;κ-型、ι-型、λ-型卡拉胶,源叶生物科技有限公司;KBr(光谱纯),科密欧;β-巯基乙醇、1-苯胺基-8-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS),阿拉丁试剂有限公司;其他化学品和试剂均为分析级。
1.2 仪器与设备
FD-1C-50型冷冻干燥机,北京博医康实验仪器有限公司;NicoletTM iS50傅里叶变换红外光谱仪,赛默飞世尔科技(中国)有限公司;UV-160型紫外可见分光光度计,上海美谱达仪器有限公司;LS55荧光光谱仪,珀金埃尔默仪器有限公司;TA.XT.plus质构仪,北京微讯超技仪器技术有限公司。
1.3 实验方法
1.3.1 鳕鱼鱼皮胶原蛋白肽-卡拉胶美拉德反应体系制备
将鳕鱼鱼皮肽溶于磷酸盐缓冲液中(0.05 mmol/L,pH 7.0),将卡拉胶加入鳕鱼鱼皮肽水溶液中搅拌至完全溶解(肽∶卡拉胶质量比4∶1),冷冻后在冷冻干燥机中冻干。将冻干样品置于培养箱培养14 d,每2 d采集样品,相对温度和湿度为60 ℃和79%,制得3种不同美拉德产物:ι-卡拉胶-鱼皮肽美拉德产物(ι-car-CSCP MRPs)、κ-卡拉胶-鱼皮肽美拉德产物(κ-car-CSCP MRPs)、λ-卡拉胶-鱼皮肽美拉德产物(λ-car-CSCP MRPs),密封保存于-20 ℃。
1.3.2 红外光谱分析
根据李灵诚[9]的方法进行制样,采用Nicoletis-50红外光谱仪在4 000~400 cm-1扫描。
1.3.3 接枝度的测定
根据MAO等[10]的方法稍作修改。通过使用邻苯二甲醛(o-phthaldialdehyde,OPA)测定游离氨基酸的减少来测定结合效率,OPA具体配制方法如下:称取40 mg OPA溶于1.0 mL体积分数95%的乙醇中,依次加入25 mL四硼酸钠缓冲溶液(0.1 mol/L)、2.5 mL SDS溶液(20%,体积分数)、0.1 mL β-巯基乙醇后混合均匀,最后加水至总体积为50 mL。
用OPA法定量游离氨基,0.05 mL的5 mg/mL样品与1.35 mL的OPA试剂混合,室温下水浴1 min,立即用紫外-分光光度计在340 nm处测定吸光度。以L-亮氨酸(1~5 mmol/L)作为含氨基的标准化合物绘制标准曲线。接枝度的计算如公式(1)所示:
接枝度/%=(1-结合后的氨基含量/结合前的氨基含量)×100
(1)
1.3.4 褐变颜色测定
采用紫外-分光光度计在420 nm处测定3种不同种类鳕鱼鱼皮胶原蛋白肽-卡拉胶美拉德产物棕色溶液(10 mg/mL)的吸光度。
1.3.5 表面疏水性测定
根据LUO等[11]的方法稍作修改。将蛋白质量浓度稀释至0.012 5、0.025、0.05、0.1、0.2 mg/mL(0.02 mol/L、pH 7磷酸缓冲液),分别向4 mL样品溶液中加入20 μL 8 mmol/L的ANS溶液,立即混匀,在390/470 nm(激发/发射)下检测荧光强度。用荧光强度对蛋白质量浓度作图并进行线性回归,表面疏水性的值即为线性回归斜率。
1.3.6 荧光光谱测定
根据CAO等[12]的方法做简要修改,配制基于不同类型卡拉胶糖的糖肽样品,质量浓度为2 mg/mL,荧光光谱仪设置参数:激发波长为347 nm,扫描范围为360~600 nm。
1.3.7 鲅鱼鱼糜凝胶的制备
取鱼肉,用5倍体积浸泡20 min,漂洗2次。再用体积分数0.3%的NaCl溶液浸泡20 min后过滤。将鱼肉、鱼肉质量3%的食盐和鱼肉质量5%的8 g/L卡拉胶糖基化产物溶液分别放入搅拌机内,混合搅拌2 min,之后把制备好的鱼糜二段式加热获得鱼糜凝胶,40 ℃加热35 min后90 ℃加热20 min。然后冷却至室温,放入4 ℃冰箱保存。
1.3.8 鲅鱼鱼糜凝胶质构特性分析
利用质构仪测定鱼糜凝胶强度和全质构分析(texture profile analysis,TPA),鱼糜凝胶强度的测定如公式(2)所示[13]:将鱼糜样品制成各边长度为20 mm的立方体,测试条件:探头型号P/5S;测前测后速度均为1 mm/s;触发力15 g。
凝胶强度/(g·mm)=破断力(g)×破断距离(mm)
(2)
鱼糜凝胶TPA参数的测定:将鱼糜样品制成各边长度为20 mm的立方体,测试条件:探头型号P/50;测前,测中,测后速度均为1 mm/s;触发力5 g。
2 结果与分析
2.1 傅里叶红外光谱分析
傅里叶红外光谱常用于分析蛋白质或多肽的二级结构,主要通过蛋白在中红外区的典型的特征峰而分析肽链的结构变化。图1为3种美拉德产物FTIR谱图,在3 500~3 000 cm-1内出现一个宽峰,这可能是游离羟基伸缩振动产生的,或是N—H键变形振动造成的;其次均在1 260~1 000 cm-1内出现吸收峰,此范围下的特征峰为碳氧键的伸缩振动造成的。这是由于美拉德反应后,糖链上的羟基引入到肽链上,使得肽链中羟基和碳氧键数量增加,使得对应的吸收增强[14]。GENG等[15]制备了卵清蛋白和羧甲基纤维素糖基化产物,同样通过红外光谱分析得到羟基的特征吸收峰增强。因此上述现象表明糖分子以共价键形式接入到了鳕鱼鱼皮肽中,形成了美拉德产物。另外,随着反应时间的延长,鳕鱼鱼皮肽糖基化产物3 500~3 000 cm-1和1 260~1 000 cm-1光谱强度逐渐增强,主要是由于糖分子以共价键形式接入肽中,使游离羟基数量增多,而美拉德反应时间越长,反应越彻底,羟基数量越多,从而导致峰的强度越大。

a-ι-car-CSCP MRPs;b-κ-car-CSCP MRPs;c-λ-car-CSCP MRPs
图1 不同孵育时间糖基化产物的傅里叶红外光谱图
Fig.1 FTIR spectra of the glycosylated products at different reaction times
2.2 接枝度及褐变颜色分析
评价美拉德反应程度的重要指标是游离氨基酸的含量,随着游离氨基酸消耗量的增多,反应越完全,随之接枝度越高。利用OPA法测定了美拉德反应产物的结合效率,如图2所示,随着反应时间延长,3种不同美拉德产物的接枝度呈增长趋势,且ι-car-CSCP MRPs、κ-car-CSCP MRPs、λ-car-CSCP MRPs在孵育14 d后,接枝度最高,最高接枝度分别为35.64%、32.25%、45.54%。美拉德反应伴随着褐变,据目前研究表明棕色物质来源于二次美拉德反应的产物。图2同时显示在不同孵育时间下,3种美拉德产物在420 nm处的吸光值,结果表明吸光值与孵育时间成正相关,即溶液褐变程度随着孵育时间越来越深,此现象的产生是由于美拉德反应后期形成大量的褐色聚合体类黑精,随着反应时间的延长,产生的色素物质增加,导致褐变程度加深[16]。其次,在美拉德反应中,鳕鱼鱼皮胶原蛋白肽-卡拉胶美拉德反应速率与接枝度成正比。

a-ι-car-CSCP MRPs;b-κ-car-CSCP MRPs;c-λ-car-CSCP MRPs
图2 不同孵育时间糖基化产物的接枝度和褐变程度
Fig.2 Grafting rate and Browning degree of glycosylated products at different reaction times
2.3 荧光强度分析
荧光物质是褐变产物形成之前产生的,是美拉德反应的早期指标。美拉德反应过程中,初始中间体通过Strecker降解转化为一种荧光物质,然后进一步反应,发生褐变[17]。如图3所示,3种不同卡拉胶美拉德产物均在孵育4 d后,荧光强度达到最大,随后随着时间的延长荧光强度逐渐减少,LIU等[18]在乳清分离蛋白和葡萄糖美拉德产物中也得到类似的结论,研究表明,乳清蛋白葡萄糖美拉德产物的荧光强度在第4天达到最大,然后下降。JING等[19]制备了核糖与酪蛋白美拉德产物,研究发现美拉德产物的荧光强度同样在第4天达到最大,然后下降。产生此现象可能是因为肽链在加热过程中结构被破坏,暴露出更多具有荧光吸收能力的苯环基团,使荧光强度增加。而在荧光强度达到峰值后随反应时间的增加而降低,可能是由于肽与卡拉胶发生共价反应,反应产物的空间位阻增加,减弱了氨基酸吸收荧光的信号,导致荧光强度降低[20]。因此荧光物质在前4天不断生成,4 d后荧光物质转化为褐色化合物,导致荧光物质减少,荧光强度降低。

a-ι-car-CSCP MRPs;b-κ-car-CSCP MRPs;c-λ-car-CSCP MRPs
图3 不同孵育糖基化时间产物的荧光光谱图
Fig.3 Intrinsic fluorescence spectra of glycosylated products with different reaction time
2.4 表面疏水性分析
图4为3种不同美拉德产物的表面疏水性分析,分析可知,当具有多羟基的卡拉胶与鳕鱼鱼皮胶原蛋白肽发生共价交联,且随着反应时间加长,表面疏水性明显降低。说明糖基化后肽表面亲水簇分子减少,有研究表明,当在肽上接入卡拉胶分子时,打破了肽自身的亲水和疏水平衡,肽链中亲水基团数量增加,分子表面的亲水性增强;其次,引入卡拉胶后,肽链分子内部的极性基团暴露出来,疏水性降低[21]。3种美拉德产物表面疏水性随着孵育时间增长而降低,当孵育14 d时,ι-car-CSCP MRPs与第0天相比降低了40.78%;κ-car-CSCP MRPs与第0天相比降低了33.95%;λ-car-CSCP MRPs与第0天相比降低了30.73%。三者对比,ι-car-CSCP MRPs对表面疏水性改变最大。由此可知,随着卡拉胶接枝到鳕鱼鱼皮胶原蛋白肽上,胶原蛋白肽的表面疏水性降低,整个体系的亲水性增强,使胶原蛋白肽更易于在体系中分散,故通过美拉德反应,鳕鱼鱼皮胶原蛋白肽的溶解性得到改善,其次较大的溶解有利于鳕鱼鱼皮胶原蛋白肽向气-水或油-水界面的扩散,极大地改善了肽的乳化性、起泡性等功能性质[22]。

a-ι-car-CSCP MRP;b-κ-car-CSCP MRPs;c-λ-car-CSCP MRPs
图4 不同孵育时间糖基化产物的表面疏水性
Fig.4 Surface hydrophobicity of glycosylated products at different reaction times
注:不同小写字母表示差异显著,P<0.05。
2.5 三种不同卡拉胶美拉德产物对鱼糜凝胶TPA性能的影响
表1、表2和表3为3种不同卡拉胶糖基化产物在不同孵育时间下对鱼糜凝胶TPA性能的影响。分析可得,添加糖基化产物后的鱼糜凝胶相比于未添加的空白组来说,硬度都有显著的提升,而弹性、黏聚性和回复性无太大差别。对于κ-car-CSCP MRPs,当样品孵育时间为6 d时,硬度达到最大,相较于空白组提高了36.63%;对于ι-car-CSCP MRPs,当样品孵育时间为4 d时,硬度达到最大,相较于空白组提高了40.91%;对于λ-car-CSCP MRPs,当样品孵育时间为2 d时,硬度达到最大,相较于空白组提高了7.65%。在此基础上,分析可得当κ-car-CSCP MRPs在孵育6 d时,鱼糜凝胶的硬度达到最大。因此,添加糖基化产物能增加鱼糜硬度,且当κ-car-CSCP MRPs孵育6 d时,硬度达到最大,为31.31 N。产生此差异的原因是由于卡拉胶自身的凝胶性质决定,不同类型卡拉胶的增稠和胶凝性质有很大的不同,κ-型卡拉胶与K+形成硬且脆的凝胶,而ι-型和λ-型卡拉胶形成的凝胶较为柔软。因此糖基化反应后,添加κ-car-CSCP MRPs的鱼糜硬度也相应较大。
表1 添加不同孵育时间ι-卡拉胶糖基化产物对鱼糜凝胶质构的影响
Table 1 Effects of adding ι-car-CSCP MRPs at different reaction times on the texture properties of surimi gel
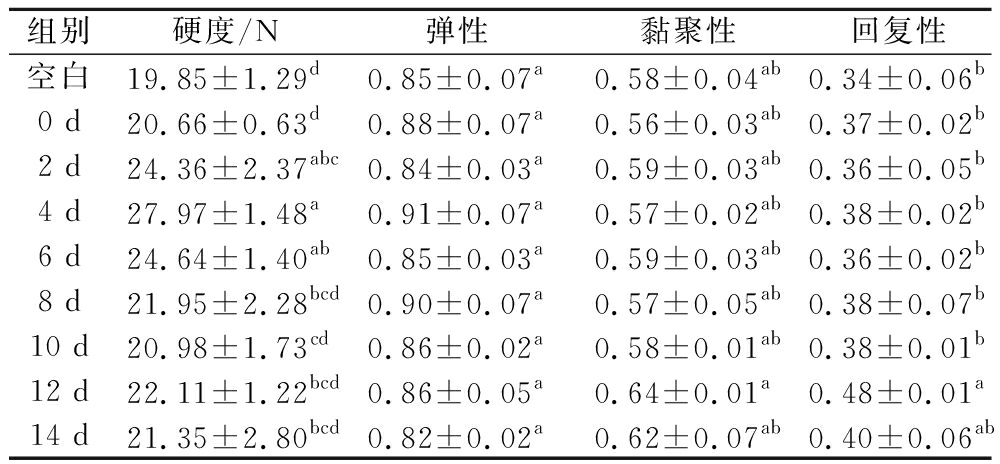
组别硬度/N弹性黏聚性回复性空白19.85±1.29d0.85±0.07a0.58±0.04ab0.34±0.06b0 d20.66±0.63d0.88±0.07a0.56±0.03ab0.37±0.02b2 d24.36±2.37abc0.84±0.03a0.59±0.03ab0.36±0.05b4 d27.97±1.48a0.91±0.07a0.57±0.02ab0.38±0.02b6 d24.64±1.40ab0.85±0.03a0.59±0.03ab0.36±0.02b8 d21.95±2.28bcd0.90±0.07a0.57±0.05ab0.38±0.07b10 d20.98±1.73cd0.86±0.02a0.58±0.01ab0.38±0.01b12 d22.11±1.22bcd0.86±0.05a0.64±0.01a0.48±0.01a14 d21.35±2.80bcd0.82±0.02a0.62±0.07ab0.40±0.06ab
注:同列不同小写字母代表差异显著,P<0.05(下同)。
表2 添加不同孵育时间κ-卡拉胶糖基化产物对鱼糜凝胶质构的影响
Table 2 Effects of adding κ-car-CSCP MRPs at different reaction times on the texture properties of surimi gel
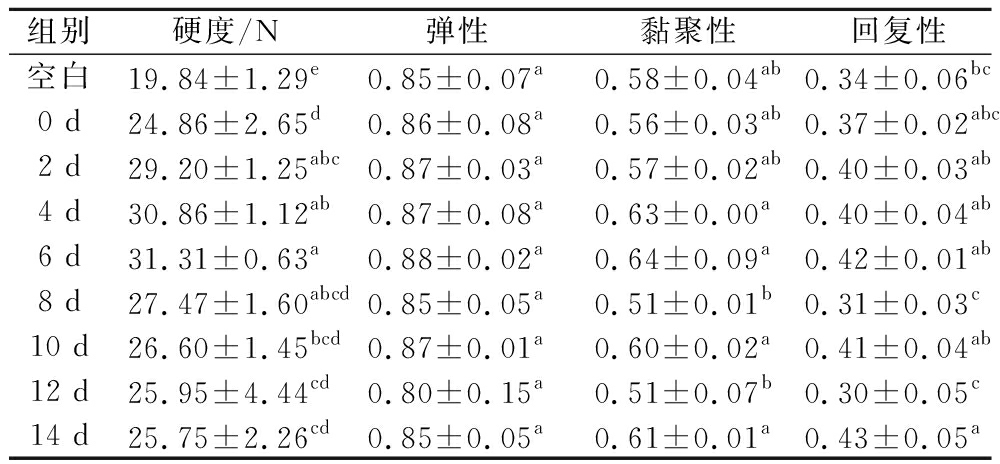
组别硬度/N弹性黏聚性回复性空白19.84±1.29e0.85±0.07a0.58±0.04ab0.34±0.06bc0 d24.86±2.65d0.86±0.08a0.56±0.03ab0.37±0.02abc2 d29.20±1.25abc0.87±0.03a0.57±0.02ab0.40±0.03ab4 d30.86±1.12ab0.87±0.08a0.63±0.00a0.40±0.04ab6 d31.31±0.63a0.88±0.02a0.64±0.09a0.42±0.01ab8 d27.47±1.60abcd0.85±0.05a0.51±0.01b0.31±0.03c10 d26.60±1.45bcd0.87±0.01a0.60±0.02a0.41±0.04ab12 d25.95±4.44cd0.80±0.15a0.51±0.07b0.30±0.05c14 d25.75±2.26cd0.85±0.05a0.61±0.01a0.43±0.05a
表3 添加不同孵育时间λ-卡拉胶糖基化产物对鱼糜凝胶质构的影响
Table 3 Effects of adding λ-car-CSCP MRPs at different reaction times on the texture properties of surimi gel

组别硬度/N弹性黏聚性回复性空白19.88±1.29a0.85±0.03a0.52±0.02a0.31±0.02a0 d21.08±1.22a0.84±0.03a0.58±0.01a0.38±0.02a2 d21.40±0.89a0.80±0.13a0.60±0.01a0.41±0.05a4 d21.00±2.47a0.75±0.08a0.57±0.05a0.37±0.07a6 d18.74±1.18a0.81±0.11a0.57±0.10a0.33±0.01a8 d14.80±1.74b0.86±0.02a0.55±0.06a0.33±0.08a10 d14.45±0.35b0.87±0.02a0.58±0.05a0.41±0.05a12 d14.40±1.19b0.78±0.065a0.63±0.06a0.36±0.00a14 d13.83±0.71b0.87±0.02a0.58±0.05a0.41±0.05a
2.6 三种不同卡拉胶美拉德产物对鱼糜凝胶强度的影响
凝胶强度是评价鱼糜品质的重要指标。图5显示了3种美拉德产物对鱼糜凝胶强度的影响。不同反应时间下,3种美拉德产物的添加对鱼糜凝胶强度的影响类似。随着孵育时间的的延长都呈先上升后下降的趋势。对于κ-卡拉胶,孵育时间为6 d时凝胶强度最大,为1 825.48 g·mm;对于ι-卡拉胶,孵育时间为4 d时凝胶强度最大,为1 700.10 g·mm;对于λ-卡拉胶,孵育时间为2 d时凝胶强度最大,为1 408.03 g·mm。且添加卡拉胶美拉德产物的鱼糜其凝胶强度均高于未添加卡拉胶美拉德产物的鱼糜凝胶强度,说明3种卡拉胶美拉德产物的添加对于鱼糜凝胶强度的提升有一定作用。可能是由于在制作鱼糜的过程中,卡拉胶能与肌肉中蛋白质发生相互作用,强化了由于肌球蛋白受热变性伸展交联形成的凝胶网状结构,从而增强凝胶网络并减少水分损失[23]。其中,κ-car-CSCP MRPs孵育6 d时的凝胶强度最好,研究表明肌原纤维蛋白交联是鱼糜凝胶的骨架,而κ-卡拉胶可以作为黏合剂来加强这种基质,使其更紧凑和更坚固,从而增强凝胶强度[24]。其次,鳕鱼鱼皮肽在美拉德反应前期,由于肽的结构部分展开,可以提高肽的凝胶性,但过度结合亦使糖基化产物溶解度降低,导致凝胶网络的弱化[25],因此,当添加孵育6 d的κ-卡拉胶糖肽物时,鱼糜的凝胶强度达到最大。

图5 添加不同孵育时间糖基化产物的鱼糜凝胶强度
Fig.5 Gel strength of surimi with glycosylated products at different reaction times
3 结论与讨论
综上所述,3种不同构型卡拉胶与鳕鱼鱼皮肽经由糖基化反应制备肽糖基化产物,红外光谱图表明糖分子以共价键形式接入到了鳕鱼鱼皮肽中,形成了美拉德产物。其次随着孵育时间的增加,反应物形成大量的褐色聚合体类黑精,使糖基化产物的接枝度、褐变程度逐渐提高;荧光强度是美拉德反应早期产物,在4 d达到最大值,随后下降;而引入卡拉胶后,肽链分子内部的极性基团暴露出来,表面疏水性随时间的延长而降低。3种构型的卡拉胶糖基化产物的结构特性有所差异,但产生差异的机理还需进一步探究。将3种不同糖基化产物添加入鲅鱼鱼糜中,制得鱼糜凝胶,相较于空白组,鱼糜凝胶的凝胶强度和硬度都有显著提升,其中孵育6 d的κ-car-CSCP MRPs加入到鱼糜凝胶中后,使其凝胶强度和硬度达到最大,分别为1 825.48 g·mm和31.31 N,主要是由于κ-型卡拉胶形成的凝胶硬且脆,而ι-型和λ-型卡拉胶形成的凝胶较为柔软。综合考虑凝胶强度和质构的测定结果,向鱼糜凝胶中添加孵育6 d的κ-car-CSCP MRPs,鱼糜凝胶的品质最优质。本研究探讨了不同构型卡拉胶与鳕鱼鱼皮肽制备肽糖基化产物,3种产物的结构性质都存在差异,其次将3种糖基化产物添加至鱼糜凝胶中,为改善鲅鱼鱼糜品质提供了理论基础,同时实现了鳕鱼鱼皮肽的废物利用,提高了鳕鱼鱼皮肽的经济价值,拓宽了鳕鱼鱼皮肽的应用范围。
[1] 阙凤, 高天麒, 汪超, 等.不同糖类对草鱼鱼糜凝胶的影响[J].食品工业科技, 2022, 43(5):48-55.
QUE F, GAO T Q, WANG C, et al. Effect of different carbohydrates on gel properties of grass carp surimi[J].Science and Technology of Food Industry, 2022, 43(5):48-55.
[2] 罗璨, 倪辉, 万硕, 等.K型与I型卡拉胶对白鲢鱼糜持水性及质构冻藏稳定性的影响[J].中国食品添加剂, 2020, 31(3):76-82.
LUO C, NI H, WAN S, et al.Effect of K-and I-carrageenan on water holding capacity and frozen storage stability of silver carp (Hypophthalmichehys molitrix) surimi[J].China Food Additives, 2020, 31(3):76-82.
[3] 张廷奕, 王灿, 李治衡, 等.四种还原糖对鱼皮胶原肽美拉德反应产物的理化性质及增咸作用影响[J].食品与发酵工业, 2021, 47(13):161-166.
ZHANG T Y, WANG C, LI Z H, et al.Four reducing sugars on the physicochemical and salt taste-enhancing properties of Maillard reaction products from fish skin collagen peptides[J].Food and Fermentation Industries, 2021, 47(13):161-166.
[4] 沈楚仪, 杨最素.鳕鱼皮胶原蛋白肽的制备与活性研究进展[J].安徽农业科学, 2018, 46(1):16-17;51.
SHEN C Y, YANG Z S.Research progress on preparation and activity of collagen peptide from cod skin[J].Journal of Anhui Agricultural Sciences, 2018, 46(1):16-17;51.
[5] CHEN J X, DENG T Y, WANG C, et al.Effect of hydrocolloids on gel properties and protein secondary structure of silver carp surimi[J].Journal of the Science of Food and Agriculture, 2020, 100(5):2252-2260.
[6] 刘建华, 苏琦, 朱旻琪, 等.糖基化凝胶增强剂对鱼糜制品凝胶特性的影响[J].食品科学, 2019, 40(4):102-107.
LIU J H, SU Q, ZHU M Q, et al.Effect of glycosylated gel enhancers on the gel properties of surimi products[J].Food Science, 40(4):102-107.
[7] 许亚彬, 胥伟, 黄迪.糖基化改性蛋清粉提高鲢鱼鱼糜凝胶性的研究[J].现代农业科技, 2015(22):278-280.
XU Y B, XU W, HUANG D.Research on improving glling properties of silver carp surimi using glycated egg white powder[J].Modern Agricultural Science and Technology, 2015(22):278-280.
[8] 何进武, 樊伟伟.糖基化大豆分离蛋白对鲤鱼鱼糜凝胶和乳化特性的影响[J].食品研究与开发, 2018, 39(6):23-27.
HE J W, FAN W W.Effects of glycosylated soy protein isolate on gel and emulsifying properties of carp myofibrillar protein[J].Food Research and Development, 2018, 39(6):23-27.
[9] 李灵诚. 大米蛋白糖基化接枝产物的制备及理化与功能特性研究[D].南宁:广西大学, 2020.
LI L C.Preparation, physicochenmical and functional properties of glycosylated graft products of rice protein[D].Nanning:Guangxi University, 2020.
[10] MAO L K, PAN Q Y, HOU Z Q, et al.Development of soy protein isolate-carrageenan conjugates through Maillard reaction for the microencapsulation of Bifidobacterium longum[J].Food Hydrocolloids, 2018, 84:489-497.
[11] LUO Y T, TU Y Q, REN F Z, et al.Characterization and functional properties of Maillard reaction products of β-lactoglobulin and polydextrose[J].Food Chemistry, 2022, 377:131749.
[12] CAO J R, YAN H X, LIU L.Optimized preparation and antioxidant activity of glucose-lysine Maillard reaction products[J].LWT, 2022, 161:113343.
[13] 孙科, 闫方华, 许晓敏, 等.苹果多酚改性蛋清改善鲅鱼鱼糜的凝胶性质[J].现代食品科技, 2020, 36(10):210-217;164.
SUN K, YAN F H, XU X M, et al.Apple polyphenols-modified egg white improves the gelling properties of Spanish mackerel surimi[J].Modern Food Science and Technology, 2020, 36(10):210-217;164.
[14] 汪姣玲. 乳清蛋白美拉德改性及其产物功能特性研究[D].无锡:江南大学, 2015.
WANG J L.Study on Maillard modification of whey protein and functional properties of its products[D].Wuxi:Jiangnan University, 2015.
[15] GENG X P, CUI B, LI Y, et al.Preparation and characterization of ovalbumin and carboxymethyl cellulose conjugates via glycosylation[J].Food Hydrocolloids, 2014, 37:86-92.
[16] 李菁, 刘骞, 孔保华, 等.L-赖氨酸与3种还原糖美拉德反应产物的理化特性及抗氧化活性[J].食品科学, 2013, 34(3):80-85.
LI J, LIU Q, KONG B H, et al.Physico-chemical properties and antioxidant activity of Maillard reaction products from L-lysine and reducing sugar model system[J].Food Science, 2013, 34(3):80-85.
[17] HAN Y T, ZHAO C C, HAN J R, et al.Antioxidant activity of sea cucumber (Stichopus japonicus) gut hydrolysates-ribose Maillard reaction products derived from organic reagent extraction[J].Journal of Food Measurement and Characterization, 2019, 13(4):2790-2797.
[18] LIU Q, KONG B H, HAN J C, et al.Structure and antioxidant activity of whey protein isolate conjugated with glucose via the Maillard reaction under dry-heating conditions[J].Food Structure, 2014, 1(2):145-154.
[19] JING H, KITTS D D.Chemical and biochemical properties of casein-sugar Maillard reaction products[J].Food and Chemical Toxicology, 2002, 40(7):1007-1015.
[20] 王亮, 田玉潭, 刘军, 等.超声预处理对鸡骨香精基料美拉德反应及生物活性的影响[J/OL].食品与发酵工业, 2022.DOI:10.13995/j.cnki.11-1802/ts.032596.
WANG L, TIAN Y T, LIU J, et al.Effect of ultrasound pretreatment on the Maillard reaction and bioactive properties of chicken bone essence basic material[J/OL].Food and Fermentation Industries, 2022.DOI:10.13995/j.cnki.11-1802/ts.032596.
[21] 罗志刚, 卢静静, 孙炜炜.乳清分离蛋白-可溶性淀粉接枝物的制备及其理化性质[J].食品与发酵工业, 2011, 37(9):70-73;78.
LUO Z G, LU J J, SUN W W.Preparation and physicochemical properties of whey protein isolate-soluble starch conjugate[J].Food and Fermentation Industries, 2011, 37(9):70-73;78.
[22] EL NASRI N A, EL TINAY A H.Functional properties of fenugreek (Trigonella foenum graecum) protein concentrate[J].Food Chemistry, 2007, 103(2):582-589.
[23] 于楠楠. 盐和多糖对鱼糜凝胶形成的影响与机制[D].无锡:江南大学, 2017.
YU N N.Effect and mechanism of salt and polysaccharide on gel formation of surimi[D].Wuxi:Jiangnan University, 2017.
[24] YU W Y, WANG Z M, PAN Y X, et al.Effect of κ-carrageenan on quality improvement of 3D printed Hypophthalmichthys molitrix-sea cucumber compound surimi product[J].LWT, 2022, 154:112279.
[25] 段汝清, 苏宇杰, 王俊伟, 等.瓜尔豆胶酶解液改性蛋清蛋白凝胶性质的研究[J].食品与生物技术学报, 2018, 37(7):714-721.
DUAN R Q, SU Y J, WANG J W, et al.Effect of guar gum hydrolysate on gel properties of egg white protein[J].Journal of Food Science and Biotechnology, 2018, 37(7):714-721.