龙须菜(Gracilariopsis lemaneiformis),又名海发菜、线菜、属于红藻门(Rhodophyta)江蓠科 (Gracilariaceae),是一种重要的产琼胶类海藻,也是中国继海带、裙带菜、紫菜之后的第四大栽培海藻[1],其原产地为山东,随后在广东、福建、海南等沿海省份养殖成功并大量栽培。2021年广东省江篱产量高达45 138 t,占全国总量的12.23%,以龙须菜为代表的江蓠栽培已成为中国海藻栽培产业的重要支柱[2-3]。龙须菜在食品行业中的一个重要用途是提取琼胶,琼胶是由1,4-3,6内醚-α-L-半乳糖和1,3-β-D-半乳糖交替连接而成的多糖链,同时含有少量的硫酸基团[4],是目前世界上用途最广泛的海藻胶(琼胶、卡拉胶和海藻酸钠)之一,由于其良好的凝胶特性,被广泛用于食品、药品和生化等领域[5-7]。
广东沿海地区是我国龙须菜主要产地,由于收获期炎热多雨,农户仓储设备简陋,遇高温天气时收获堆积的龙须菜中心温度可达50 ℃,且藻类作物在贮藏期间易受霉变,虫蛀或其他污染物的干扰,极易发生品质劣变,进而影响其后续加工利用的经济效益,造成不可避免的经济损失[8]。因此,龙须菜在贮藏过程中的品质保证至关重要。贮藏时间是影响海藻琼胶品质的重要因素,长时间贮藏会促进海藻多糖分子降解。FREILE-PELEGR N[9]曾报道过墨西哥尤卡坦州龙须菜琼胶品质会受到贮藏时间的负面影响。ROMERO等[10]对龙须菜采后贮藏31个月胞壁多糖的状况进行了研究,其结果也表明琼胶的物理和结构参数一般都随着贮藏时间的延长而降低。不仅如此,藻体水分含量、贮藏温度增加也可能会加速琼胶的降解过程[11]。张曦文等[12]探究了江篱在贮藏过程的琼胶酶活性变化规律,发现江篱采收及干燥后的水分含量是影响琼胶提取得率和凝胶强度的关键因素。ARMISEN[13]研究发现,水分含量低于20%且贮藏条件干燥良好下的石花菜贮藏期限可达10年,其琼胶的产量和质量与新鲜石花菜无异。海藻中的琼胶降解程度会随微生物的生长繁殖或琼胶降解酶活性的升高而加剧。近年来,朱思颖等[14]发现了腐败龙须菜中存在琼胶酶会使其自身发生水解,探究表明江篱琼胶的水解与微生物作用密切相关。研究发现产琼胶类海藻中34%的菌株对琼胶具有降解性,在微生物分泌的琼胶酶降解作用下,琼胶黏度显著下降,凝固性降低,琼胶的凝胶性质改变[15-17]。
N[9]曾报道过墨西哥尤卡坦州龙须菜琼胶品质会受到贮藏时间的负面影响。ROMERO等[10]对龙须菜采后贮藏31个月胞壁多糖的状况进行了研究,其结果也表明琼胶的物理和结构参数一般都随着贮藏时间的延长而降低。不仅如此,藻体水分含量、贮藏温度增加也可能会加速琼胶的降解过程[11]。张曦文等[12]探究了江篱在贮藏过程的琼胶酶活性变化规律,发现江篱采收及干燥后的水分含量是影响琼胶提取得率和凝胶强度的关键因素。ARMISEN[13]研究发现,水分含量低于20%且贮藏条件干燥良好下的石花菜贮藏期限可达10年,其琼胶的产量和质量与新鲜石花菜无异。海藻中的琼胶降解程度会随微生物的生长繁殖或琼胶降解酶活性的升高而加剧。近年来,朱思颖等[14]发现了腐败龙须菜中存在琼胶酶会使其自身发生水解,探究表明江篱琼胶的水解与微生物作用密切相关。研究发现产琼胶类海藻中34%的菌株对琼胶具有降解性,在微生物分泌的琼胶酶降解作用下,琼胶黏度显著下降,凝固性降低,琼胶的凝胶性质改变[15-17]。
琼胶的品质可以通过其物理特性(如凝胶强度、凝胶脱水、黏度、凝胶和熔融温度)和化学特性(如硫酸盐和3, 6-内醚半乳糖含量)反映。目前,关于海藻琼胶的研究主要集中在海藻琼胶的提取条件[18]、海藻种类[19]、海藻收获季节[20]及环境参数[21]等因素对琼胶的凝胶强度、凝胶脱水等品质影响的方面,但海藻收获后的贮藏条件对其琼胶品质的影响却鲜有人探究。因此,本实验通过模拟龙须菜采收及晾干后的自然贮藏条件,探究在贮藏过程中的龙须菜琼胶提取得率、凝胶强度、琼胶酶活性、还原糖含量、菌落总数和各项理化性质变化规律,明确琼胶品质变化与贮藏条件之间的内在联系,为合理贮藏龙须菜提供科学依据。
1 材料与方法
1.1 材料与试剂
龙须菜采于广东汕头,2021年9月收获,经过初步的除杂、晾干等处理,水分含量控制在12%~55%;实验用水为超纯水;HCl、三氯乙酸、BaCl2、间苯二酚、乙缩醛、NaOH等,广州化学试剂厂;以上试剂均为分析纯。
1.2 仪器与设备
HH-4快速恒温数显水浴锅,常州澳华仪器有限公司;CT-3质构仪,美国Brookfield公司;BS224S分析天平,美国Sartorius公司;AS20500/BDT超声清洗机,天津奥特赛恩斯仪器有限公司;Synergy全功能酶标仪,美国BioTek公司。
1.3 实验方法
1.3.1 琼胶的提取
预处理→碱处理→水洗Ⅰ→酸处理→水洗Ⅱ→过滤提胶→冷冻脱水→干燥
工艺流程参照文献[22-23]的方法,要点如下。
碱处理:将干重10.0 g龙须菜投入装有400 mL体积分数25%的NaOH溶液的烧杯中,40 ℃水浴4 h。藻体质量与碱用量比为1∶40 (g∶mL),用蒸馏水将藻体水洗3~4次至近中性。
酸处理:将水洗后的龙须菜投入装有400 mL的HCl溶液(pH 1.5)中浸泡10 min,排去酸液,用蒸馏水将藻体水洗3~4次至近中性。
提胶:加200 mL蒸馏水于洗至中性的龙须菜中,煮制30 min,趁热过200目纱布过滤。
冷冻脱水:将凝胶放置-20 ℃冰箱中冷冻,24 h后取出解冻脱水。
烘干和粉碎:分别将脱水后的琼胶,置于50 ℃烘箱中烘干,粉碎。
1.3.2 琼胶得率和凝胶强度的测定
将水分含量为12%、25%、35%、45%和55%的龙须菜分别密封于保鲜袋中,再分别放置于10、20、30、40、50 ℃恒温恒湿箱中模拟贮藏7 d,每组设置3个平行,测定经处理后不同贮藏时期各项指标。
1.3.2.1 得率测定
琼胶得率按公式(1)计算:
得率![]()
(1)
1.3.2.2 凝胶强度测定
参照GB 1886.239—2016《食品安全国家标准 食品添加剂 琼脂》中规定的方法制备琼胶凝胶,将琼胶液体倒入直径50 mm的玻璃培养皿中,冷凝后采用CT3质构仪测定其凝胶强度(g/cm2)。测定方法和参数:采用TA19圆柱探头,测试类型破裂模式,测试速度0.5 mm/s,触发点负载5 g,测定5~7次取平均值。
1.3.3 琼胶硫酸基含量的测定
参考丛建波等[24]优化后使用。准确吸取标准硫酸基溶液(0.6 mg/mL) 0.00、0.02、0.04、0.06、0.08、0.1、0.12、0.14、0.16、0.18、0.2 mL,加1 moL/L HCl溶液补至0.2 mL,再加入3.8 mL 3%(体积分数)三氯乙酸和1.0 mL用5 g/L明胶配制的10 g/L BaCl2溶液。摇匀,室温静置15 min,于360 nm波长下测吸收值A1。按以上操作,用1.0 mL 10 g/L明胶代替BaCl2溶液测吸收值A2,以硫酸基毫克数为横坐标,吸收值(A1-A2)为纵坐标作标准曲线。结果表明,![]() 在0~120 μg范围内线性关系良好,所得回归方程为:Y=0.020 1X+0.015 7(R2=0.999 6)。
在0~120 μg范围内线性关系良好,所得回归方程为:Y=0.020 1X+0.015 7(R2=0.999 6)。
准确称取琼胶样品35.0 mg于50 mL容量瓶中,加10 mL 1 moL/L HCl溶液,100 ℃水浴3 h,冷却后补齐至25 mL,并用滤纸过滤。按标准曲线的制作方法测吸收值(A1-A2),由标准曲线计算样品中硫酸基含量。
1.3.4 琼胶3,6-内醚半乳糖含量的测定
参考李龙等[25]的方法优化后使用。准确吸取果糖稀释溶液(25 μg/mL) 0.0、0.2、0.4、0.6、0.8、1.0 mL于10 mL的具塞试管中,用去离子水补至1.0 mL后盖塞冰水浴5 min,分别加入5 mL间苯二酚溶液,置80 ℃恒温水浴15 min后冰水浴冷却,于554 nm波长下测吸收值。其中每点做3个平行样品,取平均值。结果表明,果糖质量浓度在0~25 mg/mL线性关系良好,所得回归方程为:Y=0.024 4X+0.088 9(R2=0.996 4)。
准确称取琼胶样品25.0 mg于50 mL离心管中,加20 mL蒸馏水加热溶解,冷却后补齐至50 mL,按标准曲线的制作方法测吸收值,由标准曲线计算样品中3, 6-内醚半乳糖含量。
1.3.5 琼胶相对黏度的测定
参考问莉莉[26]的方法并稍作优化。于30 ℃恒温条件下,记1 mg/mL的糖液流经乌氏黏度计的时间为t0。保持多糖浓度一致,记录不同样品糖液流经乌氏黏度计的时间为t,糖液和溶剂水流经时间的比值即为相对黏度ηr,如公式(2)所示:
(2)
1.3.6 龙须菜中菌落总数的测定
采用平板计数法,称取25.0 g龙须菜样品,放入225 mL无菌生理盐水袋,均质。参考GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法检测。
1.3.7 龙须菜中还原糖含量的测定
参考文献[14,27]的方法优化后使用。取样品5.0 g于烧杯中,加入50 mL蒸馏水,置100 ℃水浴30 min,搅拌,真空抽滤,保存滤液。分别取滤液1.0 mL至3支10 mL离心管中,加入1.5 mL DNS溶液,沸水浴5 min,终止反应后用蒸馏水定容至25 mL,于520 nm波长下测吸收值,根据标准曲线计算还原糖含量。
1.3.8 龙须菜中琼胶酶活性的测定
参考文献[14, 27]的方法,优化后使用。取龙须菜样品5.0 g于50 mL离心管中,加入磷酸盐缓冲溶液(pH 7.4) 50 mL涡旋振荡15 min,4 ℃下4 000 r/min离心20 min,取1.0 mL上清液与含2 g/L琼胶的磷酸盐缓冲液(pH 7.4)1.5 mL于新的离心管中,混匀后40 ℃反应30 min后,加入1.5 mL DNS溶液,沸水浴5 min,终止反应后用蒸馏水定容至25 mL,于520 nm波长下测吸收值,根据标准曲线计算琼胶酶活性。
1.3.9 数据分析与统计
采用SPSS 21.0软件对实验数据进行统计分析,每组实验做3次平行,结果用“平均值±标准差”表示,用Origin 2021软件绘图。
2 结果与分析
2.1 贮藏条件对龙须菜琼胶提取得率的影响
由图1可知,相同贮藏时间和贮藏温度下,龙须菜琼胶提取得率随着水分含量的增加而显著减小(P<0.05),相同贮藏时间和水分含量下,龙须菜琼胶提取得率随着贮藏温度的升高而显著减小(P<0.05)。相对于贮藏温度10 ℃,贮藏温度50 ℃时水分含量对龙须菜琼胶的提取得率的影响更显著,相对于水分含量55%,水分含量12%时龙须菜琼胶提取得率更高。这与张曦文等[12]对江篱琼胶提取得率的研究结果具有相似性。在贮藏过程中,较高的水分含量和贮藏温度会导致龙须菜提取的琼胶得率明显下降,结合不同贮藏条件下龙须菜中琼胶酶活性的变化和还原糖含量变化,推测在适宜微生物生长的贮藏条件下,微生物大量繁殖,分泌琼胶酶、纤维素酶及其他酶致使藻体软化,在提取过程中琼胶更易溶于碱液,导致水洗时胶质不同程度的流失,得率下降。

a-1 d;b- 3 d;c- 5 d;d-7 d
图1 不同水分含量及不同贮藏时间下贮藏温度对琼胶得率的影响
Fig.1 Effect of storage temperature on the yield of agar under different moisture content and storage time
注:不同大写字母表示样品在同一贮藏时间同一水分含量下不同温度差异显著 (P<0.05),不同小写字母表示样品在同一贮藏时间同一温度下不同水分含量差异显著 (P<0.05)(下同)。
2.2 贮藏条件对龙须菜琼胶凝胶强度的影响
由图2可知,相同贮藏时间和贮藏温度下,龙须菜琼胶凝胶强度随着水分含量的增加而减小,相同贮藏时间和水分含量下,龙须菜琼胶凝胶强度随着贮藏温度的升高而减小。相对于贮藏温度10 ℃,贮藏温度50 ℃时水分含量对龙须菜琼胶凝胶强度的影响更显著,相对于水分含量55%,水分含量12%时龙须菜琼胶凝胶强度更高。ROMERO等[10]和FREILE-PELEGR N等[11]曾报道,贮藏过程中,贮藏时间的延长和水分含量的增加对藻类琼胶凝胶强度有消极影响。在实验过程中发现,还原糖含量与琼胶酶活性高的龙须菜样品,所提取的琼胶凝胶强度普遍较低,对凝胶强度有显著性差异的琼胶样品进行黏度检测,通过相对黏度反映分子质量大小,其结果表明凝胶强度与黏度之间呈极显著正相关,多糖分子质量的差异可能是导致凝胶强度变化的主要原因。可以推测在贮藏过程中海藻琼胶发生了降解,琼胶分子链断裂,分解为没有凝固性能的小分子,还原糖含量增加,3, 6-内醚半乳糖含量减少,琼胶凝胶强度降低。
N等[11]曾报道,贮藏过程中,贮藏时间的延长和水分含量的增加对藻类琼胶凝胶强度有消极影响。在实验过程中发现,还原糖含量与琼胶酶活性高的龙须菜样品,所提取的琼胶凝胶强度普遍较低,对凝胶强度有显著性差异的琼胶样品进行黏度检测,通过相对黏度反映分子质量大小,其结果表明凝胶强度与黏度之间呈极显著正相关,多糖分子质量的差异可能是导致凝胶强度变化的主要原因。可以推测在贮藏过程中海藻琼胶发生了降解,琼胶分子链断裂,分解为没有凝固性能的小分子,还原糖含量增加,3, 6-内醚半乳糖含量减少,琼胶凝胶强度降低。

a-1 d;b-3 d;c-5 d;d-7 d
图2 不同水分含量及不同贮藏时间下贮藏温度对凝胶强度的影响
Fig.2 Effect of storage temperature on gel strength under different moisture content and storage time
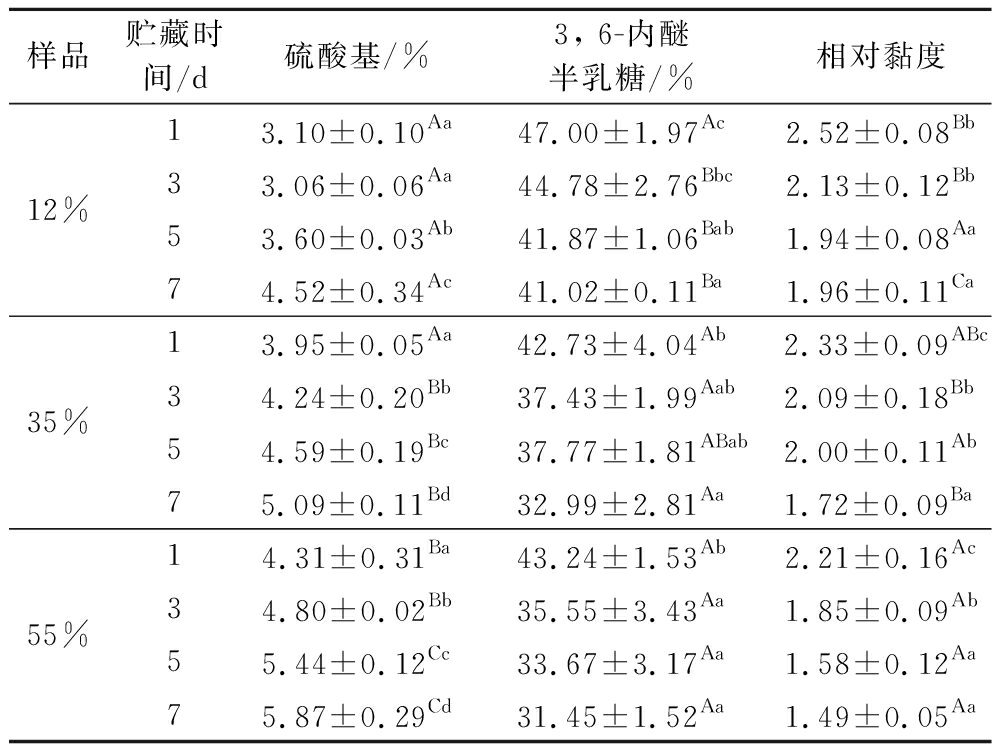
2.3 贮藏条件对琼胶理化性质的影响
硫酸基含量、3, 6-内醚半乳糖含量和相对黏度是琼胶品质的重要判断指标[28]。琼胶的硫酸化程度与凝胶特性(凝胶强度、凝胶和熔融温度)呈负相关性[29];3, 6-内醚半乳糖含量越高,琼胶凝胶能力越强;相对黏度越大,琼胶凝胶性能越好[30-31]。由表1~表3可知,贮藏温度保持恒定,在相同水分含量下,龙须菜琼胶的硫酸基含量随着贮藏时间的增加呈现增加趋势,3, 6-内醚半乳糖含量随着贮藏时间的增加呈现减小趋势。相同贮藏时间下,龙须菜琼胶的硫酸基含量随着水分含量的增加呈现增加趋势,3, 6-内醚半乳糖含量随着水分含量的增加呈现减小趋势。ROMERO等[10]和FREILE-PELEGR N等[11]的报道中,多糖分子质量的减少被认为是贮藏6个月后海藻琼胶凝胶品质下降的主要原因,在本试验中,琼胶的相对黏度随着贮藏时间和水分含量的增大呈现减小趋势,可以推测出,高水分含量加速了龙须菜琼胶的降解。
N等[11]的报道中,多糖分子质量的减少被认为是贮藏6个月后海藻琼胶凝胶品质下降的主要原因,在本试验中,琼胶的相对黏度随着贮藏时间和水分含量的增大呈现减小趋势,可以推测出,高水分含量加速了龙须菜琼胶的降解。
表1 10 ℃贮藏下不同水分含量龙须菜的理化性质
Table 1 Physical and chemical properties of G.lemaneiformis with different moisture content at stored 10 ℃
样品贮藏时间/d硫酸基/%3, 6-内醚半乳糖/%相对黏度12%13.10±0.10Aa47.00±1.97Ac2.52±0.08Bb33.06±0.06Aa44.78±2.76Bbc2.13±0.12Bb53.60±0.03Ab41.87±1.06Bab1.94±0.08Aa74.52±0.34Ac41.02±0.11Ba1.96±0.11Ca35%13.95±0.05Aa42.73±4.04Ab2.33±0.09ABc34.24±0.20Bb37.43±1.99Aab2.09±0.18Bb54.59±0.19Bc37.77±1.81ABab2.00±0.11Ab75.09±0.11Bd32.99±2.81Aa1.72±0.09Ba55%14.31±0.31Ba43.24±1.53Ab2.21±0.16Ac34.80±0.02Bb35.55±3.43Aa1.85±0.09Ab55.44±0.12Cc33.67±3.17Aa1.58±0.12Aa75.87±0.29Cd31.45±1.52Aa1.49±0.05Aa
注:大写不同字母表示同一贮藏时间不同水分含量差异显著(P<0.05),小写不同字母表示同一水分含量不同贮藏时间差异显著(P<0.05)(下同)。
表2 30 ℃贮藏下不同水分含量龙须菜的理化性质
Table 2 Physical and chemical properties of G.lemaneiformis stored at 30 ℃
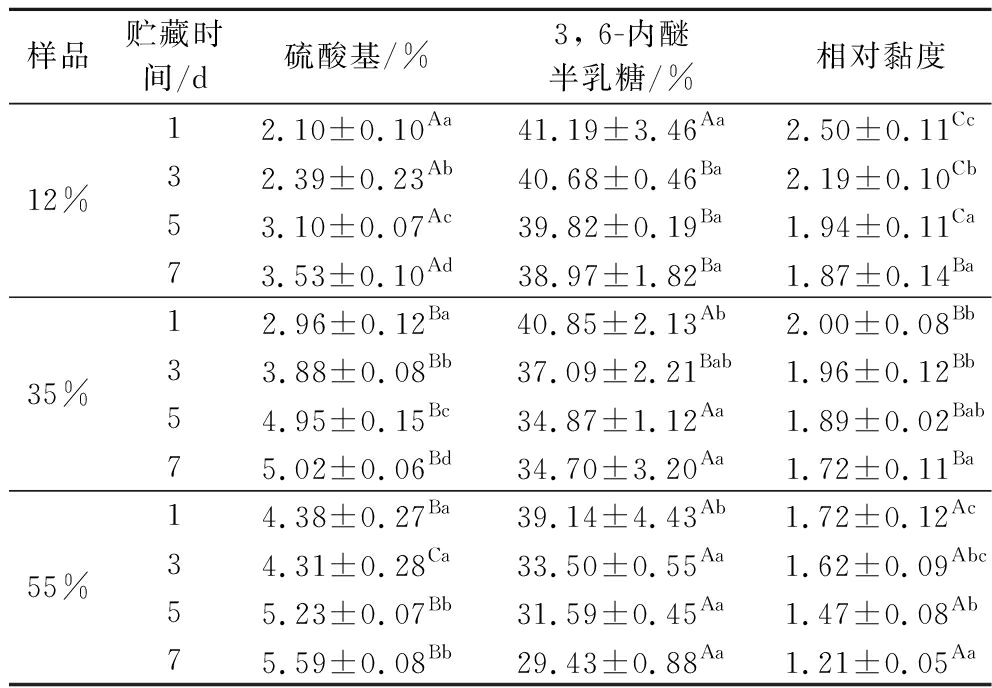
样品贮藏时间/d硫酸基/%3, 6-内醚半乳糖/%相对黏度12%12.10±0.10Aa41.19±3.46Aa2.50±0.11Cc32.39±0.23Ab40.68±0.46Ba2.19±0.10Cb53.10±0.07Ac39.82±0.19Ba1.94±0.11Ca73.53±0.10Ad38.97±1.82Ba1.87±0.14Ba35%12.96±0.12Ba40.85±2.13Ab2.00±0.08Bb33.88±0.08Bb37.09±2.21Bab1.96±0.12Bb54.95±0.15Bc34.87±1.12Aa1.89±0.02Bab75.02±0.06Bd34.70±3.20Aa1.72±0.11Ba55%14.38±0.27Ba39.14±4.43Ab1.72±0.12Ac34.31±0.28Ca33.50±0.55Aa1.62±0.09Abc55.23±0.07Bb31.59±0.45Aa1.47±0.08Ab75.59±0.08Bb29.43±0.88Aa1.21±0.05Aa
表3 50 ℃贮藏下不同水分含量龙须菜的理化性质
Table 3 Physical and chemical properties of G.lemaneiformis with different moisture content stored at 50 ℃
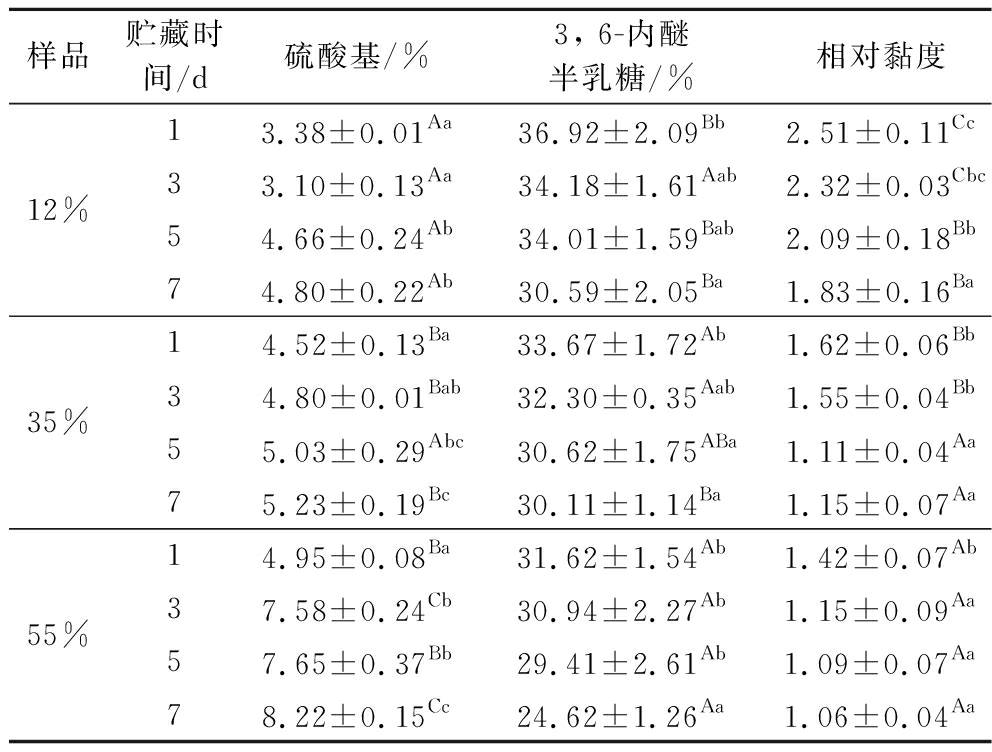
样品贮藏时间/d硫酸基/%3, 6-内醚半乳糖/%相对黏度12%13.38±0.01Aa36.92±2.09Bb2.51±0.11Cc33.10±0.13Aa34.18±1.61Aab2.32±0.03Cbc54.66±0.24Ab34.01±1.59Bab2.09±0.18Bb74.80±0.22Ab30.59±2.05Ba1.83±0.16Ba35%14.52±0.13Ba33.67±1.72Ab1.62±0.06Bb34.80±0.01Bab32.30±0.35Aab1.55±0.04Bb55.03±0.29Abc30.62±1.75ABa1.11±0.04Aa75.23±0.19Bc30.11±1.14Ba1.15±0.07Aa55%14.95±0.08Ba31.62±1.54Ab1.42±0.07Ab37.58±0.24Cb30.94±2.27Ab1.15±0.09Aa57.65±0.37Bb29.41±2.61Ab1.09±0.07Aa78.22±0.15Cc24.62±1.26Aa1.06±0.04Aa
2.4 贮藏条件对菌落总数的影响
由图3可知,龙须菜在不同水分含量和贮藏温度贮藏过程中菌落总数的变化。由图3-a可知,水分含量12%时,贮藏温度和贮藏时间对龙须菜菌落总数影响不明显;由图3-b和图3-c可知,水分含量35%和55%条件下,菌落总数随着贮藏时间的延长而上升,且不同贮藏温度下,菌落总数从高到低顺序为30 ℃>50 ℃>10 ℃。龙须菜附生菌在适宜的生长条件下大量繁殖,分泌琼胶酶,导致琼胶降解[32-34]。
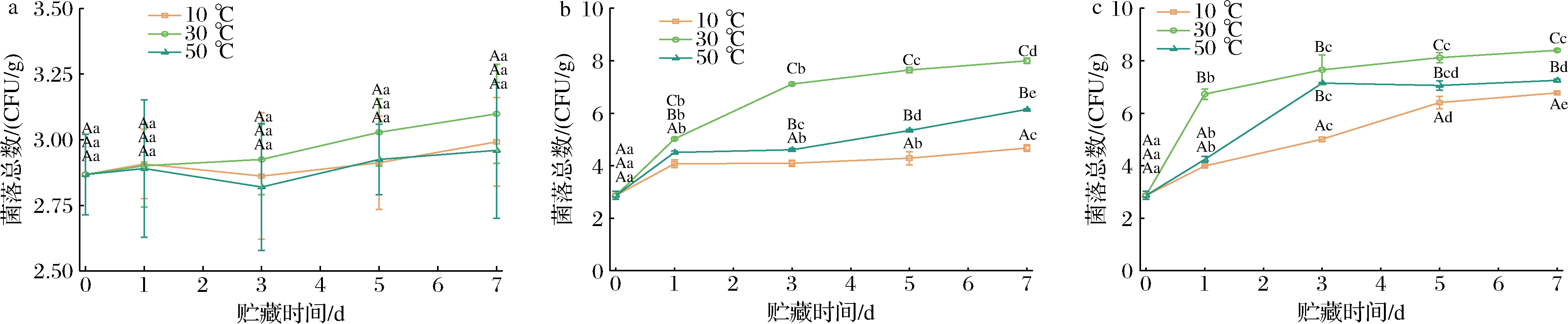
a-12%;b-35%;c-55%
图3 在不同水分含量和温度贮藏过程中菌落总数的变化
Fig.3 The change of colony count in different moisture content and temperature during storage
2.5 贮藏条件对龙须菜中还原糖含量的影响
由图4可知,龙须菜中还原糖含量受水分含量和贮藏温度的影响。由图4-a可知,水分含量12%时,贮藏温度和贮藏时间对龙须菜还原糖含量影响不明显,当水分含量增加至35%和55%时,由图4-b和图4-c可知,任意时刻下,30 ℃和50 ℃条件下龙须菜还原糖含量均比10 ℃条件下的龙须菜还原糖含量高,龙须菜中还原糖含量随贮藏温度和贮藏时间的增加而显著升高(P<0.05)。这些发现与朱思颖等[14]利用腐烂龙须菜水解生产琼胶寡糖的实验中还原糖变化趋势一致。在贮藏过程中,内源性或微生物来源的酶引起琼胶水解、多糖链断裂,导致还原糖含量显著升高,且这与产琼胶酶的微生物生长繁殖以及酶活性发挥的最适温度和水分含量有关。

a-12%;b-35%;c-55%
图4 不同水分含量下贮藏温度对还原糖的影响
Fig.4 Effect of storage temperature on reducing sugar under different moisture content
2.6 贮藏条件对龙须菜中琼胶酶活性的影响
由图5可知,龙须菜中琼胶酶活性受水分含量和贮藏温度的影响。由图5-a可知,水分含量12%时,贮藏温度和贮藏时间对龙须菜琼胶酶活力影响不明显,可能的原因是,酶的表面需要一定量的水分子使酶催化底物的活性中心达到一定柔韧性的“开放”构象[29],水分含量12%的藻体水分含量极低,活性中心均不易与底物分子结合,故无明显变化。ARMISEN[13]的报告中,也曾说明干燥良好的江篱(含水量低于20%)可以储存近10年,而不会损失产量或琼胶品质。由图5-b可知,水分含量35%条件下,琼胶酶活性随着贮藏时间的延长显著上升(P<0.05),且贮藏温度30和50 ℃条件下的琼胶酶活性明显高于10 ℃条件下的琼胶酶活性;由图5-c可知,水分含量55%条件下,贮藏温度10和30 ℃条件下的琼胶酶活性随着贮藏时间的延长显著上升(P<0.05),贮藏温度50 ℃条件下,随着贮藏时间的增加,琼胶酶活性呈现先增加后下降的趋势,酶活性在第5天达到最高。研究表明,贮藏过程中水分含量和贮藏温度的变化对龙须菜琼胶酶活性具有重要的影响。

a-12%;b-35%;c-55%
图5 不同水分含量下贮藏温度对琼胶酶活性的影响
Fig.5 Effect of storage temperature on agarase activity under different water content
3 结论与讨论
该研究以龙须菜为实验对象,通过还原糖含量、琼胶酶活性和菌落总数研究不同贮藏条件对龙须菜琼胶得率、凝胶强度的影响。实验结果表明,贮藏过程中的贮藏温度和水分含量对龙须菜琼胶提取得率和琼胶凝胶强度有显著影响。藻体微生物大量繁殖,分泌琼胶降解酶,导致琼胶分子链断裂,黏度下降,凝胶性能降低。结合现有研究现状,综合以上实验结果可以得出,龙须菜有效的前处理和贮藏技术能有效抑制微生物的活动,从而提高琼胶得率和凝胶品质。本实验为龙须菜合理贮藏提供了科学依据。
[1] 王晓梅, 张忠山, 周俊波, 等.龙须菜多糖的提取纯化及生物活性研究进展[J].海洋渔业, 2020, 42(1):120-128.
WANG X M, ZHANG Z S, ZHOU J B, et al.Research progress on extraction, purification and physiological activity of polysaccharides from Gracilaria lemaneiformis[J].Marine Fisheries, 2020, 42(1):120-128.
[2] 农业部渔业渔政管理局. 2021年中国渔业统计年鉴[M].北京:中国农业出版社, 2021.
Fisheries and Fisheries Administration of the Ministry of Agriculture.2021 China Fishery Statistical Yearbook [M].Beijing:China Agricultural Press, 2021.
[3] 隋正红, 胡依依, 周伟, 等.龙须菜栽培与遗传育种[J].中国海洋大学学报(自然科学版), 2020, 50(9):98-104.
SUI Z H, HU Y Y, ZHOU W, et al.Review on the cultivation and genetic breeding of Gracilariopsis lemaneiformis(Rhodophyta)[J].Periodical of Ocean University of China, 2020, 50(9):98-104.
[4] 王露楠, 杨少玲, 戚勃, 等.3种改性方法对琼胶理化性质的影响[J].南方水产科学, 2021, 17(2):97-103.
WANG L N, YANG S L, QI B, et al.Effect of three modification methods on physicochemical properties of agar[J].South China Fisheries Science, 2021, 17(2):97-103.
[5] 亓玺, 樊建茹, 冯云, 等.天然生物质材料的制备、性质与应用(Ⅳ):胶凝稳定的多用途海藻胶:琼脂[J].日用化学工业, 2022, 52(4):355-362.
QI X, FAN J R, FENG Y, et al.Preparation, properties and applications of natural biomass materials (Ⅳ) Stable multipurpose seaweed gel:Agar[J].China Surfactant Detergent &Cosmetics, 2022, 52(4):355-362.
[6] 王连杰, 沈照鹏, 穆惠敏, 等.微波法提取龙须菜琼胶及其理化性质的研究[J].水产学报, 2017, 41(6):854-860.
WANG L J, SHEN Z P, MU H M, et al.Extraction of agar from Gracilaria lemaneiformis based on microwave method and its physico-chemical properties[J].Journal of Fisheries of China, 2017, 41(6):854-860.
[7] TAKO M.The principle of polysaccharide gels[J].Advances in Bioscience and Biotechnology, 2015, 6(1):22-36.
[8] SANTOS R, MELO R A.Global shortage of technical agars:Back to basics (resource management)[J].Journal of Applied Phycology, 2018, 30(4):2463-2473.
[9] FREILE-PELEGR N Y.Does storage time influence yield and agar properties in the tropical agarophyte Gracilaria cornea?[J].Journal of Applied Phycology, 2000, 12(2):153-158.
N Y.Does storage time influence yield and agar properties in the tropical agarophyte Gracilaria cornea?[J].Journal of Applied Phycology, 2000, 12(2):153-158.
[10] ROMERO J B, VILLANUEVA R D, MONTA O M N E.Stability of agar in the seaweed Gracilaria eucheumatoides (Gracilariales, Rhodophyta) during postharvest storage[J].Bioresource Technology, 2008, 99(17):8151-8155.
O M N E.Stability of agar in the seaweed Gracilaria eucheumatoides (Gracilariales, Rhodophyta) during postharvest storage[J].Bioresource Technology, 2008, 99(17):8151-8155.
[11] FREILE-PELEGR N Y, MADERA-SANTANA T, ROBLEDO D, et al.Degradation of agar films in a humid tropical climate:Thermal, mechanical, morphological and structural changes[J].Polymer Degradation and Stability, 2007, 92(2):244-252.
N Y, MADERA-SANTANA T, ROBLEDO D, et al.Degradation of agar films in a humid tropical climate:Thermal, mechanical, morphological and structural changes[J].Polymer Degradation and Stability, 2007, 92(2):244-252.
[12] 张曦文, 伍菱, 童风景, 等.贮藏条件对江蓠琼胶酶活性和琼胶凝胶强度的影响[J].水产科学, 2020, 39(6):880-886.
ZHANG X W, WU L, TONG F J, et al.Effects of storage temperature and humidity on enzyme activities and strength of agar gel in brown alga Gracilaria[J].Fisheries Science, 2020, 39(6):880-886.
[13] ARMISEN R.World-wide use and importance of Gracilaria[J].Journal of Applied Phycology, 1995, 7(3):231-243.
[14] 朱思颖, 陈丹琦, 梁家铭, 等.腐烂龙须菜自水解生产琼胶寡糖的可行性研究[J].广州化工, 2016, 44(18):52-54;92.
ZHU S Y, CHEN D Q, LIANG J M, et al.Feasibility study of agar oligosaccharide production by self hydrolysis during decay process in Gracilaria lemaneiformis[J].Guangzhou Chemical Industry, 2016, 44(18):52-54;92.
[15] JAFFRAY A E, ANDERSON R J, COYNE V E.Investigation of bacterial epiphytes of the agar-producing red seaweed Gracilaria gracilis (stackhouse) steentoft, Irvine et farnham from Saldanha bay, South Africa and Lüderitz, Namibia[J].Botanica Marina, 1997, 40(1-6):569-576.
[16] ARMISÉN R.Agar and agarose biotechnological applications[J].Hydrobiologia, 1991, 221(1):157-166.
[17] ISHIMATSU K.Studies on the agar-liquefying bacteria(II):Influence of the culture conditions on the agarase production[J].Journal of Fermentation Technology, 1952, 30:472-481.
[18] WANG L J, SHEN Z P, MU H M, et al.Impact of alkali pretreatment on yield, physico-chemical and gelling properties of high quality agar from Gracilaria tenuistipitata[J].Food Hydrocolloids, 2017, 70:356-362.
[19] VEERAGURUNATHAN V, PRASAD K, SINGH N, et al.Growth and biochemical characterization of green and red strains of the tropical agarophytes Gracilaria debilis and Gracilaria edulis (Gracilariaceae, Rhodophyta)[J].Journal of Applied Phycology, 2016, 28(6):3479-3489.
[20] Ö RETMEN Ö Y, KAYA Y.Seasonal changes in the yield and gel properties of agar extracted from Gelidium latifolium (Rhodophyta)[J].Journal of Applied Phycology, 2019, 31(5):3091-3100.
RETMEN Ö Y, KAYA Y.Seasonal changes in the yield and gel properties of agar extracted from Gelidium latifolium (Rhodophyta)[J].Journal of Applied Phycology, 2019, 31(5):3091-3100.
[21] LEE W K, LIM P E, PHANG S M, et al.Agar properties of Gracilaria species (Gracilariaceae, Rhodophyta) collected from different natural habitats in Malaysia[J].Regional Studies in Marine Science, 2016, 7:123-128.
[22] 赵永强. 龙须菜琼胶糖的制备及其副产物的研究[D].湛江:广东海洋大学, 2010.
ZHAO Y Q.Study on preparation of agar from Gracilaria lemaneiformis and its by-products[D].Zhanjiang:Guangdong Ocean University, 2010.
[23] BELATTMANIA Z, BHABY S, NADRI A, et al.Gracilaria gracilis (Gracilariales, Rhodophyta) from Dakhla (southern Moroccan Atlantic coast) as source of agar:Content, chemical characteristics, and gelling properties[J].Marine Drugs, 2021, 19(12):672.
[24] 丛建波, 王长振, 李妍, 等.褐藻硫酸多糖硫酸基含量测定—硫酸钡比浊法研究[J].解放军药学学报, 2003, 19(3):181-183.
CONG J B, WANG C Z, LI Y, et al.Investigation of Barium sulfate turbidimetry on determination the sulfated group of sulfated polysaccharides[J].Pharmaceutical Journal of Chinese PLA, 2003, 19(3):181-183.
[25] 李龙, 苏永昌, 刘淑集, 等.琼脂及琼脂糖中3, 6-内醚半乳糖的测定[J].福建水产, 2012, 34(5):370-374.
LI L, SU Y C, LIU S J, et al.Determination of 3, 6-anhydro galactose in agar and agarose[J].Journal of Fujian Fisheries, 2012, 34(5):370-374.
[26] 问莉莉. 高品质琼胶的制备及其稳定性研究[D].湛江:广东海洋大学, 2013.
WEN L L.Study on preparation and stability of high-quality agar[D].Zhanjiang:Guangdong Ocean University, 2013.
[27] 李驰, 李春生, 杨贤庆, 等.海洋细菌Vibrio fluvialis的分离鉴定、产琼胶酶条件优化及酶的分离纯化[J].食品与发酵工业, 2020, 46(7):35-42.
LI C, LI C S, YANG X Q, et al.Isolation and identification of agarase-producing Vibrio fluvialis for agarase preparation and purification[J].Food and Fermentation Industries, 2020, 46(7):35-42.
[28] 赵谋明, 刘通讯, 吴晖, 等.碱处理对江蓠琼胶出胶率、性质和化学组成影响的研究[J].食品与发酵工业, 1996,22(6):1-7.
ZHAO M M, LIU T X, WU H, et al.A study of the alkali-treatment effect on the extraction yield, properties and chemical composition of agar[J].Food and Fermentation Industries, 1996,22(6):1-7.
[29] HILLIOU L, LAROTONDA F D S, ABREU P, et al.The impact of seaweed life phase and postharvest storage duration on the chemical and rheological properties of hybrid carrageenans isolated from Portuguese Mastocarpus stellatus[J].Carbohydrate Polymers, 2012, 87(4):2655-2663.
[30] 徐卓越. 超声高温一步法提取琼脂及对品质的影响[J].饮料工业, 2019, 22(2):10-13.
XU Z Y.Extraction of agar by ultrasonic with high temperature and its effect on quality[J].Beverage Industry, 2019, 22(2):10-13.
[31] RHEIN-KNUDSEN N, MEYER A S.Chemistry, gelation, and enzymatic modification of seaweed food hydrocolloids[J].Trends in Food Science &Technology, 2021, 109:608-621.
[32] 桂媛媛, 谷晓倩, 李江, 等.南极大型海藻表面可培养琼胶降解菌多样性分析[J].极地研究, 2020, 32(4):504-511.
GUI Y Y, GU X Q, LI J, et al.Biodiversity analysis of cultured agar-degrading bacteria from surfaces of Antarctic macroalgae[J].Chinese Journal of Polar Research, 2020, 32(4):504-511.
[33] CHI W J, CHANG Y K, HONG S K.Agar degradation by microorganisms and agar-degrading enzymes[J].Applied Microbiology and Biotechnology, 2012, 94(4):917-930.
[34] FU X T, KIM S M.Agarase:Review of major sources, categories, purification method, enzyme characteristics and applications[J].Marine Drugs, 2010, 8(1):200-218.