金柑(kumquat),系芸香科金柑属植物,原产于我国,现世界各地均有栽培。金柑是最小的柑桔类水果,呈球形或椭圆形,果皮光滑明亮可食[1],是具有高营养价值的药食同源类水果,在广西、西南地区及江浙地区种植较广。大多数金柑果实成熟时果皮呈金黄色,皮甘肉微酸,偶有辛辣,风味独特,清香四溢。根据《中国果树志·柑橘卷》记载和查阅文献可知,金柑属有山金柑(Fortunella hindsii Swingle)、罗浮(F.margarita Swingle)、罗纹(F.japonica Swingle)、金弹(F.crassifolia Swingle)、长寿金柑 (F.obovata Tanaka) 和长叶金柑(F.polyandra Tanaka)等金柑6个品种[2]。金柑果树幼年期短,一般为2~3年,每年可开花结果数次。金柑果内富含多种维生素、氨基酸、糖分、膳食纤维等营养物质,营养价值高,具有很好的食疗功效且外型喜庆吉利,深受人们喜爱。
我国金柑品种资源丰富,种类齐全,但只有少数地方品种得到了大力推广,实现了产业化发展,但在生产过程中也存在落花落果等资源浪费问题,并且还有很多其他优良金柑品种未被开发利用。前人已对部分金柑品种成熟果实品质特性等进行了研究,目前关于金柑果实生长发育过程中生物活性成分的变化报道较少,且检测的活性物质种类偏少。研究证明金柑果肉和果皮中均含有酚酸、类黄酮等多种生物活性成分,其中类黄酮和酚酸类物质是潜在抗氧化剂的主要来源,可预防一些常见疾病,如癌症、心血管疾病和其他与年龄有关的代谢综合征和退行性疾病[3],具有较高的保健与药用价值。
随着人们对健康果品的青睐,市场对诸如金柑之类具有较高营养保健价值的果品需求日益增加。现代社会生活条件不断改善, 天然产物中对健康有益的生物活性成分也受到学者的广泛关注,金柑作为兼有药用价值和食用价值的水果,在开发功能性产品方面具有非常广阔的应用前景[4-5]。为此,本文比较分析不同生长阶段金柑果实生物活性物质的含量,以期为我国金柑资源的深入开发利用及研究提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
本试验以4个生长时期8个品种的金柑全果为试验材料,于2021年采自国家柑桔种质资源圃。在2021年9~12月期间,分别于金柑树体开花后35~125 d,每30 d取1次果,每次随机取20~50个果实,共采摘4 次,分别于花后35、65、95、125 d采摘,对应时期编号分别为S1、S2、S3、S4。采摘样品时,从果树四周均匀采样、选择无病虫害且大小一致的金柑样品。采后样品用超纯水洗净,晾干后快速制备鲜样,密封冻藏(-20 ℃)备用。8个金柑品种分别编号1~8,名称如表1所示,“S时期编号-序号”即为每个样品的编号,S1-1即表示花后35 d采摘的融安金弹,S4-8表示花后125 d采摘的四季橘,其他品种时期编号以此类推,样品图片如图1所示。

1-融安金弹;2-长寿金柑;3-宁波罗纹;4-金柑杂种;5-温州罗浮;6-浏阳金弹;7-滑皮金柑;8-四季橘
图1 四个时期8种金柑果实的样品图
Fig.1 Pictures o of eight kumquat fruits in four periods
表1 八种金柑果实信息
Table 1 Information of eight kumquat fruits

序号样品名称缩写种名圃编号1融安金弹RAF.crassifolia Swingle(金弹)LF00062长寿金柑CSF.obovata Tanaka(长寿金柑)LF00103宁波罗纹NBF.japonica Swingle(罗纹)LF00304金柑杂种ZZF.obovata Tanaka(长寿金柑)LF00325温州罗浮WZF.margarita (Lour.) Swingle(罗浮)LF00026浏阳金弹LYF.crassifolia Swingle(金弹)LF00137滑皮金柑HPF.crassifolia Swingle(金弹)LF00178四季橘SJJF.obovata Tanaka C.mitis(四季橘)LF0007
1.1.2 试剂
甲醇和乙腈(色谱纯),美国Sigma-Aldrich;甲酸(色谱纯),上海吉至生化科技有限公司。
92种标准品信息如下:圣草酚、异鼠李素、木犀草素、栀子黄素B、异鼠李素、异东莨内酯、异泽兰黄素纯度均为98.0%以上,成都克洛玛生物科技有限公司;水合氧化前胡素、蛇床子素、珊瑚菜素、8-氧甲基胡前内酯、异槲皮苷、橙皮内酯、根皮苷、槲皮素、氧化前胡素、异紫花胡前内酯、4′,5,7,8-四甲氧基黄酮、栎精-3,7,3′,4′-四甲醚、异橙黄酮、芹菜素、水仙苷、金柑苷和没食子酸纯度均为98.0%以上,4′,5,6,7-四甲氧基黄酮和3′,4,7,8-四甲氧基黄酮纯度均为95%,上海源叶生物技术有限公司,其他标准品参照GUO等[6]。
1.2 仪器与设备
KQ5200DE超声波清洗仪,昆山市超声仪器有限公司;Milli-Q Advantage A10超纯水机,美国Millipore;3K15高速冷冻离心机,美国Sigma-Aldrich;PB3002-S/FACT分析天平,瑞士Mettler Toledo;有机相针式滤器(13 mm,0.22 m),上海安谱实验科技股份有限公司;Acquity UPLC HSS T3色谱柱,美国Waters;Nexera X2 UPLC,日本岛津公司,QTap@6500+,美国AB SCIEX 公司。
1.3 实验方法
1.3.1 金柑苷UPLC-QQQ-MS/MS检测方法的建立
GUO等[6]基于UPLC-QQQ-MS/MS平台建立了66种柑桔中生物活性成分测定的方法,实验室其他人员在其基础上增加了25种,本实验室现有方法可实现同时检测91种生物活性物质,是目前涉及柑桔中生物活性成分测定种类最多的方法,可成功用于柑桔及其他果蔬样品的检测。金柑虽为柑桔属植物,但有不同于其他柑桔品种的特有类黄酮。研究表明在金柑类黄酮的组成当中,金柑苷和根皮素-3′,5′-二-C-葡糖苷是金柑果实中特有的2种类黄酮[7-8]。金柑苷是平均含量仅次于根皮素-3′,5′-二-C-葡糖苷的第二大特有类黄酮。目前金柑苷主要通过超高效液相色谱法检测,超高效液相色谱技术是目前比较常用的有效分离复杂基质的方式,其发展成熟,应用范围广。色谱质谱联用技术结合了液相色谱和质谱两者的优点,包括低、中、高极性化合物和易挥发、难挥发性化合物,即使液相分离系统中未完全分离的样品也可以通过特征离子对物质进行分析,这使得检测结果更加可靠,特异性更强,分析效率更高。因此,本研究建立了基于UPLC-QQQ-MS/MS平台的金柑苷检测和定量方法,用于分析不同生长发育期金柑果实中特有的金柑苷的含量。化合物及MRM参数如表2所示。
表2 化合物及其MRM参数的列表
Table 2 List of the compound and their MRM parameters

化合物名称相对分子质量离子种类前体离子(m/z)产物离子(m/z)DPCE保留时间/min金柑苷592.55[M-H]-591.1324.7-80-26.45.03金柑苷592.55[M-H]-591.1289.2-80-275.03
1.3.2 方法验证相关参数
标准曲线绘制:在金柑样品上机检测之前,将配制的0.01、0.02、0.05、0.10、0.20、0.50、1、2、5、10、20、25、50、100 μg/L一系列浓度梯度标准品使用液上机检测,选择5种以上的金柑苷标准物质浓度,进行线性拟合,通过选定的金柑苷定量离子峰面积进行线性拟合,绘制金柑苷的标准曲线。信噪比≥3和信噪比≥10时对应的浓度分别确定为检测限(limit of detection,LOD)和定量限(limit of quantification,LOQ)。加标回收率试验:为了确定目标化合物的回收率,将质量浓度50和100 μg/L的金柑苷标准品溶液加到金柑样品的提取液中。回收率为添加标准品前后的金柑苷的浓度差值与添加量的比值。进行3次重复试验,加标回收率以平均值±标准差的形式表示。精密度:在同一天同一标准溶液不同的3个时间进行浓度的测定,以考察日内精密度;连续3 d在同一时间段进行样品浓度的测定,以考察日间精密度。日内差和日间差均以相对标准偏差表示。
本研究方法下,金柑苷均表现出良好的线性关系。在方法的灵敏度方面可知,金柑苷化合物的LOD为0.28 μg/L,LOQ为2.35 μg/L,具有良好的灵敏度。从表3中可知,添加水平为50 μg/L时,回收率为(78.1±0.003)%,添加水平在100 μg/L 时,回收率为(0.765 5±0.045 5)%,表明该方法具有良好的准确性。日内相对标准偏差(relative standard deviation,RSD)值为3.045%,日间RSD值为5.71%,均在可接受标准内。以上方法学验证结果表明,该方法灵敏度高,准确度和回收率高,可用于金柑样品中金柑苷化合物的靶向筛查及定量检测分析。
表3 方法验证相关参数
Table 3 List of parameters related to method validation

化合物名称标准曲线相关系数R2线性范围/(μg/L)检测限/(μg/L)定量限/(μg/L)日内差RSD/%日间差RSD/%回收率1/%回收率2/%金柑苷y=2.57e3x+9.42e2 0.999 80.36~1000.282.353.055.7178.10±0.003 076.55±0.045 5
注:回收率1表示添加水平在50 μg/L时的回收率;回收率2表示添加水平在100 μg/L时的回收率。
1.3.3 标准溶液的配制法
将购买的标准品分别用甲醇配制成500 μg/L标准品储备液,放置于低温下(-80 ℃)保存。将92种标准品储备液,按照一定比例稀释,配制为0.01、0.02、0.05、0.10、0.20、0.50、1、2、5、10、20、25、50、100 μg/L一系列质量浓度的混标,其中章鱼胺和酚酸的增加质量浓度分别为200、250、500 μg/L。
1.3.4 样品前处理
参照相关标准GB/T 8210—2011《柑桔鲜果检验方法》样品前处理方法。称取5.00 g金柑样品置于50.0 mL离心管,加入10.0 mL甲醇后振荡摇匀,超声提取30 min(25 ℃,200 W),10 000 r/min离心5 min,用50.0 mL容量瓶收集上清液。重复上述步骤4次,将4次收集的上清液用甲醇定容至50.0 mL。提取液通过有机相针式滤器(0.22 mm)过滤后即可检测。
1.3.5 UPLC-QQQ-MS/MS条件
分析参照GUO等[6]的方法,Sciex QTrap®6500的质谱数据是采用多反应监测模式在正、负两种离子模式下获得的。喷雾离子源参数:雾化气50.0 psi,辅助气50.0 psi;气帘气35.0 psi;离子源温度500.0 ℃。离子源电压+5 500.0 V,-4 500.0 V;入口电压10.0 V;碰撞室内出口电15.0 V。采用型号 ACQUITY UPLC HSS T3 (2.1 mm×100 mm,1.8 um,Waters,USA),柱温40 ℃,流速0.3 mL/min,进样量1.0 μL,样品室内温度15 ℃。
1.4 数据采集与分析
LC-MS/MS操作和数据采集在Analyst®软件(Sciex)上进行,使用软件 MultiQuant®(Sciex)进行样品中化合物定量。每个样品设计3个平行实验,以平均值±标准差表示检测结果;使用 Excel 2016和Origin 2022进行分析和图表绘制。
2 结果与分析
2.1 金柑果实生物活性物质的靶向筛查结果
4个时期8个金柑品种果实共靶向筛查到85种生物活性成分,具体物质数量如表4所示。同一品种不同生长阶段检测出的生物活性物质种类数差异较小,含量差异大,融安金弹和长寿金柑花后35~125 d,果实中均检出66~71种物质;宁波罗纹花后35~125 d,果实中检出67~73种物质;浏阳金弹、滑皮金柑果实中均检出62~68种物质;金柑杂种、温州罗浮和四季橘果实中分别检出72~80种、56~68种、59~76种物质。融安金弹、滑皮金柑、浏阳金弹、长寿金柑、金柑杂种和宁波罗纹的生物活性物质种类均为60种以上,其中金柑杂种果实中物质最丰富,S1时期高达80种。相比之下,温州罗浮和四季橘中物质较少,S2时期的物质种类分别只有56和59种,主要是S2时期的香豆素种类明显低于其他金柑品种,仅有4种和6种。由表4可知,金柑果实中生物活性物质随着成熟度的增加而减少,S3时期左右变化平缓,S1时期的物质种类最高,其中有6个品种金柑的物质种类超过70种。从总量及各类物质的变化上看,类黄酮的含量变化在较大程度上决定了总生物活性物质含量的变化趋势。92种标准物质混合液总离子流图如图2所示,花后35 d即S1时期的8种金柑果实甲醇提取物的总离子流图如图3所示。图3表明同一时期8个品种的金柑果实生物活性物质的种类和数量有明显的不同。通过S1时期金柑果实的总离子流图的对比,可看到其峰型基本一致但有个别差异,响应值及峰面积有明显差异,表明不同品种的金柑的生物活性成分与含量均有显著差异。
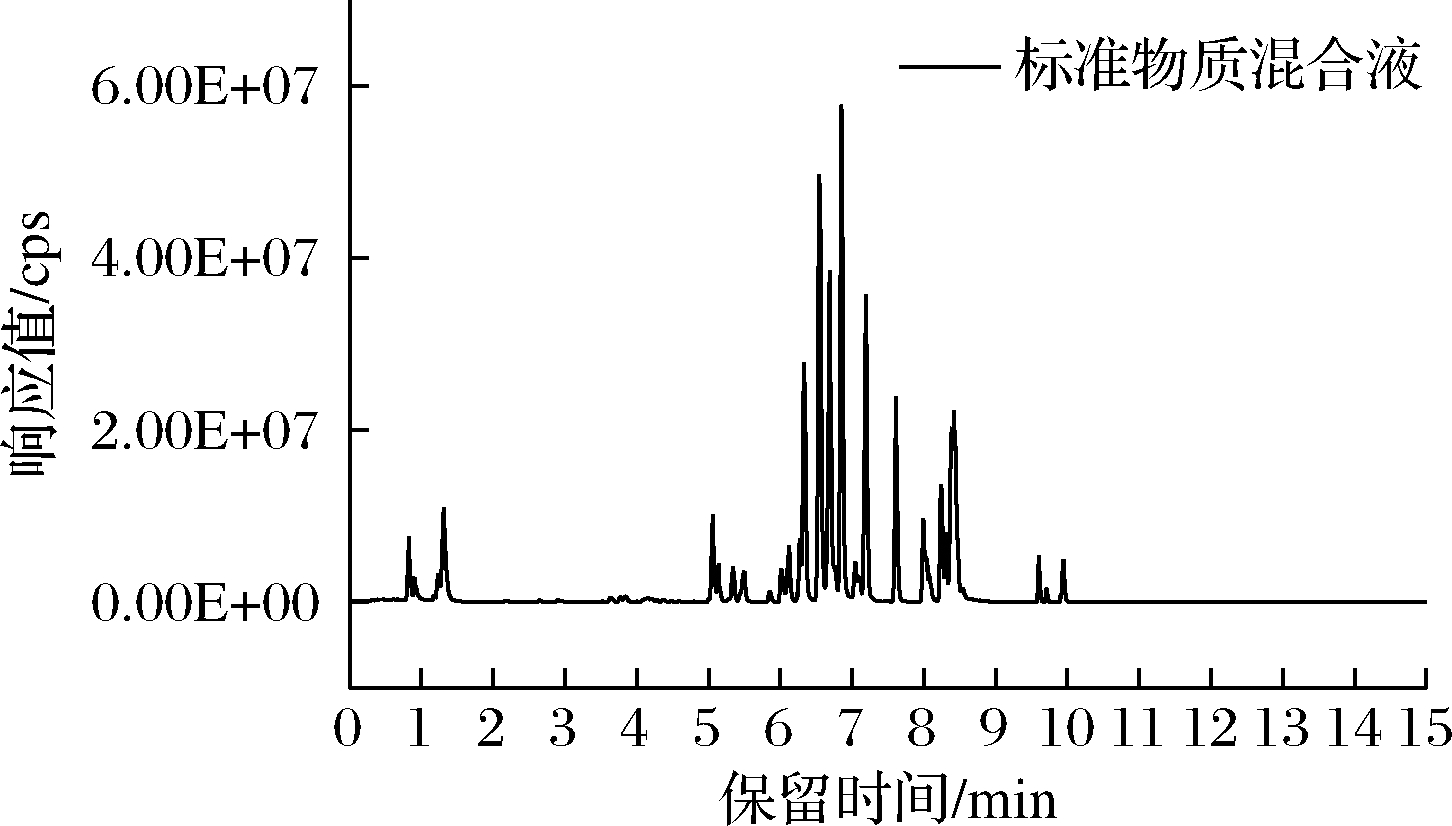
图2 标准物质混合液总离子流图
Fig.2 Total ion flow diagram of reference material mixture

S1-1-融安金弹;S1-2-长寿金柑;S1-3-宁波罗纹;S1-4-金柑杂种;S1-5-温州罗浮;S1-6-浏阳金弹;S1-7-滑皮金柑;S1-8-四季橘
图3 八种金柑果实S1时期的甲醇提取物的总离子流图
Fig.3 Total ion flow diagrams of methanol extracts from 8 kumquat fruits at S1 stage
表4 四个时期8种金柑果实中定量的次生代谢产物的数量
Table 4 The number of secondary metabolites quantitated in 8 kinds of kumquat fruits in four periods

序号样品名称时期类黄酮黄酮多甲氧基黄酮黄酮醇黄烷酮二氢查尔酮类柠檬苦素生物碱酚酸香豆素普通香豆素呋喃香豆素总计1融安金弹35 d11106121358787165 d1196121349787095 d11971213386868125 d1110611134868682长寿金柑35 d11127121359557065 d11127122349246695 d111071213497771125 d1111712135966713宁波罗纹35 d111161213487107365 d1197111338776795 d11971113388970125 d119612135967694金柑杂种35 d11167122349888065 d10167112349557295 d111671213598678125 d1016711234876745温州罗浮35 d11116122348656865 d1087112338225695 d10961213395462125 d118611233946636浏阳金弹35 d11117121339566865 d1197121339346295 d11961223392663125 d118711234945647滑皮金柑35 d11107122338867065 d11106122339426295 d111071223496670125 d119712234975698四季橘35 d11147121349697665 d10107121346155995 d10871213575664125 d10871213485765
2.2 金柑果实中类黄酮含量变化及差异分析
柑桔中多种类黄酮物质均有较强抗氧化活性,主要体现在减少自由基的产生和清除自由基两个方面。柚皮苷可增强超氧化物歧化酶和过氧化物歧化酶的活性,抑制低密度脂蛋白的氧化[9],从而达到抗氧化效果。WILMSEN等[10]报道,柑桔中橙皮苷等可以清除DPPH自由基,抑制低密度脂蛋白的氧化,亦有研究报道金柑果实中黄酮类物质有较强抗氧化活性[11]。本研究一共测定金柑中48种类黄酮,包括16种多甲氧基黄、11种黄酮、7种黄酮醇、12种黄烷酮和2种二氢查尔酮,定量类黄酮具体种类参照表4。金柑杂种中类黄酮种类明显高于其他金柑品种,4个时期均为46种以上,S1时期高达48种,其他品种金柑的S1时期种类也均高于40种。宁波罗纹、温州罗浮、浏阳金弹和四季橘的S4时期类黄酮种类较少,均只有38~39种。
大部分柑桔中类黄酮种类以黄烷酮为主[12],少数柑桔如宽皮柑桔中主要以多甲氧基黄酮为主[13]。本研究中金柑与芸香科其他柑桔属的类黄酮组成差异明显,除金柑杂种外,其他7种金柑的类黄酮中黄酮占比最高;如电子增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.032767)所示,不同时期同种金柑的类黄酮总量变化显著,总含量随着果实的生长发育呈减少趋势,S1时期即花后35 d的金柑果实中类黄酮总量最多,其次主要是S2时期和S3时期;BARRECA等[14]对比了未成熟金桔汁与成熟金桔汁的总黄酮含量,前者是后者的3倍,与本研究一致;金柑果实中类黄酮的种类繁多,不同品种金柑的类黄酮组成不同,除金柑杂种外,7个金柑品种中含量较高的7种类黄酮物质均为新西兰牡荆苷、杜荆素-2-O-鼠李糖苷,野漆树苷、金柑苷、柚皮苷、橙皮苷和枸橘苷,以上7个品种中金柑果实金柑苷的含量最为丰富,而金柑杂种中含量较高的10种类黄酮物质分别为新西兰牡荆苷、杜荆素-2-O-鼠李糖苷、地奥司明、新地奥司明、甜橙黄酮、川陈皮素、桔皮素、橙皮苷、5,7,8,4′-四甲氧基黄酮和新橙皮苷,其中金柑杂种S1时期的新西兰牡荆苷含量高达(609.633 3±6.809 0)μg/g、杜荆素-2-O-鼠李糖苷含量高达(521.033 3±11.104 8)μg/g、5,7,8,4′-四甲氧基黄酮含量高达(410.566 7±29.499 4)μg/g、橙皮苷含量高达(383.766 7±10.254 9)μg/g、新橙皮苷含量高达(411.700 0±61.800 2)μg/g。


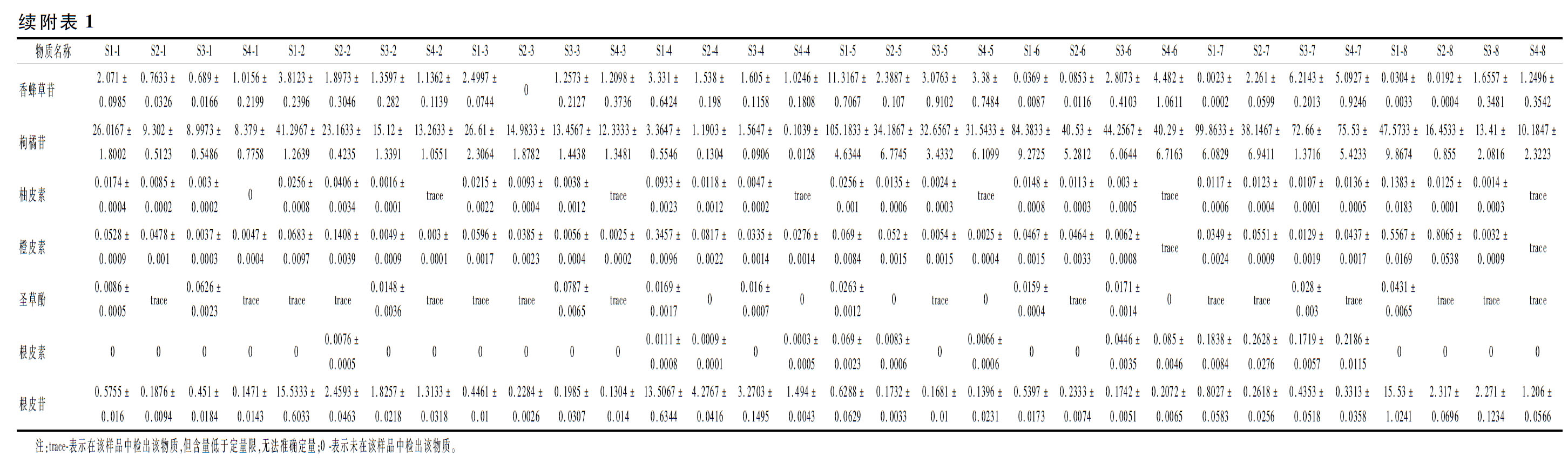
本研究发现随着果实成熟,枸橘苷的含量呈规律性降低,杜荆素-2-O-鼠李糖苷的含量呈显著下降趋势,此结论与郭鹏妹等[15]研究结论一致;KAWAII等[16]分析检测了60多个不同生物类型的柑桔和金柑果实中的黄酮类化合物,结果发现金柑中枸橘苷的含量明显高于其他柑桔果实,但是金柑中橘皮素的含量远低于其他柑桔果实,这一结论与本研究一致;由于金柑杂种作为属间杂种,其外形大小及成分种类含量与其他金柑有显著差异,郑洁[17]用超高效液相色谱法测定了15个金柑品种金柑果实干样中金柑苷的含量,所测金柑果实中金柑苷平均含量为(1 510.28±23.5)mg/kg,在成熟金柑杂种中未检出金柑苷,本研究所测的金柑品种中金柑苷的平均含量可达241.616 2 μg/g,与该研究结果一致,S1时期的滑皮金柑、温州罗浮、浏阳金弹果实中金柑苷的含量分别可达(952.366 7±37.193 7)、(692.033 3±62.032 4)、(604.433 3±17.979 7)μg/g,其余4个品种的金柑S1时期金柑苷含量也均高于240.00 μg/g,并且在金柑杂种其他3个时期有检出金柑苷;本研究首次在金柑杂种和四季橘果实中检出了栎精-3,7,3′,4′- 四甲醚,但含量偏低(0.001~0.368 3 μg/g)并且在四季橘中只有S1时期能被准确定量,其他时期因低于检测限而未能检出;不同品种的金柑类黄酮含量也具有差异,以S1时期为例,不同品种的金柑类黄酮总量比较,金柑杂种>滑皮金柑>长寿金柑>四季橘>温州罗浮>浏阳金弹>融安金弹>宁波罗纹。
通过以上数据分析可知,金柑杂种中类黄酮种类最丰富,总含量最高。除金柑杂种外,其他金柑果实中类黄酮物质含量最高的为金柑苷,推测金柑苷在金柑类黄酮提取物的生理活性方面起着重要作用。随着成熟度的增加,8种金柑中总黄酮的含量逐渐下降,多种黄酮类化合物均呈下降趋势,说明果实成熟期间,黄酮类化合物发生积累或转化。谭嫣[18]研究了6个不同发育时期浏阳金柑果实样品中5种类黄酮的含量变化,其变化规律与本研究一致。该研究还结合代谢组分析确定了25个参与金柑类黄酮糖基化修饰的候选基因,其结论可为本研究中部分类黄酮转化积累的原因提供数据参考,但更多类黄酮物质的转化机制、代谢途径还有待研究。
2.3 金柑果实中酚酸含量变化及差异分析
酚酸类化合物有较强的清除自由基的作用,是一类天然的抗氧化剂,近年来已被广泛运用于食品,化妆品等行业。本研究中共测定了9种游离态酚酸,如电子增强出版附表2所示。所测酚酸在8种金柑中均有检出,从酚酸组成来看,金柑品种和时期不同,酚酸组成和含量都具有差异。绿原酸具有抗菌、抗炎、抗病毒等多种生理活性,LIU等[19]研究发现绿原酸、迷迭香酸、异黄酮联用可有效缓解脂多糖诱导的小鼠急性肺损伤,并显著降低肺组织中炎症因子的表达水平,且呈现一定的剂量效应关系,金柑杂种中的酚酸以绿原酸为主,S1时期含量可达(24.923 3±3.198 0)μg/g,占S1时期金柑果实所测酚酸总量的98.28%;除S1时期的长寿金柑外,其他金柑中绿原酸含量均在0.50 μg/g以下,且有4个品种的绿原酸含量低于定量限而无法定量;除金柑杂种外,其他金柑均以芥子酸为主,温州罗浮和浏阳金弹中芥子酸含量较高,温州罗浮S1时期果实含量可达(6.725 3±0.126 7)μg/g,浏阳金弹S4时期含量可达(5.673 0±0.106 5)μg/g,分别占总酚酸含量的93.61%~96.65%和65.55%~93.51%;本研究发现融安金弹、长寿金柑和四季橘中9种酚酸均有检出,但含量极低无法定量,与WANG等[20]对四季橘测定结果一致;没食子酸具有抗炎,抗氧化,抗癌等多种生物学活性,谭飔[21]发现金柑果实中含有相对丰富的没食子酸,并用细胞实验验证了其抗癌活性,没食子酸在本研究样品中均有检出,由于检测方法的不同,其含量有所差异。从各个时期酚酸的总含量来看,酚酸总含量最高的为金柑杂种,其含量从大到小依次为温州罗浮、浏阳金弹、长寿金柑、滑皮金柑、四季橘、融安金弹、宁波罗纹。

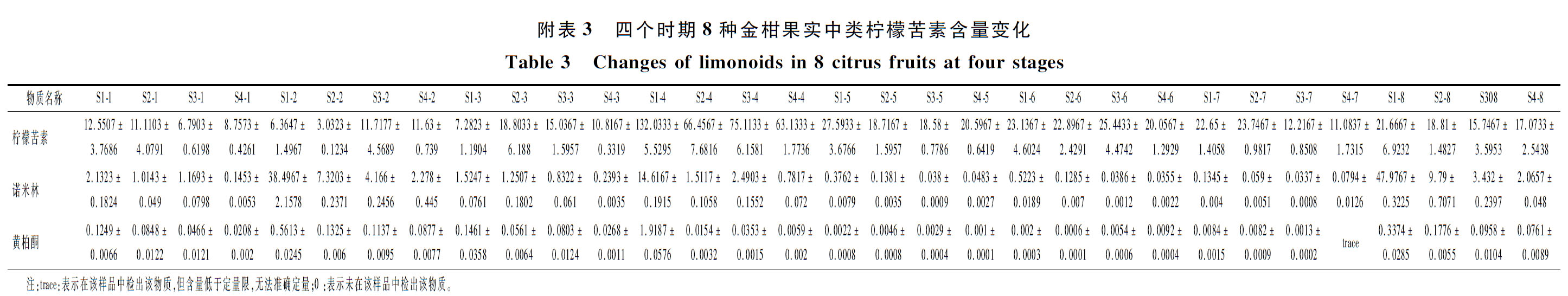
2.4 金柑果实中类柠檬苦素含量变化及差异分析
类柠檬苦素是以柠檬苦素为基本单位的三萜类衍生物,作为柑桔中的主要苦味物质,其苦味主要来源于糖苷配基。柠檬苦素类化合物的抗菌、抗癌、抗氧化等生物活性已被研究证实。本研究一共测定了柠檬苦素、诺米林和黄柏酮,3种物质在8种金柑的各个时期均有检出。如电子增强出版附表3所示,随着金柑果实的生长,类柠檬苦素的总含量整体上呈下降趋势;除四季橘与长寿金柑外,柠檬苦素在各个金柑的类柠檬苦素总含量中占比最大,其含量占总类柠檬苦素的84.75%~99.82%,其中金柑杂种S1时期柠檬苦素含量最高为(132.033 3±5.529 5)μg/g,占该时期总量的88.87%,其含量是S1时期长寿金柑的20倍;四季橘与长寿金柑中诺米林含量较高,两种金柑S1时期的含量均高于38.00 μg/g,除S1时期的金柑杂种外,而其他时期其他品种金柑中诺米林的含量均低于3.00 μg/g;除S1时期的金柑杂种黄柏酮含量高于1.00 μg/g,其余7种金柑中的黄柏酮含量较低且均在1.00 μg/g以下;HUANG等[22]测定了不同品种不同成熟阶段柑桔的柠檬苦素含量,其结论表示类柠檬苦素含量呈下降趋势,并在采摘早期达到峰值,与本研究结论一致;类柠檬苦素在不同的柑桔品种中含量不同,有研究表明,在枸橼的果皮和果肉中,诺米林含量最高,其次柠檬苦素[23],而本研究中柠檬苦素含量最高,诺米林次之,黄柏酮含量极低,其组成规律与大部分桔、柚一致。
2.5 金柑果实中生物碱含量变化及差异分析
自然界中的生物碱主要来源于天然植物,作为一类含氮的碱性有机化合物,生物碱具有多种生理活性,天然药物中的生物碱具有抗氧化、抗病毒、收缩血管、升高血压、减肥和抗肿瘤等作用[24]。甜菜碱能修复通过磷脂酰乙醇胺甲基转移酶催化的细胞甲基化反应,使得卵磷脂含量正常化,有效防止细胞产生脂肪变性,具有抗脂肪肝的效果[25]。本研究一共测定了5种生物碱,在8种金柑的大部分品种和时期中均有检出,如电子增强出版附表4所示,从5种生物碱的总含量来看,长寿金柑和四季橘中总含量较高,在130.00 μg/g以上,其他金柑的总含量均小于60.00 μg/g,这一含量特征与郭鹏妹等[15]研究结论一致;从组成来看,所有金柑中的生物碱均以N-甲基酪胺和酪胺为主,N-甲基酪胺在金柑杂种中含量最高,其他金柑均为酪胺,S1时期的长寿金柑中酪胺的含量高达(110.790 0±13.252 6)μg/g,占其生物碱总含量的69.60%~81.70%;8种金柑中的大麦芽碱、甜菜碱和章鱼胺的含量均较低,低于1.00 μg/g;甜菜碱在温州罗浮、宁波罗纹、浏阳金弹和四季橘中均为检出,在其他品种中也只在部分时期检出,且含量很低;大麦芽碱在融安金弹、宁波罗纹、温州罗浮、浏阳金弹中均为检出或检出含量很低无法定量;只有金柑杂种中的章鱼胺被准确定量,但含量均低于1.00 μg/g,其他金柑中的章鱼胺含量低于定量限,无法准确定量。ZHANG等[26]在研究中发现宽皮柑桔中主要的生物碱是N-甲基酪胺,并且本研究数据显示金柑杂种与其他7种金柑品种在生物碱组成上有显著差异,分析其原因为金柑杂种是金柑与宽皮柑桔的杂交所得,因此其生物碱组成不同于其他金柑,而是与宽皮柑桔相似。

2.6 金柑果实中香豆素含量变化及差异分析
香豆素是一类以苯骈α-吡喃酮为基本母核且具有芳香气味的天然产物,存在于芸香科、伞形科和豆科等植物中[27]。香豆素类化合物具有抗氧化、抗炎、抗病毒、抗菌抗动脉粥样硬化等多种生理活性[27]。本研究中一共测定9种普通香豆素和11种呋喃香豆素。从香豆素种类数量来看,如表4所示,融安金弹、宁波罗纹中4个时期定量的香豆素种类均≥13种,其他金柑的部分时期≥11种;从香豆素类物质总含量来看,如附表5所示,最高的是金柑杂种,宁波罗纹次之,其他金柑的总含量均低于2.00 μg/g,浏阳金弹与滑皮金柑中香豆素含量极低;从香豆素的具体成分含量来看,每种金柑不同时期各有不同,4个时期8种金柑中的6′,7′-二羟基香柠檬亭含量范围为(0.015 7~10.852 3)μg/g,在融安金弹、长寿金柑与宁波罗纹中含量较高;金柑杂种中滨蒿内酯含量最高,随着果实的生长发育,其含量先增大后迅速降低,在S3时期达到最大值为(6.386 3±0.175 7)μg/g,其他金柑中的滨蒿内酯含量均低于0.60 μg/g,甚至有部分金柑中含量太低而无法检出;4个时期8种金柑中橙皮油素的含量为0.001 5~1.917 0 μg/g,相对其他品种来说,金柑杂种与四季橘中橙皮油素含量较高,金柑杂种中S1时期橙皮油素含量为1.917 0 μg/g;本研究在7个品种中均检测出了伞形花内酯,但其含量均低于0.10 μg/g,或无法定量。芸香科中对于香豆素的研究主要集中在佛手、柚子等柑桔属,胡瀚文等[28]在佛手中鉴定出17种香豆素类化合物,而本研究测定了金柑果实中20种香豆素的含量,其中水合氧化前胡素、氧化前胡素、8-氧甲基异欧前胡内酯、异紫花前胡内酯、珊瑚菜素是首次在金柑中检出。


2.7 金柑果实中五类生物活性成分总含量聚类分析
对8种金柑果实中五大类生物活性物质的含量进行聚类分析,结果如图4所示。

图4 S1时期不同品种金柑果实中生物活性成分含量差异
Fig.4 Differences in the content of bioactive ingredients in the fruits of different varieties of citrus in the S1 period
注:图中物质的相对含量从红到绿依次递减。
品种的差异会直接影响到金柑果实代谢产物的多样性;在本研究检测的85种生物活性成分中,对比发现类黄酮在金柑的生物活性成分中贡献值最大,占总物质含量的80.70%~97.16%,其中金柑杂种的生物活性成分的总含量明显优于其他7个品种,但其金柑特有类黄酮金柑苷的含量显著低于其他金柑品种,甚至在S4时期未检出金柑苷。由图4可明显看出,除金柑杂种外,其他金柑中总类黄酮含量均以金柑苷为主,其金柑苷含量占类黄酮总量的26.08%~79.08%。金柑苷可作为金柑杂种区别于其他金柑的显著特征物质,这一差异可能与金柑杂种的母本父本有关。金柑杂种中有19种物质含量显著高于其他金柑,11种类黄酮物质分别为新西兰牡荆苷、杜荆素-2-O-鼠李糖苷、地奥司明、新地奥司明、甜橙黄酮、川陈皮素、桔皮素、5,7,8,4′-四甲氧基黄酮、橙皮苷、新橙皮苷和根皮苷,3种生物碱分别为大麦芽碱、N-甲基酪胺和章鱼胺、1种酚酸为绿原酸,1种类柠檬苦素为柠檬苦素,2种普通香豆素为滨蒿内酯和橙皮油素,1种呋喃香豆素为异欧前胡素;长寿金柑中的诺米林和酪胺含量与其他金柑有显著差异,四季橘中的5种生物活性成分的含量显著高于其他金柑,包括1种类黄酮为根皮苷,2种类柠檬苦素分别为柠檬苦素和诺米林,2种生物碱为酪胺和N-甲基酪胺;滑皮金柑中的2种类黄酮包括金柑苷和枸橘苷含量显著高于其他金柑;温州罗浮和浏阳金弹为金柑苷含量显著高于其他金柑,其他金柑的生物活性成分差异不够明显。
3 结论
本研究建立了金柑苷检测方法,通过分析不同生长阶段8个金柑品种果实中的生物活性成分,发现品种和生长期是影响金柑果实生物活性成分组成的重要因素。8个金柑品种果实共检出85种生物活性成分包括48种类黄酮、9种酚酸、3种类柠檬苦素,5种生物碱和20种香豆素。随着果实的膨大,花后35~125 d期间8种金柑果实中类黄酮、类柠檬苦素、生物碱总含量随着金柑果实的生长膨大呈大幅度降低趋势,在S3时期左右下降幅度趋于平缓,少部分金柑品种的含量在S2时期会小幅度上升,随后在S4时期下降;果实发育过程中金柑果实的酚酸、香豆素总含量差异显著,变化规律不明显;8个金柑品种中,金柑杂种的总类黄酮含量最高,但其金柑特有类黄酮金柑苷含量极少,其他7种金柑中总类黄酮含量均以金柑苷为主,其含量占类黄酮总量的26.08%~79.08%,就金柑苷含量而言,滑皮金柑、温州罗浮和浏阳金弹可作为金柑苷提取的主要药用品种材料。根据上述数据分析表明,在金柑生物活性成分提取研究过程中,确定其最佳品种与最佳研究时期是非常有必要且有意义的。本研究对整个生长发育阶段生物活性物质变化规律进行了前期摸索,研究结果明确了金柑果实不同生长时期的生物活性成分差异,对后续研究金柑生物活性物质积累规律及挖掘相关基因有重要意义,为更好地开发利用金柑资源及丰富我国金柑发展品种提供了一定的科学参考。
[1] OLCAY N, DEMIR M K.Effect of kumquat (Fortunella margarita) powders dried by different methods on some physical and chemical properties of cake[J].Journal of Food Measurement and Characterization, 2021, 15(6):5360-5368.
[2] 周开隆,叶荫民.中国果树志-柑橘卷[M].北京:中国林业出版社, 2010.
ZHOU K L,YE Y M. Annals of Chinese Fruit Tree·Citrus Volume[M].Beijing:China Forestry Press, 2010.
[3] WANG Y J, YANG C X, LIU C Y, et al.Effects of bagging on volatiles and polyphenols in Wanmi peaches during endocarp hardening and final fruit rapid growth stages[J].Journal of Food Science, 2010, 75(9):S455-S460.
[4] LIN C C, HUNG P F, HO S C.Heat treatment enhances the NO-suppressing and peroxynitrite-intercepting activities of kumquat (Fortunella margarita Swingle) peel[J].Food Chemistry, 2008, 109(1):95-103.
[5] LOU S N, LAI Y C, HSU Y S, et al.Phenolic content, antioxidant activity and effective compounds of kumquat extracted by different solvents[J].Food Chemistry, 2016, 197:1-6.
[6] GUO P M, PANG W H, ZHAO X J, et al.A rapid UPLC-QqQ-MS/MS method for targeted screening and quantitative analysis of secondary metabolites in satsuma mandarin[J].European Food Research and Technology, 2021, 247(7):1725-1736.
[7] LOU S N, LAI Y C, HUANG J D, et al.Drying effect on flavonoid composition and antioxidant activity of immature kumquat[J].Food Chemistry, 2015, 171:356-363.
[8] OGAWA K, KAWASAKI A, OMURA M, et al.3′, 5′-Di-C-β-glucopyranosylphloretin, a flavonoid characteristic of the genus Fortunella[J].Phytochemistry, 2001, 57(5):737-742.
[9] JEON S M, BOK S H, JANG M K, et al.Antioxidative activity of naringin and lovastatin in high cholesterol-fed rabbits[J].Life Sciences, 2001, 69(24):2855-2866.
[10] WILMSEN P K, SPADA D S, SALVADOR M.Antioxidant activity of the flavonoid hesperidin in chemical and biological systems[J].Journal of Agricultural and Food Chemistry, 2005, 53(12):4757-4761.
[11] ZENG H L, ZHANG Y, ZHAO Y T, et al.Extraction optimization, structure and antioxidant activities of Fortunella margarita Swingle polysaccharides[J].International Journal of Biological Macromolecules, 2015, 74:232-242.
[12] ABAD-GARC A B, GARM
A B, GARM N-LOBATO S, S
N-LOBATO S, S NCHEZ-IL
NCHEZ-IL RDUYA M B, et al.Polyphenolic contents in citrus fruit juices:Authenticity assessment[J].European Food Research and Technology, 2014, 238(5):803-818.
RDUYA M B, et al.Polyphenolic contents in citrus fruit juices:Authenticity assessment[J].European Food Research and Technology, 2014, 238(5):803-818.
[13] 王彤, 叶子茂, 刘梦雨, 等.多甲氧基黄酮在不同宽皮柑橘品种组织中的积累变化规律[J].浙江大学学报(农业与生命科学版), 2021, 47(6):729-735.
WANG T, YE Z M, LIU M Y, et al.Accumulation and change rules of polymethoxylated flavones in different tissues of mandarin[J].Journal of Zhejiang University (Agriculture and Life Sciences), 2021, 47(6):729-735.
[14] BARRECA D, BELLOCCO E, CARISTI C, et al.Kumquat (Fortunella japonica Swingle) juice:Flavonoid distribution and antioxidant properties[J].Food Research International, 2011, 44(7):2190-2197.
[15] 郭鹏妹, 秦艳, 赵希娟, 等.金柑果实主要次生代谢产物含量及差异分析[J].食品与发酵工业, 2021, 47(9):32-41.
GUO P M, QIN Y, ZHAO X J, et al.Research on the contents and difference of the main secondary metabolites in different kumquat fruits[J].Food and Fermentation Industries, 2021, 47(9):32-41.
[16] KAWAII S, TOMONO Y, KATASE E, et al.Quantitation of flavonoid constituents in citrus fruits[J].Journal of Agricultural and Food Chemistry, 1999, 47(9):3565-3571.
[17] 郑洁. 我国不同品种金柑主要营养及功能成分研究[D].重庆:西南大学, 2015.
ZHENG J.Study on main nutrition and functional components of different varieties of kumquat in China[D].Chongqing:Southwest University, 2015.
[18] 谭嫣. 金柑类黄酮糖基转移酶基因的筛选与克隆[D].重庆:西南大学, 2019.
TAN Y.Screening and cloning of flavonoid glycosyltransferase gene from kumquat[D].Chongqing:Southwest University, 2019.
[19] LIU C P, LIU J X, GU J Y, et al.Combination effect of three main constituents from Sarcandra glabra inhibits oxidative stress in the mice following acute lung injury:A role of MAPK-NF-κB pathway[J].Frontiers in Pharmacology, 2021, 11:580064.
[20] WANG Y C, CHUANG Y C, HSU H W.The flavonoid, carotenoid and pectin content in peels of citrus cultivated in Taiwan[J].Food Chemistry, 2008, 106(1):277-284.
[21] 谭飔. 金柑(Fortunella Swingle)乙醇提取物防治代谢综合征及其主要酚类物质抗癌活性的研究[D].重庆:西南大学, 2016.
TAN S.Study on the prevention and treatment of metabolic syndrome and the anticancer activity of main phenolic compounds from the ethanol extract of Fortunella Swingle[D].Chongqing:Southwest University, 2016.
[22] HUANG S J, LIU X Y, XIONG B, et al.Variation in limonin and nomilin content in citrus fruits of eight varieties determined by modified HPLC[J].Food Science and Biotechnology, 2019, 28(3):641-647.
[23] 孙崇德, 陈昆松, 戚行江, 等.柑桔果实柠檬苦素类化合物的研究与应用[J].浙江农业学报, 2002, 14(5):297-302.
SUN C D, CHEN K S, QI X J, et al.Studies and utilizations on limonoids from citrus frutis[J].Acta Agriculturae Zhejiangensis, 2002, 14(5):297-302.
[24] MONDAL A, GANDHI A, FIMOGNARI C, et al.Alkaloids for cancer prevention and therapy:Current progress and future perspectives[J].European Journal of Pharmacology, 2019, 858:172472.
[25] KHARBANDA K K, MAILLIARD M E, BALDWIN C R, et al.Betaine attenuates alcoholic steatosis by restoring phosphatidylcholine generation via the phosphatidylethanolamine methyltransferase pathway[J].Journal of Hepatology, 2007, 46(2):314-321.
[26] ZHANG Y H, JIAO B N.Simultaneous determination of six protoalkaloids in Chinese local varieties of loose-skin mandarins and sweet oranges by strong cation exchange-high performance liquid chromatography[J].Food Analytical Methods, 2019, 12(3):677-686.
[27] DUGRAND A, OLRY A, DUVAL T, et al.Coumarin and furanocoumarin quantitation in citrus peel via ultraperformance liquid chromatography coupled with mass spectrometry (UPLC-MS)[J].Journal of Agricultural and Food Chemistry, 2013, 61(45):10677-10684.
[28] 胡瀚文, 赵永艳, 杨天龙, 等.基于UPLC-Q-Orbitrap HRMS的川佛手化学成分分析[J].中国实验方剂学杂志, 2020, 26(7):148-155.
HU H W, ZHAO Y Y, YANG T L, et al.Analysis and identification of chemical constituents of citri sarcodactylis fructus by UPLC-Q-orbitrap HRMS[J].Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(7):148-155.