兽药被广泛用于动物疾病的预防和治疗、促进动物生长等方面,其种类繁多,抗生素是兽药残留分析中最常见的残留类别[1],一直是食品安全关注的重点。抗生素是一类用于杀死细菌或抑制其生长的药物[2],主要用于人和动物的疾病治疗,也作为促生长剂和亚治疗剂长期添加于动物饲料中。各国陆续出台相关条例及检测标准,对多种食品中各类抗生素残留限量进行了严格规定,这对现有检测技术也是一项巨大的挑战。在抗生素残留分析中,磺胺类、喹诺酮类及硝基咪唑类药物类属高频次检测项目,建立这些药物残留的快速筛查分析方法有利于提高日常筛查分析通量,增进风险监测效能,完善肉品质量安全控制的技术支持体系。
目前传统的抗生素检测方法比较常用的方法有HPLC[3-4]、液相色谱-质谱(liquid chromatography mass spectrometry, LC-MS)[5]、微生物抑菌试验(microbial inhibitions test, MIT)[6]等。HPLC和LC-MS法结合了色谱的分离能力和质谱的定性能力,可对复杂化合物进行更精准、简便的定性和定量分析,灵敏度比较高[7],但样品前处理、操作过程较为繁琐,检测时间长,对实验操作人员技术要求较高。MIT 法[6]可操作性非常强、成本较低,但灵敏度低、敏感性差,易受其他抗生素干扰[8]。这些方法存在前处理复杂,操作技术性强,检测成本高等缺陷。因此,开发快速、简便的抗生素筛查方法具有较好的应用价值。
抗生素残留快速筛查方法主要有胶体金免疫层析技术[9]、传感器法[10]、表面增强拉曼光谱法[11]、原位直接电离质谱等方法。这些方法灵敏度高、操作简便、反应时间短,可实现药物残留的现场快速定量检测,但易受人为因素干扰导致假阳性或假阴性,且不适合多种待测物的高通量快速检测。直接离子化质谱或原位直接电离质谱,可在大气压环境中实现原位、直接和快速的样品分析,无需复杂的样品制备过程,并可节省大量的资源和时间[12-13]。在各种原位质谱电离源中,实时直接分析(direct analysis in real time, DART)离子源是一种非表面接触的热解析大气压电离技术,结合了等离子体技术的简单性和灵敏性,可直接分析固体、液体和气体[14-17]。DART包含了大气压电离源类的软电离特性,与传统离子源(如电子轰击电离等)以及电喷雾电离源相比,不仅具有离子化效率高、灵敏度高、准分子离子峰丰度高、碎片离子少等优点,还具有较强抗基质干扰能力,实现样品的原位、无损、低碳、实时、直接和快速分析。使用DART源能够大幅简化样品制备过程,使无样品制备而直接分析成为可能, 极大地缩短了分析时间,节省了人力、物力资源,以实现实验室高通量分析[18-20]。
本研究利用DART离子源串联三重四极杆质谱(triple quadrupole,QQQ)快速筛查猪肉中23种兽药残留。通过对猪肉基质的溶剂提取和简单净化,DART源直接离子化,采用三重四极杆质谱分析测定,建立这些药物残留的快速筛查分析方法,该方法有利于提高日常筛查分析通量,增进风险监测效能,提升肉品质量安全控制,具有重要的应用价值。
1 材料与方法
1.1 材料与试剂
材料:猪肉,市售;乙腈(色谱纯),德国Merck公司;5982-0032萃取盐包、5982-4950净化包(含50 mg乙二胺-N-丙基硅烷、150 mg C18EC和900 mg Na2SO4)、0.22 μm有机微孔滤膜,美国Agilent公司;PRiME HLB固相萃取小柱,美国Waters公司。
标准品:磺胺类(磺胺喹恶啉、磺胺氯哒嗪、磺胺嘧啶、磺胺间二甲氧嘧啶、磺胺邻二甲氧嘧啶、磺胺甲基嘧啶、磺胺二甲基嘧啶、磺胺间甲氧嘧啶、磺胺吡啶、磺胺噻唑),喹诺酮类(环丙沙星、达诺沙星、双氟沙星、恩诺沙星、洛美沙星、氧氟沙星、奥比沙星、培氟沙星、沙拉沙星、司帕沙星),硝基咪唑类(甲硝唑、羟基甲硝唑、洛硝达唑),100 μg/mL,天津阿尔塔科技有限公司。
1.2 仪器与设备
ME104E电子天平,METTLER TOLEDO;Milli-Q去离子水发生器,美国Millipore公司;QL 866漩涡混合器,海门市其林贝尔仪器制造公司;SB-25-12DT超声波发生器,宁波新芝生物科技有限公司;Velocity 18R Pro 离心机,澳大利亚Dynamica公司;N-Evap 氮吹仪,上海安谱实验科技股份有限公司。
AB 4500三重四级杆液质仪,美国AB SCIEX公司;DART SVP离子源、样品传动轨道、进样玻璃棒,美国Ion- Sense公司;隔膜泵,德国Vacuubrand公司。
1.3 实验方法
1.3.1 样品前处理
市售猪肉均质匀浆后制成猪肉空白样品。
直接提取法:称取猪肉样品2.5 g试样于50 mL塑料离心管中,加入10 mL乙腈,剧烈振荡2 min。超声波提取20 min、10 000 r/min离心5 min。取2 mL上清液,40 ℃下氮吹至干。加入0.5 mL体积分数20%乙腈水溶液复溶,涡旋30 s,超声波处理5 min充分溶解,过0.22 μm有机微孔滤膜,得到基质提取液,待测。
分散固相萃取净化法:称取猪肉样品2.5 g试样于50 mL塑料离心管中,加入10 mL乙腈,剧烈振荡2 min。加入5 g萃取盐包,涡旋, 10 000 r/min离心5 min。取6 mL上清液于内含净化包的净化管中,涡旋30 s,4 000 r/min离心10 min。取2 mL上清液,40 ℃氮吹至干。加入0.5 mL体积分数20%乙腈水溶液复溶,涡旋30 s,超声波处理5 min充分溶解,过0.22 μm有机微孔滤膜,得到净化包提取液,待测。
固相萃取柱净化法:称取猪肉样品2.5 g试样于50 mL塑料离心管中,加10 mL乙腈,剧烈振荡2 min,10 000 r/min离心5 min。取5 mL上清液转移至PRiME HLB净化小柱上,洗脱收集2 mL上清液,40 ℃氮吹至干。加入0.5 mL体积分数20%乙腈水复溶,涡旋30 s,超声波处理5 min充分溶解,过0.22 μm有机微孔滤膜,得到净化柱提取液,待测。
1.3.2 仪器参数
质谱条件:扫描模式为全扫描模式;气帘气:20 psi;碰撞:Medium;离子源温度250 ℃;碰撞室脱离电压6 V;碰撞室入口电压10 V;DART离子源条件:正离子模式;解离气体温度350 ℃;栅网电极电压 200 V;样品轨道传动速度1.0 mm/s;隔膜泵压力12.0 kPa;工作气体为高纯He(99.999%),预备气体为高纯度N2(99.999%);进样装置为玻璃棒进样;用移液枪准确吸取液体2 μL于玻璃棒中,He打在玻璃棒上,离子化之后进质谱。待测化合物定量离子对、定性离子对及碰撞能量见表1。
表1 待测化合物定量离子对、定性离子对及碰撞能量
Table 1 Quantitative ion pair, qualifier ion pair, and collision energy of the analyte compound

化合物名称去簇电压/V定量离子对(m/z)驻留时间/ms定量离子对(m/z)碰撞能量/V磺胺喹恶啉80301.1→156.15301.1→10836磺胺氯哒嗪65285.1→1565285.1→108.137磺胺嘧啶40251.1→1565251.1→9238磺胺间二甲氧嘧啶70311.1→156.15311.1→21828磺胺邻二甲氧嘧啶70311.1→156.15311.1→108.237
续表1

化合物名称去簇电压/V定量离子对(m/z)驻留时间/ms定量离子对(m/z)碰撞能量/V磺胺甲基嘧啶82265.2→156.15265.2→172.125磺胺二甲基嘧啶60279.1→186.15279.1→15627磺胺间甲氧嘧啶75281.1→1565281.1→126.130磺胺吡啶40250.1→156.15250.1→10832磺胺噻唑40256→1565256→10832环丙沙星80332.1→288.15332.1→245.136达诺沙星77358.1→340.15358.1→314.137双氟沙星80400.1→356.15400.1→299.138恩诺沙星80360.1→361.15360.1→245.128洛美沙星80352→2655352→308.137氧氟沙星80362.2→318.15362.2→261.125奥比沙星80396→3525396→295.227培氟沙星80334.1→316.15334.1→290.230沙拉沙星90386.1→342.15386.1→299.132司帕沙星80393→349.25393→29232甲硝唑50172.2→127.95172.2→8220羟基甲硝唑50188.2→1235188.2→126.119洛硝达唑50201.2→1405201.2→515
1.3.3 标准溶液配置
标准混标储备液:分别量取1 mL磺胺喹恶啉、磺胺氯哒嗪、磺胺嘧啶、磺胺间二甲氧嘧啶、磺胺邻二甲氧嘧啶、磺胺甲基嘧啶、磺胺二甲基嘧啶、磺胺间甲氧嘧啶、磺胺吡啶、磺胺噻唑于10 mL容量瓶中,用乙腈定容并混匀,配置成10 μg/mL磺胺标准混标储备液。同样的方法配置喹诺酮类和硝基咪唑类10 μg/mL标准混标储备液。
标准混合中间液:取1 mL标准混标储备液于10 mL容量瓶中, 用乙腈定容并混匀,配置成1 000 μg/L中间液。
标准工作曲线:取10、20、50、80、100 μL标准混合中间液分别用乙腈、基质提取液、净化包提取液、净化柱提取液定容至1 mL,分别将3类混标配置成10、20、50、80、100 μg/L标准浓度系列工作液。
1.3.4 结果计算
取配置好的系列工作液进行测定,将标准系列工作液分别测定定量离子相应的丰度,以标准工作液的浓度为横坐标,以丰度为纵坐标,绘制标准曲线,外标法定量,数据采用Excel处理。前处理过程总基质效应(matrix effect,ME)计算参考文献[19]的方法,ME按公式(1)计算。
ME/%=B/A×100
(1)
式中:ME,前处理过程总基质效应,%;A,目标化合物在纯溶剂基质中检测的峰面积;B,目标化合物在阴性样品处理液基质中检测的峰面积。
2 结果与分析
2.1 前处理净化效果分析
空白猪肉样品按照1.3.1 节得到基质提取液、净化包提取液、净化柱提取液。取100 μL中间液分别用乙腈、基质提取液、净化包提取液、净化柱提取液定容至1 mL, 按照1.3.2节对上述3种基质标进行测定, 每个样品测定4次, 最终结果以平均值计, 并按照1.3.4 节计算ME值, 计算结果见表2。
表2 不同净化方式的ME值
Table 2 ME value of different purification methods

化合物名称乙腈基质提取液净化柱提取液净化包提取液丰度丰度ME/%丰度ME/%丰度ME/%磺胺嘧啶4.63×1063.53×1040.766.72×10514.535.25×10511.34磺胺噻唑1.90×1068.30×1030.442.51×10513.221.03×1055.45磺胺吡啶4.70×1066.36×1041.355.18×10511.027.69×10516.36磺胺甲基嘧啶3.22×1063.49×1041.084.55×10514.144.63×10514.39磺胺二甲基嘧啶6.19×1067.79×1041.269.36×10515.121.08×10617.49磺胺氯哒嗪1.73×1063.90×1030.312.02×10511.651.10×1056.34磺胺邻二甲氧嘧啶7.99×1064.13×1040.771.50×10618.788.46×10510.59磺胺间甲氧嘧啶9.30×1065.79×1040.621.15×10612.409.94×10510.69
续表2

化合物名称乙腈基质提取液净化柱提取液净化包提取液丰度丰度ME/%丰度ME/%丰度ME/%磺胺间二甲氧嘧啶9.07×1061.72×104 0.191.65×10618.219.87×10510.88磺胺喹恶啉2.27×1061.33×1040.596.06×10526.691.40×1056.16环丙沙星6.68×1031.54×104230.132.43×104363.368.64×103129.37达诺沙星3.45×1047.35×104212.812.18×105630.681.44×105415.84双氟沙星9.60×1045.09×10453.054.25×105443.091.16×105120.64恩诺沙星8.93×1046.28×10470.345.24×105586.531.62×105181.30洛美沙星5.63×1042.49×10444.21.97×105348.757.01×104124.40氧氟沙星3.30×1043.23×10497.742.45×105742.108.11×104245.36奥比沙星9.03×1041.26×10413.922.47×105273.058.99×10499.61培氟沙星4.75×1047.20×104151.73.40×105715.181.80×105379.55沙拉沙星5.33×1039.98×103187.322.73×104512.056.37×103119.48司帕沙星4.20×1042.04×10448.663.27×105778.469.23×104219.88甲硝唑7.79×1063.71×1054.764.43×1035.695.22×1056.70羟基甲硝唑3.14×1061.21×1053.863.04×1059.692.70×1058.59洛硝达唑7.78×1063.88×1054.996.03×1057.757.02×1059.02
图1、图2、图3和图4分别为标准浓度系列工作液在乙腈、基质提取液、净化包提取液和净化柱提取液中的总离子流图。

图1 标准浓度系列工作液在乙腈溶液中总离子流图(测定4次)
Fig.1 Total ion chromatogram of series standard concentration working solution in acetonitrile

图2 标准浓度系列工作液在基质提取液中总离子流图(测定4次)
Fig.2 Total ion chromatogram of series standard concentration working solution in matrix extract

图3 标准浓度系列工作液在净化包提取液中总离子流图(测定4次)
Fig.3 Total ion chromatogram of series standard concentration working solution in purification package extract

图4 标准浓度系列工作液在净化柱提取液中总离子流图(测定4次)
Fig.4 Total ion chromatogram of series standard concentration working solution in purification column extract
基质效应ME值可以反应基质效应的程度。通常ME值>100%为基质增强效应,ME值<100%为基质减弱效应,ME值=100%则不产生基质效应。从表2中可以看出,所有兽药化合物在净化柱提取液和净化包提取液中的ME值均大于在基质提取液中的ME值,这说明了基质采取2种方法净化都能够提高ME值,即净化减少了杂质的含量,减小杂质与兽药化合物竞争离子化,因而提高了兽药化合物的离子化效率。此外,大多数兽药化合物在净化柱提取液中ME值大于净化包提取液中的ME值,这说明了净化柱的净化效果优于净化包,通过净化柱能够除掉更多的杂质,提高了兽药化合物的离子化效率。
在基质提取液中(见表2),19种兽药化合物(磺胺嘧啶、磺胺噻唑、磺胺吡啶、磺胺甲基嘧啶、磺胺二甲基嘧啶、磺胺氯哒嗪、磺胺邻二甲氧嘧啶、磺胺间甲氧嘧啶、磺胺间二甲氧嘧啶、磺胺喹恶啉、双氟沙星、恩诺沙星、洛美沙星、氧氟沙星、奥比沙星、司帕沙星、甲硝唑、羟基甲硝唑、洛硝达唑)在基质中的ME值<100%,4种兽药化合物(环丙沙星、达诺沙星、培氟沙星、沙拉沙星)在基质中的ME值>100%。兽药化合物在基质中的ME值<100%,说明了杂质与兽药化合物竞争离子化,因而降低了兽药化合物的离子化效率。兽药化合物在基质中的ME值>100%,可能的原因是杂质与兽药化合物离子化后,在离子源与质谱间的通道被吸附,杂质与兽药化合物竞争吸附,从而抑制了兽药化合物在通道的损失,增加了兽药化合物通路,提高了响应值。当竞争吸附大于竞争离子化的作用,宏观表现为ME值>100%。
如表2所示,净化柱提取液中,只有10种喹诺酮ME值>100%;净化包提取液中,9种喹诺酮ME值>100%(双氟沙星、恩诺沙星、洛美沙星、氧氟沙星、司帕沙星、环丙沙星、达诺沙星、培氟沙星、沙拉沙星)。这一方面可能是由于不同前处理方式的净化效果和去除杂质种类不一致,导致目标化合物受到的基质干扰程度存在差异。另一方面可能是喹诺酮类化合物基本骨架均为氮杂双并环,但不同化合物的分子和空间结构存在一定差异,可能导致其受到基质影响不同。
2.2 兽药分子结构与基质效应特性分析
兽药分子结构与原位电离的基质效应包含了2个层面,竞争吸附和竞争离子化。从图5可知,系统聚类分析谱系图中横坐标表示临界值,临界值越小,则表明相似度越高。该图将23种兽药化合物依据基质提取液、净化柱提取液、净化包提取液3种条件下ME值综合判断,分为两大类,其中一类是喹诺酮类,另一类是磺胺硝基咪唑类。喹诺酮类竞争吸附效应占据优势,磺胺硝基咪唑类竞争离子化效应占据优势。

图5 23种兽药与其ME值的聚类分析谱系图
Fig.5 Cluster analysis pedigree of 23 kinds of veterinary drugs and their ME values
2.3 检出限
空白猪肉样品按照1.3.1节得到基质提取液、净化包提取液、净化柱提取液。取10 μL中间液分别用乙腈、基质提取液、净化包提取液、净化柱提取液定容至1 mL,按照1.3.2节对上述3种基质标进行测定,每个样品测定4次,最终结果以平均值计,另取空白基质检测,各化合物定量离子对响应结果见表3。
表3 23种兽药检出限加标及空白基质定量离子对响应
Table 3 Limit spike and blank matrix quantitative transition responses of 23 kinds of veterinary drugs

化合物名称乙腈基质提取液净化柱提取液净化包提取液10 μg/L10 μg/L0 μg/L10 μg/L0 μg/L10 μg/L0 μg/L磺胺嘧啶2.38×1051.85×103-2.58×105-3.51×104-磺胺噻唑6.10×1046.65×100-2.27×105-1.28×104-磺胺吡啶2.34×1057.07×103-1.73×105-5.35×104-磺胺甲基嘧啶1.66×1059.65×103-1.85×105-3.78×104-磺胺二甲基嘧啶3.19×1057.40×103-3.77×105-7.46×104-磺胺氯哒嗪6.87×1046.73×102-1.47×105-1.03×104-磺胺邻二甲氧嘧啶6.15×1041.71×104-7.43×105-6.15×104-磺胺间甲氧嘧啶7.18×1048.19×103-5.95×105-7.18×104-磺胺间二甲氧嘧啶3.91×1051.22×104-8.26×105-6.79×104-磺胺喹恶啉9.85×1047.40×103-1.88×105-1.28×104-环丙沙星5.61×1022.13×103-7.37×103-6.17×103-
续表3
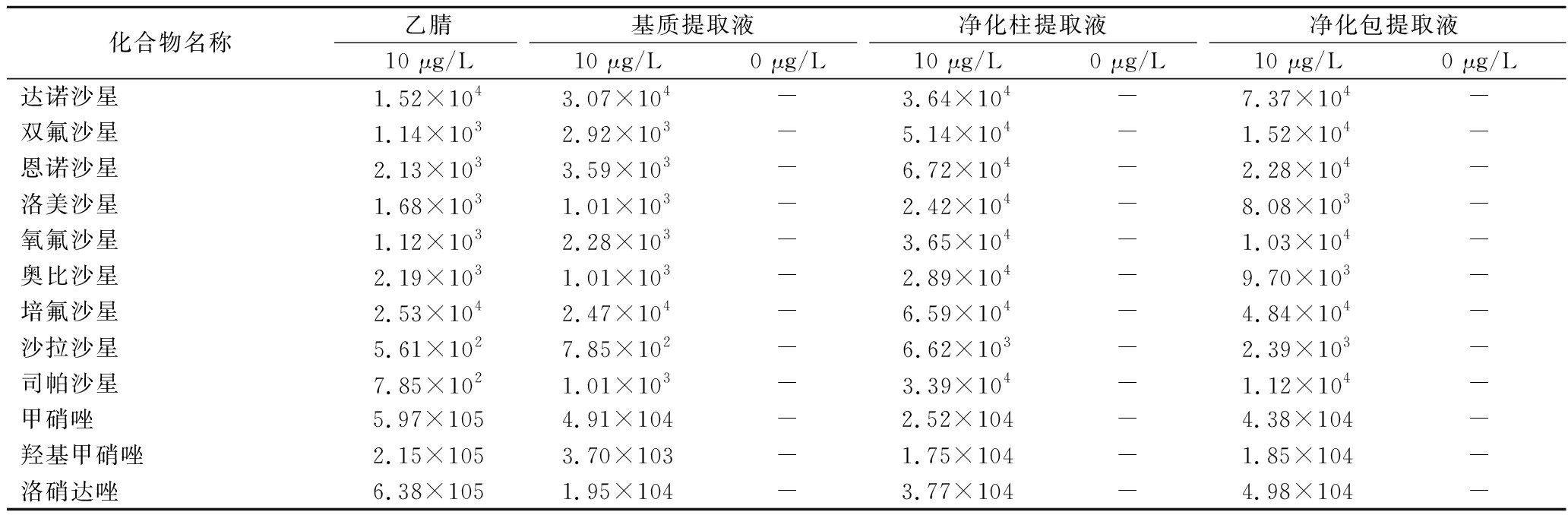
化合物名称乙腈基质提取液净化柱提取液净化包提取液10 μg/L10 μg/L0 μg/L10 μg/L0 μg/L10 μg/L0 μg/L达诺沙星1.52×1043.07×104-3.64×104-7.37×104-双氟沙星1.14×1032.92×103-5.14×104-1.52×104-恩诺沙星2.13×1033.59×103-6.72×104-2.28×104-洛美沙星1.68×1031.01×103-2.42×104-8.08×103-氧氟沙星1.12×1032.28×103-3.65×104-1.03×104-奥比沙星2.19×1031.01×103-2.89×104-9.70×103-培氟沙星2.53×1042.47×104-6.59×104-4.84×104-沙拉沙星5.61×1027.85×102-6.62×103-2.39×103-司帕沙星7.85×1021.01×103-3.39×104-1.12×104-甲硝唑5.97×1054.91×104-2.52×104-4.38×104-羟基甲硝唑2.15×1053.70×103-1.75×104-1.85×104-洛硝达唑6.38×1051.95×104-3.77×104-4.98×104-
注:“-”表示未找到定量离子,响应值为0。
从表3可以看出,10种磺胺、10种喹诺酮、3种硝基咪唑类药物在10 μg/L均有响应,在0 μg/L时, 基质提取液、净化柱提取液和净化包提取液均没有响应。因此,使用上述任何一种前处理方法,23种兽药化合物均能够在10 μg/L检出。其中,磺胺类、喹诺酮类和硝基咪唑类化合物的基质提取液经过净化柱或净化包净化后,响应都有不同程度的提升,说明净化能够明显提高这23种兽药化合物的响应。如果考虑到检测成本和检测效率,可以选择净化包作为23种兽药化合物的净化方法。
2.4 精密度
取10、20、50、80、100 μL中间液分别用乙腈、基质提取液、净化包提取液、净化柱提取液定容至1 mL,配置10、20、50、80、100 μg/L标准浓度系列,按照1.3.2节对上述3种基质标进行测定4次,最终结果以平均值计,精密度以相对标准偏差(relative standard deviation,RSD)计,23种兽残的检测精密度结果见表4。
表4 23种兽药检测精密度(RSD)
Table 4 Detection precision (RSD) of 23 kinds of veterinary drugs
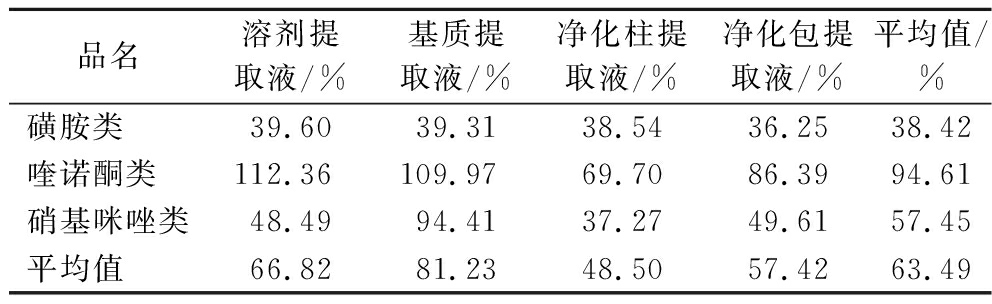
品名溶剂提取液/%基质提取液/%净化柱提取液/%净化包提取液/%平均值/%磺胺类39.6039.3138.5436.2538.42喹诺酮类112.36109.9769.7086.3994.61硝基咪唑类48.4994.4137.2749.6157.45平均值66.8281.2348.5057.4263.49
研究分别测定了磺胺类、喹诺酮类和硝基咪唑类兽药。如表4所示,兽药残留在不同基质中RSD值最低36.25%,最高112.36%,差异较大,RSD平均值63.49%。基质提取液的RSD平均值为66.82%,基质提取液经过净化后,RSD平均值由81.23%降低至48.50%(净化柱)和57.42%(净化包),说明净化后重现性明显提高。
磺胺类、喹诺酮类和硝基咪唑类兽药相比,喹诺酮类RSD平均值94.61%,明显高于磺胺类38.42%和硝基咪唑类57.45%,并且单独比较每一种提取液,喹诺酮类RSD仍高于磺胺类和硝基咪唑类。造成这个现象的原因可能是喹诺酮类具有明显的吸附效应,喹诺酮的吸附效应增强了信号,提高了响应值,但重现性变差。
因此采用原位质谱技术检测肉品中喹诺酮类时,净化柱提取液RSD明显低于其他基质的RSD,因此在检测肉品中喹诺酮时,采用净化柱净化,能够获得较好的精密度。对于磺胺类和硝基咪唑类,提高净化程度对精密度的改善不明显,采用净化包净化即可。
3 结论与讨论
本研究建立了肉品中兽药残留的高通量、快速、准确检测方法。以猪肉为基质,通过原位电离技术实现检样中23种兽药的多兽残快速测定,实现肉品中多兽药残留检测的突破。研究中通过比较基质提取液、净化柱提取液、净化包提取液3种条件下基质效应进行综合判断,发现兽药分子结构与原位电离的基质效应包含了竞争吸附和竞争离子化两个方面。喹诺酮类竞争吸附效应占据优势,磺胺硝基咪唑类竞争离子化效应占据优势。DART-QQQ在检测上无论采用固相萃取柱净化或者净化包净化,或不采取净化方式,23种化合物在10 μg/L均能够正常检出,其中,磺胺类、喹诺酮类和硝基咪唑类化合物的基质提取液经过净化柱或净化包净化后,能明显提高这23种兽药化合物的响应。采用原位质谱技术检测肉品中喹诺酮类时,净化柱提取液RSD明显低于其他基质的RSD,因此在检测肉品中喹诺酮类时,采用净化柱净化,能够获得较好的精密度。对于磺胺类和硝基咪唑类,提高净化程度对精密度的改善不明显。
本文建立的方法实现了磺胺类、喹诺酮类和硝基咪唑类三大类23种化合物同时快速测定,并且DART-QQQ检测能够达到与GB/T 21316—2007《动物源性食品中磺胺类药物残留量的测定 液相色谱-质谱/质谱法》、SN/T 2624—2010 《动物源性食品中多种碱性药物残留量的检测方法 液相色谱-质谱/质谱法》和GB/T 21312—2007《动物源性食品中14种喹诺酮药物残留检测方法 液相色谱-质谱/质谱法》一样的灵敏度级别。此外,采用DART-QQQ检测三大类化合物节省了大量的检测时间,单次样品测定时间小于 30 s,可以大幅缩短分析周期。传统HPLC检测需要较长的色谱分离过程才能将其分开,单次进样分析一般需要 10~40 min,HPLC-MS/MS检测也需10 min左右。
由于兽药种类多,衍生物复杂,本研究领域仍有更多的化合物检测方法需要建立,通过这三大类23种兽残的高通量、快速、准确测定,该方法具有通用性及可扩展性。另一方面,兽残原位质谱检测的精密度逊于液相质谱,因此对筛选出的不合格样品仍需要液相质谱进行检验。但不可否认原位质谱在兽药残留的高通量、快速、准确检测优势。因此,采用DART-QQQ检测猪肉中23种兽药残留,作为快检和对市售不合格猪肉的筛查,方法准确性、灵敏度好,并且能够扩展更多种类兽药高通量筛查,在多兽药高通量快检领域有至关重要的作用。
[1] 张璐琪, 张鸿伟, 梁成珠, 等.乳制品中兽药多种类残留的液相色谱-质谱分析研究进展[J].分析测试学报, 2017, 36(7):941-948.
ZHANG L Q, ZHANG H W, LIANG C Z, et al.Research progress on liquid chromatography-mass spectrometric analysis of multiclass veterinary drugs residues in dairy products[J].Journal of Instrumental Analysis, 2017, 36(7):941-948.
[2] 李国霞. 抗生素在抗感染中应用的药理分析[J].中国医药科学, 2018, 8(11):52-54;116.
LI G X.Pharmacological analysis of antibiotic application in anti-infection[J].China Medicine and Pharmacy, 2018, 8(11):52-54;116.
[3] SONG Y P, ZHANG L, WANG G N, et al.Dual-dummy-template molecularly imprinted polymer combining ultra performance liquid chromatography for determination of fluoroquinolones and sulfonamides in pork and chicken muscle [J].Food Control, 2017, 82:233-242.
[4] PATYRA E, PRZENIOS O-SIWCZY
O-SIWCZY SKA M, KWIATEK K.Determination of sulfonamides in feeds by high-performance liquid chromatography after fluorescamine precolumn derivatization[J].Molecules, 2019, 24(3):452.
SKA M, KWIATEK K.Determination of sulfonamides in feeds by high-performance liquid chromatography after fluorescamine precolumn derivatization[J].Molecules, 2019, 24(3):452.
[5] SUO D C, WANG P L, XIAO Z M, et al.Multiresidue determination of 27 sulfonamides in poultry feathers and its application to a sulfamethazine pharmacokinetics study on laying hen feathers and sulfonamide residue monitoring on poultry feathers[J].Journal of Agricultural and Food Chemistry, 2019, 67(40):11236-11243.
[6] 刘兴泉, 冯震, 姚蕾, 等.采用高通量微生物法和HPLC法检测猪肉中四环素和磺胺类抗生素残留[J].食品与发酵工业, 2011, 37(4):194-197.
LIU X Q, FENG Z, YAO L, et al.Analysis of tetracycline and sulfonamide antibiotic residues in pig muscle using throughout microbial assay and HPLC[J].Food and Fermentation Industries, 2011, 37(4):194-197.
[7] 林天野, 张俊鸿, 陈溪, 等.UGPLC-Q-TOF-MS法快速检测牛奶中21种磺胺类药物[J].化学分析计量, 2019, 28(6):98-104.
LIN T Y, ZHANG J H, CHEN X, et al.Rapid detection of 21 sulfonamides in milk by UGPLC-Q-TOF-MS/MS[J].Chemical Analysis and Meterage, 2019, 28(6):98-104.
[8] 王邦国. 动物性食品中磺胺类药物残留检测方法[J].今日畜牧兽医, 2020, 36(8):65.
WANG B G.Method for detecting sulfonamides residues in animal food[J].Today Animal Husbandry and Veterinary Medicine, 2020, 36(8):65.
[9] 路明, 张庆雨, 孙琛, 等.胶体金免疫层析技术在食品检测中的作用分析[J].中国食品, 2021(5):111.
LU M, ZHANG Q Y, SUN C, et al.Analysis of the role of colloidal gold immunochromatography in food detection[J].China Food, 2021(5):111.
[10] DE FARIA L V, LISBOA T P, DA SILVA CAMPOS N, et al.Electrochemical methods for the determination of antibiotic residues in milk:A critical review[J].Analytica Chimica Acta, 2021, 1173:338569.
[11] 马海宽, 张旭, 钟石磊, 等.基于静电富集-表面增强拉曼光谱联用技术的抗生素检测[J].中国激光, 2018, 45(2):306-313.
MA H K, ZHANG X, ZHONG S L, et al.Detection of antibiotics based on hyphenated technique of electrostatic-preconcentration and surface-enhanced-raman-spectroscopy[J].Chinese Journal of Lasers, 2018, 45(2):306-313.
[12] CLENDINEN C S, MONGE M E, FERN NDEZ F M.Ambient mass spectrometry in metabolomics[J].Analyst, 2017, 142(17):3101-3117.
NDEZ F M.Ambient mass spectrometry in metabolomics[J].Analyst, 2017, 142(17):3101-3117.
[13] PEACOCK P M, ZHANG W J, TRIMPIN S.Advances in ionization for mass spectrometry[J].Analytical Chemistry, 2017, 89(1):372-388.
[14] 王欣, 李林楠, 白玉, 等.实时直接分析质谱(DART-MS) 快速分析新进展[C]//中国化学会, 中国色谱学会.第二十届全国色谱学术报告会及仪器展览会论文集.西安:中国化学会, 2015:29-30.
WANG X, LI L N, BAI Y, et al.New Development of Rapid Analysis by DART-MS [C].Chinese Chemical Society, Chinese Chromatographic Society.Proceedings of the 20th National Chromatographic Academic Report and Instrument Exhibition.Xi 'an:Chinese Chemical Society, 2015:29-30.
[15] HAN J, DATLA R, CHAN S, et al.Mass spectrometry-based technologies for high-throughput metabolomics [J].Bioanalysis, 2009, 1 (9):1665-1684.
[16] XU S T, ZHANG Y D, XU L N, et al.Online coupling techniques in ambient mass spectrometry [J].Analyst, 2016, 141 (21):5913-5921.
[17] ZHOU Z G, ZHANG J L, ZHANG W, et al.Rapid screening for synthetic antidiabetic drug adulteration in herbal dietary supplements using direct analysis in real time mass spectrometry[J].Analyst, 2011, 136(12):2613-2618.
[18] LI L P, FENG B S, YANG J W, et al.Applications of ambient mass spectrometry in high-throughput screening[J].Analyst, 2013, 138 (11):3097-3103.
[19] MATUSZEWSKI B K, CONSTANZER M L, CHAVEZ-ENG C M.Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J].Analytical Chemistry, 2003, 75(13):3019-3030.
[20] 刘晗璐, 张九凯, 陈颖, 等.原位电离质谱技术在食品质量安全检测中的应用[J].分析试验室, 2020, 39(4):482-489.
LIU H L, ZHANG J K, CHEN Y, et al.Applications of ambient ionization mass spectrometry in food quality and safety detection[J].Chinese Journal of Analysis Laboratory, 2020, 39(4):482-489.