猪肉富含蛋白质、矿物质和维生素,是人们摄取营养物质的主要来源之一。单增李斯特菌是一种胞内寄生性人畜共患致病菌,在自然界中广泛存在,对苛刻环境耐受力极强,对猪肉的食用安全造成严重威胁[1]。由单增李斯特菌导致的食品安全问题不仅给消费者带来极大的食用风险,也给食品加工业造成了巨大的经济损失。
单增李斯特菌在猪肉中可以达到的最大污染浓度由该菌的生长特性决定。迟滞时间、最大比生长速率和最大污染浓度等生长动力学参数是描述单增李斯特菌生长特性的重要指标。通过对单增李斯特菌的生长动态进行数学建模可以获得该菌的生长动力学参数。生长特性仅仅决定了猪肉被加工处理前单增李斯特菌的污染浓度,对不利环境的抗性会影响单增李斯特菌进入宿主感染周期的剂量,进入宿主感染周期后,单增李斯特菌细胞的毒性大小与宿主患病的概率密切相关。
综上,在评估猪肉安全控制措施的有效性时,需要充分研究该措施对单增李斯特菌生长特性、抗性和毒性的影响。应用“栅栏技术”,即将2种或多种栅栏因子科学合理的组合起来,可以从不同方面控制单增李斯特菌的致病能力,从而提高猪肉的微生物安全。
1 猪肉制品中单增李斯特菌污染分析
我国是肉及肉制品生产大国。《中国统计年鉴》的数据显示[2],2016—2020年,我国居民平均每年总人均肉类消费量为26.8 kg,其中猪肉为20.2 kg,远远高于其他畜肉。近些年,为满足消费者对食品种类多样化的要求,猪肉制品的种类不断增加。同时,猪肉制品的安全问题,尤其是微生物安全问题,引起人们的广泛关注[3]。猪肉制品营养丰富,适合多种微生物生长,因此极易感染有害微生物,单增李斯特菌是污染猪肉制品的主要致病菌之一[3]。
猪肉制品中单增李斯特菌的污染有内源性和外源性污染2种途径。猪肉制品中单增李斯特菌的污染源头可以追溯到饲养在农场的猪。MORALES-PARTERA等[4]从西班牙2个屠宰场的150头猪中取了750份样品,其中67份检测单增李斯特菌呈阳性,阳性率高达8.9%。邱燕等[5]发现中国一些屠宰场厂中单增李斯特菌的污染率超过了25%。WANG等[6]从中国屠宰场中收集了1 322份猪粪便和104份环境样本,共分离到了5株单增李斯特菌,包含1/2a、1/2b和1/2c三个血清型。猪体携带的单增李斯特菌在猪肉中生长繁殖,可能会在加工环节污染加工设备和生产环境,进而污染其它未携带单增李斯特菌的猪肉。
在流通和销售阶段,猪肉中单增李斯特菌的阳性率也非常高。欧洲食品安全局(European Food Safety Authority,EFSA)在零售环节抽取了3 264份肉样进行致病菌检测,其中单增李斯特菌阳性检出率为5.7%[7]。KANUGANTI等[8]从美国超市抽取了340份零售猪肉样品,检出单增李斯特菌阳性率为50.2%,这些菌株中有53.5%的菌株属于家族I,可致人类和动物患病。我国很多学者也调查了流通和销售环节的猪肉制品中单增李斯特菌污染状况。虽然调查结果受地域和样品量的限制,但多数结果表明猪肉制品在流通和销售过程中单增李斯特菌污染情况较为严重。YU等[9]从河南零售市场上收集645份猪肉样品,其中43份检出单增李斯特菌,阳性率达到6.7%。WU等[10]从中国24个城市134个农贸市场收集196份肉及肉制品样品,最终检出单增李斯特菌阳性率为20.9%。
食品中病原微生物监测数据表明,我国各省市猪肉制品受到单增李斯特菌不同程度的污染,且部分省市污染情况相当严重,猪肉制品在流通过程中的单增李斯特菌污染率可高达30%(表1)。
表1 我国部分地区猪肉及猪肉制品中单增李斯特菌的阳性检出率
Table 1 Prevalence of L.monocytogenes in pork and pork products in China
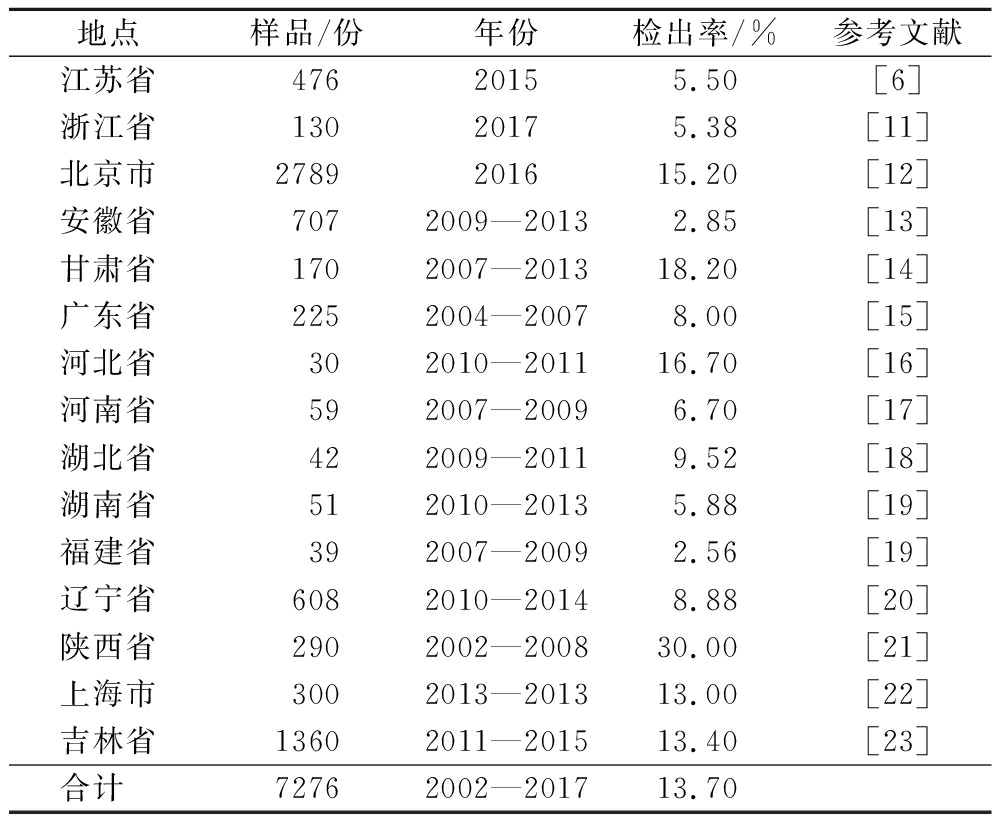
地点样品/份年份检出率/%参考文献江苏省47620155.50[6]浙江省13020175.38[11]北京市2789201615.20[12]安徽省7072009—20132.85[13]甘肃省1702007—201318.20[14]广东省2252004—20078.00[15]河北省302010—201116.70[16]河南省592007—20096.70[17]湖北省422009—20119.52[18]湖南省512010—20135.88[19]福建省392007—20092.56[19]辽宁省6082010—20148.88[20]陕西省2902002—200830.00[21]上海市3002013—201313.00[22]吉林省13602011—201513.40[23]合计 72762002—201713.70
2 单增李斯特菌病概述
根据遗传指纹图谱和致病潜力,可将单增李斯特菌分为4个不同的家族(表2)[24]。导致李斯特菌病暴发流行的主要是家族Ⅰ,家族Ⅱ主要引发零星疾病,家族Ⅲ和Ⅳ主要对动物致病,对人几乎无致病性。基于菌体/鞭毛抗原(O/H)血清学反应,将4个家族中的单增李斯特菌分为13个血清型[25]。家族I的4b血清型是致多起侵袭性李斯特菌病的血清型,且感染4b型的患者死亡率高于其他血清型感染者[25]。
表2 单增李斯特菌谱系分类总结
Table 2 Summary of L.monocytogenes lineages

家族初始发现血清型基因特点分布IPIFFA-RETTI等[25]1/2b、3b、3c、4b家族间多样性最低家族间重组水平低多种环境,包括人体均能分离得到IIPIFFA-RETTI等[25]1/2a、1/2c、3a家族间多样性高家族间重组水平高主要从食品及其相关环境分离得到IIIRASMUS-SEN等[26]4a、4b、4c家族间多样性高、重组水平多介于I和II之间多数从反刍动物体内分离IVWARD等[27]4a、4b、4c分离到的菌株很少多数从反刍动物体内分离
单增李斯特菌为兼性胞内寄生菌,可穿越宿主的肠道屏障、血脑屏障和胎盘屏障,在宿主细胞中存活并繁殖。动物和人类在摄入一定剂量的单增李斯特菌后会患李斯特菌病。李斯特菌病主要有非侵袭性(发热性胃肠炎)和侵袭性疾病2种症状。健康的成年人患李斯特菌病后会出现发热性胃肠炎症状,但是在一周内可随着身体的新陈代谢自行缓解。对于免疫力低下人群,特别是老年人、孕妇和癌症患者,被单增李斯特菌感染后通常会患侵袭性系统疾病,包括心内膜炎、流产和败血症等。另外,调查结果显示,从被感染的孕妇体内分离出来的单增李斯特菌多为4 b血清型[25]。尽管单增李斯特菌的发病率较低,但是人们患李斯特菌病后的致死率高达20%~30%,造成了极大的死亡疾病负担[28]。
在国外,EFSA和欧洲疾病预防控制中心(European Centre for Disease Prevention and Control, ECDC)调查数据显示[28],从2008—2017年,欧盟国家居民患侵袭性李斯特菌病有增多趋势,且很大比例是零星事件;2017年,欧盟国家居民中患李斯特菌病总人数为2 480人,发病率为0.48/100万;因患李斯特菌病死亡人数为227人,死亡率为9.15%。另外,美国疾病预防控制中心的调查数据显示,美国每年约有1 600人因食用被单增李斯特菌感染的食物而患李斯特菌病,患者主要是孕妇、新生儿、65岁以上的老年人及免疫力低下者(https://www.cdc.gov/dotw/listeria/index.html)。其他国家也有人类因食用被污染的食物而患李斯特菌病的报道,如2018年5月份,南非暴发全球历史上最大的李斯特菌病疫情,导致1 024人患病,200例左右患者死亡,其中42%的患者为孕妇和新生婴儿。
在中国,孙照琨等[29]收集了256例侵袭性李斯特菌病病例(1964—2013年),发现李斯特菌病多为零星事件,只有一起暴发报道(4例);进一步统计分析这些病例的临床信息发现,256例侵袭性李斯特菌病病例中,有134例是孕妇及新生儿,占患病人数的一半左右。其余122例中,20~59岁人群的比例为63.5%;60岁以上老人的比例为15.2%。256例患者中,总体死亡率达到30.8%,新生儿组死亡率最高,为52.6%。近年来,也时有单增李斯特菌引发新生儿患李斯特菌病的病例报道:如2016年,江苏省某医院收诊新生儿感染单增李斯特菌病1例[30]。2017年,甘肃省某医院收诊2例新生儿单核细胞增生李斯特菌的患者(https://www.sohu.com/a/200484268_653072)。
鉴于李斯特菌病在免疫力低下人群中的高致死率,十分有必要深入分析影响单增李斯特菌致人类患病能力的因素,进而有的放矢,采取有效措施降低食品中单增李斯特菌引起人类患李斯特菌病的风险。
3 影响单增李斯特菌致病能力的因素分析
由食源性致病微生物引发的食品安全问题日益受到全球关注。政府与企业间、企业与企业间进行风险管理和风险交流是降低食品安全问题的重要途径。风险评估可为风险管理和交流提供准确的信息及技术支撑,是风险体系的基础与核心。国际食品法典委员会(Codex Alimentarius Commission,CAC)将微生物风险评估分为危害识别、暴露评估危害特征描述和风险特征描述4部分[19]。其中,危害特征描述是风险评估的重要部分。
危害特征描述是通过剂量-效应模型(dose response model,DRM)定量(定性)描述一定剂量的单增李斯特菌进入人体后导致宿主患李斯特菌病的能力[31]。目前常用的DRM有对数模型、泊松模型和指数模型等。此处以简单的指数模型对影响单增李斯特菌致病能力的因素进行分析,指数模型表达式如公式(1)所示:
P=1-exp(-γ×N)
(1)
式中:P,消费者患李斯特菌病的概率;N,单增李斯特菌的摄入剂量,CFU;γ,单位单增李斯特菌细胞的毒性大小。
由公式(1)可知,消费者患李斯特菌病的概率由摄入该菌的剂量及毒性大小共同决定。消费者摄入单增李斯特菌的剂量由食物中该菌的污染浓度与和摄入食物的份量共同决定。因此,摄入食物份量一定时,消费者摄入单增李斯特菌的剂量由该菌在食品中的污染浓度决定。
对不利环境的抗性会影响该菌进入宿主感染周期的剂量。如热处理是最为常见的杀菌消毒及熟制食品的加工工艺[32],因此热抗性会影响单增李斯特菌在食品入口前的污染浓度;被消费者摄入后,胃肠道消化系统中的不利环境是单增李斯特菌进入宿主体内感染周期的首要屏障[33]。经过消化系统存活下来的单增李斯特菌进入宿主感染周期,此时单增李斯特菌毒性大小与宿主患病的概率密切相关[34]。因此,单增李斯特菌导致宿主患病的能力由该菌的生长特性、抗性和毒性共同决定(图1)。
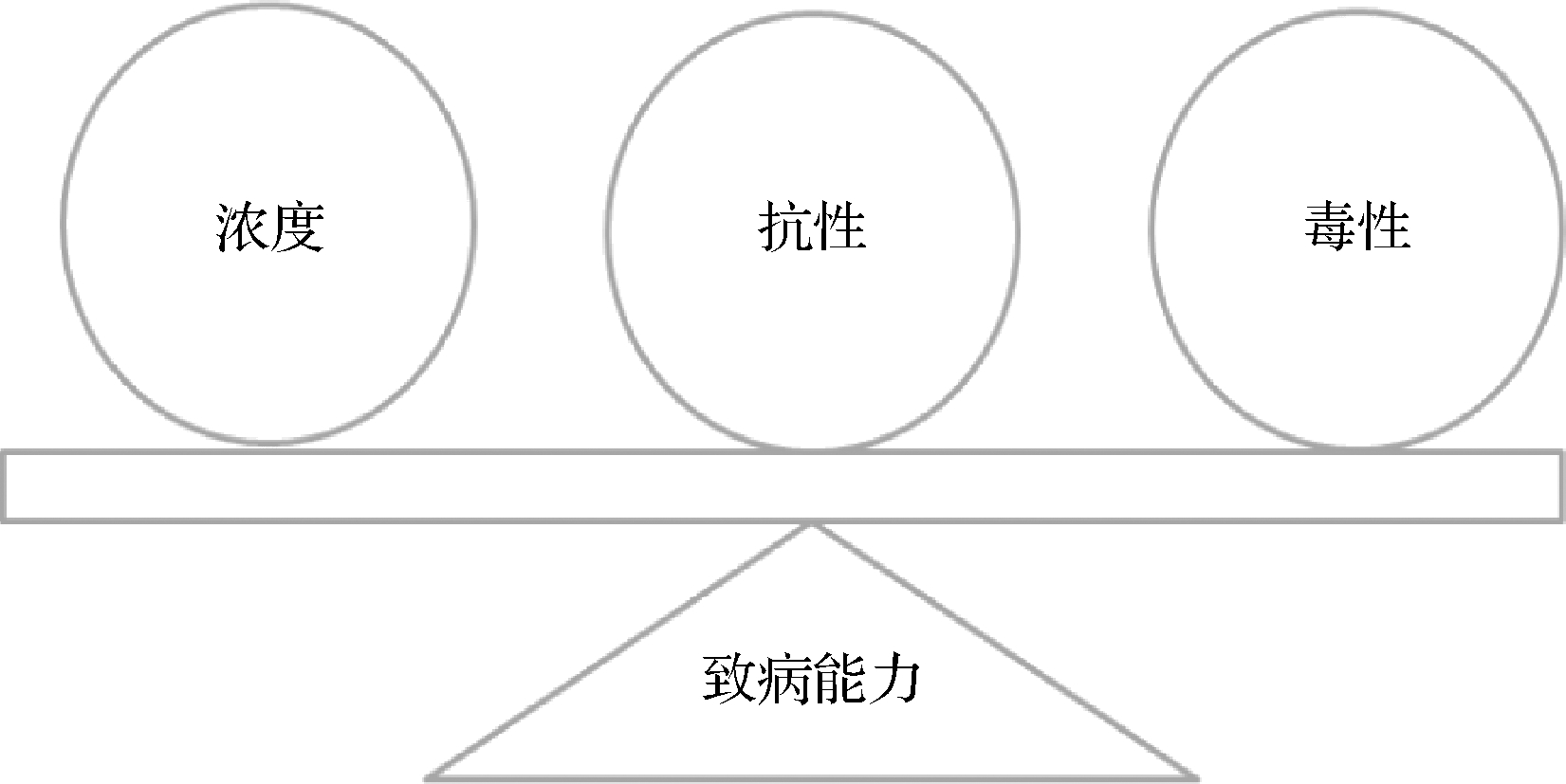
图1 影响单增李斯特菌致病能力的因素图示
Fig.1 Schematic representation for pathogenic capacity of L.monocytogenes
3.1 食品中单增李斯特菌的污染浓度
人类患李斯特菌病的概率和食品中单增李斯特菌的污染浓度紧密相关。细菌在食品中可以生长繁殖,因此即使食品中细菌的初始污染浓度较低,在经过一段时间的储存之后,仍可以生长到较高浓度,进而威胁人们的健康安全。
单增李斯特菌在食品中能够达到的最大污染浓度(Nmax)由该菌的生长特性决定。单增李斯特菌的生长呈“S”型,分为迟滞期、指数生长期和稳定期3个阶段(图2)。在迟滞期,单增李斯特菌积累着生长繁殖所需要的物质与能量,此时该菌的浓度为初始浓度N0。λ的大小决定了单增李斯特菌进入快速生长阶段所需时间的长短。当积累了足够的物质和能量后,细菌开始以二分裂的方式进行繁殖,μmax的大小描述了单增李斯特菌在快速生长阶段的最大比生长速率。食品对细菌有一个最大容纳程度(Nmax),λ和μmax共同决定了单增李斯特菌生长到稳定期的Nmax,进而影响了猪肉的微生物安全,可通过延长λ,降低μmax和Nmax从而降低单增李斯特菌的污染浓度。
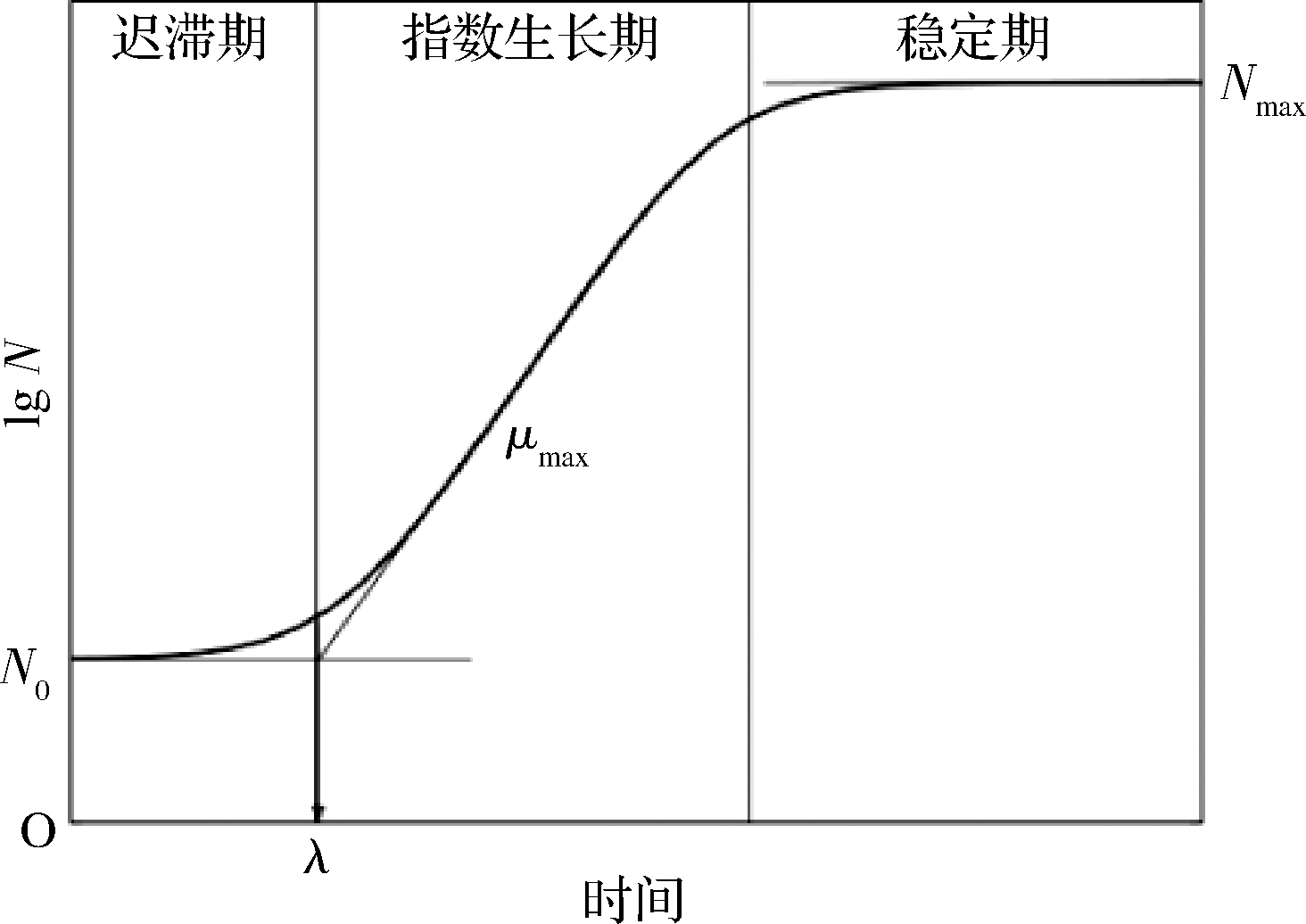
图2 细菌的生长曲线图示[35]
Fig.2 Schematic representation of bacteria growth curve[35]
3.2 食品中单增李斯特菌的抗性
对不利环境的抗性会影响该菌进入宿主感染周期的剂量。控制食品原料、加工和流通环节的单增李斯特菌污染是预防李斯特菌病的主要措施。热杀菌技术是最为常见的杀菌技术之一,热处理可破坏细胞结构,影响胞内蛋白质表达[36],从而导致细菌失活。不同热处理温度致细菌失活的效果显著不同,一般以杀死90%的细菌所需时间定为该温度下细菌的D值。如60 ℃时,杀死猪肉中90%的单增李斯特菌所需时间约为4.72 min,单增李斯特菌的D60为4.72 min,而单增李斯特菌的D62.5是1.93 min[37]。
随着被污染的食品进入宿主后,单增李斯特菌遇到的第一个屏障是宿主的胃肠道消化系统,包括口腔中的唾液、胃中的胃液(强酸)和肠道中的肠液(高渗透压)。经过消化系统后存活的单增李斯特菌进入宿主体内感染周期。由图3可知,不利环境条件导致单增李斯特菌失活时,该菌的浓度会迅速下降。
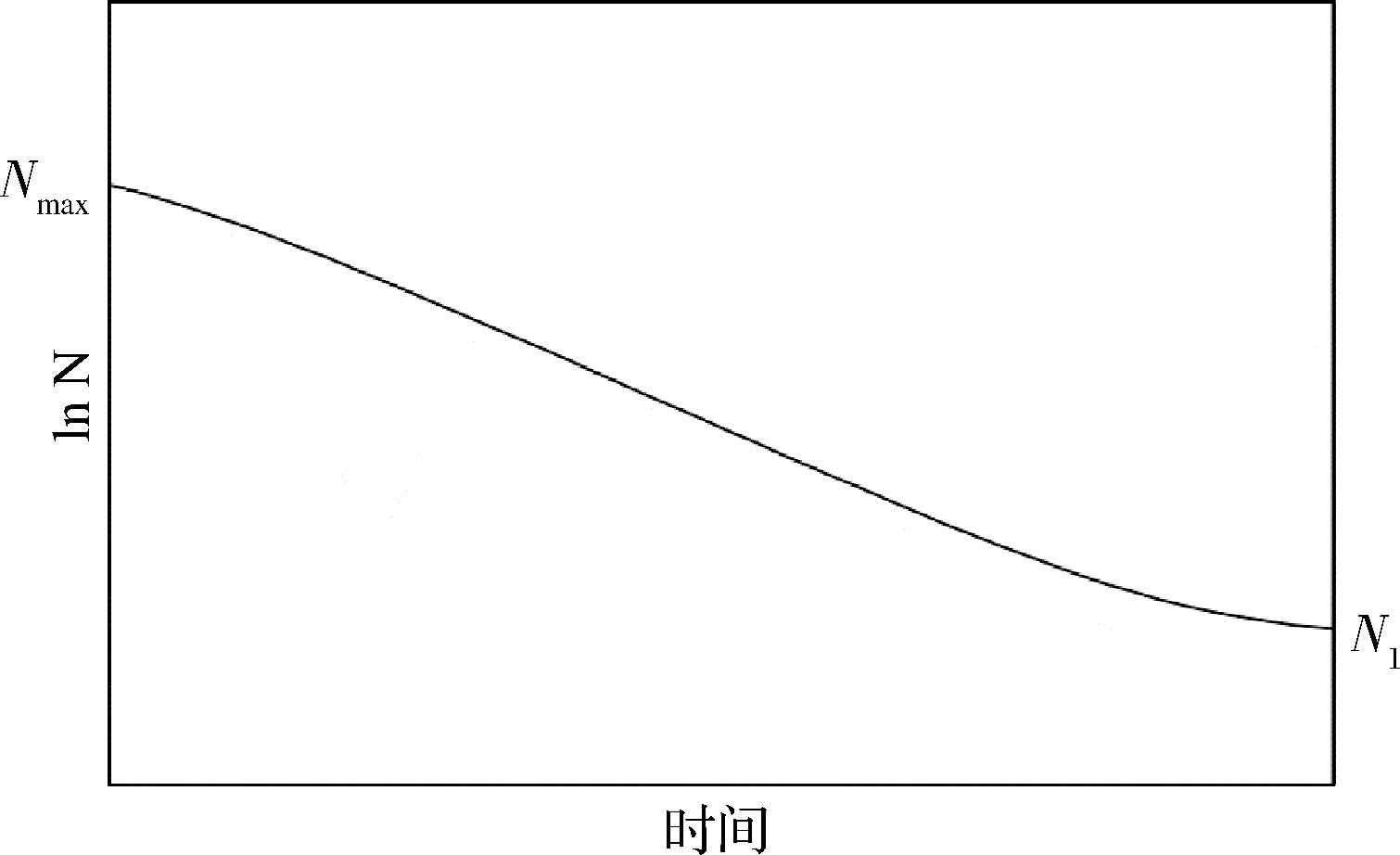
图3 细菌的失活曲线图示
Fig.3 Schematic representation of bacteria inactivation curve
单增李斯特菌对不利环境条件的抗性与菌体本身特性及抗性基因的表达有关。在温和的压力环境下,单增李斯特菌的抗性依赖于细胞内大分子物质(如核酸、蛋白质和酶)的缓冲作用和菌体细胞膜(壁)特有的稳态[38]。在恶劣的压力条件下,单增李斯特菌会启动自身的抗性应答机制以抵抗外界压力[39]。单增李斯特菌应对不同的环境压力时,会启动不同的抗性应答机制。
在高温处理时,单增李斯特菌会开启热抗性应答系统。热抗性防御系统比较保守,如在温和热处理时,单增李斯特菌的热抗性因子groEL不表达,只有热处理达到一定强度时,groEL才会大量表达以积累热抗性蛋白来抵抗热处理[40]。一些热抗性蛋白自身就是毒力蛋白,还有一些热抗性蛋白通过调控其它毒力因子的表达影响单增李斯特菌的毒性。
酸性和高渗透压环境也是细菌常遇到的不利环境,如对食品和加工环境杀菌消毒的酸性清洗剂、酸性的食品环境和人体消化道中的胃液。在温和酸处理条件下,细胞膜的通透性和流动性会协助单增李斯特菌适应酸性环境。在强酸性环境下,单增李斯特菌有多套调节细胞内外酸碱平衡的防御机制,如F0F1-ATPase和谷氨酸脱羧酶系统[41]。酸抗性应答机制的存在是单增李斯特菌耐受 “强酸”环境的主要原因。在宿主小肠中,单增李斯特菌会遇到肠液、胰液和胆汁等高渗透压环境,此时甘氨酸甜菜碱转运蛋白和胆盐水解酶等抗性因子的存在可以协助单增李斯特菌在宿主小肠中生存[42]。
单增李斯特菌对恶劣环境条件的抗性依赖于热抗性、酸抗性和渗透压抗性等抗性基因的表达,而这些抗性因子均受到Sigma B (sigB)因子的调控。sigB因子位于RNA聚合酶全酶中,可以识别基因启动子,并且与特定基因启动子的结合位点结合以开启抗性基因的转录进程,进而积累抗性蛋白以在恶劣环境下生存[43]。
食品在被消费之前所处的环境会影响单增李斯特菌的抗性。食品基质和食品贮存温度对单增李斯特菌的生存能力影响较大。另外,在食品中添加防腐剂也能改变单增李斯特菌的抗性,如IGLESIAS等[44]研究表明生物保护菌株鼠李糖乳杆菌能够降低单增李斯特菌在胃肠道系统中的生存能力。PETTERSEN等[45]指出先前暴露于高浓度的NaCl环境会增强单增李斯特菌在宿主胃肠道系统中的生存能力。细菌菌株特性和生长阶段(迟滞期/指数期/稳定期)也影响着细菌在胃肠道系统中的生存能力[46]。
3.3 食品中单增李斯特菌的毒性
进入宿主感染周期后,单增李斯特菌细胞的毒性大小与宿主患病的概率密切相关。单增李斯特菌在孕妇体内的感染进程见图4。
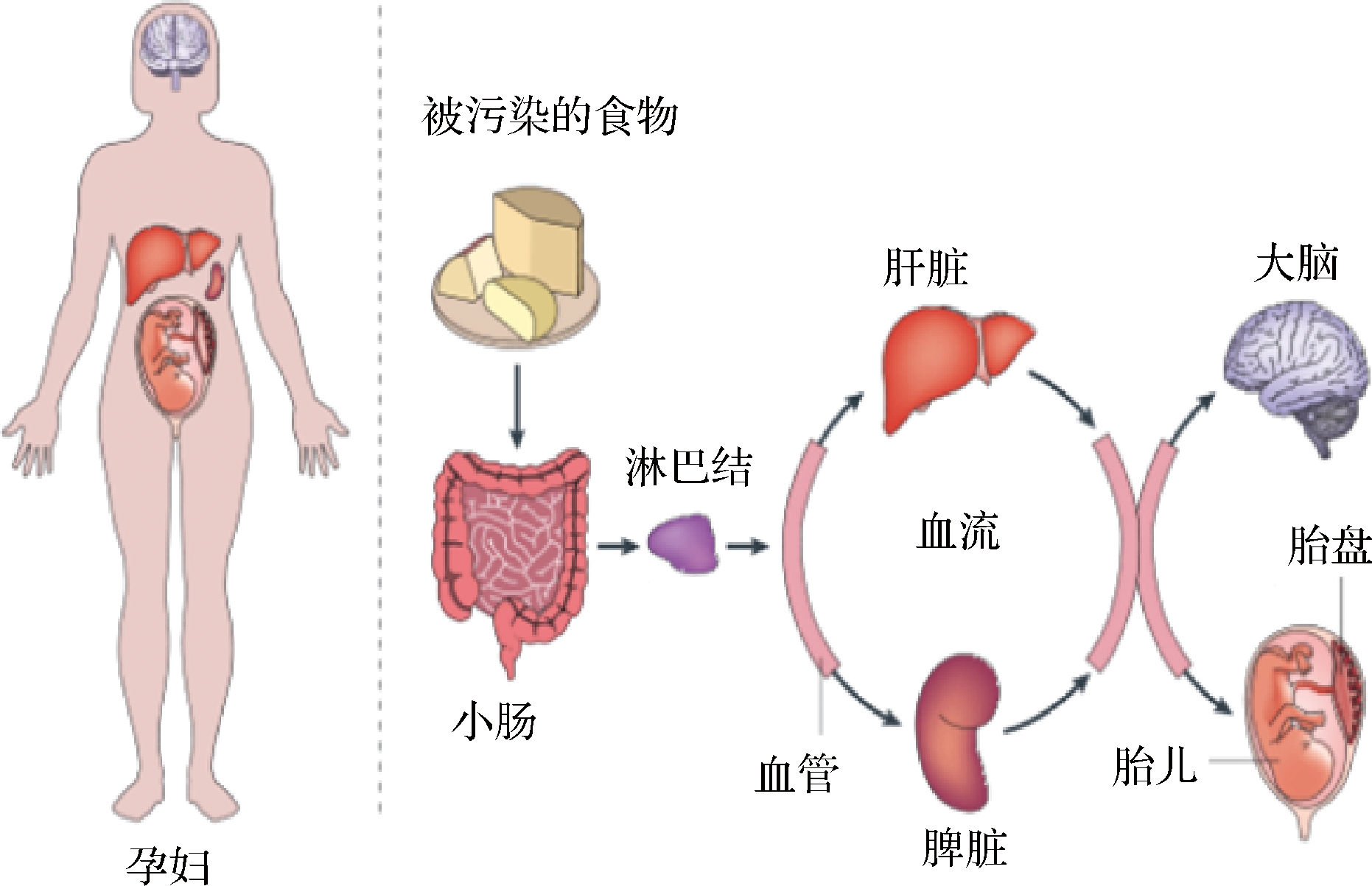
图4 单增李斯特菌在孕妇人体内的感染进程图示
Fig.4 Overview of L.monocytogenes infection in pregnant woman
单增李斯特菌为兼性胞内寄生菌,经过宿主消化系统后,对小肠上皮细胞的的黏附与侵袭能力是单增李斯特菌穿过肠道屏障而感染宿主的前提[47]。单增李斯特菌穿过宿主的肠道屏障后可以在巨噬细胞和非巨噬细胞中生长存活并且繁殖,还可以穿过宿主的血脑屏障,进入血液循环和淋巴结循环[48],随着血液和淋巴结扩散到宿主的肝脏和脾脏等组织器官,在器官内生长繁殖,最终导致器官病变。对于孕妇来说,单增李斯特菌还可以穿过孕妇的胎盘屏障感染胎儿[49],导致孕妇流产及新生婴儿患脑膜炎。2018年南非暴发大规模李斯特菌病疫情中,42%的病例为孕妇和新生婴儿。
以上分析表明,单增李斯特菌导致宿主患病的能力由该菌的生长特性、对不利环境条件的抗性和在宿主体内的毒性共同决定。先前筛选食品控制措施时主要集中于探讨控制措施对致病菌数量减少的能力,忽略了抗性和毒性的影响,这会对消费者的健康安全造成潜在的威胁。如ANDERSEN等[50]指出虽然无氧气调包装可以降低单增李斯特菌的污染浓度,但是单增李斯特菌在无氧条件下对Caco-2细胞的侵袭能力是有氧状态下的100倍。OMORI等[32]分析了乳酸处理后单增李斯特菌的生长特性和热抗性,结果表明使用质量分数<3%的乳酸处理后,单增李斯特菌的数量减少,但是热抗性增加了3.4倍。因此,充分探究食品安全控制措施对单增李斯特菌生长、抗性和毒性的影响十分必要。
4 猪肉制品中单增李斯特菌的控制
4.1 物理技术
物理灭菌方法是食品工业中较为常见的抑(杀)菌技术。物理方法灭菌速度快、效率高,已经被广泛应用于食品质量和安全控制中。热杀菌、非热杀菌、冷冻冷藏和气调保藏等都是常见的物理栅栏因子。热杀菌技术包括远红外加热杀菌、微波杀菌、超高温瞬时杀菌、高压杀菌和常压杀菌(巴氏消毒法)等。非加热杀菌不需要对食品加热而杀死微生物,如辐照、高压和超声波。冷冻杀菌通过降低温度破坏致病菌的细胞结构和蛋白质表达,但是同时食品细胞也会受损,从而导致食品质量下降。气调包装可将食品和外界的环境隔离开,预防环境中的微生物污染食品,还可通过改变气体环境抑制食品中微生物的生长[51]。近年来,物理栅栏因子不断扩增和改进,在食品质量与安全控制中得到了广泛应用。
4.2 化学技术
化学抑菌技术包括盐保藏法、糖保藏法、醋保藏法、酒保藏法及防腐剂保藏法等。盐保藏法和糖保藏法的主要原理是通过增加食品环境中的盐浓度和糖浓度,使得食品环境中(细菌外部)的渗透压增加,细菌细胞内外渗透压不平衡,细胞内部的水分外流,造成细菌细胞质壁分离,最终导致细胞死亡。醋和酒的浓度比较高时,也能通过打破细胞内外的渗透压平衡导致细菌失活。
根据防腐剂的来源和性质,可将防腐剂分为无机防腐剂和有机防腐剂。无机防腐剂主要包括硝酸盐和亚硝酸盐、食盐和CO2气体等。有机防腐剂主要包括山梨酸及其盐、苯甲酸及其盐和一些天然防腐剂。防腐剂的主要抑菌原理是通过改变细菌酶类的合成、降低蛋白质的活性和破坏细胞膜结构,进而抑制细菌生长[52]。随着消费者对食品安全需求的提高,越来越多的天然防腐剂如鱼精蛋白、茶多酚、乳酸链球菌素(nisin)和其他动植物及微生物提取物被应用在食品工业中。
4.3 生物技术
生物抑菌因子一般是从动物、植物和微生物体内(或者微生物自身)直接提取出来的天然物质,在自然界中天然存在,对消费者健康无负面影响,因此受到消费者的欢迎[53]。微生物和它们的天然产物在食品防腐抑菌中起着关键作用。生物保护菌(bioprotective cultures)是将活性微生物菌体直接添加到食品中,在不影响食品感官品质的前提下,可延长食品保质期和/或抑制致病菌生长[54]。
将生物保护菌应用于食品安全控制有以下几个条件:第一,添加到食品中的生物保护菌必须是相关标准允许的;第二,添加到食品中的生物保护菌不能对人体健康产生有害影响;第三,应用在食品中的生物保护菌在食品中需保持较高活性,能够在食品中生存和繁殖[55];第四,生物保护菌不能对食品的感官品质产生较大的负面影响[56]。
近年来,将生物保护菌应用于食品中提高食品微生物安全的研究较多。如CASTELLANO[53]等综述了将产细菌素的乳酸菌作为生物保护菌应用在鲜猪肉中抑制单增李斯特菌的相关研究。HOSSAIN等[55]总结了益生菌作为生物保护菌在提高农产品感官品质和微生物安全上的应用,并且指出选取特定的益生菌在农产品表面涂膜可以延长农产品的货架期、提高农产品的微生物安全。CALO-MATA等[56]总结了乳酸菌及其产生的细菌素在水产品微生物安全控制中的应用。WORAPRAYOTE等[57]将乳酸菌及其产生的细菌素添加到禽肉丁中抑制致病菌的生长,取得了良好效果。
4.4 栅栏技术
食品抑菌的基本原理是采用物理法、化学法和生物法预防食品被微生物污染,并且杀死(抑制)食品中已经存在的微生物。在食品加工和保藏过程中,仅靠一种防控措施很难达到理想的抑菌效果。一般是将多个不同的防控措施科学的组合起来,从不同的方面对有害菌形成综合控制,这种方法叫做栅栏技术,这些单个的防控措施叫做栅栏因子。
利用栅栏技术控制单增李斯特菌的致病性能够取得更好的效果。目前将气调包装结合其他抑菌措施抑制单增李斯特菌的文献较多。IRKIN等[58]发现单独使用高浓度CO2气调包装能够抑制单增李斯特菌的生长,但是联合精油对单增李斯特菌的抑制效果更好。CHOULIARA等[59]也指出CO2气调包装结合生物抑菌剂牛至精油对新鲜鸡胸肉中单增李斯特菌的控制效果比二者单独使用增强很多。HUGAS等[60]将产细菌素的清酒乳杆菌添加到CO2气调包装猪肉中抑制单增李斯特菌的生长,取得了良好的抑制效果。L PEZ-MENDOZA等[61]在CO2气调包装牛排中添加了抑菌剂乳酸和nisin,发现3种栅栏因子联合应用能够将单增李斯特菌的浓度降低4.0 lg CFU/g左右,并且这种联合处理对牛排的色泽、质构和pH值没有负面影响。
PEZ-MENDOZA等[61]在CO2气调包装牛排中添加了抑菌剂乳酸和nisin,发现3种栅栏因子联合应用能够将单增李斯特菌的浓度降低4.0 lg CFU/g左右,并且这种联合处理对牛排的色泽、质构和pH值没有负面影响。
5 结论及展望
单增李斯特菌在猪肉中的Nmax由该菌的生长特性决定。运用食品预测微生物学方法研究致病菌的生长特性是提高食品安全监控水平的有效措施之一。单增李斯特菌导致宿主患病的能力和该菌的生长特性、抗性和毒性密切相关,因此采用控制措施时应考虑其对上述因素的影响。
尽管各种抑菌技术应用于食品中单增李斯特菌控制已有很长历史,但要使得抑菌技术发挥最大的潜力并服务于食品安全控制还有很多工作需要完善,现将未来的研究方向展望如下:
(1)大量研究证明,不同的抑菌技术可从不同方面控制单增李斯特菌的致病力,采用“栅栏效应”的方法,可以更好的保障食品安全。
(2)先前的研究集中于监测抑菌技术对单增李斯特菌菌落浓度的影响,很少具体分析单增李斯特菌动力学参数的变化。而细菌的生长特性是由λ、μmax及Nmax三个参数共同影响的。因此,充分探讨抑菌技术对单增李斯特菌λ、μmax及Nmax的影响十分必要。
(3)现有的研究很多是将肉制品的背景菌消除后,研究抑菌技术对肉制品中单增李斯特菌的抑制作用。实际肉制品中多种微生物共存,它们之间相互影响。因此研究实际食品状态下抑菌技术对单增李斯特菌的抑制作用具有十分重要的现实意义
(4)探究抑菌技术对猪肉中单增李斯特菌生长特性、抗性和毒性的影响及其作用机制,可为抑菌技术应用到猪肉中降低单增李斯特菌危害,提高猪肉微生物安全提供理论支持和科学依据。
[1] MURRAY E G D, WEBB R A, SWANN M B R.A disease of rabbits characterised by a large mononuclear leucocytosis, caused by a hitherto undescribed bacillus Bacterium monocytogenes (n.sp.)[J].The Journal of Pathology and Bacteriology, 1926, 29(4):407-439.
[2] 中华人民共和国国家统计局. 中国统计年鉴[M].北京:中国统计出版社, 2021.
[3] LI H, WANG P F, LAN R T, et al.Risk factors and level of Listeria monocytogenes contamination of raw pork in retail markets in China[J].Frontiers in Microbiology, 2018, 9:1090.
[4] MORALES-PARTERA A M, CARDOSO-TOSET F, LUQUE I, et al.Prevalence and diversity of Salmonella spp., Campylobacter spp., and Listeria monocytogenes in two free-range pig slaughterhouses[J].Food Control, 2018, 92:208-215.
[5] 邱燕, 温贵兰, 张升波.定点屠宰场(点)猪肉中三种主要食源性致病菌污染情况调查[J].中国动物检疫, 2018, 35(8):23-28.
QIU Y, WEN G L, ZHANG S B.Investigation on pork contamination of three kinds of main food-borne pathogens in pork of fixed-point slaughterhouses[J].China Animal Health Inspection, 2018, 35(8):23-28.
[6] WANG K, YE K P, ZHU Y P, et al.Prevalence, antimicrobial resistance and genetic diversity of Listeria monocytogenes isolated from chilled pork in Nanjing, China[J].LWT - Food Science and Technology, 2015, 64(2):905-910.
[7] EFSA.The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2013[J].EFSA Journal, 2015, 13(1):3991.
[8] KANUGANTI S R, WESLEY I V, REDDY P G, et al.Detection of Listeria monocytogenes in pigs and pork[J].Journal of Food Protection, 2002, 65(9):1470-1474.
[9] YU T, JIANG X J.Prevalence and characterization of Listeria monocytogenes isolated from retail food in Henan, China[J].Food Control, 2014, 37:228-231.
[10] WU S, WU Q P, ZHANG J M, et al.Listeria monocytogenes prevalence and characteristics in retail raw foods in China[J].PLoS One, 2015, 10(8):e0136682.
[11] 吴斌, 胡元玮, 方琼楼, 等.金华市生肉食品中致病菌污染状况分析[J].中国卫生检验杂志, 2017, 27(13):1931-1933.
WU B, HU Y W, FANG Q L, et al.Analysis of the contamination by pathogenic bacteria in raw meat in Jinhua[J].China Industrial Economics, 2017, 27(13):1931-1933.
[12] LUO L J, ZHANG Z D, WANG H, et al.A 12-month longitudinal study of Listeria monocytogenes contamination and persistence in pork retail markets in China[J].Food Control, 2017, 76:66-73.
[13] 钱静. 安徽省食品中食源性致病菌监测结果研究[D].合肥:安徽医科大学, 2015.
QIAN J.Study on monitoring results of food-borne pathogens in Anhui Province[D].Hefei:Anhui Medical University, 2015.
[14] 权玉玲, 苏诚玉, 张元国, 等.甘肃省部分地区各类食品中单增李斯特菌污染情况调查分析[J].中国卫生检验杂志, 2009, 19(9):2150-2151.
QUAN Y L, SU C Y, ZHANG Y G, et al.Analysis on Listeria monocytogenes contamination status for most kinds of food in part re-gions of Gansu[J].China Industrial Economics, 2009, 19(9):2150-2151.
[15] 谭海芳, 丁丽娜.2004—2007年肇庆市食品中食源性致病菌监测与分析[J].中国食品卫生杂志, 2009, 21(3):267-270.
TAN H F, DING L N.Surveillance on food-borne pathogens in food in Zhaoqing city from 2004 to 2007[J].Chinese Journal of Food Hygiene, 2009, 21(3):267-270.
[16] 郑秀清, 刘小娟, 陈克功, 等.邯郸市食品中单核细胞增生李斯特菌污染状况调查[J].职业与健康, 2010, 26(12):1359-1360.
ZHENG X Q, LIU X J, CHEN K G, et al.Investigation on food contamination by Listeria monocytogenes in Handan city[J].Occupation and Health, 2010, 26(12):1359-1360.
[17] 张春艳, 阎学燕, 许姣, 等.开封市市售生肉与生肉制品致病菌污染状况分析[J].河南预防医学杂志, 2016, 27(12):955-958.
ZHANG C Y, YAN X Y, XU J, et al. Analysis on contamination by pathogenic bacteria in underessed meay and its processing in Kaifeng[J]. Henan Journal of Preventive Medicine, 2016, 27(12): 955-958.
[18] 郭芳, 黄晓敏, 彭斌, 等.湖北省随州市2009年-2011年食源性致病菌污染状况分析[J].中国卫生检验杂志, 2012, 22(11):2717-2719.
GUO F, HUANG X M, PENG B, et al.Analysis of contamination status of food-borne pathogens in Suizhou from 2009 to 2011[J].Chinese Journal of Health Laboratory Technology, 2012, 22(11):2717-2719.
[19] 唐靓, 李跃中, 徐水祥, 等.我国食品食源性致病菌监测结果分析[J].中国卫生检验杂志, 2016, 26(21):3049-3052.
TANG L, LI Y Z, XU S X, et al.Monitoring results and analysis of food borne pathogen in Chinese food from China[J].Chinese Journal of Health Laboratory Technology, 2016, 26(21):3049-3052.
[20] 文涛, 王文思, 孙葳, 等.辽宁省食品中单增李斯特菌监测分析[J].中国公共卫生, 2015, 31(11):1475-1477.
WEN T, WANG W S, SUN W, et al.Contamination of Listeria monocytogenes in foods in Liaoning Province, 2010-2014[J].Chinese Journal of Public Health, 2015, 31(11):1475-1477.
[21] 王安礼, 马国柱, 李雪梅, 等.陕西省市售肉与肉制食品中食源性致病菌污染监测与分析[J].中国卫生检验杂志, 2010, 20(9):2278-2280.
WANG A L, MA G Z, LI X M, et al.Shaanxi commercial meat and meat Food borne pathogens in food of pollution monitoring and analysis[J].Chinese Journal of Health Laboratory Technology, 2010, 20(9):2278-2280.
[22] 王支兰, 陈伟鑫, 陈培超, 等.上海市嘉定区生禽畜肉及相关食品中致病菌污染状况分析[J].上海预防医学, 2014(12):681-682.
WANG Z L, CHEN W X, CHEN P C, et al. Analysis of pathogenic bacteria pollution in raw livestock meat and related foods in Jiading District, Shanghai[J]. Shanghai Journal of Preventive Medicine, 2014, 26(12):681-682.
[23] 杨修军, 赵薇, 刘桂华, 等.2011—2015年吉林省食品中单增李斯特菌的监测数据分析[J].食品安全质量检测学报, 2017, 8(1):105-110.
YANG X J, ZHAO W, LIU G H, et al.Analysis on the monitoring data of Listeria monocytogenes in food of Jilin Province in 2011-2015[J].Journal of Food Safety &Quality, 2017, 8(1):105-110.
[24] ORSI R H, DEN BAKKER H C, WIEDMANN M.Listeria monocytogenes lineages:Genomics, evolution, ecology, and phenotypic characteristics[J].International Journal of Medical Microbiology, 2011, 301(2):79-96.
[25] PIFFARETTI J C, KRESSEBUCH H, AESCHBACHER M, et al.Genetic characterization of clones of the bacterium Listeria monocytogenes causing epidemic disease[J].Proceedings of the National Academy of Sciences of the United States of America, 1989, 86(10):3818-3822.
[26] RASMUSSEN O F, BECK T, OLSEN J E, et al. Listeria monocytogees isolates can be classified into two major types according to the sequence of the listeriolysin gene[J]. Infection And Immunity, 1991, 59: 3945-3951.
[27] WARD T J, DUCEY T F, USGAARD T, et al. Multilocus geno-typing assays for single nucleotide polymorphism-based subtyping of Listeria monocytogenes isolates[J]. Applied and Environmental Microbiology, 2008, 74: 7629-7642.
[28] The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2017[J]. EFSA Journal, 2017: 16-18.
[29] 孙照琨, 吴璇, 陈蕊, 等.李斯特菌病既往中国文献报告病例分析[J].中国微生态学杂志, 2016, 28(11):1323-1326.
SUN Z K, WU X, CHEN R, et al.Previous cases of Listeria disease reported in China[J].Chinese Journal of Microecology, 2016, 28(11):1323-1326.
[30] 潘伟, 赵呈元.新生儿感染单核细胞增生李斯特菌1例[J].中国感染控制杂志, 2017, 16(8):771-772.
PAN W, ZHAO C.Listeria monocytogenes infection in newborn:One case report[J].Chinese Journal of Infection Control, 2017, 16(8):771-772.
[31] BUCHANAN R L, GORRIS L G M, HAYMAN M M, et al.A review of Listeria monocytogenes:An update on outbreaks, virulence, dose-response, ecology, and risk assessments[J].Food Control, 2017, 75:1-13.
[32] OMORI Y, MIAKE K, NAKAMURA H, et al.Influence of lactic acid and post-treatment recovery time on the heat resistance of Listeria monocytogenes[J].International Journal of Food Microbiology, 2017, 257:10-18.
[33] COL S-MED
S-MED P, ABADIAS M, OLIVEIRA M, et al.Influence of fruit matrix and storage temperature on the survival of Listeria monocytogenes in a gastrointestinal simulation[J].Food Control, 2017, 73:1045-1052.
P, ABADIAS M, OLIVEIRA M, et al.Influence of fruit matrix and storage temperature on the survival of Listeria monocytogenes in a gastrointestinal simulation[J].Food Control, 2017, 73:1045-1052.
[34] BIERNE H, SABET C, PERSONNIC N, et al.Internalins:A complex family of leucine-rich repeat-containing proteins in Listeria monocytogenes[J].Microbes and Infection, 2007, 9(10):1156-1166.
[35] SWINNEN I A M, BERNAERTS K, DENS E J J, et al.Predictive modelling of the microbial lag phase:A review[J].International Journal of Food Microbiology, 2004, 94(2):137-159.
[36] BRACKETT R E, SCHUMAN J D, BALL H R, et al.Thermal inactivation kinetics of Salmonella spp.within intact eggs heated using humidity-controlled air[J].Journal of Food Protection, 2001, 64(7):934-938.
[37] JUNEJA V K, ALTUNTA E G, AYHAN K, et al.Predictive model for the reduction of heat resistance of Listeria monocytogenes in ground beef by the combined effect of sodium chloride and apple polyphenols[J].International Journal of Food Microbiology, 2013, 164(1):54-59.
E G, AYHAN K, et al.Predictive model for the reduction of heat resistance of Listeria monocytogenes in ground beef by the combined effect of sodium chloride and apple polyphenols[J].International Journal of Food Microbiology, 2013, 164(1):54-59.
[38] EARNSHAW R G, APPLEYARD J, HURST R M.Understanding physical inactivation processes:Combined preservation opportunities using heat, ultrasound and pressure[J].International Journal of Food Microbiology, 1995, 28(2):197-219.
[39] SCHÖFFL F, PR NDL R, REINDL A.Regulation of the heat-shock response[J].Plant Physiology, 1998, 117(4):1135-1141.
NDL R, REINDL A.Regulation of the heat-shock response[J].Plant Physiology, 1998, 117(4):1135-1141.
[40] HARTKE A, FR RE J, BOUTIBONNES P, et al.Differential induction of the chaperonin GroEL and the co-chaperonin GroES by heat, acid, and UV-irradiation in Lactococcus lactis subsp.lactis[J].Current Microbiology, 1997, 34(1):23-26.
RE J, BOUTIBONNES P, et al.Differential induction of the chaperonin GroEL and the co-chaperonin GroES by heat, acid, and UV-irradiation in Lactococcus lactis subsp.lactis[J].Current Microbiology, 1997, 34(1):23-26.
[41] DUSSURGET O, PIZARRO-CERDA J, COSSART P.Molecular determinants of Listeria monocytogenes Virulence[J].Annual Review of Microbiology, 2004, 58:587-610.
[42] DORTU C, HUCH M, HOLZAPFEL W H, et al.Anti-listerial activity of bacteriocin-producing Lactobacillus curvatus CWBI-B28 and Lactobacillus sakei CWBI-B1365 on raw beef and poultry meat[J].Letters in Applied Microbiology, 2008, 47(6):581-586.
[43] SA IBUSQUIZA P, NIEROP GROOT M, DEB
IBUSQUIZA P, NIEROP GROOT M, DEB N-VALLES A, et al.Impact of growth conditions and role of sigB on Listeria monocytogenes fitness in single and mixed biofilms cultured with Lactobacillus plantarum[J].Food Research International, 2015, 71:140-145.
N-VALLES A, et al.Impact of growth conditions and role of sigB on Listeria monocytogenes fitness in single and mixed biofilms cultured with Lactobacillus plantarum[J].Food Research International, 2015, 71:140-145.
[44] IGLESIAS M B, VI AS I, COL
AS I, COL S-MED
S-MED P, et al.Adhesion and invasion of Listeria monocytogenes and interaction with Lactobacillus rhamnosus GG after habituation on fresh-cut pear[J].Journal of Functional Foods, 2017, 34:453-460.
P, et al.Adhesion and invasion of Listeria monocytogenes and interaction with Lactobacillus rhamnosus GG after habituation on fresh-cut pear[J].Journal of Functional Foods, 2017, 34:453-460.
[45] PETTERSEN K S, SKJERDAL T, WASTESON Y, et al.Survival of Listeria monocytogenes during in vitro gastrointestinal digestion after exposure to 5 and 0.5% sodium chloride[J].Food Microbiology, 2019, 77:78-84.
[46] ARYANI D C, DEN BESTEN H M W, HAZELEGER W C, et al.Quantifying variability on thermal resistance of Listeria monocytogenes[J].International Journal of Food Microbiology, 2015, 193:130-138.
[47] PIZARRO-CERD J, KÜHBACHER A, COSSART P.Entry of Listeria monocytogenes in mammalian epithelial cells:An updated view[J].Cold Spring Harbor Perspectives in Medicine, 2012, 2(11):a010009.
J, KÜHBACHER A, COSSART P.Entry of Listeria monocytogenes in mammalian epithelial cells:An updated view[J].Cold Spring Harbor Perspectives in Medicine, 2012, 2(11):a010009.
[48] COSSART P.Illuminating the landscape of host-pathogen interactions with the bacterium Listeria monocytogenes[J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(49):19484-19491.
[49] BAKARDJIEV A I, STACY B A, PORTNOY D A.Growth of Listeria monocytogenes in the Guinea pig placenta and role of cell-to-cell spread in fetal infection[J].The Journal of Infectious Diseases, 2005, 191(11):1889-1897.
[50] ANDERSEN J B, ROLDGAARD B B, CHRISTENSEN B B, et al.Oxygen restriction increases the infective potential of Listeria monocytogenes in vitro in Caco-2 cells and in vivo in guinea pigs[J].BMC Microbiology, 2007, 7(1):55-60.
[51] RODRIGUES I, TRINDADE M A, PALU A F, et al.Modified atmosphere packaging for lamb meat:Evaluation of gas composition in the extension of shelf life and consumer acceptance[J].Journal of Food Science and Technology, 2018, 55(9):3547-3555.
[52] ZENG J M, ZHANG N, HUANG B, et al.Mechanism of azithromycin inhibition of HSL synthesis in Pseudomonas aeruginosa[J].Scientific Reports, 2016, 6:24299.
[53] CASTELLANO P, BELFIORE C, FADDA S, et al.A review of bacteriocinogenic lactic acid bacteria used as bioprotective cultures in fresh meat produced in Argentina[J].Meat Science, 2008, 79(3):483-499.
[54] MELERO B, VINUESA R, DIEZ A M, et al.Application of protective cultures against Listeria monocytogenes and Campylobacter jejuni in chicken products packaged under modified atmosphere[J].Poultry Science, 2013, 92(4):1108-1116.
[55] HOSSAIN M I, SADEKUZZAMAN M, HA S D.Probiotics as potential alternative biocontrol agents in the agriculture and food industries:A review[J].Food Research International, 2017, 100:63-73.
[56] CALO-MATA P, ARLINDO S, BOEHME K, et al.Current applications and future trends of lactic acid bacteria and their bacteriocins for the biopreservation of aquatic food products[J].Food and Bioprocess Technology, 2008, 1(1):43-63.
[57] WORAPRAYOTE W, MALILA Y, SORAPUKDEE S, et al.Bacteriocins from lactic acid bacteria and their applications in meat and meat products[J].Meat Science, 2016, 120:118-132.
[58] IRKIN R, ESMER O K.Control of Listeria monocytogenes in ground chicken breast meat under aerobic, vacuum and modified atmosphere packaging conditions with or without the presence of bay essential oil at 4.DEG.C[J].Food Science and Technology Research, 2010, 16(4):285-290.
[59] CHOULIARA E, KARATAPANIS A, SAVVAIDIS I N, et al.Combined effect of oregano essential oil and modified atmosphere packaging on shelf-life extension of fresh chicken breast meat, stored at 4 ℃[J].Food Microbiology, 2007, 24(6):607-617.
[60] HUGAS M, PAGÉS F, GARRIGA M, et al.Application of the bacteriocinogenicLactobacillus sakei CTC494 to prevent growth of Listeria in fresh and cooked meat products packed with different atmospheres[J].Food Microbiology, 1998, 15(6):639-650.
[61] L PEZ-MENDOZA M C, RUIZ P, MATA C M.Combined effects of nisin, lactic acid and modified atmosphere packaging on the survival of Listeria monocytogenes in raw ground pork[J].International Journal of Food Science &Technology, 2007, 42(5):562-566.
PEZ-MENDOZA M C, RUIZ P, MATA C M.Combined effects of nisin, lactic acid and modified atmosphere packaging on the survival of Listeria monocytogenes in raw ground pork[J].International Journal of Food Science &Technology, 2007, 42(5):562-566.