γ-氨基丁酸(gamma-aminobutyric acid, GABA)是一种非蛋白质的天然氨基酸,动物、植物和微生物中均可产生,具有降血压、抗抑郁、抗惊厥、镇静安神的作用,既有利于心脑血压的缓解,又能促进人体内氨基酸代谢平衡[1-2]。GABA作为重要的抑制性神经递物质,参与多种代谢活动,具有很高的生理活性,越来越受到人们的关注,作为一种功能性因子,将被广泛地用于食品、医药及化工等行业[3-4]。GABA化学合成法的成本高、得率低,在生产工艺中使用危险溶剂,不是天然食品添加剂,不能应用于食品。生物合成法相比较来说是一种既安全、又低成本的方法,合成条件温和,安全性高,是GABA合成的理想途径[5-7]。酿酒酵母是发酵中最常用的微生物种类,是与人类关系最密切的一种酵母,常用于酿酒及制作面包和馒头等食品,是我国重要的微生物资源,因此,筛选产GABA的酵母菌株具有较好的应用前景和较高的经济效益[8-10]。基因组改组技术是建立在菌株诱变和原生质体融合基础之上的菌株选育技术,常被应用于菌株的改良选育中[11-12]。通过对原始菌株诱变筛选得到正向突变体,将其作为亲代菌株,利用热处理和紫外灭活制备原生质体,之后进行原生质体融合再生[13-15]。本研究通过对筛选的产GABA酿酒酵母进行基因组改组选育,获得具有稳定遗传性和安全性的高产GABA融合菌株,具有成本低、产率高、安全性高等优点,为后续的产业化应用提供了理论基础和技术支持。
1 材料与方法
1.1 实验材料
1.1.1 菌种
菌株CLNJ1由实验室筛选,保藏于中国普通微生物菌种保藏管理中心,编号:CGMCC No.23423。
1.1.2 培养基
LB培养基(g/L):葡萄糖3、酵母浸3、蛋白胨10、NaCl 5,调节pH至 6.2,121 ℃灭菌20 min。
固体培养基:发酵培养基中加入琼脂20 g/L。
再生培养基:用原生质体稳定液代替蒸馏水,按照发酵培养基配方配制。
磷酸缓冲液、高渗缓冲液、预处理溶液、原生质体稳定液、促融合剂、酶溶液的配置参照文献[16-17]的方法。
1.2 实验方法
1.2.1 GABA的定量测定
参照方绮等[18]的方法, 采用Berthelot比色法进行测定。
1.2.2 菌株鉴定
形态学鉴定:平板培养观察菌落形态大小,颜色及边缘隆起状况,挑取单个菌落进行革兰氏染色,在显微镜下观察菌落形态特征。
同源性分析和系统发育树的构建:将筛选菌株送至吉林省库美生物科技有限公司测序,将菌株序列用BLAST与数据库中的已知序列进行比较,利用MEGA软件进行同源性分析并绘制系统发育树。
1.2.3 菌株基因组改组
1.2.3.1 菌株生长曲线
将CLNJ1菌株活化后接入LB培养基中,于适宜温度下振荡培养,每隔2 h取1次菌液,在600 nm波长下测定吸光度值,总计测24 h,记录实验结果。
1.2.3.2 LiCl诱变
配制含有不同质量分数LiCl的LB培养基,将活化后培养至对数期的CLNJ1菌液转接其中培养24 h,以未经LiCl诱变的为对照,涂布完成后的平板在恒温培养箱中培养48 h。待菌落长出后,计活菌数,取致死率在80%~90%的时间进行LiCl诱变。为确保诱变菌株的稳定性,将菌株连续传代10次后进行液体发酵,对其GABA产量进行测定,从而判断诱变菌株的遗传稳定性。
1.2.3.3 基因组改组
参照文献[16-17]的方法,配置原生质体菌悬液,适当稀释,并涂布于固体培养基上。再分别取1 mL菌株原生质体细胞悬液,加入9 mL高渗缓冲溶液中,稀释到合适浓度后,在再生固体培养基上涂布,培养48 h后,计算菌株原生质体形成率和再生率。根据不同处理条件下原生质体的形成率和再生率,选择酶最佳的浓度和温度,菌体生长时期制备原生质体,获得最适双亲灭活(热灭活或紫外线灭活)条件。
分别取CLNJ1-Y菌株原生质体各1 mL,混合均匀后放入无菌离心管中,用高渗缓冲液离心洗涤2次,离心后加入1 mL原生质体稳定溶液于上述沉淀菌体中,混匀后再加入1.8 mL 40%(体积分数)促溶剂聚乙二醇6000,摇匀,37 ℃恒温水浴10 min,再用原生质体稳定溶液稀释至适当的浓度。涂布于再生平板上,30 ℃培养3~5 d,计算融合率。
将融合液涂布在再生培养基上进行培养,观察并比较亲株和重组子的细胞形态。将菌株进行纯化、斜面保藏。将保藏的菌株接种至LB液体培养基中培养1~2 d,测定改组菌株发酵液中GABA的含量。改组后菌株经过稳定性试验后保存。
1.2.4 菌株安全性评价
1.2.4.1 菌株溶血试验
将改组后菌株(CLNJ1-YC)在LB固体培养基上进行划线活化,然后接种于哥伦比亚血琼脂培养基上培养48 h,根据平板上是否出现溶血环判断菌株安全性,α-溶血环为草绿色,β-溶血环为无色透明,本实验以金黄色葡萄球菌作为阳性对照菌株。
1.2.4.2 抗生素敏感性实验
采用K-B纸片扩散法检测CLNJ1-YC菌株对10种抗生素的耐药性,测量并记录各药敏纸片的抑菌圈直径大小。参照美国临床和实验室标准协会(Clinical &Laboratory Standards Institute,CLSI) 标准进行结果判定,结果描述为敏感、中度敏感、耐药。
1.3 数据处理与统计分析
样品的每个指标均设置3次重复,采用SPSS 25.0软件进行Duncan多重比较分析,采用Origin 95C进行绘图,结果以平均值±标准差表示,统计结果以P<0.05表示差异达到显著水平。
2 结果与分析
2.1 酿酒酵母CLNJ1菌株鉴定
2.1.1 菌落菌体特征
由图1-a可知,酿酒酵母CLNJ1为乳白色、圆形、边缘规则、表面光滑、湿润,直径约2.9 mm。革兰氏染色后呈现蓝色,菌体为椭圆形,呈单个排列方式(图1-b)。

a-菌落形态;b-革兰氏染色图片
图1 酿酒酵母CLNJ1菌落形态特征
Fig.1 Morphological characteristics of CLNJ1
2.1.2 16SrDNA和ITS序列比对分析及系统发育树的构建
将菌株CLNJ1送由吉林省库美生物科技有限公司测序,选择ITS基因序列测序(正向引物ITS1:TCCGTAGGTGAACCTGCGG,反向引物ITS4:TCCTCCGCTTATTGATATGC),测序结果与NCBI数据库序列进行BLAST同源性检索。结果显示,CLNJ1菌株序列与已公布序列的酿酒酵母菌 (Saccharomyces cerevisiae) 99%同源,系统发育树结果如图2所示。

图2 CLNJ1系统发育树
Fig.2 Phylogenetic tree of CLNJ1
2.2 酿酒酵母CLNJ1菌株生长曲线
如图3所示,酿酒酵母CLNJ1发酵4 h后进入对数生长期,发酵14 h后结束对数生长期,GABA产量为1.72 g/L。
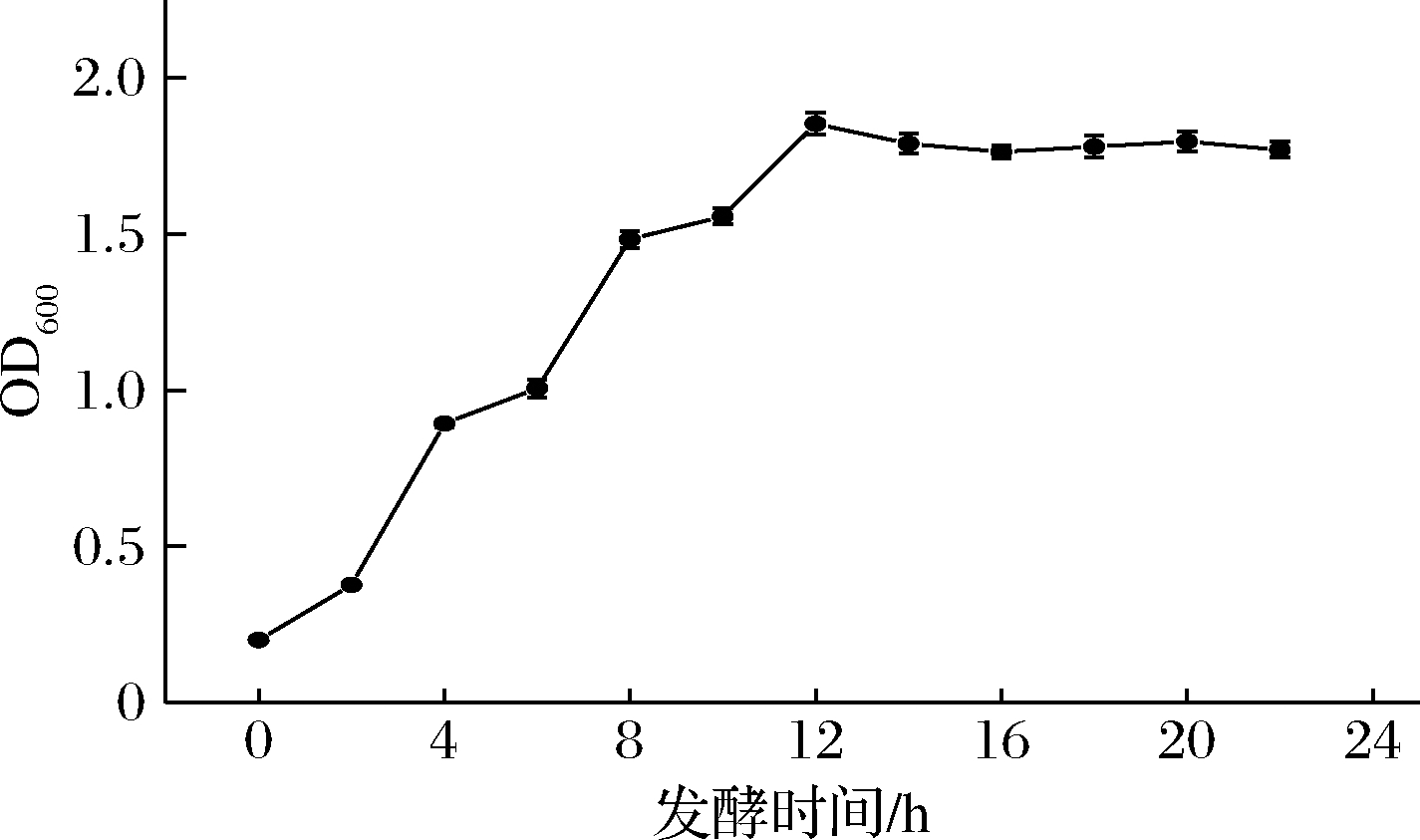
图3 菌株生长曲线
Fig.3 Strain growth curve
2.3 酿酒酵母CLNJ1的LiCl诱变研究
由图4-a可知,当LiCl质量分数为0.3%时,菌株CLNJ1致死率达到90%~95%,故选择0.3%作为菌株CLNJ1的LiCl诱变最佳质量分数,进行多次诱变和测定后,得到一株产量较高的诱变菌株CLNJ1-Y,GABA产量为5.96 g/L,比出发菌株提高了246%。将诱变菌株 CLNJ1-Y传代10次,进行GABA产量测定,比较菌株遗传稳定性,LiCl诱变菌株CLNJ1-Y经过10次传代,GABA产量基本稳定,没有出现回复突变的问题(图4-b)。

a-诱变致死率;b-诱变稳定性
图4 LiCl诱变结果
Fig.4 Results of LiCl mutagenesis
2.4 基因组改组选育高产GABA菌株
2.4.1 原生质体的再生比率
CLNJ1-Y菌株在培养8 h,预处理时间15 min,溶菌酶和蜗牛酶酶解时间3 h条件下原生质体的再生比率为99.66%,得到的原生质体己经比较纯净。
2.4.2 原生质体灭活条件的确定
对不同时间紫外灭活处理和热灭活处理的再生培养基平板上的菌落进行菌落计数,按灭活率公式计算,结果见图5,对于菌株CLNJ1-Y,紫外照射超过20 s后原生质体的灭活率达到100%,热灭活80 min时原生质体的灭活率达到100%。

a-紫外灭活;b-热灭活
图5 紫外处理和热处理对菌株灭活率的影响
Fig.5 Effect of UV treatment and heat treatment on the inactivation rate of strains
2.4.3 改组菌株的检出与筛选
将制备好的原生质体混合后用紫外和热灭活的方式进行灭活,然后进行融合,适当稀释后涂布于高渗培养基中。长出菌落后按照上述所用的初筛和复筛的方法,最终筛选出一轮改组菌株,改组后菌株CLNJ1-YC的GABA产量为12.28 g/L,比CLNJ1-Y提高106%,比CLNJ1提高614%。
2.4.4 改组菌株的遗传稳定性实验
为确保改组菌株的稳定性,因此将改组菌株分别转接10次进行传代,对转接10次的菌株进行产GABA能力测定,由图6可知,CLNJ1-YC产量基本稳定,没有出现回复突变的问题。

图6 基因组改组菌株遗传稳定性
Fig.6 Genetic stability of genome shuffling strains
2.5 重组菌株CLNJ1-YC安全性评价
2.5.1 菌株溶血试验
将重组菌株CLNJ1-YC和金黄色葡萄球菌分别划线接种于哥伦比亚血琼脂培养基上,培养后观察,结果如图7所示。金黄色葡萄球菌菌落周围出现了透明圈,发生了β-溶血现象,而CLNJ1菌落周围无溶血环出现,说明CLNJ1-YC不是溶血性细菌,不存在引起败血症的风险。

a-CLNJ1-YC;b-金黄色葡萄球菌
图7 菌株溶血实验结果
Fig.7 Results of strain hemolysis test
2.5.2 抗生素敏感性试验
菌株安全性评价的首要指标是菌株对抗生素的敏感性,本实验选取青霉素、氨苄西林、头孢曲松、庆大霉素、四环素、红霉素、环丙沙星、林可霉素、复方新诺明、氯霉素10种抗生素对菌株进行研究,根据CLSI的方法测定菌株抑菌环直径,菌株敏感性结果如表1所示。CLNJ1-YC对10种常见的抗生素表现均为敏感性,证明菌株安全性好。
表1 菌株对10种抗生素的敏感性检测结果
Table 1 Sensitivity test results of strains to 10 antibiotics
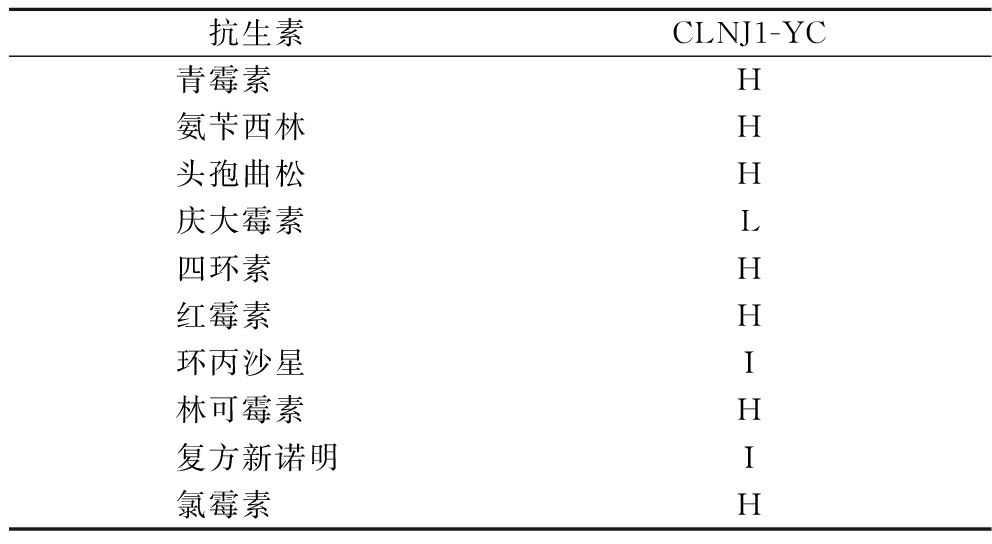
抗生素CLNJ1-YC青霉素 H氨苄西林 H头孢曲松 H庆大霉素 L四环素 H红霉素 H环丙沙星 I林可霉素 H复方新诺明I氯霉素 H
注:高敏感(H)-15~20 mm;中敏感(I)-10~14 mm;低敏感(L)-<10 mm;不敏感(R)-0 mm。
3 讨论与结论
酿酒酵母是传统发酵中应用最广泛的微生物,其在发酵过程可以产生GABA,选育高产GABA酵母菌株在工业发酵生产中具有重要意义。菌株诱变是一种操作简便、容易获得的诱变方式,可以有效地得到高质量突变菌株。沙见宇等[19]利用紫外诱变筛选获得2株高产莫纳可林K突变株M7、M8,产量比出发菌株提高了26%、27%。吴峥等[20]利用紫外诱变获得产胞外谷胱甘肽突变菌株UV3-10,产量是出发菌株的2.52倍。ELHUSSIENY等[21]利用溴化乙啶诱变酿酒酵母,获得突变体EtB20b的乙醇产量 (19.5%) 高于原始菌株 (18.0%)。本实验中LiCl诱变后菌株CLNJ1-Y的GABA产量为5.96 g/L,比出发菌株CLNJ1(1.72 g/L)产量提高了246%,证明LiCl对CLNJ1菌株的诱变效果好,提高菌株产GABA的能力。基因组改组是将传统育种和原生质体融合相结合的一种高效育种方法,是将诱变后的菌株制备成原生质体进行融合,使菌株的细胞基因组进行重排。GHOSH等[22]通过基因组改组筛选出具有明显培养特性的融合子 F2-19,黄色素、橙色素和红色素的含量分别比野生型高67%、70%和76%。ABD等[23]采用基因组改组方法,显著提高了植物乳杆菌的抗菌活性,金黄色葡萄球菌、鼠伤寒沙门氏菌、铜绿假单胞菌和大肠杆菌的抑制区增加1.34、1.31、1.37和1.37倍。王晓洁等[24]利用基因组改组技术,获得融合子F2-24的短杆菌素产量是出发菌株的1.92倍。本实验获得的融合菌株CLNJ1-YC的GABA产量为12.28 g/L,比诱变菌株CLNJ1-Y提高了106%,比出发菌株CLNJ1提高了614%,因此,基因组改组能够更有效地提高菌株产GABA的能力。
改组菌株进行菌株溶血试验和抗生素敏感性试验,CLNJ1-YC没有溶血环出现,无溶血性,对大多数抗生素均敏感,菌株安全性良好,可以广泛应用于发酵食品生产中。
[1] 李海峰, 李冰冰, 石硕硕, 等.γ-氨基丁酸在食品中的应用研究进展[J].河南工业大学学报(自然科学版), 2023, 44(1):117-125.
LI H F, LI B B, SHI S S, et al.Research progress on the application of γ-aminobutyric acid in food[J].Journal of Henan University of Technology (Natural Science Edition), 2023, 44(1):117-125.
[2] 刘鸷驹, 张东星, 晏仁义, 等.γ-氨基丁酸的生物活性研究进展[J].现代药物与临床, 2022, 37(9):2167-2172.
LIU Z J, ZHANG D X, YAN R Y, et al.Research progress on biological activities of γ-aminobutyric acid[J].Drugs &Clinic, 2022, 37(9):2167-2172.
[3] GARAVAND F, DALY D F M, G MEZ-MASCARAQUE L G.Biofunctional, structural, and tribological attributes of GABA-enriched probiotic yoghurts containing Lacticaseibacillus paracasei alone or in combination with prebiotics[J].International Dairy Journal, 2022, 129:105348.
MEZ-MASCARAQUE L G.Biofunctional, structural, and tribological attributes of GABA-enriched probiotic yoghurts containing Lacticaseibacillus paracasei alone or in combination with prebiotics[J].International Dairy Journal, 2022, 129:105348.
[4] 林杨, 唐琦勇, 楚敏, 等.γ-氨基丁酸的功能、生产及食品应用研究进展[J].中国调味品, 2021, 46(6):173-179.
LIN Y, TANG Q Y, CHU M, et al.Research progress on function, production and food application of γ-aminobutyric acid[J].China Condiment, 2021, 46(6):173-179.
[5] SONG C N, ZHU L P, SHAO Y C, et al.Enhancement of GABA content in Hongqu wine by optimisation of fermentation conditions using response surface methodology[J].Czech Journal of Food Sciences, 2021, 39(4):297-304.
[6] 宁亚维, 马梦戈, 杨正,等.γ-氨基丁酸的制备方法及其功能食品研究进展[J].食品与发酵工业, 2020, 46(23):238-247.
NING Y W, MA M G, YANG Z, et al.Research progress in the enrichment process and functional foods of γ-aminobutyric acid[J].Food and Fermentation Industries, 2020, 46(23):238-247.
[7] JIN Y W, WU J Y, HU D, et al.Gamma-aminobutyric acid-producing Levilactobacillus brevis strains as probiotics in litchi juice fermentation[J].Foods, 2023, 12(2):302.
[8] ZHANG L, YUE Y, WANG X J, et al.Optimization of fermentation for γ-aminobutyric acid (GABA) production by yeast Kluyveromyces marxianus C21 in okara (soybean residue)[J].Bioprocess and Biosystems Engineering, 2022, 45(7):1111-1123.
[9] 俞德慧, 杨杨, 陈凤莲, 等.γ-氨基丁酸及其在谷物发酵食品中的研究进展[J].食品与发酵工业, 2022, 48(11):290-296.
YU D H, YANG Y, CHEN F L, et al.Research progress of γ-aminobutyric acid in cereal fermented food[J].Food and Fermentation Industries, 2022, 48(11):290-296.
[10] 孙向阳, 汪杰, 姚红梅, 等.屎肠球菌与酿酒酵母共发酵产γ-氨基丁酸条件优化及机制研究[J].食品工业科技, 2022, 43(15):132-138.
SUN X Y, WANG J, YAO H M, et al.Optimization of conditions for γ-aminobutyric acid yield by co-fermentation of Enterococcus faecium with Saccharomyces cerevisiae and mechanism research[J].Science and Technology of Food Industry, 2022, 43(15):132-138.
[11] 韩笑, 杜春梅, 李玉婷, 等.基因组改组技术在微生物育种方面的应用[J].中国酿造, 2022, 41(11):7-13.
HAN X, DU C M, LI Y T, et al.Application of genome shuffling technique in microbial breeding[J].China Brewing, 2022, 41(11):7-13.
[12] CHEN L, XIN Q H, MA L M, et al.Applications and research advance of genome shuffling for industrial microbial strains improvement[J].World Journal of Microbiology and Biotechnology, 2020, 36(10):1-8.
[13] WAWRO A.Improvement of acetic acid tolerance in Saccharomyces cerevisiae by novel genome shuffling[J].Applied Biochemistry and Microbiology, 2021, 57(2):180-188.
[14] LI J, GUO S Y, HUA Q, et al.Improved AP-3 production through combined ARTP mutagenesis, fermentation optimization, and subsequent genome shuffling[J].Biotechnology Letters, 2021, 43(6):1 143-1 154.
[15] 林路成, 徐志伟, 张建泽, 等.原生质体融合结合基因编辑技术显著提高酿酒酵母2-苯乙醇产量[J].食品与发酵工业, 2023, 49(5):18-28.
LIN L C, XU Z W, ZHANG J Z, et al.Protoplast fusion combined with gene editing technology significantly improves the ability of Saccharomyces cerevisiae to produce 2-phenylethanol[J].Food and Fermentation Industries, 2023, 49(5):18-28.
[16] 熊香元. 基因组改组技术选育发酵米粉乳酸菌及应用研究[D].长沙:湖南农业大学, 2021.
XIONG X Y.Study on lactic acid bacteria from fermented rice noodle by genome shuffling[D].Changsha:Hunan Agricultural University, 2021.
[17] 郭兴燃. 细胞融合选育高产γ-氨基丁酸菌株关键技术及发酵培养基条件优化研究[D].长春:吉林农业大学, 2022.
GUO X R.Study on the key technology of breeding high-yield GABA strain by cell fusion and optimization of fermentation medium conditions[D].Changchun:Jilin Agricultural University, 2022.
[18] 方绮, 兰秋霞, 万蓝婷, 等.基于Berthelot比色法快速测定糙米中γ-氨基丁酸(GABA)含量的体系优化[J/OL].中国食物与营养.DOI: 10.19870/j.cnki.11-3716/ts.20220923.002.
FANG Q,LAN Q X,WANG L T, et al.System Optimization Berthelot Colorimetric Method for Determinating GABA Content Brown Rice[J/OL].Food and Nutrition in China.DOI: 10.19870/j.cnki.11-3716/ts.20220923.002.
[19] 沙见宇, 裴欢, 刘曦, 等.高产Monacolin K红曲霉的诱变选育及其与酿酒酵母共酵培养[J].中国酿造, 2023, 42(2):189-192.
SHA J Y, PEI H, LIU X, et al.Mutagenesis of high-yield Monacolin K Monascus strains and co-fermentation culture with Saccharomyces cerevisiae[J].China Brewing, 2023, 42(2):189-192.
[20] 吴峥, 雷敏, 蔡俊.产胞外谷胱甘肽酿酒酵母的诱变选育及发酵优化[J].食品研究与开发, 2023, 44(3):201-207.
WU Z, LEI M, CAI J.Breeding and fermentation optimization of Saccharomyces cerevisiae producing extracellular glutathione[J].Food Research and Development, 2023, 44(3):201-207.
[21] ELHUSSIENY N I, BAKRI M M, GANASH M, et al.Chemical mutagenesis of Saccharomyces cerevisiae for enhancing bioethanol production with fermentation at very high sugar concentration[J].BioResources, 2020, 15(1):1354-1369.
[22] GHOSH S, DAM B.Genome shuffling improves pigment and other bioactive compound production in Monascus purpureus[J].Applied Microbiology and Biotechnology, 2020, 104(24):10451-10463.
[23] ABD ALLAH F M, ELHOSINY A M, MOHAMED H F, et al.Enhanced antimicrobial activity of lactic acid bacteria through genome shuffling and genetic variability among shuffled strains[J].World Journal of Microbiology and Biotechnology, 2023, 39(5):114.
[24] 王晓洁, 孟凡强, 周立邦, 等.利用基因组改组技术提高短杆菌素产量及其培养条件优化[J].中国生物工程杂志, 2021, 41(8):42-51.
WANG X J, MENG F Q, ZHOU L B, et al.Breeding of brevibacillin producing strain by genome shuffling and optimization of culture conditions[J].China Biotechnology, 2021, 41(8):42-51.