四川晒醋是麸醋的一类,以麸皮和大米为主要原料,用药曲做糖化剂,采取糖化、酒化、醋化同池进行的生料开放式多菌混合固态发酵工艺。经蒸煮、发酵、日晒(其醋醅和成品醋均经日光暴晒)、陈酿四大工艺流程,20多道工序,使得四川晒醋色泽黑褐、无沉淀、香气芬芳,具有酸味醇厚、微甜爽口、回味悠长、久存不腐的特点[1-2]。霉菌是食醋发酵过程中一类重要的微生物,包括毛霉、曲霉、青霉等,在发酵过程中不仅起着糖化、液化等作用,还与食醋风味、品质等紧密相关[3-4]。
在食醋酿造过程中,通过添加纤维素酶生产菌种可以提升食醋风味[5-6],微生物所产生的纤维素酶系是一个多组分酶系,通常将纤维素酶分为内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶,可将纤维素水解成葡萄糖,用于生产乙醇、有机酸等化合物[7]。在这三类酶的协同作用下,纤维素可降解为葡萄糖,内切葡聚糖酶作用于纤维素的非结晶区,将纤维素切割成聚合度不同的短链纤维素;外切葡聚糖酶从短链纤维素的非还原端开始水解β-1,4糖苷键,释放纤维二糖;β-葡萄糖苷酶通过将纤维素二糖转化为葡萄糖来完成纤维素水解的最后一步[8-9]。
本研究从四川晒醋醋醅中分离得到一株能够产纤维素酶的菌株,结合生理生化试验和分子生物学手段鉴定为横梗霉菌(Lichtheimia ramosa),以内切葡聚糖、β-葡萄糖苷酶活力为指标,通过单因素试验、正交试验确定该菌的产酶条件及酶学性质,以期为后期横梗霉菌与四川晒醋风味物质形成的相关性研究提供理论依据,并为四川晒醋的生产提供了一定的参考价值。
1 材料与方法
1.1 材料与设备
醋醅,采集于四川某晒醋厂。
主要试剂:羧甲基纤维素钠、Na2SO3、乙酸、乙酸钠、葡萄糖(分析纯),成都科隆化学品有限公司;牛肉膏、蛋白胨(生化级),成都奥博星生物技术有限公司;酵母膏(生化试剂),上海展云化工有限公司;刚果红,天津市大茂化学试剂厂;水杨苷(分析纯),上海阿拉丁科技股份有限公司;琼脂(食品级),石狮市环球琼胶工业有限公司;马铃薯,市售。
T-114电子天平,奥豪斯仪器有限公司;QYC-2102C型恒温培养摇床,上海福马实验设备有限公司;BSG-24水浴锅、THZ-98C恒温培养箱,上海一恒科学仪器有限公司;T6紫外-可见分光光度计,北京普析通用仪器有限公司;YXQ-75SII高压蒸汽灭菌锅,上海博讯医疗生物仪器股份有限公司;BM1000显微镜,南京江南永新光学有限公司;AT-710型pH计,日本京都电子制造有限公司;SW-CJ-1FD单人单面净化超净工作台,上海沪净医疗器械有限公司。
1.2 培养基
基础培养基(g/L):(NH4)2SO4 5,KH2PO4 1,MgSO4·7H2O 5,CaCl2·2H2O 0.1,酵母膏0.2,NaCl 0.1,碳源10(氮源5)。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、羧甲基纤维素钠培养基参考文献[10-11]配制;胰蛋白胨大豆肉汤(tryptose soya broth,TSB)培养基、明胶培养基、淀粉水解培养基参考文献[12]配制。
1.3 实验方法
1.3.1 菌株分离鉴定
1.3.1.1 产纤维素酶菌株的筛选
取10 g醋醅投入盛有90 mL无菌水的三角瓶中,充分振荡后梯度稀释至10-1~10-6。取上述各梯度的稀释液100 μL涂布于PDA平板上,30 ℃倒置培养至长出单菌落。挑取单菌落点接于羧甲基纤维素钠培养基中,30 ℃恒温培养48 h后,倒入1 mg/mL刚果红溶液染色10 min,倒去刚果红溶液,向平板加入1 mol/L的NaCl溶液浸泡15 min脱色,观察菌落周围有无水解圈,并测量菌圈比,并且将产纤维素酶活力较强的菌株进行斜面保藏。
1.3.1.2 菌株形态观察
载片培养[13]后进行光学显微镜观察。
1.3.1.3 菌株的生理生化特性观察
根据《伯杰系统细菌鉴定手册》[14]和《微生物分类学》[15]对菌种进行碳氮源利用试验、温度耐受试验、盐耐受试验、明胶液化试验、淀粉水解试验。
1.3.1.4 菌株分子鉴定
采用DNA试剂盒对筛选到的菌株进行全基因组提取,以ITS1/ITS4进行PCR扩增,经纯化后送至上海派森诺生物科技有限公司测序。测序结果用NCBI Blast程序将拼接后的序列文件与NCBI核酸数据库中的数据进行比对,得到与待测物种序列相似性最大的物种信息,利用软件MEGA 6构建系统发育树。
1.3.2 单因素试验
1.3.2.1 培养时间对横梗霉菌产酶能力影响
将菌株接种于PDA斜面培养基,于30 ℃培养48 h后,用无菌水洗脱孢子,调节稀释倍数,用血球计数板计孢子数,使生物量为3.5×106 CFU/mL,再以5%(体积分数,下同)接种量接种于PDA发酵培养基,分别测定培养12、24、36、48、60、72 h后的纤维素酶活力。
1.3.2.2 接种量对横梗霉菌产酶能力影响
根据1.3.2.1节的测定结果,选择最优培养时间,在此培养时间条件下探索不同接种量(0.5%、1%、3%、5%、7%和9%)对产酶的影响。
1.3.2.3 反应温度对酶活力的影响
在确定接种量、发酵时间后,取粗酶液,设置不同的反应温度(4、30、40、50、60 ℃),比较反应温度对纤维素酶活性的影响。
1.3.2.4 pH值对酶活力的影响
在最适反应温度的基础上,设置不同酶反应体系pH值(3.0~10.0),测定不同pH值条件对纤维素酶活性的影响。
1.3.3 正交设计试验
在单因素试验基础上,选用培养时间、酶反应底物pH值、酶反应温度进行三因素三水平正交试验,分别测定内切葡聚糖酶、β-葡萄糖苷酶活力,酶活力单位为U/mL,内切葡聚糖酶活力正交设计见表1,β-葡萄糖苷酶活力正交设计见表2。取最佳组合条件做验证性试验,比较结果,确定最佳酶作用条件。
表1 内切葡聚糖酶活力因素水平表
Table 1 factor levels of Endoglucanase activity

水平A(培养时间)/hB(pH值)C(温度)/℃1244.0402365.0503486.060
表2 β-葡萄糖苷酶活力因素水平表
Table 2 factor level of β-glucosidase activity

水平A'(培养时间)/hB'(pH值)C'(温度)/℃1245.0402366.0503487.060
1.3.4 酶活力测定方法
发酵液于4 ℃、6 000 r/min离心10 min,上清液即为粗酶液。
采用DNS法[16-17]测定酶活力:取3支干燥洁净的20 mL具塞刻度试管,分别在试管中加入0.5 mL粗酶液和1.5 mL反应底物(内切葡聚糖酶活力测定采用羧甲基纤维素钠溶液;β-葡萄糖苷酶活力测定采用水杨苷溶液),同时另取一组已灭活的粗酶液作为空白对照。50 ℃水浴30 min后,立即向试管中各加入2 mL DNS溶液,充分摇匀后沸水浴5 min,冷却后用蒸馏水定容至20 mL,充分混匀。在540 nm波长下测定各试管溶液的OD值,根据葡萄糖标准曲线查相应的葡萄糖量,并计算相应的酶活力。
反应底物的制备:0.5 g羧甲基纤维素钠(即1.0 g水杨苷)定容到100 mL乙酸-乙酸钠缓冲液(0.2 mol/L pH 4.5)中。
在特定温度、特定pH值条件下,每分钟内催化底物产生1 μg还原糖所需要的酶量定义为1个酶活力单位(U),计算如公式(1)所示:
酶活力![]()
(1)
式中:ρ,对照葡萄糖标准曲线得到的葡萄糖质量浓度,mg/mL;V0,反应体积,mL;t,反应时间,min;V,粗酶液体积,mL。
1.4 数据处理
实验均平行测定3次,数据以平均值±标准差表示,采用Excel软件处理数据,运用SPSS 22进行单因素ANOVA分析,并使用Duncan’s法进行多重比较,P<0.05表示差异显著,数值后标注不同小写字母表明差异性显著。正交试验结果采用极差分析法确定最优的组合。采用Origin 2021软件绘制柱状图,运用MEGA 6软件,Neighbor-Joining法构建系统发育树。
2 结果与分析
2.1 产酶菌株筛选结果
从晒醋醋醅中筛选出1株丝状真菌,命名为CPM,通过将单菌落点接于羧甲基纤维素钠琼脂培养基进行培养,并进行产纤维素酶活力检测,菌落1、2、3周围形成无色晕圈,如表3所示菌圈比分别为2.61±0.14、2.72±0.13、2.69±0.05,初步确定该菌具有降解纤维素的能力[18]。因此,选择该菌株进行后续实验。
表3 菌株菌圈比
Table 3 Ratio of bacterial ring
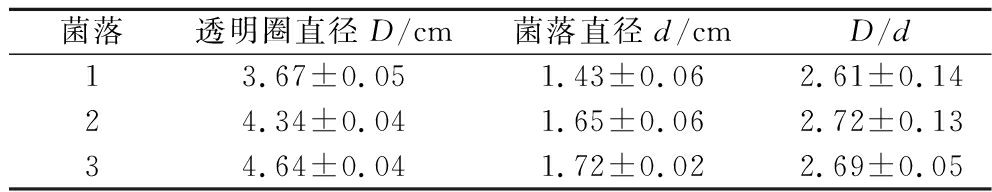
菌落透明圈直径D/cm菌落直径d/cmD/d13.67±0.051.43±0.062.61±0.1424.34±0.041.65±0.062.72±0.1334.64±0.041.72±0.022.69±0.05
2.2 菌株生理生化试验及形态特征结果
生理生化试验结果见表4,本研究选用12种碳源、11种氮源培养基培养菌株CPM,发现其均可利用;在30 ℃、37 ℃均能生长,但37 ℃下生长较为缓慢;该菌可在含有0~10% NaCl溶液的培养基中生长;可分解明胶、淀粉。
表4 生理生化试验结果
Table 4 Physiological and biochemical test results

生理生化试验条件试验结果碳源利用乙酸钠、甘露醇、葡萄糖、麦芽糖、山梨醇、海藻糖、肌醇、木糖、乳糖、蔗糖、果糖、甘油+氮源利用天冬氨酸、苯丙氨酸、谷氨酸、丙氨酸、苏氨酸、精氨酸、酪氨酸、亮氨酸、赖氨酸、脯氨酸、缬氨酸+温度耐受4 ℃-30 ℃+37 ℃+(较弱)盐耐受 NaCl溶液质量分数0~10%+明胶水解+淀粉水解+
如图1-a所示,于PDA培养基30 ℃条件培养,48 h后菌落呈疏松的絮状,白色,边界不清晰;72 h后铺满平皿,成熟菌丝转变为黄色到不同程度灰色。

a-菌落形态;b-孢子囊及孢子形态
图1 菌株CPM菌落、孢子囊及孢子形态
Fig.1 Colony, sporangium and spore morphology of CPM strain
由图1-b可看出孢子囊表面光滑呈球形,孢子表面光滑呈椭圆形。根据文献[19-20]初步鉴定该菌为真菌界、毛霉门(Mucoromycota)、毛霉纲(Mucoraceae)、毛霉目(Mucorales)、横梗霉属(Lichtheimia)。
2.3 菌株分子生物学鉴定
建立系统发育树,比较菌株之间的同源性,如图2所示,菌株CPM与横梗霉菌(Lichtheimia ramosa)同源性较高。结合菌株形态学观察、生理生化分析,初步认定该菌为横梗霉菌(Lichtheimia ramosa)。

图2 菌株CPM的系统发育树
Fig.2 Phylogenetic tree of strain CPM
2.4 单因素试验结果
2.4.1 培养时间的优化
葡萄糖标准曲线测定结果得到线性回归方程:
y=1.454 6x-0.008,R2=0.999 1。如图3-a所示,菌株CPM的产酶效果和接种时间存在一定关系。接种量为5%,培养36 h时,内切葡聚糖酶和β-葡萄糖苷酶的酶活力最高,分别为(76.86±0.43)、(44.55±0.22) U/mL。当培养时间<36 h时,随着培养时间的增加酶活力升高,而36 h后,酶活力下降,可能是由于培养时间较长,菌体老化,从而影响菌株的产酶能力[21]。

a-培养时间;b-接种量;c-反应温度;d-pH
图3 单因素试验结果
Fig.3 Single factor experimental results
2.4.2 接种量的优化
如图3-b所示,菌株CPM的产酶效果在接种量为1%时,内切葡聚糖酶和β-葡萄糖苷酶的酶活力均为最高,分别为(96.52±0.26)、(49.72±0.36) U/mL。当接种量大于1%时,酶活力下降,可能是由于接种量过高,培养基中菌浓度较大,经36 h后培养基中缺乏营养物质,使菌株代谢受阻,进而降低产酶效果[22]。
2.4.3 反应温度对酶活力的影响
由图3-c可知,在50 ℃条件下反应30 min时,该菌的内切葡聚糖酶、β-葡萄糖苷酶活力均为最高,分别为(97.85±0.92)和(49.22±0.61) U/mL;60 ℃条件下反应30 min仍有较高的酶活力,说明内切葡聚糖酶、β-葡萄糖苷酶有一定的耐高温特性,但是比50 ℃下的酶活力低,可见反应温度太高依然会降低酶活力;4 ℃反应30 min条件下酶活力最低,内切葡聚糖酶酶活力为(28.57±0.79) U/mL,β-葡萄糖苷酶酶活力(19.91±0.55) U/mL,可见低温会抑制酶的活性。综上所述,内切葡聚糖酶和β-葡萄糖苷酶的最适反应温度为50 ℃,且有较好的耐热性,耐高温这一特性与HONG等[23]研究结果一致。
2.4.4 pH值对酶活力的影响
过酸或过碱条件下都会影响纤维素酶的结构,从而降低酶的活力[24]。由图3-d可知,内切葡聚糖酶在pH 5.0时酶活力最高,为(96.72±0.83) U/mL,高于或低于pH 5.0酶活力均有所下降,说明该酶属于酸性酶,并且pH值范围在3.0~10.0均保持活性,说明菌株CPM所分泌出的内切葡聚糖酶具有良好的适应能力;pH 6.0时β-葡萄糖苷酶酶活力最高,为(51.07±0.83) U/mL,在pH值为3.0~10.0均保持活性,但是酸性条件下的酶活力均高于碱性条件,由此可知β-葡萄糖苷酶在酸性条件下的活力更高。
2.5 正交试验结果
内切葡聚糖酶活力正交试验结果如表5所示。经极差分析,可知对内切葡聚糖酶活力影响的主次关系为A>B>C,培养时间影响最大,其次是pH值和温度;通过比较均值K,得到最佳组合为A1B2C3,即培养时间24 h、反应底物pH 5.0、反应温度60 ℃;通过比较酶活力可知试验2的酶活力最大,达(95.92±0.99) U/mL。
表5 内切葡聚糖酶活力正交试验结果
Table 5 Orthogonal test results of endoglucanase activity
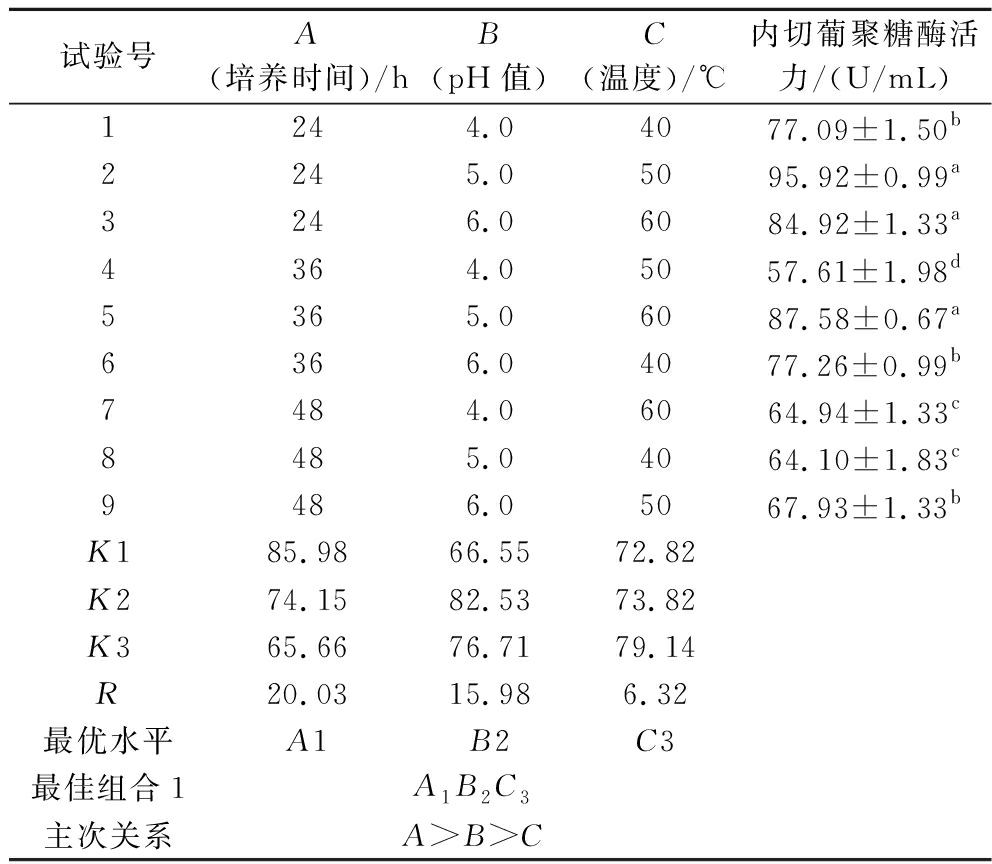
试验号A(培养时间)/hB(pH值)C(温度)/℃内切葡聚糖酶活力/(U/mL)1244.04077.09±1.50b2245.05095.92±0.99a3246.06084.92±1.33a4364.05057.61±1.98d5365.06087.58±0.67a6366.04077.26±0.99b7484.06064.94±1.33c8485.04064.10±1.83c9486.05067.93±1.33bK185.9866.5572.82K274.1582.5373.82K365.6676.7179.14R20.0315.986.32最优水平A1B2C3最佳组合1A1B2C3主次关系A>B>C
β-葡萄糖苷酶活力正交试验结果如表6所示。经极差分析,可知对β-葡萄糖苷酶活力影响的主次关系为C′>A′>B′,温度影响最大,其次是培养时间和pH值;通过比较均值K,得到最佳组合为A′1B′1C′2,即培养时间24 h、反应底物pH 5.0、反应温度50 ℃;通过比较酶活力可知试验11的酶活力最大,达(47.57±3.66) U/mL。
表6 β-葡萄糖苷酶活力正交试验结果
Table 6 Orthogonal test results of β-glucosidase activity

试验号A'(培养时间)/hB'(pH值)C'(温度)/℃β-葡萄糖苷酶活力/(U/mL)10245.04035.92±0.33ab11246.05047.57±3.66a12247.06039.91±0.67ab13365.05046.91±0.67a14366.06032.92±4.32ab15367.04023.59±4.33b16485.06030.59±6.67ab17486.04025.59±4.99b18487.05034.24±4.33abK'141.1337.8028.37K'234.4735.3642.91K'330.1432.5834.47R'10.995.2214.54最优水平A'1B'1C'2最佳组合2A'1B'1C'2主次关系C'>A'>B'
2.6 验证性试验
按正交试验结果,取最佳组合1(A1B2C3)测定内切葡聚糖酶活力,最佳组合2(A′1B′1C′2)测定β-葡萄糖苷酶活力,试验重复3次。结果如表7所示,正交试验2号的内切葡聚糖酶活力高于最佳组合1,正交试验11号的β-葡萄糖苷酶活力高于最佳组合2。故内切葡聚糖酶最优的酶作用条件为A1B2C2,即培养时间24 h、反应底物pH 5.0、反应温度50 ℃;β-葡萄糖苷酶最优的酶作用条件为A′1B′2C′2,即培养时间24 h、反应底物pH 6.0、反应温度50 ℃。
表7 验证试验结果
Table 7 Results of verification test

试验号水平组合内切葡聚糖酶活力/(U/mL)β-葡萄糖苷酶活力/(U/mL)正交试验2号A1B2C295.92±0.99/最佳组合1A1B2C384.40±0.67/正交试验11号A'1B'2C'2/47.57±3.66最佳组合2A'1B'1C'2/38.25±1.67
3 结论
真菌产纤维素酶的主要特点是酶系全、产量高,并且能分泌到细胞外[25],横梗霉菌属于毛霉目的其中一种丝状真菌,可产生羧甲基纤维素酶、β-葡萄糖苷酶、木聚糖酶和β-木糖苷酶[5]、β-甘露聚糖酶[26]、淀粉酶[27]等。横梗霉菌在醋醅中比较少见,常存在于大曲中[28-29]。本文从四川晒醋醋醅中筛选出的1株能够产纤维素酶的横梗霉菌(Lichtheimia ramosa),通过单因素试验、正交试验探究其产酶条件与酶学性质。结果表明该菌所产的内切葡聚糖酶和β-葡萄糖苷酶分别在pH 5.0和pH 6.0条件下酶活力较高,具有较宽作用pH值和温度范围,对环境具有较强的耐受能力和适应性。后续还可以结合晒醋主料配方继续优化发酵底物,测定横梗霉菌在醋酸发酵过程中的代谢产物,这有助于横梗霉菌与四川晒醋风味物质形成的相关性研究。
[1] 朱文优, 张超, 魏琴, 等.四川晒醋烘醅工艺的改良研究[J].中国调味品, 2012, 37(4):82-84;91.
ZHU W Y, ZHANG C, WEI Q, et al.Technical innovation in the baking fermented grains processing of Sichuan Sun vinegar[J].China Condiment, 2012, 37(4):82-84;91.
[2] 周荣清. 四川麸醋生产工艺的特点及发展趋势[J].四川食品与发酵, 2000, 36(3):24-28.
ZHOU R Q.Characteristics and development trend of Sichuan bran vinegar production technology[J].Sichuan Food and Fermetation, 2000, 36(3):24-28.
[3] 张桂容, 冯洁雅, 蔡吉, 等.四川晒醋固态发酵过程中理化因子与真菌群落结构的动态变化规律[J].食品工业科技, 2022, 43(9):131-138.
ZHANG G R, FENG J Y, CAI J, et al.Dynamic changes of physicochemical properties and fungal community structure during solid-state fermentation of Sichuan Sun vinegar[J].Science and Technology of Food Industry, 2022, 43(9):131-138.
[4] 冯洁雅, 张桂容, 蔡吉, 等.基于高通量测序解析四川晒醋固态发酵过程中细菌群落变化[J].食品工业科技, 2021, 42(19):135-143.
FENG J Y, ZHANG G R, CAI J, et al.Analysis of bacterial community changes in Sichuan Sun vinegar solid-state fermentation process based on high-throughput sequencing[J].Science and Technology of Food Industry, 2021, 42(19):135-143.
[5] 鲍晓华, 董维多.纤维素酶在食品发酵和加工中的应用[J].思茅师范高等专科学校学报, 2010, 26(3):26-29.
BAO X H, DONG W D.Application of cellulase in food fermentation and processing[J].Journal of Simao Teacher’s College, 2010, 26(3):26-29.
[6] 邓天福, 杜开书, 李广领.纤维素酶及其在酿造业中的应用[J].中国酿造, 2011, 30(12):17-19.
DENG T F, DU K S, LI G L.Cellulase and its application in brewing industry[J].China Brewing, 2011, 30(12):17-19.
[7] ZANG X Y, LIU M T, WANG H, et al.The distribution of active β-glucosidase-producing microbial communities in composting[J].Canadian Journal of Microbiology, 2017, 63(12):998-1008.
[8] 阎伯旭, 齐飞, 张颖舒, 等.纤维素酶分子结构和功能研究进展[J].生物化学与生物物理进展, 1999, 26(3):233-237.
YAN B X, QI F, ZHANG Y S, et al.Progress in structure function studies of cellulases[J].Progress in Biochemistry and Biophysics, 1999, 26(3):233-237.
[9] TAO P, ZHANG Y H, WU Z M, et al.Enzymatic pretreatment for cellulose nanofibrils isolation from bagasse pulp:Transition of cellulose crystal structure[J].Carbohydrate Polymers, 2019, 214:1-7.
[10] 苑广伟, 周洁嫦, 王欣宇, 等.一株来源于土壤的横梗霉菌及其产羧甲基纤维素酶性质[J].工业微生物, 2021, 51(1):23-29.
YUAN G W, ZHOU J C, WANG X Y, et al.A Sporidiobolus pararoseus XWNR1 from soil and its properties of carboxymethyl cellulase[J].Industrial Microbiology, 2021, 51(1):23-29.
[11] 刘军, 江若宇, 王麒麟, 等.四川晒醋醋醅中一株产纤维素酶的芽孢杆菌分离筛选[J].食品与发酵工业, 2018, 44(6):140-144.
LIU J, JIANG R Y, WANG Q L, et al.Screening of cellulose-producing Bacillus from Sichuan Sun vinegar[J].Food and Fermentation Industries, 2018, 44(6):140-144.
[12] 吴佳. 链霉菌AJ56的生理生化特性研究[J].长治医学院学报, 2022, 36(1):12-14.
WU J.Study of the physiological and biochemical characteristics of Streptomyces AJ56[J].Journal of Changzhi Medical College, 2022, 36(1):12-14.
[13] 马鹏. 高酯化力、糖化力和液化力霉菌的筛选及强化大曲的研究[D].阿拉尔:塔里木大学, 2022.
MA P.Screening of molds with high esterification, saccharification and liquefaction ability and study on strengthening Daqu[D].Ala’er:Tarim University, 2022.
[14] WILLIAMS S T, SHARPE E M, HOLT J G.Bergey’s Manual of Systematic Bacteriology[M].Philadelphia:The William’s &Wilkins Company, 1984, 23:103-107.
[15] 张纪忠. 微生物分类学[M].上海:复旦大学出版社, 1990:317-325.
ZHANG J Z.Microbial Taxonomy[M].Shanghai:Fudan University Press, 1990:317-325.
[16] 邓诗贵. 白酒糟粗纤维降解真菌的筛选与降解工艺的初步研究[D].南昌:江西农业大学, 2018.
DENG S G.Screening of fungi degrading crude fiber from distiller’s grains and preliminary study on degradation technology[D].Nanchang:Jiangxi Agricultural University, 2018.
[17] 郭金玲, 陈程鹏, 周一郎, 等.黑曲霉β-葡萄糖苷酶的分离纯化及酶学性质研究[J].中国酿造, 2021, 40(2):83-87.
GUO J L, CHEN C P, ZHOU Y L, et al.Isolation, purification and enzymatic properties of β-glucosidase from Aspergillus niger[J].China Brewing, 2021, 40(2):83-87.
[18] 江学斌, 成雪鸿, 马苗鹏, 等.产纤维素酶芽孢杆菌的鉴定与酶活力比较[J].广东农业科学, 2022, 49(4):116-122.
JIANG X B, CHENG X H, MA M P, et al.Identification and enzyme activity comparison of cellulase-producing Bacillus[J].Guangdong Agricultural Sciences, 2022, 49(4):116-122.
[19] S.A.瓦克斯曼著〔美〕,阎逊初译.放线菌属和种分类、鉴定和描述(第二卷)[M]. 北京:科学出版社, 1974:187-188.
S.A.WAKSMAN[USA], translated by YAN X C.Taxonomy, Identification and Description of Genera and Species of Actinomycetes (vol.2)[M].Beijing: Science Press, 1974:187-188.
[20] 魏景超. 真菌鉴定手册[M].上海:上海科学出版社, 1979.
WEI J C.Manual of Fungal Identification[M].Shanghai:Shanghai Science Press, 1979.
[21] 白茹玉, 石彥鹏, 张萍.不同培养条件对林可链霉菌种子液代谢影响[J].中国兽药杂志, 2022, 56(3):53-59.
BAI R Y, SHI Y P, ZHANG P.Effects of different culture conditions on metabolism of seed fluid of Streptomyces lincolnensis[J].Chinese Journal of Veterinary Drug, 2022, 56(3):53-59.
[22] 雅男. 纤维素降解菌的筛选及酶学性质的研究[D].哈尔滨:东北林业大学, 2017.
YA N.Screening of cellulose degrading bacteria and studies on cellulase characteristics[D].Harbin:Northeast Forestry University, 2017.
[23] HONG S B, KIM D H, LEE M N, et al.Zygomycota associated with traditional meju, a fermented soybean starting material for soy sauce and soybean paste[J].Journal of Microbiology, 2012, 50(3):386-393.
[24] 孙启星, 曾小波, 李学伟, 等.酱油曲中谷氨酰胺酶酶学特性研究[J].中国调味品, 2021, 46(4):82-85.
SUN Q X, ZENG X B, LI X W, et al.Research on the enzymatic properties of glutaminase in soy sauce koji[J].China Condiment, 2021, 46(4):82-85.
[25] 徐菲, 朱慧霞, 王淮, 等.黄曲霉YZC产纤维素酶的固态发酵条件优化[J].纤维素科学与技术, 2014, 22(4):44-51.
XU F, ZHU H X, WANG H, et al.Optimization of solid-state fermentation conditions for cellulase production with Aspergillus flavus YZC[J].Journal of Cellulose Science and Technology, 2014, 22(4):44-51.
[26] XIE J H, PAN L, HE Z M, et al.A novel thermophilic β-mannanase with broad-range pH stability from Lichtheimia ramosa and its synergistic effect with α-galactosidase on hydrolyzing palm kernel meal[J].Process Biochemistry, 2020, 88:51-59.
[27] DE OLIVEIRA A P A, SILVESTRE M A, GARCIA N F L, et al.Production and catalytic properties of amylases from Lichtheimia ramosa and Thermoascus aurantiacus by solid-state fermentation[J].The Scientific World Journal, 2016, 2016:1-10.
[28] YANG S, LEE J, KWAK J, et al.Fungi associated with the traditional starter cultures used for rice wine in Korea[J].Journal of the Korean Society for Applied Biological Chemistry, 2011, 54(6):933-943.
[29] YANG J G, DOU X, HAN P J, et al.Microbial diversity in daqu during production of Luzhou flavored liquor[J].Journal of the American Society of Brewing Chemists, 2017, 75(2):136-144.
 10
10