唾液酸是一类神经氨酸衍生物的总称,广泛存在于哺乳动物组织、乳汁和卵类中,主要以低聚糖、糖蛋白或糖脂的形式存在[1]。其中N-乙酰神经氨酸(Neu5Ac)和N-羟乙酰神经氨酸(Neu5Gc)是最常见的存在形式,主要有抗炎、协助神经发育和抑制病菌等作用[2]。另外,人类生存所需的动物源膳食如乳品、禽蛋和肉类等含有丰富的唾液酸,这类唾液酸多以结合态的形式存在,主要通过α2-6/α2-3糖苷键连接在半乳糖/半乳糖胺上,如燕窝糖蛋白、卵黏蛋白、酪蛋白糖巨肽、3′-唾液酸乳糖等[3]。
燕窝(edible bird’s nest, EBN)是金丝燕及多种同属燕类利用唾液分泌物建造的巢穴,经过处理后可以作为食品。中医理论认为燕窝具有补中益气、入胃补脾和化痰止咳等功能[4]。许多研究表明燕窝具有促进大脑发育、改善记忆[5]和抗病毒[6]等功效。燕窝的主要成分为富含唾液酸的黏蛋白,唾液酸含量占干重的7%~15%,不同产地来源的燕窝唾液酸含量差别较大[7]。
女性在妊娠期会通过自身的代谢对胎儿的生长发育产生影响。孕妇血液中的唾液酸会随着妊娠阶段的不同有所改变,研究表明母体会合成唾液酸并通过胎盘提供给7~9个月的胎儿,以供其生长发育所需[8]。BRIESE等[9]发现母体是胎儿唾液酸的主要来源,对胎儿在妊娠晚期的发育起重要作用。研究表明,摄入外源唾液酸可以提高妊娠期女性血液中唾液酸含量[10],而燕窝经过消化后糖链结构的改变可能对人类,特别是妊娠期女性的肠道健康产生影响。
肠道微生物对宿主健康至关重要[11]。肠道微生物可以发酵糖类物质产生短链脂肪酸(short chain fatty acids, SCFAs),主要包括乙酸、丙酸和丁酸,它们对机体生理代谢的调节起重要作用[12]。益生菌是指对宿主有益并有利于肠内菌群生态平衡的活性微生物,在改善肠道环境,参与免疫调节等方面具有潜在的应用价值[13]。本研究以富含唾液酸的燕窝为研究对象,通过酸处理切除燕窝糖蛋白末端唾液酸(acidolysis bird’s nest,ABN)为对照,分别比较EBN、ABN和Neu5Ac的功能,探究燕窝糖蛋白末端唾液酸完整性对其抗氧化活性的影响,以及对益生菌生长和孕妇肠道菌群调节的作用。
1 材料与方法
1.1 菌株与培养基
短双歧杆菌FWX346、动物双歧杆菌ZJTZ1M2、干酪乳杆菌FJSSZ4L6、鼠李糖乳杆菌FFJLY7L1、嗜黏蛋白阿克曼黏细菌(Akkermansia muciniphila),江南大学(中国无锡)食品微生物菌种保藏中心;燕窝样品,厦门燕之屋生物工程有限公司,将即食的炖煮燕窝用去离子水冲洗过滤3次,收集沉淀冻干制成EBN冻干粉备用。
EBN脱唾液酸的方法参照文献[14],略作修改。将冻干得到的EBN粉末以1 mol/L盐酸在37 ℃下处理12 h,再次清洗过滤,收集沉淀,得到ABN作为对照。
MRS培养基(g/L):胰蛋白胨10、酵母提取物5、葡萄糖3、CH3COONa 5、K2HPO4 2、MnSO4 0.2、MgSO4 0.2、CaCl2 0.45、L-半胱氨酸0.5、柠檬酸铵2和1 mL吐温-80,pH 6.5。
基础营养培养基(g/L):蛋白胨2、酵母提取物2、NaCl 0.1、KH2PO4 0.04、K2HPO4 0.04、NaHCO3 2、胆盐0.5、L-半胱氨酸盐酸盐0.5、MgSO4 0.01、CaCl2 0.025、维生素K 0.002、氯化血红素0.025、2 mL 吐温-80,pH 6.5。
1.2 体外模拟消化
1.2.1 模拟唾液消化
将KCl(1.126 g/L)、NaHCO3(1.143 g/L)、NaCl(0.12 g/L)、CaCl2(0.167 g/L)和α-淀粉酶(150 U/mL)溶解于去离子水中制备唾液消化液。然后,以1∶1体积比例分别与EBN、ABN溶液在EP管中混合,在80 r/min、37 ℃水浴振荡。消化15 min后,在100 ℃水中煮沸10 min灭酶。
1.2.2 模拟胃液消化
将人工胃液与模拟唾液消化液按1∶1体积比混合,使用0.1 mol/L盐酸将所得溶液的pH值调节至2.0,在80 r/min、37 ℃水浴振荡。消化4 h后,在100 ℃的水中煮沸10 min灭酶。
1.2.3 模拟小肠液消化
将上述得到的胃消化液用1 mol/L的NaHCO3溶液将pH值调为7.0,再向其中加入等体积的人工小肠液,80 r/min、37 ℃水浴振荡。消化6 h后,在100 ℃的水中煮沸10 min灭酶,得到最终的消化液。
1.3 唾液酸的检测方法
参考文献[15]的方法使用间苯二酚-盐酸法测定唾液酸的含量。
1.4 抗氧化活性的检测方法
参考文献[16]中的方法测定DPPH自由基清除率、·OH清除率![]() 清除率、还原力。
清除率、还原力。
1.5 双歧杆菌和乳杆菌的培养方法
在厌氧培养箱进行单个细菌的体外培养。在MRS培养基中激活菌株。将EBN和ABN作为碳源以5 g/L的终质量浓度、Neu5Ac和菊粉作为对照以0.5 g/L的终质量浓度取代MRS培养基中的葡萄糖。不含葡萄糖的MRS作为空白。每组进行3个平行,以10%(体积分数)的接种量于37 ℃培养24 h,使用紫外分光光度计测量光密度(OD600nm)。
1.6 SCFAs的气相色谱检测方法
使用GC进行测定,HP-INNOWAX色谱柱,Agilent-7890A气相色谱仪。取1 mL离心后的发酵上清液,添加终浓度为1 mmol/L的2-甲基丁酸作为内标,再向其中添加250 μL浓盐酸和1 mL乙醚,混匀。收集有机层,使用0.22 μm的有机滤膜过滤杂质后备用。以1∶20的分流比将5 μL样品注入仪器,进样器温度220 ℃,检测器温度250 ℃。使用N2作为载气,流速为1.5 mL/min。计算SCFAs的含量。
1.7 志愿者和粪便的收集
使用无菌的粪便收集管从3名适龄未妊娠健康女性(食用中国传统膳食,年龄20~30岁)志愿者收集健康女性的粪便样本,从无锡市江南大学附属医院妇产科的6名孕晚期孕妇志愿者收集孕晚期孕妇的粪便样本(江南大学附属医院医学伦理委员会的批准号:LS2021066),并且收集了所有志愿者的书面知情同意书。主要收集的信息包括年龄和孕周(表1),按照年龄差距分为2组,组Ⅰ的年龄较小,组Ⅱ的年龄较高。参与者在粪便样本捐赠前至少2个月没有服用益生菌或益生元,并且没有胃肠道疾病史。收集的粪便样品立即保存在厌氧培养袋中,置于冰盒,在6 h内送到实验室作下一步处理。
表1 粪便捐赠者的基本信息
Table 1 Basic information of feces donors
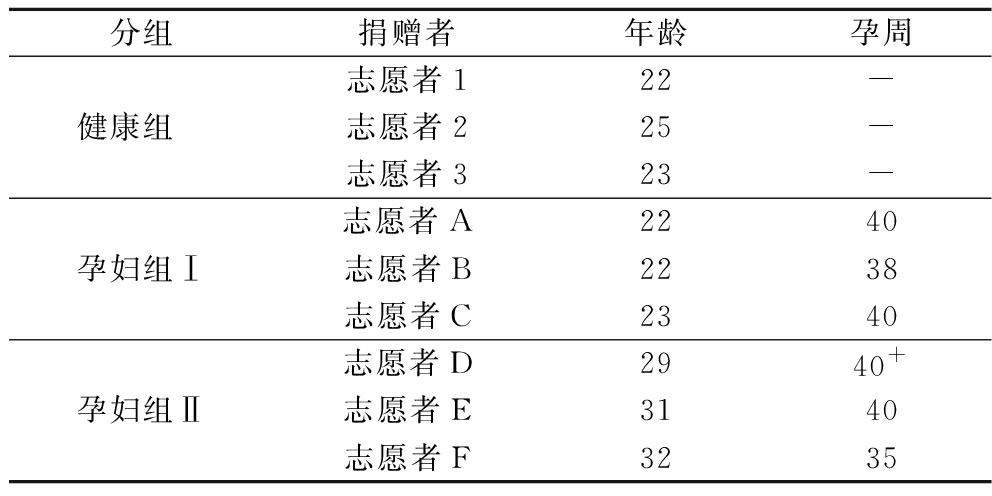
分组捐赠者年龄孕周健康组 志愿者122-志愿者225-志愿者323-孕妇组Ⅰ志愿者A2240志愿者B2238志愿者C2340孕妇组Ⅱ志愿者D2940+志愿者E3140志愿者F3235
1.8 健康女性和不同年龄段孕晚期孕妇粪便微生物的体外发酵
将EBN和ABN消化液作为碳源以5 g/L的终质量浓度、唾液酸单体(Neu5Ac)作为对照以0.5 g/L的终质量浓度添加到基础营养培养基中。将每组3个人的粪便样本等量混合,并用无菌的生理盐水梯度稀释,无菌的4层纱布过滤。将粪便稀释液以10%的体积分数转接到培养基中。基础营养培养基作为空白组,每组3个平行,37 ℃培养24 h。分别收集0 h和24 h的发酵液样品。
1.9 粪便菌群组成的检测方法
使用CTAB方法从样品中提取细菌基因组DNA,带Barcode的特异引物扩增16S rRNA基因的V3~V4区。使用TruSeq-DNA PCR-Free样品制备试剂盒生成测序文库并进行测序。根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数据,进行拼接和过滤处理,得到的有效数据利用Uparse算法聚类成为OTUs。对OTUs序列进行物种注释,用Mothur方法与Silva 138.1的SSUrRNA数据库进行物种注释分析,获得分类学信息并分别在各个分类水平统计各样本的群落组成。使用Qiime软件(Version 1.9.1)计算α多样性指数等。
1.10 统计分析
所有样品均设置3个平行,使用SPSS 25.0统计软件进行分析。数据以平均值±标准差表示。使用单因素方差分析数据,在P<0.05时确定具有显著差异。
2 结果与分析
2.1 燕窝中结合唾液酸对其抗氧化活性的影响
天然多糖和糖蛋白一直被认为具有良好的抗氧化活性[17],EBN是其中代表性的唾液酸糖蛋白。实验所用燕窝的唾液酸含量经检测约为(10.81±0.57)%,表明经过蒸煮处理的即食燕窝中唾液酸含量变化不大。本研究首先比较不同浓度EBN、ABN以及Neu5Ac的抗氧化活性。如图1所示,当质量浓度为10 g/L时,EBN对DPPH自由基的清除率为54.3%,ABN的清除率为32.8%,Neu5Ac的清除率为28.2%。因此,相比Neu5Ac,2种燕窝消化液清除DPPH的活性明显提高,其中破坏了糖链末端唾液酸的ABN对DPPH自由基的清除率明显下降,但仍高于Neu5Ac。当质量浓度为10 g/L时,EBN对·OH的清除率为72.1%,ABN的清除率为63.3%,可以看出EBN对·OH有较好的清除效果。当质量浓度为10 g/L时,EBN对![]() 的清除率为44.1%,ABN的清除率为16.5%,Neu5Ac的清除率仅为6.3%。从随浓度变化的趋势上看,清除·OH的活性为,维生素C>EBN>ABN>Neu5Ac。对3组样品的还原力进行测定,从低浓度到高浓度,与维生素C相比,3组样品均未表现出明显还原力,Neu5Ac的还原力表现略优于EBN和ABN。本研究验证了EBN具有良好的抗氧化活性,而ABN的抗氧化活性相较于有完整糖链的EBN有所降低,也证明了EBN糖蛋白末端唾液酸的完整性对其生物活性有重要意义。
的清除率为44.1%,ABN的清除率为16.5%,Neu5Ac的清除率仅为6.3%。从随浓度变化的趋势上看,清除·OH的活性为,维生素C>EBN>ABN>Neu5Ac。对3组样品的还原力进行测定,从低浓度到高浓度,与维生素C相比,3组样品均未表现出明显还原力,Neu5Ac的还原力表现略优于EBN和ABN。本研究验证了EBN具有良好的抗氧化活性,而ABN的抗氧化活性相较于有完整糖链的EBN有所降低,也证明了EBN糖蛋白末端唾液酸的完整性对其生物活性有重要意义。

a-DPPH自由基清除率;b-·OH清除率;![]() 清除率;d-还原力测定
清除率;d-还原力测定
图1 抗氧化活性
Fig.1 Antioxidant activity
注:![]() 维生素C;▲EBN:燕窝;▼ABN:酸处理燕窝;62N-乙酰神经氨酸
维生素C;▲EBN:燕窝;▼ABN:酸处理燕窝;62N-乙酰神经氨酸
2.2 燕窝中结合唾液酸对双歧杆菌和乳杆菌生长的影响
双歧杆菌和乳杆菌是受到广泛认可的益生菌,有益于宿主健康。例如双歧杆菌在免疫增强、改善胃肠道功能和抵抗病原菌等方面发挥着关键的作用[18]。我们进一步研究EBN、ABN和Neu5Ac对双歧杆菌和乳杆菌生长的影响,结果如图2所示。在发酵24 h后,EBN和Neu5Ac显著增加短双歧杆菌的生物量分别至0.97±0.03和0.85±0.03,显著高于ABN和菊粉组。这可能是由于双歧杆菌的生长与代谢来自多种多聚寡糖和糖蛋白的复杂碳水化合物的能力有关。CHEN等[19]发现在人肠道菌群体外发酵过程中添加唾液酸化免疫球蛋白G能够显著促进双歧杆菌的生长。短双歧杆菌具有去糖基化糖蛋白和利用聚糖作为碳源的能力,还可以通过胞外唾液酸酶从低聚糖中释放唾液酸[20]。因此,脱去唾液酸的ABN无法像EBN那样显著改善短双歧杆菌的生长。EBN和ABN显著增加了干酪乳杆菌和动物双歧杆菌的生物量,空白、菊粉和Neu5Ac组之间的差异不大。可能是由于这2种益生菌可以利用燕窝中的其他营养成分导致的。鼠李糖乳杆菌在添加了菊粉的培养基中生长最好,EBN、ABN和Neu5Ac组则没有显著差异。

a-短双歧杆菌;b-动物双歧杆菌;c-干酪乳杆菌;d-鼠李糖乳杆菌
图2 燕窝中结合唾液酸对双歧杆菌和乳杆菌生物量的影响
Fig.2 Effect of bound sialic acid of EBN on the growth of Bifidobacterium and Lactobacillus
注:图中不同小写字母表示差异显著(P<0.05),下同。
SCFAs对人体健康起重要作用,如乙酸是结肠上皮细胞的能量来源,丙酸在降低脂肪的合成及血清胆固醇水平方面具有关键作用,丁酸可以通过刺激抗菌肽的生成改善肠道屏障[21]。检测在发酵24 h内积累SCFAs的浓度,如图3所示。4株益生菌在体外发酵EBN过程中分别产生(83.22±16.46)、(106.76±6.09)、(73.09±1.78)、(101.4±4.58) mmol/L的乙酸,显著高于其他组(P<0.05),2株乳杆菌产生的丙酸总体高于双歧杆菌。短双歧杆菌、动物双歧杆菌和鼠李糖乳杆菌在体外发酵EBN过程中产生的丁酸浓度显著高于其他组(P<0.05)。可以看出,燕窝能够促进双歧杆菌和乳杆菌的生长,糖链结构完整的EBN可以显著促进能够利用唾液酸的益生菌生长(如短双歧杆菌)并增加益生菌产生有机酸的量以改善肠道环境,而脱去唾液酸的ABN则无此效果。

a-乙酸;b-丙酸;c-丁酸
图3 燕窝中结合唾液酸对双歧杆菌和乳杆菌产SCFAs的影响
Fig.3 Effect of bound sialic acid of EBN on the production of SCFAs by Bifidobacterium and Lactobacillus
2.3 燕窝中结合唾液酸对阿克曼黏细菌生长的影响
嗜黏蛋白阿克曼黏细菌(Akkermansia muciniphila)被认为是一种很有应用潜力的候选益生菌,具有多种对宿主有益的活性功能。它在体内的丰度与结肠炎、Ⅱ型糖尿病[22]、肥胖、动脉粥样硬化[23]等诸多疾病呈负相关,可以改善脂代谢、调节免疫、改善肠道屏障[24]等。如图4-a所示,在体外发酵过程中,EBN和菊粉都可以很好的促进A.muciniphila的生长,在24 h内细菌生物量的生长显著高于ABN和Neu5Ac组(P<0.05)。检测A.muciniphila在发酵24 h积累SCFAs的浓度,在体外发酵过程中EBN组的乙酸浓度在24 h内显著高于ABN组(P<0.05),丙酸和丁酸产量较少且差别不大。A.muciniphila的特征是高度适应在黏蛋白降解物中生存,EBN中丰富的唾液酸黏蛋白含量也印证了这一点,但是破坏了末端唾液酸的ABN则没有显著促进A.muciniphila生长的能力,据此我们推测,EBN末端唾液酸是发挥其生物活性的重要结构组成。

a-细菌生物量;b-乙酸;c-丙酸;d-丁酸
图4 燕窝中结合唾液酸对阿克曼黏细菌生物量和产SCFAs的影响
Fig.4 Effect of bound sialic acid of EBN on the growth and the production of SCFAs of Bifidobacterium and Lactobacillus
2.4 燕窝中结合唾液酸对健康女性和孕妇肠道菌群的影响
2.4.1 燕窝中结合唾液酸对粪便微生物有机酸生成的影响
肠道微生物在结肠发酵常常伴随着SCFAs的产生,这些有机酸具有抑制有害病原体生长、调节上皮屏障功能、降低结肠pH值和预防结直肠癌等作用[25]。用健康女性和孕妇的粪菌发酵EBN、ABN和Neu5Ac,SCFAs生成结果如图5所示。与健康女性组相比,EBN在孕妇组产生的乙酸比其他组的差异更加显著(P<0.05)。妊娠期的女性易发妊高症,乙酸盐能够诱导血管舒张和降低血压[26],乙酸积累量的增加对孕妇健康有益。健康组、孕妇组Ⅰ和孕妇组Ⅱ发酵EBN的丙酸积累量分别为(2.16±0.34)、(5.73±0.93)、(9.72±0.25) mmol/L。丙酸经结肠吸收后由肝脏代谢用作能源,还能降低血糖和胰岛素水平[27],有助于妊娠期女性调节血糖,降低妊娠期糖尿病的风险。

a-乙酸;b-丙酸;c-丁酸
图5 燕窝中结合唾液酸在体外粪菌发酵中SCFAs的影响
Fig.5 Effect of bound sialic acid of EBN in vitro fecal bacteria fermentation on the production of SCFAs
2.4.2 燕窝中结合唾液酸对健康女性和孕妇粪便菌群组成的影响
人体肠道菌群结构容易受饮食、年龄、生活方式及药物等因素影响。如CHANG等[28]研究发现灵芝多糖能够逆转肥胖小鼠肠道微生态失衡,促进肠道屏障完整,降低厚壁菌门与拟杆菌门间的比值。本研究通过16S rRNA高通量测序探究EBN、ABN和Neu5Ac对体外发酵过程中粪便菌群变化的影响,结果如图6所示。

a-健康组门水平;b-健康组属水平;c-孕妇组Ⅰ门水平;d-孕妇组Ⅰ-属水平;e-孕妇组Ⅱ-门水平;f-孕妇组Ⅱ-属水平
图6 燕窝中结合唾液酸在体外粪菌发酵中对菌群组成的影响
Fig.6 Changes in bacterial composition during in vitro fecal fermentation of bound sialic acid of EBN
在门水平上,与空白和Neu5Ac组相比,EBN和ABN在健康女性和孕妇的粪菌发酵中均可显著地增加厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的相对丰度,降低变形菌门(Proteobacteria)的相对丰度。在属水平上,与空白和Neu5Ac相比,在EBN和ABN两组燕窝发酵中拟杆菌属(Bacteroides)、粪杆菌属(Faecalibacterium)和粪球菌属(Coprococuus)的相对丰度更高,而空白组和Neu5Ac组中大肠杆菌-志贺氏菌属(Escherichia-Shigella)、肠杆菌属(Enterobacter)和克雷伯氏菌属(Klebsiella)的相对丰度较高。粪杆菌属(Faecalibacterium)是丁酸的重要产生者之一,具有抗炎作用,能够维持细菌酶的活性,保护消化系统免受肠道病原体的侵害[29]。粪球菌属(Coprococcus)是厚壁菌门毛螺菌科重要成员,是肠道重要的菌属,积极发酵碳水化合物,和Faecalibacterium一样可以产生丁酸。粪球菌可用作评估人体胃肠道健康状况的微生物生物标志物,可能有助于抑制免疫反应,降低过敏反应的严重程度[30]。2组燕窝均有效抑制了以上病原菌的富集,孕妇组的EBN在富集有益菌和抑制病原菌上的效果优于ABN组。
LEfSe分析显示了EBN、ABN、Neu5Ac和空白之间具有显著差异的菌群(LDA值>4),如图7所示。

a-健康女性组;b-孕妇组Ⅰ;c-孕妇组Ⅱ
图7 LEfSe分析在体外粪菌发酵中显著变化的菌群
Fig.7 LEfSe analysis of microbiota communities after in vitro 24 h fecal fermentation with different substrates
在健康女性组,拟杆菌科(Bacteroidales)和拟杆菌属(Bacteroides)分别在EBN和ABN发酵中显著富集。拟杆菌科和拟杆菌属拥有强大的碳水化合物利用系统,可以分解利用肠道中的糖类物质产生乙酸盐和丙酸盐等,改善肠道环境,是潜在的益生菌[31]。空白组会在发酵过程中显著增加肠杆菌属(Enterobacter)和克雷伯氏菌属(Klebsiella)等致病菌的丰度,而EBN组可以在不同水平显著富集拟杆菌,同时,在健康女性组还可增加乳杆菌目(Lactobacillales)和普雷沃氏菌属(Prevotalla_9),在孕妇组Ⅰ可以富集梭菌纲(Closteridia)和颤螺菌目(Oscillospirales),在孕妇组Ⅱ也可富集梭菌纲(Closteridia)和厚壁菌门(Firmicutes)。结果显示,空白组会增加病原菌的生长,而EBN对以上主要病原菌有明显抑制作用。
研究显示,人或动物体内的黏蛋白具有抵御微生物入侵的作用,是维持包括肠道在内的消化系统健康的重要保障[32]。如酪蛋白糖巨肽是一种含有唾液酸的活性糖基磷酸肽,具有多样化的生物功能活性,如抑制细菌与病毒黏附、促进肠道益生菌增殖等[33]。卵黏蛋白主要存在于禽蛋中,是一种糖基化程度很高的蛋白质,有研究发现其对大肠杆菌和幽门螺杆菌有显著抑制作用[34]。燕窝是富含唾液酸的优质外源黏蛋白,本研究发现EBN在抗氧化、促进益生菌生长和抑制病原菌富集等方面具有显著效果,其末端唾液酸在被破坏后,生物活性明显下降。因此,黏蛋白糖链结构的完整性对其生理活性的影响值得进一步探究。
3 结论
本文主要研究了燕窝唾液酸糖蛋白经过消化后的生理功能,验证了EBN经过消化后具有良好的抗氧化活性,EBN糖链末端唾液酸的缺失会导致其抗氧化活性有所降低。EBN可以改善乳杆菌和双歧杆菌的生长情况,对于能够分解利用Neu5Ac的菌株如短双歧杆菌,ABN与EBN相比在促进细菌生长和积累有机酸方面有明显差异。EBN还可以显著促进嗜黏蛋白阿克曼黏细菌(A.muciniphila)的生长。通过健康女性和孕妇粪便的体外发酵验证了EBN对肠道菌群的影响:相比健康女性的粪菌结构,EBN能够降低孕晚期孕妇粪菌中大肠杆菌-志贺氏菌属(Escherichia-Shigella)、肠杆菌属(Enterobacter)和克雷伯氏菌属(Klebsiella)等致病菌的相对丰度,增加潜在益生菌拟杆菌属(Bacteroides)的相对丰度,提高粪杆菌属(Faecalibacterium)和粪球菌属(Coprococuus)等产SCFAs菌的相对丰度。ABN和Neu5Ac在抗氧化、改善益生菌生长和调节肠道菌群等生理活性与EBN存在明显差距,EBN中结合唾液酸糖链结构的完整性对其生物活性具有重要意义。
[1] SHEN G J, DATTA A K, IZUMI M, et al.Expression of α2, 8/2, 9-polysialyltransferase from Escherichia coli K92[J].Journal of Biological Chemistry, 1999, 274(49):35139-35146.
[2] S NCHEZ-FELIPE L, VILLAR E, MU
NCHEZ-FELIPE L, VILLAR E, MU OZ-BARROSO I.α2-3- and α2-6- N-linked sialic acids allow efficient interaction of Newcastle Disease Virus with target cells[J].Glycoconjugate Journal, 2012, 29(7):539-549.
OZ-BARROSO I.α2-3- and α2-6- N-linked sialic acids allow efficient interaction of Newcastle Disease Virus with target cells[J].Glycoconjugate Journal, 2012, 29(7):539-549.
[3] LI Z K, NI Z J, CHEN X S, et al.Multi-enzymatic cascade one-pot biosynthesis of 3′-sialyllactose using engineered Escherichia coli[J].Molecules, 2020, 25(16):3567.
[4] 樊耀华, 范群艳, 李宗晖, 等.燕窝功效考[J].广东药科大学学报, 2020, 36(4):590-593.
FAN Y H, FAN Q Y, LI Z H, et al.A study on efficacy of bird’s nest in traditional Chinese medicine[J].Journal of Guangdong Pharmaceutical University, 2020, 36(4):590-593.
[5] WANG B, YU B, KARIM M, et al.Dietary sialic acid supplementation improves learning and memory in piglets[J].The American Journal of Clinical Nutrition, 2007, 85(2):561-569.
[6] GUO C T, TAKAHASHI T, BUKAWA W, et al.Edible bird’s nest extract inhibits influenza virus infection[J].Antiviral Research, 2006, 70(3):140-146.
[7] LAI Q W S, GUO M S S, WU K Q, et al.Edible bird’s nest, an Asian health food supplement, possesses moisturizing effect by regulating expression of filaggrin in skin keratinocyte[J].Frontiers in Pharmacology, 2021, 12:685982.
[8] ORCZYK-PAWI OWICZ M, FLORIA
OWICZ M, FLORIA SKI J, ZALEWSKI J, et al.Relative amounts of sialic acid and fucose of amniotic fluid glycoconjugates in relation to pregnancy age[J].Glycoconjugate Journal, 2005, 22(7):433-442.
SKI J, ZALEWSKI J, et al.Relative amounts of sialic acid and fucose of amniotic fluid glycoconjugates in relation to pregnancy age[J].Glycoconjugate Journal, 2005, 22(7):433-442.
[9] BRIESE V, KUNKEL S, PLATH C, et al.Sialic acid, steroids and proteohormones in maternal, cord and retroplacental blood[J].Zeitschrift Fur Geburtshilfe Und Neonatologie, 1999, 203(2):63-68.
[10] 乔阳. 唾液酸与婴儿生长发育的研究[D].苏州:苏州大学, 2013.
QIAO Y.The effects of SA contents on infant growth and development[D].Suzhou:Soochow University, 2013.
[11] SCHROEDER B O, B CKHED F.Signals from the gut microbiota to distant organs in physiology and disease[J].Nature Medicine, 2016, 22(10):1079-1089.
CKHED F.Signals from the gut microbiota to distant organs in physiology and disease[J].Nature Medicine, 2016, 22(10):1079-1089.
[12] ZHU Y, MAO Y Q, CHEN H, et al.Apigenin promotes apoptosis, inhibits invasion and induces cell cycle arrest of T24 human bladder cancer cells[J].Cancer Cell International, 2013, 13(1):54.
[13] 阿热爱·巴合提, 武瑞赟, 肖梦圆, 等.益生菌的生理功能及作用机理研究进展[J].食品与发酵工业, 2020, 46(22):270-275.
AREAI Bahati, WU R Y, XIAO M Y, et al.Research progress in physiological function and mechanism of probiotics[J].Food and Fermentation Industries, 2020, 46(22):270-275.
[14] SPICHTIG V, MICHAUD J, AUSTIN S.Determination of sialic acids in milks and milk-based products[J].Analytical Biochemistry, 2010, 405(1):28-40.
[15] 袁菲, 于旭博, 孔素娟, 等.测定唾液酸含量的改良间苯二酚-盐酸法的建立及验证[J].中国生物制品学杂志, 2016, 29(10):1087-1093.
YUAN F, YU X B, KONG S J, et al.Development and validation of an improved resorcinol-hydrochloric acid assay for sialic acid content[J].Chinese Journal of Biologicals, 2016, 29(10):1087-1093.
[16] 曾维才, 石碧.天然产物抗氧化活性的常见评价方法[J].化工进展, 2013, 32(6):1205-1213;1247.
ZENG W C, SHI B.Common methods of antioxidant activity evaluation for natural products:A review[J].Chemical Industry and Engineering Progress, 2013, 32(6):1205-1213;1247.
[17] ABUJA P M, ALBERTINI R.Methods for monitoring oxidative stress, lipid peroxidation and oxidation resistance of lipoproteins[J].Clinica Chimica Acta, 2001, 306(1-2):1-17.
[18] FUKUDA S, TOH H, HASE K, et al.Bifidobacteria can protect from enteropathogenic infection through production of acetate[J].Nature, 2011, 469(7331):543-547.
[19] CHEN C X, LI T H, CHEN G J, et al.Commensal relationship of three bifidobacterial species leads to increase of Bifidobacterium in vitro fermentation of sialylated immunoglobulin G by human gut microbiota[J].Journal of Agricultural and Food Chemistry, 2020, 68(34):9110-9119.
[20] EGAN M, O’CONNELL MOTHERWAY M, VENTURA M, et al.Metabolism of sialic acid by Bifidobacterium breve UCC2003[J].Applied and Environmental Microbiology, 2014, 80(14):4414-4426.
[21] SCHULTHESS J, PANDEY S, CAPITANI M, et al.The short chain fatty acid butyrate imprints an antimicrobial program in macrophages[J].Immunity, 2019, 50(2):432-445.
[22] RÉGNIER M, RASTELLI M, MORISSETTE A, et al.Rhubarb supplementation prevents diet-induced obesity and diabetes in association with increased Akkermansia muciniphila in mice[J].Nutrients, 2020, 12(10):2932.
[23] LI J, LIN S Q, VANHOUTTE P M, et al.Akkermansia muciniphila protects against atherosclerosis by preventing metabolic endotoxemia-induced inflammation in apoe-/- mice[J].Circulation, 2016, 133(24):2434-2446.
[24] MACCHIONE I G, LOPETUSO L R, IANIRO G, et al.Akkermansia muciniphila:Key player in metabolic and gastrointestinal disorders[J].European Review for Medical and Pharmacological Sciences, 2019, 23(18):8075-8083.
[25] XU X F, XU P P, MA C, et al.Gut microbiota, host health, and polysaccharides[J].Biotechnology Advances, 2013, 31(2):318-337.
[26] HSU C N, YU H R, CHAN J Y H, et al.Maternal acetate supplementation reverses blood pressure increase in male offspring induced by exposure to minocycline during pregnancy and lactation[J].International Journal of Molecular Sciences, 2022, 23(14):7924.
[27] AL-LAHHAM S H, PEPPELENBOSCH M P, ROELOFSEN H, et al.Biological effects of propionic acid in humans;metabolism, potential applications and underlying mechanisms[J].Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 2010, 1801(11):1175-1183.
[28] CHANG C J, LIN C S, LU C C, et al.Ganoderma lucidum reduces obesity in mice by modulating the composition of the gut microbiota[J].Nature Communications, 2015, 6:7489.
[29] HEINKEN A, KHAN M T, PAGLIA G, et al.Functional metabolic map of Faecalibacterium prausnitzii, a beneficial human gut microbe[J].Journal of Bacteriology, 2014, 196(18):3289-3302.
[30] VALLES-COLOMER M, FALONY G, DARZI Y, et al.The neuroactive potential of the human gut microbiota in quality of life and depression[J].Nature Microbiology, 2019, 4(4):623-632.
[31] LIU W, LI X Q, ZHAO Z L, et al.Effect of chitooligosaccharides on human gut microbiota and antiglycation[J].Carbohydrate Polymers, 2020, 242:116413.
[32] BERGSTROM K S B, XIA L J.Mucin-type O-glycans and their roles in intestinal homeostasis[J].Glycobiology, 2013, 23(9):1026-1037.
[33] ABD EL-SALAM M H, EL-SHIBINY S, BUCHHEIM W.Characteristics and potential uses of the casein macropeptide[J].International Dairy Journal, 1996, 6(4):327-341.
[34] KOBAYASHI K, HATTORI M, HARA-KUDO Y, et al.Glycopeptide derived from hen egg ovomucin has the ability to bind enterohemorrhagic Escherichia coli O157∶H7[J].Journal of Agricultural and Food Chemistry, 2004, 52(18):5740-5746.