糖尿病是由于胰岛素代谢异常或胰岛素分泌不足而导致的慢性高血糖疾病,仅次于恶性肿瘤、心脑血管疾病,是危害人类健康的第三大疾病[1]。长期的高血糖会增加心血管疾病、视网膜病变及神经性病变的风险,同时会导致患者产生糖尿病足、创口不愈合溃疡等现象[2-4]。目前糖尿病尚无治愈的方法,因此控制血糖对预防糖尿病及并发症具有重要作用,日常生活中人们食用具有调节血糖功效的功能性食品具有广阔的应用前景。
食用植物酵素是以可用于食品加工的植物为主要原料,经酵母菌、乳酸菌和霉菌等益生菌发酵制得含有特定功能性成分可供人体食用的产品[5]。益生菌发酵能在改善产品风味的同时产生新的次级代谢产物和活性成分,增加酵素的保健功能。近年来,酵素的市场需求量日益增大,市售酵素种类逐渐增多,其研究主要集中在降脂减肥[6]、改善肠道菌群[7]、提高免疫力[8]、增强消化功能和胃肠道吸收[9]及抗氧化[10]等方面,调节血糖的酵素产品研究相对较少,且进口食用酵素售价普遍昂贵。故本研究以红参、玉竹、马齿苋、枸杞、柚子、南瓜、生姜、芹菜、山药为原料,复合乳酸菌为菌种,α-淀粉酶抑制率为评价指标,通过星点设计-响应面试验优化发酵工艺,旨在探讨乳酸菌发酵对酵素α-淀粉酶抑制率的影响,为开发具有调节血糖功效的功能型食用酵素提供理论支持。
1 材料与方法
1.1 材料与设备
柚子、南瓜、生姜、芹菜、山药,市售;红参、玉竹、马齿苋,同仁堂;枸杞,安徽药知源中药饮片有限公司;复合乳酸菌Novum F312(活菌数为1×1010 CFU/g,包含乳双歧杆菌、嗜酸乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌),山东中科嘉亿生物工程有限公司;低聚果糖,河南旗诺食品配料有限公司;猪胰α-淀粉酶、链脲佐菌素(streptozotocin, STZ),Sigma公司;糖化酶,上海瑞恩生物科技有限公司;可溶性淀粉、无水乙醇、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid, DNS)(均为分析纯),国药集团化学试剂有限公司;中药复方益糖康[红参、黄芪、黄精、甘草、白术、丹参、枸杞子、葛根、三七、茯苓、五味子、黄连(10∶10∶13∶4∶3∶3∶3∶3∶3∶3∶3∶3)],辽宁中医药大学附属医院。
试验动物信息:SPF级雄性Wistar大鼠[体质量(200±20) g,许可证号:SCXK(辽)2020-0001],辽宁长生生物技术有限公司。
电热式压力蒸汽灭菌锅,浙江新丰医疗器械有限公司;超净工作台,苏州净化医疗器械有限公司;HH-2数显恒温水浴锅,常州智博瑞仪器制造有限公司;数显高速分散均质机,上海标本模型厂制造;UV-5100紫外分光光度计,上海元析仪器有限公司;电脑控温恒温培养箱,宁波乐电仪器制造有限公司;SC-3614低速离心机,安徽中科中佳科学仪器有限公司;ACCU-CHEK血糖仪,中国罗氏制药有限公司。
1.2 试验方法
1.2.1 酵素发酵工艺流程
原料→粉碎→调配→均质→灭菌→冷却→接种→发酵→离心→成品
操作要点:选取干燥的红参(30 g)、玉竹(40 g)、马齿苋(40 g)、枸杞(30 g)与新鲜的柚子(40 g)、南瓜(40 g)、生姜(30 g)、芹菜(40 g)、山药(40 g)进行粉碎,原料与蒸馏水按3∶10(质量比)的比例于榨汁机中磨浆,之后12 000 r/min均质5 min。将均质后的样品于115 ℃条件下灭菌30 min,冷却至室温后接入复合乳酸菌进行发酵,最后于4 500 r/min离心3 min,即得到复合植物酵素。由于酵素原液含量较高,试验测定时将其稀释至不同含量,稀释后酵素含量的计算如公式(1)所示:
酵素含量![]()
(1)
1.2.2 单因素试验设计
考察发酵时间(0、12、24、36、48、60 h)、发酵温度(28、31、34、37、40 ℃)、复合乳酸菌添加量(0、0.025%、0.05%、0.1%、0.2%、0.3%,质量分数,下同)、低聚果糖添加量(0、2%、4%、6%、8%、10%,质量分数,下同)对酵素α-淀粉酶抑制率的影响。
1.2.3 星点设计-响应面优化试验
根据单因素试验结果,利用Design-expert 8.0.6分析软件设计响应面试验,优化酵素的发酵工艺。以发酵时间(h)、发酵温度(℃)及复合乳酸菌添加量(%)为自变量,以α-淀粉酶抑制率为响应值,试验设计见表1。
表1 响应面试验因素与水平
Table 1 Response surface test factors and levels

水平因素发酵时间/h发酵温度/℃菌添加量/%-1.688320.016-124340.05048370.10172400.151.6888420.184
1.2.4 α-淀粉酶抑制率的测定及IC50的测定
参照LI等[11]的方法略做修改。取28 μL 25 mL/L的酵素溶液、1 mL的PBS(pH 6.8,0.1 mol/L)、100 μL α-淀粉酶(29 U)溶液依次加入到10 mL离心管中,混合均匀,37 ℃反应20 min后,加入5 mL 1%(质量分数)可溶性淀粉溶液,5 min后立刻取1 mL于试管中沸水浴,冷却后加入1 mL蒸馏水和1.5 mL DNS溶液,沸水浴中反应5 min,冷却后加蒸馏水补至10 mL,于540 nm处测定吸光度,用PBS代替酵素作为空白组,用PBS代替α-淀粉酶作为样品对照,用PBS代替酵素和α-淀粉酶作为空白对照。分别取12.5、16.7、20、25、33.3 mL/L的酵素28 μL,计算抑制率和IC50。抑制率的计算如公式(2)所示:
α-淀粉酶抑制率![]()
(2)
式中:A,空白吸光度;A0,空白对照吸光度;Ax,样品吸光度;Ax0,样品对照吸光度。
1.2.5 酵素对α-葡萄糖苷酶抑制率及IC50的测定
试验参照刘雪蕊[12]的方法。取40 μL不同浓度的酵素(33.3、50、66.6、100、200 mL/L),分别与40 μL葡萄糖苷酶(0.02 U)溶液于37 ℃加热10 min后,加入20 μL 7.5 mmol/L 4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside, pNPG)溶液,混合液反应10 min后加入100 μL 0.1 mol/L NaCO3溶液终止反应,于405 nm处测定吸光度,用0.1 mol/L pH 6.8的PBS代替酵素作为空白组,用PBS代替α-葡萄糖苷酶溶液作为样品对照。计算抑制率和IC50。抑制率的计算如公式(3)所示:
α-葡萄糖苷酶抑制率![]()
(3)
式中:A,空白吸光度;Ax,样品吸光度;Ax0,样品对照吸光度。
1.2.6 酵素的指标测定
pH的测定:采用pH计;总酸(以乳酸计)的测定参考GB 12456—2021《食品安全国家标准 食品中总酸的测定》;乳酸菌的测定参考GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》;大肠菌群的测定参考GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》;霉菌的测定参考GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》;金黄色葡萄球菌的测定参考GB 4789.10—2016《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》;沙门氏菌的测定参考GB 4789.4—2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》。
1.2.7 糖尿病大鼠造模方法
选取SPF级健康Wistar大鼠40只,随机设定10只大鼠作为正常组,普通饮食喂养,其余30只大鼠连续喂养高脂饮食(在饲料中加入猪油、蔗糖、胆固醇、胆酸钠等成分)。维持上述喂养方法2周后,禁食16 h,称重后,腹腔注射链脲佐菌素,剂量为45 mg/kg,建立2型糖尿病大鼠模型,以随机血糖值>16.7 mmol/L作为造模标准。空白组大鼠根据体重注射同等体积的柠檬酸钠缓冲液(0.1 mmol/L)。
1.2.8 实验分组和给药
造模成功后的大鼠随机分为模型组、中药组(中药复方益糖康)、酵素组,每组10只。各组大鼠采用每日经口灌胃方式给药1次,连续8周。正常组和模型组每日10 mL/(kg·d)的生理盐水灌胃,中药组以每日10 mL/(kg·d)的中药复方益糖康灌胃,酵素组以每日10 mL/(kg·d)的酵素灌胃。
1.2.9 大鼠空腹血糖测定
大鼠禁食16 h后尾尖取血,使用血糖仪测量各组大鼠的空腹血糖(fasting blood glucose, FBG)。
1.3 数据处理
使用Origin 2019b和Excel 2019软件进行作图,Design-Expert.V 8.0.6进行响应面分析。使用SPSS 11.6进行二次多项式回归分析,P<0.05表示具有显著性差异。所有实验均重复3次,数值用平均值±标准偏差表示。
2 结果与分析
2.1 单因素试验结果
如图1-a所示,随着发酵时间在0~60 h增加,酵素的α-淀粉酶抑制率逐渐增大。48 h内的α-淀粉酶抑制率增长较快,超过48 h趋于平稳;24 h内的pH急剧下降,48 h的pH降至最低,说明乳酸菌在发酵前24 h代谢旺盛,产酸速率快,到48 h时发酵基本完成。因此确定最适发酵时间为48 h。

a-发酵时间对α-淀粉酶抑制率的影响;b-发酵温度对α-淀粉酶抑制率的影响;c-菌添加量对α-淀粉酶抑制率的影响;d-低聚果糖添加量对α-淀粉酶抑制率的影响
图1 单因素试验结果
Fig.1 Single-factor test results
注:不同小写字母代表差异显著(P<0.05),相同代表差异不显著。
如图1-b所示,28~37 ℃内,酵素的α-淀粉酶抑制率逐渐增大,超过37 ℃呈下降趋势。37 ℃时pH降至最低,说明温度过高或过低都会影响乳酸菌的生长,导致发酵能力差,不利于抑制酶活性的功能性成分生成[13]。故选择37 ℃作为最适发酵温度。
由图1-c可知,随着复合乳酸菌添加量的增加,α-淀粉酶抑制率出现先增大后平稳的趋势。当添加量大于0.1%,α-淀粉酶抑制率基本保持不变,且酵素pH值趋于平稳,说明发酵完成。故选择0.1%作为最适复合乳酸菌添加量。
为探究低聚果糖对酵素α-淀粉酶抑制率的影响,将发酵时间调整为30 h。由图1-d所示,不添加低聚果糖时,酵素的α-淀粉酶抑制率约为60%。为提高α-淀粉酶抑制率,继续添加2%、4%、6%、8%、10%的低聚果糖。结果发现,0~10%的低聚果糖对α-淀粉酶抑制率和pH均无显著差异(P>0.05),说明添加低聚果糖不影响酵素的发酵速度及对α-淀粉酶的抑制作用。由此说明乳酸菌依靠原料中的碳源能够完成发酵,并不需要额外添加。因此选择不添加低聚果糖,且响应面试验中去掉该因素。
2.2 星点设计-响应面试验优化结果
星点设计-响应面试验优化发酵工艺结果见表2。以α-淀粉酶抑制率(Y)为响应值,利用Design Expert.V8.0.6对试验结果进行分析,建立发酵时间(A)、发酵温度(B)、复合乳酸菌添加量(C)3因素的二次多项回归方程为:
表2 星点设计-响应面试验设计及结果
Table 2 Central composite design-response surface test design and results

发酵时间/h发酵温度/℃复合乳酸菌添加量/%α-淀粉酶抑制率/%1 1.00 1.00 1.0075.621.001.00-1.0045.730.000.000.0098.640.000.000.0092.15-1.001.00-1.0032.56-1.00-1.001.0075.870.000.001.6889.481.680.000.0089.990.000.00-1.6831.5100.000.000.0094.611-1.680.000.0040.712-1.001.001.0035.9130.000.000.0091.1140.000.000.0096.7151.00-1.00-1.0033.8160.00-1.680.0040.2171.00-1.001.0087.918-1.00-1.00-1.0028.9190.001.680.0033.9200.000.000.0098.6
Y=95.28+11.18A-3.46B+16.96C+4.49AB+4.21AC-8.46BC-10.55A2-20.54B2-12.27C2
表3的方差分析结果表明,模型的P值极显著(P<0.000 1),表明模型可用。失拟项不显著(P>0.05),证明试验残差是由随机误差引起的。决定系数![]() 表明该模型可解释约97.05%响应值的变化。R2=0.984 5,说明方程拟合良好,该模型合理,可以充分反映各因素与响应值之间的关系。通过F值的大小可知,各因素对α-淀粉酶抑制率的影响大小依次是C(复合乳酸菌添加量)>A(发酵时间)>B(发酵温度)。通过响应面试验得出最佳发酵条件为:发酵时间49.44 h,发酵温度37.06 ℃,复合乳酸菌添加量0.100 7%,此时α-淀粉酶抑制率的预测值为95.28%。根据实际情况对各试验参数调整为:发酵时间49.5 h,发酵温度37 ℃,复合乳酸菌添加量0.1%。在此条件下进行3次平行试验,测得酵素的α-淀粉酶抑制率为(96.83±1.8)%,与预测值基本相符,表明经星点设计-响应面法优化后的发酵条件具有一定的可行性。
表明该模型可解释约97.05%响应值的变化。R2=0.984 5,说明方程拟合良好,该模型合理,可以充分反映各因素与响应值之间的关系。通过F值的大小可知,各因素对α-淀粉酶抑制率的影响大小依次是C(复合乳酸菌添加量)>A(发酵时间)>B(发酵温度)。通过响应面试验得出最佳发酵条件为:发酵时间49.44 h,发酵温度37.06 ℃,复合乳酸菌添加量0.100 7%,此时α-淀粉酶抑制率的预测值为95.28%。根据实际情况对各试验参数调整为:发酵时间49.5 h,发酵温度37 ℃,复合乳酸菌添加量0.1%。在此条件下进行3次平行试验,测得酵素的α-淀粉酶抑制率为(96.83±1.8)%,与预测值基本相符,表明经星点设计-响应面法优化后的发酵条件具有一定的可行性。
表3 回归模型方差分析结果
Table 3 Regression model ANOVA results

方差来源平方和自由度均值F值P值显著性模型15 122.7791 680.3170.36<0.000 1**A1 706.1211 706.1271.44<0.000 1**B163.791163.796.860.025 6*C3 930.1613 930.16164.57<0.000 1**AB161.101161.106.750.026 6*AC141.961141.965.940.035 0*BC572.911572.9123.990.000 6**A21 604.4211 604.4267.18<0.000 1**B26 079.5516 079.55254.57<0.000 1**C22 168.2812 168.2890.79<0.000 1**残差238.811023.88失拟项186.70537.343.580.093 8不显著纯误差52.11510.42总误差15 361.5819R2=0.984 5R2Adj=0.970 5
注:*P<0.05代表差异显著,**P<0.01代表差异极显著。
2.3 酵素的质量评价
以复合乳酸菌为菌种制备酵素,可提高发酵速度,显著降低酵素的pH值,提高总酸含量[14]。由表4知,各项理化指标均符合QB/T 5323—2018《植物酵素》的要求。酵素发酵前对α-淀粉酶和α-葡萄糖苷酶均有抑制作用,经乳酸菌发酵后抑制率显著提高,可能是原料本身保留了营养成分的同时,乳酸菌发酵有利于2种酶活性抑制成分的生成。且最佳发酵工艺制备的酵素色泽良好,甘苦味适中,口感细腻无异味,质地均匀,无致病菌检出。
表4 酵素的指标
Table 4 Indicators of Jiaosu

指标标准要求发酵前发酵后pH值≤4.54.83±0.04a3.35±0.05b总酸含量/[g/(100 g)]≥0.81.41±0.11a3.94±0.08b乳酸菌/(CFU/mL)≥1×105-1.65×1011α-淀粉酶抑制率/%-19.94±4.58a96.83±1.80bα-葡萄糖苷酶抑制/%-28.68±2.41a97.84±2.51b霉菌/(CFU/mL)≤20未检出未检出大肠菌群/(CFU/mL)<1未检出未检出金黄色葡萄球菌不得检出未检出未检出沙门氏菌不得检出未检出未检出
注:同行不同小写字母表示差异显著(P<0.05)。
2.4 酵素对α-淀粉酶与α-葡萄糖苷酶的抑制作用
如表5所示,酵素对α-淀粉酶和α-葡萄糖苷酶的抑制呈浓度依赖性特征,计算得出酵素对α-淀粉酶和α-葡萄糖苷酶的IC50值分别为(16.54±0.40)和(46.54±6.50) mL/L,表明酵素对α-淀粉酶的抑制率达到50%所需要的浓度低于同等酶活力时α-葡萄糖苷酶抑制率达到50%所需要的浓度,即在同浓度下,酵素对α-淀粉酶的抑制强于α-葡萄糖苷酶。
表5 酵素对α-淀粉酶与α-葡萄糖苷酶的抑制作用
Table 5 Inhibition of α-amylase and α-glucosidase by Jiaosu
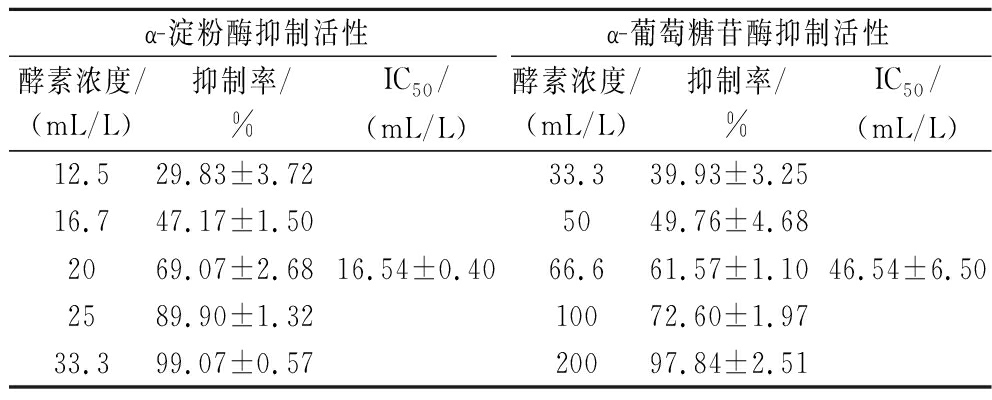
α-淀粉酶抑制活性α-葡萄糖苷酶抑制活性酵素浓度/(mL/L)抑制率/%IC50/(mL/L)酵素浓度/(mL/L)抑制率/%IC50/(mL/L)12.529.83±3.7216.747.17±1.502069.07±2.682589.90±1.3233.399.07±0.5716.54±0.4033.339.93±3.255049.76±4.6866.661.57±1.1010072.60±1.9720097.84±2.5146.54±6.50
2.5 酵素对大鼠空腹血糖的影响
酵素干预糖尿病大鼠的空腹血糖变化结果如表6所示,造模成功后,与正常组相比,喂食高脂饲料的3组大鼠在干预前空腹血糖值显著升高(P<0.01)。干预2周后,与模型组相比,中药组大鼠的FBG明显降低(P<0.05);从第4周开始,中药组和酵素组的FBG显著降低(P<0.01)。干预8周的中药组和酵素组大鼠血糖水平分别降低了44.64%和37.12%,说明酵素组效果接近于中药组,能明显改善大鼠的空腹血糖。
表6 各组大鼠空腹血糖值 单位:mmol/L
Table 6 Fasting blood glucose values of rats in each group

干预前干预后2周干预后4周干预后6周干预后8周正常组5.3±0.265.0±0.555.1±0.705.2±0.375.2±0.96模型组22.8±2.55**23.6±1.57**23.4±1.12**24.8±1.41**24.2±1.66**中药组22.4±1.38**20.1±1.71**#18.9±1.04**##14.9±1.65**##12.4±1.44**##酵素组22.9±1.22**22.0±2.05**20.5±0.77**##17.6±1.51**##14.4±1.98**##
注:与正常组比较,*P<0.05,*P<0.01;与模型组比较,#P<0.05,##P<0.01。
3 讨论
与化学合成物相比,天然产物更加经济、安全,利用天然产物开发调节血糖的功能性产品已成为预防和治疗糖尿病的新趋势[15-17]。发酵能在改善产品风味的同时提高其功能性,故发酵产品的研制已成为研究热点。研究显示,水果酵素对α-淀粉酶和α-葡萄糖苷酶抑制率分别为99.57%和81.67%,酶抑制率较高,其中多酚对α-淀粉酶有抑制效果[18],但该酵素为自然发酵,发酵周期长,易受多种微生物影响,需要严格控制发酵条件以保证品质[19];紫薯汁发酵后对α-淀粉酶和α-葡萄糖苷酶抑制率分别为63.5%和70.9%,且发酵后提高了多糖、总酚、总酮含量[20];由乳酸菌发酵制备出富含多酚的接骨木果汁,其对α-淀粉酶和α-葡萄糖苷酶抑制率分别为68.62%和72.39%[21]。大量研究表明,发酵可提高多糖含量[22],释放黄酮[23]和多酚物质[24],且植物中的黄酮、多酚、多糖等高活性物质是天然降血糖提取物的研究热点[25]。结合上述研究,推测酵素中含黄酮、多酚或多糖类物质,并具有改善血糖的效果。
本研究酵素碳源充足,制备工艺简单,发酵周期短,微量酵素抑制酶活性效果显著,经发酵后对α-淀粉酶和α-葡萄糖苷酶的抑制率分别提高了4.86倍和3.41倍,且酵素浓度为33.3 mL/L可完全抑制α-淀粉酶活性。该酵素可改善糖尿病大鼠的空腹血糖,可能与其抑制α-淀粉酶和α-葡萄糖苷酶的活性有关,或酵素发酵过程中提高多糖、多酚或黄酮类物质含量,同时产生的有益次级代谢产物起协同降糖作用。本研究仅对酵素调节血糖的能力进行初步研究,还需对活性成分进行分离鉴定,这也为后期深入研究其调节血糖能力及其相关机制、发酵过程中代谢物的变化规律等研究提供参考。
4 结论
本研究采用单因素试验及星点设计-响应面法得出了酵素的最佳发酵工艺,最终确定发酵时间为49.5 h,发酵温度为37 ℃,复合乳酸菌添加量为0.1%。该酵素发酵周期短,发酵工艺简便,适合工业规模化生产,应用此模型继续优化酵素的其他保健功效,与改善血糖作用相结合,具有更为广阔的研发价值和市场潜力,并在产业化中具有一定的指导意义,有利于满足国内日益增多的糖尿病患者的需求,减少患者副作用的同时降低国民生活成本。
[1] OZOUGWU O.The pathogenesis and pathophysiology of type 1 and type 2 diabetes mellitus[J].Journal of Physiology and Pathophysiology, 2013, 4(4):46-57.
[2] JO Y H, LEE S, YEON S W, et al.Anti-diabetic potential of Masclura tricuspidata leaves:Prenylated isoflavonoids with α-glucosidase inhibitory and anti-glycation activity[J].Bioorganic Chemistry, 2021, 114:105098.
[3] SCHALKWIJK C G, STEHOUWER C D A.Methylglyoxal, a highly reactive dicarbonyl compound, in diabetes, its vascular complications, and other age-related diseases[J].Physiological Reviews, 2020, 100(1):407-461.
[4] JAIN S, SARAF S.Type 2 diabetes mellitus:Its global prevalence and therapeutic strategies[J].Diabetes &Metabolic Syndrome:Clinical Research &Reviews, 2010, 4(1):48-56.
[5] 索婧怡, 朱雨婕, 陈磊, 等.食用酵素的研究及发展前景分析[J].食品与发酵工业, 2020, 46(19):271-283.
SUO J Y, ZHU Y J, CHEN L, et al.The research and development prospect of edible Jiaosu[J].Food and Fermentation Industries, 2020, 46(19):271-283.
[6] GARCIA-DIAZ D F, JOHNSON M H, DE MEJIA E G.Anthocyanins from fermented berry beverages inhibit inflammation-related adiposity response in vitro[J].Journal of Medicinal Food, 2015, 18(4):489-496.
[7] 朱晓振. 菊粉及其短链脂肪酸酯对糖尿病和肥胖小鼠代谢和肠道微生态的影响[D].烟台:中国科学院大学(中国科学院烟台海岸带研究所), 2020.
ZHU X Z.Effects of inulin and short chain fatty acid ester on metabolism and intestinal microecology in diabetic and obese mice[D].Yantai:Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, 2020.
[8] WUYTS S, VAN BEECK W, ALLONSIUS C N, et al.Applications of plant-based fermented foods and their microbes[J].Current Opinion in Biotechnology, 2020, 61:45-52.
[9] 杨权, 杨成玮, 袁斌, 等.“药食同源”型诺丽果酵素对小鼠胃肠动力作用的探究[J].现代食品, 2019(7):143-148.
YANG Q, YANG C W, YUAN B, et al.Research of “drug-food homologous” noni fruit enzymes on the gastrointestinal motility of mice[J].Modern Food, 2019(7):143-148.
[10] JIANG K K, ZHAO Y L, LIANG C, et al.Composition and antioxidant analysis of jiaosu made from three common fruits:Watermelon, cantaloupe and orange[J].CyTA - Journal of Food, 2021, 19(1):146-151.
[11] LI L J, XU H B, ZHOU J P, et al.Mechanisms underlying the effect of tea extracts on in vitro digestion of wheat starch[J].Journal of Agricultural and Food Chemistry, 2021, 69(29):8227-8235.
[12] 刘雪蕊. 黄秋葵多糖的提取及其降血糖活性研究[D].天津:天津科技大学, 2017.
LIU X R.Research on the extraction and hypoglycemic activity of polysaccharide from okra[D].Tianjin:Tianjin University of Science &Technology, 2017.
[13] 黄克霞, 祝义伟, 陈秋生, 等.蓝莓果汁发酵工艺优化及挥发性风味物质分析[J].中国酿造, 2021, 40(12):109-114.
HUANG K X, ZHU Y W, CHEN Q S, et al.Optimization of fermentation process and analysis of volatile flavor compounds of blueberry juice[J].China Brewing, 2021, 40(12):109-114.
[14] 张玉慧. 乳酸菌发酵蓝莓果汁的工艺研究[D].沈阳:沈阳农业大学, 2016.
ZHANG Y H.Study on processing technology of blueberry juice fermented by lactic acid bacteria[D].Shenyang:Shenyang Agricultural University, 2016.
[15] DAOUDI N E, BOUHRIM M, OUASSOU H, et al.Inhibitory effect of roasted/unroasted Argania spinosa seeds oil on α- glucosidase, α-amylase and intestinal glucose absorption activities[J].South African Journal of Botany, 2020, 135:413-420.
[16] SILVEIRA A C, DIAS J P, SANTOS V M, et al.The action of polyphenols in diabetes mellitus and Alzheimer’s disease:A common agent for overlapping pathologies[J].Current Neuropharmacology, 2019, 17:590-613.
[17] DU X J, JING H J, WANG L, et al.Characterization of structure, physicochemical properties, and hypoglycemic activity of goat milk whey protein hydrolysate processed with different proteases[J].LWT, 2022, 159:113257.
[18] 李云姣, 李琪, 杜佳峰, 等.水果酵素体外抗氧化及抑制α-淀粉酶和α-葡萄糖苷酶活性的研究[J].中国食品学报, 2019, 19(4):79-84.
LI Y J, LI Q, DU J F, et al.Antioxidant activity and inhibitory effects on α-amylase and α-glucosidase of fermented fruit juice in vitro[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(4):79-84.
[19] DAI J, SHA R Y, WANG Z Z, et al.Edible plant Jiaosu:Manufacturing, bioactive compounds, potential health benefits, and safety aspects[J].Journal of the Science of Food and Agriculture, 2020, 100(15):5313-5323.
[20] 刘思含, 李高阳, 宋莹, 等.不同菌发酵紫薯制品对降血糖相关酶的影响及活性成分分析[J].食品工业科技, 2020, 41(16):88-96.
LIU S H, LI G Y, SONG Y, et al.Effects of fermented purple sweet potato products fermented by different bacteria on hypoglycemic related enzymes and analysis of active components[J].Science and Technology of Food Industry, 2020, 41(16):88-96.
[21] 封弦, 翁佩芳, 吴祖芳, 等.乳酸菌发酵接骨木果汁降血糖与抗氧化活性机理[J].食品与生物技术学报, 2022, 41(8):95-103.
FENG X, WENG P F, WU Z F, et al.Preliminary study on hypoglycemic antioxidant activity and mechanism of elderberry juice fermented by lactic acid bacteria[J].Journal of Food Science and Biotechnology, 2022, 41(8):95-103.
[22] 罗游. 番石榴叶多糖活性分析及分离鉴定与发酵提升[D].广州:华南理工大学, 2020.
LUO Y.Bioactivity evaluation, isolation, identification and fermentation promotion of polysaccharides from guava leaves[D].Guangzhou:South China University of Technology, 2020.
[23] 梅玉立, 黄先智, 丁晓雯.响应面法优化发酵对桑叶生物碱、黄酮和多糖含量的影响[J].食品安全质量检测学报, 2022, 13(6):1764-1772.
MEI Y L, HUANG X Z, DING X W.Effects of optimized fermentation on the content of alkaloids, flavonoids and polysaccharides in mulberry leaves by response surface methodology[J].Journal of Food Safety &Quality, 2022, 13(6):1764-1772.
[24] MA S, ZHANG H C, XU J X.Characterization, antioxidant and anti-inflammation capacities of fermented Flammulina velutipes polyphenols[J].Molecules, 2021, 26(20):6205.
[25] 朱运平, 任斐.降血糖食品的研究进展[J].中国酿造, 2022, 41(9):1-7.
ZHU Y P, REN F.Research progress of hypoglycemic foods[J].China Brewing, 2022, 41(9):1-7.