枳壳(Fructus aurantii)为芸香科植物酸橙(Citrus aurantium L.)及其栽培变种的干燥未成熟果实,具有治疗胸胁气滞、胀满疼痛、食积不化等功效[1],不仅可作为原料添加到功能性食品中,也能直接作为中药材。不同柑橘品种黄烷酮种类和含量也不一样,如枳壳中主要黄烷酮成分新橙皮苷和柚皮苷分别为5.6%和 4.11%[2],其含量的高低直接影响枳壳的药理作用,因此分析、提取和研究枳壳中这两种功能成分,将对枳壳的中药现代化及药食同源开发及应用具有重要意义。新橙皮苷具有减肥[3]、抑制股骨头坏死[4]、减轻肺纤维化[5]、保护神经系统[6]、抗癌[7]等药理作用。柚皮苷具有抗骨质疏松[8]、动脉粥样硬化[9]、过敏[10]、促进细胞凋亡[11]、调节微生物活性[12]等作用。此外,新橙皮苷和柚皮苷在调味品中也都有很大的应用价值,其对应的二氢查尔酮(新橙皮苷二氢查尔酮和柚皮苷二氢查尔酮)相对蔗糖甜度值分别为1 000和300[13],是优良的零热量新型甜味剂。
传统提取类黄酮化合物的方法主要有水浴回流提取、索氏提取、醇提酸析、碱提酸析等[14],但这些提取技术普遍存在工艺耗时长、有机溶剂成本高、萃取率低、生物活性成分易降解等缺陷。因此,为了克服传统提取技术的缺陷,国内外已开发出新的提取技术,如双水相(aqueous two-phase,ATP)提取技术、半仿生-酶法提取技术[15]、闪式提取技术[16]等。其中,双水相提取技术是一种利用目标化合物在两种互不相溶的两水相间选择性的分配,而实现分离的技术,可一步实现目标化合物的提取和初步纯化[17],别具优势。近年来,有机溶剂-盐系统具有价格低廉、绿色环保、传质与平衡反应迅速、回收效率高等特点,在提取和分离植物中的天然活性物质方面得到了广泛应用。基于双水相提取技术独特的分离优势,已经将其与其他提取技术结合起来[18],从而实现更高的提取分离效果。超声辅助提取是目前应用最广泛的一种提取技术,不仅能增加产品的得率、缩短提取时间,还能降低理化伤害[19]。酶辅助提取因具有高效、环境友好、易于操作等优点在食品工业中被广泛应用[20]。本文结合双水相提取、超声辅助提取及酶辅助提取技术三者独特的优势,拟开发一种更高效和绿色环保的提取方法,它被定义为超声-酶辅助双水相提取技术(ultrasonic-enzyme assisted aqueous two-phase extraction,UEA-ATPE)。
本文以重庆铜梁枳壳为原料,将黄烷酮新橙皮苷和柚皮苷的得率作为考察指标,筛选最适的双水相体系作为提取剂,将超声辅助提取与酶辅助提取应用于黄烷酮的提取,并通过制备型液相色谱、核磁共振(nuclear magnetic resonance,NMR)、傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)、高分辨质谱(high-resolution mass spectrometry,HR MS)等方法对提取物做分离、纯化和鉴定,以期为枳壳功能成分的高效提取利用提供基础实验和方法支撑。
1 材料与方法
1.1 材料与试剂
枳壳,产自重庆铜梁(40目筛);乙醇(分析纯)、新橙皮苷(分析对照品,≥98%)、柚皮苷(分析对照品,≥98%)(色谱级),ACMEC公司;Na2SO4、Na2CO3、(NH4)2SO4、K2CO3、Na2HPO4、KH2PO4、NaCl(均为分析纯)、磷酸、乙腈(色谱级),麦克林Macklin公司;酸性果胶酶(300 000 U/g)、酸性纤维素酶(500 000 U/g)、中性蛋白酶(150 000 U/g),山东隆科特酶制剂有限公司。
1.2 仪器与设备
DF101S集热式恒温磁力搅拌器,郑州长城科工贸有限公司;DP-800超声波清洗器,上海生析超声仪器有限公司;L-550台式低速大容量离心机,长沙湘仪离心机仪器有限公司;RE52CS-2旋转蒸发仪,上海亚荣生化仪器厂;LC-1260高效液相色谱仪,德国安捷伦科技有限公司;AS20005半制备液相色谱仪,江苏汉邦科技有限公司;600 MHz核磁共振波谱仪、BRUKER TENSOR 27傅里叶变换红外光谱仪FT-IR、impact II高分辨率质谱仪,德国布鲁克仪器有限公司。
1.3 实验方法
1.3.1 超声辅助双水相提取枳壳黄烷酮的工艺研究
1.3.1.1 双水相体系的确定
采用浊点滴定法[21]分别考察Na2SO4、Na2CO3、(NH4)2SO4、K2CO3、Na2HPO4、KH2PO4、NaCl/乙醇的成相能力,根据试验结果选择合适的无机盐绘制相图。称取无机盐3.6 g于50 mL具塞试管中,分别加入12.4 g去离子水溶解,再将乙醇滴加于盐溶液中,以澄清液刚好变为乳浊液为滴加终点,记下对应的乙醇质量(m1);体系再滴加去离子水,以乳浊液刚好变为澄清液为滴加终点,记下对应的去离子水质量(m2)。以无机盐质量分数(%)为横坐标、乙醇质量分数(%)为纵坐标,绘制双水相图。
1.3.1.2 单因素试验
枳壳粉碎后取0.5 g置于50 mL离心管中,加入20 g双水相溶剂,磁力搅拌器混合均匀后于50 ℃超声处理30 min,真空泵抽滤后于分液漏斗中静置1 h,待体系平衡后取出上相提取液,低温贮存过夜除去部分盐,4 200 r/min离心10 min后,再经0.22 μm微孔滤膜过滤,备用。通过单因素试验分别研究乙醇质量分数(23%、25%、27%、29%、31%、33%)、(NH4)2SO4质量分数(15%、17%、19%、21%、23%、25%)和超声功率(40、70、100、130、160、190 W)对新橙皮苷和柚皮苷得率的影响。
1.3.1.3 响应面设计
在单因素试验基础上,以乙醇质量分数(A)、(NH4)2SO4质量分数(B)、超声功率(C)为自变量,新橙皮苷和柚皮苷得率为响应值,按照Box-Behnken设计试验,筛选出超声辅助双水相提取枳壳黄烷酮的最佳工艺参数,因素与水平设计见表1。
表1 响应面分析与因素水平
Table 1 Response surface analysis factors and levels

水平因素A(乙醇质量分数)/%B((NH4)2SO4质量分数)/%C(超声功率)/W-125191000272113012923160
1.3.2 新橙皮苷、柚皮苷的含量测定
采用《中国药典》[1]枳壳中新橙皮苷、柚皮苷的含量测定方法:Eclipse-XD8-C18色谱柱(4.6 mm×150 mm,5 μm),V(乙腈):V(水)=20:80(pH用冰醋酸调整为3),检测波长为283 nm。分别吸取新橙皮苷(390 μg/mL)和柚皮苷(385 μg/mL)对照品储备液1.0、3.0、5.0、7.0、9.0 mL,分别置于10 mL容量瓶中,用甲醇定容。以对照品质量浓度梯度(μg/mL)为横坐标,峰面积(mUA)为纵坐标,绘制标准曲线,新橙皮苷:y=10.59x-42.77(R2=0.999 7,线性范围39~351 μg/mL);柚皮苷:y=7.977 4x-6.91(R2=0.999 6,线性范围38.5~346.5 μg/mL)。
1.3.3 UEA-ATPE提取枳壳黄烷酮的工艺研究
枳壳粉末取0.5 g置于50 mL离心管中,分别加入4.2 g (NH4)2SO4和10.4 g水使其充分溶解,然后加入5.4 g乙醇和0.05 g酶,用磁力搅拌器混合均匀,于50 ℃下水浴2 h后,在137 W下超声30 min,后续处理同1.3.1.2节。本试验先考察酶种类(纤维素酶、果胶酶、中性蛋白酶以及质量比1:1的复合酶,包括纤维素酶/果胶酶、纤维素酶/中性蛋白酶、中性蛋白酶/果胶酶),再根据酶种类试验结果筛选复合酶比例(1:1、1:2、1:3、2:1、2:3、3:1、3:2)(质量比),酶总量为0.05 g,后续处理同1.3.1.2节。
1.3.4 不同提取方法比较
为研究本试验新建立的提取方法与传统和新型单一提取方法在提取枳壳黄烷酮方面的差异,试验比较了超声辅助双水相、50%(体积分数)乙醇浸渍、水煎法、90%(体积分数)乙醇超声辅助。实验参数见表2。
表2 不同提取方法试验参数
Table 2 Experimental parameters of different extraction methods

方法试验参数超声辅助双水相不加酶,其余参数与UEA-ATPE工艺保持一致50%乙醇浸渍m(枳壳):m(50%乙醇)=1:40,室温浸渍30 min水煎法m(枳壳):m(水)=1:40,煮沸30 min90%乙醇超声辅助溶剂为90%乙醇,不加酶,其余参数与UEA-ATPE工艺保持一致
1.3.5 UEA-ATPE提取物的分离、纯化和鉴定
采用制备型液相色谱对UEA-ATPE上相提取液做进一步的分离纯化。选择色谱柱:C18(250 mm×9.4 mm,5 μm);以V(甲醇):V(水)=45:55 (pH用冰醋酸调整为3)为流动相;流量3.5 mL/min;室温;波长283 nm;样品量为0.5 mL,于11.3~11.9 min内人工采集馏分。
将制备型液相色谱收集的馏分经旋转蒸发后,获得一种淡黄色粉末,取其中一部分溶解于甲醇后经分析型液相色谱测定,方法同1.3.2节,并用峰面积归一化法计算纯度,剩余部分来做定性分析。采用NMR、FT-IR和HR MS等方法解析其结构,从而进一步对纯化物质作定性确认。
a)NMR:称取20 mg纯化物质于核磁管中,加入0.6 mL DMSO-d6充分溶解,进行核磁共振碳谱和氢谱测定。通过分析各个峰的化学位移及裂分情况,初步确定其结构。
b)FT-IR:取适量纯化物质与溴化钾以质量比1:200混合压片,压片后在傅里叶红外光谱仪上进行400~4 000 cm-1波长范围扫描,分析图谱主要特征吸收峰。
c)HR MS:取适量纯化物溶于甲醇,在高分辨质谱正离子模式下全扫分析,取样范围(m/z)为50~1 300。
1.3.6 数据分析处理
实验设计与数据处理、绘图采用Origin 2021、Excel 2019、SPSS 26.0、Design-Expert 8.0和ChemDraw17.0等软件;所有样品平行试验3次,结果为平均值±标准差。
2 结果与分析
2.1 超声辅助双水相提取枳壳黄烷酮条件的确定
2.1.1 双水相体系的确立
2.1.1.1 乙醇与无机盐构成双水相体系的成相结果
表3显示乙醇与多种无机盐(Na2SO4、Na2CO3、(NH4)2SO4、K2CO3、Na2HPO4、KH2PO4、NaCl)构建双水相体系的成相结果。Na2SO4、Na2CO3、(NH4)2SO4、K2CO3均能和乙醇形成双水相,其中,Na2SO4迅速分层,静置一会后下相出现沉淀;Na2CO3迅速分层后,上相浑浊;Na2HPO4、KH2PO4、NaCl均不能与乙醇形成双水相。因此选择(NH4)2SO4和K2CO3进一步考察相图绘制。
表3 各双水相体系的成相结果
Table 3 Phase formation of various ATPS

双水相组成盐种类分层情况成相特点Na2SO4快速成相后下相有些沉淀Na2CO3快速迅速分层后,上相浑浊(NH4)2SO4快速容易成相、澄清、稳定乙醇K2CO3快速容易成相,临界点不清晰Na2HPO4不分层不成相KH2PO4不分层不成相NaCl不分层不成相,下相有沉淀
2.1.1.2 K2CO3/(NH4)2SO4与乙醇相图
根据试验结果选择成相能力较好的(NH4)2SO4和K2CO3并分别绘制与乙醇的相平衡图,结果如图1所示。曲线将体系划分成两个区域,曲线上方是一个两相区域,上相主要含乙醇,下相主要含无机盐;曲线下方是单相区域,表示不可形成双水相。本试验应从曲线上方选择合适的无机盐/乙醇组成,由图1可知,(NH4)2SO4/乙醇的质量分数上下限均大于K2CO3/乙醇的质量分数,结合表3各双水相体系的成相结果,对比两种双水相体系成相特点,(NH4)2SO4/乙醇的成相能力强,所以在接下来的试验中选择(NH4)2SO4。
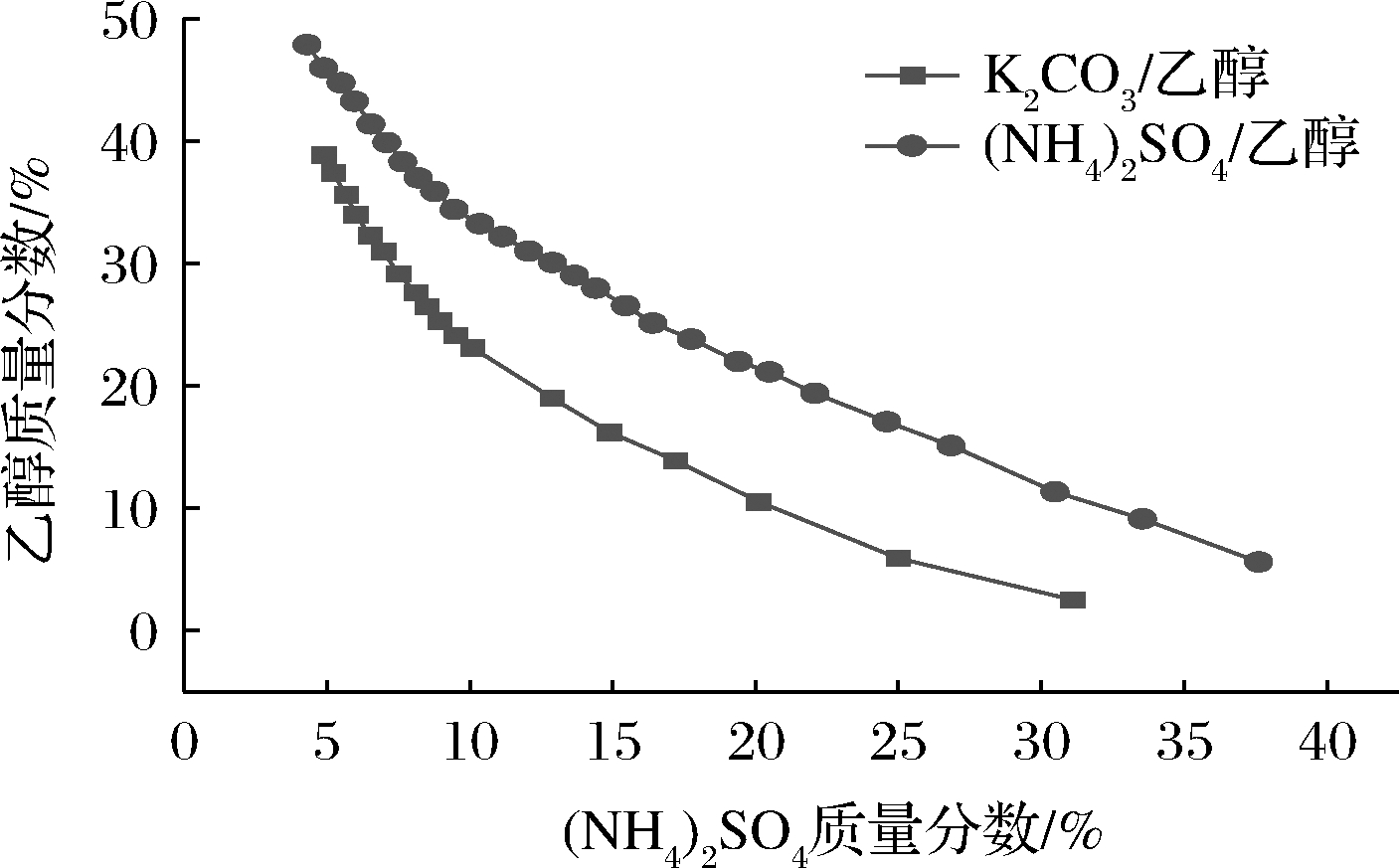
图1 乙醇与不同无机盐构成体系的相图
Fig.1 Phase diagrams of ATPS built by ethanol and different inorganic salts
2.1.2 单因素试验结果
2.1.2.1 乙醇质量分数的确定
固定(NH4)2SO4质量分数19%、功率100 W、50 ℃超声辅助提取30 min等条件下,试验结果如图2-a所示。随着乙醇质量分数的增加,新橙皮苷和柚皮苷得率先增大后下降,当乙醇质量分数为27%时,两者的得率都为最大值。这是因为随着乙醇质量分数的增加,使得双水相体系的极性更接近于两者的极性,根据相似相溶原理[22],从而提高了两者在双水相体系中的溶解度,而当继续增大乙醇质量分数时,双水相体系提高了溶解其他有机物的能力,进而抑制了目标化合物的溶解[23]。因此,本试验选择乙醇质量分数为27%。

a-乙醇质量分数/%;b-(NH4)2SO4质量分数/%;c-超声功率/W
图2 新橙皮苷和柚皮苷得率的单因素分析
Fig.2 Analyses of single factors effecting on the yield of neohesperidin and naringin
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.1.2.2 (NH4)2SO4质量分数的确定
固定乙醇质量分数27%,其他参数不变,试验结果如图2-b所示。(NH4)2SO4质量分数的增加,两者得率先是逐渐上升,当质量分数超过21%时则呈下降趋势。这是因为(NH4)2SO4浓度的增加会促进双水相体系上相中的疏水相向上相分配,从而提高了两者得率,这与WANG等[24]在乙醇/盐水溶液两相系统-超声法从橄榄叶中提取多酚有关(NH4)2SO4的趋势变化结果相似。因此,本试验选择(NH4)2SO4的质量分数21%。
2.1.2.3 超声功率的确定
固定乙醇、(NH4)2SO4质量分数分别为27%和21%,其他参数不变,试验结果如图2-c所示。功率在40~130 W时,随着超声功率的增加两者得率持续增加,这是因为空化效应产生的能量,在一定程度上破坏了枳壳粉末组织和细胞壁,而导致两者得率增加,但超过130 W因强烈的空化效应会导致两者得率下降;同时超声波作用时因高速振荡也将枳壳粉末分散得更均匀[25],从而增加了两者得率。故本试验选择超声功率130 W。
2.1.3 响应面优化超声辅助双水相提取黄烷酮的试验结果
2.1.3.1 响应面结果及回归模型
根据单因素试验结果,设计3因素(A、B、C)3水平共17组响应面优化试验,得到二次回归模型:新橙皮苷得率Y1=72.54+0.67A+4.63B+3.22C-5.42AB-3.64AC-3.97BC-6.27A2-5.64B2-4.81C2;柚皮苷得率Y2=59.85+0.033A+3.40B+2.62C-4.39AB-2.41AC-2.88BC-6.40A2-6.14B2-4.66C2。
对回归模型进行方差分析,结果见表4。两个模型都拥有低P值(0.000 4、0.000 5,均小于0.05)和高F值(19.48、17.47),表明两种模型均适合本试验。失拟项P值(0.137 9、0.300 3)均大于0.05,不显著,表明模型与实际试验拟合较好。回归方程校正系数![]() 变异系数(coefficient of variation,CV)=3.57%、4.22%,说明实际值与预测值相关性良好。做响应曲面和等高线图,以新橙皮苷为例,如图3所示,上方分别为AB、BC、AC的响应曲面,下方分别为三者的等高线图,其等高线呈椭圆形,说明三者之间的交互作用对新橙皮苷得率都有影响。
变异系数(coefficient of variation,CV)=3.57%、4.22%,说明实际值与预测值相关性良好。做响应曲面和等高线图,以新橙皮苷为例,如图3所示,上方分别为AB、BC、AC的响应曲面,下方分别为三者的等高线图,其等高线呈椭圆形,说明三者之间的交互作用对新橙皮苷得率都有影响。

a、d-乙醇质量分数和(NH4)2SO4质量分数;b、e-乙醇质量分数和功率;c、f-(NH4)2SO4质量分数和功率
图3 新橙皮苷得率的响应面和等高线
Fig.3 Response surfaces and contours of neohesperidin yield
注:a~c为响应面图;d~f为等高线图
表4 二次响应面回归模型方差分析
Table 4 Analysis of variance of quadratic response surface regression model

方差来源新橙皮苷(R2 Adj=0.912 2,CV=3.57%)柚皮苷(R2 Adj=0.902 6,CV=4.22%)平方和自由度均方F值P值显著性平方和自由度均方F值P值显著性模型934.289103.8119.480.000 4**751.49983.517.470.000 5**A3.6213.620.680.437 18.88E-0318.88E-031.86E-030.966 8B171.141171.1432.110.000 8**92.51192.5119.350.003 2**C82.9182.915.550.005 6**54.92154.9211.490.011 6*AB117.591117.5922.060.002 2**76.92176.9216.090.005 1**AC53.01153.019.950.016 1*23.17123.174.850.063 6*BC63.17163.1711.850.010 8*33.2133.26.940.033 7*A2165.481165.4831.050.000 8**172.261172.2636.040.000 5**B2134.161134.1625.170.001 5**158.661158.6633.190.000 7**C297.29197.2918.250.003 7**91.39191.3919.120.003 3**残差37.3175.3333.4674.78失拟项26.6438.883.330.137 9 18.8536.281.720.300 3
注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。
2.1.3.2 响应面验证试验
利用Design-expert 8.0软件分析优化枳壳中新橙皮苷、柚皮苷提取的最佳条件:乙醇质量分数26.61%、(NH4)2SO4质量分数21.84%、超声功率137.06 W,新橙皮苷提取效果预测为73.83 mg/g,柚皮苷提取效果预测为60.62 mg/g。为了便于实际操作,对最佳条件进行优化:乙醇质量分数27%、(NH4)2SO4质量分数21%、超声功率137 W,其他参数同1.3.1.2节。经过3次平行试验实际测得,新橙皮苷得率为(74.94±1.45) mg/g,柚皮苷得率为(61.05±1.42) mg/g,与预测值接近,说明该模型适用于超声辅助双水相提取新橙皮苷和柚皮苷的工艺优化。
2.2 UEA-ATPE提取枳壳黄烷酮条件的确定
2.2.1 酶种类的确定
其他参数同响应面优化结果,试验结果如图4-a所示。纤维素酶促进作用优于果胶酶和中性蛋白酶,纤维素酶复合另外两种酶后,促进作用变弱;中性蛋白酶/果胶酶促进作用强于其他两种复合酶。由于枳壳中存在果胶,在加热状态下果胶大量溶出,提取液黏稠[26],增加了分离难度,故引入果胶酶提高新橙皮苷和柚皮苷的得率,它与中性蛋白酶复合使用后,两者得率达到最大,这可能是因为枳壳种子中还含有蛋白质,引入中性蛋白酶有利于提高两者得率,因此,本试验后续选择中性蛋白酶/果胶酶。

a-酶种类;b-酶质量比
图4 酶种类和比例对新橙皮苷和柚皮苷得率的影响
Fig.4 Effects of different enzyme types and enzyme proportions on the yield of neohesperidin and naringin
2.2.2 酶比例的确定
选择中性蛋白酶/果胶酶,其他参数同响应面优化结果,试验结果如图4-b所示。1:2与1:3(质量比)的复合酶分别对两者得率有类似的影响。1:1(质量比)的复合酶对两者得率优于其他几种比例组合,不同酶组合比例对新橙皮苷得率的影响比柚皮苷大,究其原因可能是:a)本试验枳壳提取液中新橙皮苷的含量高于柚皮苷,在适宜的酶处理条件下,柚皮苷的溶出量已达到饱和状态;b)新橙皮苷和柚皮苷的热稳定性和溶解度不一样[27]。故综合考虑,选择质量比1:1,新橙皮苷和柚皮苷得率分别为(92.27±2.13)、(72.24±1.56) mg/g。
2.3 UEA-ATPE与其他提取方法得率的比较
结果如图5所示,不同的提取工艺对新橙皮苷和柚皮苷得率有明显的影响:UEA-ATPE>超声辅助双水相>50%乙醇浸渍>水煎法>90%乙醇超声辅助,可能是由于双水相的选择特性,超声辅助提取的空化作用,以及酶辅助提取的高效性能更大程度地破坏枳壳细胞壁结构,促进更多的黄烷酮被释放出来。在5种方法中,新橙皮苷纯度最高的是UEA-ATPE和超声辅助双水相,由于双水相独特的选择性,蛋白质、多糖等杂质向下相转移,可以实现新橙皮苷的初步分离,并简化后续进一步纯化操作。本试验结果表明,一种适宜的盐/乙醇双水相体系可以作为提取植物中有效成分的溶剂,这与近年来的科研结果一致[28],同时超声和酶辅助能大大提高目标化合物的提取效率。

图5 不同提取方法对新橙皮苷和柚皮苷得率的影响
Fig.5 Effects of different extraction methods on the yield of neohesperidin and naringin
2.4 UEA-ATPE提取物的分离、纯化和鉴定
本试验材料为重庆铜梁枳壳,其新橙皮苷含量高于柚皮苷,因公司后续开发需要,本次试验仅以新橙皮苷作为目标物质来进行分离、纯化和鉴定。经分析型液相色谱测定,枳壳样品中的第2个峰初步确定为新橙皮苷,其纯度达99.37%。对分离纯化的物质分别采用NMR、FT-IR和HR MS分析,发现a)纯化物质的核磁共振数据见表5,所列波谱数据与有关文献[29]所列基本相同;b)纯化物质在3 417.47 cm-1处有宽而强的吸收峰,为羟基的伸缩振动峰,表明分子间或分子内有O—H;在2 861.24 cm-1附近出现尖峰,这是一种非对称和对称的亚甲基振动,说明分子内有C—H;在1 645.90 cm-1处有吸收峰,是C![]() O不对称伸缩引起的振动;1 575.90、1 519.06、1 451.20 cm-1处吸收峰属于苯环C
O不对称伸缩引起的振动;1 575.90、1 519.06、1 451.20 cm-1处吸收峰属于苯环C![]() C骨架伸缩振动的谱带[30];c)选取全谱最高峰m/z=633.178 7进行解析,其归属为[M+Na]+,分子式C28H34NaO15,即纯化物质在高分辨质谱条件下结合游离的Na+形成的+1价阳离子簇框架峰[(C28H34O15)Na]+,解析出纯化物质m/z=611.197 6,分子式为C28H34O15。NMR、FT-IR和HR MS图谱详见附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.034267)。
C骨架伸缩振动的谱带[30];c)选取全谱最高峰m/z=633.178 7进行解析,其归属为[M+Na]+,分子式C28H34NaO15,即纯化物质在高分辨质谱条件下结合游离的Na+形成的+1价阳离子簇框架峰[(C28H34O15)Na]+,解析出纯化物质m/z=611.197 6,分子式为C28H34O15。NMR、FT-IR和HR MS图谱详见附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.034267)。

a-纯化物质核磁共振碳谱图;b-纯化物质核磁共振氢谱图;c-纯化物质傅里叶红外光谱图;d-纯化物质高分辨质谱图
附图1 纯化物质的核磁共振图谱、傅里叶红外光谱图和高分辨质谱图
Fig.S1 NMR、FT-IR and HR MS of the purified substance
表5 纯化物质的核磁共振数据
Table 5 NMR data of purified substance

碳δCδH碳δCδH1118.36.89 t10103.9-2148.5-11163.4-3112.76.98 m1296.86.16 m4131.4-13165.3-5114.76.98 m1495.76.16 m6147.1-15163.1-75.18 m16100.95.56 m842.72.81 m17985.18 m9197.4-
注:-表示未检测到。
综上NMR、FT-IR和HR MS所列结果该物质鉴定为新橙皮苷。
3 结论
本文建立了UEA-ATPE提取枳壳黄烷酮的工艺,并进行了参数优化。试验结果表明,最佳双水相体系为 (NH4)2SO4/乙醇,乙醇和(NH4)2SO4质量分数分别为27%和21%,超声功率137 W,中性蛋白酶/果胶酶质量比为1:1,新橙皮苷和柚皮苷得率分别达到(92.27±2.13)、(72.24±1.56) mg/g。比较了UEA-ATPE和传统、新型单一提取等方法,结果表明UEA-ATPE得率最高,其提取液纯化后经光谱分析,结果表明纯化物质纯度达99.37%,光谱分析鉴定为新橙皮苷。枳壳黄烷酮作为一种天然的食品成分,可用于抗炎、抗癌、保健品等方面,这为枳壳的新橙皮苷和柚皮苷的高效提取以及综合开发利用提供参考。
[1] 国家药典委员会. 中华人民共和国药典:一部[M].北京:中国医药科技出版社, 2020.
State Pharmacopoeia Commission.Pharmacopoeia of the People′s Republic of China:Part I[M].Beijing:China Pharmaceutical Science and Technology Press, 2020.
[2] 刘晗, 赵揆, 席凯方.麸炒枳壳的最佳工艺条件研究[J].检验检疫学刊, 2020, 30(3):122-123.
LIU H, ZHAO K, XI K F.Study on the optimum technological conditions of fructus aurantii sauteed with bran[J].Journal of Inspection and Quarantine, 2020, 30(3):122-123.
[3] LU J F, ZHU M Q, ZHANG H, et al.Neohesperidin attenuates obesity by altering the composition of the gut microbiota in high-fat diet-fed mice[J].FASEB Journal, 2020, 34(9):12053-12071.
[4] YUAN S, ZHANG C X, ZHU Y L, et al.Neohesperidin ameliorates steroid-induced osteonecrosis of the femoral head by inhibiting the histone modification of lncRNA HOTAIR[J].Drug Design, Development and Therapy, 2020, 14:5419-5430.
[5] ZHAO T T, HU S L, MA P Y, et al.Neohesperidin suppresses IgE-mediated anaphylactic reactions and mast cell activation via Lyn-PLC-Ca2+ pathway[J].Phytotherapy Research: PTR, 2019, 33(8):2034-2043.
[6] CHAKRABORTY S, RAKSHIT J, BANDYOPADHYAY J, et al.Multi-target inhibition ability of neohesperidin dictates its neuroprotective activity:Implication in Alzheimer’s disease therapeutics[J].International Journal of Biological Macromolecules, 2021, 176:315-324.
[7] GONG Y L, DONG R, GAO X M, et al.Neohesperidin prevents colorectal tumorigenesis by altering the gut microbiota[J].Pharmacological Research, 2019, 148:104460.
[8] WANG W, MAO J, CHEN Y, et al.Naringin promotes osteogenesis and ameliorates osteoporosis development by targeting JAK2/STAT3 signalling[J].Clinical and Experimental Pharmacology &Physiology, 2022, 49(1):113-121.
[9] WANG F, ZHAO C Y, TIAN G F, et al.Naringin alleviates atherosclerosis in ApoE-/- mice by regulating cholesterol metabolism involved in gut microbiota remodeling[J].Journal of Agricultural and Food Chemistry, 2020, 68(45):12651-12660.
[10] ESCRIBANO-FERRER E, QUERALT REGUÉ J, GARCIA-SALA X, et al.In vivo anti-inflammatory and antiallergic activity of pure naringenin, naringenin Chalcone, and quercetin in mice[J].Journal of Natural Products, 2019, 82(2):177-182.
[11] KIM H, LEE D G.Naringin-generated ROS promotes mitochondria-mediated apoptosis in Candida albicans[J].IUBMB Life, 2021, 73(7):953-967.
[12] SOST M M, AHLES S, VERHOEVEN J, et al.A Citrus fruit extract high in polyphenols beneficially modulates the gut microbiota of healthy human volunteers in a validated in vitro model of the colon[J].Nutrients, 2021, 13(11):3915.
[13] DEL R O J A, FUSTER M D, SABATER F,et al.Selection of citrus varieties highly productive for the neohesperidin dihydrochalcone precursor[J].Food Chemistry, 1997, 59(3):433-437.
O J A, FUSTER M D, SABATER F,et al.Selection of citrus varieties highly productive for the neohesperidin dihydrochalcone precursor[J].Food Chemistry, 1997, 59(3):433-437.
[14] 谷政伟, 李丹, 樊苏萍, 等.微波辅助碱液提取花生壳黄酮工艺[J].中国粮油学报, 2020, 35(12):125-129.
GU Z W, LI D, FAN S P, et al.Microwave-assisted extraction of flavonoids from Arachis hypogaea L.hulls by lye[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(12):125-129.
[15] 薛璇玑, 罗俊, 张新新, 等.半仿生酶法提取柿叶中总黄酮的工艺筛选及优化[J].中国药房, 2017, 28(13):1813-1816.
XUE X J, LUO J, ZHANG X X, et al.Screening and optimization of the extraction technology of total flavonoids in persimmon leaves by semi-bionic-enzyme method[J].China Pharmacy, 2017, 28(13):1813-1816.
[16] 赵成萍, 陈胜萍, 刘晓光, 等.响应面法优化山楂果肉总黄酮闪式提取研究[J].山东农业科学, 2022, 54(4):140-145.
ZHAO C P, CHEN S P, LIU X G, et al.Optimization of flash extraction of total flavonoid from hawthorn flesh by response surface methodology[J].Shandong Agricultural Sciences, 2022, 54(4):140-145.
[17] AHMED T, YAMANISHI C, KOJIMA T, et al.Aqueous two-phase systems and microfluidics for microscale assays and analytical measurements[J].Annual Review of Analytical Chemistry, 2021, 14(1):231-255.
[18] 李申, 卫立心, 董玲玲,等.双水相萃取技术在植物多酚分离中的应用[J].黑龙江农业科学, 2021(1):152-156.
LI S, WEI L X, DONG L L, et al.Application of aqueous two-phase extraction technology for the separation of plant polyphenols[J].Heilongjiang Agricultural Sciences, 2021(1):152-156.
[19] 张艳霞, 朱彩平, 邓红, 等.超声辅助双水相提取石榴皮多酚[J].食品与发酵工业, 2016, 42(12):150-156.
ZHANG Y X, ZHU C P, DENG H, et al.Optimization of ultrasound assisted aqueous two-phase extraction of polyphenols from pomegranate peel by response surface methodology[J].Food and Fermentation Industries, 2016, 42(12):150-156.
[20] 孟永海, 付敬菊, 秦蓁, 等.超声技术辅助酶技术提取中草药有效成分的研究进展[J].化学工程师, 2020, 34(7):51-57.
MENG Y H, FU J J, QIN Z, et al.Research progress of ultrasonic assisted enzymatic extraction of effective components from Chinese herbal medicines[J].Chemical Engineer, 2020, 34(7):51-57.
[21] 高晓燕. 几种天然产物的双水相体系萃取研究[D].徐州:中国矿业大学, 2019.
GAO X Y.Study on extraction of several natural products by aqueous two-phase system[D].Xuzhou:China University of Mining and Technology, 2019.
[22] 刘帅, 邹国华, 邓阳, 等.略论相似相溶原理的内涵与部分应用[J].化学教育(中英文), 2021, 42(11):60-64.
LIU S, ZOU G H, DENG Y, et al.On the connotation and partial application of the similarity and intermiscibility principle[J].Chinese Journal of Chemical Education, 2021, 42(11):60-64.
[23] 张喜峰, 杨春慧, 罗光宏.乙醇/硫酸铵双水相体系分离纯化葡萄籽总黄酮[J].食品与发酵工业, 2013, 39(10):254-258.
ZHANG X F, YANG C H, LUO G H.Separation and purification of total flavonids of grape seedswith ethanol/ammonium sulphate aqueous two-phase system[J].Food and Fermentation Industries, 2013, 39(10):254-258.
[24] WANG W X, YANG J B, YANG J.Optimization of ultrasound-assisted aqueous two phase extraction of polyphenols from olive leaves[J].Preparative Biochemistry &Biotechnology, 2021, 51(8):821-831.
[25] 郭佳俊, 袁江涛, 刘贵珊.牛骨胶原蛋白肽的超声辅助提取及抗氧化活性研究[J].食品与发酵工业, 2023, 49(10):185-192.
GUO J J, YUAN J T, LIU G S.Ultrasound-assisted extraction and antioxidant activity of bovine bone collagen peptides[J].Food and Fermentation Industries, 2023, 49(10):185-192.
[26] 王姣姣, 吕广, 杨晓光.柑橘果胶和纤维连续提取工艺研究及其理化检测[J].食品科技, 2021, 46(5):173-179.
WANG J J, LYU G, YANG X G.Continuous extraction technology and detection of physical-chemical indexes of citrus pectin and fiber[J].Food Science and Technology, 2021, 46(5):173-179.
[27] 刘学仁, 蔡品品, 姜涛, 等.微波辅助提取枳壳中柚皮苷、新橙皮苷的工艺研究[J].中成药, 2013, 35(2):420-423.
LIU X R, CAI P P, JIANG T, et al.Study on microwave-assisted extraction of naringin and neohesperidin from fructus aurantii[J].Chinese Traditional Patent Medicine, 2013, 35(2):420-423.
[28] YAN Y, ZHOU H, WU C H, et al.Ultrasound-assisted aqueous two-phase extraction of synephrine, naringin, and neohesperidin from Citrus aurantium L.fruitlets[J].Preparative Biochemistry &Biotechnology, 2021, 51(8):780-791.
[29] 阮伸. 新橙皮苷结构的波谱分析[J].江苏化工, 1994, 22(3):36-40.
RUAN S.Spectral analysis of the structure of neohesperidin[J].Jiangsu Chemical Industry, 1994, 22(3):36-40.
[30] SHARIF M, ANSARI F, HASSAN N U, et al.Explore the antiproliferative phytocompounds from ethanolic extracts of Citrus paradisi against liver cancer cell line by chemical analysis using TLC and FT-IR spectroscopy[J].Brazilian Journal of Biology, 2022, 82:e256856.