毛肚、鸭肠、黄喉等水发食品在我国西南地区深受消费者喜爱,消费量较大,但其中检出氨基脲的事件时有发生,给食品加工业带来了巨大的经济损失。氨基脲属于联胺类化合物,对实验动物的生殖系统、内分泌系统和免疫系统有多效性影响和改变,具有致畸性、致突变性和致癌性,长期摄入会给人体造成安全隐患[1-2]。食品动物养殖过程中使用呋喃西林药物,可在体内代谢产生氨基脲[3-4]。此外,部分甲壳类动物体内存在内源性氨基脲[5-7],偶氮二甲酰胺用作发泡剂或面粉增筋剂时,高温分解也会产生氨基脲[8-10]。市售的毛肚、鸭肠、黄喉大部分是干制产品,必须经过复水涨发才能食用,在水发食品的生产加工过程中,部分厂家会加入次氯酸钠消毒剂用于防腐消毒,水发食品与次氯酸钠接触后,会分解出游离的氨基酸和氨基酸衍生物,精氨酸、组氨酸等含有胍基的氨基酸可分解产生氨基脲;精氨酸降解后产生尿素和氨水,氨水与次氯酸钠反应生成氯胺,氯胺与尿素反应生成氨基脲;氯胺与氨反应可生成联氨,谷氨酰胺和天冬酰胺等含有酰胺基团的氨基酸与次氯酸钠作用能生成异氰酸盐,联胺与异氰酸盐反应也可生成氨基脲[11-16]。目前,国内关于水发食品中氨基脲研究报道比较少,为系统考察次氯酸钠消毒剂对水发食品中氨基脲产生量的影响,本文以毛肚、鸭肠、黄喉等水发食品为研究对象,全面探究次氯酸钠消毒剂溶液浓度、浸泡时间、浸泡pH、浸泡温度、漂洗次数对氨基脲产生量的影响,为改进水发食品生产工艺、减少氨基脲生成提供技术支撑和理论参考。
1 材料与方法
1.1 材料与试剂
毛肚、鸭肠及黄喉,重庆超市及农贸市场。
氨基脲标准品,Dr.Ehrenstorfer GmbH公司;氨基脲-13C-15N2标准品,WITEGA公司;乙腈、甲酸、正己烷均为色谱纯,上海安谱实验科技股份有限公司;乙酸铵、乙酸乙酯、磷酸氢二钾、盐酸(均为分析纯),重庆川东化工有限公司;氢氧化钠(分析纯),成都市科龙化工试剂厂;水,经Millipore超纯水仪处理过的超纯水;邻硝基苯甲醛(含量>99%),日本TGI公司;二甲基亚砜(纯度≥99.5%),日本Sigma公司;次氯酸钠(有效氯10%),成都金山化学试剂有限公司。
1.2 仪器与设备
1290型高效液相色谱仪,美国安捷伦公司;API5500型三重四级杆质谱仪,美国AB SCIEX公司;涡旋振荡器,海门市其林贝尔公司;TD16-WS型台式高速离心机,长沙湘仪公司;恒温水浴振荡器,金坛市环宇科学仪器厂。
1.3 实验方法
1.3.1 次氯酸钠溶液处理
称取2.0 g阴性样品于50 mL离心管中,分别加入不同质量浓度、不同pH值的次氯酸钠溶液10 mL,涡旋振荡30 s后,置于恒温水浴振荡器,于不同温度、不同时间下进行振荡浸泡处理。浸泡结束后,视实验需要,用清水漂洗样品。
1.3.2 样品制备
经次氯酸钠溶液消毒处理的毛肚、鸭肠及黄喉样品用10 mL水冲洗后均质制样,准确称取2.0 g样品置于50 mL离心管中,加入100 ng/mL氨基脲内标工作溶液100 μL,涡旋混合1 min,放置20 min后加入适量1 mol/L盐酸溶液20 mL和0.1 mol/L邻硝基苯甲醛溶液0.15 mL,涡旋振荡1 min后,置于恒温水浴振荡器中37 ℃避光振荡16 h。取出离心管冷却至室温,加入1.0 mol/L磷酸氢二钾溶液5 mL,用NaOH溶液调节pH至7.0~7.4,加入5 mL乙酸乙酯,涡旋振荡1 min,取上层清液至10 mL离心管中,再加入5 mL乙酸乙酯重复上述操作,合并上清液后40 ℃氮气吹干。准确加入1 mL水,2 mL正己烷涡旋振荡溶解残留物,8 000 r/min离心5 min,取下层清液过0.22 μm滤膜,待液相色谱-串联质谱(liquid chromatography tandem mass spectrometry,LC-MS/MS)检测。样品平行测定3份,结果取平均值。同时用纯水代替次氯酸钠溶液,做空白试验。
1.3.3 基质标准溶液制备
分别称取6份阴性样品,每份2.0 g,置于50 mL离心管中,氨基脲加标水平分别为0.5、1、2、5、10、20 μg/kg,加入100 ng/mL氨基脲内标工作溶液100 μL,涡旋混合1 min,余下操作同1.3.2节“放置20 min后加入1 moL/L盐酸溶液20 mL和……,待LC-MS/MS检测”。
1.3.4 色谱条件
色谱柱:HSS T3(50 mm×2.1 mm,1.7 μm),流动相A相为乙腈(含0.1%甲酸),B相为10 mmol/L乙酸铵水溶液(含0.1%甲酸),梯度洗脱程序为:0~0.6 min,15% A;0.6~3.0 min,15%~85% A;3.0~4.5 min,85% A;4.5~4.6 min,85%~15% A;4.6~6.1 min,15% A。流速0.3 mL/min,柱温40 ℃,进样体积:2 μL。
1.3.5 质谱条件
离子化模式:电喷雾正离子模式(ESI+),喷雾电压:5 000 V;离子源温度:550 ℃;扫描模式:多反应监测(multiple reaction monitoring,MRM);气帘气:270 kPa;GAS1:380 kPa,GAS2:380 kPa;质谱参数见表1。标准溶液和样品的质量色谱图见图1和图2。

图1 标准溶液质量色谱图
Fig.1 MRM spectra of standard solution
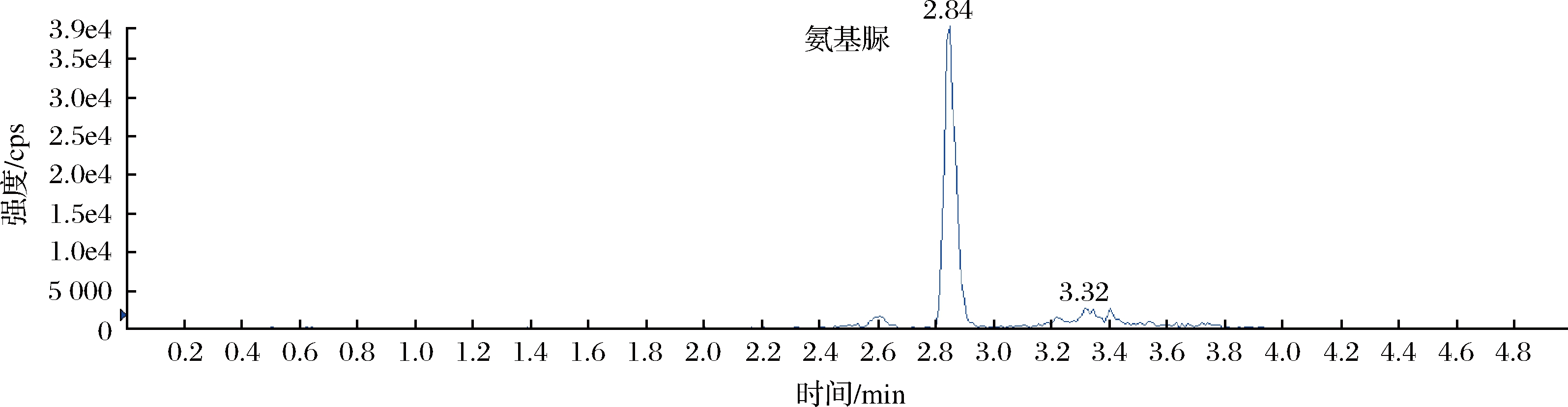
图2 样品质量色谱图
Fig.2 MRM spectra of sample
表1 氨基脲和同位素内标物的多反应监测质谱参数
Table 1 Mass spectrometry parameters of MRM mode for semicarbazide and isotope internal standard
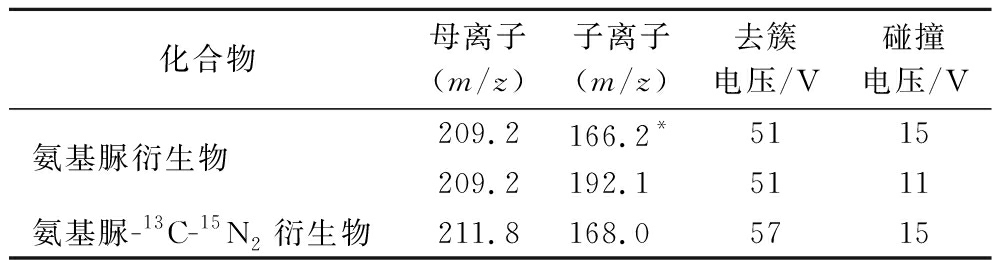
化合物母离子(m/z)子离子(m/z)去簇电压/V碰撞电压/V氨基脲衍生物209.2166.2*5115209.2192.15111氨基脲-13C-15N2衍生物211.8168.05715
注:*为定量离子。
2 结果与分析
2.1 次氯酸钠溶液质量浓度对氨基脲产生量的影响
食品加工行业中,次氯酸钠作为消毒剂的质量浓度一般为0.05~0 g/L,25 ℃条件下,分别采用pH为7质量浓度为0.05、0.1、0.2、0.5、1、2 g/L的次氯酸钠溶液振荡浸泡毛肚、鸭肠和黄喉,浸泡时间为1 h。浸泡后进行测定,氨基脲含量结果见表2。由表2可知,不同的水发食品氨基脲的生成量有较大差异。次氯酸钠溶液质量浓度为0.05 g/L时,毛肚、鸭肠和黄喉中均未检出氨基脲,当次氯酸钠溶液质量浓度达到0.1 g/L,毛肚、鸭肠和黄喉中均产生了氨基脲,而且随着次氯酸钠质量浓度增加,氨基脲产生量也不断增加,氨基脲产生量与次氯酸钠溶液质量浓度呈正相关关系。次氯酸钠溶液质量浓度为1 g/L时,毛肚、鸭肠、黄喉中氨基脲生成量分别为11.52、9.74、4.98 μg/kg,毛肚中氨基脲生成量约为黄喉的2倍。
表2 次氯酸钠质量浓度对氨基脲产生量的影响
Table 2 Effect of immersion concentration on the production of semicarbazide

指标次氯酸钠质量浓度/(g/L)0.050.10.20.512毛肚氨基脲含量/(μg/kg)/1.863.356.1411.5221.70鸭肠氨基脲含量/(μg/kg)/1.222.434.859.7418.26黄喉氨基脲含量/(μg/kg)/0.540.932.224.9810.18
注:/表示未检出氨基脲。
利用相同质量浓度的次氯酸钠溶液处理毛肚、鸭肠和黄喉,氨基脲生成量不同,可能由于黄喉表面组织比较致密,次氯酸钠渗入量较少;也可能与样品的氨基酸组成差异及样品表面积差异有关,有待进一步研究。
2.2 浸泡时间对氨基脲产生量的影响
为系统考察浸泡时间对氨基脲产生量的影响,25 ℃条件下,采用pH为7质量浓度为1 g/L次氯酸钠溶液分别浸泡毛肚、鸭肠和黄喉,浸泡时间分别为0.5、1、3、5、8、12 h,浸泡后进行测定,结果见表3。由表3可知,次氯酸钠浸泡0.5~3 h内,氨基脲生成量变化较小,随着浸泡时间的延长,氨基脲的生成量也逐渐增加,氨基脲的生成量与浸泡时间呈正相关性。因此,为了尽量控制并减少水发食品中的生成氨基脲,应尽量缩短消毒处理时间。
表3 次氯酸钠浸泡时间对氨基脲产生量的影响
Table 3 Effects of soaking time on the production of semicarbazide
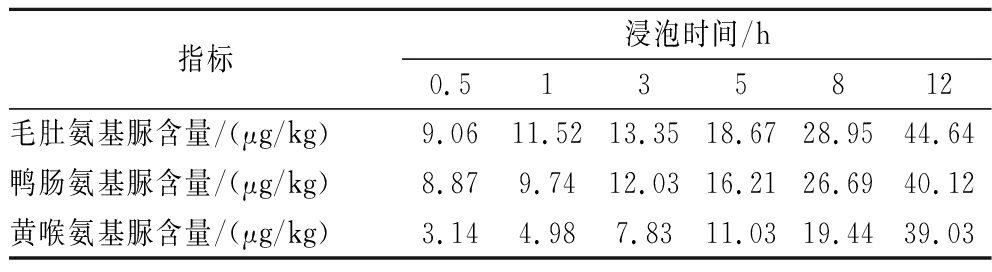
指标浸泡时间/h0.5135812毛肚氨基脲含量/(μg/kg)9.0611.5213.3518.6728.9544.64鸭肠氨基脲含量/(μg/kg)8.879.7412.0316.2126.6940.12黄喉氨基脲含量/(μg/kg)3.144.987.8311.0319.4439.03
2.3 浸泡溶液pH对氨基脲产生量的影响
次氯酸钠溶液pH值越小,稳定性越差,pH值在7以上,较稳定。25 ℃条件下,用质量浓度为1 g/L、pH为7、9、10、11、12的次氯酸钠溶液分别浸泡毛肚、鸭肠和黄喉1 h,浸泡后进行测定,测定结果见表4。从表4可以看出,毛肚、鸭肠和黄喉中氨基脲生成量随pH增大而显著增多。BENDALL[17]研究表明,高pH较高时,次氯酸钠与有利于生成氨基异氰酸,继而与尿素反应生成氨基脲。此外,pH值次氯酸钠溶液的稳定性有较大影响,低pH时,次氯酸钠容易分解,高pH时,次氯酸钠分解速度相对减慢[18]。由于高pH会加速生成氨基脲,利用次氯酸钠消毒处理水发食品时,应将次氯酸钠溶液pH控制在7~9。
表4 浸泡溶液pH对氨基脲产生量的影响
Table 4 Effects of soaking pH on the production of semicarbazide

指标次氯酸钠溶液pH79101112毛肚氨基脲含量/(μg/kg)2.062.6216.5245.23140.47鸭肠氨基脲含量/(μg/kg)1.782.1614.7437.25124.59黄喉氨基脲含量/(μg/kg)1.011.5910.9833.07106.91
2.4 浸泡温度对氨基脲产生量的影响
为尽可能覆盖食品企业生产环境温度,采用pH为7、质量浓度为1 g/L次氯酸钠溶液浸泡毛肚、鸭肠和黄喉,温度分别设为4、15、25、37 ℃,浸泡1 h后进行测定,结果见表5。由表5可知,4 ℃浸泡条件下,仅毛肚中检出了氨基脲,鸭肠和黄喉中均为未检出氨基脲,可见,较低温度下不利于生成氨基脲。在所考察的浸泡温度内,随着浸泡温度的升高,氨基脲的生成量逐渐增加,氨基脲的生成量与浸泡时间呈正相关性。可能是因为浸泡温度升高,动物组织纤维空隙增大,与次氯酸钠接触的表面积也随之增加,反应更充分,产生的氨基脲也就越多。25 ℃浸泡条件氨基脲生成量是15 ℃浸泡条件下的约2~4倍,但37 ℃浸泡条件氨基脲生成量较25 ℃浸泡条件下变化较小,可能是因为温度超过30 ℃后,次氯酸钠容易分解,导致氨基脲生成量变化不显著。因此,利用次氯酸钠消毒处理水发食品时,应控制温度低于15 ℃。
表5 浸泡温度对氨基脲产生量的影响
Table 5 Effects of soaking temperature on the production of semicarbazide

指标浸泡温度/℃4152537毛肚氨基脲含量/(μg/kg)2.155.3811.5216.34鸭肠氨基脲含量/(μg/kg)/3.099.7412.42黄喉氨基脲含量/(μg/kg)/1.314.987.60
2.5 漂洗次数对氨基脲产生量的影响
25 ℃条件下,采用pH为7、质量浓度为1 g/L次氯酸钠溶液浸泡毛肚、鸭肠和黄喉,浸泡1 h后,分别用清水漂洗1次和2次,漂洗时间为5 min,漂洗后进行测定,结果见表6。由表6可知,经第1次漂洗后,氨基脲降低较多,第2次漂洗后,氨基脲较第1次漂洗变化较小。实验说明水发食品在次氯酸钠溶液作用下生成的氨基脲部分为游离态,可经清水漂洗适当降低。
表6 漂洗次数对氨基脲产生量的影响
Table 6 Effects of rinsing times on the production of semicarbazide

指标漂洗次数012毛肚氨基脲含量/(μg/kg)11.525.034.65鸭肠氨基脲含量/(μg/kg)9.743.743.38黄喉氨基脲含量/(μg/kg)4.982.692.43
3 结论
本实验在不同条件下采用次氯酸钠消毒剂浸泡处理毛肚、鸭肠和黄喉等水发食品,研究结果显示,经次氯酸钠消毒剂浸泡处理后水发食品中会生成氨基脲,且毛肚、鸭肠和黄喉等不同的水发食品氨基脲生成量存在差异。氨基脲的生成量与次氯酸钠溶液质量浓度、浸泡时间、浸泡溶液pH、浸泡温度呈正相关性;而漂洗可有效减少氨基脲的生成。利用次氯酸钠溶液消毒处理水发食品时,应尽量用质量浓度小于0.5 g/L、pH值7~9的次氯酸钠在温度低于15 ℃、0.5 h内进行,且处理后用清水漂洗。水发食品中的氨基脲不仅来源于动物源性食品前期饲养阶段使用的呋喃西林药物,还与食品消毒处理过程中使用的次氯酸钠有关系。因此,水发食品生产企业生产过程应控制和减少使用次氯酸钠消毒剂,尽量避免氨基脲污染给人体健康带来的危害。
[1] HIRAKAWA K, MIDORIKAWA K, OIKAWA S, et al.Carcinogenic semicarbazide induces sequence-specific DNA damage through the generation of reactive oxygen species and the derived organic radicals[J].Mutation Research-Genetic Toxicology and Environmental Mutagenesis, 2003, 536(1/2):91-101.
[2] 高素, 汝少国.氨基脲的毒性效应研究进展[J].环境科学研究, 2013, 26(6):637-644.
GAO S, RU S G.Research progress on the toxicity of semicarbazide[J].Research of Environmental Sciences, 2013, 26(6):637-644.
[3] LEITNER A, ZÖLLNER P, LINDNER W.Determination of the metabolites of nitrofuran antibiotics in animal tissue by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2001, 939(1-2):49-58.
[4] 辛少平, 邓建朝, 杨贤庆, 等.高效液相色谱法测定硝基呋喃类药物代谢物及其在对虾体内的代谢[J].食品科学, 2014, 35(24):151-157.
XIN S P, DENG J C, YANG X Q, et al.Determination of nitrofuran metabolites by high performance liquid chromatography and their metabolism in shrimp[J].Food Science, 2014, 35(24):151-157.
[5] JOHNSTON J, DUVERNA R, WILLIAMS M, et al.Investigating the suitability of semicarbazide as an indicator of preharvest nitrofurazone use in raw chicken[J].Journal of Food Protection, 2020, 83(8):1368-1373.
[6] 程波, 舒秀君, 宋蓓, 等.甲壳类水产品氨基脲残留来源研究进展[J].广东海洋大学学报, 2018, 38(5):93-98.
CHENG B, SHU X J, SONG B, et al.Advance in research on other sources that are linked neither to the illegal use of nitrofurazone in crustacean aquatic products[J].Journal of Guangdong Ocean University, 2018, 38(5):93-98.
[7] YU W L, LIU W H, SANG Y X, et al.Analysis of endogenous semicarbazide during the whole growth cycle of litopenaeus vannamei and its possible biosynthetic pathway[J].Journal of Agricultural and Food Chemistry, 2019, 67(29):8235-8242.
[8] 黄晓姗, 关铭鑫, 杭义萍.面制品添加剂偶氮甲酰胺热处理下转化为氨基脲的研究[J].分析测试学报, 2018, 37(8):977-980.
HUANG X S, GUAN M X, HANG Y P.Study on degradation of flour additive azodicarbazide to semicarbazide under heat treatment[J].Journal of Instrumental Analysis, 2018, 37(8):977-980.
[9] AHMAD ZAUZI N S, ARIFF Z M, KHIMI S R.Foamability of natural rubber via microwave assisted foaming with azodicarbonamide (ADs) as blowing agent[J].Materials Today: Proceedings, 2019, 17(3):1001-1007.
[10] 黎娟, 曹民, 王翠苹, 等.高效液相色谱-四极杆/离子阱质谱确证测定面粉及面制品中氨基脲[J].分析测试学报, 2017, 36(4):490-495.
LI J, CAO M, WANG C P, et al.Identification and detection of semicarbazide in flour and flour products by high performance liquid chromatography coupled to quadrupole/linear ion trap mass spectrometry[J].Journal of Instrumental Analysis, 2017, 36(4):490-495.
[11] HOENICKE K, GATERMANN R, HARTIG L, et al.Formation of semicarbazide (SEM) in food by hypochlorite treatment:Is SEM a specific marker for nitrofurazone abuse?[J].Food Additives and Contaminants, 2004, 21(6):526-537.
[12] 曹爱玲, 余招锋, 陈怡琳, 等.动物源食品中呋喃西林及其代谢物氨基脲研究进展[J].中国动物检疫, 2019, 36(6):62-67.
CAO A L, YU Z F, CHEN Y L, et al.Research progress on nitrofurazone and its metabolite of semicarbazide in animal-derived food[J].China Animal Health Inspection, 2019, 36(6):62-67.
[13] 沈金灿, 谢冬冬, 康海宁, 等.次氯酸钠消毒处理条件对鸡爪中氨基脲残留的影响[J].食品科学, 2015, 36(10):1-5.
SHEN J C, XIE D D, KANG H N, et al.Influence of disinfection conditions with sodium hypochlorite on semicarbazide residue in chicken claw[J].Food Science, 2015, 36(10):1-5.
[14] 杨春梅, 曾议霆, 吴宇, 等.次氯酸钠消毒剂对猪黄喉中氨基脲生成量的影响[J].食品安全质量检测学报, 2021, 12(8):3071-3077.
YANG C M, ZENG Y T, WU Y, et al.Effect of sodium hypochlorite disinfectant on the production of semicarbazone in pig aorta[J].Journal of Food Safety and Quality, 2021, 12(8):3071-3077.
[15] 袁涛, 田国华, 吴伟, 等. 次氯酸钠、酒精及穿串用竹签对鸡肉产品中呋喃西林代谢物检测结果的影响研究. 中国家禽, 2011, 33(20):18-20; 23.
YUAN T, TIAN G H, WU W, et al. Effect of sodium hypochlorite, alcohol and bamboo skewer on nitrofurazone metabolite in chicken products. China Poultry, 2011, 33(20):18-20; 23.
[16] 叶刚, 梁通雯, 淮文蓓, 等.过氧乙酸消毒液处理动物性食品后氨基脲的生成量变化[J].食品科学, 2016, 37(17):190-194.
YE G, LIANG T W, HUAI W B, et al.Differences of semicarbazide content in animal-derived foods disinfected by peroxyacetic acid disinfectant[J].Food Science, 2016, 37(17):190-194.
[17] BENDALL J G.Semicarbazide is non-specific as a marker metabolite to reveal nitrofurazone abuse as it can form under Hofmann conditions[J].Food Additives Contaminants:Part A, 2009, 26(1):47-56.
[18] 李杰, 张文福.次氯酸钠消毒液稳定性研究进展[J].中国消毒学杂志, 2015, 32(12):1233-1237.
LI J, ZHANG W F.Research progress on stability of sodium hypochlorite disinfectant[J].Chinese Journal of Disinfection, 2015, 32(12):1233-1237.