小麦是世界三大粮食作物之一,也是我国的主要粮食作物之一,我国是世界最大的小麦生产国和消费国。小麦籽粒中含有丰富的淀粉、脂肪、蛋白质、矿物质等营养物质,主要用于制粉并加工成面制品为人类活动提供热量。此外,小麦籽粒还含有丰富的生物活性植物化学物质,如酚类化合物、γ-氨基丁酸、类胡萝卜素等[1],具有抗氧化、降低心血管疾病、预防癌症和糖尿病等功能[2],其中酚类物质被认为是谷物抗氧化能力的最重要贡献者,近年来备受关注[3]。另据报道,小麦发芽后其营养成分、生物活性物质及抗营养因子发生显著变化,尤其是酚类物质变化较大[4]。VAN等[5]研究发现,加拿大小麦发芽后总酚含量和抗氧化能力显著提高,其中游离酚酸的增幅较大,![]() 等[6]对发芽的波兰小麦进行研究得出同样结论,然而GAWLIK-DZIKI等[7]和CHEN等[8]分别对塞尔维亚小麦种子和中国小麦种子萌发过程进行研究,发现小麦游离态和结合态的酚类化合物都显著提高。迄今为止,关于小麦发芽过程中酚类物质变化的研究还不够充分,这限制了发芽小麦作为一种功能性食品原料的广泛应用。
等[6]对发芽的波兰小麦进行研究得出同样结论,然而GAWLIK-DZIKI等[7]和CHEN等[8]分别对塞尔维亚小麦种子和中国小麦种子萌发过程进行研究,发现小麦游离态和结合态的酚类化合物都显著提高。迄今为止,关于小麦发芽过程中酚类物质变化的研究还不够充分,这限制了发芽小麦作为一种功能性食品原料的广泛应用。
酚类物质合成以苯丙烷代谢途径为主,其合成途径为:由L-苯丙氨酸经苯丙氨酸解氨酶(phenylalanine ammonia lyase, PAL)脱氨基,形成反式肉桂酸,在肉桂酸-4-羟化酶(cinnamic acid 4-hydroxylase, C4H)和4-香豆酸辅酶A连接酶(4-coumaric acid:CoA ligase, 4CL)等作用下生成黄酮类、酚酸和花色苷类等酚类物质[9]。谷物籽粒萌发时生理生化过程得以调控,物质代谢流向改变,酚类物质呈现动态变化。以往关于小麦中酚类物质的研究主要集中于不同品种原料籽粒及组织部位中含量变化,关注点更多在于对酚类物质变化结果的分析,而对于发芽过程中小麦酚类物质及其合成途径中关键酶活力、抗氧化能力的动态变化还缺乏系统研究。基于此,本研究以大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个品种小麦为研究对象,探讨在不同发芽阶段下,小麦苗总酚含量、酚类物质合成关键酶PAL、C4H、4CL活力及抗氧化能力的变化,为研发谷物芽苗健康食品提供科学依据和技术支撑。
1 材料与方法
1.1 材料与试剂
小麦:品种为大平原1号、秋乐6号、秋乐168、郑麦163和百农307购自河南省秋乐种业科技有限公司,2020年收获,置于-20 ℃下保存。
培养条件:称取经过挑选、除杂后的小麦籽粒,用0.5%(体积分数)的NaClO溶液以料液比1:5(g:mL)消毒15 min,用去离子水浸泡6 h。然后将小麦籽粒均匀放置于有自动喷淋装置的小型发芽机中进行发芽,发芽机置于湿度80%,25 ℃的恒温培养箱中。采用LED白光照射,每天照射12 h。分别在第2、4、6天取样(0 d为原料种子),用于后续指标检测。
甲醇和乙酸乙酯,广东光华科技股份有限公司;福林酚、DPPH、ABTS、Trolox、没食子酸,Sigma-Aldrich公司;盐酸、碳酸钠、氢氧化钠、抗坏血酸,国药集团化学试剂有限公司。
1.2 仪器与设备
MS-04SU型磁力搅拌器,苏州捷美电子有限公司;WH-861型涡旋器,太仓市华利达实验设备有限公司;UV-5100B型紫外可见分光光度计,上海元析仪器有限公司;MS-04SU型磁力搅拌器,苏州捷美电子有限公司。
1.3 实验方法
1.3.1 生长状况测定
随机选取30株小麦芽苗,测定其芽长/根长,取其平均值,结果表示为mm/株。随机选取100株小麦芽苗,测定其鲜重/干重,取其平均值,结果表示为g/100株。
1.3.2 游离和结合酚类物质提取
游离和结合酚类化合物提取方法在MA等[10]方法的基础上作适当的修改。将小麦苗冷冻干燥、粉碎并过60目的筛网后,取小麦苗粉1 g,加20 mL 80%(体积分数)甲醇,于试管架上手摇10 min,然后在10 000×g,4 ℃条件下离心10 min,重复此操作3次并把离心后的提取液合并旋转蒸发至干,定容后作为游离酚提取液。提取游离酚后的沉淀物加入2 mol/L NaOH后避光振荡水解4 h,然后将得到的水解液调整pH值为1.8,乙酸乙酯与水解液充分混合后离心10 min,取上层乙酸乙酯层,重复此操作3次后合并乙酸乙酯层旋转蒸发至干,定容后作为结合酚提取液。
1.3.3 总酚含量
总酚含量的测定参照CHEN等[8]的方法。以没食子酸作为标准品,通过标准曲线计算总酚含量,总酚含量用mg GAE(gallic acid equivalents)/100 g DW(dry weight)表示。
1.3.4 PAL活力
PAL的提取与测定参照ASSIS等[11]的方法。取小麦苗,以料液比1:10(g:mL)加入预冷的缓冲液,研磨离心后取上清液加入硼砂缓冲液、L-苯丙氨酸溶液,于37 ℃ 保温60 min,在290 nm下测定吸光值。以每小时每克小麦苗(鲜重)酶促反应体系吸光度值增加0.01 为一个PAL活力单位(U),表示为0.01ΔOD290/(h·g FW),即U/g FW(fresh weight)。
1.3.5 C4H活力
C4H的提取与测定参照HAN等[12]的方法。取小麦苗,以料液比1:10加入预冷的缓冲液,研磨离心后取上清液加入磷酸缓冲液、肉桂酸、NADPH,于30 ℃保温20 min,在340 nm下测定吸光值。以每分钟每克小麦苗(鲜重)酶促反应体系吸光度值增加0.01为一个C4H活力单位(U),表示为0.01ΔOD340/(min·g FW),即U/g FW(fresh weight)。
1.3.6 4CL活力
4CL的提取与测定参照HAN等[12]的方法。取小麦苗,以料液比1:10加入预冷的缓冲液,研磨离心后取上清液加入MgCl2、ATP、CoA、对香豆酸,于40 ℃保温10 min,在333 nm下测定吸光值。以每分钟每克小麦苗(鲜重)酶促反应体系吸光度值增加0.01为一个4CL活力单位(U),表示为0.01ΔOD 333/min·g FW,即U/g FW(fresh weight)。
1.3.7 ABTS阳离子自由基和DPPH自由基清除能力
ABTS阳离子自由基和DPPH自由基清除能力的测定参照MA等[10]的方法。以Trolox配制标准曲线,ABTS阳离子自由基和DPPH自由基清除能力以μmol TE/g DW(dry weight)计。
1.4 数据处理和统计分析
设计3次生物学重复实验,结果以平均值(means)±标准偏差(SD)表示。数据采用SPASS 20.0进行统计分析,显著性水平为P<0.05。
2 结果与分析
2.1 发芽对小麦苗生长状况的影响
随着发芽时间的延长,大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个品种小麦的芽长、根长和鲜重均呈增加趋势(图1-A~图1-C),而干重则下降(图1-D)。其中芽长在发芽前期增加幅度较大,4 d时5个品种小麦的芽长均是2 d的3倍以上,而发芽6 d时5个品种小麦的芽长则是4 d的1.5~2.0倍。秋乐168和郑麦163在发芽全程保持较高的长势。鲜重的变化趋势与芽长变化一致,也是在发芽前期的增长幅度大于后期。5个品种小麦的根长和干重则在整个发芽期间保持相对稳定的变化速率。

A-芽长; B-根长; C-鲜重;D-干重
图1 不同小麦品种发芽期间生长状况变化
Fig.1 Changes of growth status in different wheat varieties during germination
注: 不同小写字母表示在同一发芽时间下不同品种间差异显著(P<0.05)(下同)。
2.2 发芽对小麦苗总酚含量的影响
随着发芽时间的延长,大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个品种小麦的游离酚含量、结合酚和总酚含量均呈增加趋势(图2)。发芽2 d时,大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个小麦品种游离酚含量分别较未发芽种子增加92%、51%、52%、86%和111%;发芽4 d时,大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个小麦品种游离酚含量分别较发芽2 d时增加68%、50%、81%、37%和51%,其中秋乐168小麦苗的游离酚含量为193 mg GAE/100 g DW,显著高于其他品种(P<0.05),秋乐6号小麦苗的游离酚含量最低;发芽6 d时,大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个小麦品种游离酚含量分别较第4天时增加88%、84%、54%、110%和120%,游离酚增幅最大的为百农307,其次为郑麦163、秋乐168,增幅最小的为秋乐6号。由于百农307和郑麦163游离酚增幅较大,到第6天时,二者含量已和秋乐168接近,均显著高于另外2个品种(P<0.05)。对于结合酚而言,5个小麦品种中秋乐168具有最高的结合酚含量,且均显著高于其他品种,秋乐6号次之,百农307含量最低。与发芽第4天相比,5个品种小麦结合酚含量分别增加48%、43%、34%、110%和120%,其涨幅变化与游离酚变化基本一致。发芽过程中随着游离酚和结合酚含量的提高,小麦苗的总酚含量也大幅提高,秋乐168在发芽全程都具有最高的总酚含量。
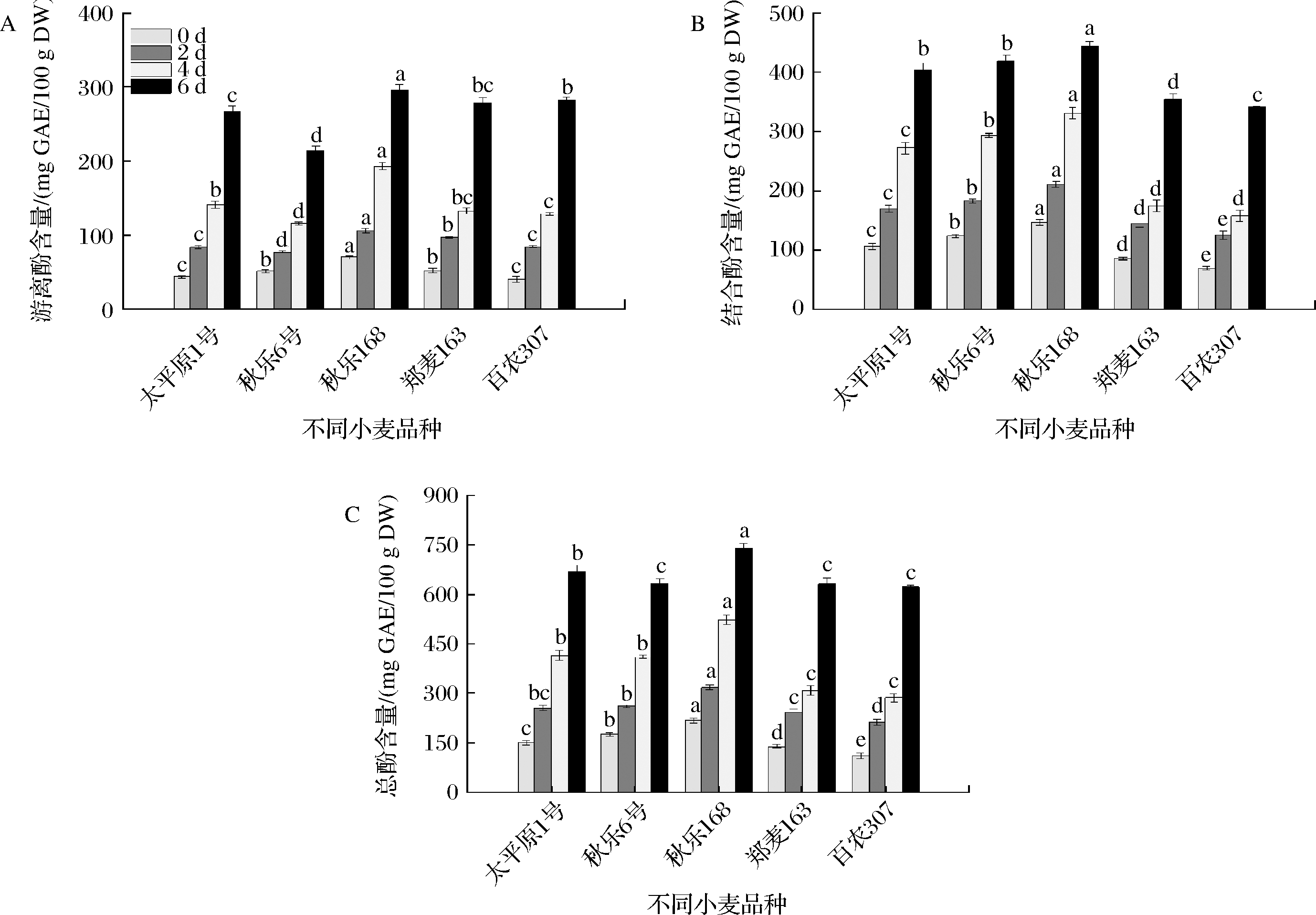
A-游离酚; B-结合酚;C-总酚
图2 不同小麦品种发芽期间总酚含量变化
Fig.2 Changes of phenolics contents in different wheat varieties during germination
2.3 发芽过程小麦苗游离和结合酚比例变化
如图3所示,发芽过程中游离酚占总酚含量的比值呈上升趋势,但是不同品种之间差异较大,未发芽时,大平原1号、秋乐6号、秋乐168、郑麦163和百农307游离酚占总酚含量的比值分别为31%、29%、32%、38%和38%;第2天时5个小麦品种游离酚占总酚含量的比值分别为33%、30%、34%、40%和41%;发芽第4天时,游离酚占总酚含量的比值分别为34%、31%、37%、43%和44%;第6天时其比值变为39%、34%、40%、44%和45%。结果显示,发芽使小麦苗中游离和结合酚类物质的比例发生了较大变化,进一步改善了小麦的功能品质。
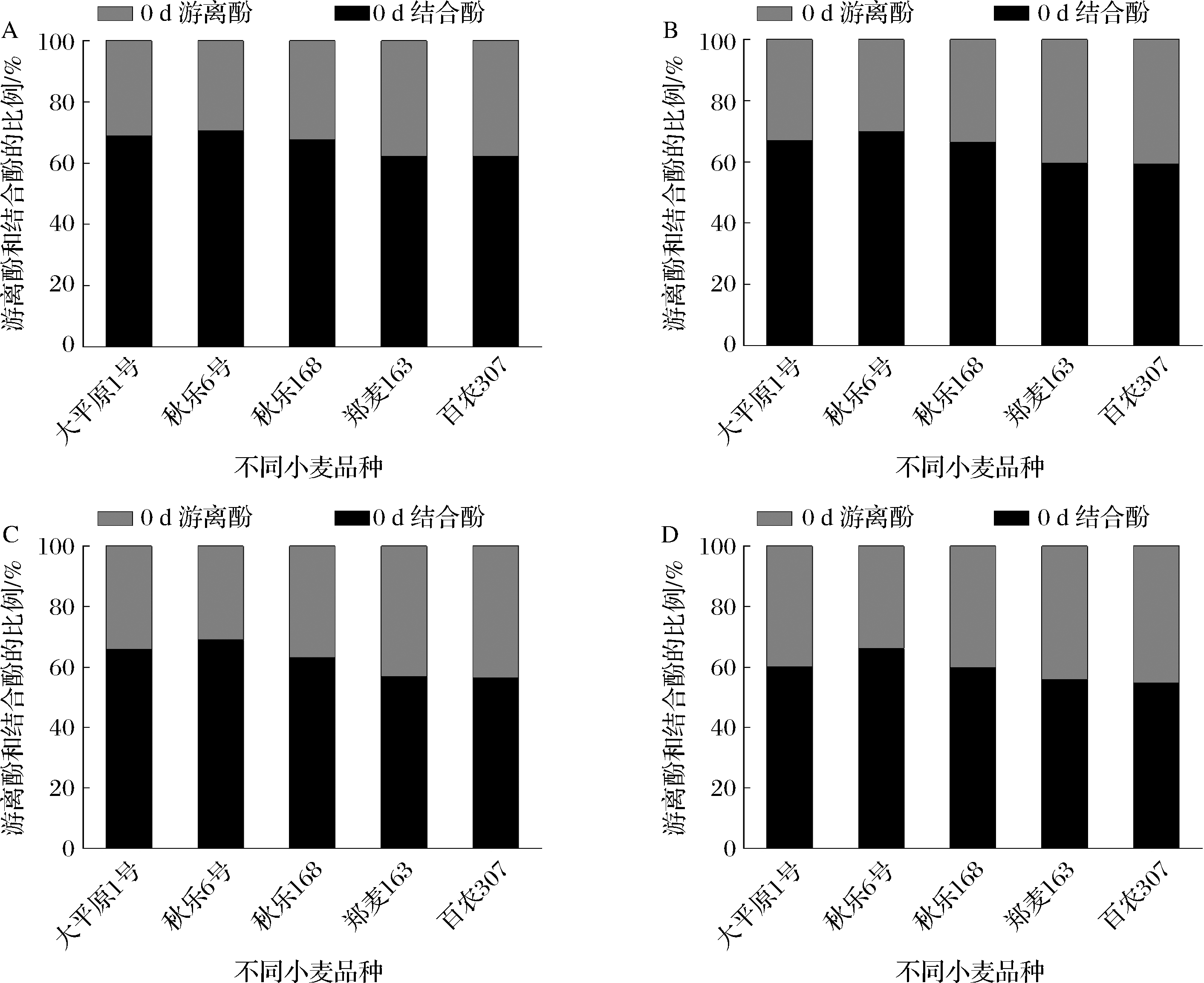
A-0 d; B-2 d; C-4 d;D-6 d
图3 不同小麦品种发芽期间游离酚类和结合酚类物质比例变化
Fig.3 Changes in the proportion of free and bound phenols in different wheat varieties during germination
2.4 发芽对小麦苗PAL、C4H和4CL活力的影响
PAL是苯丙烷代谢途径的第一步酶,也是重要的限速酶。如图4-A所示,随着发芽时间的延长,5个品种小麦苗的PAL活力均先增加后下降的趋势。发芽全程,秋乐168号小麦苗中PAL活力最高,显著高于其他4个品种(P<0.05),百农307的PAL活力最低。如图4-B所示,随着发芽时间的延长,5个品种的小麦苗C4H活力均呈上升趋势,发芽4 d时,大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个小麦品种C4H活力分别较发芽2 d增加47%、20%、45%、75%和48%;发芽6 d时,大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个小麦品种C4H活力分别较第4天时增加79%、81%、43%、2%和21%,品种间变化差异较大。4CL活力变化与PAL变化趋势一致,也是随着发芽时间的延长活力均先增加后下降的趋势(图4-C),但各个品种间差异较大。发芽2 d和4 d时,郑麦163活力显著高于其余4个品种;发芽6 d时,郑麦163小麦苗4CL活力与秋乐6之间无显著差异。

A-PAL; B-C4H; C-4CL
图4 不同小麦品种发芽期间PAL、C4H和4CL变化
Fig.4 Changes of PAL, C4H and 4CL during germination of different wheat varieties
2.5 发芽对小麦苗抗氧化能力的影响
由图5看出小麦苗的抗氧化能力随着发芽时间的延长而增加,游离态和结合态总酚的ABTS阳离子自由基和DPPH自由基清除能力均提高。发芽2 d时,大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个小麦品种小麦苗总酚的ABTS阳离子自由基清除能力分别较未发芽种子增加60%、42%、47%、84%和104%,DPPH自由基清除能力分别较未发芽种子增加60%、47%、48%、72%和90%;发芽4 d时,5个小麦品种小麦苗总酚的ABTS阳离子自由基清除能力分别较未发芽种子增加57%、57%、59%、25%和33%,DPPH自由基清除能力分别较第2天增加58%、52%、76%、41%和45%;发芽6 d时,5个小麦品种小麦苗总酚的ABTS阳离子自由基清除能力分别较第4天增加47%、35%、27%、70%和93%,DPPH自由基清除能力分别较未发芽种子增加56%、47%、20%、72%和90%。整体看来,小麦苗ABTS阳离子自由基清除能力和DPPH自由基清除能力变化趋势较为一致。

A-游离ABTS阳离子自由基; B-结合ABTS阳离子自由基; C-总ABTS阳离子自由基;D-游离DPPH自由基;B-E-结合DPPH自由基;F-总DPPH自由基
图5 不同小麦品种发芽期间抗氧化能力变化
Fig.5 Changes of antioxidant capacity of different wheat varieties during germination
2.6 小麦苗酚类物质和抗氧化能力相关性分析
对小麦苗酚类物质和抗氧化能力进行相关性分析。由表1可知,大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个小麦品种在不同生长阶段的总酚含量与ABTS阳离子自由基清除能力均在0.01水平上均呈现显著正相关。秋乐168在不同生长阶段的总酚含量与DPPH自由基清除能力在0.05水平上均呈现显著正相关,其余4个品种的麦苗在不同生长阶段的总酚含量与ABTS阳离子自由基清除能力均在0.01水平上均呈现显著正相关。
表1 小麦苗酚类物质和抗氧化能力相关性分析
Table 1 Correlation analysis between phenols and antioxidant capacity of Wheat Seedlings
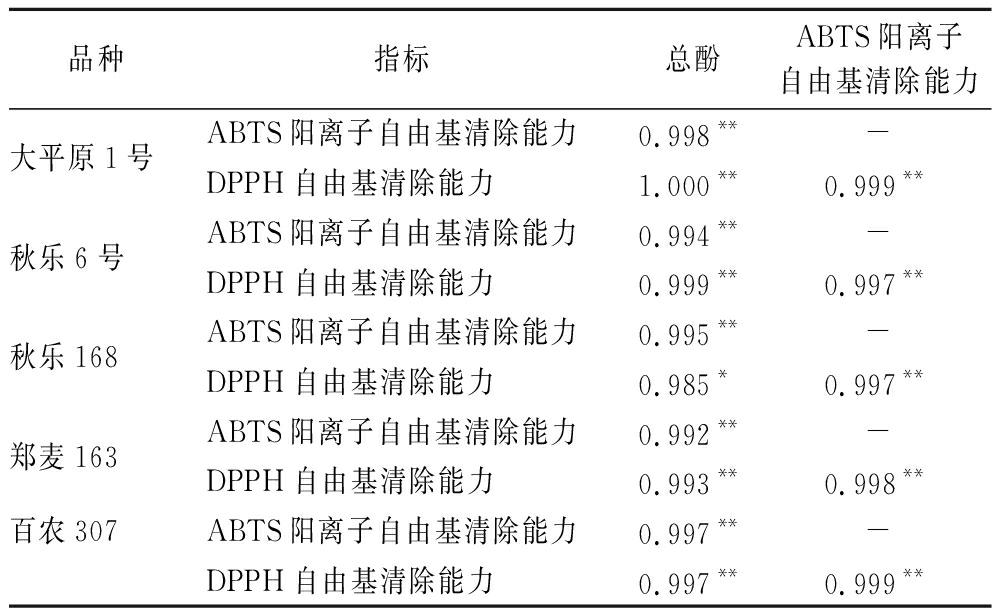
品种指标总酚ABTS阳离子自由基清除能力大平原1号ABTS阳离子自由基清除能力0.998**-DPPH自由基清除能力1.000**0.999**秋乐6号ABTS阳离子自由基清除能力0.994**-DPPH自由基清除能力0.999**0.997**秋乐168ABTS阳离子自由基清除能力0.995**-DPPH自由基清除能力0.985*0.997**郑麦163ABTS阳离子自由基清除能力0.992**-DPPH自由基清除能力0.993**0.998**百农307ABTS阳离子自由基清除能力0.997**-DPPH自由基清除能力0.997**0.999**
注:-表示无;**在0.01水平上显著相关,*在0.05水平上显著相关。
3 讨论
本研究中,大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个小麦品种的芽长、根长和鲜重随着发芽时间的延长而增加(图1)。小麦芽苗在不同萌发阶段的生长情况不同,在本研究的3个发芽阶段(0~2 d、2~4 d、4~6 d)中小麦苗生长表现出典型的“慢-快-慢”趋势:0~2 d发芽减慢,2~4 d发芽加快,4~6 d发芽减慢,这与ZHOU等[13]的研究结果相似。谷物发芽时,直链淀粉和支链淀粉水解成单糖,贮藏蛋白水解成肽和氨基酸,因而干重下降,植酸酶活性增加降解多余植酸盐,从而提高了营养物质的生物利用率[14]。与此同时,发芽使得谷物中γ-氨基丁酸、类黄酮和酚酸等生理活性成分含量增加,谷物抗氧化、抗菌消炎、免疫力调节等功效增强,营养价值和保健功能得到提升。本研究比较了不同品种小麦籽粒中游离、结合及总酚含量,结果表明发芽能够显著提高小麦的酚类物质含量(图2),这与前人研究结果一致[15-16]。谷物中的多酚类化合物包括酚酸、花青素、醌类、黄酮醇、查耳酮、黄酮、黄烷酮类等[17],酚类物质一部分以游离态存在,另一部分与蛋白质、木聚糖、纤维素和半纤维素等结合存在于植物的细胞壁中[18]。以往关于酚类物质的研究对象主要为蔬菜和水果,对于谷物中酚类物质的研究有限,由于酚类物质提取和纯化工艺的进步,使得谷物中大量结合态酚类物质(酚酸)被发现,结合酚的抗氧化能力也陆续得到证实,谷物的营养价值被重新认定,成为膳食多酚的重要来源之一。值得注意的是,本研究特别关注了小麦发芽期间游离和结合总酚比例的变化,发现发芽过程中游离酚占总酚含量的比值呈上升趋势(图3),这与他人研究中小麦等谷物游离态酚类物质含量增加结论明显一致,可能是由于发芽期间籽粒生命活动增强,苯丙烷代谢途径被激活,相关酶的活动使得与细胞壁等结构结合的酚类物质释放出来[6]。
酚类物质含量的增加与酚类物质合成途径的关键酶活力变化有关,目前关于植物食品原料中酚类物质的研究主要集中于游离态、酯化和结合态酚酸的提取和纯化工艺[19],酚类物质组分及含量的分析[8,20]以及生理活性[21-22]等方面。对于酚类物质合成关键酶活力关注较少,对于酶活力与酚类物质含量相关性分析研究尚浅。PAL在植物次生代谢过程中有重要作用,迄今为止,已证实PAL参与花青素积累、木质化、黄酮类物质合成以及病虫害防御等多种生理过程[23]。PAL是苯丙烷代谢途径的限速酶,其活力对酚类物质的形成速率有重要影响。本研究中,发芽前期,PAL的变化趋势与5个品种小麦苗的总酚含量变化趋势一致,均是随着发芽时间的延长而持续提高,这是酚类物质积累的直接原因,发芽后期PAL酶活力下降,但酚类物质持续增加,这可能是因为酶活力呈动态变化,而取样时间点有限,此外,PAL活力虽然有所下降,但仍高于发芽初期,这也使得酚类物质持续积累,含量增加。在不同发芽阶段,5个品种小麦苗酚类物质含量与PAL酶活均呈显著或极显著正相关(P<0.05或P<0.01),其中秋乐168PAL酶活最强,其也具有最高的酚类物质含量。C4H在植物组织中具有很高的活性,是黄酮类物质合成的关键酶[24],本研究中,C4H与5个品种小麦苗的总酚含量在发芽全过程变化一致,都是随着发芽时间的延长而增加。4CL于1976年由MANSELL等首次从嫩柳枝中提取,4CL酶处在苯丙烷类代谢中合成特定产物的转折点上,其可生成绿原酸、羟基肉桂酸等酚酸类物质,也可以作为重要的前体物质介入类黄酮代谢[9]。发芽全过程4CL的变化趋势与PAL较为一致,在发芽前期增加,后期略有下降,不同品种间表现出一致性(图4)。在发芽前期阶段(2 d,4 d),5个品种小麦苗酚类物质含量与C4H和4CL酶活相关性较弱,但在发芽后期(6 d)酚类物质含量与C4H和4CL酶活表现出较强正相关。
大量研究表明,酚类物质通常被认为是对人体健康有益的一类生物活性物质,主要是因为它们具有较强的抗氧化活性。本研究采用ABTS阳离子自由基和DPPH自由基清除能力评价小麦苗的抗氧化能力,这2种评价方法都是基于电子转移并涉及有色氧化剂还原,目前已被广泛用来评价谷物及果蔬的抗氧化能力。研究结果表明小麦苗的抗氧化能力随着发芽时间的延长而增加,游离态和结合态总酚的ABTS阳离子自由基和DPPH自由基清除能力均提高(图5)。对小麦苗酚类物质和抗氧化能力进行相关性分析发现,不同生长阶段麦苗的总酚含量与ABTS阳离子自由基和DPPH自由基清除能力均呈现极显著正相关(表1),说明酚类物质的积累是提高抗氧化能力的重要条件。
本研究分析了不同品种小麦苗发芽过程中酚类含量、酚类合成关键酶活力以及抗氧化能力的变化,可为小麦苗产品开发提供一定理论基础。总所周知,酚类物质种类众多,包括酚酸、黄酮、缩合单宁、木脂素等几大类8 000多种物质,且在不同原料中的含量和种类差异较大,基于此,后续工作应加强对小麦苗酚类物质鉴定分析,深入研究小麦苗发芽过程酚类物质的组成、存在形式及含量变化,系统性构建小麦苗发芽过程酚类物质变化图谱。
4 结论
谷物营养价值高,富含膳食纤维、维生素和矿物质,发芽可提高谷物中各营养元素的含量,且可显著提高籽粒生物活性成分,赋予其更多生理活性功能,用来开发功能食品。本研究聚焦于发芽对大平原1号、秋乐6号、秋乐168、郑麦163和百农307五个品种小麦苗酚类物质形成及抗氧化能力的影响,结果表明,发芽激活了小麦苗酚类物质合成关键酶,随着发芽时间的延长小麦苗酚类物质显著增加,抗氧化能力显著增强。该研究结果可为小麦深加工提供新思路,为开发富含酚类物质等其他功能成分的谷物食品奠定理论基础,对促进国民经济和社会发展有重要意义。
[1] KTENIOUDAKI A, ALVAREZ-JUBETE L, GALLAGHER E.A review of the process-induced changes in the phytochemical content of cereal grains:The breadmaking process[J].Critical Reviews in Food Science &Nutrition, 2015, 55(5):611-619.
[2] AUNE D, KEUM N, GIOVANNUCCI E, et al.Whole grain consumption and risk of cardiovascular disease, cancer, and all cause and cause specific mortality:Systematic review and dose-response meta-analysis of prospective studies[J].BMJ, 2016, 353:i2716.
[3] SINGH A, SHARMA S.Bioactive components and functional properties of biologically activated cereal grains:A bibliographic review[J].Critical Reviews in Food Science and Nutrition, 2017, 57(14): 3051-3071.
[4] GHUMMAN A, SINGH N, KAUR A.Chemical, nutritional and phenolic composition of wheatgrass and pulse shoots[J].International Journal of Food Science &Technology, 2017, 52(10):2191-2200.
[5] VAN HUNG P, HATCHER D W, BARKER W.Phenolic acid composition of sprouted wheats by ultra-performance liquid chromatography (UPLC) and their antioxidant activities[J].Food Chemistry, 2011, 126(4):1896-1901.
[6] ![]() S,
S, ![]() V, et al.Can the sprouting process applied to wheat improve the contents of vitamins and phenolic compounds and antioxidant capacity of the flour?[J].International Journal of Food Science &Technology, 2014, 49(4):1040-1047.
V, et al.Can the sprouting process applied to wheat improve the contents of vitamins and phenolic compounds and antioxidant capacity of the flour?[J].International Journal of Food Science &Technology, 2014, 49(4):1040-1047.
[7] GAWLIK-DZIKI U, DZIKI D, NOWAK R, et al.Influence of sprouting and elicitation on phenolic acids profile and antioxidant activity of wheat seedlings[J].Journal of Cereal Science, 2016, 70:221-228.
[8] CHEN Z J, WANG P, WENG Y, et al.Comparison of phenolic profiles, antioxidant capacity and relevant enzyme activity of different Chinese wheat varieties during germination[J].Food Bioscience, 2017, 20:159-167.
[9] VOGT T.Phenylpropanoid biosynthesis[J].Molecular Plant, 2010, 3(1):2-20.
[10] MA Y, WANG P, WANG M, et al.GABA mediates phenolic compounds accumulation and the antioxidant system enhancement in germinated hulless barley under NaCl stress[J].Food Chemistry, 2019, 270:593-601.
[11] ASSIS J S, MALDONADO R, MU OZ T, et al.Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J].Postharvest Biology and Technology, 2001, 23(1):33-39.
OZ T, et al.Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J].Postharvest Biology and Technology, 2001, 23(1):33-39.
[12] HAN C, LI J, JIN P, et al.The effect of temperature on phenolic content in wounded carrots[J].Food Chemistry, 2017, 215:116-123.
[13] ZHOU S Y, ZHANG Q.The influence of difference temperature on the growth of soybean sprouts[J].Gansu Science and Technology, 2012, 28, 142-143.
[14] MÜNTZ K.Proteases and proteolytic cleavage of storage proteins in developing and germinating dicotyledonous seeds[J].Journal of Experimental Botany, 1996, 47(5):605-622.
[15] BENINCASA P, GALIENI A, MANETTA A C, et al.Phenolic compounds in grains, sprouts and wheatgrass of hulled and non-hulled wheat species[J].Journal of the Science of Food &Agriculture, 2015, 95(9):1795-1803.
[16] ![]() M, DZIKI D.Improvement in sprouted wheat flour functionality:Effect of time, temperature and elicitation[J].International Journal of Food Science &Technology, 2015, 50(9):2135-2142.
M, DZIKI D.Improvement in sprouted wheat flour functionality:Effect of time, temperature and elicitation[J].International Journal of Food Science &Technology, 2015, 50(9):2135-2142.
[17] FARDET A.New hypotheses for the health-protective mechanisms of whole-grain cereals:What is beyond fibre?[J].Nutrition Research Reviews, 2010, 23(1):65-134.
[18] 马燕, 魏媛, 王冕, 等.谷物酚酸合成途径及代谢调控研究进展[J].食品科学, 2019, 40(15):269-276.
MA Y, WEI Y, WANG M, et al. A review of process in understand biosynthesis pathway and metabolic regulation of phenolic acids in cereals. Food Science, 2019, 40(15): 269-276.
[19] XU B J, CHANG S K C.A comparative study on phenolic profiles and antioxidant activities of legumes as affected by extraction solvents[J].Journal of Food Science, 2007, 72(2):S159-S166.
[20] ![]() U, DODURGA Y, ELMAS L, et al.Ferulic acid decreases cell viability and colony formation while inhibiting migration of MIA PaCa-2 human pancreatic cancer cells in vitro[J].Gene, 2016, 576(1):476-482.
U, DODURGA Y, ELMAS L, et al.Ferulic acid decreases cell viability and colony formation while inhibiting migration of MIA PaCa-2 human pancreatic cancer cells in vitro[J].Gene, 2016, 576(1):476-482.
[21] ALRAHMANY R, AVIS T J, TSOPMO A.Treatment of oat bran with carbohydrases increases soluble phenolic acid content and influences antioxidant and antimicrobial activities[J].Food Research International, 2013, 52(2):568-574.
[22] SHADLE G L, WESLEY S V, KORTH K L, et al.Phenylpropanoid compounds and disease resistance in transgenic tobacco with altered expression of L-phenylalanine ammonia-lyase[J].Phytochemistry, 2003, 64(1):153-161.
[23] OKARTER N, LIU C S, SORRELLS M E, et al.Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J].Food Chemistry, 2010, 119(1):249-257.
[24] SEWALT V J H, BLOUNT J W.Reduced lignin content and altered lignin composition in transgenic tobacco down-regulated in expression of L-phenylalanine ammonia-lyase or cinnamate 4-hydroxylase[J].Plant Physiology, 1997, 115(1):41-50.