沙枣是西北地区具有开发利用前景的重要资源,大果沙枣(Elaeagnus moorcroftii Wall. ex Schlecht.)是新疆南疆地区重要的防风固沙树种,其花、果、叶等均有经济价值,也是一种重要的经济树种[1]。大果沙枣可食部位营养丰富,具有多种功效价值,但其活性和药理学研究目前仍然处在初步阶段,主要以粗提物形式进行,并且主要集中于一个沙枣品种(Elaeagnus angustifolia L.)[2]。研究表明,沙枣中含有丰富的多酚类化合物,这些物质具有很好的营养价值和抗氧化、抗炎活性,对体内自由基的清除有着极大效果,可抑制脂质氧化、延缓衰老、预防肿瘤、防止多种疾病的发生,是一种天然绿色的抗氧化剂[3];因此继续开展对沙枣活性成分的研究并予以利用尤为重要。
多酚类化合物的经典提取方式主要为有机溶剂提取,为了减少有机挥发性溶剂对环境和人类带来的不利影响,近年来环境友好的绿色溶剂和创新技术备受关注,与传统有机溶剂提取相比,新型溶剂[例如水、超临界流体、生物基溶剂、离子液体和低共熔溶剂(deep eutectic solvents,DESs)]和微波、超声、加压等技术联用,可获得更安全、更高品质的植物提取物[4]。
DESs是环境友好型绿色溶剂中最为有效的一种溶剂,相对于有机溶剂毒性大、易挥发、易燃易爆的问题,DESs具有安全性高、成本低、绿色环保等优势[5]。除此之外,DESs和同为绿色溶剂的离子液体相比,不仅具有离子液体的提取效率高、易降解等优点,还能弥补离子液体具有一定毒性且易残留、成本高的缺点[6]。DESs作为有机溶剂的替代溶剂常用于多酚类化合物的提取研究。罗蓉等[7]利用DESs和乙醇超声辅助法提取山楂总黄酮,发现氯化胆碱-丙三醇作为DESs提取,其提取液中黄酮得率和抗氧化活性均优于传统的醇提法。王晓艺等[8]用同样方法比较DESs和有机溶剂提取玫瑰多酚的效率,发现用氯化胆碱-乳酸为DESs提取的多酚含量比醇提法提高了24%。这些研究表明,DESs应用于天然产物中多酚类化合物的提取比有机溶剂提取更具有显著的实际意义。
多酚类化合物通常以自由、共轭可溶和不可溶的形式被包裹在植物细胞中。DESs通过氢键作用力能更好地渗透进植物细胞,不仅可以高效地将多酚类化合物提取出来,而且更有助于保证酚类产品的安全。此外,通过超声波等加工技术辅助,还可提高DESs大规模提取酚类化合物的效率。因此,DESs提取方法作为从自然资源中提取酚类化合物的一种环境友好方法值得进一步探索开发。
本课题着眼于新疆南疆地区大果沙枣资源开发,通过超声辅助DESs提取新疆大果沙枣多酚类化合物的工艺,评价其体外抗氧化活性,对新的功能食品或药物的研发具有科学意义,为沙枣的开发利用可提供有效的理论依据。
1 材料与方法
1.1 材料与试剂
新疆大果沙枣,品种:金莎,产自新疆喀什地区莎车县阿瓦提镇,为新培育品种;氯化胆碱(>99.0%)、1,2-丙二醇(>99.0%)、乙二醇(>98.0%)、DPPH(纯度> 99.5%)、ABTS(纯度> 98.0%)、福林酚试剂,上海源叶生物科技有限公司;苹果酸,常茂生物化学工程股份有限公司;柠檬酸,天津永晟精细化工有限公司;乳酸,天津市天新精细化工开发中心;乙二醇,熬稞新材料科技有限公司;丙三醇,天津市恒兴化学试剂制造有限公司;无水葡萄糖,成都市科龙化工试剂厂;木糖醇,天津市光复精细化工研究所;果糖,北京酷来搏科技有限公司;尿素,天津市盛奥化学试剂有限公司;Trolox,美国Sigma公司;总抗氧化能力(total antioxidant capacity, T-AOC)测定试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
Molecular Devices SpectraMax i3多功能酶标仪,美谷分子仪器(上海)有限公司;3K15离心机,美国Sigma公司;BSA124S-CW电子天平,赛多利斯科学仪器(北京)有限公司;C-MAG HS7 digital加热磁力搅拌器,德国艾卡仪器设备有限公司;电热恒温水浴锅,上海博讯实业有限公司医疗设备厂;超声清洗机,上海乔跃电子科技有限公司。
1.3 实验方法
1.3.1 大果沙枣抗氧化成分的提取
新疆大果沙枣,去核留可食部分,60 ℃干燥24 h,粉碎过60目筛,即为大果沙枣粉,密封贮存备用。将0.5 g大果沙枣粉和5.0 mL的不同溶剂[水、60%(体积分数)乙醇、80%(体积分数)甲醇和12种不同DESs]充分混合,混合物用超声波处理器处理,超声时间30 min,超声温度50 ℃。将提取液定容,8 000 r/min离心5 min,取上清液过滤,收集滤液4 ℃保存备用。
1.3.2 DESs制备
DESs由氯化胆碱为氢键受体(hydrogen-bond acidity, HBA)与不同氢键供体(hydrogen-bond donor, HBD)按照一定摩尔比加热搅拌生成。分别称取适量的反应物质置于100 mL烧杯中,于80 ℃用磁力搅拌器进行搅拌,直至得到无色透明液体,之后冷却至室温,即可制得DESs。为了降低所得液体的黏度,加入20%(体积分数)的水。室温下溶剂贮存在玻璃瓶中。DESs组成见表1。
表1 DESs的组成
Table 1 Composition of the DESs
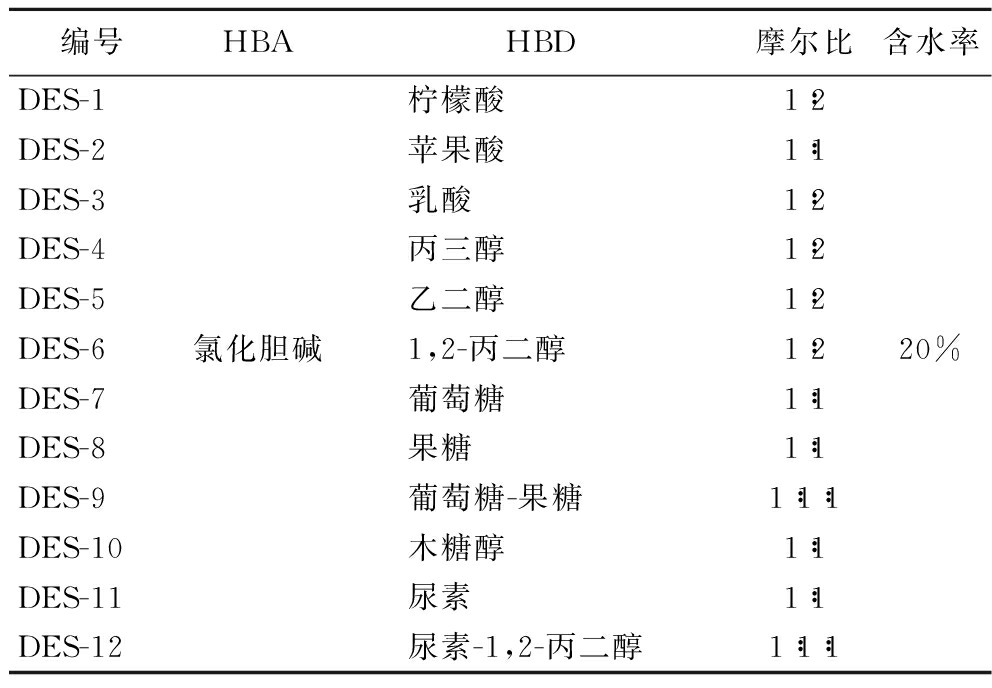
编号HBAHBD摩尔比含水率DES-1柠檬酸1:2DES-2苹果酸1:1DES-3乳酸1:2DES-4丙三醇1:2DES-5乙二醇1:2DES-6氯化胆碱1,2-丙二醇1:220%DES-7葡萄糖1:1DES-8果糖1:1DES-9葡萄糖-果糖1:1:1DES-10木糖醇1:1DES-11尿素1:1DES-12尿素-1,2-丙二醇1:1:1
1.3.3 大果沙枣多酚含量(total phenolic content, TPC)的测定
总酚含量测定采用福林酚法,具体参考DEWANTO等[9]并作适当修改,取50 μL样品溶液,加入0.5 mL双纯水和125 μL福林酚试剂,混合均匀,室温下静置6 min,然后加入1.25 mL 70 g/L的Na2CO3溶液,用双纯水补足至3 mL,振荡均匀后在40 ℃水浴避光反应90 min,最后用酶标仪在760 nm的波长下测得其吸光值。以没食子酸为标准品,测得质量浓度为1~12 μg/mL的没食子酸标准溶液的吸光值,然后制作标准曲线,Y1=0.050 7X1+0.003 81(R2=0.999),其中X1为没食子酸质量浓度(μg/mL),Y1为吸光值。
总酚含量结果以每克大果沙枣中所含的没食子酸当量表示,单位为mg/g,计算如公式(1)所示:
多酚得率![]()
(1)
式中:C为没食子酸当量质量浓度,μg/mL;V为定容体积,mL;N为稀释倍数;m为样品质量,g。
1.3.4 大果沙枣黄酮含量(total flavonoid content, TFC)的测定
黄酮含量的测定方法采用AlCl3法,具体参考LIU等[10]方法并做适当修改。取0.5 mL稀释后的样液,加入1.5 mL双纯水和90 μL 50 g/L的NaNO2溶液,振荡均匀后室温下反应6 min,然后加入180 μL 100 g/L的AlCl3·6H2O溶液,静置5 min后加入0.6 mL 1 mol/L的NaOH溶液,最后用双纯水补足到3 mL,用酶标仪于510 nm下测得其吸光值。同时以芦丁为标准品,测得质量浓度为1~20 μg/mL的芦丁标准溶液的吸光值,得到标准曲线,Y2=0.006 2X2+0.000 8(R2=0.999 1),其中X2为芦丁质量浓度(μg/mL),Y2为吸光值。
总黄酮含量结果以每克大果沙枣中所含的芦丁当量(mg/g)表示,计算如公式(2)所示:
黄酮得率![]()
(2)
式中:C为芦丁当量质量浓度,μg/mL;V为定容体积,mL;N为稀释倍数;m为样品质量,g。
1.3.5 DPPH自由基清除能力测定
将50 μL样品稀释液与150 μL DPPH 溶液(100 μmol/L,用无水乙醇溶解)在96孔板中混合,在室温下避光反应30 min,通过酶标仪在517 nm处测定吸光值。以250 μg/mL Trolox为标准品,以不同标准品浓度(X3)为横坐标,DPPH自由基清除率(Y3)为纵坐标绘制标准曲线,Y3=2.201 7X3+6.470 7(R2=0.997 1),自由基的清除能力以mg TE/g表示。
DPPH自由基清除率计算如公式(3)所示:
DPPH自由基清除率![]()
(3)
式中:Ai表示样品组吸光值(50 μL样品稀释液+150 μL DPPH溶液);Aj表示空白样品吸光值(50 μL无水乙醇+150 μL样品稀释液);A0表示空白组吸光值(50 μL无水乙醇+150 μL DPPH溶液)。
1.3.6 ABTS阳离子自由基清除能力测定
7 mmol/L ABTS水溶液和2.45 mmol/L过硫酸钾水溶液混合,避光反应12~16 h。用无水乙醇稀释ABTS阳离子自由基溶液,使其在734 nm处的吸光度为0.70±0.02。将20 μL样品稀释液与180 μL ABTS阳离子自由基溶液混合,并在黑暗中静置30 min,通过酶标仪在734 nm处测定吸光值。以250 μg/mL Trolox为标准品,以不同标准品浓度(X4)为横坐标,ABTS阳离子自由基清除率(Y4)为纵坐标绘制标准曲线,Y4=0.928 8X4+7.255 9(R2=0.999),自由基的清除能力以mg TE/g表示。
ABTS阳离子自由基清除率计算如公式(4)所示:
ABTS阳离子自由基清除率![]()
(4)
式中:Ai表示样品组吸光值(20 μL样品稀释液+180 μL ABTS溶液);Aj表示空白样品吸光值(20 μL无水乙醇+180 μL样品稀释液);A0表示空白组吸光值(20 μL无水乙醇+180 μL ABTS溶液)。
1.3.7 总抗氧化能力测定
本试验采用T-AOC测定试剂盒对不同溶剂提取的大果沙枣提取液进行测定,处理前分别将水、60%乙醇、80%甲醇以及DESs作为溶剂的提取液稀释一定倍数后进行测定,并将结果进行计算。
1.3.8 超声辅助DESs提取大果沙枣多酚类化合物的单因素优化试验
通过单因素试验考察提取工艺参数对大果沙枣提取物多酚和黄酮得率的影响,包括不同溶剂提取(水、60%乙醇、80%甲醇和12种不同DESs)、DES-2中不同摩尔比(3:1,2:1,1:1,1:1.5,1:2,1:2.5,1:3)、不同含水率(0%,10%,20%,30%,40%,50%)、不同料液比(1:10,1:20,1:30,1:40,1:50,1:60)、不同超声波时间(10、20、30、40、50、60、70 min)、不同提取温度(20、30、40、50、60、70 ℃)。
1.3.9 超声辅助DESs提取大果沙枣多酚类化合物的响应面优化试验
采用Box-Behnken设计优化提取条件。在上述单因素试验方差分析后的基础上,选择含水率(A)、料液比(B)、超声时间(C)和超声温度(D)4个变量作为Box-Behnken设计的自变量,以多酚得率(Y1)、黄酮得率(Y2)、DPPH自由基清除能力(Y3)和ABTS阳离子自由基清除能力(Y4)为响应值,设计4因素3水平的响应面优化试验,共29组试验,如表2所示。
表2 响应面因素水平设计
Table 2 Factors and levels of response surface methodology
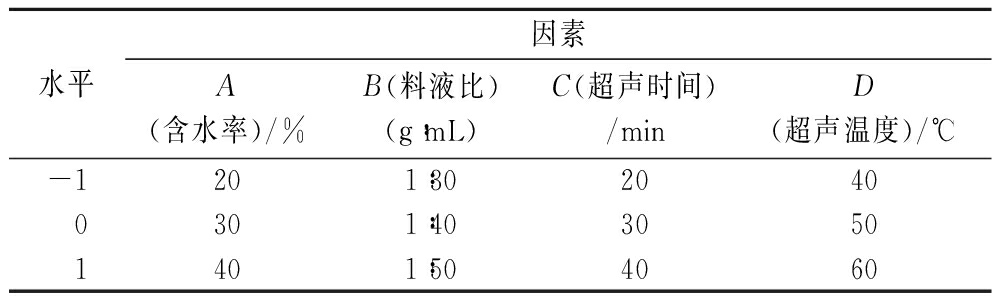
水平因素A(含水率)/%B(料液比)(g:mL)C(超声时间)/minD(超声温度)/℃-1201:3020400301:4030501401:504060
1.4 数据处理与分析
采用SPSS 20.0软件LSD法进行方差分析(ANOVA),并用不同小写字母表示差异显著(P<0.05);运用OriginPro 2021软件进行绘图;响应面设计实验及数据统计用Design Experct 13.0进行。
2 结果与分析
2.1 单因素试验结果
2.1.1 最适溶剂选择
本试验选取廉价易得的季铵盐类化合物——氯化胆碱(choline chloride, ChCl)作为氢键受体,以氢键供体的不同,将其分为四类共12种DESs进行制备,包括ChCl-羧酸类、ChCl-多元醇类、ChCl-糖类和ChCl-酰胺及醇类。同时采用水、60%乙醇和80%甲醇作为传统提取溶剂,在同一提取条件下,即溶剂含水率20%,料液比1:10,在50 ℃下超声30 min进行提取,测得的多酚和黄酮得率进行对比,如图1所示,所有的DESs对大果沙枣总酚的提取率远高于传统溶剂,但黄酮的提取率除ChCl-羧酸类DES外,均没有达到有机溶剂所提取的含量,这里的原因可能是由于大果沙枣中主要成分是糖类,以羧酸为供氢体的DESs中存在着游离的H+,H+可促进大果沙枣细胞壁中的纤维素、半纤维素和果胶的水解,有效加强了沙枣细胞中多酚类化合物向溶剂的释放。

图1 不同溶剂对大果沙枣多酚和黄酮得率的影响
Fig.1 Effects of different solvents on the yield of polyphenols and flavonoids of E.moorcroftii Wall.ex Schlecht.
注:图中不同小写字母表示存在显著差异(P<0.05)(下同)。
由统计分析可知,ChCl-苹果酸相较其他溶剂的提取率都显著提高,ChCl-苹果酸提取的多酚得率分别比水提、60%乙醇和80%甲醇提取的高出约5.2、4、3.6倍,该DESs提取的黄酮得率分别比水提、60%乙醇和80%甲醇提取的高出约23.7、5.5、4.7倍。因此,确定ChCl-苹果酸(DES-2)为最合适的提取溶剂。
2.1.2 最适DESs摩尔比选择
氢键受体和氢键供体摩尔比是影响DESs密度、分子间作用力、黏度、极性等物理化学性质的因素[11]。由此设置了ChCl和苹果酸不同的摩尔比溶剂体系,分别为3:1、2:1、1:1、1:1.5、1:2、1:2.5、1:3,提取实验结果如图2所示,过多的氢键供体或者氢键受体都会影响酚类化合物的得率。因此,实验设置溶剂含水率为20%,料液比1:10,50 ℃下超声30 min,当两者摩尔比例为1:1时,多酚和黄酮的得率最高,因此选择氯化胆碱与苹果酸的摩尔比为1:1。

图2 不同摩尔比DESs溶剂对大果沙枣多酚和黄酮得率的影响
Fig.2 Effects of DESs with different molar ratios on the yield of polyphenols and flavonoids of E.moorcroftii Wall.ex Schlecht.
2.1.3 最适DESs含水率选择
DESs在常温下可形成广泛的氢键网络,具有了高黏度的特征。高黏度限制了有效成分的提取,而水的进入,可以通过离子水之间形成氢键来降低DESs的黏度,进而提高从固体到液体的传质速率[12]。此外,水还可增加DESs的极性,促进生物资源中极性化合物的溶解。多酚类物质都带有多个羟基,属于极性物质,但由图3可知,随着溶剂体系中含水量的增加,多酚和黄酮得率先增加后减少。这可能与DESs中水量过多导致体系中氢键的破坏以及影响了生物活性物质与DESs之间的氢键作用有关,从而造成目标化合物的提取效率降低。实验结果表明,ChCl-苹果酸摩尔比1:1,料液比1:10,50 ℃下超声30 min,DES含水量以30%为好,其多酚和黄酮的提取率达到最大值。

图3 不同含水率对大果沙枣多酚和黄酮得率的影响
Fig.3 Effects of DESs with different water content on the yield of polyphenols and flavonoids of E.moorcroftii Wall.ex Schlecht.
2.1.4 最适DESs料液比选择
固-液萃取过程中物料与溶剂的比例对提取率有很大影响[13]。在DESs含水量为30%,提取温度50 ℃下超声30 min,改变料液比来测定料液比对大果沙枣中多酚和黄酮得率的影响。结果如图4所示,当料液比在一定范围内,酚类化合物的得率随溶剂量的上升而增大,可能是由于溶剂增多后,能更好地与原料相互作用,有助于更多的酚类化合物扩散到溶剂中。随着料液比进一步增大到1:40,提取率无显著性差异。原因可能为扩散达到平衡,随着料液比的增大,提取率几乎没有增加。为避免溶剂的浪费,故选择1:40的料液比。
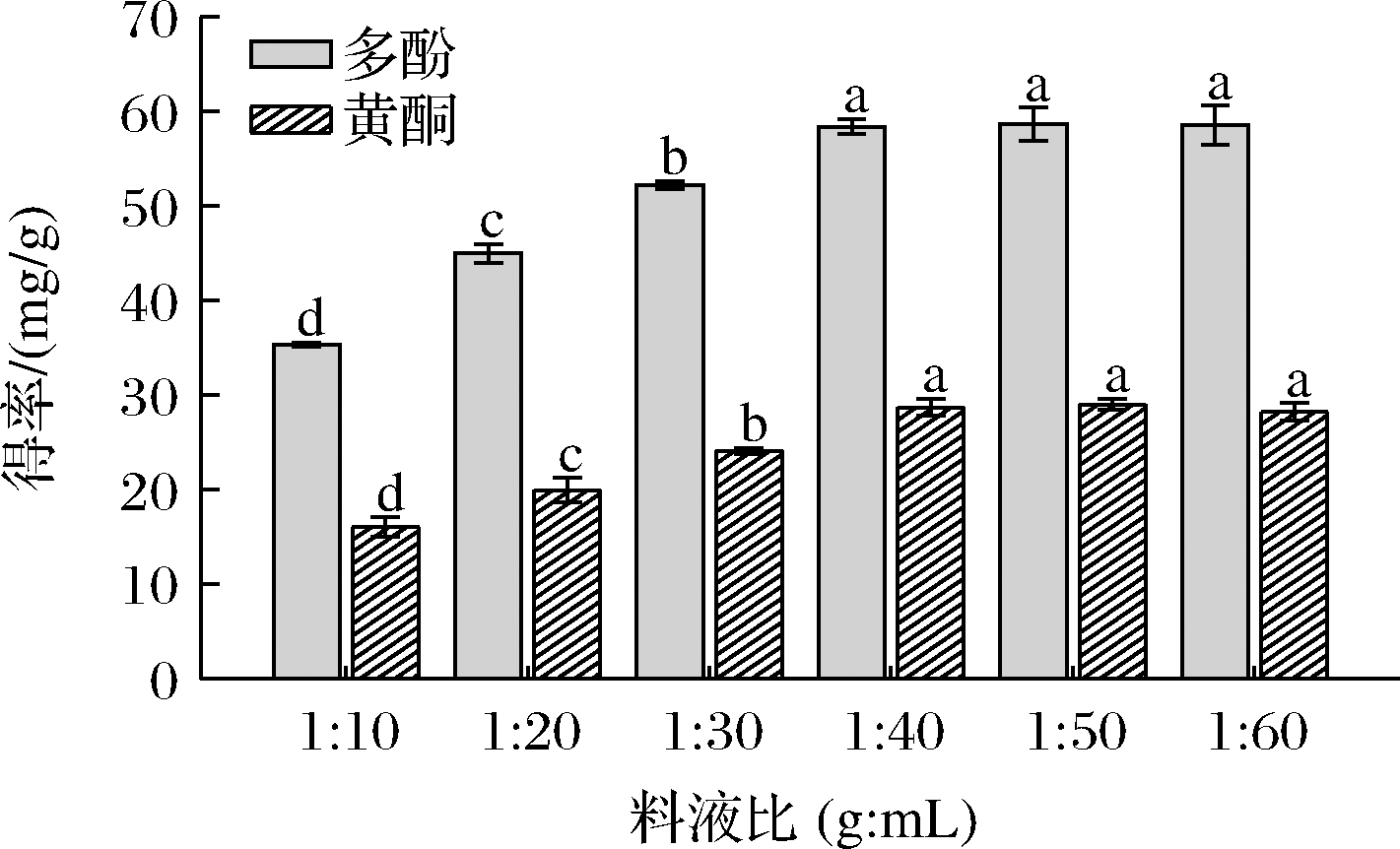
图4 不同料液比对大果沙枣多酚和黄酮得率的影响
Fig.4 Effects of of liquid-solid ratios on the yield of polyphenols and flavonoids of E.moorcroftii Wall.ex Schlecht.
2.1.5 最适DESs超声时间选择
多酚类化合物浓度达到平衡之前,延长萃取时间可以提高多酚类化合物的产率[14]。如图5所示,在10~30 min,大果沙枣中多酚和黄酮得率呈增长态势,再随着超声时间的延长,提取量虽略有上升,但差异并不显著,可能是萃取过程非常接近固液平衡时,扩散速度降低。因此,设置ChCl-苹果酸摩尔比为1:1,料液比1:40,超声温度为50 ℃,选择超声时间为30 min为最适反应时间。

图5 不同超声时间对大果沙枣多酚和黄酮得率的影响
Fig.5 Effects of off ultrasonic time on the yield of polyphenols and flavonoids of E.moorcroftii Wall.ex Schlecht.
2.1.6 最适DESs超声温度选择
提高萃取温度可以降低DESs的密度、黏度和表面张力,从而使其更容易渗透到细胞中去提高酚类化合物得率[15]。在同一提取条件下(ChCl-苹果酸摩尔比为1:1,1:40的料液比,超声时间为30 min),不同超声温度对多酚和黄酮得率的影响如图6所示。提取温度在30~50 ℃内增加时,多酚和黄酮得率呈上升趋势,并且在50 ℃时达到最大值。而在此之后,随着温度的不断升高,多酚和黄酮得率略有上升,但差异并不显著。因此,选择最佳的提取超声温度为50 ℃。
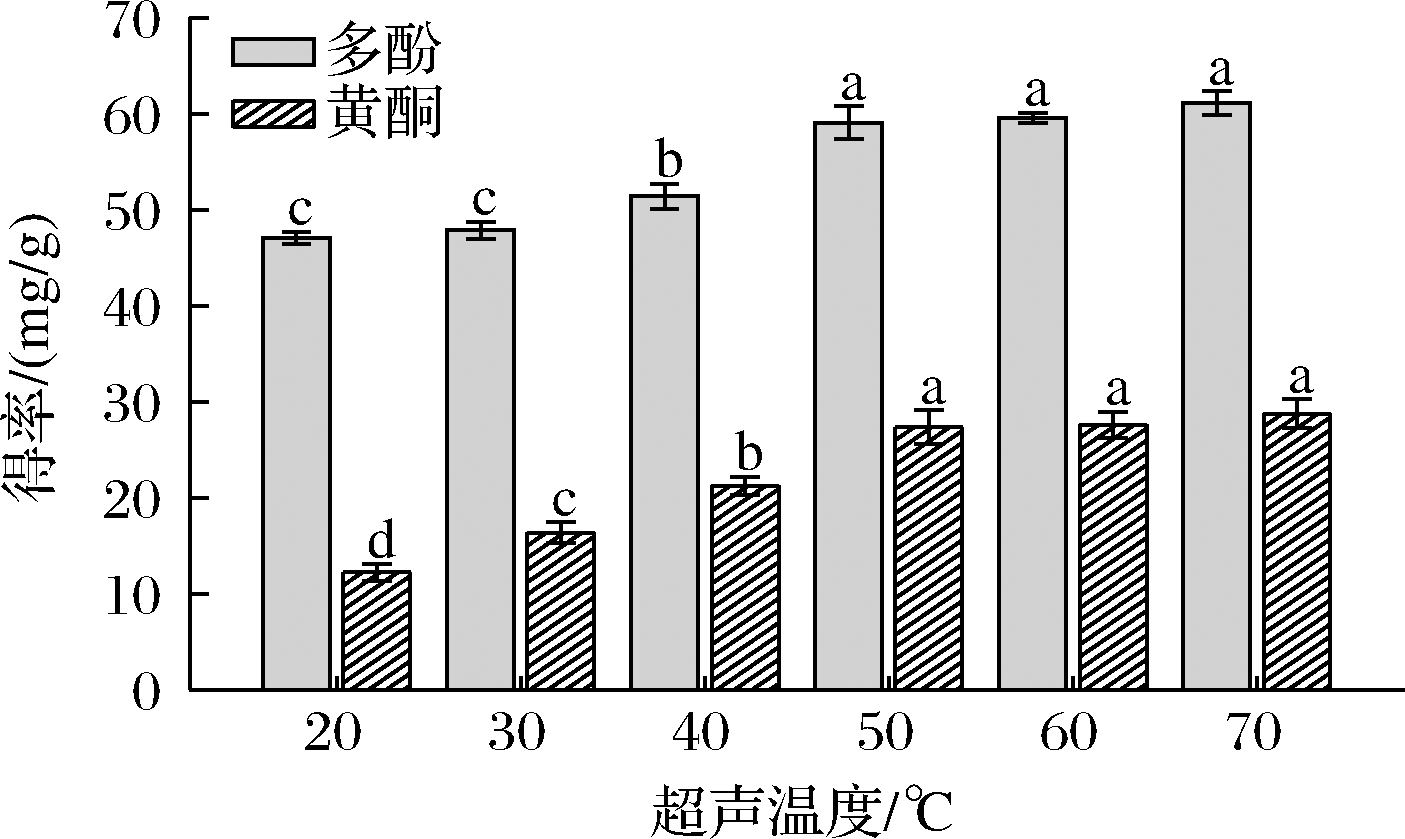
图6 不同超声温度对大果沙枣多酚和黄酮得率的影响
Fig.6 Effects of off ultrasonic temperature on the yield of polyphenols and flavonoids of E.moorcroftii Wall.ex Schlecht.
2.2 响应面实验结果
2.2.1 响应面试验设计及方差分析
响应面试验设计与结果如表3所示,响应面结果方差分析如表4所示。利用Design-Expert分析软件对表3数据进行回归方程拟合,得到各因素[A(含水率)、B(料液比)、C(超声时间)、D(超声温度)]对多酚得率(YTPC)、黄酮得率(YTFC)、DPPH自由基清除能力(YDPPH)和ABTS阳离子自由基清除能力(YABTS)的二次多元回归方程如下:
表3 响应面试验设计与结果
Table 3 Design and result Box-Behnken

编号A(含水率)B(料液比)C(超声时间)D(超声温度)多酚得率/(mg/g)黄酮得率/(mg/g)DPPH自由基清除能力/(mg TE/g)ABTS阳离子自由基清除能力/(mg TE/g)1000060.9528.6134.3567.75200-1158.1627.9133.5365.9930-10151.9523.3032.3659.874001161.3128.9734.7973.29500-1-152.4919.6929.4049.376010161.7232.4635.1980.787-1-10054.2026.4231.6758.5681-10047.9020.7430.5354.45901-1061.6331.1935.3073.0810101057.7526.1333.1561.39110-10-143.7418.3325.6145.4912100-148.9220.0329.6852.2813000059.6028.9834.7270.61140-11053.0224.8831.7562.3815-10-1060.2529.5933.5957.5616011061.2131.3534.7872.391710-1054.5423.6732.0658.9618000059.8529.6834.3671.2919-100-154.3721.9829.0750.3120100156.9725.6233.1065.8121000060.7529.3934.8570.6122001-152.0621.5128.4256.15230-1-1050.0822.8528.7253.4324000060.0129.2934.7466.0925-100160.5830.6235.5274.2826110059.8829.7734.8371.7227-101060.6229.4835.2472.6428-110062.1532.3236.3078.3529010-154.8524.2931.6461.27
表4 响应面结果方差分析
Table 4 Analysis of Box-Behnken

方差来源多酚得率黄酮得率DPPH自由基清除能力ABTS阳离子自由基清除能力F值P值F值P值F值P值F值P值模型294.43<0.000 1***200.66<0.000 1***106.92<0.000 1***46.46<0.000 1***A(含水率)345.28<0.000 1***293.38<0.000 1***40.72<0.000 1***16.870.001 1**B(料液比)1 843.26<0.000 1***988.12<0.000 1***473.48<0.000 1***245.73<0.000 1***C(超声时间)39.22<0.000 1***27.070.000 1***19.280.000 6***36.51<0.000 1***D(超声温度)984.37<0.000 1***908.85<0.000 1***593.12<0.000 1***254.12<0.000 1***AB24.490.000 2***14.430.002 0***0.195 30.665 30.440 10.517 9AC12.200.003 6**9.720.007 6**0.572 40.461 811.030.005 0**AD5.120.040 0*13.720.002 4**17.340.001 0***7.500.016 0*BC17.040.001 0***5.180.039 0*23.890.000 2***6.410.024 0*BD2.700.122 415.090.001 7**19.340.000 6***1.810.199 7CD19.270.000 6***0.84520.373 59.540.008 0**0.019 10.892 1A256.32<0.000 1***39.07<0.000 1***4.530.051 616.160.001 3**B2394.15<0.000 1***25.760.000 2***55.04<0.000 1***2.060.173 3C212.880.003 0***31.37<0.000 1***31.72<0.000 1***15.740.001 4**D2572.24<0.000 1***528.09<0.000 1***272.68<0.000 1***57.80<0.000 1***失拟项0.269 40.957 91.010.543 12.990.151 40.608 70.761 3R20.996 6 0.995 00.990 70.978 9Radj20.993 20.990 10.981 50.957 9
注:*为有统计学差异,P<0.05;**为有显著统计学差异,P<0.01;***为有极其显著的统计学差异,P<0.001。
YTPC=-114.381 60-0.345 311×A+3.161 20×B+0.093 888×C+3.920 88×D+0.010 075×AB+0.007 112×AC+0.004 609×AD-0.008 405×BC-0.003 347×BD+0.008 937×CD-0.011 998×A2-0.031 741×B2-0.005 738×C2-0.038 246×D2;
YTFC=-111.535 340+0.278 845×A+0.536 704×B+0.695 315×C+4.042 55×D+0.007 827×AB+0.006 422×AC-0.007 631×AD-0.004 691×BC+0.008 004×BD-0.001 894×CD-0.010 113×A2-0.008 213×B2-0.009 06×C2-0.037 183×D2;
YDPPH=-104.281 36+0.567 028 9×A+1.765 60×B+0.644 188×C+2.990 54×D-0.000 803×AB-0.001 375×AC-0.007 568×AD-0.008 882×BC-0.007 993×BD+0.005 615×CD-0.003 037×A2-0.010 588×B2-0.008 038×C2-0.023 567×D2;
YABTS=-301.708 97+4.082 88×A+1.991 88×B+3.959 33×C+6.790 92×D-0.006 316×AB-0.031 6×AC-0.026 080×AD-0.024 104×BC+0.012 815×BD+0.001 316×CD-0.030 054×A2-0.010 728×B2-0.029 666 7×C2-0.056 843×D2。
通过分析29组数据,发现多酚类化合物得率和各抗氧化能力之间并无明显线性关系,仅考察单一响应值过于片面。因此,通过对多个响应值考察,可全面讨论多酚类化合物与各抗氧化活性的关系,并可有效筛选出具有高抗氧化活性且富含多酚类化合物的提取方法。
依据表4分析,4个因素模型P<0.000 1,说明该模型适合并具有显著性;失拟项P>0.05不显著,表明模型拟合度良好;总决定系数R2和模型调整系数Radj2均接近于1,表明实验值与预测值具有高度的相关性,该模型相关度较好。从响应面试验结果中可以看出料液比(B)和超声温度(D)是影响4个响应值最大的2个因素,超声时间(C)和含水率(A)的影响相对较小。
2.2.2 验证试验结果分析
高多酚和黄酮得率是本次大果沙枣多酚类化合物提取研究的主要目标,抗氧化活性是评判酚类活性常用的一种指标,故本实验提取工艺首先需保证较高得率的多酚和黄酮,其次还应具有对DPPH自由基及ABTS阳离子自由基较高的清除能力,同时还要考虑能耗及对后续工艺的影响。通过对本实验模型分析表明,经过DesignExpert 13.0优化后的最佳提取工艺为:含水率24.998%,料液比1:48.315(g:mL),超声时间33.264 min,超声温度57.263 ℃,在此条件下,理论预计多酚得率63.947 mg/g、黄酮得率33.606 mg/g、DPPH自由基清除能力为36.447 mg TE/g、ABTS阳离子自由基清除能力为82.583 mg TE/g。在验证实验中,考虑实际条件,将操作工艺参数调整为含水率25%、料液比1:48(g:mL)、超声时间34 min、超声温度57 ℃,做3组平行实验。大果沙枣多酚得率为63.378 mg/g,黄酮得率为33.528 mg/g,DPPH自由基清除能力为35.004 mg TE/g,ABTS阳离子自由基清除能力为82.443 mg TE/g,与理论值分别相差0.89%、0.23%、3.96%、0.17%,说明该模型与实际拟合效果较好,在提高了活性成分得率的同时保证了抗氧化活性,适用于大果沙枣多酚类活性成分和抗氧化活性的同时提取,说明本模型有效。
2.2.3 不同提取方法对TPC、TFC得率及抗氧化活性影响的比较
用水、60%乙醇、80%甲醇和ChCl-苹果酸分别提取,将多酚、黄酮得率和DPPH自由基、ABTS阳离子自由基清除能力、总抗氧化能力进行比较。通过Pearson correlation test进行相关性分析(图7),结果表明,多酚得率、黄酮得率、DPPH自由基清除能力、ABTS阳离子自由基清除能力与总抗氧化能力之间具有正相关性关系,说明不同溶剂提取的大果沙枣中多酚、黄酮含量虽不同,但是都具有抗氧化活性。同时表明本研究所采用的提取方法在提高了活性成分得率的同时保证了抗氧化活性,适用于大果沙枣多酚类化合物的提取。

图7 不同提取方法对大果沙枣活性成分与抗氧化能力相关性分析
Fig.7 Correlation analysis of active components and antioxidant capacity by different extraction methods
注:*表示P<0.05,**表示P<0.01,***表示P<0.001。
3 结论与讨论
实验采用超声辅助DESs提取新疆大果沙枣中多酚类化合物。在单因素试验的基础上,采用Box-Behnken设计方法,对新疆大果沙枣中多酚、黄酮得率和DPPH自由基、ABTS阳离子自由基清除能力同时进行优化。实验得到最优提取工艺参数为含水率25%、料液比1:48(g:mL)、超声时间34 min、超声温度57 ℃,此条件下多酚得率为62.87 mg/g,黄酮得率为33.53 mg/g,DPPH自由基清除能力为34.27 mg TE/g,ABTS阳离子自由基清除能力为82.44 mg TE/g,与模型的预测值相近。通过Pearson correlation test 进行相关性分析结果表明,多酚得率、黄酮得率、DPPH自由基清除能力、ABTS阳离子自由基清除能力与总抗氧化能力之间具有正相关性关系。从多酚类化合物得率、生物活性以及相关性分析3个角度分析,本研究所采用的提取方法在提高了多酚类化合物得率的同时保证了抗氧化活性,适用于后期对大果沙枣抗氧化活性的研究。
通过和传统提取方法的比较,得到DESs ChCl-苹果酸体系对大果沙枣多酚的提取得率比水提、60%醇提、80%甲醇提取的高8.75、6.72、6.05倍;黄酮得率比水提、60%醇提,80%甲醇提取的高49.73、11.59、9.92倍。通过与其他研究的比较,本研究提取的大果沙枣黄酮含量比凯迪日耶·玉苏普等[16]提取的高5.67倍,比夏泆斌等[17]研究的4个不同地域的大果沙枣品种的多酚和黄酮提取含量也高出约11倍和6倍,说明本实验采用的提取方法高效,将DESs应用于大果沙枣多酚类化合物的提取具有较高的实用价值。
DESs作为一种新型的提取体系,具有绿色环保、可持续和低成本等优点,大量研究表明,其提取有效成分的效率均高于传统有机溶剂,故DESs在一定程度上能够替代传统有机溶剂[18],可应用于功能性食品和制药等领域,为新疆大果沙枣的进一步开发利用提供理论依据。
[1] 于玮玮, 阎国荣.沙枣的资源及研究现状[J].天津农学院学报,2009,16(2):46-50.
YU W W, YAN G R.Resources and research situation of Elaeagnus spp.[J].Journal of Tianjin Agricultural University,2009,16(2):46-50.
[2] 刘巧玲, 刘丽燕, 盛玮.新疆大果沙枣果实营养分析及开发利用[J].现代园艺,2021,44(9):54-56.
LIU Q L, LIU L Y, SHENG W. Nutritional analysis and development and utilization of Elaeagnus angustifolia fruit in Xinjiang. Contemporary Horticulture, 2021, 44(9):54-56.
[3] 艾百拉·热合曼,籍保平,周峰.沙枣果实营养、活性成分及药理作用研究进展[J].食品工业科技,2018,39(3):343-352.
EBEYDULLA R, JI B P, ZHOU F.Research progress in nutritional,bioactive content and pharmacological activity of oleaster fruit[J].Science and Technology of Food Industry,2018,39(3):343-352.
[4] HASHEMI B, SHIRI F,  VEC F, et al.Green solvents and approaches recently applied for extraction of natural bioactive compounds[J].TrAC Trends in Analytical Chemistry, 2022, 157:116732.
VEC F, et al.Green solvents and approaches recently applied for extraction of natural bioactive compounds[J].TrAC Trends in Analytical Chemistry, 2022, 157:116732.
[5] LU W D, LIU S J.Choline chloride-based deep eutectic solvents (Ch-DESs) as promising green solvents for phenolic compounds extraction from bioresources:State-of-the-art, prospects, and challenges[J].Biomass Conversion and Biorefinery,2022, 12(7):2949-2962.
[6] 郝翠, 翟立海, 陈立宗, 等.新型绿色溶剂在天然产物提取中的应用研究进展[J].西南民族大学学报(自然科学版),2020,46(5):464-470.
HAO C,ZHAI L H, CHEN L Z, et al.Application of new green solvents in extraction of natural products[J].Journal of Southwest Minzu University (Natural Science Edition),2020,46(5):464-470.
[7] 罗蓉, 蔡旭, 薛宏坤, 等.响应面法优化超声辅助低共熔溶剂提取山楂总黄酮工艺[J].食品工业科技, 2022,43(22):229-237.
LUO R, CAI X, XUE H K, et al.Optimization of ultrasonic-assisted deep eutectic solvent extraction of flavonoids from Crataegus pinnatifida using response surface methodology[J].Science and Technology of Food Industry, 2022,43(22):229-237.
[8] 王晓艺, 李培坤, 李锦红, 等.超声辅助低共熔溶剂提取玫瑰多酚及其抗氧化活性[J].食品研究与开发,2022,43(8):98-105.
WANG X Y, LI P K, LI J H, et al.Ultrasonic-assisted extraction of rose polyphenols by deep eutectic solvent and antioxidant activity[J].Food Research and Development,2022,43(8):98-105.
[9] DEWANTO V, WU X Z, ADOM K K, et al.Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity.[J].Journal of Agricultural and Food Chemistry,2002,50(10):3010-3014.
[10] LIU L, WEN W, ZHANG R F, et al.Complex enzyme hydrolysis releases antioxidative phenolics from rice bran[J].Food Chemistry,2017,214:1-8.
[11] ZHANG H L, HAO F L, YAO Z F, et al.Efficient extraction of flavonoids from Polygonatum sibiricum using a deep eutectic solvent as a green extraction solvent[J].Microchemical Journal,2022,175:107168.
[12] DAI Y T, VAN SPRONSEN J, WITKAMP G J, et al.Natural deep eutectic solvents as new potential media for green technology[J].Analytica Chimica Acta,2013,766:61-68.
[13] CAO Q S, LI J H, XIA Y L, et al.Green extraction of six phenolic compounds from rattan (calamoideae faberii) with deep eutectic solvent by homogenate-assisted vacuum-cavitation method[J].Molecules (Basel, Switzerland), 2018,24(1):113.
[14] PARK H E, TANG B K, ROW K H.Application of deep eutectic solvents as additives in ultrasonic extraction of two phenolic acids from herba Artemisiae scopariae[J].Analytical Letters,2014,47(9):1476-1484.
[15] BI W T, TIAN M L, ROW K H.Evaluation of alcohol-based deep eutectic solvent in extraction and determination of flavonoids with response surface methodology optimization[J].Journal of Chromatography A,2013,1285:22-30.
[16] 凯迪日耶·玉苏普, 美合热阿依·木台力甫, 周茜.大果沙枣不同部位总黄酮含量比较研究[J].中国民族民间医药,2022,31(1):31-35.
KAIDIRIYE Y, MEIHEREAYI M, ZHOU Q.Comparative study on the content of total flavonoids content in different parts of Elaeagnus angustifolia[J].Chinese Journal of Ethnomedicine and Ethnopharmacy,2022,31(1):31-35.
[17] 夏泆斌, 祝小开, 郭佳, 等.4个大果沙枣品种抗氧化活性及其成分含量比较分析[J].中国果树,2019(3):38-42.
XIA Y B, ZHU X K, GUO J, et al.Comparative analyses of antioxidant contents and it’s ingredient contents of four cultivars of Elaeagnus moorcroftii Wall.ex Schlecht[J].China Fruits,2019(3):38-42.
[18] CHEN J N, LI Y, WANG X P, et al.Application of deep eutectic solvents in food analysis:A review[J].Molecules (Basel, Switzerland), 2019,24(24):4594.