桃(Prunus persica L.)果实口感香甜,汁多味美,营养丰富,深受消费者的喜爱。果皮色泽是桃果实外观的主要性状之一,色泽鲜红的果实容易引起消费者的购买欲望[1]。花色苷是桃果皮色泽形成的重要物质[2],可使植物呈现出丰富的颜色[3]。花色苷具有较强的抗氧化能力,不仅具有抗衰老、保护视力等保健功能,还能提高植物抵抗逆境胁迫的能力[3-4]。桃果实套袋栽培可使果面洁净、防止病虫害的侵害[5],但遮光套袋采收会减少花色苷的合成和果实着色,影响了采后果实外观品质和商品价值[1]。因此,寻求一种有效地促进套袋桃果实采后花色苷合成的方法具有重要的意义。
花色苷在植物体内的生物合成途径已基本明确,其主要通过类黄酮类物质合成途径合成[6]。花色苷的合成受结构基因和调节基因的控制[7]:结构基因编码花色苷生物合成途径中的酶,调节基因主要为MYB、bHLH和WD40这三类转录因子基因[6]。花色苷的合成始于苯丙氨酸,经苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)、查尔酮合成酶(chalcone synthase,CHS)、查尔酮异构酶(chalcone isomerase,CHI)、黄酮醇-3-羟化酶(flavonone 3-hydroxylase,F3H)、类黄酮-3′-羟化酶(flavonoid 3′-hydroxylase,F3′H)、二氢黄酮醇-4-还原酶(dihydroflavonol 4-reductase,DFR)、花青素合成酶(anthocyanidin synthase,ANS)和糖基转移酶(UDP-glucose-flavonoid 3-O-glucosyltransferase,UFGT)等一系列酶催化,最终形成花色苷,随后经谷胱甘肽S-转移酶(glutathione S-transferase,GST)转运至液泡贮存[7-8]。苯丙氨酸是花色苷生物合成的前体,在其生物合成中发挥着重要的作用[6,9]。
苯丙氨酸作为一种芳香族氨基酸,是植物苯丙烷代谢的底物,在植物生长过程中有很重要的作用[10]。苯丙氨酸处理叶面可以降低灰霉菌对拟南芥、矮牵牛花和番茄植株的浸染,增强植株抗性[11];采后苯丙氨酸处理的番茄果实具有较高的酚类物质及抗氧化能力,降低了番茄果实冷害率[12];用含有苯丙氨酸的可食用涂层处理牛油果果实,可以降低果实腐烂率,保持果实的贮藏品质[13]。目前,外源苯丙氨酸处理对花色苷合成的作用正被逐渐探究:适当添加苯丙氨酸能促进野生型拟南芥合成更多的花色苷[14],叶面施用苯丙氨酸可以增加葡萄果实的花色苷含量[15]。本研究以套袋采收的桃果为材料,研究采后苯丙氨酸处理对桃果实贮藏期花色苷合成的影响,以期探讨苯丙氨酸影响桃果实着色的初步机制,为苯丙氨酸在调控桃采后色泽形成中的应用提供参考。
1 材料与方法
1.1 材料与试剂
本实验的桃品种为‘湖景蜜露’桃[Prunus persica (L.) Batsch cv.‘Hujingmilu’],果实套“内黑外黄”双层纸袋,桃果实在花后105 d进行采摘(果实七成熟),采摘地点为江苏省徐州市的某果园。桃果实采后当天运至江苏省农业科学院,挑选外观、大小一致且无机械损伤,无病虫害的桃果实作为实验材料。
DL-苯丙氨酸(99%),北京百灵威科技有限公司;甲醇(分析纯),上海凌峰化学试剂有限公司;盐酸(分析纯),南京化学试剂有限公司;氯化钾(分析纯),国药集团化学有限公司;无水乙酸钠(分析纯),广州市金华大化学试剂有限公司;β-巯基乙醇(99%),上海麦克林生物科技有限公司;FastPure Plant Total RNA Isolation Kit(Polysaccharides & Polyphenolics-rich)RNA提取试剂盒、HiScript III RT SuperMix for qPCR(+gDNA wiper)cDNA合成试剂盒,南京诺唯赞生物科技股份有限公司。
1.2 仪器与设备
pH计,梅特勒-托利多仪器(上海)有限公司;CR-400型全自动测色色差仪,柯尼卡美能达株式会社(日本);UV-1102型紫外可见分光光度计,上海天美科学仪器有限公司;FM40型雪花制冰机,北京长流科学技术公司;Tissuelyser-64型多样品组织研磨机,上海净信实业发展有限公司;Centrifuge 5804R型离心机,德国艾本德公司;东胜龙EDC810型PCR仪,北京东胜创新生物科技有限公司;CFX Connect实时定量PCR仪,伯乐生命医学产品(上海)有限公司。
1.3 实验方法
1.3.1 实验材料的处理
参考SOGVAR等[16]的方法,略有改变,采用8 mmol/L 苯丙氨酸进行浸泡处理,对照组采用清水浸泡,均浸泡10 min处理。所有处理组浸泡完成后自然吹风晾干,将2组果实(8个一组)分别置于打孔的保鲜袋内,随后放到室内常温[(22±2) ℃,光照强度(200±50) Lux,模拟水果超市室内环境]条件下贮藏8 d,每个处理组设置3次重复实验。在贮藏期间,每隔一天取样,每组随机取桃24个,用不锈钢刀片分离桃果皮和果肉样本,取桃果实整果果皮,将组织样本置于液氮中速冻并存放在-80 ℃冰箱中,用于测定相关指标。
1.3.2 果皮色差的测定
参考田梦瑶等[1]的方法,并稍作改动。采用CR-400全自动色差仪对桃果实赤道部位相对的4个点进行果皮色差的测定,得到L*、a*和b*值,按公式(1)~公式(4)计算饱和度C*、色调值h、颜色指数(color index of red grape,CIRG)和总色差值ΔE:
(1)
(2)
(3)
(4)
式中:![]() 和
和![]() 分别为第0天L*、a*和b*值的平均值。
分别为第0天L*、a*和b*值的平均值。
1.3.3 总花色苷含量的测定
采用pH示差法[17]测定桃果皮中总花色苷含量。称取0.8 g桃皮样品,加入4.0 mL 95%(体积分数)酸化甲醇(0.1 mol/L HCl),于黑暗条件下振荡提取4 h后离心(10 000 r/min,20 min,4 ℃),取上清液备用。将上清液分别用0.025 mol/L KCl缓冲液(pH=1.0)和0.4 mol/L CH3COONa缓冲液(pH=4.5)稀释,室温下静置15 min后测定溶液在520 nm和700 nm 下的吸光度值。根据公式(5)计算得出桃果皮中总花色苷含量:
总花色苷含量![]()
(5)
式中:ΔA=(A520-A700)pH1.0-(A520-A700)pH4.5;Mw为矢车菊素-3-葡萄糖苷的分子质量,449.2 g/mol;DF为稀释因子;V为提取液总体积,mL;ε为摩尔吸收率,26 900 L/(mol·cm);m为样品质量,g;1为比色皿宽度1 cm。
1.3.4 桃果皮总RNA的提取及cDNA的合成
桃果皮总RNA提取参考FastPure Plant Total RNA Isolation Kit(Polysaccharides & Polyphenolics-rich)RNA提取试剂盒的产品说明,然后经HiScript III RT SuperMix for qPCR(+gDNA wiper)cDNA合成试剂盒的方法反转录成cDNA,-20 ℃保存备用。
1.3.5 qRT-PCR测定基因表达水平
花色苷合成相关基因引物序列参考相关文献[18-19],具体的基因引物序列和内参基因TEF2的序列如表1所示。反应体系为:10 μL 2×ChamQ SYBR qPCR Master Mix,0.4 μL正向引物,0.4 μL反向引物,2 μL DNA模板,7.2 μL ddH2O。采用2-ΔΔct法进行相对定量分析。
表1 花色苷合成相关基因引物序列
Table 1 Sequence of primers for genes related to anthocyanin synthesis
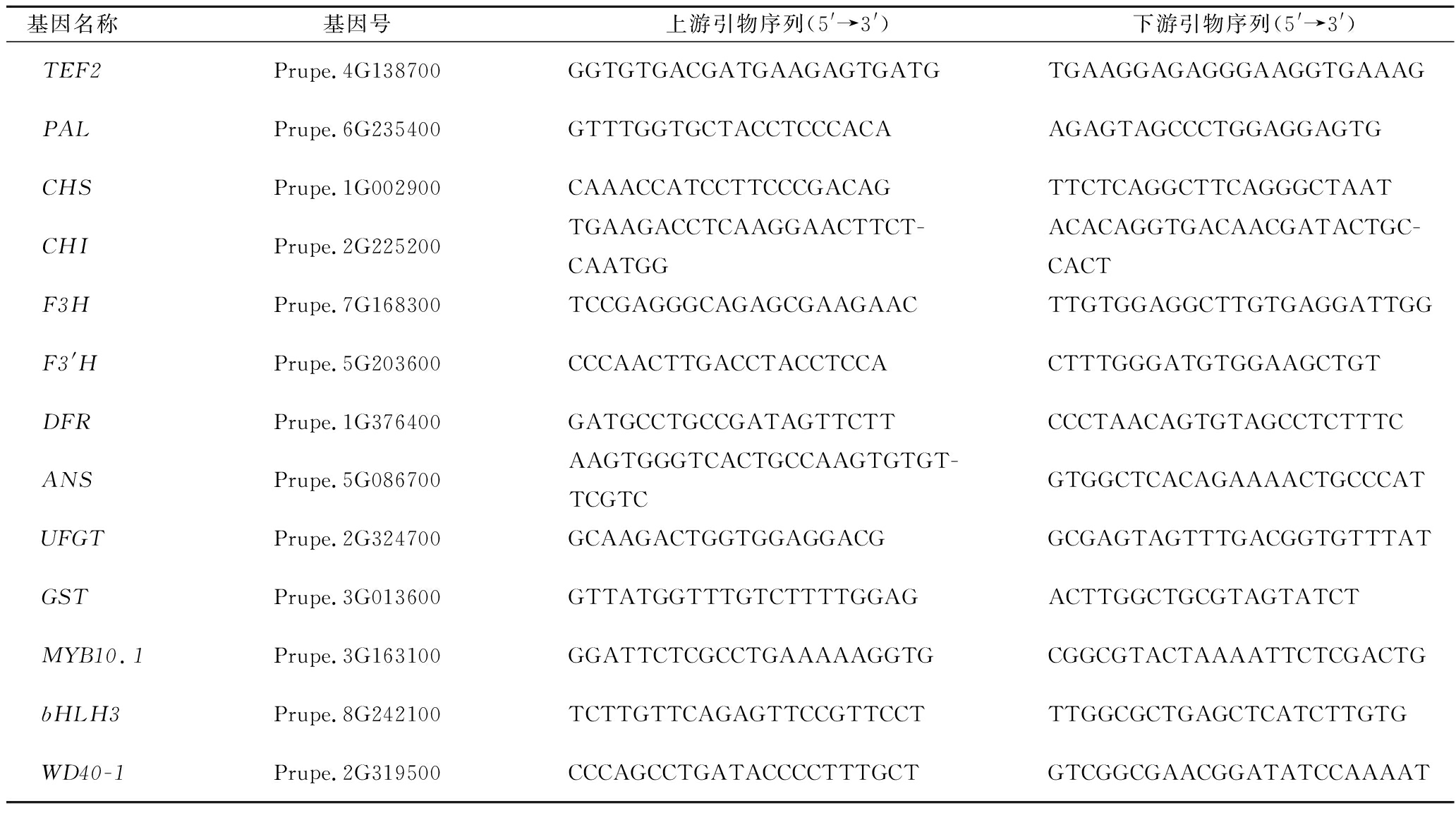
基因名称 基因号上游引物序列(5'→3')下游引物序列(5'→3')TEF2Prupe.4G138700GGTGTGACGATGAAGAGTGATGTGAAGGAGAGGGAAGGTGAAAGPALPrupe.6G235400GTTTGGTGCTACCTCCCACAAGAGTAGCCCTGGAGGAGTGCHSPrupe.1G002900CAAACCATCCTTCCCGACAGTTCTCAGGCTTCAGGGCTAATCHIPrupe.2G225200TGAAGACCTCAAGGAACTTCT-CAATGGACACAGGTGACAACGATACTGC-CACTF3HPrupe.7G168300TCCGAGGGCAGAGCGAAGAACTTGTGGAGGCTTGTGAGGATTGGF3'HPrupe.5G203600CCCAACTTGACCTACCTCCACTTTGGGATGTGGAAGCTGTDFRPrupe.1G376400GATGCCTGCCGATAGTTCTTCCCTAACAGTGTAGCCTCTTTCANSPrupe.5G086700AAGTGGGTCACTGCCAAGTGTGT-TCGTCGTGGCTCACAGAAAACTGCCCATUFGTPrupe.2G324700GCAAGACTGGTGGAGGACGGCGAGTAGTTTGACGGTGTTTATGSTPrupe.3G013600GTTATGGTTTGTCTTTTGGAGACTTGGCTGCGTAGTATCTMYB10.1Prupe.3G163100GGATTCTCGCCTGAAAAAGGTGCGGCGTACTAAAATTCTCGACTGbHLH3Prupe.8G242100TCTTGTTCAGAGTTCCGTTCCTTTGGCGCTGAGCTCATCTTGTGWD40-1Prupe.2G319500CCCAGCCTGATACCCCTTTGCTGTCGGCGAACGGATATCCAAAAT
1.4 数据处理
采用Excel 2019软件对数据进行统计,采用SPSS 24.0软件对数据进行t-test检验分析,比较差异显著性(P<0.05),采用OriginPro 2021软件进行绘图。所有数据均平行测定3次。
2 结果与分析
2.1 苯丙氨酸处理对采后桃果皮着色的影响
苯丙氨酸处理对采后桃果皮着色的影响如图1所示。由图1可以看出,采收时桃果实表面偏白,对照组与苯丙氨酸组的桃果皮着色程度均随着贮藏时间延长逐渐增加,但苯丙氨酸处理可以显著提高桃果皮的着色程度。苯丙氨酸处理组桃果实的着色时间明显早于对照组:贮藏第2天时苯丙氨酸组已出现明显变红,对照组刚开始着色;贮藏第4天时,苯丙氨酸组桃果皮表面已几乎全部变为红色,对照组在贮藏第8天时桃果皮表面才全变为红色。苯丙氨酸处理组果实的着色程度也明显高于对照组:贮藏第8天时,苯丙氨酸组桃果皮的红色程度明显地深于对照组,颜色更为鲜红。

图1 苯丙氨酸处理桃果实表型图
Fig.1 Fruit phenotype of peach treated with phenylalanine
2.2 苯丙氨酸处理对采后桃果皮色差的影响
色差是判断色泽变化的重要数据:其中ΔE值表明颜色的总体变化;a*值表示红绿值,正值表示偏红;L*值表示亮度,数值越大表示越白亮[20];CIRG值表示果实色泽,与花色苷含量有关[21]。由图2-a可以看出,对照组和苯丙氨酸组果实的ΔE值在贮藏期间均逐渐上升,但苯丙氨酸组果实的ΔE值显著高于对照组(P<0.05),说明苯丙氨酸组果实颜色变化最大。2组果实的L*值也随着贮藏时间延长逐渐降低(图2-b),表明果面色泽逐渐形成。红色相关指标a*值和CIRG值变化趋势一致,均呈上升趋势(图2-c和图2-d),但苯丙氨酸组果实的a*值和CIRG值显著高于对照组(P<0.05),说明苯丙氨酸处理明显促进了果实表面红色的形成。贮藏第2天,苯丙氨酸组a*值为正值,说明苯丙氨酸组果实已经出现红色着色现象,贮藏第4天,对照组a*值达到正值,但仅为苯丙氨酸组的21.82%,表明苯丙氨酸组果实着色时间也明显早于对照组。

a-ΔE值;b-L*值;c-a*值;d-CIRG值
图2 苯丙氨酸处理对采后桃果皮色差ΔE值、L*值、a*值和CIRG值的影响
Fig.2 Effects of phenylalanine treatment on ΔE, L*, a* and CIRG values of postharvest peach peel color difference
注:*表明同一贮藏时间下2种处理间具有显著性差异(P<0.05)(下同)。
2.3 苯丙氨酸处理对采后桃果皮总花色苷含量的影响
花色苷是桃果皮呈色的主要物质,花色苷的含量可以表明色泽的变化[2]。由图3可以看出,2组桃果皮总花色苷含量在贮藏期间均不断上升,苯丙氨酸处理组的花色苷含量显著高于对照组(P<0.05)。贮藏第2天时,苯丙氨酸组果皮的花色苷含量高出对照组4.86倍,显著高于对照组(P<0.05),表明苯丙氨酸处理明显加快了果实的着色。贮藏第8天,2组桃果皮花色苷含量均达到8 d贮藏期间的最大值,其中苯丙氨酸组果皮的花色苷含量是对照组的1.64倍,说明苯丙氨酸处理明显提高采后桃果皮总花色苷含量。
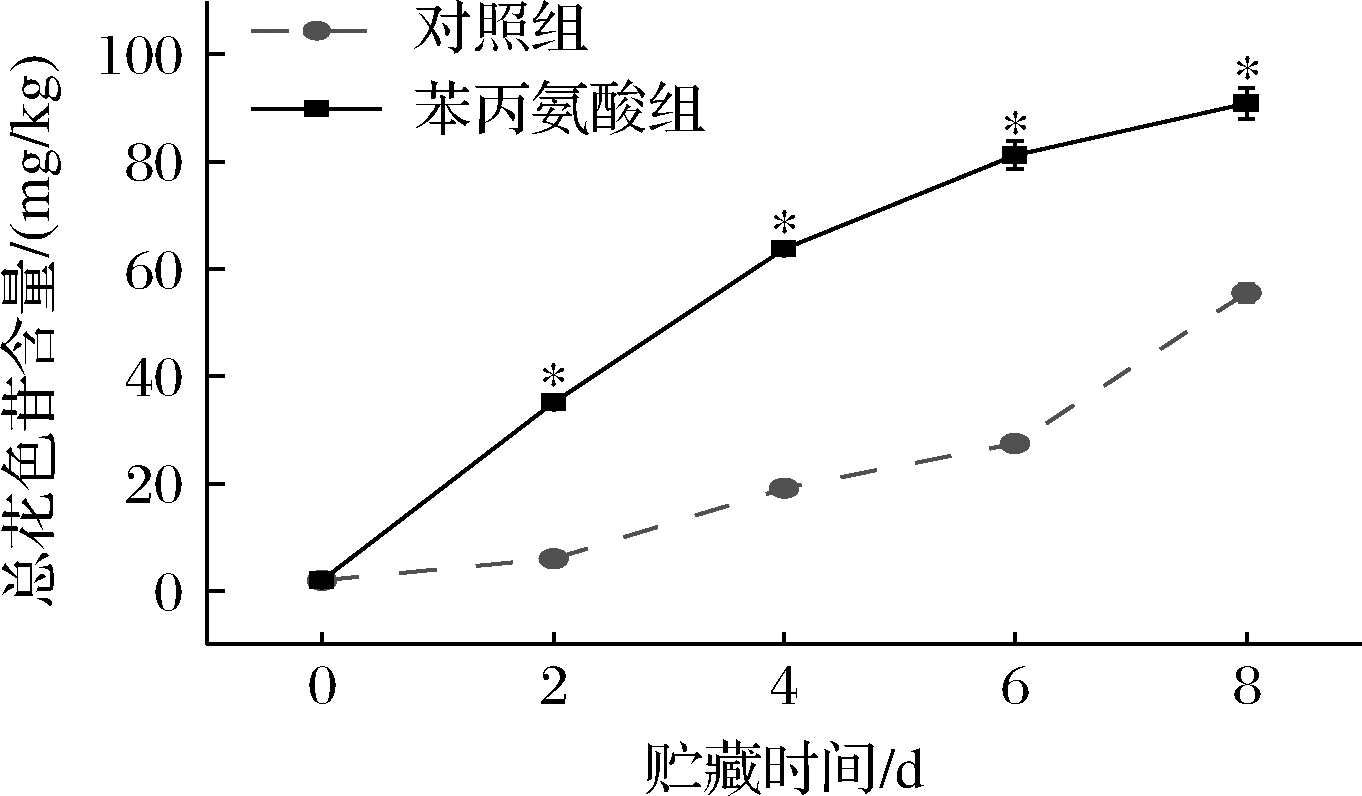
图3 苯丙氨酸处理对采后桃果皮总花色苷含量的影响
Fig.3 Effects of phenylalanine treatment on total anthocyanins content in postharvest peach peel
2.4 苯丙氨酸处理对采后桃果皮花色苷合成和转运相关基因表达的影响
花色苷的合成受多种结构基因和调控基因的控制,其中PAL, CHS, CHI, F3H, F3′H, DFR, ANS和UFGT基因是花色苷合成途径的关键结构基因[22],GST基因是花色苷转运途径的关键基因[23]。如图4所示,整个贮藏过程中2组桃果实的大多数结构基因的表达量呈现先上升后下降的趋势,其中苯丙氨酸处理显著促进了贮藏前期桃果皮中相关结构基因的表达。如图4-a所示,贮藏第2天,第4天和第6天时,黄酮类化合物合成途径的上游基因PAL在苯丙氨酸处理组中的表达量显著高于对照组(P<0.05),且在第4天时达到贮藏期最高的峰值。苯丙氨酸处理也显著促进了下游基因的表达,并且在第4天时达到最高峰值:苯丙氨酸处理组中CHS, CHI, F3H, DFR, ANS和UFGT基因在第4天时的表达量分别是对照组的6.79倍、9.85倍、5.26倍、3.16倍、2.56倍和1.33倍。贮藏第6天时,苯丙氨酸处理组中CHS, F3H, F3′H, ANS和UFGT基因的表达量显著高于对照组(P<0.05)。苯丙氨酸处理也显著地提升了花色苷转运相关基因的表达量,贮藏第6天和第8天时,苯丙氨酸处理组中GST基因表达量分别为对照组的1.73和2.56倍。

a-PAL;b-CHS;c-CHI;d-F3H;e-F3′H;f-DFR;g-ANS;h-UFGT;i-GST
图4 苯丙氨酸处理对采后桃果皮花色苷代谢相关途径关键基因的基因表达的影响
Fig.4 Effects of phenylalanine treatment on gene expression of key genes related to anthocyanin metabolism in postharvest peach peel
2.5 苯丙氨酸处理对采后桃果皮MYB、bHLH和WD40类转录因子基因表达的影响
花色苷合成结构基因的表达受MYB、bHLH和WD40类转录因子以及其组成的MBW复合体调控[24]。如图5-a所示,苯丙氨酸处理显著促进了MYB10.1基因的表达,其表达量在贮藏第2天,第4天和第8天时均显著高于对照组(P<0.05)。苯丙氨酸组的bHLH3和WD40-1基因表达量在贮藏期间均呈先上升后下降的趋势,在贮藏第2天、第4天和第6天时,其基因表达量均显著高于对照组(P<0.05)(图5-b和图5-c)。贮藏前4 d,苯丙氨酸处理显著促进了MYB、bHLH和WD40类转录因子的基因表达,这与苯丙氨酸处理对大多数花色苷合成相关结构基因表达量变化趋势的影响一致(图4)。
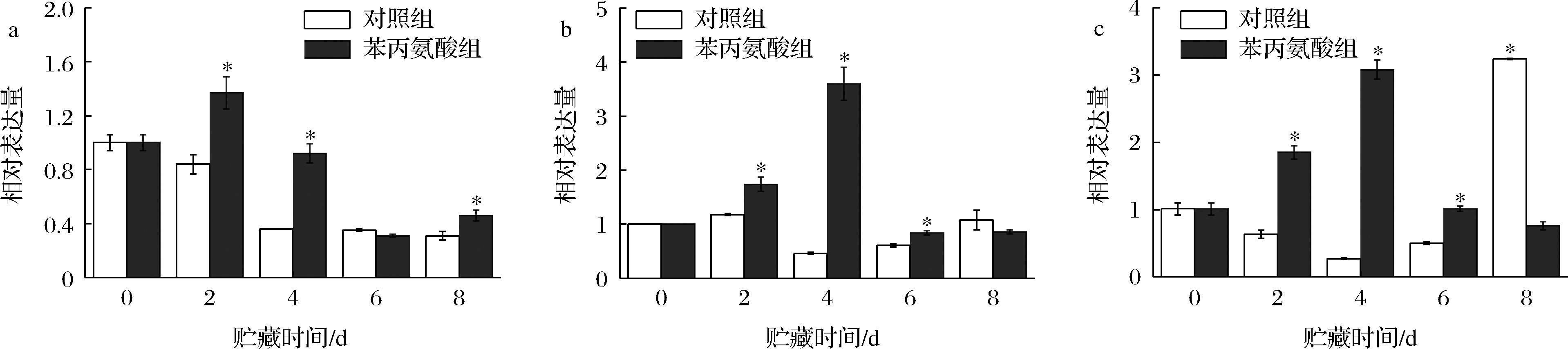
a-MYB10.1;b-bHLH3;c-WD40-1
图5 苯丙氨酸处理对采后桃果皮转录因子MYB10.1、bHLH3和WD40-1基因表达的影响
Fig.5 Effects of phenylalanine treatment on gene expression of transcription factors, MYB10.1, bHLH3, and WD40-1 in postharvest peach peel
3 讨论
花色苷是桃果皮色泽形成的主要物质[2],但研究发现遮光套袋会影响采收果实花色苷的生物合成,导致果实外观偏白[1,19]。花色苷合成途径是目前研究的最清楚的植物次生代谢途径之一,在一些模式植物和园艺作物上已经被清楚地阐明[6-7]。研究发现苯丙氨酸是花色苷生物合成的前体物质,在其生物合成中发挥着重要的作用[6,9]。为了探究苯丙氨酸对套袋桃果实着色的影响,本研究以套袋采收的‘湖景蜜露’桃为实验品种,发现采后苯丙氨酸浸泡处理可有效提早和增加桃果实着色(图1),苯丙氨酸处理后桃果皮的花色苷含量显著高于对照组,红色相关色差值a*值和CIRG值也显著提高(P<0.05)。EDAHIRO等[25]采用苯丙氨酸作为培养液连续培养产花色苷的草莓细胞,在一定浓度范围内增加苯丙氨酸的量可以增加花色苷的产生量;SOGAVR等[16]发现外源苯丙氨酸处理提高了李果实花色苷、黄酮和酚类物质的含量,这些研究均与本研究结果一致,表明苯丙氨酸可在促进花色苷合成中发挥作用。PORTU等[15]发现叶面喷施苯丙氨酸和尿素可轻微促进Tempranillo葡萄总花色苷含量,但苯丙氨酸处理几乎没有增加Garnacha葡萄的总花色苷含量[26],这说明苯丙氨酸处理对果实花色苷积累可能具有多重性和复杂性。桃果实花色苷合成相关基因在果实采后着色过程中明显地升高[19,27];BISWAS等[28]发现添加苯丙氨酸和水解乳蛋白能提高Panax sikkimensis细胞的L-苯丙氨酸解氨酶、类黄酮半乳糖苷转移酶活性和其基因的表达,提升花色苷的产量;AGHDAM等[12]发现苯丙氨酸处理可以提升番茄果实L-苯丙氨酸解氨酶酶活性提高和酚类和黄酮类物质的积累。本研究发现苯丙氨酸处理可以有效地促进花色苷合成途径中相关基因的表达,特别是显著促进了贮藏前期PAL、F3H、DFR基因和MYB10.1、bHLH3转录因子的表达(P<0.05),与前人结果一致[19,27]。这表明采后苯丙氨酸处理可能是通过促进桃花色苷合成相关基因的表达实现花色苷含量增加和促进着色的效果。目前关于苯丙氨酸在促进果实着色中的应用主要聚焦在采前阶段:FANYUK等[29]发现采前2~4周施用苯丙氨酸可以促进芒果和苹果果皮着色,GOHARI等[30]发现采前叶面施用壳聚糖结合苯丙氨酸的纳米复合材料可以提高葡萄L-苯丙氨酸解氨酶酶活性和花色苷含量。本研究发现采后苯丙氨酸处理同样可以促进套袋桃果皮花色苷合成和着色,为苯丙氨酸在桃采后色泽调控中的应用提供了新的思路。
4 结论
本研究以套袋采收的‘湖景蜜露’桃果实为实验材料,探究了采后苯丙氨酸处理对桃果皮色泽形成的影响。结果表明,采后苯丙氨酸处理可以显著提高采后桃果皮色差a*值、CIRG值和总花色苷含量,促进果皮的着色;苯丙氨酸处理可提升花色苷合成途径相关结构基因和调节基因的表达量,有利于其花色苷的合成。本研究为苯丙氨酸在桃采后色泽调控中的应用提供了新的理论参考。
[1] 田梦瑶, 周宏胜, 唐婷婷, 等.外源蔗糖处理对采后桃果皮色泽形成的影响[J].食品科学, 2022, 43(1):177-183.
TIAN M Y, ZHOU H S, TANG T T, et al.Effect of exogenous sucrose treatment on the peel coloration in postharvest peaches[J].Food Science, 2022, 43(1):177-183.
[2] RAHIM M A, BUSATTO N, TRAINOTTI L.Regulation of anthocyanin biosynthesis in peach fruits[J].Planta, 2014, 240(5):913-929.
[3] 徐僡, 郑远静, 高方平, 等.花色苷的生物合成及其影响因素研究进展[J].江苏农业学报, 2019, 35(5):1246-1253.
XU H, ZHENG Y J, GAO F P, et al.Advances in the biosynthesis and influencing factors of anthocyanins[J].Jiangsu Journal of Agricultural Sciences, 2019, 35(5):1246-1253.
[4] ZENG X Q, LI H, JIANG W B, et al.Phytochemical compositions, health-promoting properties and food applications of crabapples:A review[J].Food Chemistry, 2022, 386:132789.
[5] 何平, 李林光, 王海波, 等.套袋对‘秋雪’桃果实品质及花青素合成相关基因表达的影响[J].植物生理学报, 2018, 54(2):273-281.
HE P, LI L G, WANG H B, et al.Effect of bagging on fruit quality and anthocyanin synthesis-related gene expression of ‘Qiuxue’ peach[J].Plant Physiology Journal, 2018, 54(2):273-281.
[6] 庄维兵, 刘天宇, 束晓春, 等.植物体内花青素苷生物合成及呈色的分子调控机制[J].植物生理学报, 2018, 54(11):1630-1644.
ZHUANG W B, LIU T Y, SHU X C, et al.The molecular regulation mechanism of anthocyanin biosynthesis and coloration in plants[J].Plant Physiology Journal, 2018, 54(11):1630-1644.
[7] 戴思兰, 洪艳.基于花青素苷合成和呈色机理的观赏植物花色改良分子育种[J].中国农业科学, 2016, 49(3):529-542.
DAI S L, HONG Y.Molecular breeding for flower colors modification on ornamental plants based on the mechanism of anthocyanins biosynthesis and coloration[J].Scientia Agricultura Sinica, 2016, 49(3):529-542.
[8] GAO H N, JIANG H, CUI J Y, et al.Review:The effects of hormones and environmental factors on anthocyanin biosynthesis in apple[J].Plant Science, 2021, 312:111024.
[9] KUMAR PATEL M, MAURER D, FEYGENBERG O, et al.Phenylalanine:A promising inducer of fruit resistance to postharvest pathogens[J].Foods, 2020, 9(5):646.
[10] PERKOWSKI M C, WARPEHA K M.Phenylalanine roles in the seed-to-seedling stage:Not just an amino acid[J].Plant Science, 2019, 289(C):110223.
[11] OLIVA M, HATAN E, KUMAR V, et al.Increased phenylalanine levels in plant leaves reduces susceptibility to Botrytis cinerea[J].Plant Science, 2020, 290:110289.
[12] AGHDAM M S, MORADI M, RAZAVI F, et al.Exogenous phenylalanine application promotes chilling tolerance in tomato fruits during cold storage by ensuring supply of NADPH for activation of ROS scavenging systems[J].Scientia Horticulturae, 2019, 246:818-825.
[13] SAIDI L, DUANIS-ASSAF D, GALSARKER O, et al.Elicitation of fruit defense response by active edible coatings embedded with phenylalanine to improve quality and storability of avocado fruit[J].Postharvest Biology and Technology, 2021, 174:111442.
[14] CHEN Q B, MAN C, LI D N, et al.Arogenate dehydratase isoforms differentially regulate anthocyanin biosynthesis in Arabidopsis thaliana[J].Molecular Plant, 2016, 9(12):1609-1619.
[15] PORTU J, L PEZ-ALFARO I, G
PEZ-ALFARO I, G MEZ-ALONSO S, et al.Changes on grape phenolic composition induced by grapevine foliar applications of phenylalanine and urea[J].Food Chemistry, 2015, 180:171-180.
MEZ-ALONSO S, et al.Changes on grape phenolic composition induced by grapevine foliar applications of phenylalanine and urea[J].Food Chemistry, 2015, 180:171-180.
[16] SOGVAR O B, RABIEI V, RAZAVI F, et al.Phenylalanine alleviates postharvest chilling injury of plum fruit by modulating antioxidant system and enhancing the accumulation of phenolic compound[J].Food Technology and Biotechnology, 2020, 58(4):433-444.
[17] 洪敏, 贺明阳, 王日葵, 等.塔罗科血橙室温贮藏期间花色苷和糖酸积累变化及相关代谢基因表达特征[J].浙江大学学报(农业与生命科学版), 2021, 47 (5):589-597.
HONG M, HE M Y, WANG R K, et al.Changes of anthocyanin, sugar and acid accumulation and expression characteristics of related metabolic genes in Tarocco blood oranges during room temperature storage[J].Journal of Zhejiang University (Agriculture and Life Sciences), 2021, 47(5):589-597.
[18] ZHAO Y, DONG W Q, WANG K, et al.Differential sensitivity of fruit pigmentation to ultraviolet light between two peach cultivars[J].Frontiers in Plant Science, 2017, 8:1552.
[19] TANG T T, ZHOU H S, WANG L B, et al.Post-harvest application of methyl jasmonate or prohydrojasmon affects color development and anthocyanins biosynthesis in peach by regulation of sucrose metabolism[J].Frontiers in Nutrition, 2022, 9:871467.
[20] PATHARE P B, OPARA U L, AL-SAID F A.Colour measurement and analysis in fresh and processed foods:A review[J].Food and Bioprocess Technology, 2013, 6(1):36-60.
[21] CARRE O J, MART
O J, MART NEZ A, ALMELA L, et al.Measuring the color of table grapes[J].Color Research and Application, 1996, 21(1):50-54.
NEZ A, ALMELA L, et al.Measuring the color of table grapes[J].Color Research and Application, 1996, 21(1):50-54.
[22] XU Y H, LI S E, HUAN C, et al. Effects of 1-methylcyclopropene treatment on quality and anthocyanin biosynthesis in plum (Prunus salicina cv. Taoxingli) fruit during storage at a non-chilling temperature. Postharvest Biology and Technology, 2020, 169: 111291.
[23] ZHAO Y, DONG W Q, ZHU Y C, et al.PpGST1, an anthocyanin-related glutathione S-transferase gene, is essential for fruit coloration in peach[J].Plant Biotechnology Journal, 2020, 18 (5):1284-1295.
[24] LIU Y F, MA K X, QI Y W, et al.Transcriptional regulation of anthocyanin synthesis by MYB-bHLH-WDR complexes in kiwifruit (Actinidia chinensis)[J].Journal of Agricultural and Food Chemistry, 2021, 69(12):3677-3691.
[25] EDAHIRO J I, NAKAMURA M, SEKI M, et al.Enhanced accumulation of anthocyanin in cultured strawberry cells by repetitive feeding of L-phenylalanine into the medium[J].Journal of Bioscience and Bioengineering, 2005, 99(1):43-47.
[26] PORTU J, L PEZ R, SANTAMAR
PEZ R, SANTAMAR A P, et al.Elicitation with methyl jasmonate supported by precursor feeding with phenylalanine:Effect on Garnacha grape phenolic content[J].Food Chemistry, 2017, 237:416-422.
A P, et al.Elicitation with methyl jasmonate supported by precursor feeding with phenylalanine:Effect on Garnacha grape phenolic content[J].Food Chemistry, 2017, 237:416-422.
[27] ZHANG Y T, LING J, ZHOU H S, et al.1-Methylcyclopropene counteracts ethylene inhibition of anthocyanin accumulation in peach skin after harvest[J].Postharvest Biology and Technology, 2022, 183:111737.
[28] BISWAS T, MATHUR A, GUPTA V, et al.Elicitation and phenylalanine precursor feeding based modulation of in vitro anthocyanin production, enzyme activity and gene expression in an Indian ginseng congener- Panax sikkimensis Ban[J].Industrial Crops &Products, 2020, 145:111986.
[29] FANYUK M, KUMAR PATEL M, OVADIA R, et al.Preharvest application of phenylalanine induces red color in mango and apple fruit’s skin[J].Antioxidants, 2022, 11(3):491.
[30] GOHARI G, ZAREEI E, KULAK M, et al.Improving the berry quality and antioxidant potential of flame seedless grapes by foliar application of chitosan-phenylalanine nanocomposites (CS-Phe NCs)[J].Nanomaterials, 2021, 11(9):2287.