低聚糖是一种新型功能性糖源,已广泛应用于食品、医药、饲料添加剂等领域[1-2]。研究表明,功能性低聚糖具有抗氧化、降血脂、降血糖和促进肠道益生菌增殖等功效[3-4],在预防便秘、结肠癌、肥胖、糖尿病、调节肠道菌群结构等方面具有积极作用[5-6]。低聚糖不能被人体直接消化利用,但是可以通过肠道菌的发酵产生有机酸,维持肠道内环境稳定,对人体健康至关重要。
短链脂肪酸(short chain fatty acids,SCFAs)是肠道菌群代谢的有机酸,膳食纤维、抗性淀粉和低聚糖是微生物发酵产短链脂肪酸的主要底物。短链脂肪酸可以调节肠道的酸碱平衡,抑制肠道内病原菌的繁殖,维持肠道微生态平衡[7-8]。此外,短链脂肪酸能为结肠细胞提供能量,作为信号分子调控人体的不同生物过程[9-10]。短链脂肪酸进入肝脏后可以参与胆固醇合成的调控,降低人体血液中的胆固醇,在维持人体健康方面发挥了重要作用[11-12]。大量研究显示,低聚糖和膳食纤维能够促进肠道益生菌增殖,调节肠道pH。酸解米糠和木薯浆得到的低聚糖能促进乳酸杆菌、双歧杆菌、拟杆菌的增殖[13]。大豆膳食纤维可以促进肠道菌产生乙酸[14]。山药低聚糖能促进植物乳杆菌产生乳酸,而对保加利亚乳杆菌产生乙酸有促进作用[15]。从灵芝孢子粉中提取的两种低聚糖均能被肠道微生物利用,促进短链脂肪酸的积累[16]。短链脂肪酸的形成受益生元的种类和菌群结构的影响,研究特定的低聚糖对益生菌短链脂肪酸代谢的影响,可以反映菌群的活性。
铁皮石斛属于兰科石斛属植物,为名贵中药材,多糖是其主要活性成分[17]。渠婷等[18]从金钗石斛中分离出一个低聚糖纯品,能显著提高乳杆菌增殖和对环境的耐受性。WONG等[19]采用酶解的方法从铁皮石斛多糖制备了低聚糖,并对其结构进行了分析。这些研究表明铁皮石斛中可能存在低聚糖。本研究通过铁皮石斛低聚糖的分离纯化,探讨其对益生菌增殖和有机酸代谢的影响,明确铁皮石斛低聚糖的益生功能。低聚糖是石斛多糖提取时的副产物,结果为石斛低聚糖的开发和利用提供依据。
1 材料与方法
1.1 材料与试剂
新鲜铁皮石斛购于安徽省霍山县;嗜酸乳杆菌 (Lactobacillus acidophilus) CICC6075、干酪乳杆菌 (Lactobacillus casei) CICC20995,中国工业微生物菌种保藏管理中心;两歧双歧杆菌 (Bifidobacterium bifidum) CCFM16,江南大学微生物实验室;肠道菌来自小鼠粪便;Sephadex G-10、DEAE-52纤维素,各种分子质量的右旋糖苷,北京瑞达恒辉科技发展有限公司;甘露糖、核糖、鼠李糖、阿拉伯糖、木糖、岩藻糖、葡萄糖醛酸、半乳糖醛酸,分析纯,美国Sigma公司;乳酸、乙酸、丙酸、丁酸、磷酸二氢钾、甲醇、三氟乙酸(均为色谱纯)、低聚果糖(分析纯),北京索莱宝科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
RE-52AA旋转蒸发器,上海亚荣生化仪器厂;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;YQX-2厌氧培养箱,上海新苗器械制造有限公司;JK-JH01超净台,安徽杰克欧德实验室设备有限公司;Imark酶标仪,美国伯乐有限公司;JY-1002电子天平,上海良平天平厂;THZ-98AB摇床,上海一恒科学仪器有限公司;LC-20A高效液相色谱仪,日本岛津公司。
1.3 试验方法
1.3.1 铁皮石斛低聚糖的提取
将新鲜的铁皮石斛烘干粉碎后过60目筛,按料液比1:50(g:mL)加入蒸馏水,60 ℃水浴浸提3 h,然后离心取上清液浓缩,加入无水乙醇至体系乙醇体积分数达80%,4 ℃静置24 h沉淀多糖,离心后取上清液,采用活性炭脱色、Sevage法脱蛋白,进行初步的分离纯化,浓缩后进行真空冷冻干燥得粗低聚糖。
1.3.2 铁皮石斛低聚糖的纯化
1.3.2.1 DEAE-52阴离子纤维素纯化铁皮石斛低聚糖
利用DEAE-52阴离子纤维素色谱柱分离低聚糖,色谱柱规格16 mm×500 mm,上样量为4 mL,上样质量浓度为10 g/L,用不同浓度NaCl溶液(pH 7.0)洗脱,流速为 2 mL/min,每隔5 min收集1管,采用苯酚-硫酸法[20]检测低聚糖,以低聚糖质量浓度(g/L)为纵坐标,洗脱管数为横坐标作洗脱曲线图。
1.3.2.2 Sephadex G-10葡聚糖凝胶纯化铁皮石斛低聚糖
利用Sephadex G-10葡聚糖凝胶柱对DEAE-52阴离子纤维素分离后的低聚糖进行二次分离纯化,色谱柱规格16 mm×500 mm,上样量为4 mL,上样质量浓度为10 g/L,用蒸馏水洗脱,流速为0.5 mL/min,每隔10 min收集1管,苯酚-硫酸法检测低聚糖,以低聚糖质量浓度(g/L)为纵坐标,洗脱管数为横坐标作洗脱曲线图。
1.3.3 铁皮石斛低聚糖分子质量测定
利用凝胶渗透色谱法测定低聚糖的相对分子质量,取10 mg样品,配制成10 g/L溶液,用0.22 μm滤膜过滤后备用。
色谱条件:P230型GPC-凝胶渗透色谱系统,色谱柱 Pl aquagel-OH MIXED(7.5 mm×300 mm),进样流速1.0 mL/min,柱温40 ℃,流动相0.1 mol/L NaNO3,标准样品:不同相对分子质量的右旋糖苷。
1.3.4 铁皮石斛低聚糖单糖组成测定
精密称取样品1 mg至10 mL安培瓶中,加入3.0 mL、2 mol/L 三氟乙酸,然后定容10 mL,充氮,封管,120 ℃酸解4 h,取出加入甲醇氮吹干三氟乙酸,加3.0 mL水复溶备用。
检测条件:色谱柱Xtimate C18 (4.6 mm×200 mm, 5 μm);柱温30 ℃;流速1.0 mL/min。检测波长250 nm;进样量20 μL;流动相V(0.05 mol/L磷酸二氢钾溶液):V(乙腈)=83:17。
1.3.5 铁皮石斛低聚糖体外模拟消化
参考王如月[21]的方法配制胃与小肠消化液,将铁皮石斛低聚糖溶于20 mL胃液中至糖终质量浓度为2 g/L,同时取等体积的胃液做空白对照,于37 ℃,90 r/min保温,在0、2、4、6 h后,分别取出1.0 mL样品,在水中煮沸10 min以灭酶,最后用1.0 mol/L NaHCO3溶液中和。
将10 mL上述反应6 h后的胃液(模拟胃消化6 h 后的溶液用1.0 mol/L NaHCO3 中和)与3 mL模拟小肠液混合,此为A组,B组为3 mL蒸馏水与10 mL胃消化液,C组为10 mL蒸馏水与3 mL小肠液,于37 ℃、120 r/min保温,在0、2、4、6 h后,分别取出1.0 mL 样品,在水中煮沸10 min以灭酶,最后用1.0 mol/L NaHCO3溶液中和。
1.3.6 铁皮石斛低聚糖对菌体生长的影响
乳酸菌菌种活化:在无菌操作条件下,从乳酸菌冻存管中吸取400 μL接种到MRS培养基中活化,活化处理12 h,活化处理3次后用于接种。
两歧杆菌菌种活化:在无菌无氧操作条件下,从冻存管中吸取400 μL接种到MRS培养基中培养24 h,活化处理3次后用于接种。
肠道菌获得:新鲜的小鼠粪便从皖南医学院动物实验中心获得,以无菌粪便收集盒收集小鼠粪便,立即用无菌磷酸盐缓冲液(PBS,0.1 mol/L)转移至厌氧操作箱内。小鼠粪便与PBS缓冲液以1:20(g:mL)比例配制。经涡旋振荡器充分混匀后,以5层无菌纱布过滤得到粪便匀浆用于接种[22]。
以添加5 g/L铁皮石斛低聚糖为唯一碳源代替培养基中的葡萄糖,以葡萄糖(阴性)、低聚果糖(阳性)为对照,每瓶分装30 mL培养基,分别接种嗜酸乳杆菌、干酪乳杆菌、两歧双歧杆菌和肠道菌,接种量为5%(体积分数),置于厌氧工作站37 ℃下恒温培养。在(0、4、8、12、24、36、48 h)取出发酵液,采用平板计数法,测定培养基中活菌数,比较不同碳源对菌体增殖的影响。
1.3.7 发酵液pH测定
取不同培养阶段的发酵液(0、4、8、12、24、36、48 h),用精密pH计进行pH测定。
1.3.8 发酵液中残糖的测定
取不同时间点的发酵液,用苯酚-硫酸法测定发酵液中残糖含量。
1.3.9 发酵液中有机酸的测定
利用高效液相色谱测定有机酸的含量,色谱条件:Supersil AQ-C18(2.6 mm×150 mm,5 μm);流动相A:浓度为0.05 mol/L 磷酸二氢钾(磷酸调节其pH为2.8±0.02);流动相B:甲醇;检测波长210 nm;流速1.0 mL/min;柱温40 ℃;进样量10 μL;洗脱程序:[0~7 min V(A):V(B)=95:5,7~25 min V(A):V(B)=85:15]。
取乳酸、乙酸、丙酸和丁酸4种标准品各10.00 mg,以双蒸水定容至10.00 mL,配制成标准溶液。分别取各标准溶液50、100、200、400、800 μL,以双蒸水定容至1.00 mL,配制成不同浓度的标准溶液。以标准有机酸浓度为横坐标,相应的峰面积为纵坐标绘制标准曲线,得到线性回归方程。乳酸的标准曲线为Y1=518 386X+610.0,R2=0.999 8;乙酸的标准曲线为 Y2=289 046X+1 527.1,R2=0.999 9;丙酸的标准曲线为 Y3=335 849X-2 578.8,R2=0.999 5;丁酸的标准曲线为Y4=331 719X+1 269.0,R2=0.999 5。
取各个时间段发酵液1 mL于4 ℃下离心(10 000 r/min,5 min),取其上清液经0.22 μm滤膜过滤后,使用高效液相色谱法进行测定,样品中待测组分用保留时间和峰高增量法定性,标准曲线法定量。
1.3.10 发酵过程中小鼠肠道特定菌群数量测定
参考郑志昌等[23]的研究方法,按说明书要求分别配制双歧杆菌、乳杆菌、拟杆菌和大肠杆菌检测培养基,于121 ℃灭菌30 min备用。取不同时间点的发酵液,并用无菌生理盐水进行梯度稀释,取合适稀释度的菌液200 μL均匀涂布在不同的培养基中,然后将平板置于厌氧工作站37 ℃恒温培养48 h,每个样本做3个平行试验。
1.4 数据处理与统计分析
试验结果采用平均值附加标准差(x±s)表示;运用SPSS 26软件,采用方差分析(ANOVA)进行数据统计分析;各处理组间的差异比较用最小显著差别(least significant difference,LSD)法,P<0.05数据差异显著。
2 结果与分析
2.1 铁皮石斛低聚糖的纯化
2.1.1 DEAE-52阴离子纤维素分离纯化铁皮石斛低聚糖
利用DEAE-52阴离子纤维素交换柱对铁皮石斛粗低聚糖进行纯化,结果如图1-a所示,用蒸馏水和不同浓度梯度的NaCl溶液洗脱得到3个组分,分别为DOO-1,DOO-2和DOO-3,其中DOO-1为中性糖,其含量为83.25%,DOO-2和DOO-3为酸性糖,含量分别为6.65%和10.08%。由于DOO-1含量很高,DOO-2和DOO-3含量很低,故后续实验选用DOO1组分进行分离纯化。
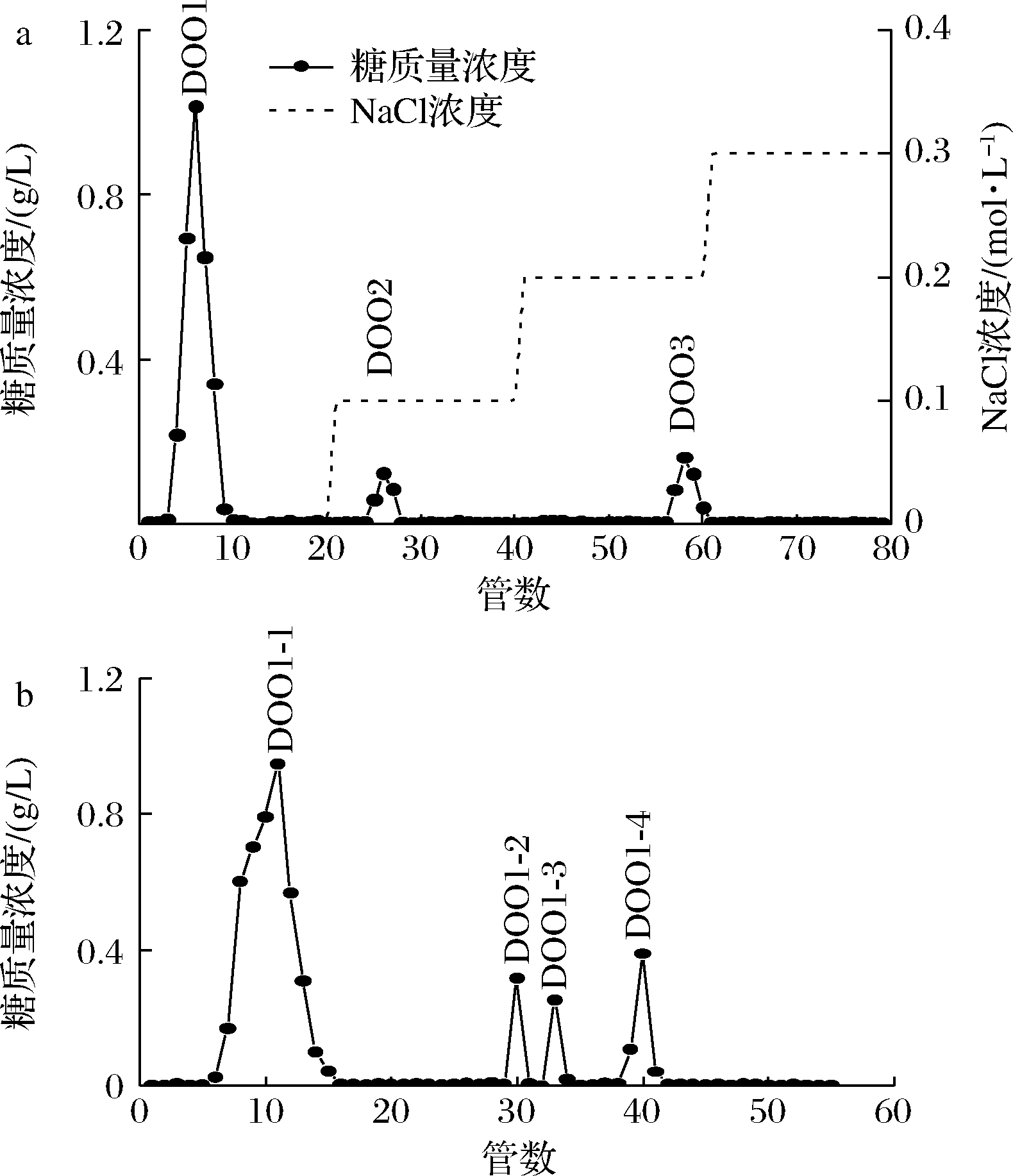
a-DEAE-52阴离子纤维素;b-Sephadex G-10
图1 铁皮石斛低聚糖洗脱曲线
Fig.1 Elution profile of Dendrobium officinale oligosaccharides on DEAE-52 cellulose and Sephadex G-10 column
2.1.2 Sephadex G-10葡聚糖凝胶分离纯化铁皮石斛低聚糖
利用 Sephadex G-10葡聚糖凝胶柱对DOO-1组分进一步分离纯化,结果如图1-b所示,葡聚糖凝胶洗脱出4个组分,分别为DOO1-1(81.37%)、DOO1-2(5.40%)、DOO1-3(3.79%)、DOO1-4(9.43%),由于DOO1-1组分含量最高,其余组分含量很低,故合并收集DOO1-1组分进行后续研究。
2.2 铁皮石斛低聚糖相对分子质量及其单糖组成
由图2可知,铁皮石斛低聚糖DOO1-1组分均一性良好,峰形单一且对称。根据标准曲线计算得到其相对分子质量为2 270 Da,说明DOO1-1为低聚糖。由图3-b可知,铁皮石斛低聚糖DOO1-1主要是由葡萄糖(65.0%)、甘露糖(28.0%)构成,还含有少量葡萄糖醛酸(2.6%)、半乳糖(3.1%)、阿拉伯糖(1.4%)。其百分摩尔比葡萄糖:甘露糖:葡萄糖醛酸:半乳糖:阿拉伯糖为1.00:0.43:0.04:0.05:0.02。
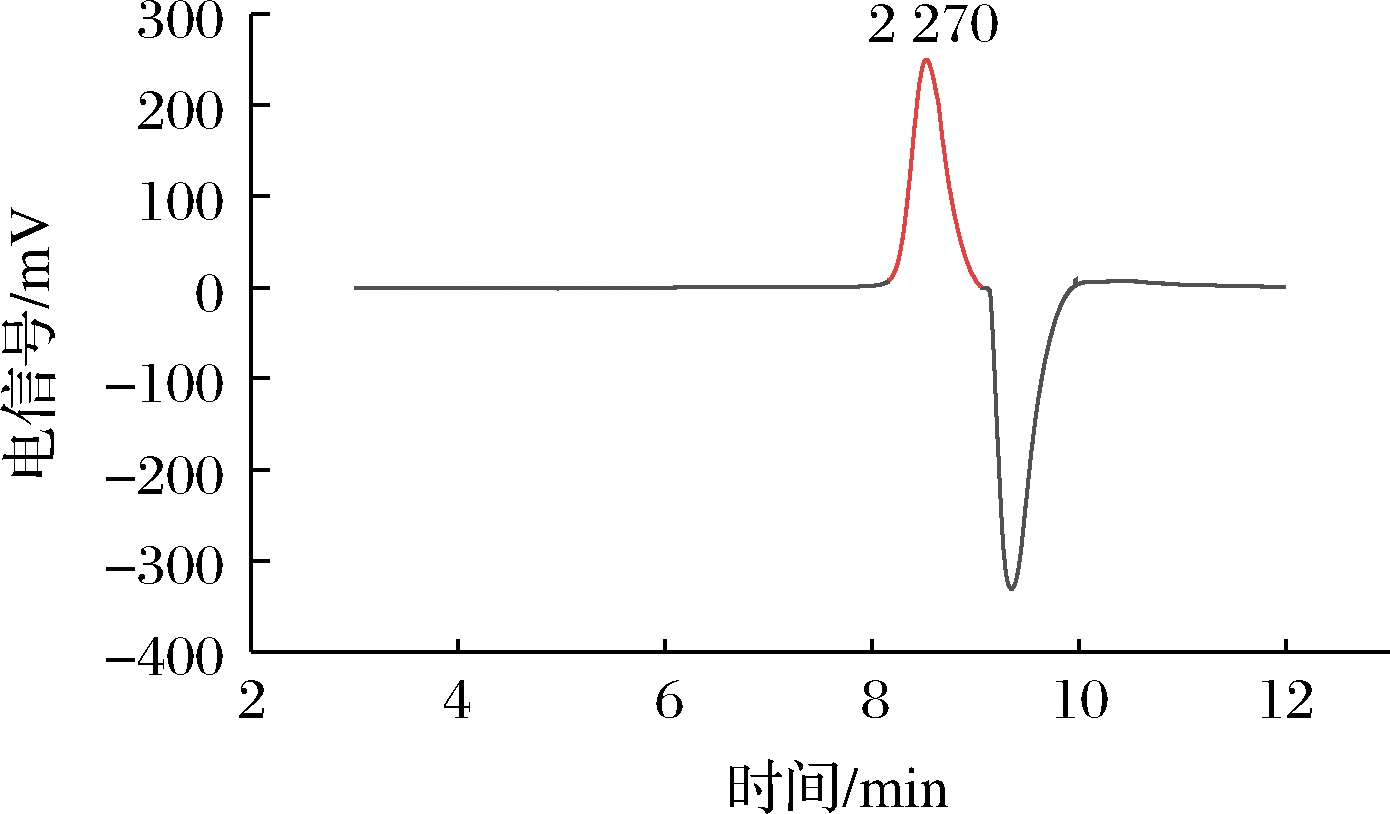
图2 低聚糖DOO1-1的相对分子质量
Fig.2 The relative molecular mass of oligosaccharide DOO1-1

a-单糖标准图谱;b-单糖组成图谱
图3 低聚糖DOO1-1单糖组成
Fig.3 The monosaccharide composition of DOO1-1
2.3 铁皮石斛低聚糖体外模拟消化
利用模拟胃肠液对铁皮石斛低聚糖DOO1-1降解的影响,模拟胃肠液中总糖和还原糖变化情况如表1所示。经过模拟胃和肠液消化6 h后,铁皮石斛低聚糖DOO1-1的总糖和还原糖含量均没有明显变化。说明铁皮石斛低聚糖DOO1-1能够抵抗人体胃肠环境的消化,初步认为其符合益生元的标准。
表1 DOO1-1在模拟胃肠液中的水解情况
Table 1 Hydrolysis of DOO1-1 in simulated gastrointestinal fluid

样品消化时间/h总糖含量/(mg/mL)还原糖含量/(mg/mL)01.997±0.0430.183±0.002人工胃液21.994±0.0280.184±0.00841.992±0.0110.179±0.00761.976±0.0120.184±0.00301.393±0.0220.150±0.004人工肠液21.391±0.0280.152±0.00541.383±0.0060.148±0.00561.367±0.0090.152±0.001
2.4 铁皮石斛低聚糖对菌体生长的影响
图4表示嗜酸乳杆菌、干酪乳杆菌、两歧双歧杆菌和肠道菌在不同碳源培养基中的生长状况。由图4可知,随着培养时间的延长,葡萄糖组、低聚果糖组和铁皮石斛低聚糖组菌体数量均随着时间的延长而增加。与铁皮石斛低聚糖和低聚果糖相比,前4 h葡萄糖组各种菌体生长速率较高,可能是因为葡萄糖为单糖,更容易被菌体利用,而低聚糖需要被降解成单糖后才能利用。在4~24 h,铁皮石斛低聚糖与低聚果糖组菌体数量显著升高;24~48 h,菌体数量几乎没有增加,菌体代谢缓慢,可能是营养物质耗尽,菌体生长进入稳定期。不同低聚糖益生特性不同[23],铁皮石斛低聚糖DOO1-1对干酪乳杆菌、嗜酸乳杆菌、两歧双歧杆菌和肠道菌均具有促生作用,其效果好于低聚果糖,这表明铁皮石斛低聚糖DOO1-1具有良好的益生活性,是一种极具开发潜能的益生元。

a-干酪乳杆菌;b-嗜酸乳杆菌;c-两歧双歧杆菌;d-肠道菌
图4 铁皮石斛低聚糖DOO1-1对益生菌生长的影响
Fig.4 Effect of oligosaccharide DOO1-1 from Dendrobium officinale on the growth of probiotics
2.5 发酵液pH的变化
图5表示嗜酸乳杆菌、干酪乳杆菌、两歧双歧杆菌和肠道菌在不同碳源培养基中pH变化。由图5可知,随着培养时间的延长,发酵液的pH逐渐降低,24 h之前pH变化较大,说明菌体生长较快,24~48 h发酵液pH较为稳定。在菌体培养过程中,以铁皮石斛低聚糖为碳源的发酵液pH均低于以低聚果糖为碳源的发酵液的pH。pH变化反映了菌体对碳源的利用和产酸能力[24]。铁皮石斛低聚糖能促进各种菌体的生长和有机酸的代谢,降低发酵液的pH,其效果好于低聚果糖。

a-干酪乳杆菌;b-嗜酸乳杆菌;c-两歧双歧杆菌;d-肠道菌群
图5 不同碳源发酵液中pH变化
Fig.5 Changes of pH in fermentation broth with different carbon sources
2.6 发酵液中残糖变化
图6表示嗜酸乳杆菌、干酪乳杆菌、两歧双歧杆菌和肠道菌在不同碳源培养基中残糖含量变化。由图6可知,随着发酵时间的增加,葡萄糖组、低聚果糖组、铁皮石斛低聚糖组的残糖含量均随发酵时间的延长而逐渐降低,说明它们都能被各种菌体利用,但两歧双歧杆菌对碳源利用速度慢一点。培养48 h后,在肠道菌培养基中的残糖含量最低,各种菌体对铁皮石斛低聚糖利用率高于低聚果糖,表明铁皮石斛低聚糖比低聚果糖益生效果好。这可能与糖的聚合度、单糖组成、链连接方式等因素有关[22]。

a-干酪乳杆菌;b-嗜酸乳杆菌;c-两歧双歧杆菌;d-肠道菌群
图6 在不同碳源发酵液中残糖含量变化
Fig.6 Changes of residual sugar in fermentation broth with different carbon sources
2.7 菌体发酵铁皮石斛低聚糖产酸分析
图7表示铁皮石斛低聚糖DOO1-1对干酪乳杆菌、嗜酸乳杆菌、两歧双歧杆菌和肠道菌产有机酸的影响。由图7可知,各种菌体都能利用铁皮石斛低聚糖DOO1-1发酵产生乳酸、乙酸、丙酸和丁酸,且它们的含量均随发酵时间延长而增加。DOO1-1能促进乳酸和乙酸的积累,但产丙酸和丁酸能力较差。在各种菌体中,干酪乳杆菌产酸能力最好,随着培养时间的延长,部分短链脂肪酸能被肠道菌利用,导致含量有所降低。

图7 低聚糖DOO1-1对益生菌发酵产短链脂肪酸的影响
Fig.7 Effect of oligosaccharides DOO1-1 on the production of short chain fatty acids by probiotics
注:不同小写字母表示差异显著。
短链脂肪酸是肠道微生物利用难消化的碳水化合物的代谢产物,在降低肠道pH,调控肠道菌群结构和免疫调节等方面起着重要作用[21]。此外,短链脂肪酸可以被宿主利用,被认为是宿主肠道的重要能量来源。因此,可推测铁皮石斛低聚糖促进短链脂肪酸的积累可能对机体表现出一定的益生作用。
2.8 不同碳源发酵过程中小鼠肠道特定菌群数量的变化
与葡萄糖相比,铁皮石斛低聚糖DOO1-1与低聚果糖显著增加了肠道菌群中双歧杆菌和乳杆菌的丰度(P<0.05),同时了降低了大肠杆菌和拟杆菌的丰度(P<0.05)(表2)。铁皮石斛低聚糖DOO1-1的效果好于低聚果糖,这表明铁皮石斛低聚糖DOO1-1具有良好的调节肠道菌群的功能。
表2 不同碳源发酵过程中小鼠肠道特定菌群数量的变化
Table 2 Changes of the number of special intestinal flora in mice in different carbon source during fermentation

碳源时间/h双歧杆菌(lg CFU/mL)乳杆菌(lg CFU/mL)拟杆菌(lg CFU/mL)大肠杆菌(lg CFU/mL)06.72±0.04e7.70±0.07d4.96±0.04e6.23±0.03e葡萄糖127.83±0.04d7.9±0.03bc6.56±0.11d7.78±0.03cd248.07±0.02c8.03±0.06b6.83±0.04b8.24±0.03a低聚果糖128.14±0.03c7.87±0.04c6.74±0.02bc7.73±0.03d248.85±0.06b7.92±0.02bc7.12±0.02a7.95±0.05bDOO1-1128.06±0.06c8.09±0.08ab6.63±0.04cd7.81±0.04cd249.08±0.06a8.19±0.07a7.07±0.05a7.82±0.03bc
注:同列肩标不同小写字母表示差异显著(P<0.05)。
3 结论
经水提和乙醇沉淀去除多糖,得到铁皮石斛粗低聚糖,再经DEAE-52阴离子纤维柱和Sephadex G-10凝胶色谱柱分离纯化得到一个铁皮石斛低聚糖组分DOO1-1,其含量为81.37%,相对分子质量为2 270,铁皮石斛低聚糖主要由葡萄糖(65.0%)、甘露糖(28.0%)构成,还含有少量葡萄糖醛酸(2.6%)、半乳糖(3.1%)、阿拉伯糖(1.4%)。其百分摩尔比葡萄糖:甘露糖:葡萄糖醛酸:半乳糖:阿拉伯糖为1.00:0.43:0.04:0.05:0.02。铁皮石斛低聚糖DOO1-1具有较强的抗胃肠消化能力。
益生试验结果表明,铁皮石斛低聚糖DOO1-1能促进干酪乳杆菌、嗜酸乳杆菌、两歧双歧杆菌以及肠道菌的增殖,其效果好于低聚果糖。铁皮石斛低聚糖能显著提高小鼠肠道菌群中乳杆菌和双歧杆菌的丰度,降低大肠杆菌和拟杆菌的丰度,调节肠道菌群结构。
铁皮石斛低聚糖DOO1-1能被干酪乳杆菌、嗜酸乳杆菌、两歧双歧杆菌和肠道菌利用产生乳酸、乙酸、丙酸和丁酸,其中乳酸和乙酸含量较高,而丙酸和丁酸含量较低。
[1] CATENZA K F, DONKOR K K.Recent approaches for the quantitative analysis of functional;oligosaccharides used in the food industry:A review[J].Food Chemistry, 2021, 355:129416.
[2] 陈又铭, 李宁, 袁卫涛, 等.低聚果糖的功能性质及其在食品中的应用[J].中国食品添加剂, 2022, 33(1):11-15.
CHEN Y M, LI N, YUAN W T, et al.The function properties of fructo-oligosaccharides and its application in food[J]. China Food Additives, 2022, 33(1):11-15.
[3]  VILA P F, MARTINS M, DE ALMEIDA COSTA F A, et al.Xylooligosaccharides production by commercial enzyme mixture from agricultural wastes and their prebiotic and antioxidant potential[J].Bioactive Carbohydrates and Dietary Fibre, 2020, 24:100234.
VILA P F, MARTINS M, DE ALMEIDA COSTA F A, et al.Xylooligosaccharides production by commercial enzyme mixture from agricultural wastes and their prebiotic and antioxidant potential[J].Bioactive Carbohydrates and Dietary Fibre, 2020, 24:100234.
[4] BABBAR N, DEJONGHE W, GATTI M, et al.Pectic oligosaccharides from agricultural by-products:Production, characterization and health benefits[J].Critical Reviews in Biotechnology, 2016, 36(4):594-606.
[5] BERSANETI G T, PAN N C, BALDO C, et al.Co-production of fructo oligosaccharides and levan by levansucrase from Bacillus subtilis natto with potential application in the food industry[J].Applied Biochemistry and Biotechnology, 2018, 184(3):838-851.
[6] 冯欣静, 史瑛, 周志磊, 等.黄酒低聚糖对便秘、肠道炎症与肥胖作用的研究进展[J].中国酿造, 2021, 40(8):1-7.
FENG X J, SHI Y, ZHOU Z L, et al.Research progress of effect of Huangjiu oligosaccharides on constipation, intestinal inflammation and obesity[J].China Brewing, 2021, 40(8):1-7.
[7] BLAAK E E, CANFORA E E, THEIS S, et al.Short chain fatty acids in human gut and metabolic health[J].Beneficial Microbes, 2020, 11(5):411-455.
[8] MAKKI K, DEEHAN E C, WALTER J, et al.The impact of dietary fiber on gut microbiota in host health and disease[J].Cell Host & Microbe, 2018, 23(6):705-715.
[9] KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al.From dietary fiber to host physiology:Short-chain fatty acids as key bacterial metabolites[J].Cell, 2016, 165(6):1332-1345.
[10] DING Q, NIE S P, HU J L, et al.In vitro and in vivo gastrointestinal digestion and fermentation of the polysaccharide from Ganoderma atrum[J].Food Hydrocolloids, 2017, 63:646-655.
[11] GAMAGE H K A H, TETU S G, CHONG R W W, et al.Fiber supplements derived from sugarcane stem, wheat dextrin and Psyllium husk have different in vitro effects on the human gut microbiota[J].Frontiers in Microbiology, 2018, 9:1618.
[12] OMAR J M, CHAN Y M, JONES M L, et al.Lactobacillus fermentum and Lactobacillus amylovorus as probiotics alter body adiposity and gut microflora in healthy persons[J].Journal of Functional Foods, 2013, 5(1):116-123.
[13] HANSAWASDI C, KURDI P.Potential prebiotic oligosaccharide mixtures from acidic hydrolysis of rice bran and cassava pulp[J].Plant Foods for Human Nutrition, 2017, 72(4):396-403.
[14] 王贲香, 贺阳, 蒋海芹, 等.大豆不溶性膳食纤维体外发酵产短链脂肪酸的研究[J].食品与发酵工业, 2020, 46(11):138-145.
WANG B X, HE Y, JIANG H Q, et al.Fermentation of soybean insoluble dietary fiber to produce short-chain fatty acids[J].Food and Fermentation Industries, 2020, 46(11):138-145.
[15] 刘露, 张雁, 魏振承, 等.肠道益生菌体外发酵山药低聚糖产短链脂肪酸的研究[J].食品科学技术学报, 2019, 37(4):49-56.
LIU L, ZHANG Y, WEI Z C, et al.Study on production of short chain fatty acids from yam oligosaccharides by intestinal probiotics fermentation in vitro[J].Journal of Food Science and Technology, 2019, 37(4):49-56.
[16] 杨开, 张雅杰, 张酥, 等.灵芝孢子粉低聚糖的制备及调节肠道菌群功能研究[J].食品与发酵工业, 2020, 46(9):37-42.
YANG K, ZHANG Y J, ZHANG S, et al.Preparation of Ganoderma lucidum spore oligosaccharide and its regulation on gut microbiota[J].Food and Fermentation Industries, 2020, 46(9):37-42.
[17] 魏明, 张倩, 钱森和, 等.不同预处理对铁皮石斛热风干燥特性及品质的影响[J].农业工程学报, 2022, 38(8):281-287.
WEI M, ZHANG Q, QIAN S H, et al.Effects of different pretreatment methods on the hot-air drying characteristics and quality of Dendrobium officinale stems[J].Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(8):281-287.
[18] 渠婷, 马朝阳, 王洪新.金钗石斛低聚糖纯品对乳杆菌抗应激能力的影响[J].安徽农业大学学报, 2017, 44(6):968-972.
QU T, MA C Y, WANG H X.Isolation of oligosaccharide from Dendrobium nobile and it effect on the anti-stress ability of Lactobacilli[J].Journal of Anhui Agricultural University, 2017, 44(6):968-972.
[19] WONG T L, LI L F, ZHANG J X, et al.Oligosaccharide analysis of the backbone structure of the characteristic polysaccharide of Dendrobium officinale[J].Food Hydrocolloids, 2023, 134:108038.
[20] CAI M, CHEN S, MA Q H, et al.Isolation of crude oligosaccharides from Hericium erinaceus by integrated membrane technology and its proliferative activity[J].Food Hydrocolloids, 2019, 95(4):426-431.
[21] 王如月. 燕麦多糖及其寡糖的制备与对肠道微生物的影响研究[D].无锡:江南大学, 2020.
WANG R Y. Preparation of oat polysaccharides and their oligosaccharides and their effects on intestinal microbes[D].Wuxi:Jiangnan University, 2020.
[22] 冯欣静, 周志磊, 姬中伟, 等.黄酒低聚糖的分离纯化与体外菌群增殖评价[J].食品与发酵工业, 2022, 48(18):34-41.
FENG X J, ZHOU Z L, JI Z W, et al.Isolation and purification of oligosaccharides from yellow rice wine and evaluation of flora proliferationin vitro[J].Food and Fermentation Industries, 2022, 48(18):34-41.
[23] 郑志昌, 陈映彤, 郭娟娟, 等.莲子低聚糖各单体体外益生效果研究[J].中国食品学报, 2019, 19(7):56-63.
ZHENG Z C, CHEN Y T, GUO J J, et al.Studies on the probiotic effect of different monomers of oligosaccharides from lotus (Nelumbo nucifera gaertn.) seeds in vitro[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(7):56-63.
[24] 李雅丽, 王默涵, 周志桥.6种低聚糖对肠道益生菌生长情况的影响及代谢产物分析[J].食品科技, 2021, 46(3):7-13.
LI Y L, WANG M H, ZHOU Z Q.Effects of six oligosaccharides on the growth of intestinal probiotics and analysis of metabolites[J].Food Science and Technology, 2021, 46(3):7-13.