姜黄素是从姜黄提取出来的一类多酚化合物,因其具有良好的抗炎、抗氧化、抗肿瘤等作用[1]而备受广大研究者的青睐。然而,姜黄素具有水溶性低、遇热不稳定、在胃肠道中稳定性差、口服生物利用度低等特性,因此限制了其在功能性食品和营养制剂中的应用[2]。研究表明姜黄素在纳米脂质体[3]、纳米乳液[4]和纳米复合物[5]等包埋体系中具有高溶解性和高稳定性。因此,通过包埋体系解决姜黄素的稳定性差、溶解性低的问题,对于扩展姜黄素在功能性食品和营养制剂中的应用具有重要意义。
在构建姜黄素包埋体系的材料中,多糖-蛋白质复合物因其天然无毒、生物相容性、低免疫原性和生物可降解性而备受关注。YANG等[6]发现姜黄素的稳定性和抗氧化活性在牛血清白蛋白-卡拉胶复合物的包埋下显著提高。CHEN等[7]的研究表明大豆分离蛋白-大豆可溶性多糖复合物可作为姜黄素的良好载体,以提高其热稳定性和可控释放率。在构建多糖-蛋白质复合物包埋体系的各种蛋白质中,酪蛋白是一种含磷钙的结合蛋白,具有来源广泛、价格低、无毒和营养价值高等优点[8]。同时酪蛋白还具有两亲性,在水溶液中能自组装成酪蛋白胶束,这种特性使酪蛋白成为开发包埋体系的合适材料,以包埋姜黄素等活性小分子[9]。然而,单独的蛋白质形成的复合物稳定性差,易被胃肠道中的蛋白酶降解,导致活性物质的泄露或失活[10]。可通过在制备过程中引入多糖以改善蛋白质的稳定性,多糖可以通过静电相互作用覆盖在蛋白质表面,保护蛋白质不被水解,同时也能稳定被包封的活性物质[11]。例如,果胶是一种阴离子多糖,其羧基基团可以与酪蛋白中的氨基基团发生相互作用,具有稳定酪蛋白胶束的作用[12],同时也能延缓酪蛋白钠在胃中的降解[13]。然而,果胶-酪蛋白复合物的稳定性受多种因素影响,如pH、离子强度、电荷密度和果胶浓度等[14]。其中pH是影响果胶-酪蛋白相互作用和稳定性的重要因素[14],了解pH值对酪蛋白-果胶复合物相互作用的影响对姜黄素包埋体系的调控非常重要。然而,目前研究pH值对酪蛋白-果胶复合物稳定性的影响主要集中在复合物的宏观性能指标分析,无法直接反映出pH值引起的相互作用在分子水平上的变化程度。分子动力学模拟(molecular dynamics simulation, MD)可以深入地阐述分子间的相互作用并较好地解释相互作用的机理,有望在分子水平上为待研究物质的实验现象提供理论支持[15]。FERNANDES等[16]利用MD模拟发现花青素与果胶之间存在弱氢键和疏水相互作用。ZHANG等[17]通过MD模拟发现疏水和氢键相互作用促进了肌球蛋白和姜黄素的结合。然而,目前尚未见用MD模拟来研究pH值对果胶-酪蛋白复合物作为姜黄素包埋体系的稳定性的影响机制的报道。
本研究通过实验和MD模拟联合研究了果胶-酪蛋白复合物在酸性(pH 5.0)和中性(pH 7.0)条件下作为姜黄素包埋体系的物理性质、稳定性和相互作用。首先制备了在不同pH条件下的酪蛋白-果胶-姜黄素复合物,并研究了果胶和pH值对姜黄素包封率和物理性质(ζ-电位、微观形貌)的影响。其次,利用荧光光谱分析了果胶和pH值对酪蛋白构象的影响。随后,分析了pH对酪蛋白-果胶-姜黄素复合物中姜黄素的热稳定性和在体外模拟胃肠道消化液中的生物可及性和保留率的影响。最后,通过MD模拟探究了不同pH条件下的酪蛋白-果胶-姜黄素复合物的相互作用。本研究有望为果胶-酪蛋白包埋体系的性能调控提供参考。
1 材料与方法
1.1 材料与试剂
酪蛋白(CAS:9000-71-9)、胰蛋白酶,合肥博美生物科技有限公司;果胶(酯化度67.9%),恒锐食品生物科技有限公司;姜黄素(CAS:458-37-7),国药集团化学试剂有限公司;胃蛋白酶、猪胆盐,上海麦克林生化科技有限公司。
1.2 仪器与设备
FD-1A-50型冷冻干燥机,北京博医康实验仪器有限公司;F-2500型荧光分光光度计,日本日立公司;Zetasizer Nano ZS 90粒径分析仪,英国马尔文仪器有限公司;Phenom Pro10102型扫描电镜,荷兰Phenom World公司;TGL-16G台式离心机,上海安亭科学仪器厂。
1.3 实验方法
1.3.1 复合物的制备
分别配制20 g/L的酪蛋白溶液和4 g/L的果胶溶液,4 ℃冷藏12 h使其完全水合。取20 mL酪蛋白溶液置于100 mL烧杯中,加入2 mg姜黄素,充分混匀1 h使姜黄素完全溶解得到混合物。然后,分别向混合物中加入20 mL超纯水(调整pH至7.0)、20 mL果胶溶液(调整pH至7.0)和20 mL果胶溶液(调整pH至5.0),充分混匀1 h分别得到pH为7.0的酪蛋白-姜黄素复合物(CS-Cur pH 7.0),pH为7.0的果胶-酪蛋白-姜黄素复合物(PE-CS-Cur pH 7.0)和pH为5.0的果胶-酪蛋白-姜黄素复合物(PE-CS-Cur pH 5.0)。
1.3.2 包封率和负载容量
参照OKAGU等[18]的做法,稍作修改,将所得的3种复合物离心(6 201×g, 10 min),吸取上清液,用无水乙醇萃取上清液的姜黄素10 min,并于420 nm处测定其荧光强度,由标准曲线计算出上清液中姜黄素质量。姜黄素的包封率和负载容量计算如公式(1)、公式(2)所示:
包封率![]()
(1)
负载容量![]()
(2)
1.3.3 ζ-电位测定
采用Zetasizer Nano ZS 90测定了在pH 7.0和5.0时的酪蛋白、果胶、CS-Cur和PE-CS-Cur的ζ-电位。水相溶液的折射率设置为1.33,测试温度为25 ℃,平衡时间为120 s。对每个样品平行测定3组,对每组进行3次测定,取平均值作为每次的测量值。
1.3.4 扫描电镜观察
采用扫描电子显微镜观察酪蛋白、果胶、姜黄素以及复合物(CS-Cur pH 7.0、PE-CS-Cur pH 7.0、PE-CS-Cur pH 5.0)的形貌。将样品分散于有双面胶的样品台,吹掉浮粉并喷金,进行扫描观察,放大倍数为300、2 000、10 000倍,加速电压为10 kV。
1.3.5 荧光光谱分析
以酪蛋白为对照,使用荧光分光光度计测定复合物(CS-Cur pH 7.0、PE-CS-Cur pH 7.0、PE-CS-Cur pH 5.0)的荧光光谱。固定激发波长为280 nm,激发狭缝宽度设置为2.5 nm[19],发射狭缝宽度设置为5 nm,扫描范围为300~500 nm。
1.3.6 复合物的热稳定性
通过测定80 ℃下复合物的降解动力学曲线来分析复合物中姜黄素的热稳定性[7]。分别在锥形瓶中加入40 mL新鲜制备的复合物(CS-Cur pH 7.0、PE-CS-Cur pH 7.0、PE-CS-Cur pH 5.0)。此外,制备游离的姜黄素溶液作为对照,取2 mg姜黄素于锥形瓶中,加入1 mL无水乙醇使其充分溶解,再加入40 mL去离子水,搅拌均匀后即得游离的姜黄素溶液。将上述各组样品在80 ℃保温,每隔0.5 h取样0.15 mL分析姜黄素的保留率,姜黄素的保留率为不同处理时间后样品中姜黄素的质量与处理前样品中姜黄素的质量的百分比。
1.3.7 复合物中姜黄素在体外模拟胃肠道消化中的保留率和生物可及性
参考CHEN等[20]的方法,通过体外模拟胃肠道消化分析复合物中姜黄素的生物可及性。取20 mL新鲜制备的复合物(CS-Cur pH 7.0、PE-CS-Cur pH 7.0、PE-CS-Cur pH 5.0),用2 mol/L HCl调节pH至1.5,在水浴锅(37 ℃)中预热10 min,加入8 mg胃蛋白酶,开始模拟胃液消化。60 min后,用4.0 mol/L NaOH调节pH至7.0,并加入100 mg猪胆盐提取物,混匀10 min后加入16 mg胰蛋白酶,模拟小肠消化120 min。在消化过程中每隔0.5 h取样0.15 mL,按照1.3.6节方法分析姜黄素的保留率。此外,在消化终点时取1 mL消化液离心(6 201×g, 10 min),按照1.3.2节方法计算上清液中的姜黄素质量,根据公式(3)计算姜黄素的生物可及性:
姜黄素的生物可及性![]()
(3)
1.4 MD模拟
MD模拟使用GROMACS(version:2019.06)[21]软件包,可视化分析采用PyMOL(version 2.4)软件[22]。首先,参考ZHAO等[23]的同源建模方法获得酪蛋白结构,并通过Cellulose-Builder工具[24]构建果胶结构,从Pubchem数据库中获得姜黄素(ID:969516)的初始分子结构。随后,利用acpype.py调用Ambertools18软件[25],在Gaff力场下生成姜黄素的拓扑文件和坐标文件,并在B3LYP-D3(BJ)/6-31G(D,P)水平上,联合Gaussian09[26]和Multiwfn(version 3.7)[27]计算得到姜黄素的限制性拟合静电势电荷,替换原有的Austin Model 1电荷。在GLYCAM06力场下生成果胶的拓扑和坐标文件。利用H++在线服务器(http://biophysics.cs.vt.edu/H++)计算酪蛋白在pH 7.0和pH 5.0的质子化状态,并在Amber99SB-ILDN力场下得到对应pH下酪蛋白的拓扑和坐标文件。然后,将果胶、酪蛋白、姜黄素包埋在一个13 Å×13 Å×13 Å的立方体盒中,加入TIP3P模型水,并通过NaCl来中和系统电荷。系统通过1 500步的共轭梯度进行能量最小化,随之进行最陡下降算法进行体系预平衡。最后,设置pH为4.6,模拟温度和压力分别为298 K和1 Bar运行时间60 ns的模拟,步长为2 fs。此外,按照同样的方法进行了pH 7.0的酪蛋白-姜黄素模拟。均方根偏差(root-mean-square deviation,RMSD)、氢键数量指标均从轨迹分析中获得。
1.5 数据处理
实验指标平行测定3次,样品平行测定2次,结果以平均值±标准偏差表示。用统计软件SPSS 18.0进行单因素ANOVA分析(P<0.05时为差异显著)。
2 结果与分析
2.1 复合物对姜黄素的包封率和负载容量
图1为不同复合物对姜黄素包封率和负载容量。与CS-Cur pH 7.0(80.2%)相比,PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0对姜黄素的包封率分别增加了3.0%和15.8%,表明果胶的加入可提高复合物对姜黄素的包封率。此外,在pH 5.0下制备的PE-CS-Cur复合物对姜黄素的包封率和负载容量最高,分别为96.0%和4.8%,说明在pH 5.0下制备可以进一步提高复合物对姜黄素的包封率和负载容量。这可能是因为当pH由7变为5时,酪蛋白胶束之间由于静电斥力减弱而发生聚集,从而导致更多的姜黄素被包裹[10]。

图1 姜黄素在复合物CS-Cur pH 7.0、PE-CS-Cur pH 7.0、PE-CS-Cur pH 5.0中的包封率和负载容量
Fig.1 Encapsulation efficiency and loading capacity of CS-Cur pH 7.0, PE-CS-Cur pH 7.0, and PE-CS-Cur pH 5.0
注:同组不同大小写字母分别表示差异性显著(P<0.05)(下同)。
2.2 复合物的ζ-电位
酪蛋白、果胶、CS-Cur和PE-CS-Cur在pH 7.0和5.0时的ζ-电位如图2所示。pH为5.0时,酪蛋白(-7.2 mV)和CS-Cur(-7.8 mV)的ζ-电位没有显著变化,说明姜黄素的存在不会显著影响分散液中酪蛋白的表面电荷。然而,在pH 5.0时,PE-CS-Cur的ζ-电位(-30.9 mV)显著低于CS-Cur(-7.8 mV),这是由于果胶成功包覆在CS-Cur的表面,其较大的电位导致分散液中颗粒的ζ-电位降低[28]。此外,与酪蛋白(-7.2 mV)相比,PE-CS-Cur在pH 5.0时的ζ-电位(-30.9 mV)与果胶(-33.1 mV)更相近,表明PE-CS-Cur的表面电荷主要受果胶的影响,同时也说明果胶成功包覆在CS-Cur的表面[27]。
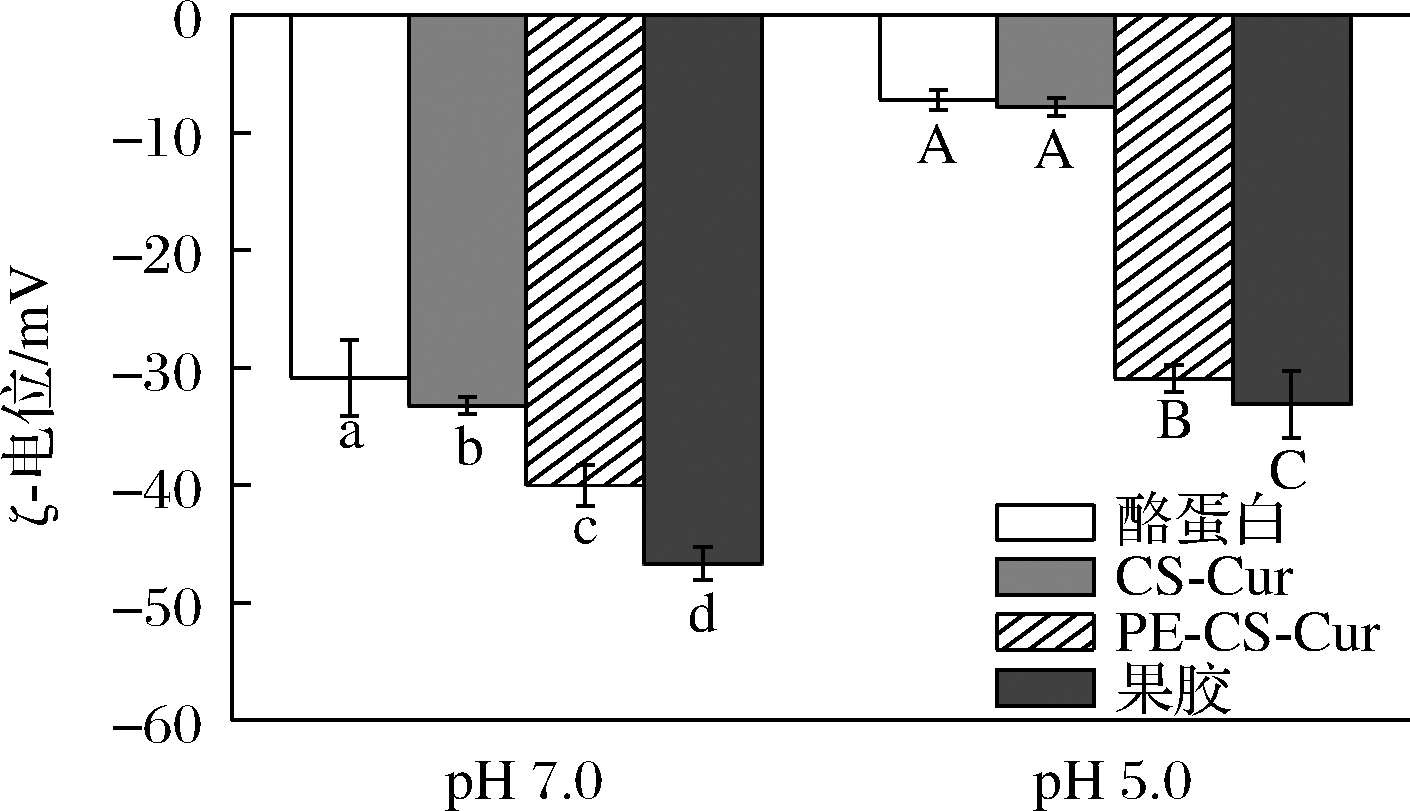
图2 酪蛋白、果胶、CS-Cur和PE-CS-Cur在pH 7.0和5.0时的ζ-电位
Fig.2 ζ-potential of casein, pectin, CS-Cur, and PE-CS-Cur at pH 7.0 and 5.0
2.3 复合物的形貌
图3为酪蛋白、果胶、姜黄素、CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0的扫描电镜图。酪蛋白、果胶和姜黄素分别呈现出光滑球状结构(图3-A)、不规则条状结构(图3-B)和针状结构(图3-C)。CS-Cur pH 7.0(图3-D)表面呈现出不规则凝胶网状结构,表面凹陷较多,呈蜂窝状。由于果胶的覆盖,PE-CS-Cur pH 7.0(图3-E)的表面结构较CS-Cur pH 7.0(图3-D)更为平整,虽然仍有凹陷,但蜂窝状结构明显减少。PE-CS-Cur pH 5.0(图3-F)结构与PE-CS-Cur pH 7.0(图3-E)相似,表现出连续的、无裂缝的凸起结构,其颗粒明显大于PE-CS-Cur pH 7.0(10 000倍时),这是因为PE-CS-Cur pH 5.0的表面净电荷量较低,导致液滴之间的排斥力太低而发生聚集[29]。

A-酪蛋白;B-果胶;C-姜黄素;D-CS-Cur pH 7.0;E-PE-CS-Cur pH 7.0;F-PE-CS-Cur pH 5.0
图3 酪蛋白、果胶、姜黄素、CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0的扫描电镜图
Fig.3 Scanning electron micrograph of casein, pectin, curcumin, CS-Cur pH 7.0, PE-CS-Cur pH 7.0, and PE-CS-Cur pH 5.0
注:放大倍数分别为300、2 000、10 000倍。
2.4 复合物的荧光光谱
酪蛋白的内源荧光主要来源于色氨酸残基,故可通过荧光光谱法来研究配体与酪蛋白之间的相互作用及酪蛋白的构象变化。图4显示了酪蛋白、CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0的荧光光谱。酪蛋白在337 nm处具有荧光最大发射峰,源于酪蛋白中的色氨酸残基。添加姜黄素后,3种复合物中酪蛋白的荧光强度均降低,且荧光最大发射峰均蓝移至328 nm,表明姜黄素与酪蛋白发生了疏水相互作用,导致酪蛋白的构象发生变化,使色氨酸残基所处的微环境极性发生改变,疏水性增加[29]。此外,PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0的荧光强度低于CS-Cur pH 7.0的荧光强度,但荧光最大发射峰没有发生移动,说明果胶不会影响酪蛋白与姜黄素之间的相互作用,不能改变酪蛋白的极性环境。与PE-CS-Cur pH 7.0相比,PE-CS-Cur pH 5.0的荧光强度明显降低,这是由于PE-CS-Cur pH 5.0接近酪蛋白的理论等电点(pI=4.7),此时酪蛋白分子的净电荷低,颗粒之间的电荷排斥作用减弱,易形成沉淀,导致荧光强度降低[29]。
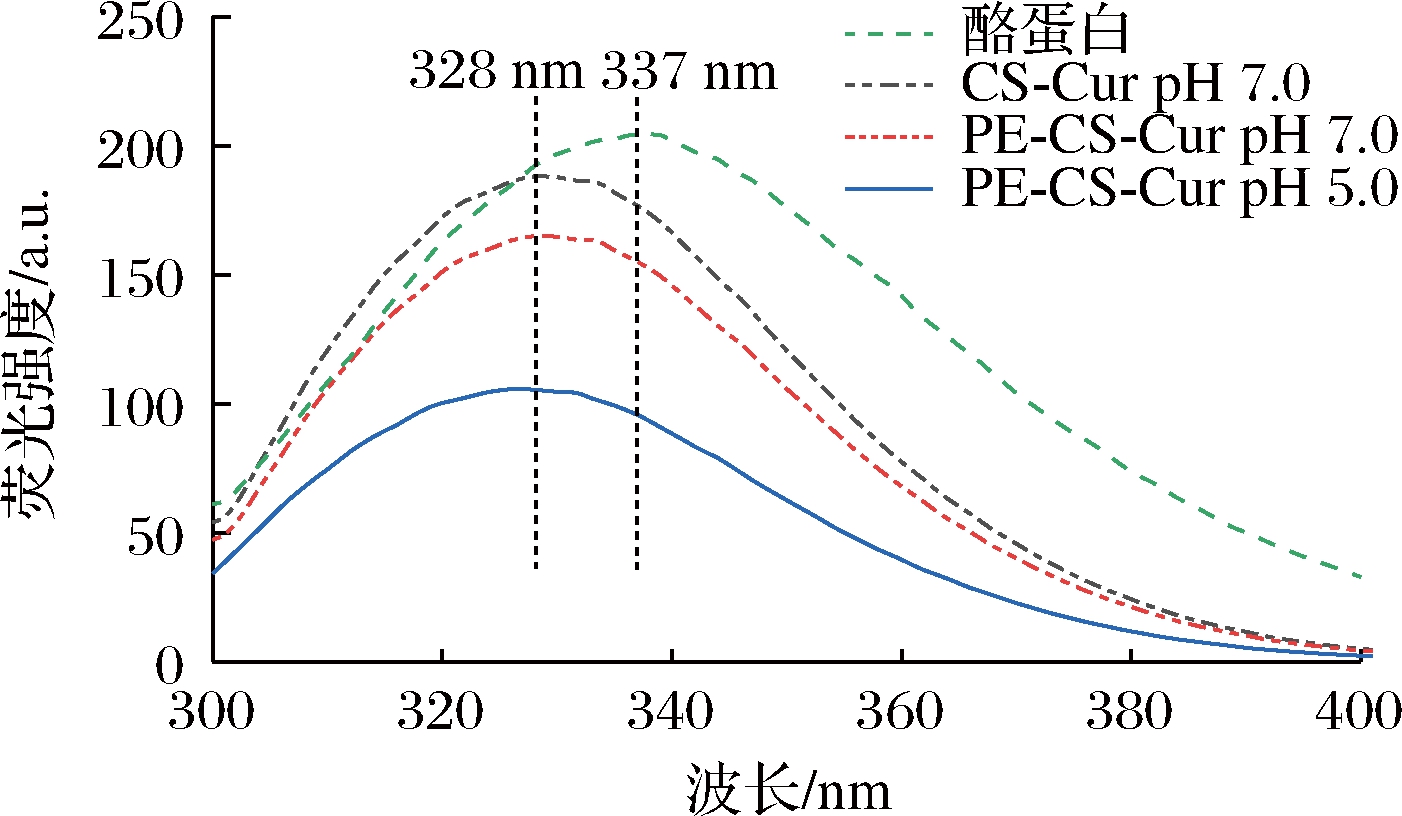
图4 酪蛋白、CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0的荧光光谱
Fig.4 Fluorescence spectra of casein, CS-Cur pH 7.0, PE-CS-Cur pH 7.0, and PE-CS-Cur pH 5.0
2.5 姜黄素在复合物中的热稳定性
姜黄素受热易降解,本研究评估了游离姜黄素和不同复合物(CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0)包埋的姜黄素在80 ℃下的降解动力学,结果如图5所示。随着加热时间的延长,游离的姜黄素以及3种复合物中的姜黄素的降解过程均呈衰减趋势。加热3 h后,CS-Cur pH 7.0中姜黄素的保留率(46.7%)显著大于游离姜黄素的保留率(39.4%),表明酪蛋白的结合提高了姜黄素的热稳定性。此外,PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0中姜黄素的保留率分别为48.8%和66.9%,均大于游离姜黄素(39.4%)和CS-Cur pH 7.0中姜黄素的保留率(46.7%),说明添加果胶可以进一步提高姜黄素的热稳定性,有效减少姜黄素分子的高温降解。与CS-Cur pH 7.0(48.8%)相比,PE-CS-Cur pH 5.0(66.9%)中姜黄素的保留率显著提高,说明在pH 5.0下制备的果胶-酪蛋白复合物包埋的姜黄素的热稳定性最好。

图5 在80 ℃下游离姜黄素和不同复合物(CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0)包裹的姜黄素在80 ℃下的降解动学曲线
Fig.5 Degradation kinetic curve of free curcumin and curcumin in CS-Cur pH 7.0, PE-CS-Cur pH 7.0, and PE-CS-Cur pH 5.0 at 80 ℃
2.6 复合物包埋的姜黄素在体外模拟消化过程中的生物可及性和稳定性
游离姜黄素和不同复合物(CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0)包埋的姜黄素在体外模拟胃肠道消化过程中的生物可及性如图6-A所示。与游离姜黄素(31.6%)相比,CS-Cur pH 7.0(64.6%)包埋的姜黄素的生物可及性显著提高,表明酪蛋白的包埋作用可以提高姜黄素的生物可及性。此外,姜黄素在CS-Cur pH 7.0(64.6%)和PE-CS-Cur pH 7.0(63.2%)中的生物可及性接近(P<0.05),表示姜黄素生物可及性受果胶包埋的影响不大。与CS-Cur pH 7.0(64.6%)和PE-CS-Cur pH 7.0(63.2%)相比,姜黄素在PE-CS-Cur pH 5.0(79.1%)中的生物可及性最大,这可能与PE-CS-Cur pH 5.0中姜黄素的包封率最高(图1)有关[30]。
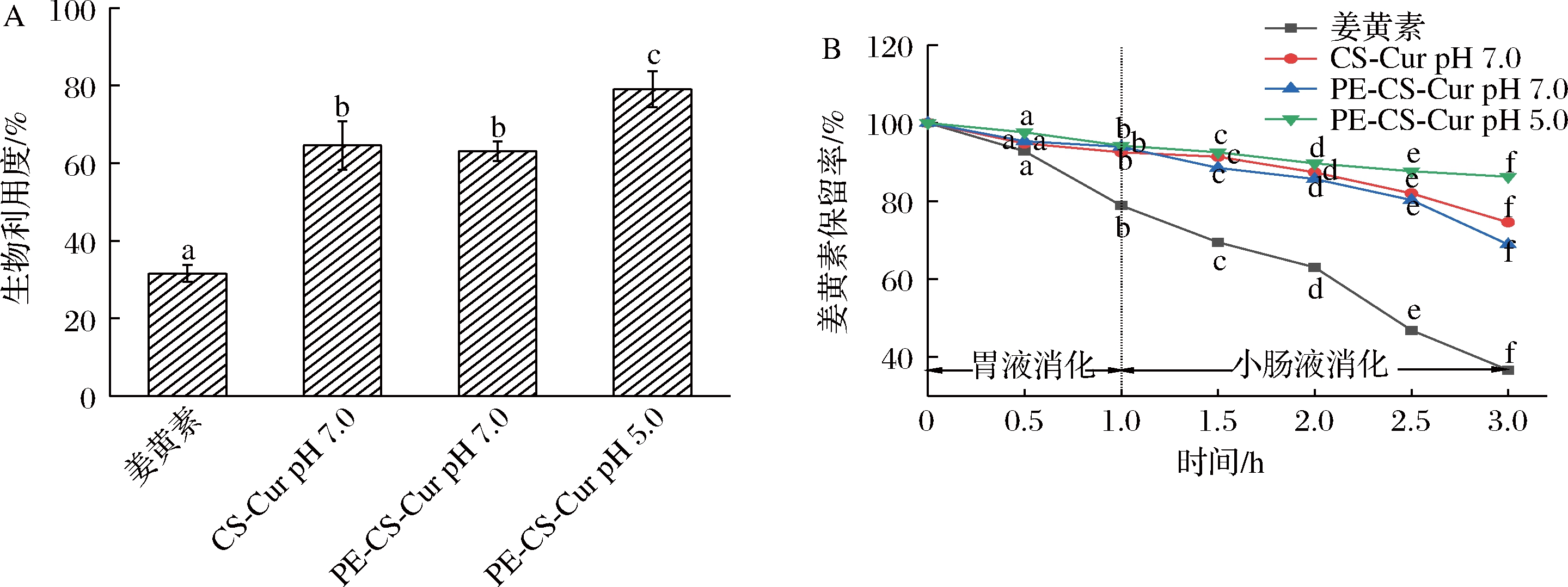
A-生物可及性;B-降解动力学曲线
图6 体外模拟胃肠道消化中游离姜黄素和不同复合物(CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0)中包埋的姜黄素的生物可及性和降解动力学曲线
Fig.6 In vitro simulation of the bioavailability and degradation kinetics curve of free curcumin and curcumin in CS-Cur pH 7.0, PE-CS-Cur pH 7.0, and PE-CS-Cur pH 5.0 in gastrointestinal digestion
游离姜黄素和不同复合物(CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0)包埋的姜黄素在体外模拟胃肠道消化过程中的保留率如图6-B所示。在模拟胃消化过程时,游离姜黄素降解了21.2%,显著高于CS-Cur pH 7.0(7.5%)、PE-CS-Cur pH 7.0(6.1%)和PE-CS-Cur pH 5.0(5.8%)。在模拟小肠消化过程时,游离姜黄素迅速降解了42.1%,而复合物(CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0)的中姜黄素分别降解了17.9%、25.1%和8.0%。这些结果表明酪蛋白和果胶的包埋作用可以提高姜黄素在胃肠道消化过程中的稳定性,延缓其在胃肠道消化液中的释放。此外,与PE-CS-Cur pH 7.0(生物可及性=63.2%,保留率=68.9%)相比,PE-CS-Cur pH 5.0的生物可及性(79.1%)和姜黄素保留率(86.2%)更大,表明PE-CS-Cur pH 5.0在模拟消化液中的生物可及性和稳定性最高,可以达到更好的缓释效果。
2.7 MD模拟
2.7.1 RMSD分析
通过分析CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0复合物的RMSD,可反映整个模拟过程中复合物体系偏离初始结构的程度,当RMSD值在0.2 nm范围内波动时,表明体系达到了平衡[23]。由图7可知,0~55 ns时,CS-Cur pH 7.0的RMSD值波动较大,但55 ns后,整体趋于稳定,此时其平均值约为1.26 nm。对于PE-CS-Cur复合物,在pH 7.0下,果胶的存在减弱了RMSD的波动,PE-CS-Cur pH 7.0在MD模拟前40 ns内的RMSD值在0.66 nm附近波动;在40 ns后,RMSD值维持在0.86 nm的平衡值,低于CS-Cur pH 7.0的RMSD值(1.26 nm),表明果胶可以提高复合物的稳定性。在pH 5.0下,PE-CS-Cur pH 5.0在MD模拟前40 ns内的RMSD值在0.82 nm附近波动;在40 ns后趋于稳定,此时其平均值约为0.69 nm,低于PE-CS-Cur pH 7.0的RMSD值(0.86 nm),表明PE-CS-Cur pH 5.0的稳定性强于PE-CS-Cur pH 7.0,与实验结果中PE-CS-Cur pH 5.0的热稳定性和体外消化稳定性较好相一致(图5、图6)。

图7 CS-Cur pH 7.0, PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0在MD模拟过程中的RMSD变化
Fig.7 The RMSD of CS-Cur pH 7.0, PE-CS-Cur pH 7.0 and PE-CS-Cur pH 5.0 along the MD simulation
2.7.2 氢键分析
图8-A为CS-Cur pH 7.0、PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0在MD模拟过程中形成的氢键数量随时间的变化。在MD模拟达到平衡后(55~60 ns),PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0在大多数时间内出现4个氢键,而CS-Cur pH 7.0呈现1或2个氢键,表明果胶可以与酪蛋白或姜黄素以氢键结合形成复合物。此外,PE-CS-Cur pH 5.0的平均氢键数量(4个)多于PE-CS-Cur pH 7.0(2个),表明在pH 5.0条件下PE-CS-Cur复合物可以形成更多的分子间氢键,有利于增强体系的稳定性。图8-B为复合物在平衡后(58.73 ns)的代表性氢键示意图。由图8可知,与PE-CS-Cur pH 7.0(3个)和CS-Cur pH 7.0(1个)相比,PE-CS-Cur pH 5.0可以形成更多的分子间氢键(8个),与PE-CS-Cur pH 5.0的平均氢键个数最多一致,对维持复合物的稳定性有着积极影响。此外,理论计算与实际PE-CS-Cur复合物体系中的相互作用存在一定偏差,因为在分子动力学模拟时,考虑到计算量和建模复杂性,采用单果胶、酪蛋白和姜黄素分子代表实际PE-CS-Cur包埋体系的各组分,但未考虑各组分内的分子之间的相互作用。

A-氢键数量;B-氢键示意图
图8 CS-Cur pH 7.0, PE-CS-Cur pH 7.0和PE-CS-Cur pH 5.0在MD模拟过程中的氢键数量和58.73 ns时的氢键示意图
Fig.8 The number of hydrogen bonds of CS-Cur pH 7.0, PE-CS-Cur pH 7.0, and PE-CS-Cur pH 5.0 of MD simulation and the hydrogen bonds at 58.73 ns
3 结论
本文研究了pH对PE-CS复合物作为姜黄素包埋体系的稳定性、生物可及性和相互作用的影响。pH 5.0是制备最优性能的PE-CS-Cur的pH值。在此条件下,复合物的ζ-电位为-30.9 mV,包封率高达96.0%。ζ-电位的结果表明果胶成功包覆在CS-Cur的表面。荧光光谱表明姜黄素与酪蛋白之间存在疏水相互作用。经PE-CS包埋后的姜黄素在高温下的保留率提高了27.5%,且在模拟胃肠道消化液中的保留率和生物可及性也分别提高了49.5%和47.5%,表现出更好的稳定性,进而延缓了姜黄素在胃肠道消化液中的释放。此外,分子动力学模拟表明在pH 5.0条件下PE-CS-Cur可以形成更多的分子间氢键,使其具有更好的稳定性。总之,本研究为PE-CS复合物作为姜黄素包埋体系的性能调控提供了理论参考。
[1] CHEN S, LI Q K, MCCLEMENTS D J, et al.Co-delivery of curcumin and piperine in zein-carrageenan core-shell nanoparticles:Formation, structure, stability and in vitro gastrointestinal digestion[J].Food Hydrocolloids, 2020, 99:105334.
[2] ARAIZA-CALAHORRA A, AKHTAR M, SARKAR A.Recent advances in emulsion-based delivery approaches for curcumin:From encapsulation to bioaccessibility[J].Trends in Food Science &Technology, 2018, 71:155-169.
[3] CHENG C, PENG S F, LI Z L, et al.Improved bioavailability of curcumin in liposomes prepared using a pH-driven, organic solvent-free, easily scalable process[J].RSC Advances, 2017, 7(42):25978-25986.
[4] LI J L, HWANG I C, CHEN X G, et al.Effects of chitosan coating on curcumin loaded nano-emulsion:Study on stability and in vitro digestibility[J].Food Hydrocolloids, 2016, 60:138-147.
[5] DAI L, LI R R, WEI Y, et al.Fabrication of zein and rhamnolipid complex nanoparticles to enhance the stability and in vitro release of curcumin[J].Food Hydrocolloids, 2018, 77:617-628.
[6] YANG M L, WU Y, LI J B, et al.Binding of curcumin with bovine serum albumin in the presence of ι-carrageenan and implications on the stability and antioxidant activity of curcumin[J].Journal of Agricultural and Food Chemistry, 2013, 61(29):7150-7155.
[7] CHEN F P, OU S Y, TANG C H.Core-shell soy protein-soy polysaccharide complex (nano) particles as carriers for improved stability and sustained release of curcumin[J].Journal of Agricultural and Food Chemistry, 2016, 64(24):5053-5059.
[8] BARICK K C, TRIPATHI A, DUTTA B, et al.Curcumin encapsulated casein nanoparticles:Enhanced bioavailability and anticancer efficacy[J].Journal of Pharmaceutical Sciences, 2021, 110(5):2114-2120.
[9] 赵英源, 邓玉程, 汤中义, 等.虾青素-酪蛋白纳米复合物的制备、表征及稳定性[J].食品科技, 2021, 46(11):236-243.
ZHAO Y Y, DENG Y C, TANG Z Y, et al.Preparation, characterization and stability of astaxanthin aggregates and casein nanoparticles[J].Food Science and Technology, 2021, 46(11):236-243.
[10] HUA C H, YU W J, YANG M Y, et al.Casein-pectin nanocomplexes as a potential oral delivery system for improving stability and bioactivity of curcumin[J].Colloid and Polymer Science, 2021, 299(10):1557-1566.
[11] 汪少芸, 冯雅梅, 伍久林, 等.蛋白质-多糖多尺度复合物结构的形成机制及其应用前景[J].食品科学, 2021, 42(17):1-9.
WANG S Y, FENG Y M, WU J L, et al.Formation mechanism of protein-polysaccharide multi-scale complexes and their future applications[J].Food Science, 2021, 42(17):1-9.
[12] LAURENT M A, BOULENGUER P.Stabilization mechanism of acid dairy drinks (ADD) induced by pectin[J].Food Hydrocolloids, 2003, 17(4):445-454.
[13] LUO Y C, PAN K, ZHONG Q X.Casein/pectin nano complexes as potential oral delivery vehicles[J].International Journal of Pharmaceutics, 2015, 486(1-2):59-68.
[14] LIANG L, LUO Y C.Casein and pectin:Structures, interactions, and applications[J].Trends in Food Science &Technology, 2020, 97:391-403.
[15] GENG S, JIANG Z J, MA H J, et al.Fabrication and characterization of novel edible pickering emulsion gels stabilized by dihydromyricetin[J].Food Chemistry, 2021, 343:128486.
[16] FERNANDES A, BR S N F, MATEUS N, et al.Understanding the molecular mechanism of anthocyanin binding to pectin[J].Langmuir: the ACS Journal of Surfaces and Colloids, 2014, 30(28):8516-8527.
S N F, MATEUS N, et al.Understanding the molecular mechanism of anthocyanin binding to pectin[J].Langmuir: the ACS Journal of Surfaces and Colloids, 2014, 30(28):8516-8527.
[17] ZHANG L, WANG P, YANG Z Y, et al.Molecular dynamics simulation exploration of the interaction between curcumin and myosin combined with the results of spectroscopy techniques[J].Food Hydrocolloids, 2020, 101:105455.
[18] OKAGU O D, VERMA O, MCCLEMENTS D J, et al.Utilization of insect proteins to formulate nutraceutical delivery systems:Encapsulation and release of curcumin using mealworm protein-chitosan nano-complexes[J].International Journal of Biological Macromolecules, 2020, 151:333-343.
[19] 赵伟睿, 马海乐, 贾俊强, 等.超声波对麦胚蛋白性质及其酶解物ACE抑制活性的影响[J].食品与生物技术学报, 2010, 29(2):177-182.
ZHAO W R, MA H L, JIA J Q, et al.Effect of ultrasound treatment on the defatted wheat germ protein properties and its ACE inhibition activity[J].Journal of Food Science and Biotechnology, 2010, 29(2):177-182.
[20] CHEN F P, LI B S, TANG C H.Nano complexation between curcumin and soy protein isolate:Influence on curcumin stability/bioaccessibility and in vitro protein digestibility[J].Journal of Agricultural and Food Chemistry, 2015, 63(13):3559-3569.
[21] ABRAHAM M J, MURTOLA T, SCHULZ R, et al.GROMACS:High performance molecular simulations through multi-level parallelism from laptops to supercomputers[J].SoftwareX, 2015, 1-2:19-25.
[22] DELANO W L.The PyMOL molecular graphics system[J].2002.http://www.pymol.org.
[23] ZHAO R C, QIN X L, ZHONG J F.Interaction between curcumin and β-casein:Multi-spectroscopic and molecular dynamics simulation methods[J].Molecules, 2021, 26(16):5092.
[24] GOMES T C F, SKAF M S.Cellulose-builder:A toolkit for building crystalline structures of cellulose[J].Journal of Computational Chemistry, 2012, 33(14):1338-1346.
[25] CASE D A, CHEATHAM T E Ⅲ, DARDEN T, et al.The amber biomolecular simulation programs[J].Journal of Computational Chemistry, 2005, 26(16):1668-1688.
[26] FRISCH M, TRUCKS G, SCHLEGEL H B, et al.Gaussian 09, Revision A.01, Gaussian.Inc., Wallingford CT[J].2009.
[27] LU T, CHEN F W.Multiwfn:A multifunctional wavefunction analyzer[J].Journal of Computational Chemistry, 2012, 33(5):580-592.
[28] GUO Q, BAYRAM I, SHU X, et al.Improvement of stability and bioaccessibility of β-carotene by curcumin in pea protein isolate-based complexes-stabilized emulsions:Effect of protein complexation by pectin and small molecular surfactants[J].Food Chemistry, 2022, 367:130726.
[29] 雷选, 王旭苹, 程镜蓉, 等.芦丁和阿魏酸与酪蛋白的相互作用研究[J].食品科学技术学报, 2020, 38(2):73-80.
LEI X, WANG X P, CHENG J R, et al.Study on interaction of rutin and ferulic acid with casein[J].Journal of Food Science and Technology, 2020, 38(2):73-80.
[30] LIU Y, GUO R.pH-dependent structures and properties of casein micelles[J].Biophysical Chemistry, 2008, 136(2-3):67-73.