代谢综合征(metabolic syndrome, MS)是由多种代谢紊乱状态构成的症候群,表现为中心肥胖、血糖血脂异常、胰岛素抵抗等核心症状,是进一步造成代谢性疾病和心脑血管疾病的重要危险因素,严重并长期影响人类生命健康[1]。当前,由于人们饮食习惯和生活方式的不断变化,导致全球代谢综合征患病率持续上升。该项疾病机制复杂、病程长、并发症多,药物治疗难度较大。近年来,大量研究表明一些药食同源的天然植物及其提取物对代谢综合征的防治具有较好效果[2-4],受到人们广泛的关注。通过日常饮食积极开展代谢综合征防控工作,具有较高的社会价值和经济价值。
青钱柳 (Cyclocarya Paliurus)也被称为金钱柳、金钱李等,是中国特有的一种宝贵植物资源。在湖南等南方多省,自古素有将青钱柳作为“甜茶”日常饮用的民间习俗,青钱柳的安全性和风味在长期使用中均得到认可[5]。2013年,青钱柳被批准为“新食品原料”[6],相关功能性食品被相继研究开发。以青钱柳叶为原料研制的保健茶已成为国家地理标志产品,这也是我国第一个获美国食品药品监督管理局认证的保健茶,市场前景良好。虽然已有大量研究表明青钱柳中富含多糖、三萜、酚类等活性成分,其提取物具有降血糖、降血脂、降血压等多种功效[7-9],但鲜见青钱柳调节糖脂代谢作用和机制的深入研究。因此,本研究通过长期高果糖喂养诱导大鼠代谢综合征模型,评价青钱柳对动物糖脂代谢紊乱的调节作用,探讨其机制是否涉及炎症及氧化应激。最后通过网络药理学分析青钱柳作用于代谢综合征的物质基础和潜在靶点-功能-通路,为深入研究开发青钱柳资源提供参考依据和理论基础。
1 材料与方法
1.1 材料与试剂
SD雄性大鼠,8~10周龄,体质量280~320 g,SPF级,合格证号SCXK(湘)2021-0002。湖南中医药大学实验动物中心购买及饲养,实验方案(编号LLBH-202206220003)经实验动物伦理委员会批准实验方案。
青钱柳干叶产地为湖南常德石门壶瓶山,由湖南省月岭山农林科技股份有限公司提供。
果糖、葡萄糖,上海麦克林生化科技股份有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low-density lipoprotein,LDL-C)、高密度脂蛋白(high-density lipoprotein,HDL-C)试剂盒,南京建成生物工程研究所有限公司;大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒,武汉博士德生物工程有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH)、丙二醛(malondialdehyde,MDA)试剂盒,京建成生物工程研究所有限公司;大鼠晚期糖基化终末产物(advanced glycation endproducts,AGEs)ELISA试剂盒,江苏菲亚生物科技有限公司。
1.2 仪器与设备
YJCW20/1+1微压煎药机,长沙卓成医疗器械有限公司;CA-2610冷却水循环装置、NVP-2000隔膜真空泵,东京理化器械株式会社;R-1010旋转蒸发仪,郑州长城科工贸有限公司;GA-3型血糖仪及试纸,三诺生物传感股份有限公司;DLX-880 酶联免疫仪,美国BIO-TEK仪器有限公司;RM2016病理切片机,徕卡显微系统(上海)贸易有限公司;真空冷冻干燥机,美国LABCONCO公司。
1.3 实验方法
1.3.1 青钱柳水提物制备
将青钱柳干叶加入10倍质量的水浸泡30 min,待青钱柳叶软化后放入提取罐,120 ℃煮沸后煎煮30 min。过滤后将剩余青钱柳叶继续加8倍质量的水,120 ℃煮沸后煎煮30 min。过滤后将2次所得的滤液合并,76 kPa、56 ℃旋蒸浓缩后冷冻干燥备用。
1.3.2 大鼠代谢综合征模型构建及分组
动物在标准受控的环境中饲养,条件为:温度22~24 ℃,湿度55%,通风良好,明/暗周期12 h。本研究意在探究青钱柳作为功能性食品长期摄入对糖脂代谢紊乱的影响,而非不同摄入剂量的作用。因此,根据文献[10-11]及前期预实验选择800 mg/kg·d作为青钱柳干预浓度。适应性喂养1周后,36只大鼠随机分成4组,实验设计为:正常对照组(以下简称正常组,n=9)、代谢综合征模型组(以下简称模型组,n=9)、青钱柳水提物干预组(以下简称青钱柳干预组,n=9)、青钱柳水提物对照组(以下简称青钱柳对照组,n=9)。将10%(体积分数)果糖溶液替代饮用水供模型组和青钱柳干预组大鼠自由饮用,10周建立代谢综合征模型。期间各组喂养及干预方式如图1所示。每天对大鼠基本形态进行观察并记录食物和饮水消耗量,每周测量一次体质量和空腹血糖值。10周后,据“1.3.3节”方法完成口服葡萄糖耐量试验(oral glucose tolerance test, OGTT)和胰岛素耐量试验 (insulin tolerance test, ITT),量取大鼠腰围、体长,并根据公式(1)计算Lee′s指数[12]:

图1 大鼠代谢综合征模型构建及干预方案
Fig.1 Construction of rat metabolic syndrome model and intervention
(1)
实验结束后,禁食不禁水(普通饮用水,下同)过夜,用戊巴比妥钠将大鼠麻醉。经腹主动脉插管取血,静置过夜后离心取上清,分离血清;处死大鼠后迅速分离并漂洗肝脏组织,用滤纸尽量吸干水分后称取组织质量,按个体肝脏质量/体质量计算相应肝脏指数[13]。将用于组织切片的肝脏组织浸泡于4%(体积分数)多聚甲醛中,过夜后更换浸泡液。其他肝脏组织加入9倍组织质量的冰生理盐水,组织匀浆机研磨后离心取上清。
1.3.3 OGTT和ITT
OGTT:大鼠禁食不禁水12 h,测量0 min时血糖水平。后经灌胃立即给予大鼠 1.5 g/kg葡萄糖溶液(0.3 g/mL),测量15、30、60、90、120 min时血糖水平。
ITT:大鼠禁食不禁水6 h,测量0 min时血糖水平。后立即腹腔注射1.6 mL/kg胰岛素注射液(0.3 U/mL),测量15、30、60、90、120 min时血糖水平。
1.3.4 肝脏HE染色及病理评分
经固定-脱水-包埋-切片-脱蜡等常规步骤后,对各组大鼠肝脏标本进行HE染色。镜下观察、拍照并据标准评分。评分标准[14]为:结构,组织结构正常清晰、细胞形态排列整齐(0分);组织结构正常清晰、细胞形态排列轻微变形、偶见脂滴空泡(1分);组织结构改变、细胞形态结构明显变形、较多脂滴空泡(2分);组织结构显著异常、细胞形态结构明显变形、大量脂滴空泡(3分);大面积空泡样病变(4分)。炎症,无炎性细胞浸润(0分);有轻微炎性浸润(1分);有较多炎性浸润(2分);有显著炎性浸润显著(3分);有炎性坏死(4分)。胞质染色,胞质染色均一(0分);胞质染色轻微变化(1分);胞质染色明显(2分);胞质染色显著变化(3分);组织坏死(4分)。将同一肝脏组织的结构、炎症、胞质染色评分相加,即为该样本的肝脏病理评分。
1.3.5 血清及肝脏组织生化指标测定
按试剂盒说明测定大鼠血清和肝脏组织中TC、TG、LDL-C和HDL-C。
1.3.6 血清及肝脏组织炎症因子、氧化应激和AGEs水平测定
按ELISA试剂盒说明测定大鼠血清及肝脏组织中TNF-α、IL-1β、IL-6和AGEs水平。按检测试剂盒说明测定大鼠肝脏组织SOD活力和GSH、MDA水平,以反映其氧化应激状态。BCA法测定肝脏匀浆样本蛋白浓度以校正结果。
1.3.7 青钱柳活性成分筛选及靶点预测
因多个数据库中均无法找到青钱柳相关有效成分,故以“青钱柳”和“Cyclocarya paliurus”为主题词检索文献,进行活性成分筛选。Uniport数据库 (https://beta.uniprot.org/)比对靶点蛋白标准名称,Swiss Target Prediction数据库 (http://www.swisstargetprediction.ch/)估测青钱柳活性成分的潜在靶点。
在Drugbank (https://go.Drugbank.com/)、GenecardS (https://www.genecards.org/ds)、Omim (https://omim.org/)等数据库检索代谢综合征相关疾病靶点,并结合Venny 2.1.0 (https://bioinfogp.cnb.csic.es/tools/venny/)构建有效成分靶点与代谢综合征的韦恩图。
在Cytoscape 3.9.1软件中导入交集靶点并进行分析,完成“青钱柳-成分-靶点-代谢综合征”关系网络的构建。利用网络拓扑学得到青钱柳干预代谢综合征的主要有效成分,以连接度、介度和紧密度中位数作为其阈值筛选出有效成分。
1.3.8 蛋白-蛋白互作网络构建和生物功能预测
借助String数据库 (https://cn.string-db.org/)对青钱柳与代谢综合征的相关交集靶点进行蛋白-蛋白互作网络 (protein-protein interaction,PPI)构建与分析,置信度≥0.4。使用Cytoscape软件,以自由度、中介中心度、接近中心度、邻里连通性中位数为阈值筛选相关核心靶点。
将找到的交集靶点信息导入David数据库(https://david.ncifcrf.gov/home.jsp),完成KEGG通路富集分析。
1.4 数据统计与分析
数据均以平均值±标准差表示。采用SPSS 26.0软件统计,GraphPad Prism 9软件作图。组间差异采用One-Way ANOVA或ANCOVA检验分析,双侧P<0.05认为有统计学差异。
2 结果与分析
2.1 大鼠基本状态和体型
自由饮用果糖溶液后,模型组和青钱柳干预组大鼠的摄食量均有下降趋势,而饮水量则明显增加。果糖为能量性甜味剂,提供的能量使大鼠产生饱腹感,这可能是其摄食意愿降低的主要原因。此外,果糖造成了大鼠血浆高渗状态,进而增加其饮水意愿。造模10周后,模型组大鼠体态肥胖、行动迟缓、精神不振、狂躁易怒,青钱柳干预组大鼠体态基本正常、活动能力强、精神状态良好、不易烦躁,说明青钱柳能明显改善果糖给大鼠带来的形态和精神状态变化。青钱柳对照组大鼠和正常组大鼠基本状态无异常表现。
体质量反映了机体整体代谢水平。如图2-A所示,果糖溶液自由饮用2周后,模型组和青钱柳干预组大鼠体重相较于正常组略有下降,结果无统计学差异 (P>0.05),这可能是由于该组大鼠食物摄入量降低造成。4周后,模型组大鼠体质量较正常组显著升高(P<0.01),且此显著性差异一直保持至第10周实验结束。这与前人所建代谢综合征模型特点一致,长期高果糖摄入可造成大鼠肥胖[15]。4周时,青钱柳干预组大鼠体质量较模型对照组显著下降(P<0.01),且此优势一直保持至10周实验结束。青钱柳对照组大鼠与正常组相比,体质量结果无显著性差异(P>0.05)。表明青钱柳水提物可使果糖诱导的大鼠体质量增加逐步回归正常,有效降低其患代谢综合征风险。
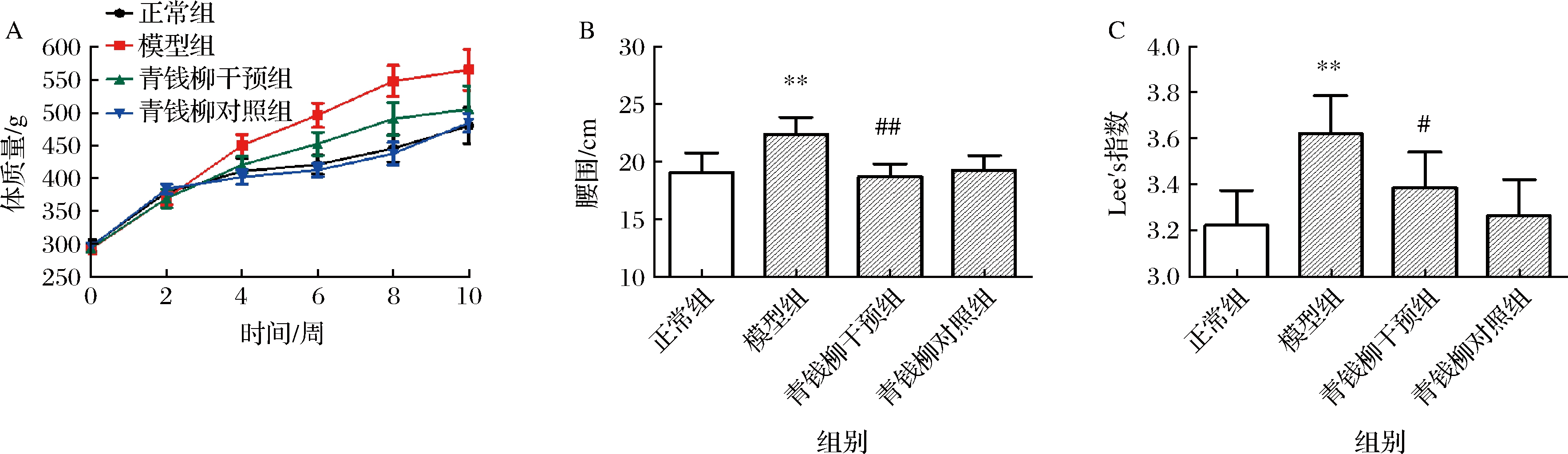
A-体质量变化;B-腰围;C-Lee’s指数
图2 各组大鼠体型变化
Fig.2 Body size of rats
注:与正常组比较,*表示P<0.05,**表示P<0.01;与模型组比较,#表示P<0.05,##表示P<0.01(下同)。
腰围是判断机体腹型肥胖的重要指标,代谢综合征核心表现之一即为中心性肥胖。如图2-B所示,果糖溶液自由饮用10周后,模型组大鼠腰围较正常组显著增加(P<0.01)。青钱柳水提物能显著改善果糖造成的腰围增加(P<0.01),且对正常饮食的大鼠腰围没有影响(P>0.05)。Lee′s指数是评价成年大鼠肥胖的关键性指标。10周后,各组大鼠Lee′s指数结果(图2-C)趋势与腰围变化趋势(图2-B)完全一致。体重、腰围及Lee′s指数结果共同说明青钱柳水提物可有效调节代谢紊乱状态,改善果糖诱导的大鼠体态变化。
2.2 大鼠肝脏变化
肝脏是机体最为重要的代谢中心,当肝脏被代谢性疾病影响将直接反映为肝脏脂质堆积及质量变化[16]。在本研究中(表1),模型组大鼠肝脏指数和肝脏组织TC、TG水平较正常组均显著增加(P<0.01)。青钱柳水提物可有效控制果糖诱导的肝脏指数(P<0.05)和肝脏组织TC、TG水平变化(P<0.01),提示青钱柳对肝脏的保护作用。
表1 各组大鼠肝脏指数、肝脏TC、TG水平变化
Table 1 Liver index, TC, and TG levels in the liver of rats
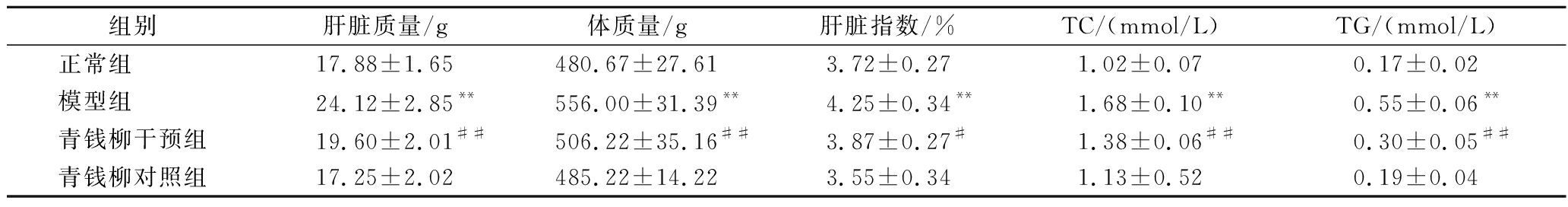
组别肝脏质量/g体质量/g肝脏指数/%TC/(mmol/L)TG/(mmol/L)正常组 17.88±1.65480.67±27.613.72±0.271.02±0.070.17±0.02模型组 24.12±2.85**556.00±31.39**4.25±0.34**1.68±0.10**0.55±0.06**青钱柳干预组19.60±2.01##506.22±35.16##3.87±0.27#1.38±0.06##0.30±0.05##青钱柳对照组17.25±2.02485.22±14.223.55±0.341.13±0.520.19±0.04
注:与正常组比较,*表示P<0.05,**表示P<0.01;与模型组比较,#表示P<0.05,##表示P<0.01(下同)。
通过HE染色,对各组大鼠的肝脏进行了病理学检查及评分,以进一步观察实验中动物肝脏的变化。如图3-A所示,正常组和青钱柳对照组大鼠肝脏组织结构正常清晰、细胞形态排列整齐,无炎性细胞浸润且胞质染色均一。模型组大鼠肝脏组织结构异常、细胞形态结构变形、出现大量脂滴空泡及炎性浸润、同时胞质染色也出现变化。青钱柳干预组大鼠肝脏组织病理形态改变不明显,相较于模型组趋于正常水平,病理学评分平均值较模型组降低45%,结果有显著性差异(P<0.05)(图3-B)。验证了青钱柳对于肝脏的保护作用,同时提示青钱柳可能通过调节肝脏糖脂代谢,改善果糖引起的代谢综合征变化。

A-肝脏HE染色(100×);B-肝脏病理评分
图3 各组大鼠肝脏病理变化
Fig.3 Pathological changes in the liver of rats
2.3 大鼠糖脂代谢变化
代谢综合征中多种代谢紊乱聚集,已有多项研究报道高果糖诱导的代谢综合征模型将出现糖脂代谢紊乱,血糖、血脂均改变明显[17]。如图4-A所示,高果糖喂养前期,模型组大鼠空腹血糖逐步升高,但与正常组比较并无明显改变(P>0.05)。果糖喂养6周后至第10周实验结束,模型组大鼠空腹血糖始终维持在较高水平,与正常组差异明显(P<0.01)。青钱柳干预组大鼠空腹血糖值一直处于正常范围内,该组大鼠自第8周起空腹血糖值与模型组差异明显(P<0.01)。OGTT(图4-B)试验结果显示,通过10周的干预,模型组大鼠血糖调节能力降低(P<0.05),而青钱柳能显著提高其糖耐量(P<0.05)。ITT(图4-C)试验结果可见,模型组大鼠胰岛素敏感性降低,青钱柳能一定程度改善其胰岛素敏感性,但除60 min时青钱柳组血糖改变与模型组比较有显著性差异外(P<0.05),其他各时间点2组差异无统计学意义。
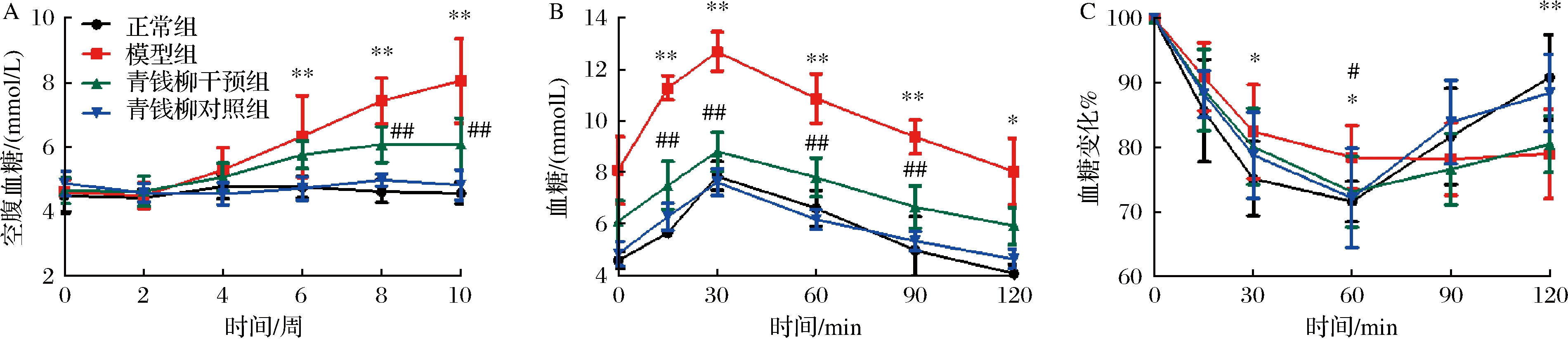
A-空腹血糖;B-OGTT;C-ITT
图4 各组大鼠糖代谢变化
Fig.4 Glucose metabolism of rats
血脂四项是临床脂代谢异常相关疾病的经典检测指标,共同反映着机体一段时间内的脂质代谢情况。如表2所示,与正常组相比,模型组大鼠血清TC、TG和LDL-C水平显著升高(P<0.01)、HDL-C水平显著降低(P<0.05),说明在高果糖喂养的长期影响下模型组大鼠已经出现了明显的血脂紊乱。青钱柳干预组大鼠血清TC、TG和LDL-C水平与模型组相比显著降低(P<0.01),HDL-C水平无显著变化(P>0.05)。
表2 各组大鼠血脂变化
Table 2 Blood fat of rats

组别TC/(mmol/L)TG/(mmol/L)LDL-C/(mmol/L)HDL-C/(mmol/L)正常组 1.62±0.230.29±0.030.44±0.051.01±0.04模型组 2.08±0.15**0.79±0.04**0.75±0.07**0.95±0.02*青钱柳干预组1.77±0.16##0.53±0.03##0.58±0.03##0.94±0.03青钱柳对照组1.52±0.220.33±0.040.47±0.041.00±0.06
2.4 大鼠血清及肝脏炎症因子水平
近年来,免疫炎症已成为代谢性疾病研究的热门方向。自HOTAMISLIGIL等[18]首次在糖尿病和肥胖动物的脂肪中发现炎症因子TNF-α表达显著升高后,又有诸多研究证实其他代谢类疾病也伴随有整体和/或局部炎症水平的升高[19-21],慢性炎症反应已被肯定为代谢性疾病发生发展的关键因素。青钱柳中富含多糖、三萜、酚类等活性成分。彭晓娟等[22]在非酒精性脂肪性肝病合并2型糖尿病大鼠模型中发现,青钱柳多糖和青钱柳黄酮能显著减轻该模型大鼠肝脏脂肪变性及炎症反应。在本研究的肝脏组织病理学染色结果中(图3),也观察到相似现象。因此推测青钱柳对代谢综合征大鼠糖脂代谢的改善可能涉及炎症调节。
为证实以上推论,研究检测了各组大鼠血清炎症因子水平,以观察青钱柳水提物对实验动物免疫炎症的影响。结果如图5-A~5-C所示,模型组大鼠血清TNF-α、IL-1β、IL-6水平,与正常组比较显著上升(P<0.01)。青钱柳干预组大鼠血清中TNF-α、IL-1β、IL-6水平,与模型组比较显著下降(P<0.01)。这一结果表明,长期高果糖喂养将使机体处于炎症紊乱状态并诱导的代谢综合征的发生,而青钱柳可显著减轻其整体炎症反应。肝脏作为代谢综合征病理改变的核心靶器官,其局部组织炎症处于整体炎症风暴中心。在本研究中,大鼠肝脏微环境的炎症水平(图5-D~图5-F)同整体的炎症水平趋向一致,进一步验证了青钱柳糖脂代谢调节机制可能涉及免疫炎症这一假说。

A-血清TNF-α;B-血清IL-1β;C-血清IL-6;D-肝脏TNF-α;E-肝脏IL-1β;F-肝脏IL-6
图5 各组大鼠血清及组织炎性因子水平
Fig.5 Inflammatory factors levels in serum and tissue of rats
2.5 大鼠肝脏氧化应激水平
氧化应激通常伴随炎症共同发生[23],特别是肝脏微环境中的氧化应激强关联肝脏糖脂代谢紊乱,推动着代谢综合征的发生发展[24]。如图6所示,与正常组比较,模型组大鼠肝脏中SOD活力和GSH水平明显下降(P<0.01),而MDA水平则明显升高(P<0.01),提示果糖诱导的代谢综合征模型大鼠肝脏微环境中存在明显的氧化应激损伤。与模型组比较,青钱柳干预组大鼠肝脏SOD活力和GSH水平明显升高(P<0.01),而MDA水平则明显降低(P<0.01)。说明青钱柳可有效改善果糖诱导的肝脏脂质过氧化及氧化损伤,减轻代谢综合征诱导的肝脏氧化应激损伤和炎症反应。
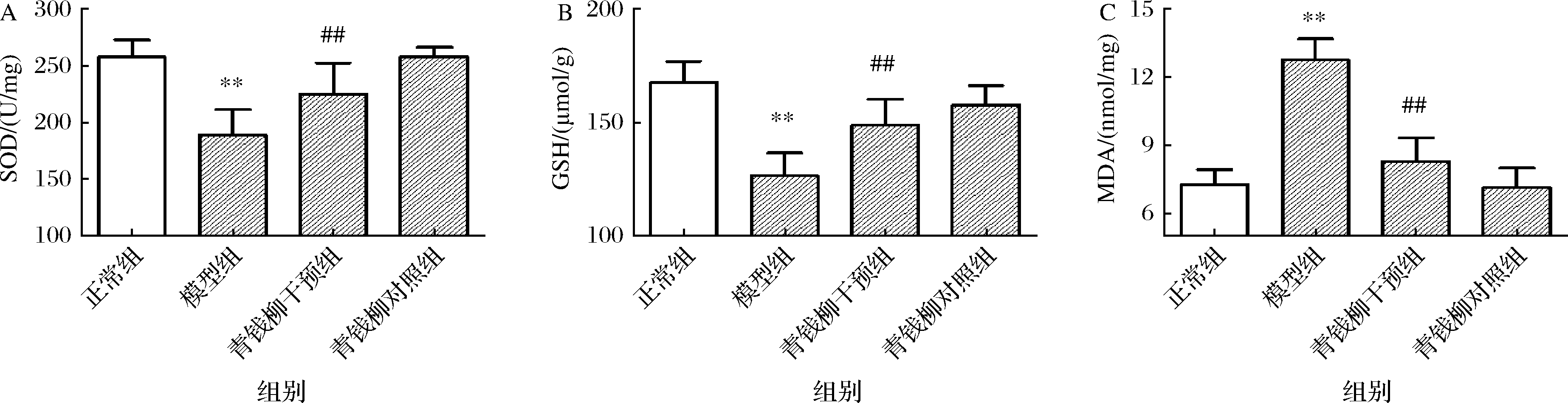
A-肝脏SOD;B-肝脏GSH;C-肝脏MDA
图6 各组大鼠肝脏氧化应激水平
Fig.6 Oxidative stress levels in the liver of rats
2.6 “青钱柳-成分-靶点-代谢综合征”关系网络
传统的药用植物研究基于“单一成分-单一靶点-单一途径”思路,目前青钱柳物质基础和功能机制研究割裂,不利于后续开发利用。网络药理学可利用计算机高级算力从海量文献及数据库中筛选化学成分靶点,构建“疾病-靶点-药物-成分”等多层次网络,有助于整体性阐明青钱柳不同成分与疾病靶点之间的关联性[25]。本研究经文献查阅共获得青钱柳化学成分354个,经过筛选后保留有效活性成分166个,并将其重新编号为QQL1-166。通过数据库比对、整合后,获得445个青钱柳活性成分的潜在靶点。
在GenecardS(2 099个)、OMIM(1 261个)、Drugbank(9个)共3个数据库检索、整合后,获得2 637个代谢综合征疾病相关靶点。将2 637个疾病靶点与445个青钱柳靶点绘制韦恩图以获取交集靶点,得到交集靶点169个。
基于以上有效成分及交集靶点筛选,完成“青钱柳-成分-靶点-代谢综合征”关系网络的构建(图7)。该网络包括228个节点,580条边。以连接度≥2、介度≥0.000 871 060 956 581 262及紧密度≥0.330 915 065 722 952,即中位数为阈值筛选。其中青钱柳中46种有效成分、47个潜在靶点达到阈值,进一步提示药食同源植物青钱柳“多成分-多靶点”的作用特点。

图7 “青钱柳-成分-靶点-代谢综合征”关系网络图
Fig.7 “Component-target-disease” relationship network
将上述结果以连接度、介度、紧密度排序,发现前十的活性成分基本为酚类化合物(表3)。目前已有多项研究提示青钱柳黄酮类和青钱柳酚酸调节代谢的可能作用[26-28],佐证该项分析结果。有趣的是,除巨大的药用潜力外,植物中的酚类物质通常还决定其感官风味[29]。因此,有理由认为青钱柳酚类物质将是未来功能食品开发的重要部位。
表3 青钱柳干预代谢综合征活性成分(前10)的拓扑学参数
Table 3 Topological parameters of the active components of cyclocarya interfering with metabolic Syndrome (Top 10)
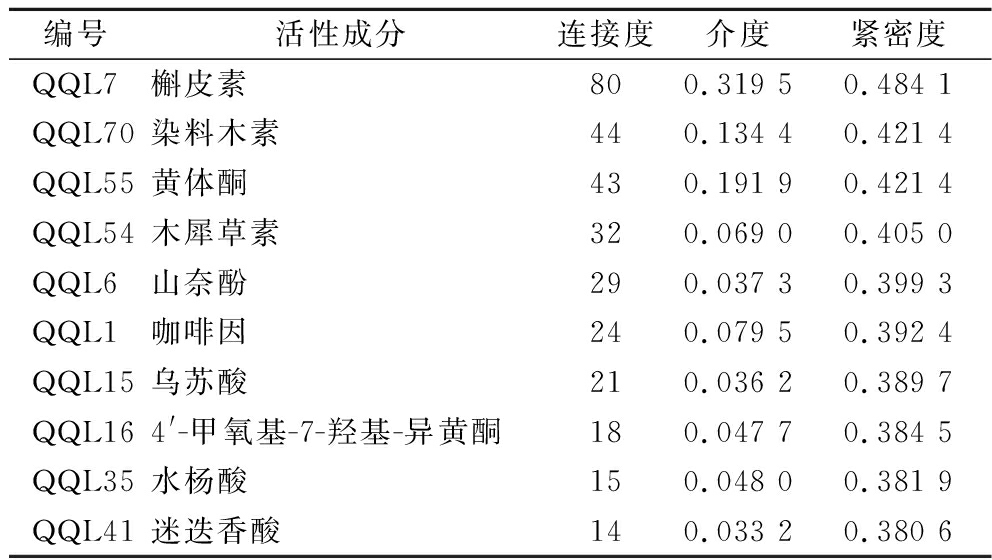
编号活性成分连接度介度紧密度QQL7槲皮素800.319 50.484 1QQL70染料木素440.134 40.421 4QQL55黄体酮430.191 90.421 4QQL54木犀草素320.069 00.405 0QQL6山奈酚290.037 30.399 3QQL1咖啡因240.079 50.392 4QQL15乌苏酸210.036 20.389 7QQL164'-甲氧基-7-羟基-异黄酮180.047 70.384 5QQL35水杨酸150.048 00.381 9QQL41迷迭香酸140.033 20.380 6
2.7 PPI网络及KEGG通路富集分析
将169个交集靶点导入数据库,隐藏没有作用关系的节点,绘制PPI网络。该网络共167个节点,2 964条边。以自由度≥12、中介中心度≥0.072 817 303、接近中心度≥0.509 090 909、邻里连通性≥54.583 333 33,即中位数为阈值进一步筛选相关靶点,最终得到青钱柳干预代谢综合征的潜在靶点共20个,相互关系如图8-A所示。在这20个强相关靶点中,IL、SOD、NOS等多项炎症、氧化应激相关靶点与本研究动物实验结果指向一致并相互印证,提示青钱柳干预代谢综合征的作用机制涉及炎症及氧化应激。
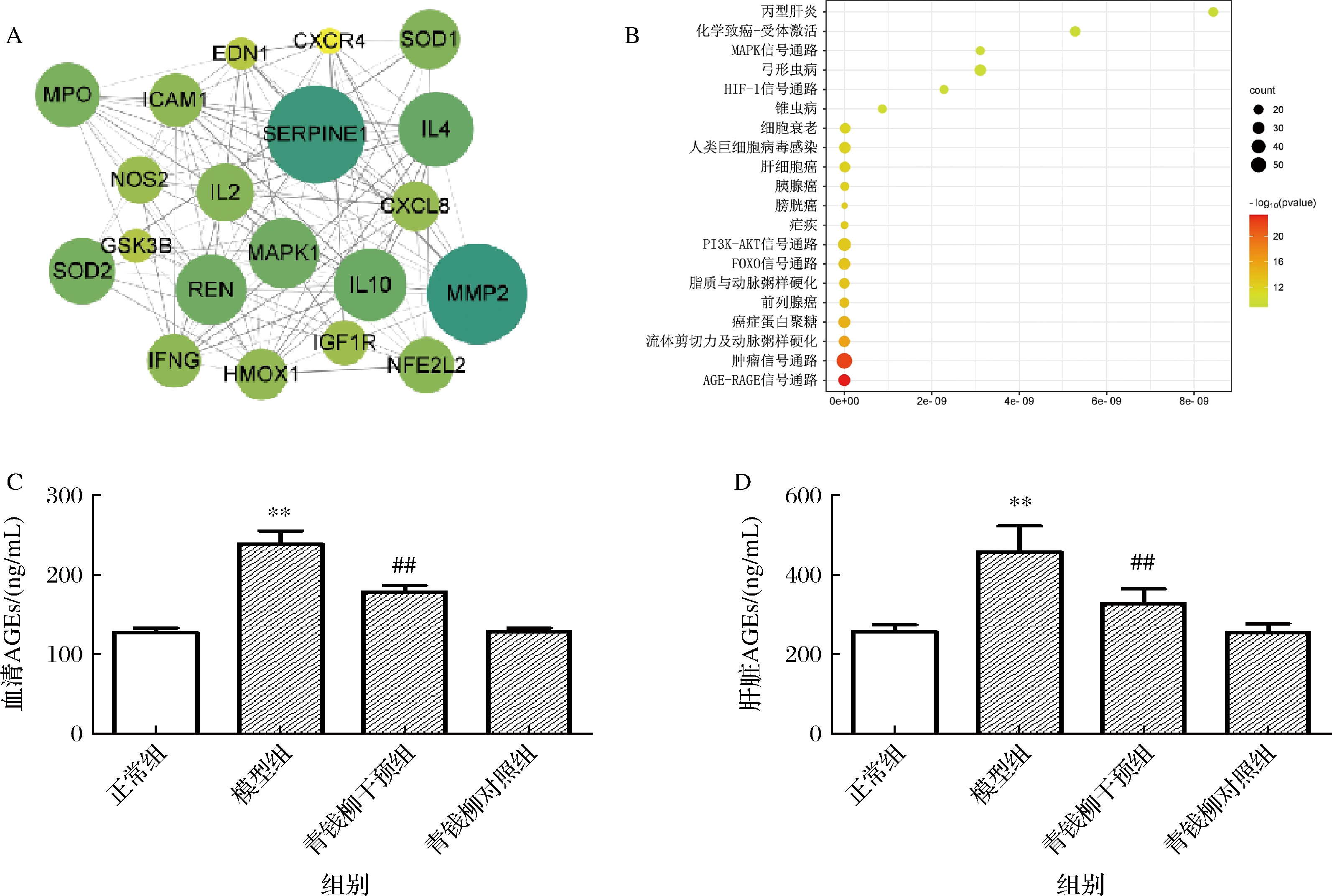
A-青钱柳干预代谢综合征关键靶点的PPI网络;B-KEGG通路富集分析(前20);C-血清AGEs水平;D-肝脏AGEs水平
图8 PPI网络与KEGG通路富集分析及其验证
Fig.8 PPI network and KEGG analysis of intersection targets
为预测青钱柳作用可能涉及通路,将169个交集靶点进行KEGG通路富集。分析后共得到141条通路,排名前20的通路如图8-B所示。其中AGE-RAGE信号通路的可信度位居首位。AGE是由葡萄糖、果糖等还原糖分子与机体物质发生反应形成的配体,有多种形式。AGEs与细胞膜上对应的受体RAGE结合产生效应,启动下游信号级联,广泛参与代谢性疾病、动脉粥样硬化及神经退行性病变等多种疾病的发生发展[30-31]。本研究进一步检测了各组大鼠AGEs水平变化,以验证网络药理学结果。在血清(图8-C)和肝脏组织(图8-D)中,模型组AGEs水平相较于正常组显著升高(P<0.01),青钱柳干预组AGEs水平相较于模型组则显著降低(P<0.01)。体内AGEs的形成受多因素影响,血糖浓度和机体代谢能力是其中较为重要的影响因素[32]。高糖状态下,大量AGEs产生后作用于受体,激活NF-κB等信号,上调氧化应激水平、引起炎症反应,进而加剧疾病发展[33]。新近研究发现,许多天然化合物可抑制内源性AGEs的形成并控制疾病发展[34]。因此,推测青钱柳可能通过抑制内源性AGEs生成发挥抗炎和抗氧化应激的作用,AGE-RAGE可能是青钱柳抗代谢综合征的关键性通路。
3 结论
作为一种功能性甜味剂或能量补充,果糖早已广泛应用于食品工业。现代加工食品和饮品中大量添加果糖或果葡糖浆以改善风味,造成全球果糖消费逐年上升。果糖在带来“甜蜜”的同时,也在逐渐侵蚀着人民的美好生活。高果糖饮食造成的糖脂代谢异常将影响人体健康,显著增加代谢综合征的发生率和心血管疾病死亡率[35]。本研究建立了果糖诱导的代谢综合征模型,通过10周的干预,结果显示青钱柳水提物可显著改善果糖诱导的大鼠基本状态、体型、肝脏变化和糖脂代谢紊乱。这一作用可能与青钱柳缓解肝脏脂质过氧化及氧化损伤,调节整体及肝脏微环境中免疫炎症作用有关。网络药理学结果与动物实验结果相互印证,同时提示其发挥糖脂代谢调节的物质基础主要为酚类物质,涉及AGE-RAGE等信号通路。此外,在本研究中,长期灌胃青钱柳水提物的大鼠并未出现明显不良反应,一定程度上说明了青钱柳作为功能食品长期使用的安全性。
综上所述,本研究运用动物模型和网络药理学方法,探究青钱柳水提物对果糖诱导的大鼠代谢综合征模型糖脂代谢紊乱的调节作用,并从炎症和氧化应激的角度初步探讨了青钱柳的糖脂代谢调节机制。结果表明,青钱柳用于代谢综合征防治的潜力较大,并有利于其应用于功能性健康食品开发。后期可通过深入研究AGE-RAGE等相关信号通路,进一步研究青钱柳对于糖脂代谢调节的具体作用机制和物质基础。
[1] LEMIEUX I, DESPRÉS J P.Metabolic syndrome:Past, present and future[J].Nutrients, 2020, 12(11):3501.
[2] KAO T W, HUANG C C.Recent progress in metabolic syndrome research and therapeutics[J].International Journal of Molecular Sciences, 2021, 22(13):6862.
[3] JING X X, ZHOU J X, ZHANG N H, et al.A review of the effects of puerarin on glucose and lipid metabolism in metabolic syndrome:Mechanisms and opportunities[J].Foods, 2022, 11(23):3941.
[4] YOON S J, KIM S K, LEE N Y, et al.Effect of Korean red ginseng on metabolic syndrome[J].Journal of Ginseng Research, 2021, 45(3):380-389.
[5] 陈絮蒙, 王雅靖, 陈靓, 等.青钱柳活性物质及其代谢调节作用的研究与应用进展[J].食品与发酵工业,2023,49(12):336-344.
CHEN X M, WANG Y J, CHEN L, et al.Research and application progress of active substances and their metabolic regulatory effects of Cyclocarya paliurus[J].Food and Fermentation Industries,2023,49(12):336-344.
[6] 国家卫生计生委. 关于批准裸藻等8种新食品原料的公告[J].中国食品卫生杂志, 2014,26(1):91.
National Health and Family Planning Commission.Announcement on approving eight new food raw materials, such as Euglena sp. Chinese Journal of Food Hygiene, 2014, 26(1):91.
[7] KAKAR M U, NAVEED M, SAEED M, et al.A review on structure, extraction, and biological activities of polysaccharides isolated from Cyclocarya paliurus (Batalin) Iljinskaja[J].International Journal of Biological Macromolecules, 2020, 156:420-429.
[8] SUN H H, TAN J, LV W Y, et al.Hypoglycemic triterpenoid glycosides from Cyclocarya paliurus (sweet tea tree)[J].Bioorganic Chemistry, 2020, 95:103493.
[9] ZHAO J J, WANG Z T, XU D P, et al.Advances on Cyclocarya paliurus polyphenols:Extraction, structures, bioactivities and future perspectives[J].Food Chemistry, 2022,396:133667.
[10] LIU C C, ZHAO M M, WEN L R, et al.The chemical composition and toxic effects of aqueous extracts of Cyclocarya paliurus leaves[J].Frontiers in Nutrition, 2022, 9:994055.
[11] WANG Q Q, JIANG C H, FANG S Z, et al.Antihyperglycemic, antihyperlipidemic and antioxidant effects of ethanol and aqueous extracts of Cyclocarya paliurus leaves in type 2 diabetic rats[J].Journal of Ethnopharmacology, 2013, 150(3):1119-1127.
[12] OTHMAN Z A, ZAKARIA Z, SULEIMAN J B, et al.Bee bread ameliorates vascular inflammation and impaired vasorelaxation in obesity-induced vascular damage rat model:The role of eNOS/NO/cGMP-signaling pathway[J].International Journal of Molecular Sciences, 2021, 22(8):4225.
[13] PAN J P, OUYANG X L, JIN Q, et al.Hypolipidemic effect of ethanol extract from Chimonanthus nitens Oliv.leaves in hyperlipidemia rats via activation of the leptin/JAK2/STAT3 pathway[J].Molecular Medicine, 2022, 28(1):159.
[14] LIU F L, SHI K J, DONG J J, et al.Ganoderic acid A attenuates high-fat-diet-induced liver injury in rats by regulating the lipid oxidation and liver inflammation[J].Archives of Pharmacal Research, 2020, 43(7):744-754.
[15] NIMROUZI M, RUYVARAN M, ZAMANI A, et al.Oil and extract of safflower seed improve fructose induced metabolic syndrome through modulating the homeostasis of trace elements, TNF-α and fatty acids metabolism[J].Journal of Ethnopharmacology, 2020, 254:112721.
[16] DING X Q, WU W Y, JIAO R Q, et al.Curcumin and allopurinol ameliorate fructose-induced hepatic inflammation in rats via miR-200a-mediated TXNIP/NLRP3 inflammasome inhibition[J].Pharmacological Research, 2018, 137:64-75.
[17] PRASATTHONG P, MEEPHAT S, RATTANAKANOKCHAI S, et al.Hesperidin ameliorates signs of the metabolic syndrome and cardiac dysfunction via IRS/Akt/GLUT4 signaling pathway in a rat model of diet-induced metabolic syndrome[J].European Journal of Nutrition, 2021, 60(2):833-848.
[18] HOTAMISLIGIL G S, SHARGILL N S, SPIEGELMAN B M.Adipose expression of tumor necrosis factor-alpha:Direct role in obesity-linked insulin resistance[J].Science, 1993, 259(5091):87-91.
[19] LEE Y S, OLEFSKY J.Chronic tissue inflammation and metabolic disease[J].Genes &Development, 2021, 35(5-6):307-328.
[20] YU W L, LI C X, ZHANG D J, et al.Advances in T cells based on inflammation in metabolic diseases[J].Cells, 2022, 11(22):3554.
[21] WADE H, PAN K C, SU Q Z.CREBH:A complex array of regulatory mechanisms in nutritional signaling, metabolic inflammation, and metabolic disease[J].Molecular Nutrition &Food Research, 2021, 65(1):e2000771.
[22] 彭晓娟, 钟绿, 吴楚添, 等.青钱柳多糖和青钱柳黄酮对非酒精性脂肪性肝病合并2型糖尿病模型大鼠血液代谢指标及肝脏病变的影响[J].中国病理生理杂志, 2021, 37(10):1838-1847.
PENG X J, ZHONG L, WU C T, et al.Effects of polysaccharides and flavonoids from Cyclocarya paliurus on blood metabolism parameters and liver pathological changes in nonalcoholic fatty liver disease rats with type 2 diabetes mellitus[J].Chinese Journal of Pathophysiology, 2021, 37(10):1838-1847.
[23] PICKERING R J.Oxidative stress and inflammation in cardiovascular diseases[J].Antioxidants, 2021, 10(2):171.
[24] REZZANI R, FRANCO C.Liver, oxidative stress and metabolic syndromes[J].Nutrients, 2021, 13(2):301.
[25] 严媛, 吴伟杰, 郜海燕, 等.茭白壳提取物对小鼠溃疡性结肠炎的预防作用[J].食品科学, 2022, 43(23):97-105.
YAN Y,WU W J, GAO H Y, et al.Preventive effect of Zizania latifolia shell extract on ulcerative colitis in mice[J].Food Science, 2022, 43(23):97-105.
[26] 陈玉慧, 郭彤彤, 张鑫, 等.青钱柳黄酮及三萜调节人体肠道菌群作用研究[J].中国野生植物资源, 2019, 38(2):6-10;15.
CHEN Y H, GUO T T, ZHANG X, et al.Modulatory effect of flavonoids and triterpenoids from Cyclocarya paliurus on human intestinal microbiota[J].Chinese Wild Plant Resources, 2019, 38(2):6-10;15.
[27] WU Z F, GAO T H, ZHONG R L, et al.Antihyperlipidaemic effect of triterpenic acid-enriched fraction from Cyclocarya paliurus leaves in hyperlipidaemic rats[J].Pharmaceutical Biology, 2017, 55(1):712-721.
[28] LIU Y, CAO Y N, FANG S Z, et al.Antidiabetic effect of Cyclocarya paliurus leaves depends on the contents of antihyperglycemic flavonoids and antihyperlipidemic triterpenoids[J].Molecules, 2018, 23(5):1042.
[29] 徐子媛, 严娟, 蔡志翔, 等.桃果实糖酸和酚类物质与口感风味的相关性[J].江苏农业学报, 2022, 38(1):190-199.
XU Z Y, YAN J, CAI Z X, et al.Correlation between soluble sugar, organic acid and phenolic substances with tasted flavor in peach fruit[J].Jiangsu Journal of Agricultural Sciences, 2022, 38(1):190-199.
[30] SHAO M Z, YU M Y, ZHAO J, et al.miR-21-3p regulates AGE/RAGE signalling and improves diabetic atherosclerosis[J].Cell Biochemistry and Function, 2020, 38(7):965-975.
[31] YAMAGISHI S I.Role of advanced glycation endproduct (AGE)-receptor for advanced glycation endproduct (RAGE) axis in cardiovascular disease and its therapeutic intervention[J].Circulation Journal: Official Journal of the Japanese Circulation Society, 2019, 83(9):1822-1828.
[32] KEHM R, RÜCKRIEMEN J, WEBER D, et al.Endogenous advanced glycation end products in pancreatic islets after short-term carbohydrate intervention in obese, diabetes-prone mice[J].Nutrition &Diabetes, 2019, 9(1):9.
[33] DONG H B, ZHANG Y, HUANG Y, et al.Pathophysiology of RAGE in inflammatory diseases[J].Frontiers in Immunology, 2022, 13:931473.
[34] YU W Z, TAO M R, ZHAO Y L, et al.4′-Methoxyresveratrol alleviated AGE-induced inflammation via RAGE-mediated NF-κB and NLRP3 inflammasome pathway[J].Molecules, 2018, 23(6):1447.
[35] PAN Y, KONG L D.High fructose diet-induced metabolic syndrome:Pathophysiological mechanism and treatment by traditional Chinese medicine[J].Pharmacological Research, 2018, 130:438-450.