肉苁蓉(Cistanche deserticola Y.C.Ma),别名寸芸、苁蓉,属濒危种[1-2]。草本植物,大部分在地下生长,主要分布在我国甘肃、宁夏及新疆部分地区[3]。肉苁蓉是一种寄生在沙漠中梭梭树根部的寄生植物,素有“沙漠人参”之美誉,具有极高的食用价值,是中国传统的药食同源原料。从中医角度来看,肉苁蓉性甘、咸、温。归肾、大肠经,具有补肾阳,益精血,润肠通便,缓解疲劳及抗衰老的功效[4];其作为药用成分主要治疗阳萎遗精、腰膝冷痛、筋骨无力、肠燥便秘,另外,据现代医学分析肉苁蓉中还含有丰富的苯乙醇苷类、环烯醚萜及其苷类、木脂素及其苷类、多糖、维生素等化合物和人体所需的铜、锌、锰、铁等微量元素[5-6]。这些微量元素具有延长动物寿命、调节内分泌、提高机体的新陈代谢的能力[7-8]。通过溶剂对肉苁蓉中多种有效营养物质进行提取、浓缩和干燥去除溶剂,可以得到营养物质含量较高的提取产物。提取产物可以被用于滋补食品、保健药品、养生茶等功效产品的生产加工中[9]。所以建立一种高效且节能环保的提取和干燥工艺方法,具有重要的现实意义。
针对药物提取有很多种方式,包括:a)浸泡提取[10],该提取方式仅需要加入提取溶剂,不需要任何辅助条件,是最节约成本的提取方式,然而简单的浸泡方式无法充分提取药物中的有效成分,致使该方法很少被普及使用;b)加热回流提取[11],该方法是应用较为广泛的从药物中有效物质的提取方式,但是该提取方法有一定隐患存在,因为在回流提取有效物质的同时会将药物中的农药残留一起富集到提取产物中,是一种较高风险的方法;c)超声辅助提取[12-13],该方法能增加溶剂分子及目标物分子间的相互作用,是一种新兴的提取方式,但普通的超声设备功率太小,无法突破药材植物细胞壁,所以该提取方式提取效率有限;d)超临界流体提取[14-16],是一种极具发展潜力的提取方式,提取介质使用无毒的CO2,且去除溶剂的方式更加快速简单,极少存在溶剂残留问题;e)亚临界水提取[17-19],亚临界水是指将水加热到沸点以上,临界点以下,并控制系统压力使水保持为液体状态。亚临界水具有很多优秀的特点,如亚临界水的介电常数可以随着温度的变化而改变,在实际应用中,可以通过控制特定的温度,促使亚临界水呈现不同的极性,可以提取特殊极性范围的物质[20]。另外一个显著的特点是其拥有较高的离子积,即高浓度的氢离子和氢氧根离子。常温常压下水的离子积是10-14,当温度升高到200~300 ℃时,亚临界水中水分子也会电离产生更多的氢离子和氢氧根离子,离子积可以达到10-11,较常温常压下提高了1 000倍,更容易与一些路易斯酸碱性物质结合,提高萃取效果[21-22]。同时随着温度的升高,水分子的氢键作用会减弱,氢键数量也会减少,亚临界水的黏度和表面张力随着温度的升高而降低,较低的黏度和表面张力有利于物质的传递和渗透,从而提高了提取效率,基于亚临界水的诸多特性,可以考虑用于肉苁蓉提取工作中。
本文利用亚临界水和超临界流体等4种提取方法分别对肉苁蓉的有效成分进行提取,对提取产物中的肉苁蓉苷类物质(京尼平苷酸、松果菊苷、肉苁蓉苷 A、2′-乙酰基毛蕊花糖苷、毛蕊花糖苷、异毛蕊花糖苷),维生素类物质(维生素B1、维生素B2、维生素B6),微量元素(铜、铁、锰、锌),农药残留(克百威、甲基异硫磷、甲拌磷、毒死蜱)四类物质进行检测,确定其含量,通过评价提取产物的品质,对比4种提取方法,筛选最优提取方法;同时将得到的提取物通过冷冻真空冷冻干燥、常压烘干、减压烘干的方法去除溶剂,得到肉苁蓉提取物干粉,再次检测干粉中有效物质含量,评价3种干燥方法对肉苁蓉干粉的品质影响,为进一步开发肉苁蓉副产品奠定理论基础。
1 材料与方法
1.1 材料与试剂
肉苁蓉样品,甘肃金沙源生物科技有限公司;乙醇、乙腈、甲醇,均为色谱纯,北京百灵威科技有限公司;京尼平苷酸(98.5%)、松果菊苷(99.5%)、肉苁蓉苷A(99.7%)、2′-乙酰基毛蕊花糖苷(99.5%)、毛蕊花糖苷(98.7%)、异毛蕊花糖苷(97.5%)、维生素B1(99.5%)、维生素B2(98.5%)、维生素B6(99.7%)、克百威(97.5%)、甲基异硫磷(97.5%)、甲拌磷(97.5%)、毒死蜱(97.5%)、铜、铁、锰、锌(液态标准,1.00 mg/L),标准品,德国Dr.Ehrenstorfer公司。
1.2 仪器与设备
1260型液相色谱仪,配二级管阵列检测器、7500型电感耦合等离子体质谱仪,安捷伦科技有限公司;GCMS-QP2020 NX气相色谱-串联三重四极杆质谱,岛津科技有限公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;RX-II型离心机,天美中国科学仪器有限公司;5L-100L亚临界水提取系统,鲲华生物技术有限公司;HA220-50-06超临界流体萃取设备,北京世纪森朗实验仪器有限公司。
1.3 实验方法
1.3.1 亚临界水对肉苁蓉最佳提取压力及温度条件优化
对亚临界水提取肉苁蓉的压力,温度条件进行筛选优化。分别选择303、404、505、606、707 kPa 5个压力条件和200、210、220、230、240、250、300 ℃ 7个温度条件,做35组棋盘实验。检测每组提取液中肉苁蓉苷A化合物,参考苷类化合物的含量,选择最佳提取压力和温度。
1.3.2 亚临界水对肉苁蓉最佳提取时间选择
分别选择5、7.5、10、12.5、15、17.5、20 min 7个不同提取时间提取肉苁蓉,检测每组提取液中肉苁蓉苷A化合物,参考苷类化合物的含量,选择最佳提取时间。
1.3.3 肉苁蓉样品粉碎制备
根据文献[23]方法:将干燥的肉苁蓉样品粉碎过40目筛,得到粉状筛下物,按照振动筛分方法,将样品分成若干等份,待用。
1.3.4 亚临界水提取
称取肉苁蓉样品10.00 g,放入亚临界水提取系统的提取釜中,加入200 mL纯水,密封好系统,在505 kPa压力,230 ℃条件下,提取15 min,得到的产物标记为1号产物。
1.3.5 回流提取
称取肉苁蓉样品10.00 g,放入圆底烧瓶中,加入200 mL纯水,密封好回流系统,在常压,微沸腾条件下回流30 min,得到的产物标记为2号产物。同时按上述条件将200 mL纯水替换为200 mL乙醇,实施实验,得到的产物标记为3号产物。
1.3.6 超声提取
称取肉苁蓉样品10.00 g,放入锥型瓶中,加入200 mL纯水,密封好锥型瓶,在常压下,超声提取(600 W,42 kHz) 40 min,得到的产物标记为4号产物。同时按上述条件将200 mL纯水替换为200 mL乙醇,实施实验,得到的产物标记为5号产物。
1.3.7 超临界流体提取
称取肉苁蓉样品10.00 g,放入超临界流体提取设备的提取釜中,密封好锥型瓶,完成提取,得到的产物标记为6号产物。
1.3.8 肉苁蓉苷含量测定
根据参考文献[24]方法,将1号~5号产物用相应的提取溶剂定容至500 mL,6号产物用甲醇溶解,定容至500 mL。得到样品待测液,过0.22 μm微孔滤膜后,按照以下色谱条件进入液相色谱检测。色谱柱:ODS C18柱 (250 mm×4.6 mm,5 μm);流动相:乙腈-0.5%(体积分数)乙酸水溶液,检测波长:237 nm;流速:1.0 mL/min;柱温:30 ℃;进样量:20 μL。分别精密称取10.0 mg有效含量的各标准品,置于10 mL容量瓶中,用甲醇溶解定容,得到1 000.0 μg/mL的标准储备液,使用时用甲醇稀释为适当浓度。本实验使用1.0~100.0 μg/mL的标准系列校准产物中目标物含量,以浓度为横坐标,峰面积为纵坐标,得到校准曲线如表1所示。含量计算如公式(1)所示:
表1 六种苷类物质校准曲线
Table 1 Calibration curves of six glycosides

组分名称标准曲线方程及线性相关系数京尼平苷酸y=23.503x+7.494 8R2=0.999 8松果菊苷y=20.7x+5.705 2R2=0.999 8肉苁蓉苷Ay=20.076x+11.859R2=0.999 62'-乙酰基毛蕊花糖苷y=17.857x-6.295 4R2=0.999 9毛蕊花糖苷y=18.723x+2.510 9R2=0.999 9异毛蕊花糖苷y=19.754x-6.047R2=0.999 9
(1)
式中:X为目标物含量,mg/g;c为由标准曲线校准得到的样品液中目标物含量,μg/mL;V为样品液体积,500 mL;m为样品质量,10.0 g;1 000为毫克与微克的换算系数。
1.3.9 维生素含量测定
根据参考文献[25]方法检测维生素B1,参考文献[26]方法检测维生素B2,参考文献[27]方法检测维生素B6。将1号~6号产物的样品待测液过0.22 μm微孔滤膜后,按照以下色谱条件进入液相色谱检测。色谱柱:ODS C18柱 (250 mm×4.6 mm,5 μm);流动相:乙腈-pH值为3.5的乙酸铵水溶液,维生素B1激发波长:365 nm,发射波长:425 nm;维生素B2激发波长:462 nm,发射波长:522 nm;维生素B6激发波长:293 nm,发射波长:395 nm;流速:1.0 mL/min;柱温:30 ℃;进样量:20 μL。分别精密称取10.0 mg有效含量的各标准品,置于10 mL容量瓶中,用甲醇溶解定容,得到1 000.0 μg/mL的标准储备液。使用时用pH值为3.5的乙酸铵水溶液稀释为适当浓度。本实验使用50.0~1 000.0 ng/mL的标准系列校准产物中目标物含量。以浓度为横坐标,峰面积为纵坐标,得到校准曲线如表2所示。含量计算如公式(2)所示:
表2 维生素类物质校准曲线
Table 2 Calibration curve for vitamins

组分名称标准曲线方程及线性相关系数维生素B1y=429 055x-1 767.7 R2=0.999 8维生素B2y=702 552x-3 746.6 R2=0.999 8维生素B6y=498 900x-3 154.7 R2=0.999 5
(2)
式中:X为目标物含量,mg/100 g;c为由标准曲线校准得到的样品液中目标物含量,μg/mL;V为样品液体积,500 mL;m为样品质量,10.0 g;1 000为毫克与微克的换算系数;100为每克与每一百克的换算系数。
1.3.10 微量元素含量测定
根据参考文献[28]方法,将1号~6号产物的样品待测液浓缩至干,精密称取0.200~0.500 g浓缩产物,置于聚四氟乙烯消解罐内,加硝酸6 mL,混匀,浸泡过夜,盖好内盖,旋紧外套,置于微波消解炉内,进行消解。测定时,精密量取铜、铁、锰、锌标准品贮备液适量,用2%硝酸溶液稀释制一定系列浓度混合溶液,同时选取63Cu以72Ge作为内标,56Fe以45Sc作为内标,55Mn以45Sc作为内标,66Zn以72Ge作为内标,并根据仪器的要求选用适宜校正方程对测定的元素进行校正,该仪器使用内置曲线对样品液校准,所得到的信号为样品液中目标物浓度。将待测液过0.22 μm微孔滤膜后,进入ICP-MS测定铜、铁、锰、锌的含量。含量计算如公式(2)所示。
1.3.11 农药残留含量测定
根据参考文献[29]方法,将1号~6号产物的样品待测液浓缩至近干,加入2 mL乙腈复溶,并用乙腈定容至5.0 mL,经QuEChERS处理后,过0.22 μm微孔滤膜后,按照以下色谱条件进入进入气相色谱-三重四极杆质谱检测。色谱柱:DB-5MS石英毛细管柱[30 m×0.25 mm(内径)×0.25 μm];进样口温度:250 ℃;升温程序:70 ℃(1 min)→25 ℃/min→120 ℃→30 ℃/min→300 ℃(2 min);载气:氦气(纯度≥99.999%),流速:1.0 mL/min;进样量:1 μL;质谱条件:色谱与质谱接口温度:250 ℃;离子源温度:230 ℃;电离方式:电子轰击源(electron impact ion source,EI);电离能量:70 eV。每种农药分别选择一对定量离子,一对定性离子,每组所需检测离子对,按照出峰顺序,分时分段监测,根据丰度值外标法定量。以浓度为横坐标,丰度值为纵坐标,得到校准曲线如表3所示。含量计算如公式(3)所示:
表3 农药残留类物质校准曲线
Table 3 Calibration curve for pesticide residues

组分名称标准曲线方程及线性相关系数克百威 y=251 149x+30.11R2=0.999 2甲拌磷 y=448 815x+81.0R2=0.999 8甲基异硫磷y=244 881x+131.2R2=0.999 9毒死蜱 y=3 290 525x+171.2 R2=0.999 8
(3)
式中:X为目标物含量,mg/kg;c为由标准曲线校准得到的样品液中目标物含量,μg/mL;V为样品液体积,500 mL;m为样品质量,10.0 g。
1.3.12 提取物粉末中有效物质含量
称取1 000 g肉苁蓉样品,按照“1.3.2节”方法得到的产物提取液,分别通过真空冷冻干燥,常压蒸干,减压蒸干的方式去除溶剂,得到干粉。按方法“1.3.6节~1.3.9节”的条件将干粉复溶至500 mL,分别检测干粉中的肉苁蓉苷、维生素、微量元素和农药残留含量。对比真空冷冻干燥,常压蒸干,减压蒸干3种干燥方式,选出营养物质损失最少的一种方式。
2 结果与分析
2.1 亚临界水提取肉苁蓉的最佳压力和温度条件
5个压力条件和7个温度条件,总计35组棋盘实验结果如表4所示。
表4 提取温度和压力条件棋盘实验结果
Table 4 Optimal results of temperature and pressure conditions for subcritical water extraction

指标压力/kPa温度/℃2002102202302402503003030.340.450.540.770.790.941.144040.640.760.871.131.231.311.37肉苁蓉苷A含量/(mg/g)5050.970.991.141.441.421.441.446061.021.021.191.431.431.441.427071.011.131.221.441.421.421.43
由表4可知,亚临界水提取肉苁蓉,随温度和压力的升高,提取液中苷类物质含量越高,最高达到1.44 mg/g。当压力大于505 kPa时,升高压力,其提取液中肉苁蓉苷A含量增加不明显,当压力小于505 kPa时,升高提取系统温度,也不能完全将肉苁蓉苷类物质提取出来。而在505 kPa压力下,温度升高到230 ℃时,已经将样品中全部苷类物质提取到提取液中,继续升高温度只会增加提取成本,不会得到更大收益。所以本实验选择505 kPa,230 ℃条件下,使用亚临界水提取肉苁蓉中的有效营养物质。
2.2 亚临界水提取肉苁蓉的最佳提取时间
由图1可知,亚临界水提取肉苁蓉,提取液中肉苁蓉苷A的含量随提取时间延长而增加,但是当提取时间超过10 min后,延长提取时间,肉苁蓉苷A含量增加变慢,当提取时间到15 min时,亚临界水能将样品中全部苷类物质提取出来,含量达到1.44 mg/g。继续延长提取时间只会增加提取成本,不会得到更大收益。所以本实验选择提取时间为15 min,使用亚临界水提取肉苁蓉中的有效营养物质。
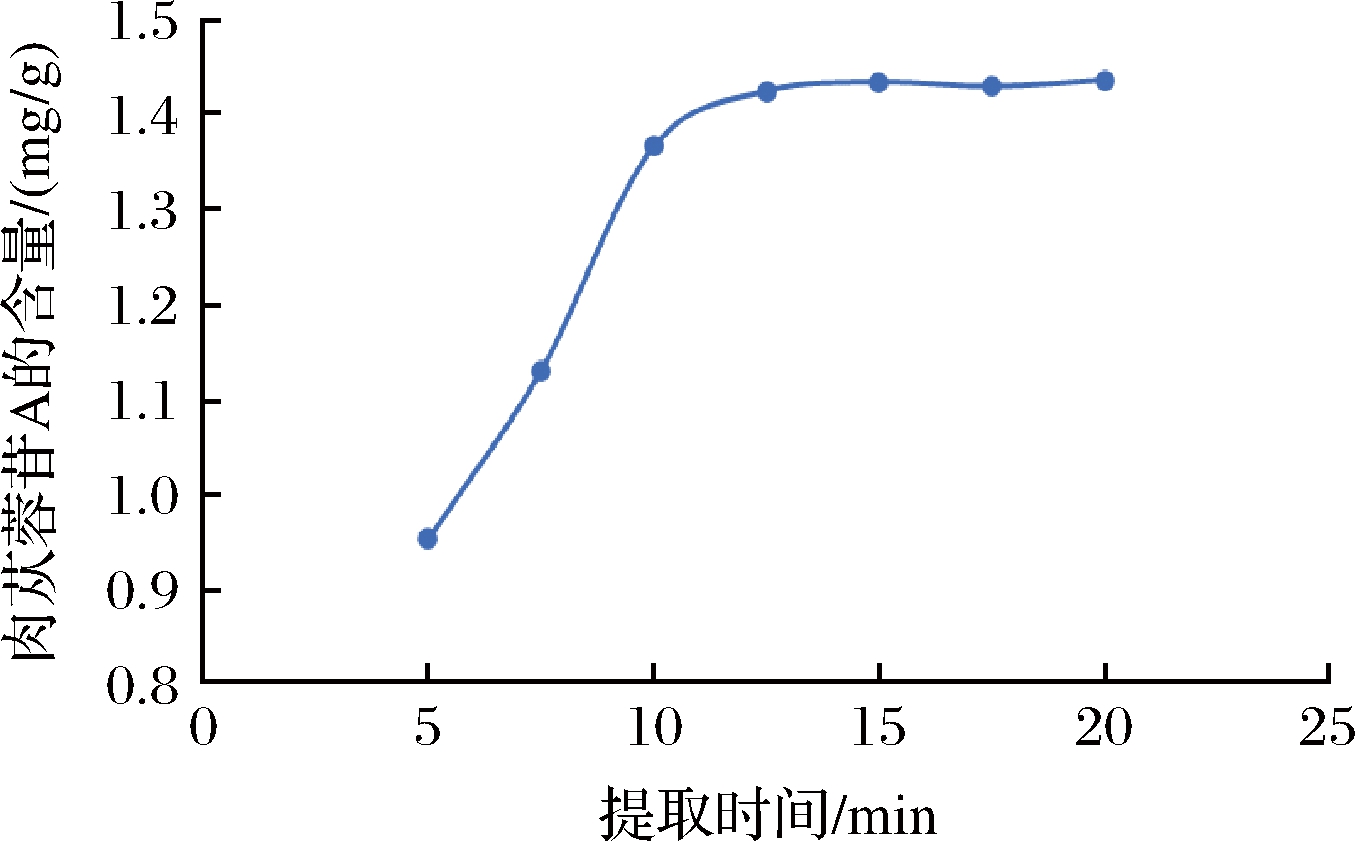
图1 不同提取时间提取液中肉苁蓉苷A的含量
Fig.1 Content of Cistanche glycoside A in different extraction time
2.3 不同提取产物中肉苁蓉苷类物质含量对比
不同提取产物中肉苁蓉苷类物质含量对比如表5所示,色谱图见图2所示。
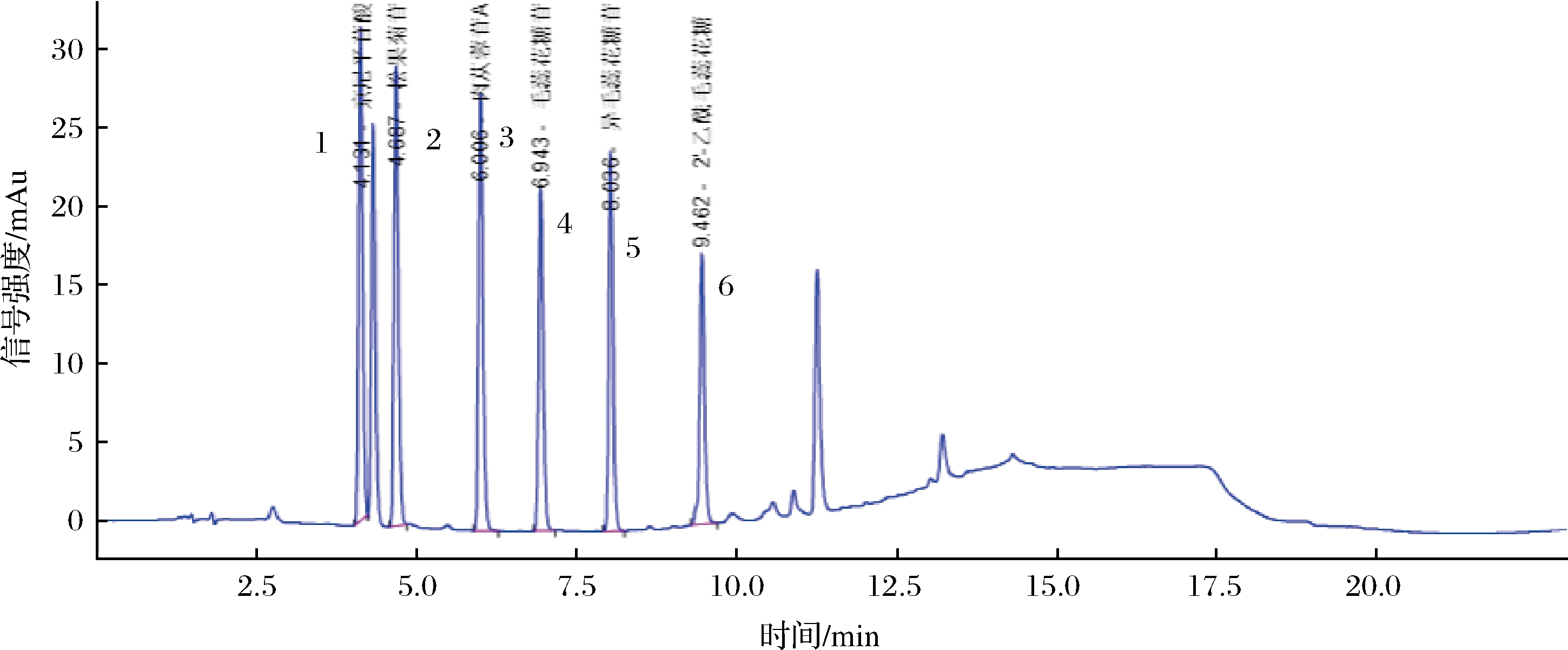
1-甲京尼平苷酸;2-松果菊苷;3-肉苁蓉苷A;4-毛蕊花糖苷;5-异毛蕊花糖苷;6-2′-乙酰基毛蕊花糖苷
图2 肉苁蓉苷类物质液相色谱图
Fig.2 Liquid chromatogram of Cistanche glycoside
表5 不同提取产物中肉苁蓉苷类物质含量 单位:mg/g
Table 5 Content of Cistanche glycoside in different extracts

组分名称提取方式亚临界水溶剂水回流乙醇回流水溶剂超声乙醇超声超临流体界京尼平苷酸含量1.631.241.621.131.441.64松果菊苷含量12.347.8410.347.429.9411.79肉苁蓉苷A含量1.44 1.021.39 0.961.13 1.372'-乙酰基毛蕊花糖苷含量1.36 1.041.33 0.871.18 1.32毛蕊花糖苷含量2.41 1.542.24 1.181.82 2.33异毛蕊花糖苷含量2.31 1.562.15 1.091.77 2.25
由表5可知,亚临界水提取方式对6种肉苁蓉苷类物质提取效果最佳,6种苷类物质含量分别达到:1.63、12.34、1.44、1.36、2.41、2.31 mg/g;平均提取效率比超临界流体提取高2.93%;比乙醇溶剂回流提取高6.08%;比水溶剂回流提取高30.28%;比乙醇溶剂超声提取高18.95%;比水为溶剂超声提取高40.63%。水为溶剂超声提取效果最不理想,这是因为苷类物质都存在于植物细胞内部,而且更加易溶于中等极性的有机试剂,所以乙醇作为溶剂提取的效果明显高于水作溶剂的效果。而简单的超声辅助提取,不足以使苷类物质完全突破植物细胞壁,需要更剧烈的方式使植物细胞壁完全破裂。回流提取需要在加热煮沸条件下,提取效果也相对提高,超临界流体只有通过二氧化碳流体在特殊压力下才能将细胞内的物质完全提取出来,而亚临界水提取条件为高温高压,完全破坏了植物细胞壁,很容易将细胞内有效物质全部溶出,相比于其他几种提取方式是一种环保高效的提取方式。由图2可知,6种肉苁蓉苷在该色谱条件下被完全分离,峰没有重叠,前沿或拖尾现象,确保定量定性结果准确稳定。
2.4 不同提取产物中维生素类物质含量对比
由表6可知,亚临界水提取方式对维生素类物质提取效果最佳,维生素B1含量达到0.024 mg/100 g,维生素B2含量达到0.021 mg/100 g,维生素B6含量达到0.044 mg/100 g。其效果与水和乙醇作为溶剂回流提取效果相当;平均提取效率比超临界流体提取高6.64%;比乙醇溶剂超声提取高34.56%;比水为溶剂超声提取高35.75%。因为仅超声提取效果不完全。其他提取方式都能完全提取肉苁蓉中的维生素。是因为维生素B1、维生素B2、维生素B6都是水溶性维生素,在水和中等极性溶剂中都极易溶解。所以在回流,加压等剧烈提取方式下,都能将目标物全部提取出来。而亚临界水提取时间短,仅需要15 min,且更加绿色环保。由图3可知,3种维生素在各自色谱条件下出现的色谱峰,对称性良好,有利于定性定量检测结果的准确性和稳定性。
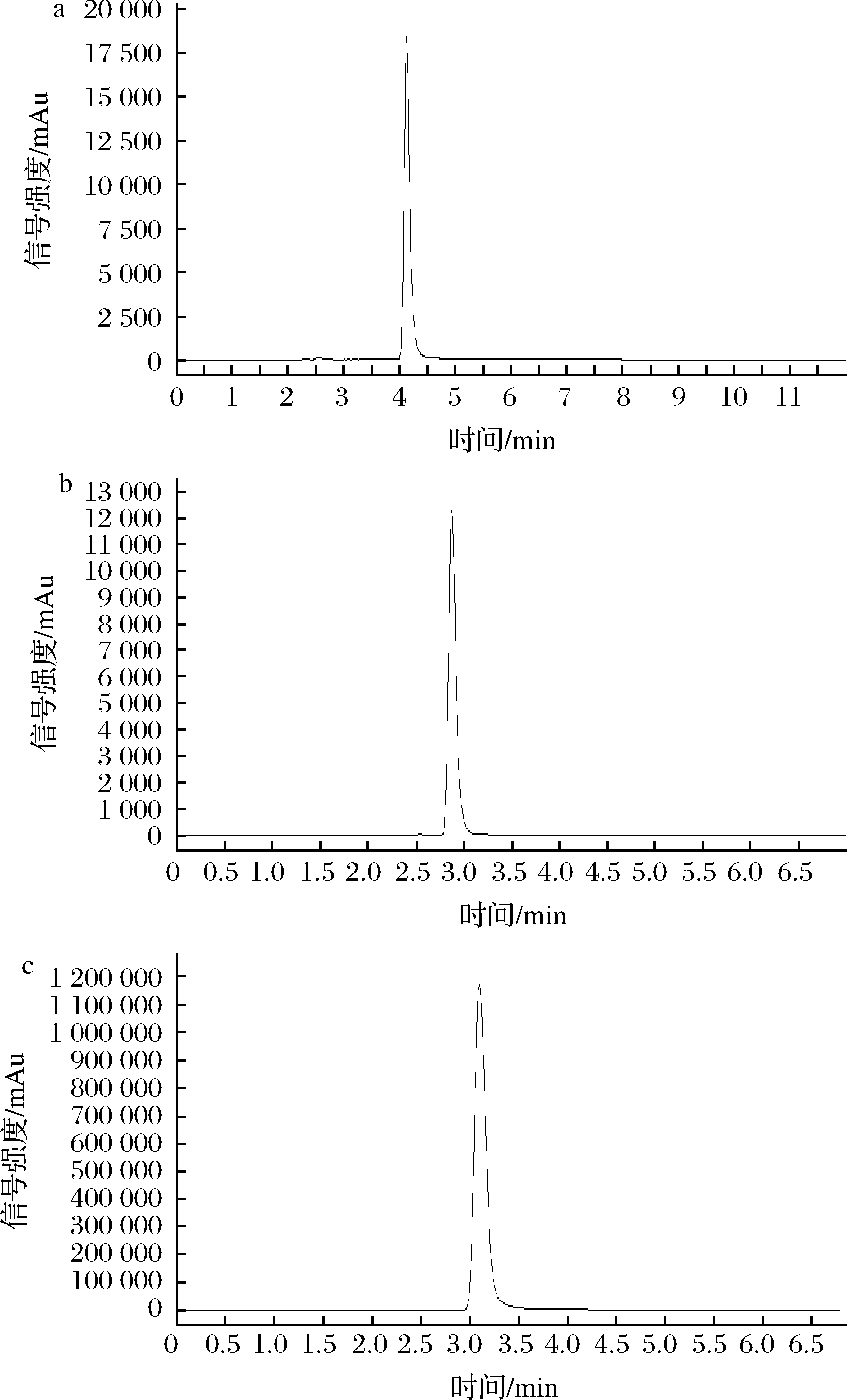
a-维生素B1;b-维生素B2;c-维生素B6
图3 肉苁蓉维生素类物质液相色谱图
Fig.3 Vitamin liquid chromatography
表6 不同提取产物中维生素类物质含量 单位:mg/100 g
Table 6 Content of vitamin in different extracts
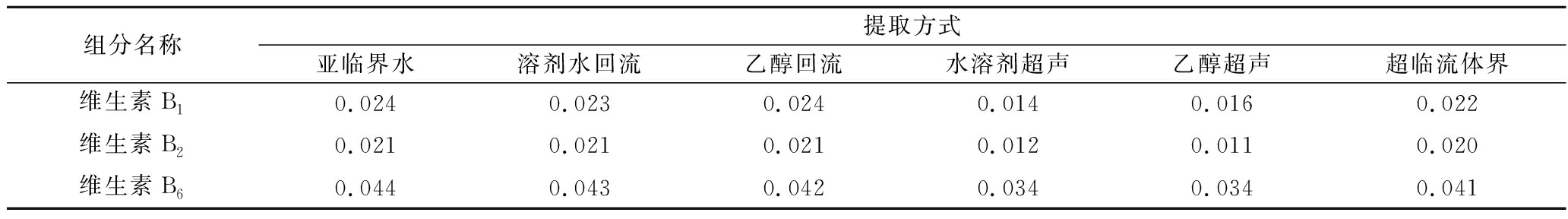
组分名称提取方式亚临界水溶剂水回流乙醇回流水溶剂超声乙醇超声超临流体界维生素B10.0240.0230.0240.0140.0160.022维生素B20.0210.0210.0210.0120.0110.020维生素B60.0440.0430.0420.0340.0340.041
2.5 不同提取产物中微量元素含量对比
肉苁蓉中含有铜、锌、铁、锰等对人体有益的微量元素,由表7可知,亚临界水提取方式对微量元素提取效果:铜元素含量达到0.94 mg/100 g,锌元素含量达到1.13 mg/100 g,铁元素含量达到4.66 mg/100 g,锰元素含量达到1.04 mg/100 g。其效果与水作为溶剂回流提取效果相当,平均提取效率比超临界流体提取高97.34%、比水为溶剂超声提取高47.07%、比乙醇溶剂超声提取和回流提取高99.22%。这是因为微量元素易溶于水,极难溶于有机溶剂中,所以使用亚临界水提取,水溶剂回流提取方式都能将样品中微量元素充分提取出来,乙醇和超临界流体作溶剂提取基本无法将微量元素溶解到溶剂中。说明亚临界水提取方式有利于将肉苁蓉样品中的微量元素提取到提取液中。
表7 不同提取产物中微量元素的含量 单位:mg/100 g
Table 7 Content of trace elements in different extracts
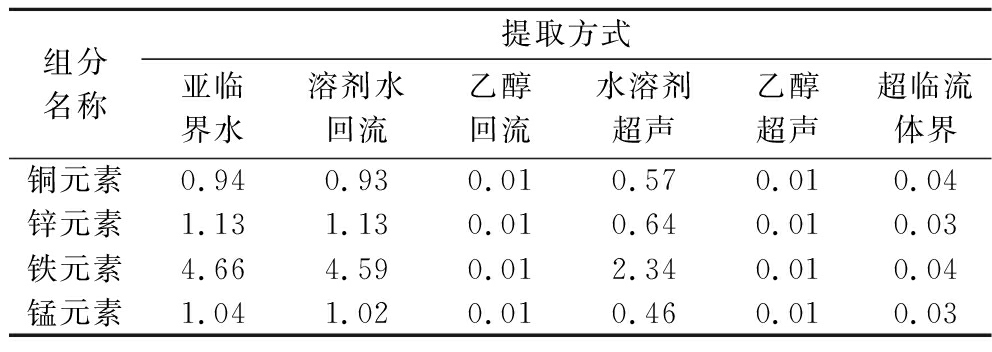
组分名称提取方式亚临界水溶剂水回流乙醇回流水溶剂超声乙醇超声超临流体界铜元素0.940.930.010.570.010.04锌元素1.131.130.010.640.010.03铁元素4.664.590.012.340.010.04锰元素1.041.020.010.460.010.03
2.6 不同提取产物中农药残留含量对比
由表8可知,亚临界水提取方式对农药残留提取效果:克百威含量为0.004 mg/100 g,甲拌磷含量为0.005 mg/100 g,甲基异硫磷含量为0.012 mg/100 g,毒死蜱含量为0.006 mg/100 g。其效果与水作为溶剂回流提取和超声提取效果相当,平均提取效率比超临界流体提取低84.47%、比乙醇为溶剂超声提取低72.89%、比乙醇为溶剂回流提取低83.25%。这是因为样品中含有少量脂溶性的农药残留,超临界流体对农药残留具有极好的溶解性,几乎可以将样品中残留的农药完全提取出来。乙醇对农药残留的提取效果次之,且回流提取方式优于超声提取方式。亚临界水提取、水溶剂回流提取和超声提取都无法将脂溶性农药残留物质提取到提取液中。而农药残留是对食用者有害的物质,应当含量越少越好。由图4可知,该色谱和质谱条件,能完全分离4种农药残留,互不影响。
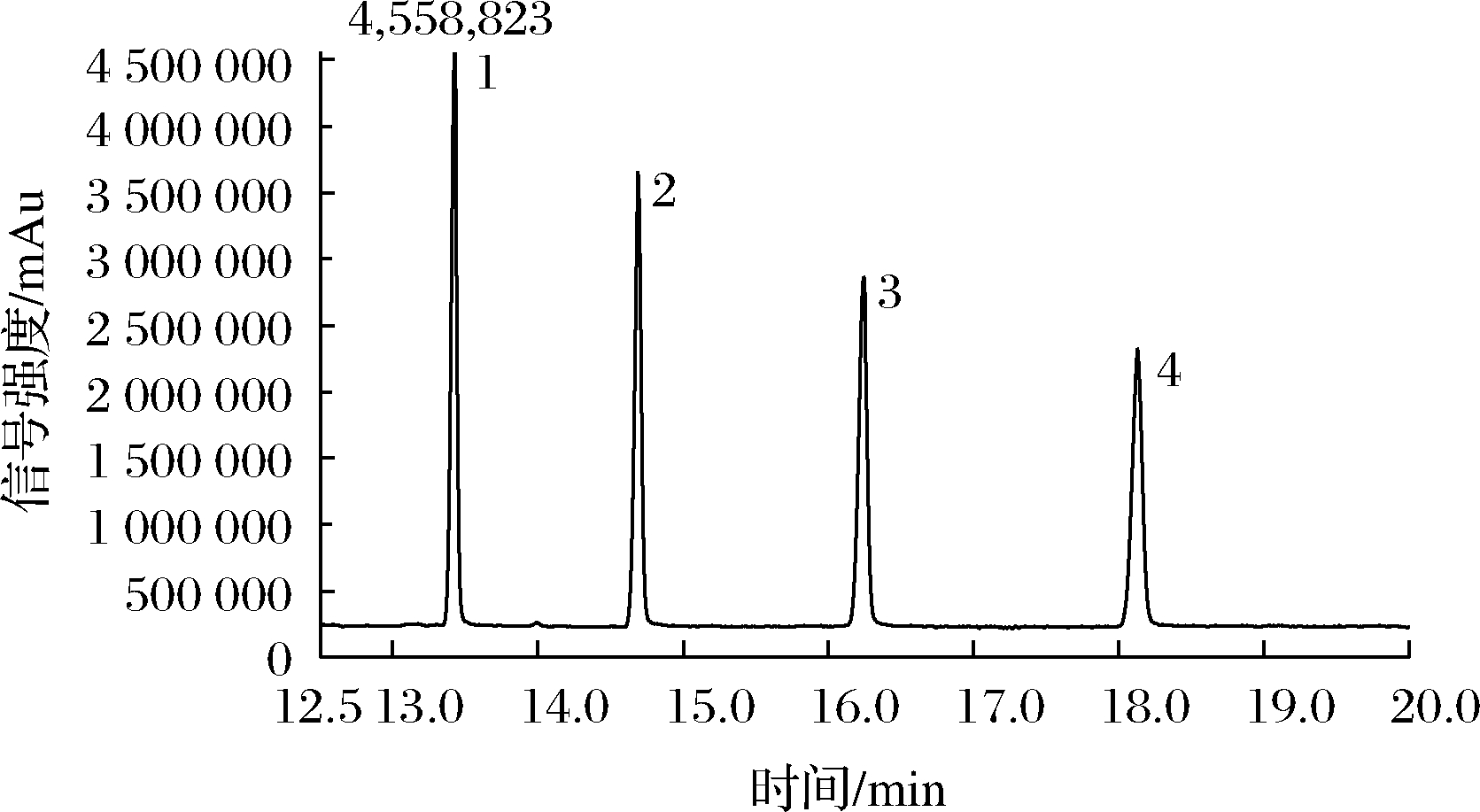
1-甲拌磷;2-克百威;3-毒死蜱;4-甲基异硫磷
图4 肉苁蓉中农药残留质谱图
Fig.4 Mass spectrum of pesticide residues in Cistanche
表8 不同提取产物中农药残留的含量 单位:mg/100 g
Table 8 Content of pesticide residues in different extracts
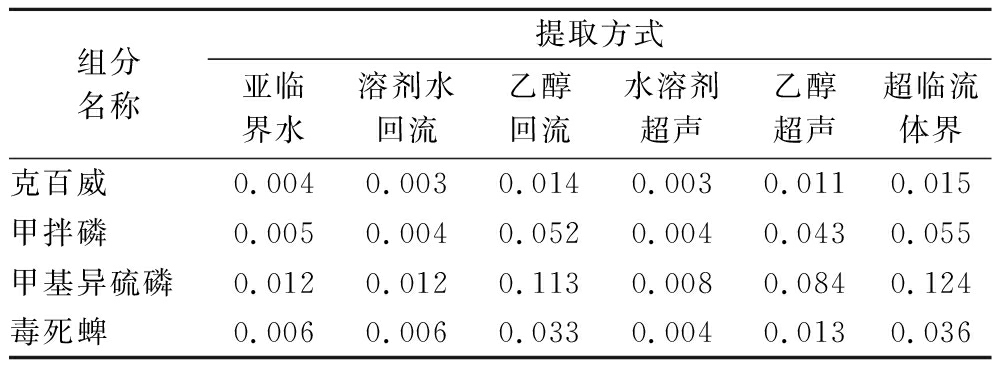
组分名称提取方式亚临界水溶剂水回流乙醇回流水溶剂超声乙醇超声超临流体界克百威0.0040.0030.0140.0030.0110.015甲拌磷0.0050.0040.0520.0040.0430.055甲基异硫磷0.0120.0120.1130.0080.0840.124毒死蜱0.0060.0060.0330.0040.0130.036
综合以上实验结果,超声辅助提取方式对营养物质的提取效率最低。用水作溶剂回流提取也不能将全部营养物质提取出来。而乙醇回流提取、超临界流体提取,亚临界水提取、都能将肉苁蓉中苷类物质,维生素类物质完全提取出来,但是乙醇回流提取,超临界流体提取方式无法有效提取样品中对食用者有益的微量元素,还会将样品中残留的农药提取到提取液中,可能导致后续产品存在农药残留。亚临界水提取方式不仅能有效地提取样品中苷类物质、维生素、有益微量元素,同时大幅减少对农药残留物质的提取,是一种对保健食品研发友好的提取方式。
2.7 干燥方式对干粉产物中各物质含量的影响
由表9可知,样品提取液干燥条件的温度越高,有效营养物质的损失也越大,真空冷冻方式能有效保留提取液中有效营养物质,减压干燥得到的粉末,其中肉苁蓉苷类物质含量平均下降16.53%,维生素B1含量下降25.00%,维生素B2含量下降23.81%,维生素B6含量下降9.09%。常压干燥得到的粉末,其中肉苁蓉苷类物质含量平均下降28.36%,维生素B1含量下降54.17%,维生素B2含量下降57.14%,维生素B6含量下降13.64%。而且温度升高提取液中有效物质也容易和氧气发生氧化反应,导致最终干燥产物质量增加,且减压蒸干和常压蒸干得到坚硬的块状浓缩产物,而冷冻真空干燥得到粉状产物,经简单研磨过筛后,可以方便制备其衍生产品。
表9 不同干燥方式对干粉中各物质含量的影响
Table 9 Effects of different drying methods on the content of various substances in dry powder
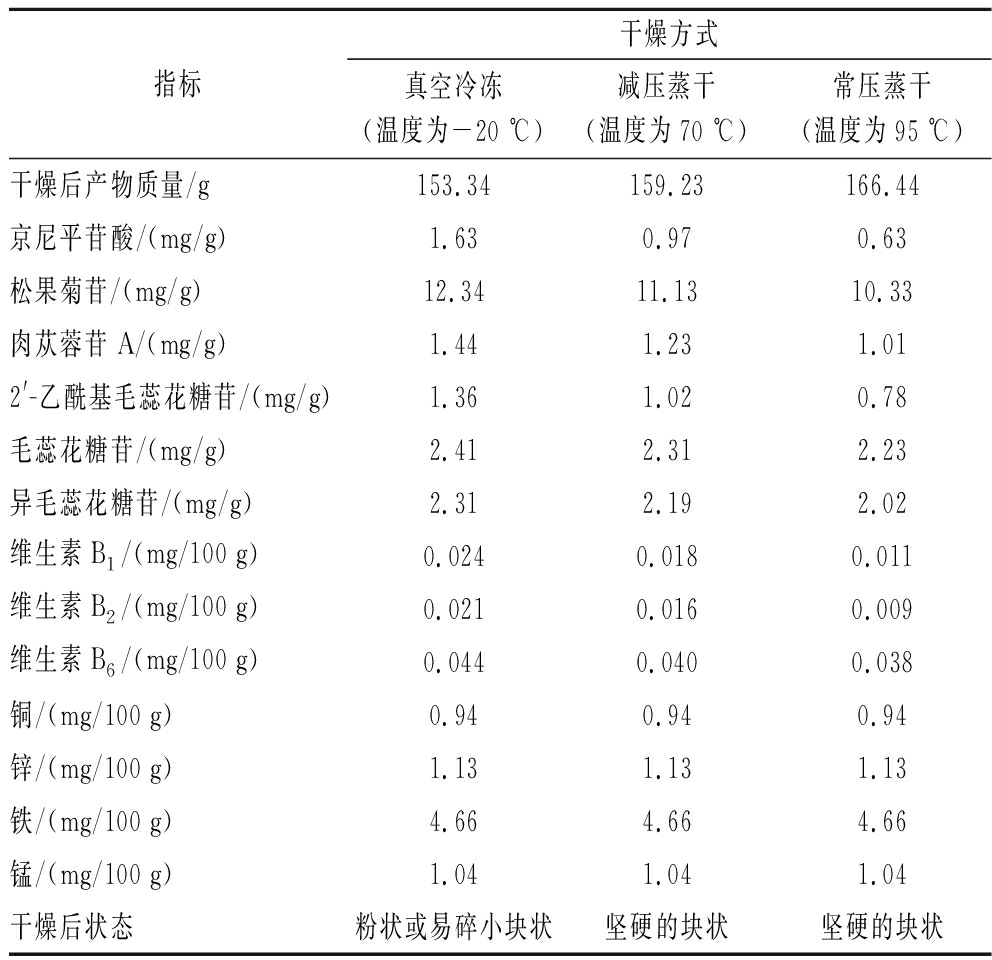
指标干燥方式真空冷冻(温度为-20 ℃)减压蒸干(温度为70 ℃)常压蒸干(温度为95 ℃)干燥后产物质量/g153.34159.23166.44京尼平苷酸/(mg/g)1.630.970.63松果菊苷/(mg/g)12.3411.1310.33肉苁蓉苷A/(mg/g)1.441.231.012'-乙酰基毛蕊花糖苷/(mg/g)1.361.020.78毛蕊花糖苷/(mg/g)2.412.312.23异毛蕊花糖苷/(mg/g)2.312.192.02维生素B1/(mg/100 g)0.0240.0180.011维生素B2/(mg/100 g)0.0210.0160.009维生素B6/(mg/100 g)0.0440.0400.038铜/(mg/100 g)0.940.940.94锌/(mg/100 g)1.131.131.13铁/(mg/100 g)4.664.664.66锰/(mg/100 g)1.041.041.04干燥后状态粉状或易碎小块状坚硬的块状坚硬的块状
3 结论
亚临界水在料液比1:20,505 kPa压力,230 ℃条件下,提取15 min,能将肉苁蓉样品中肉苁蓉苷类物质、维生素类物质、微量元素提取到提取液中,并且不会将样品中对食用者有害的农药残留提取到提取液中,较超声提取、回流提取、超临界流体萃取有明显优势,同时亚临界水提取更加绿色、环保。在对提取液的干燥处理中,真空冷冻干燥法较其他几种干燥方法能更好地保留提取液中的有效营养成分。综上所述,亚临界水提取结合真空冷冻干燥对制备肉苁蓉干粉是较为理想的方式。
[1] WANG F J, TU P F, ZENG K W, et al. Total glycosides and polysaccharides of Cistanche deserticola prevent osteoporosis by activating Wnt/β-catenin signaling pathway in SAMP6 mice[J]. Journal of Ethnopharmacology, 2021, 271:113899.
[2] HUANG X M, HUANG Y, NONG X W, et al. Identification of HPLC characteristic chromatograms of phenylethanoid glycosides and iridoid glycosides in herba Cistanche of different origins[J]. Medicinal Plant, 2020, 11(5):41-43, 48.
[3] WANG F M, ZHUO B Y, WANG S, et al. Atriplex canescens: A new host for Cistanche deserticola[J]. Heliyon, 2021, 7(6): e07368.
[4] HU J P, CAO D D, JU B W, et al. Study on nasal absorption of Cistanche deserticola phenylethanol glycosides nanoemulsion in vivo[J]. Zhongguo Zhong Yao Za Zhi=Zhongguo Zhongyao Zazhi=China Journal of Chinese Materia Medica, 2020, 45(20):4896-4901.
[5] JIANG Y, TU P F. Analysis of chemical constituents in Cistanche species[J]. Journal of Chromatography A, 2009, 1216(11):1970-1979.
[6] 侯建华, 王劼, 周玉碧. 荒漠肉苁蓉不同部位高效液相指纹图谱与化学成分分析[J]. 分析试验室, 2021, 40(10):1182-1186.
HOU J H, WANG J, ZHOU Y B. HPLC fingerprints and chemical compositions analysis of Cistanche deserticola from different parts[J]. Chinese Journal of Analysis Laboratory, 2021, 40(10):1182-1186.
[7] HU Y B, HUANG J H, LI Y X, et al. Cistanche deserticola polysaccharide induces melanogenesis in melanocytes and reduces oxidative stress via activating NRF2/HO-1 pathway[J]. Journal of Cellular and Molecular Medicine, 2020, 24(7):4023-4035.
[8] SUN X, LI L, PEI J, et al. Metabolome and transcriptome profiling reveals quality variation and underlying regulation of three ecotypes for Cistanche deserticola[J]. Plant Molecular Biology, 2020, 102(3):253-269.
[9] 冯波, 陈强. HACCP体系与统计过程控制在片剂保健品生产中的结合应用[J]. 食品安全质量检测学报, 2018, 9(22):6064-6070.
FENG B, CHEN Q. Combinative application of hazard analysis critical control point system and statistical process control in tablet health products production[J]. Journal of Food Safety &Quality, 2018, 9(22):6064-6070.
[10] 刘田园, 丁惠, 陈衍男, 等. 浸泡时间对金银花7种成分水提效果的影响[J]. 食品研究与开发, 2019, 40(23):109-115.
LIU T Y, DING H, CHEN Y N, et al. Effect of soaking time on water extraction of seven components of Lonicera japonica Flos[J]. Food Research and Development, 2019, 40(23):109-115.
[11] 李蒙, 付艳秋, 韩静, 等. 响应面法优化肉苁蓉苯乙醇苷回流提取工艺[J]. 中南药学, 2015, 13(8):819-823.
LI M, FU Y Q, HAN J, et al. Optimization of reflux extraction of phenylethanoid glycoside in Cistanche deserticola Y.C. Ma by response surface[J]. Central South Pharmacy, 2015, 13(8):819-823.
[12] 丁慧玲, 许丹丹, 金天佑, 等. 超声-微波回流提取新疆管花肉苁蓉苯乙醇苷的工艺研究[J]. 食品工业科技, 2016, 37(12):301-305.
DING H L, XU D D, JIN T Y, et al. Ultrasonic microwave extraction technology of Xinjiang phenylethanoid glycosides from Cistanche tubulosa[J]. Science and Technology of Food Industry, 2016, 37(12):301-305.
[13] NIU L X, LI Z N, LI H J, et al. Study on ultrasonic wave extraction of flavonoids from the bulb of Lilium lancifolium[J]. Journal of Chinese Medicinal Materials, 2007, 30(1):85-88.
[14] LANG Q Y, WAI C M. Supercritical fluid extraction in herbal and natural product studies—a practical review[J]. Talanta, 2001, 53(4):771-782.
[15] DAUBER C, CARRERAS T, FERN NDEZ FERN
NDEZ FERN NDEZ A, et al. Response surface methodology for the optimization of biophenols recovery from “alperujo” using supercritical fluid extraction. Comparison between Arbequina and Coratina cultivars[J]. The Journal of Supercritical Fluids, 2022, 180:105460.
NDEZ A, et al. Response surface methodology for the optimization of biophenols recovery from “alperujo” using supercritical fluid extraction. Comparison between Arbequina and Coratina cultivars[J]. The Journal of Supercritical Fluids, 2022, 180:105460.
[16] 孟江平, 李忠彬, 廖文利, 等. 超临界CO2流体萃取在中药有效成分提取中的应用[J]. 安徽农业科学, 2011, 39(22):13565-13567.
MENG J P, LI Z B, LIAO W L, et al. Research and application of supercritical CO2 fluid extraction in the extraction of active components from traditional Chinese medicines[J]. Journal of Anhui Agricultural Sciences, 2011, 39(22):13565-13567.
[17] KHAJENOORI M, ASL A H, HORMOZI F, et al. Subcritical water extraction of essential oils fromzataria multifloraboiss[J]. Journal of Food Process Engineering, 2009, 32(6):804-816.
[18] CHENG Y, XUE F M, YU S, et al. Subcritical water extraction of natural products[J]. Molecules, 2021, 26(13):4004.
[19] 赵超. 超声强化亚临界水提取枸杞多糖的研究[D]. 广州: 华南理工大学, 2014.
ZHAO C. Ultrasound-enhanced subcritical water extraction of polysaccharides from Lycium barbarum L[D]. Guangzhou: South China University of Technology, 2014.
[20] 李国胜, 黄秀银, 白新鹏. 响应面法优化亚临界水提取火龙果茎多糖[J]. 福建农业学报, 2021, 36(2):195-201.
LI G S, HUANG X Y, BAI X P. Response surface optimization on subcritical water extraction of polysaccharides from pitaya stems[J]. Fujian Journal of Agricultural Sciences, 2021, 36(2):195-201.
[21] TOOR S S, ROSENDAHL L, RUDOLF A. Hydrothermal liquefaction of biomass: A review of subcritical water technologies[J]. Energy, 2011, 36(5):2328-2342.
[22] WANG X, CHEN Q R, LÜ X. Pectin extracted from apple pomace and citrus peel by subcritical water[J]. Food Hydrocolloids, 2014, 38:129-137.
[23] 梁渐崧, 薛翠丽, 吴孟华, 等. 肉苁蓉与沙苁蓉中6种苯乙醇苷类成分的UPLC含量测定及化学计量学评价[J]. 药物分析杂志, 2021, 41(2):226-235.
LIANG J S, XUE C L, WU M H, et al. Determination and chemometric evaluation of six phenylethanolic glycosides in Cistanche deserticola and Cistanche sinensis by UPLC[J]. Chinese Journal of Pharmaceutical Analysis, 2021, 41(2):226-235.
[24] FENG S S, YANG X M, WENG X, et al. Aqueous extracts from cultivated Cistanche deserticola Y.C. Ma as polysaccharide adjuvant promote immune responses via facilitating dendritic cell activation[J]. Journal of Ethnopharmacology, 2021, 277:114256.
[25] 刘爱红, 谢杰菲, 王倩, 等. 高效液相色谱法检测维生素B1含量的测定条件优化[J]. 食品与发酵科技, 2017, 53(6):102-105.
LIU AH, XIE J F, WANG Q,et al. Optimization of determination condition of vitamin B1 by means of high performance liquid chromatography(HPLC)[J]. Food and Fermentation Sciences &Technology, 2017, 53(6):102-105.
[26] 徐硕, 徐文峰, 金鹏飞, 等. HPLC法同时测定复合维生素B片中5种维生素的含量[J]. 中国药师, 2018, 21(1):177-180.
XU S, XU W F, JIN P F, et al. Simultaneous determination of five vitamins in complex vitamin B tablets by HPLC[J]. China Pharmacist, 2018, 21(1):177-180.
[27] 陈彩云, 魏鲜娥, 蔡伟江, 等. 高效液相色谱法同时测定保健食品中泛酸、烟酰胺、维生素B1、维生素B2、维生素B6的含量[J]. 食品安全质量检测学报, 2017, 8(5):1866-1871.
CHEN C Y, WEI X E, CAI W J, et al. Determination of pantothenate, nicotinamide, vitamin B1, vitamin B2, and vitamin B6 in healthy food by high performance liquid chromatography[J]. Journal of Food Safety &Quality, 2017, 8(5):1866-1871.
[28] 徐文峰, 金鹏飞, 徐硕, 等. 电感耦合等离子质谱在药物分析中的应用[J]. 药物分析杂志, 2017, 37(12):2123-2132.
XU W F, JIN P F, XU S, et al. Application of ICP-MS in pharmaceutical analysis[J]. Chinese Journal of Pharmaceutical Analysis, 2017, 37(12):2123-2132.
[29] 程志, 张蓉, 刘韦华, 等. 气相色谱-串联质谱法快速筛查测定中药材中144种农药残留[J]. 色谱, 2014, 32(1):57-68.
CHENG Z, ZHANG R, LIU W H, et al. Rapid screening and quantitative analysis of 144 pesticide residues in traditional Chinese medicinal herbs by gas chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2014, 32(1):57-68.