母乳中含有丰富的营养物质,不仅可以满足婴儿生长需求,其中含有的各种有益菌还可以促进婴儿肠道营养物质消化吸收、增强免疫,减少疾病发生,被公认为是婴儿最佳的营养来源[1]。这些营养成分可以促进婴幼儿生长[2],更会直接或间接地增强婴儿肠道黏膜的屏障功能和免疫功能,提高婴儿对疾病的抵抗能力[3]。KORDY等[4]研究发现母乳中的细菌主要由Staphylococcus,Streptococcus,Acinetobacter和Enterobacter组成。 UBIECH等[5]研究发现母乳含有乳酸杆菌属细菌中最常见的是:Lactobacillus gasseri和Lacticaseibacillus paracasei。DING等[6]研究发现母乳中的细菌组成受泌乳时间的影响,人类母乳在建立婴儿肠道健康和免疫方面发挥重要作用。因此可以证明母乳中存在微生物,并且微生物通过特定的内源性路线源源不断地提供共生细菌来促进婴儿肠道健康[7],保护婴儿远离外源病菌,并且提高婴儿的免疫系统。
UBIECH等[5]研究发现母乳含有乳酸杆菌属细菌中最常见的是:Lactobacillus gasseri和Lacticaseibacillus paracasei。DING等[6]研究发现母乳中的细菌组成受泌乳时间的影响,人类母乳在建立婴儿肠道健康和免疫方面发挥重要作用。因此可以证明母乳中存在微生物,并且微生物通过特定的内源性路线源源不断地提供共生细菌来促进婴儿肠道健康[7],保护婴儿远离外源病菌,并且提高婴儿的免疫系统。
益生菌被定义为当摄入足够的量时,对宿主具有健康作用的活的微生物,而对胃肠液的耐受性是益生菌筛选的关键环节,只有能耐受人体消化液的菌株才能到达相应部位发挥其功效成为益生菌[8]。研究表明,益生菌产品中活菌的数量应至少为106~107 CFU/g,才能产生有益作用[9]。益生菌的益生功效被不断证实和挖掘,益生菌与人体健康的研究正受到前所未有的关注,例如:益生菌可以调节消化道微生态平衡[10]、对机体进行免疫调节[11]、可通过调控机体代谢从而缓解代谢综合征的发生与发展等。益生乳酸菌被广泛应用于乳制品、活菌药物,现代农业和动物养殖,具有广泛的应用前景和研究价值。然而,我国具有优良特性的自主知识产权乳酸菌资源相对缺乏。因此,分离、保藏乳酸菌对于优良益生特性菌种的筛选和利用具有重要意义。
本文采用传统纯培养方法对6份新疆地区母乳中的乳酸菌进行分离纯化,将益生菌株Bifidobacterium lactis BB12作为对照组,通过发酵特性、体外胃肠液耐受性及胆盐耐受性试验对双歧杆菌进行筛选,得到2株具有潜在益生特性的双歧杆菌,研究其生理生化特征及生物学特性,为研究新疆地区母乳样品中的乳酸菌多样性提供原始数据,丰富我国菌种资源,为母乳中益生菌的研究和开发提供双歧杆菌菌株。
1 材料与方法
1.1 样品来源与采集
母乳样品来源于新疆维吾尔自治区妇幼保健医院6名哺乳期身体状况良好的汉族和维吾尔族志愿者妇女分娩后4~5 d内分泌的初乳汁。
母乳样品采集时需戴好一次性无菌手套,用洁净布擦拭乳头以及周围,手动收集母乳,丢弃最初的3~5 滴母乳后收集10滴母乳于15 mL无酶无菌离心管内。6份母乳样品分别做好标记(HM1~HM6),标记后用封口膜封好管口,迅速置于冰盒或加入保护剂液氮速冻。转移至车载冰箱-4 ℃保存后,低温运输,尽快运回实验室,保存于-80 ℃备用。
1.2 实验方法
1.2.1 乳酸菌的分离纯化及保存
将6份母乳样品进行10倍梯度稀释后,选取10-3、10-4、10-5梯度涂布在RCM固体培养基上,在37 ℃、厌氧条件下,平板倒置,培养48 h;随机挑取形态、大小、颜色不同的菌落于RCM液体培养基上,在37 ℃、厌氧条件下培养24 h;之后在RCM固体培养基上划线纯化2次,在37 ℃、厌氧条件下,平板倒置,培养48 h;挑取单个菌落于RCM液体培养基上,并在37 ℃、厌氧条件下培养24 h,记录菌落形态;连续培养至第3代,将二代菌液离心,收集菌泥,利用细菌基因组DNA提取试剂盒提取乳酸菌DNA,并用ND-1000型微量紫外分光光度计进行检测,若A260/A280值范围保持在1.8~2.0即视为纯DNA样品。按照表1的扩增程序,利用扩增仪进行16S rRNA基因扩增,扩增完成后,将扩增成功的PCR产物进行16S rRNA基因测序及同源性比对,构建系统发育树,用于菌种鉴定[12];将培养3代菌液8 000 r/min离心,用PBS缓冲液洗涤2次,革兰氏染色后镜检并观察记录,对细胞形态进行拍照保存;将革兰氏染色阳性进行过氧化氢酶试验阴性的纯培养物确定为疑似乳酸菌[13],加入菌种保护剂,均匀分置于安瓿管进行抽真空冷冻干燥保藏。
表1 PCR 50 μL反应体系(30个循环)及扩增程序
Table 1 PCR 50 μL reaction system (30 cycles) and amplification program
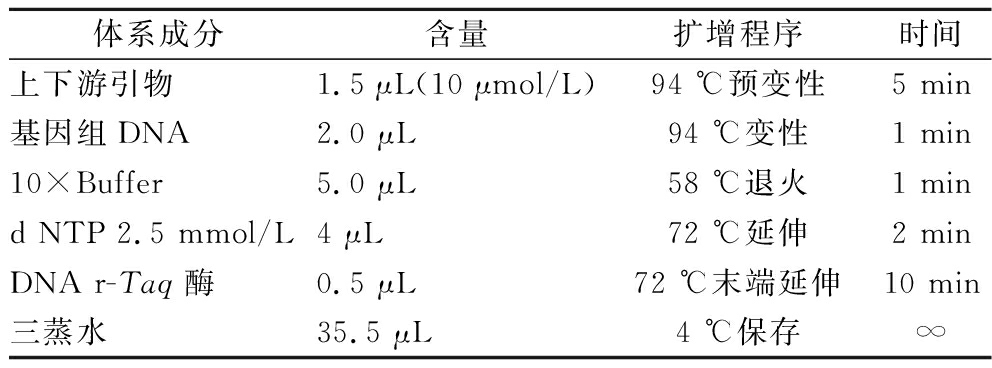
体系成分含量扩增程序时间上下游引物1.5 μL(10 μmol/L)94 ℃预变性5 min基因组DNA 2.0 μL 94 ℃变性1 min10×Buffer 5.0 μL58 ℃退火1 mind NTP 2.5 mmol/L 4 μL72 ℃延伸2 minDNA r-Taq酶0.5 μL 72 ℃末端延伸10 min三蒸水35.5 μL4 ℃保存∞
1.2.2 具有潜在益生特性菌株的筛选
a)供试菌液的制备
将获得的双歧杆菌株接种于RCM液体培养基中于37 ℃厌氧培养20 h,进行3次传代后,离心收集菌体细胞加入40 mL PBS制备供试菌液。
b)耐受pH 2.5试验
将供试菌液按2%接种于pH 2.5的RCM液体培养基,在37 ℃、厌氧条件下,培养3 h,用一次性接种环蘸取上述培养3 h后的RCM液体培养基并于RCM固体培养基上划线,在37 ℃、厌氧条件下,平板倒置,培养72 h后,观察是否生成菌落。
c)对人工胃肠液耐受性试验
人工胃肠液的配制及其耐受性试验参照文献[14]所用方法进行。对具有潜在耐酸特性的供试菌液进行10倍稀释计数,即为0 h原菌液活菌数[15]。取制备菌液与pH 2.5人工胃液混合,37 ℃下厌氧培养3 h后,用平板计数法测定活菌数,转接入人工肠液(pH 8.0)中,置37 ℃、厌氧培养,记录3、4、7、8、11 h的活菌数,随后计算存活率,如公式(1)所示:
存活率![]()
(1)
d)对胆盐耐受性试验
以MRS液体培养基(含0.2%巯基乙酸钠)为空白对照,配制含牛胆盐的MRS液体培养基(含0.2%巯基乙酸钠,0.3%的Oxgall),将培养末期的菌株按1%接种量接种于这两种培养基并置于37 ℃厌氧培养,每小时取样测定600 nm吸光度下的OD值,当菌株OD600值增加0.3个单位以上时停止培养。以延滞期长短作为菌株耐受胆盐能力的评价标准,延滞期是指实验组和空白组菌株吸光度增加0.3个单位所需时间的差值[16]。
1.2.3 生理生化试验鉴定
菌株最适生长温度、对pH的耐受性、对盐的耐受性,以及生长曲线的测定方法和菌株发酵产酸能力的测定方法按照表2的试验方法进行。
表2 生理生化试验条件
Table 2 Physiological and biochemical test conditions

菌株接种量培养基培养条件温度/℃pHNaCl质量分数/%生长曲线产酸能力2%RCM202.50303.52.0374.54.0455.56.0556.58.0-7.510.0将菌株发酵液以2%接种量接种于改良的牛乳培养基中,37 ℃静置厌氧培养,于0~30 h(间隔2 h)取样,测定600 nm吸光度下的OD值将菌株按2%接种量接种到含有11%牛乳的液体培养基中,在菌株最适生长温度下发酵1 d,(间隔2 h)取样测定发酵液pH值
注:-表示无。
2 结果与分析
2.1 菌种的分离鉴定结果
由新疆地区6份母乳样品中乳酸菌的分离鉴定结果(表3)和相对含量(图1)可知,6份母乳样品中共分离出的69株乳酸菌,经16S rRNA序列测定,归类于7个属11个种,其中Streptococcus salivarius共分离到27株,占总分离株的39.1%,为优势菌种;Enterococcus faecalis共分离到19株,占总分离株的27.5%;其余菌种占33.4%。选取其中4株双歧杆菌进行后续潜在益生菌筛选试验。

图1 乳酸菌分离株的相对含量
Fig.1 Relative content of lactic acid bacteria isolates
表3 母乳分离株的分离鉴定汇总结果 单位:株
Table 3 Summary results of isolation and identification of breast milk isolates
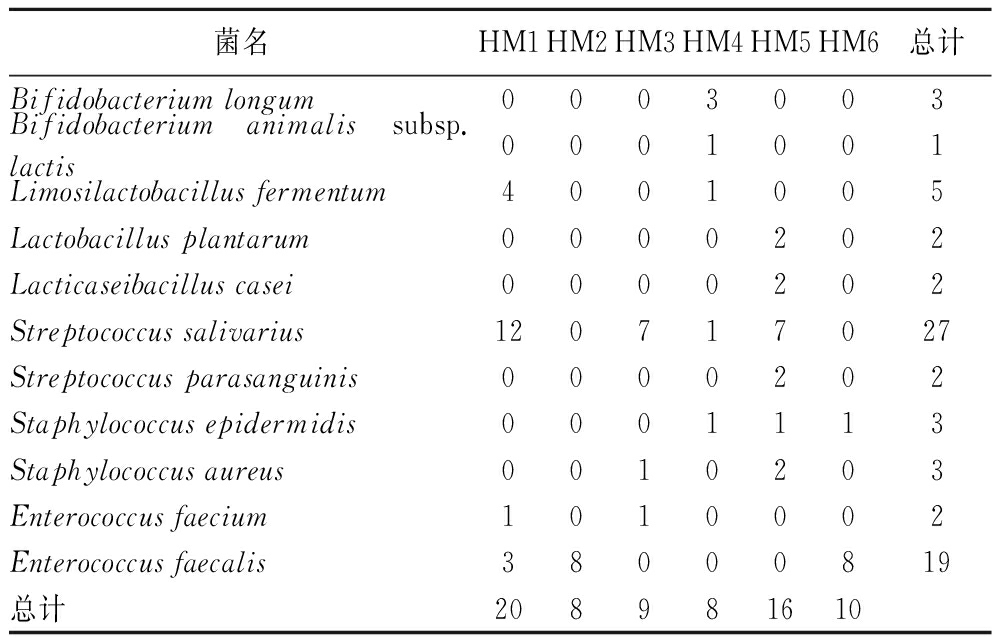
菌名HM1HM2HM3HM4HM5HM6总计Bifidobacterium longum0003003Bifidobacterium animalis subsp.lactis0001001Limosilactobacillus fermentum4001005Lactobacillus plantarum0000202Lacticaseibacillus casei0000202Streptococcus salivarius120717027Streptococcus parasanguinis0000202Staphylococcus epidermidis0001113Staphylococcus aureus0010203Enterococcus faecium1010002Enterococcus faecalis38000819总计208981610
由图2可知,菌株IMAU99747与模式株Staphylococcus aureus DSM20231(MN652637)聚为一类,同源相似性为100%,故鉴定为S.aureus。菌株IMAU99761与模式株Staphylococcus epidermidis ATCC14990(Z26894)聚为一类,同源相似性为100%,故鉴定为S.epidermidis。菌株IMAU99681与模式株Enterococcus faecalis NBRC 100481(AB681179)聚为一类,同源相似性为100%,故鉴定为E.faecalis。菌株IMAU99675与模式株Enterococcus faecium DSMZ20477(MH544640)聚为一类,同源相似性为100%,故鉴定为E.faecium。菌株IMAU99715与模式株Streptococcus salivarius ATCC7073(AY188352)聚为一类,同源相似性为100%,故鉴定为S.salivarius。菌株IMAU99745与模式株Streptococcus parasanguinis ATCC15912(AF003933)聚为一类,同源相似性为100%,故鉴定为S.parasanguinis。菌株IMAU99733与模式株Lacticaseibacillus casei DSMZ20011(KP326371)聚为一类,同源相似性为100%,故鉴定为L.casei。菌株IMAU99729与模式株Limosilactobacillus fermentum ATCC14931(M58819)聚为一类,同源相似性为100%,故鉴定为L.fermentum。菌株IMAU99737、IMAU99732与模式株Lactiplantibacillus plantarum JCM1149(HM162417)聚为一类,同源相似性为100%,故鉴定为L.plantarum。菌株IMAU99728与模式株Bifidobacterium animalis subsp.lactis DSM10140(AB050136)聚为一类,同源相似性为100%,故鉴定为B.animalis subsp. lactis。菌株IMAU99725、IMAU99726、IMAU99727与模式株Bifidobacterium longum KCTC3128(GU361823)聚为一类,同源相似性为100%,故鉴定为B.longum。

图2 母乳中部分乳酸菌分离株16S rRNA基因序列系统发育树
Fig.2 Phylogenetic tree of 16S rRNA gene sequences of lactic acid bacteria isolated from breast milk
2.2 具有潜在益生特性菌株的初步筛选结果
2.2.1 双歧杆菌耐受pH 2.5生长情况及凝乳情况
由表4可知,B.longum IMAU99727在pH 2.5生长情况最好,OD600值最高,且具有凝乳情况,B.animalis subsp.lactis IMAU99728和B.longum IMAU99726在pH 2.5生长情况较好,OD600值较高,且具有凝乳情况,而B.longum IMAU99725在pH 2.5生长情况较差,OD600值最低,并且无凝乳情况。
表4 双歧杆菌耐受pH 2.5生长情况及凝乳情况
Table 4 Growth and coagulation of Bifidobacterium tolerance to pH 2.5
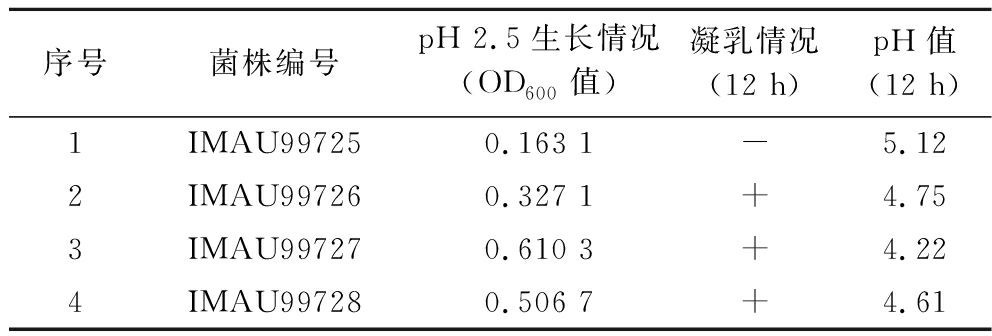
序号菌株编号pH 2.5生长情况(OD600值)凝乳情况(12 h)pH值(12 h)1IMAU997250.163 1-5.122IMAU997260.327 1+4.753IMAU997270.610 3+4.224IMAU997280.506 7+4.61
注:-表示无凝乳情况,+表示有凝乳情况。
2.2.2 菌株对人工胃肠液耐受性试验
由表5可知,B.longum IMAU99725和B.longum IMAU99726对人工胃液耐受性表现出的耐受力(pH 2.5)较弱,人工胃液中3 h后存活率不足50%;而B.longum IMAU99727和B.animalis subsp.lactis IMAU99728均对人工胃液耐受性表现出较强的耐受力(pH 2.5),其中B.longum IMAU99727对人工胃液耐受性的耐受力更好,与来源于人体肠道中的对照菌B.lactis BB12相比无显著差异;4株菌对人工肠液(pH 8.0)表现的耐受力不同,其中B.longum IMAU99727对人工肠液的耐受性更好,最终存活率高于对照菌B.lactis BB12。
表5 菌株对人工胃肠液耐受性试验
Table 5 Tolerance test of strains to artificial gastrointestinal fluid
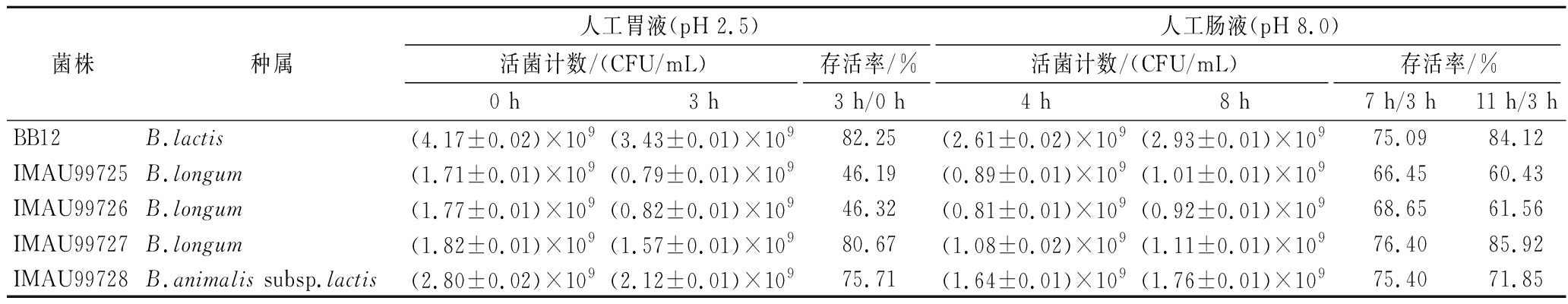
菌株种属人工胃液(pH 2.5)人工肠液(pH 8.0)活菌计数/(CFU/mL)存活率/%活菌计数/(CFU/mL)存活率/%0 h3 h3 h/0 h4 h8 h7 h/3 h11 h/3 hBB12B.lactis(4.17±0.02)×109(3.43±0.01)×10982.25(2.61±0.02)×109(2.93±0.01)×10975.0984.12IMAU99725B.longum(1.71±0.01)×109(0.79±0.01)×10946.19(0.89±0.01)×109(1.01±0.01)×10966.4560.43IMAU99726B.longum(1.77±0.01)×109(0.82±0.01)×10946.32(0.81±0.01)×109(0.92±0.01)×10968.6561.56IMAU99727B.longum(1.82±0.01)×109(1.57±0.01)×10980.67(1.08±0.02)×109(1.11±0.01)×10976.4085.92IMAU99728B.animalis subsp.lactis(2.80±0.02)×109(2.12±0.01)×10975.71(1.64±0.01)×109(1.76±0.01)×10975.4071.85
2.2.3 菌株对胆盐耐受性试验
由表6可知,B.longum IMAU99725和B.longum IMAU99726对胆盐的耐受能力较差;B.longum IMAU99727和B.animalis subsp.lactis IMAU99728对胆盐表现出较高水平的耐受性,与对照组菌株B.lactis BB12无显著差异。
表6 试验菌株对肉汤培养基中0.3%牛胆盐的耐受性
Table 6 Tolerance of test strains to 0.3% bile salt in broth medium

菌株种属在620 nm 2处增加0.3单位吸光度的时间/hMRS(无牛胆盐)MRS(含有0.3%牛胆盐)延滞期/hBB12B.lactis4.40±0.10a6.28±0.01a1.98±0.01aIMAU99725B.longum3.19±0.64b5.41±0.03b1.54±0.02cIMAU99726B.longum3.22±0.15b5.20±0.01b1.67±0.01bIMAU99727B.longum4.26±0.25a6.17±0.01a1.96±0.01aIMAU99728B.animalis subsp.lactis4.36±0.12a6.23±0.02a1.95±0.02a
注:同行角标不同表示差异性显著(P<0.05),同行上角标相同表示差异性不显著(P>0.05)。
通过发酵特性、体外胃肠液耐受性及胆盐耐受性试验对菌株的初步筛选,结果表明,B.longum IMAU99727和B.animalis subsp.lactis IMAU99728与对照组菌株B.lactis BB12无明显差异,具有益生能力,故选择这2株菌进行后续生理生化特性试验。
2.3 生理生化特性试验结果
2.3.1 最适温度的确定
由图3可知,当温度低于37 ℃时,随温度的升高,B.longum IMAU99727和B.animalis subsp.lactis IMAU99728的OD600值呈逐渐增大的趋势,当温度为37 ℃,B.longum IMAU99727和B.animalis subsp.lactis IMAU99728生长较快,OD600值最大,菌悬液浓度较高。当温度高于37 ℃时,随着温度的升高,B.longum IMAU99727和菌株IMAU99728的OD600值呈降低的趋势,菌悬液浓度较低。在不同温度下,B.longum IMAU99727的OD600值始终高于B.animalis subsp.lactis IMAU99728 OD600值,B.longum IMAU99727的活性较好。

图3 菌株IMAU99727和IMAU99728最适温度的确定
Fig.3 Determination of optimum temperature of IMAU99727 and MAU99728
注:Linear为线性趋势线,表示OD600值以恒定的比率增加或减少(下同)。
2.3.2 菌株对pH的耐受性
由图4可知,当pH值低于7时,OD600值呈逐渐上升趋势,此时B.longum IMAU99727和B.animalis subsp.lactis IMAU99728随pH的升高,生长越快,菌悬液浓度越高,当pH值为7时,OD600值最高,此时B.longum IMAU99727和B.animalis subsp.lactis IMAU99728生长最好;当pH值超过7时,OD600值呈平缓下降趋势,当pH值为3以下时,OD600值较低,此时B.longum IMAU99727和B.animalis subsp.lactis IMAU99728几乎不生长;因此B.longum IMAU99727和B.animalis subsp.lactis IMAU99728的适宜pH范围为5.5~7.5。

图4 菌株IMAU99727和MAU99728对pH的耐受性
Fig.4 The tolerance of IMAU99727 and IMAU99728 to pH
2.3.3 菌株IMAU99727和IMAU99728对NaCl的耐受性
由图5可知,B.longum IMAU99727和B.animalis subsp.lactis IMAU99728具有一定的耐盐性,当液体培养基NaCl添加量低于2%(质量分数)时,OD600值迅速上升,说明在此范围内其对B.longum IMAU99727和B.animalis subsp. lactis IMAU99728的生长无明显影响;当NaCl添加量高于2%时,OD600值呈下降趋势,此时B.longum IMAU99727和B.animalis subsp.lactis IMAU99728生长受到一定程度的抑制,且NaCl浓度越高,抑制越明显。
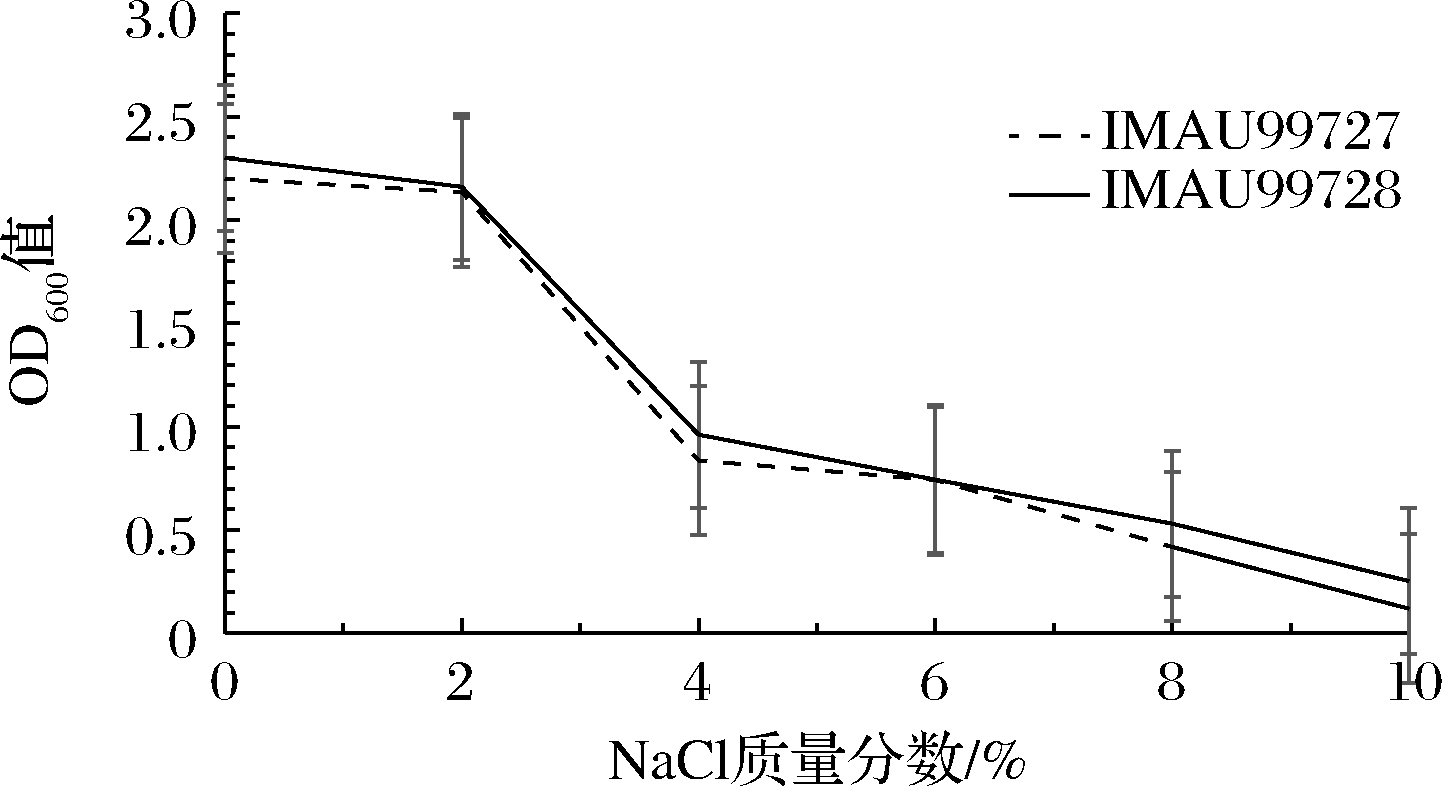
图5 菌株IMAU99727和IMAU99728对NaCl的耐受性
Fig.5 The tolerance of IMAU99727 and MAU99728 to NaCl
2.3.4 生长曲线的绘制和菌株的产酸能力测定
从图6中,B.longum IMAU99727的生长曲线可以看出,0~2 h是菌株的生长延滞期,OD600值保持缓慢上升;2~12 h为菌株的对数生长期,OD600值迅速增加;在12 h后菌株开始进入稳定期,18 h时,OD600值达到最高,24 h后,OD600值开始下降,菌株进入衰亡期。由B.animalis subsp.lactis IMAU99728的生长曲线可知,0~2 h时,为菌株的生长延滞期,OD600值保持缓慢上升;2~14 h为菌株的对数生长期;16 h后OD600值开始缓慢增加,进入菌株的稳定期,18 h时OD600值达到最高;24 h后,OD600值显示出下降趋势,菌株进入衰亡期。由菌株的产酸曲线可知,20 h时,B.longum IMAU99727的pH最低达到4.28;24 h时,B.animalis subsp.lactis IMAU99728的pH达到最低4.28。菌株产生乳酸速度与pH下降速度、抑制其他细菌的能力成正比,综上,0~18 h,B.longum IMAU99727比B.animalis subsp.lactis IMAU99728的pH低、OD600值高,因此B.longum IMAU99727比B.animalis subsp.lactis IMAU99728乳酸菌产酸速度快、生长速度快。
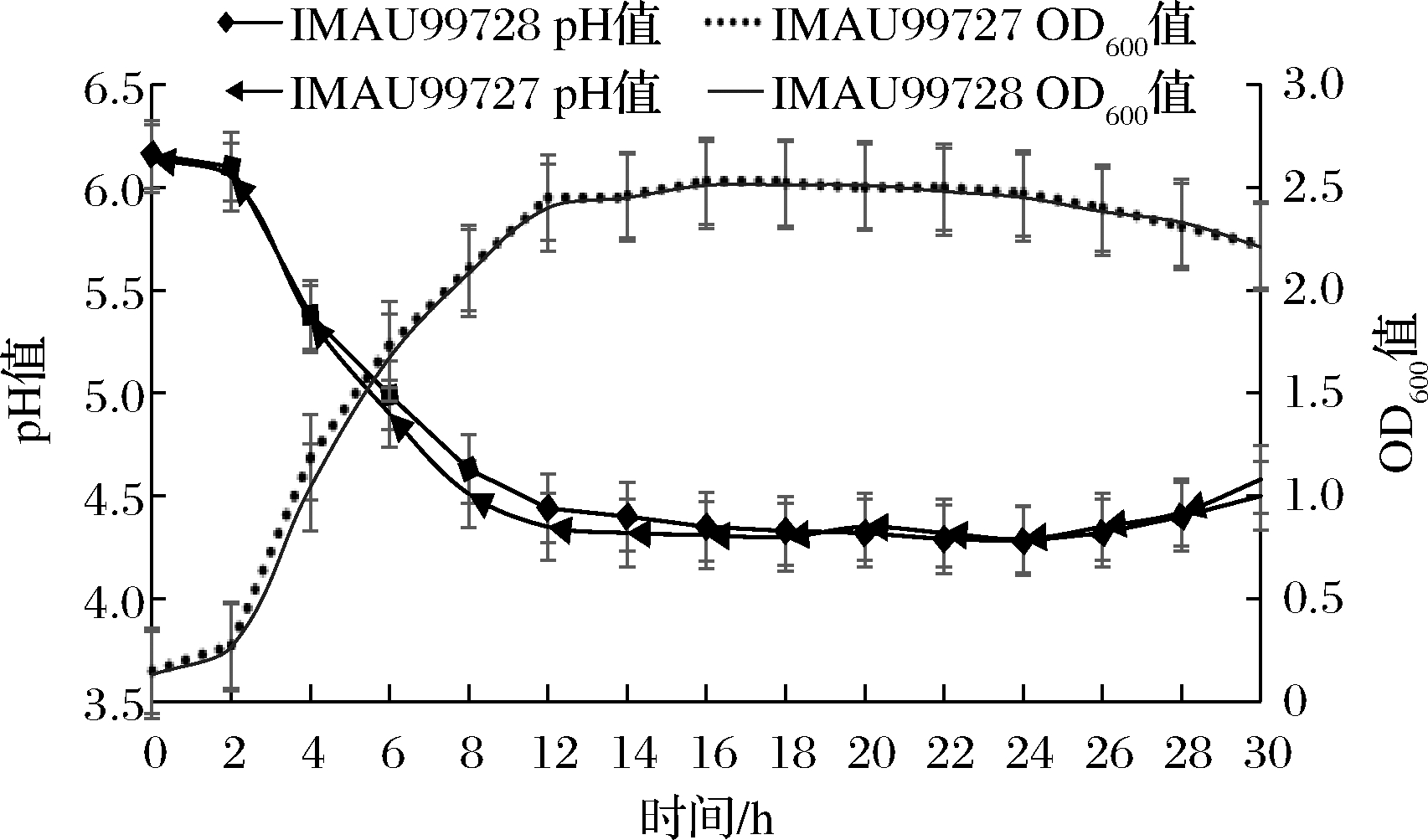
图6 菌株IMAU99727和IMAU99728的生长曲线及产酸能力的测定
Fig.6 Determination of growth curve and acid production capacity of strain IMAU99727 and IMAU99728
3 讨论
母乳喂养是一个永恒的主题,随着医学科学的发展,世界早已公认母婴喂养对婴儿健康的有利影响及其重要意义[17]。母乳具有极高的研究价值,大量研究证明母乳中以乳杆菌和双歧杆菌为代表的益生菌有助于婴儿消化系统和免疫功能的成熟,对其成长发育有不可替代的促进作用[18]。特别是在婴儿自身防御不成熟的脆弱时期,双歧杆菌可以通过黏附肠道上皮细胞,参与防御病原体[19]。通过研究表明,从母乳中分离出的部分菌株具有明显抑菌效果。双歧杆菌(1.7%)和乳杆菌(0.4%)占比小,仅代表母乳细菌的一小部分,但至关重要[20]。尹春媚[21]从10份母乳样品中筛选出22株乳酸菌,其中L.planturum R9具有较好的耐酸、耐胆盐以及黏附特性。GUAN等[22]从人母乳中分离到1株新型S.thermophilus FUA329,并且证明S.thermophilus FUA329是1株新型尿石素A产生菌,有望用于尿石素A的工业化生产。因此从母乳中分离出乳酸菌具有抗感染作用、益生作用。
众所周知,益生菌的摄入对肠道菌群及其代谢产物均具有免疫调节作用,其中双歧杆菌在免疫系统的成熟、结肠炎和肿瘤的预防中起着至关重要的作用。DEKKER等[23]研究发现,益生菌B.animalis subsp.lactis HN019具有明显的抗病毒效果,可以降低中国婴儿上呼吸道感染。SABATÉ等[24]研究发现,肠易激综合征患者通过30 d的B.longum 35624治疗,可降低其疾病的严重程度并改善生活质量,其中患有最严重肠易激综合征的患者效果明显。双歧杆菌是人体微生物群的重要组成部分,在消化、肠道免疫和癌症预防等方面发挥着重要作用,尤其对婴儿肠道菌群的发育与健康状况至关重要[25]。故而,本研究对新疆地区母乳中的双歧杆菌优良特性进行筛选,为益生菌菌种资源库提供广阔的开发和应用前景。
4 结论
本文利用传统纯培养方法对采新疆地区的6份母乳样品进行乳酸菌分离鉴定,共分离出69株乳酸菌,经16S rRNA基因序列测定,这69株菌被鉴定为乳酸菌于7个属11个种及亚种,其中S.salivarius为本次研究中该地区母乳的优势菌种。此外,本文从母乳来源的分离株筛选获得B.longum IMAU99727和B.animalis subsp.lactis IMAU99728两株潜在益生菌,具有良好的发酵特性、体外胃肠液耐受性及胆盐耐受性,有望作为新的母乳源益生菌进行其他益生特性研究和开发利用。
[1] 林雅敏. 母乳喂养与人工喂养对婴儿免疫、营养及智能发育的影响比较[J].中外医学研究, 2022, 20(25):141-144.
LIN Y M. Comparison of the effects of breastfeeding and artificial feeding on infants′ immunity, nutrition and intelligence development. Chinese and Foreign Medical Research, 2022, 20(25):141-144.
[2] 郭艳荣, 党娜, 苏馨, 等.埃塞俄比亚发酵食品中乳酸菌的分离鉴定[J].中国乳品工业, 2020, 48(5):15-19.
GUO Y R, DANG N, SU X, et al. Isolation and identification of lactic acid bacteria from fermented foods in Ethiopian. China Dairy Industry, 2020, 48(5):15-19.
[3] 张娜. 母乳婴儿源益生菌筛选及其干预炎症性肠病的免疫效应和相关机制研究[D].保定:河北农业大学, 2020.
ZHANG N. Screening of probiotics from breast-milk infants and its immune effect and related mechanism in intervening inflammatory bowel disease.Baoding: Hebei Agricultural University, 2020.
[4] KORDY K, GAUFIN T, MWANGI M, et al.Contributions to human breast milk microbiome and enteromammary transfer of Bifidobacterium breve[J].PLoS One, 2020, 15(1):e0219633.
[5]  UBIECH K,
UBIECH K, ![]() M.Lactobacillus bacteria in breast milk[J].Nutrients, 2020, 12(12):3783.
M.Lactobacillus bacteria in breast milk[J].Nutrients, 2020, 12(12):3783.
[6] DING M, ZHENG Y, LIU F, et al.Lactation time influences the composition of Bifidobacterium and Lactobacillus at species level in human breast milk[J].Beneficial Microbes, 2022, 13(4):319-330.
[7] YI E J, LEE J E, JO S Y,et al.Anti-hemolytic and antimicrobial effects against multidrug-resistant bacteria of Enterococcus faecalis isolated from human breast milk[J].Microbiology and Biotechnology Letters, 2021, 49(4):519-527.
[8] GU Q Z, YIN Y, YAN X J, et al.Encapsulation of multiple probiotics, synbiotics, or nutrabiotics for improved health effects:A review[J].Advances in Colloid and Interface Science, 2022,309: 102781.
[9] TRIPATHI M K, GIRI S K.Probiotic functional foods:Survival of probiotics during processing and storage[J].Journal of Functional Foods, 2014, 9:225-241.
[10] KAYAMA H, OKUMURA R, TAKEDA K.Interaction between the microbiota, epithelia, and immune cells in the intestine[J].Annual Review of Immunology, 2020, 38:23-48.
[11] WESTFALL S, LOMIS N, KAHOULI I, et al.Microbiome, probiotics and neurodegenerative diseases:Deciphering the gut brain axis[J].Cellular and Molecular Life Sciences, 2017, 74(20):3769-3787.
[12] DELBÉS C, ALI-MANDJEE L, MONTEL M C.Monitoring bacterial communities in raw milk and cheese by culture-dependent and -independent 16S rRNA gene-based analyses[J].Applied and Environmental Microbiology, 2007, 73(6):1882-1891.
[13] 张秋月, 黎谢飞, 曾小群, 等.产超氧化物歧化酶乳酸菌的筛选及发酵条件优化[J].中国食品学报, 2021, 21(10):143-150.
ZHANG Q Y, LI X F, ZENG X Q, et al.Screening of producing superoxide dismutase lactic acid bacteria and the optimization of fermentation conditions[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(10):143-150.
[14] LIU W J, CHEN M X, DUO L N, et al. Characterization of potentially probiotic lactic acid bacteria and bifidobacteria isolated from human colostrum. Journal of Dairy Science, 2020, 103(5):4013-4025.
[15] 如意. 酸马奶发酵剂菌株筛选及其发酵特性的研究[D].呼和浩特:内蒙古农业大学, 2021.
RU Y.Screening of yoghurt starter strains and study on their fermentation characteristics[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[16] 赵芳, 李艳琴, 李彬春.模拟人体胃肠道环境筛选益生乳杆菌[J].微生物学通报, 2016, 43(6):1396-1403.
ZHAO F, LI Y Q, LI B C.Screening of probiotic Lactobacillus in simulated gastrointestinal environment[J].Microbiology China, 2016, 43(6):1396-1403.
[17] VERHASSELT V.Neonatal tolerance under breastfeeding influence[J].Current Opinion in Immunology, 2010, 22(5):623-630.
[18] BODE L.Human milk oligosaccharides:Every baby needs a sugar mama[J].Glycobiology, 2012, 22(9):1147-1162.
[19] CHIU Y H, TSAI J J, LIN S L, et al.Characterisation of bifidobacteria with immunomodulatory properties isolated from human breast milk[J].Journal of Functional Foods, 2014, 7:700-708.
[20] ARBOLEYA S, RUAS-MADIEDO P, MARGOLLES A, et al.Characterization and in vitro properties of potentially probiotic Bifidobacterium strains isolated from breast-milk[J].International Journal of Food Microbiology, 2011, 149(1):28-36.
[21] 尹春媚. 母乳源乳酸菌的筛选、鉴定及其益生特性研究[D].长春:吉林农业大学, 2020.
YIN C M.Screening, identification and probiotic characteristics of lactic acid bacteria from breast milk[D].Changchun:Jilin Agricultural University, 2020.
[22] GUAN X F, XU Q X, ZHENG Y, et al.Screening and characterization of lactic acid bacterial strains that produce fermented milk and reduce cholesterol levels[J].Brazilian Journal of Microbiology, 2017, 48(4):730-739.
[23] DEKKER J, QUILTER M, QIAN H.Comparison of two probiotics in follow-on formula:Bifidobacterium animalis subsp.lactis HN019 reduced upper respiratory tract infections in Chinese infants[J].Beneficial Microbes, 2022, 13(4):341-353.
[24] SABATÉ J M, IGLICKI F.Effect of Bifidobacterium longum 35624 on disease severity and quality of life in patients with irritable bowel syndrome[J].World Journal of Gastroenterology, 2022, 28(7):732-744.
[25] 罗江钊. 双歧杆菌对婴儿肠道菌群的发育与健康状况至关重要[J].中国食品学报, 2022, 22(3):419-420.
LUO J Z. Bifidobacterium is very important to the development and health of infant intestinal flora. Journal of Chinese Institute of Food Science and Technology, 2022, 22(3):419-420.