佛手(Citrus medica L.var.sarcodactylis Swingle)是芸香科柑橘属植物,在我国广西、广东、四川、云南、福建、浙江等地均有栽培,根据产地的不同,可分为广佛手、川佛手和金佛手。佛手果实药食两用历史悠久,研究表明佛手具有保护心脏,降低血压血脂,镇痛,抗癌等多种药理作用[1]。佛手能为人类健康带来益处与其中含有丰富的类黄酮和香豆素等次生代谢产物密不可分。
类黄酮在植物生命活动中发挥着重要的作用,包括抵御病原体攻击,紫外线保护,调节生长素运输,充当抗氧化剂等[2]。香豆素也被认为是柑橘属植物重要的活性物质之一,对植物的生长发育过程有着重要的意义,例如调节根系微生物群落结构,延迟种子萌发[3]等。目前,对佛手果实类黄酮和香豆素类物质等次生代谢产物进行鉴定和分析检测的研究已有报道。吴学峰[4]从广佛手中鉴定出12种黄酮及黄酮苷和22种香豆素;胡瀚文等[5]从四川佛手中鉴定了16种黄酮类,17种香豆素类;ZHONG等[6]从广佛手中检验出21种香豆素。但是他们只对佛手中的生物化学成分进行了非靶向筛查和鉴定,并没有进行定量分析。陈燕霞[7]运用HPLC测定了广佛手中橙皮苷和柠檬内酯的含量;张璐等[8]使用HPLC测定了6个不同产地佛手中橙皮苷的含量;曹士政等[9]基于HPLC测定不同产地佛手中6种化学成分的含量,包括柠檬内酯、滨蒿内酯、橙皮苷、地奥司明、水合氧化前胡素和佛手苷内酯;左龙亚[10]使用HPLC定量了重庆佛手中圣草次苷,地奥司明,甜橙黄酮和桔皮素的含量。但是这些研究均使用HPLC对佛手的生物活性成分进行定量分析,所测成分较少或者洗脱时间偏长,基于质谱的定量分析方法很少。因类黄酮和香豆素类物质同分异构体较多,使用高效液相色谱-二级管阵列检测器法(high performance liquid chromatography with diode array detector,HPLC-DAD)不能有效地完成几十种物质且包含多种同分异构体同时分离检测的需求,而使用超高效液相色谱三重四级杆串联质谱法(ultra-high performance liquid chromatography coupled with triple-quadrupole mass spectrometry, UPLC-QqQ-MS/MS)中的多反应监测模式可有效避免因同分异构体带来的定性和定量不准确的问题,与传统的HPLC-DAD检测方法相比,具有更高的分离度、灵敏度和更快的分析速度。因此,本研究拟基于UPLC-QqQ-MS/MS技术,采用多反应监测模式对金华佛手和云南佛手中的36种类黄酮和23种香豆素类物质同时进行靶向筛查和定量分析,其中包含了13对同分异构体,相比于以往的研究,鉴定和定量的物质种类更多,这对评估佛手的营养功能品质以及后续的资源利用具有一定的借鉴意义。
1 材料与方法
1.1 材料与试剂
本研究中使用的金华佛手采自浙江省金华市金东区赤松镇,云南佛手采自云南省红河自治州蒙自市。于成熟期挑选大小适宜、无病虫害的优质果实作为实验材料。
甲醇(色谱纯),美国Sigma-Aldrich公司,甲酸(色谱纯),上海吉至生化科技有限公司。
实验中所使用的标准物质包括36种类黄酮和23种香豆素类物质如表1所示,购买自成都克洛玛生物科技有限公司和上海源叶生物科技有限公司,具体信息参照课题组已有的报道[11-12]。
表1 物质及方法相关信息
Table 1 Information of parameters related to compounds and method

中文名CAS号离子模式定性与定量离子对保留时间/min线性方程及相关系数线性范围/(μg/L)1.甜橙黄酮2306-27-6[M+H]+373.1-312.1, 373.1-343.36.70y=8.7e4x+1.5e5(r=0.995 2)1~1002.5-羟基-7,8,4'-三甲氧基黄酮57096-03-4[M+H]+329.1-268.1, 329.1-296.08.02y=1.6e5x+9.6e2 (r =0.993 8)0.02~1003.半齿泽兰素-5-甲醚21764-09-0[M+H]+359.0-297.0, 359.0-329.06.04y=4.1e5x+2.7e3 (r=0.993 7)0.01~1004.5-降甲基蜜桔黄素2174-59-6[M+H]+389.1-341.3, 389.1-359.17.97y=2.6e5x+1.2e4 (r=0.998 0)0.01~1005.蔓荆子黄素479-91-4[M+H]+375.1-359.1, 375.1-342.27.07y=7.7e4x+2.0e3 (r =0.992 5)0.02~1006.异橙黄酮17290-70-9[M+H]+373.2-358.1, 373.2-343.26.28y=1.2e6x+3.7e4(r =0.990 4)0.01~1007.4',5,7,8-四甲氧基黄酮6601-66-7[M+H]+343.2-312.9, 343.2-328.16.80y=1.3e5x+2.6e4 (r=0.992 1)0.05~1008.4',5,6,7-四甲氧基黄酮1168-42-9[M+H]+343.1-282.4, 343.1-313.47.16y=5.4e5x+4.1e4(r=0.992 0)0.05~1009.栀子黄素B2798-20-1[M+H]+359.3-310.9, 359.3-329.38.41y=5.0e5x+4.9e4 (r =0.996 8)0.2~100
续表1

中文名CAS号离子模式定性与定量离子对保留时间/min线性方程及相关系数线性范围/(μg/L)10.栎精-3,7,3',4'-四甲醚1245-15-4[M+H]+359.2-329.3, 359.2-344.28.36y=7.2e5x+7.0e3 (r=0.995 2)0.02~10011.3',4',5,5',6,7-六甲氧基黄酮29043-07-0[M+H]+403.2-373.0, 403.2-342.17.00y=1.6e5x-1.0e3 (r=0.991 3)0.01~10012.川陈皮素478-01-3[M+H]+403.2-342.1, 403.2-373.07.15y=1.2e6x+1.5e6(r=0.997 2)1~10013.根皮素60-82-2[M+H]+275.1-168.9, 275.1-107.15.74y=4.8e3x+9.9e2 (r=0.992 3)0.5~10014.根皮苷60-81-1[M-H]-435.1-167.3, 435.1-273.04.50y=1.1e4x-66.8 (r=0.994 6)0.02~10015.牡荆素鼠李糖苷64820-99-1[M+H]+579.1-433.2, 579.1-313.23.55y=5.1e3x+4.3e3 (r=0.993 0)1~10016.维采宁-223 666-13-9[M+H]+595.2-577.1, 595.2-457.32.89y=6.7e3x+6.7e2 (r=0.998 3)0.1~10017.香叶木素520-34-3[M+H]+301.1-258.0, 301.1-286.15.96y=1.7e5x+4.4e3 (r=0.991 1)0.02~10018.金合欢素480-44-4[M-H]-283.0-240.2, 283.0-268.07.07y=9.9e4x+4.1e3 (r=0.999 6)0.01~10019.地奥司明520-27-4[M-H]-607.2-284.1, 607.2-299.14.19y=1.4e4x+2.4e3 (r =0.995 2)0.5~10020.野漆树苷17306-46-6[M+H]+579.1-433.2, 579.1-270.94.13y=5.2e4x+6.2e3 (r =0.992 7)0.05~10021.水仙苷604-80-8[M+H]+625.2-317.1, 625.2-479.04.02y=1.1e4x+7.3e2 (r =0.995 3)0.1~10022.芹菜素520-36-5[M+H]+271.2-119, 271.2-153.25.79y=4.5e4x-9.8e2 (r =0.998 4)0.1~10023.牡荆素3681-93-4[M+H]+433.3-397.4, 433.3-313.23.71y=1.9e4x+7.9e2 (r =0.990 1)0.05~10024.异牡荆素29702-25-8[M-H]-431.0-340.9, 431.0-311.23.71y=6.3e3x-1.1e3 (r =0.995 0)0.5~10025.芦丁153-18-4[M-H]-609.1-271, 609.1-300.03.62y=5.8e3x+8.7e2 (r =0.996 6)0.5~5026.异槲皮苷21637-25-2[M-H]-463.0-270.9, 463.0-300.23.80y=6.1e3x+1.3e3 (r =0.996 3)0.5~10027.圣草次苷13463-28-0[M-H]-595.2-151.1, 595.2-459.23.60y=3.6e3x+2.4e3 (r =0.991 3)2~10028.甲基橙皮苷11013-97-1[M-H]-623.2-356.6, 623.2-315.24.73y=1.2e4x-15.8 (r =0.991 3)0.01~10029.橙皮素520-33-2[M-H]-301.0-150.9, 301.0-164.26.00y=1.5e4x+371.3 (r =0.995 0)0.01~10030.柚皮素480-41-1[M-H]-271.0-119.0, 271.0-151.05.79y=3.9e4x+1.4e3 (r =0.992 2)0.05~10031.香蜂草苷14259-47-3[M-H]-593.1-327.1, 593.1-285.15.08y=1.7e4x+2.8e3 (r =0.982 7)0.1~10032.枸橘苷14941-08-3[M-H]-593.1-285.1, 593.1-327.15.17y=1.0e3x+639.3 (r=0.996 9)1~10033.新橙皮苷13241-33-3[M-H]-609.1-286.0, 609.1-301.14.38y=1.1e4x+2.1e4 (r=0.990 9)2~10034.柚皮苷10236-47-2[M-H]-579.2-313.2, 579.2-150.94.16y=3.8e3x+7.3e3 (r=0.997 9)5~10035.芸香柚皮苷14259-46-2[M-H]-579.2-313.2, 579.2-150.94.00y=2.7e3x+4.2e3 (r=0.992 6)5~10036.橙皮苷520-26-3[M-H]-609.1-286.0, 609.1-301.14.25y=6.8e3x+4.4e4 (r=0.994 4)2~5037.滨蒿内酯120-08-1[M+H]+207.1-191.3, 207.1-151.05.06y=2.8e5x+1.2e5 (r=0.993 6)0.05~10038.柠檬内酯(5,7-二甲氧基香豆素)487-06-9[M+H]+207.1-191.9, 207.1-164.06.46y=7.9e4x+1.9e4 (r=0.999 0)0.2~5039.异橙皮内酯1088-17-1[M+H]+261.1-243.2, 261.1-189.16.80y=1.5e6x+1.4e5(r=0.991 2)0.05~10040.橙皮油素495-02-3[M+H]+299.1-137.2, 299.1-163.19.71y=2.4e5x+3.3e4(r=0.994 1)0.1~10041.伞形花内酯93-35-6[M+H]+163.2-118.9, 163.2-106.84.06y=3.3e4x+1.1e4 (r=0.991 5)0.5~10042.5-牻牛儿醇基-7-甲氧基香豆素7380-39-4[M+H]+329.3-137.2, 329.3-193.19.94y=1.5e6x+4.2e4(r=0.991 4)0.1~5043.东莨菪亭92-61-5[M+H]+193.1-164.9, 193.1-137.09.95y=1.7e5x+4.0e3 (r=0.994 8)0.1~10044.橙皮内酯23971-42-8[M+H]+261.1-189.1, 261.1-243.14.96y=4.5e5x+2.3e4 (r=0.995 3)0.02~245.蛇床子素484-12-8[M+H]+245.0-131.1, 245.0-189.08.29y=1.3e6x+1.9e4 (r=0.995 5)0.01~10046.香柑醇486-60-2[M+H]+203.1-131.1, 203.1-147.15.40y=2.5e5x+3.6e4 (r=0.990 1)0.5~5047.6',7'-环氧香柠檬亭206978-14-5[M+H]+355.1-202.8, 355.1-153.18.52y=1.2e5x+1.8e3 (r=0.991 0)0.01~10048.6',7'-二羟基香柠檬亭145414-76-2[M+Na]+395.2-225.1, 395.2-194.26.80y=7.9e3x-338.7 (r=0.992 8)0.5~10049.水合氧化前胡素2643-85-8[M+H]+305.5-149.2, 305.5-203.35.36y=5.9e4x+4.0e3 (r=0.995 1)0.02~10050.氧化前胡素737-52-0[M+H]+287.0-85, 287.0-203.37.15y=1.9e5x+2.8e3 (r=0.994 8)0.02~5051.异紫花前胡内酯13849-08-6[M+H]+247.0-175.3, 247.0-229.35.26y=2.5e5x+5.3e3 (r=0.995 5)0.05~10052.珊瑚菜素2543-94-4[M+H]+301.2-233.2, 301.2-245.38.22y=8.0e4x+4.2e3 (r=0.993 2)0.1~10053.8-氧甲基异欧前胡内酯 14348-22-2[M+H]+301.0-217.1, 301.0-233.28.22y=1.6e6x+1.1e4 (r=0.991 5)0.01~10054.佛手苷内酯484-20-8[M+H]+217.1-174.0, 217.1-202.06.61y=4.2e5x-7.1e3 (r=0.997 1)0.2~10055.花椒毒素298-81-7[M+H]+217.1-202.0, 217.1-174.06.23y=4.9e5x+3.5e3 (r=0.991 7)0.02~10056.欧前胡素482-44-0[M+H]+271.1-147.1, 271.1-203.17.96y=7.1e5x+2.0e3 (r=0.993 2)0.02~10057.异欧前胡素482-45-1[M+H]+271.1-203.1, 271.1-147.18.45y=1.2e5x+4.1e3 (r=0.996 2)0.05~10058.补骨脂素66-97-7[M+H]+187.0-115.2, 187.0-131.16.05y=2.3e5x+850.1 (r=0.993 6) 0.01~10059.异补骨脂素523-50-2[M+H]+187.0-131.1, 187.0-115.26.20y=1.6e4x+5.8e3 (r=0.992 9)60.5~100
1.2 次生代谢产物的提取
在邢天天[13]的方法基础上进行改进,大致如下:取金华佛手和云南佛手将其切成细条状,分别放入烘盘标记后置于烘箱中烘干48 h,经打粉机粉碎后,用封口袋收集保存于常温干燥条件下备用。精确称取样品粉末0.5 g,每个样品设置3个生物重复,分别置于10 mL 离心管中,加入7 mL甲醇摇匀,室温条件下300 W超声30 min,取上清液于25 mL棕色容量瓶中,残渣加7 mL甲醇再提取,重复上述操作2次。合并以上3次提取的上清液并用甲醇定容至25 mL,储存于4 ℃ 冰箱。取样品提取液2 mL于2 mL圆底连盖离心管中作为原液,再将每种样品提取液及其生物重复液用无水甲醇分别稀释10倍、100倍、1 000倍、10 000倍和100 000倍,稀释液均取1 mL于2 mL圆底连盖离心管中。最后使用0.22 μm亲水性聚四氟乙烯(poly tetra fluoroethylene,PTFE)针式滤器过滤至进样小瓶中备用。
1.3 UPLC-QqQ-MS/MS条件
UPLC使用的是岛津的Nexera X2 UPLC系统(日本),色谱柱为ACQUITY UPLC HSS T3(2.1 mm×100 mm, 1.8 μm, Waters公司),色谱柱温度为40 ℃,流速为0.3 mL/min,进样量为1.0 μL,样品室温度为15 ℃,流动相为含有0.10%(体积分数)甲酸的纯水(A)和乙腈(B),洗脱程序与GUO等[11]的报道一致。
三重四极杆串联质谱使用的是SCIEX QTrap®6500+MS/MS系统(美国)。采用电喷雾离子源(turbo spray),正离子模式(ESI+)和负离子模式(ESI-),采集模式为程序多反应监测模式,参数设置参照GUO等[11]的研究。
将混标稀释为0.01、0.02、0.05、0.1、0.2、0.5、1.0、2.0、10、20、25、50、100 μg/L的一系列溶液,13个连续稀释的混合标准溶液用于59种次生代谢产物的线性评估。
2 结果与分析
2.1 佛手果实中类黄酮和香豆素类物质的靶向筛查
使用实验室已建立好的UPLC-QqQ-MS/MS靶向筛查方法,对佛手样品中的36种类黄酮和23种香豆素类物质进行了靶向筛查,59种目标化合物中共存在13对同分异构体,分别是橙皮苷和新橙皮苷、香蜂草苷和枸橘苷、4′,5,7,8-四甲氧基黄酮和4′,5,6,7-四甲氧基黄酮、牡荆素和异牡荆素、芸香柚皮苷和柚皮苷、野漆树苷和牡荆素鼠李糖苷、3′,4′,5,5′,6,7-六甲氧基黄酮和川陈皮素、甜橙黄酮和异橙黄酮、欧前胡素和异欧前胡素、滨蒿内酯和柠檬内酯、佛手苷内酯和花椒毒素、补骨脂素和异补骨脂素、橙皮内酯和异橙皮内酯。为了更准确地实现靶向筛查定性,使用离子对和保留时间2项指标进行确证以更好地区分同分异构体。表1显示了用于筛查的59种目标物标准品对应的离子对和保留时间,使用至少5个标准品的数据对每种化合物进行线性拟合,结果表明,59种化合物的线性相关系数均大于0.99,峰面积与化合物浓度之间具有良好的线性关系。59种目标物的标准品混合物总离子流图和提取离子流图如图1所示。大部分类黄酮和香豆素类物质在正离子模式下电离信号较强,因此正离子模式下出峰较多(图1-B),负离子模式下出峰较少(图1-C)。使用该方法对云南佛手和金华佛手果实的甲醇提取物进行了靶向筛查(图1-D和图1-E)。结果显示,2个品种共筛查出36种类黄酮和21种香豆素,对其中的34种类黄酮和21香豆素进行了准确定量(表2,表3),各物质的定量离子对、线性方程、相关系数和线性范围如表1所示。枸橘苷和川陈皮素有检出,但无法定量,花椒毒素和异补骨脂素无检出。栀子黄素B在云南佛手中的含量低于0.1 μg/g,在金华佛手中有检出,但不能准确定量。其余的33种类黄酮和21种香豆素在2个品种中均能被准确定量,表明2种佛手的次生代谢产物在种类上基本一致。这是目前对佛手果实所含次生代谢产物进行定量分析报道中涉及物质数量最多的研究。

A-混标总离子流色谱图;B-混标正离子模式下提取离子流色谱图;C-混标负离子模式下提取离子流色谱图;D-云南佛手总离子流色谱图;E-金华佛手总离子流色谱图
图1 UPLC-QqQ-MS/MS色谱图
Fig.1 UPLC-QqQ-MS/MS chromatograms
注:图1-B和图1-C中的序号对应物质与表1中一致。
表2 两种佛手中类黄酮含量
Table 2 Flavonoid contents in two kinds of fingered citrons
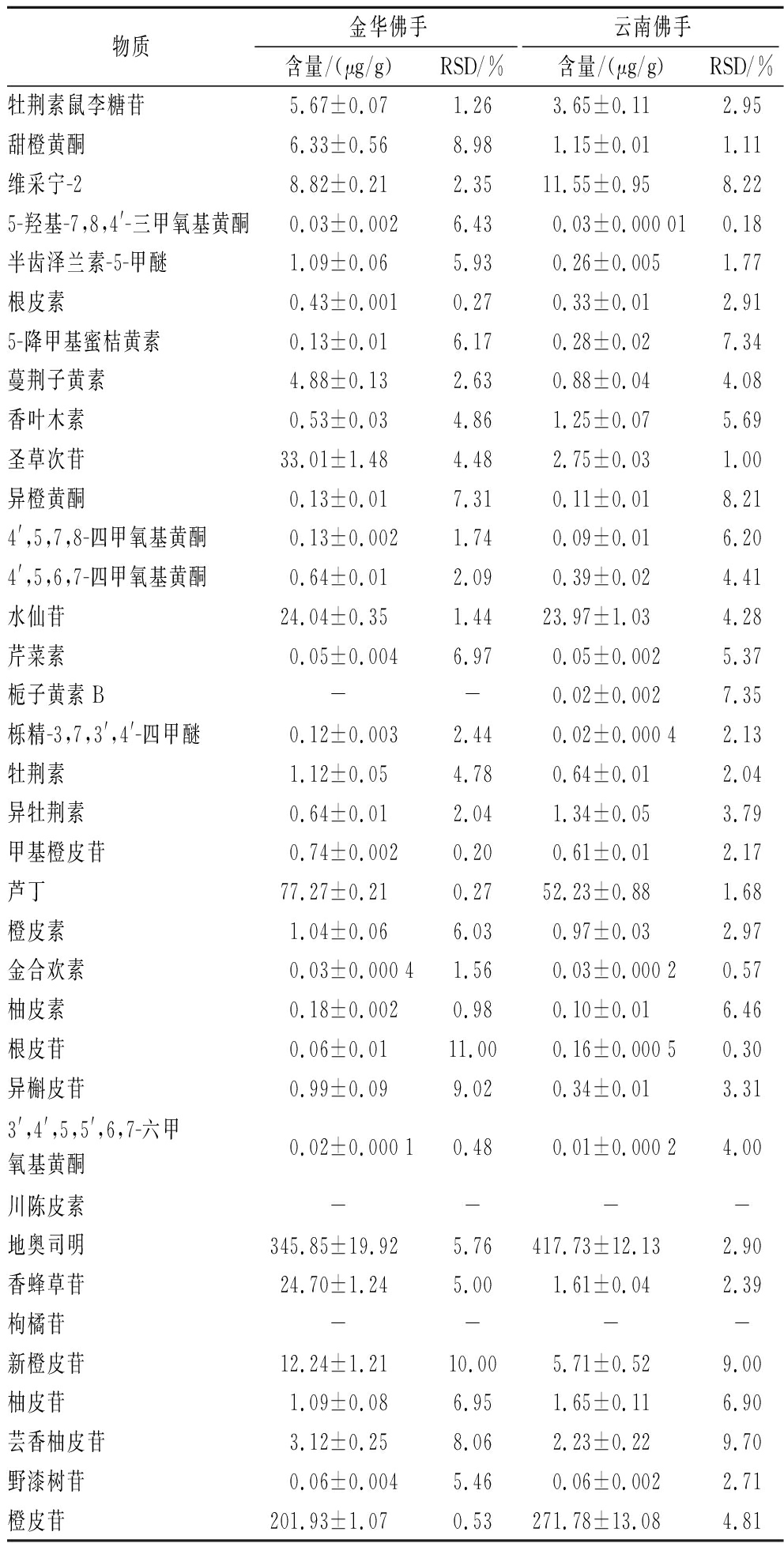
物质金华佛手云南佛手含量/(μg/g)RSD/%含量/(μg/g)RSD/%牡荆素鼠李糖苷5.67±0.071.263.65±0.11 2.95甜橙黄酮6.33±0.568.981.15±0.011.11维采宁-28.82±0.212.3511.55±0.958.225-羟基-7,8,4'-三甲氧基黄酮0.03±0.0026.430.03±0.000 010.18半齿泽兰素-5-甲醚1.09±0.065.930.26±0.0051.77根皮素0.43±0.0010.270.33±0.012.915-降甲基蜜桔黄素0.13±0.016.170.28±0.027.34蔓荆子黄素4.88±0.132.630.88±0.044.08香叶木素0.53±0.034.861.25±0.075.69圣草次苷33.01±1.484.482.75±0.031.00异橙黄酮0.13±0.017.310.11±0.018.214',5,7,8-四甲氧基黄酮0.13±0.0021.740.09±0.016.204',5,6,7-四甲氧基黄酮0.64±0.012.090.39±0.024.41水仙苷24.04±0.351.4423.97±1.034.28芹菜素0.05±0.0046.970.05±0.0025.37栀子黄素B--0.02±0.0027.35栎精-3,7,3',4'-四甲醚0.12±0.0032.440.02±0.000 42.13牡荆素1.12±0.054.780.64±0.012.04异牡荆素0.64±0.012.041.34±0.053.79甲基橙皮苷0.74±0.0020.200.61±0.012.17芦丁77.27±0.210.2752.23±0.881.68橙皮素1.04±0.066.030.97±0.032.97金合欢素0.03±0.000 41.560.03±0.000 20.57柚皮素0.18±0.0020.980.10±0.016.46根皮苷0.06±0.0111.000.16±0.000 50.30异槲皮苷0.99±0.099.020.34±0.013.313',4',5,5',6,7-六甲氧基黄酮0.02±0.000 10.480.01±0.000 24.00川陈皮素----地奥司明345.85±19.925.76417.73±12.132.90香蜂草苷24.70±1.245.001.61±0.042.39枸橘苷----新橙皮苷12.24±1.2110.005.71±0.529.00柚皮苷1.09±0.086.951.65±0.116.90芸香柚皮苷3.12±0.258.062.23±0.229.70野漆树苷0.06±0.0045.460.06±0.0022.71橙皮苷201.93±1.070.53271.78±13.084.81
注:-表示有检出但无法定量。
表3 2种佛手中香豆素含量
Table 3 Contents of coumarins in two kinds of fingered citrons

物质金华佛手云南佛手含量/(μg/g)RSD/%含量/(μg/g)RSD/%滨蒿内酯5.96±0.020.382.79±0.103.46柠檬内酯(5,7-二甲氧基香豆素)946.17±10.781.14561.00±46.428.28异橙皮内酯0.05±0.0023.250.35±0.046.92香柑醇1.07±0.043.362.05±0.094.52橙皮油素0.32±0.027.200.40±0.0717.896',7'-环氧香柠檬亭0.02±0.0012.580.03±0.0039.436',7'-二羟基香柠檬亭0.18±0.0031.580.23±0.027.71伞形花内酯0.77±0.067.580.17±0.0052.655-牻牛儿醇基-7-甲氧基香豆素0.17±0.017.550.20±0.029.83东莨菪亭0.18±0.029.150.17±0.016.44橙皮内酯0.06±0.0034.990.16±0.000 30.20水合氧化前胡素6.33±0.223.5412.70±0.816.40氧化前胡素91.90±1.481.6178.38±1.081.37异紫花前胡内酯0.17±0.015.710.12±0.0054.01珊瑚菜素18.58±0.201.102.49±0.031.07蛇床子素0.09±0.0011.680.09±0.019.218-氧甲基异欧前胡内酯19.36±0.110.573.65±0.246.44佛手苷内酯2.14±0.104.564.34±0.378.49花椒毒素////欧前胡素1.79±0.010.420.32±0.027.62异欧前胡素6.57±0.172.656.30±0.375.80补骨脂素0.84±0.044.451.03±0.076.57异补骨脂素////
注:/ 表示无检出。
吴学峰[4]对广佛手的活性物质进行了分析鉴定,其中鉴定出的圣草次苷、芦丁、香叶木素、地奥司明、橙皮苷和橙皮素等6种类黄酮以及东莨菪亭、滨蒿内酯、柠檬内酯、水合氧化前胡素、氧化前胡素、伞形花内酯、佛手苷内酯、欧前胡素、异欧前胡素和珊瑚菜素等10种香豆素类物质,本研究在云南佛手和金华佛手果实中也有检出。胡瀚文等[5]曾报道四川佛手中含有维采宁-2、芦丁、牡荆素、水仙苷、野漆树苷、柚皮素、香叶木素、地奥司明、橙皮苷、橙皮素、甲基橙皮苷、川陈皮素等12种类黄酮和伞形花内酯、滨蒿内酯、柠檬内酯、佛手苷内酯、欧前胡素、珊瑚菜素、异欧前胡素、香柑醇、东莨菪亭等9种香豆素,本研究发现云南佛手和金华佛手果实中同样含有以上类黄酮和香豆素类物质,除此之外,本研究靶向筛查鉴定出的类黄酮和香豆素类物质的数量多于相关文献中已有的报道,而且有14种类黄酮和4种香豆素是首次在佛手中检出,分别是牡荆素鼠李糖苷,5-羟基-7,8,4′-三甲氧基黄酮、半齿泽兰素-5-甲醚、根皮素、根皮苷、蔓荆子黄素、异橙黄酮、4′,5,7,8-四甲氧基黄酮、4′,5,6,7-四甲氧基黄酮、芹菜素、栀子黄素B、栎精-3,7,3′,4′-四甲醚、金合欢素、3′,4′,5,5′,6,7-六甲氧基黄酮以及6′,7′-环氧香柠檬亭、6′,7′-二羟基香柠檬亭、5-牻牛儿醇基-7-甲氧基香豆素和异紫花前胡内酯。同时,本研究对34种类黄酮和21种香豆素进行了准确定量。
2.2 佛手果实中类黄酮组分与含量分析
本研究一共检出并准确定量了34种类黄酮,包括6种黄酮、9种黄烷酮、6种黄酮醇、2种二氢查尔酮和11种多甲氧基黄酮。金华佛手和云南佛手总类黄酮含量分别为(757.11±27.12) μg/g和(803.98±29.41) μg/g。地奥司明是2种佛手中含量最高的类黄酮,在金华佛手中含量为(345.85±19.92) μg/g,在云南佛手中含量为(417.73±12.13) μg/g,橙皮苷次之,含量均在200 μg/g以上(表2,图2-A)。2种佛手中定量的类黄酮平均含量高于10 μg/g的物质从高到低依次为地奥司明、橙皮苷、芦丁、水仙苷。金华佛手中圣草次苷和香蜂草苷的含量也高于10 μg/g,分别为(33.01±1.48) μg/g和(24.70±1.24) μg/g(图2-B)。而且,金华佛手中新橙皮苷,香蜂草苷、圣草次苷、芦丁以及水仙苷的含量均高于云南佛手,而云南佛手中维采宁-2的含量略高于金华佛手。除甜橙黄酮外,其余的多甲氧基黄酮在云南佛手中的含量均不足1 μg/g(表2)。

A-高含量的3种类黄酮的含量比较;B-其余31种类黄酮的含量比较
图2 类黄酮在2种佛手果实中的含量比较
Fig.2 Content comparison of flavonoids in two kinds of fingered citrons
从类黄酮的种类来看,大部分柑橘以黄烷酮为主[14]。比如甜橙中的橙皮苷[15],柚中的柚皮苷[16]含量都极为丰富。但在本研究中,佛手与橙、宽皮柑橘等的类黄酮组成具有较大差异。2种佛手的类黄酮中黄酮总含量占比最高,金华佛手和云南佛手占比分别高达47.68%和54.02%,含量最高的黄酮是地奥司明。黄烷酮也是2种佛手重要的类黄酮物质,占比在30%以上,但柚皮苷,柚皮素,芸香柚皮苷等柑橘属含量较高的黄烷酮在佛手类黄酮中占比都不足1%。值得注意的是,多甲氧基黄酮是柑橘属特有的一类类黄酮物质,尤其在果皮中含量较高,川陈皮素几乎是所有柑橘中含量最高的多甲氧基黄酮[17]。但在本研究中,金华佛手多甲氧基黄酮含量占类黄酮总含量的比例仅为1.78%,而云南佛手不足1%,且2种佛手中的川陈皮素含量很低。
CHU等[18]测定广佛手中地奥司明含量为(462.3±7.7) μg/g,张璐等[8]测得金华佛手橙皮苷含量为250 μg/g,这与本研究结果基本一致。曹士政等[9]也在云南佛手和金华佛手中检出了地奥司明和橙皮苷,但与本研究在含量上具有一定差异,这可能与样品采收时间和检测方法不同有关。此外,与已有文献不同的是,本研究首次报道云南佛手和金华佛手中含有牡荆素鼠李糖苷、5-羟基-7,8,4′-三甲氧基黄酮、半齿泽兰素-5-甲醚、根皮素、根皮苷、蔓荆子黄素、异橙黄酮、4′,5,7,8-四甲氧基黄酮、4′,5,6,7-四甲氧基黄酮、芹菜素、栀子黄素B、栎精-3,7,3′,4′-四甲醚、金合欢素、3′,4′,5,5′,6,7-六甲氧基黄酮,并对这些类黄酮进行了准确定量。这些物质中在金华佛手和云南佛手中含量最高的是牡荆素鼠李糖苷,分别为(5.67±0.07) μg/g和(3.65±0.11) μg/g,仅次于维采宁-2,此外在金华佛手中蔓荆子黄素和半齿泽兰素-5-甲醚的含量均高于1 μg/g,分别为(4.88±0.13) μg/g和(1.09±0.06) μg/g。
2.3 佛手果实中香豆素类物质组分与含量分析
本研究中一共检出并准确定量了21种香豆素,包括12种呋喃香豆素和9种简单香豆素(表3)。金华佛手和云南佛手总香豆素含量分别为(1 102.72±13.29) μg/g和(676.97±49.77) μg/g。金华佛手和云南佛手中的香豆素以简单香豆素为主,占比分别高达86.49%和83.51%,柠檬内酯是2种佛手中含量最高的简单香豆素,分别为(946.17±10.78) μg/g和(561.00±46.42) μg/g(图3-A),滨蒿内酯次之,含量分别为(5.96±0.02) μg/g和(2.79±0.10) μg/g,其他的简单香豆素在2种佛手的含量均不足1 μg/g。呋喃香豆素仅占约10%,氧化前胡素是金华佛手和云南佛手中含量最高的呋喃香豆素,也是含量第二高的香豆素类物质(图3-A),分别为(91.9±1.48) μg/g和(78.38±1.08) μg/g。除此之外,金华佛手中含有较多的8-氧甲基异欧前胡内酯和珊瑚菜素,二者的含量均在云南佛手的6倍以上,而云南佛手含有较高含量的水合氧化前胡素(图3-B)。蛇床子素和 6′,7′-环氧香柠檬亭在2种佛手中的含量都极低,花椒毒素和异补骨脂素在2种佛手中均未检出。

A-高含量的2种香豆素类物质的含量比较;B-其余19种香豆素类物质的含量比较
图3 香豆素类物质在2种佛手果实中的含量比较
Fig.3 Content comparison of coumarins in two kinds of fingered citrons
刘盼等[19]检测到柠檬内酯在金华佛手和云南佛手干燥果实甲醇提取液中的含量分别为730 μg/g、510 μg/g,与这本研究结果基本一致,魏莹等[20]用同样的提取方法测得5种广佛手柠檬内酯含量为1 000 μg/g左右,结合以往研究,相比于金华佛手和广佛手,云南佛手中柠檬内酯含量较低。值得注意的是,CHU等[18]使用HPLC方法检测到广佛手滨蒿内酯的含量为(100.5±0.2) μg/g,吴春蓉[21]使用HPLC测得滨蒿内酯在四川佛手含量为364.83 μg/g,广佛手含量为179.89 μg/g,崔广林等[22]使用HPLC法测得48种川佛手的滨蒿内酯和东莨菪亭含量基本在100 μg/g以上,而本研究使用UPLC-QqQ-MS/MS方法测得2种佛手的滨蒿内酯和东莨菪亭含量均低于10 μg/g,检测方法以及样品来源和前处理的差异均会造成最终定量结果的差异。此外,本研究首次发现云南佛手和金华佛手中含有6′,7′-环氧香柠檬亭、6′,7′-二羟基香柠檬亭、5-牻牛儿醇基-7-甲氧基香豆素和异紫花前胡内酯,并对这些香豆素类物质进行了准确定量,这4种物质在2种佛手的含量均不足1 μg/g。
2.4 佛手果实中类黄酮和香豆素类物质含量的比较
2个产地的佛手所测香豆素总含量和类黄酮总含量有所差别,金华佛手的香豆素总含量高于类黄酮,云南佛手中总香豆素略低于总黄酮的含量,造成这种差异的原因是云南佛手含有较高的橙皮苷和地奥司明,而柠檬内酯含量远低于金华佛手。就单个物质而言,柠檬内酯是2种佛手主要的香豆素,地奥司明和橙皮苷是主要的类黄酮,2个产地的佛手中柠檬内酯的含量都高于地奥司明或橙皮苷(图4)。结合以往的研究,CHU等[18]检测到广佛手中柠檬内酯、地奥司明和橙皮苷的含量分别为(1 206.6±11.7) μg/g、(462.3±7.7) μg/g和(243.4±4.4) μg/g,崔广林等[22]对48个产地的川佛手的8种成分进行含量测定,除少数产地的川佛手中橙皮苷含量略高于柠檬内酯外,川佛手中柠檬内酯的含量远高于橙皮苷,这与本研究结果一致。而目前对其他柑橘类果实次生代谢产物的研究表明,柠檬中含量最高的类黄酮和香豆素分别是橙皮苷和柠檬内酯,但橙皮苷的含量远高于柠檬内酯[23],酸橙果皮和果实中均含有类黄酮和香豆素,且均以黄烷酮类成分即柚皮苷、新橙皮苷的含量较高[24],金柑中类黄酮占总物质含量的80.70%~97.16%[25]。与其他柑橘类果实不同的是,佛手中含量最高的是香豆素而不是类黄酮。
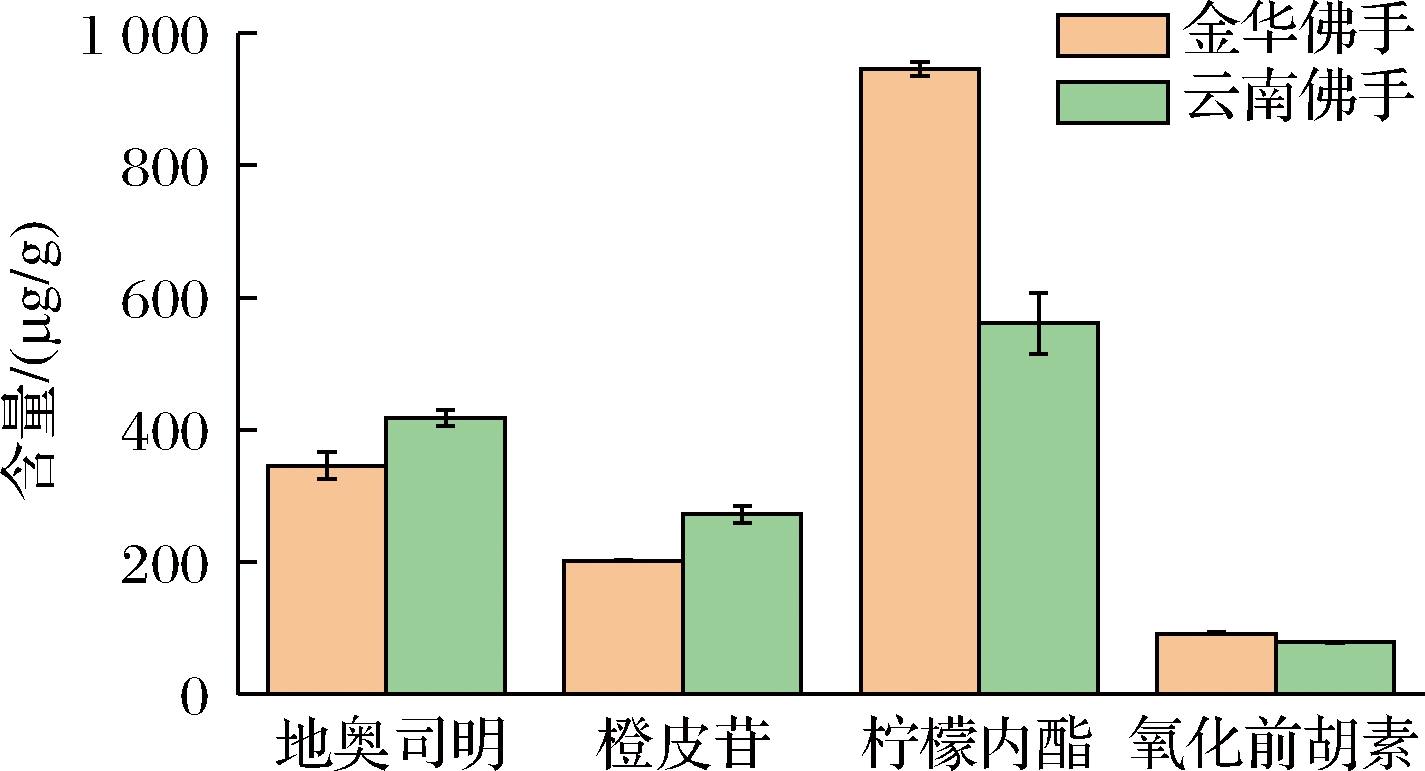
图4 两种佛手中含量最高的香豆素和类黄酮的比较
Fig.4 Comparison of coumarins and flavonoids with higher contents in two kinds of fingered citrons
3 结论
本研究采用UPLC-QqQ-MS/MS对金华佛手和云南佛手的类黄酮和香豆素类物质进行了靶向筛查和定量分析,得到了34种类黄酮和21种香豆素类物质的含量。结果表明,2种佛手中类黄酮种类均以黄酮为主,地奥司明是金华佛手和云南佛手含量最高的类黄酮,橙皮苷次之,2种佛手中香豆素种类均以简单香豆素为主,柠檬内酯是2种佛手中含量最高的香豆素类物质,氧化前胡素次之。此外,2个产地的佛手中柠檬内酯的含量都高于地奥司明。本研究结果可以为更好地发掘应用佛手资源、评价佛手的品质提供数据支持。
[1] CHHIKARA N, KOUR R, JAGLAN S, et al.Citrus medica:Nutritional, phytochemical composition and health benefits-a review[J].Food &Function, 2018, 9(4):1978-1992.
[2] HASSAN S, MATHESIUS U.The role of flavonoids in root-rhizosphere signalling:Opportunities and challenges for improving plant-microbe interactions[J].Journal of Experimental Botany, 2012, 63(9):3429-3444.
[3] CHEN B X, PENG Y X, GAO J D, et al.Coumarin-induced delay of rice seed germination is mediated by suppression of abscisic acid catabolism and reactive oxygen species production[J].Frontiers in Plant Science, 2019, 10: 828.
[4] 吴学峰. 广佛手炮制前后指纹图谱建立及成分差异分析[D].广州:广东工业大学, 2021.
WU X F.Study on Fingerprint and the chemical composition diversity before and after processing of fingered citron[D].Guangzhou:Guangdong University of Technology, 2021.
[5] 胡瀚文, 赵永艳, 杨天龙, 等.基于UPLC-Q-Orbitrap HRMS的川佛手化学成分分析[J].中国实验方剂学杂志,2020, 26(7):148-155.
HU H W, ZHAO Y Y, YANG T L, et al.Analysis and identification of chemical constituents of Fructus Citri sarcodactylis by UPLC-Q -Orbitrap HRMS[J].Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26 (7):148-155.
[6] ZHONG Y M, FENG Y F, WU X, et al.Rapid identification of coumarins from Fructus Citri Sarcodactylis by UPLC/Q-TOF-MS[J].Natural Product Research, 2015, 29(1):53-58.
[7] 陈燕霞. 岭南特色饮片制佛手生产工艺优化及质量标准研究[D].广州:广州中医药大学.2014.
CHEN Y X.Study on the production process optimization and the quality standard of Fructus Citri sarcodactylis steaming process[D].Guangzhou:Guangzhou University of Chinese Medicine, 2014.
[8] 张璐, 田静, 尹萌, 等.基于数学模型分析不同产地佛手的化学成分差异性[J].药物分析杂志.2019, 39 (1):122-126.
ZHANG L, TIAN J, YIN M, et al.Analysis of chemical diversity of Fructus Citri sarcodactylis from different habitats based on mathematical model[J].Chinese Journal of Pharmaceutical Analysis, 2019, 39(1):122-126.
[9] 曹士政, 赵登高, 马燕燕, 等.一测多评法同时测定不同产地佛手中6种化学成分的含量[J].中南药学, 2022, 20(5):1167-1172.
CAO S Z, ZHAO D G, MA Y Y, et al.Simultaneous determination of 6 chemical components in Citrus medica from different areas by quantitative analysis of multi-components with single marker method[J].Central South Pharmacy, 2022, 20(5):1167-1172.
[10] 左龙亚. 柑橘亚属植物果皮多酚类物质提取及其抗氧化、抑菌活性检测[D].重庆:西南大学, 2018.
ZUO L Y.Polyphenols extraction and antioxidant, antifungal activities test of subgenus Citrus[D].Chongqing:Southwest University, 2018.
[11] GUO P M, PANG W H, ZHAO X J, et al.A rapid UPLC-QqQ-MS/MS method for targeted screening and quantitative analysis of secondary metabolites in satsuma mandarin[J].European Food Research and Technology, 2021, 247(7):1725-1736.
[12] ZHAO X J, GUO P M, PANG W H, et al.A rapid UHPLC-QqQ-MS/MS method for the simultaneous qualitation and quantitation of coumarins, furocoumarins, flavonoids, phenolic acids in pummelo fruits[J].Food Chemistry, 2020, 325:126835.
[13] 邢天天. 基于UPLC-QTOf-MS的宽皮柑橘和橙果皮化学成分及代谢组学研究[D].重庆:西南大学, 2018.
XING T T.Study on chemical compositions and metabonomics of the peels of mandarins and oranges by UPLC-Q-TOF-MS[D].Chongqing:Southwest University, 2018.
[14] 刘贤青, 涂虹, 王守创, 等.不同类型柑橘果实汁胞中类黄酮的液相色谱质谱联用分析[J].植物生理学报, 2016, 52(5):762-770.
LIU X Q, TU H, WANG S C, et al.Flavonoid composition of Citrus juice sacs determined by high-performance liquid chromatography coupled with tandem electrospray ionization mass spectrometry[J].Plant Physiology Communications, 2016, 52 (5):762-770.
[15] CHEN J J, ZHANG H Y, PANG Y B, et al.Comparative study of flavonoid production in lycopene-accumulated and blonde-flesh sweet oranges (Citrus sinensis) during fruit development[J].Food Chemistry, 2015, 184:238-246.
[16] 聂嘉琳, 赵希娟.六种柚果实不同部位次生代谢产物的靶向筛查及其差异研究[J].陕西师范大学学报(自然科学版), 2021, 49(3):105-116.
NIE J L, ZHAO X J.Targeted screening of secondary metabolites in different parts of six pommelo (Citrus grandis (L.) Osbeck) fruits and their difference investigation[J].Journal of Shaanxi Normal University (Natural Science Edition), 2021, 49(3):105-116.
[17] 韩丹丹, 毕金峰, 周沫, 等.柑、橘、橙果皮中天然羟基化多甲氧基黄酮的转化率研究[J].中国食品学报, 2018, 18(5):294-301.
HAN D D, BI J F, ZHOU M, et al.Studies on the conversion rates of natural hydroxyl polymethoxyflavones in tangerine, mandarine and orange peels[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(5):294-301.
[18] CHU J, LI S L, YIN Z Q, et al.Simultaneous quantification of coumarins, flavonoids and limonoids in Fructus Citri sarcodactylis by high performance liquid chromatography coupled with diode array detector[J].Journal of Pharmaceutical and Biomedical Analysis, 2012, 66:170-175.
[19] 刘盼, 雷素娟, 何兵, 等.合江佛手两种香豆素含量测定及指纹图谱研究[J].食品研究与开发, 2019, 40(3):184-189.
LIU P, LEI S J, HE B, et al.Determination of two coumarins and fingerprint of Fructus Citri sarcodactylis from Hejiang[J].Food Research and Development, 2019, 40(3):184-189.
[20] 魏莹, 陈珍, 杨兰, 等.HPLC法同时测定不同产地佛手中5个成分的含量[J].药物分析杂志, 2017, 37(12):2180-2184.
WEI Y, CHEN Z, YANG L, et al.Simultaneous determination of 5 components in Fructus Citri sarcodactylis from different habitats by HPLC[J].Chinese Journal of Pharmaceutical Analysis, 2017, 37(12):2180-2184.
[21] 吴春蓉. 佛手物质基础及质量评价研究[D].广州:广东药科大学, 2018.
WU C R.Study on the material base and quality evaluation of Fructus Citri sarcodactylis[D].Guangzhou:Guangdong Pharmaceutical University, 2018.
[22] 崔广林, 李隆云, 谭均, 等.不同产地川佛手中8种化学成分的分析与评价[J].天然产物研究与开发, 2019, 31(2):250-260;324.
CUI G L, LI L Y, TAN J, et al.Analysis and evaluation of eight active ingredients in Fructus Citri sarcodactylis from different regions[J].Natural Product Research and Development, 2019, 31(2):250-260;324.
[23] 赵希娟, 庞雯辉, 谭涛, 等.基于UPLC-Q-TOF/HRMS技术结合SWATH采集方法同时测定柠檬果实中26种生物活性成分的含量[J].食品与发酵工业, 2022, 48(23): 306-314.
ZHAO X J, PANG W H, TAN T, et al.Simultaneous determination of 26 bioactive components in lemon fruits based on UPLC-Q-TOF/HRMS and SWATH acquisition mode[J].Food and Fermentation Industries, 2022, 48(23): 306-314.
[24] PETERSON J J, DWYER J T, BEECHER G R, et al.Flavanones in oranges, tangerines (mandarins), tangors, and tangelos:A compilation and review of the data from the analytical literature[J].Journal of Food Composition and Analysis, 2006, 19:S66-S73.
[25] 尹会平, 王夜梅, 李江南, 等.不同生长阶段金柑果实中类黄酮等活性物质含量差异分析[J/OL].食品与发酵工业, 2022.https://doi.org/10.13995/j.cnki.11-1802/ts.032767.
YIN H P, WANG Y M, LI J N, et al.Analysis of the difference in the content of flavonoids and other active substances in the fruits of Kumquat at different growth stages[J/OL].Food and Fermentation Industries, 2022.https://doi.org/10.13995/j.cnki.11-1802/ts.032767.