百香果属于西番莲科(Passiflora caerulea L.)西番莲属(Passiflora)多年生常绿藤本植物,是一种作为果汁生产原料和鲜果消费都具有相当重要的经济意义的作物[1]。因其富含维生素、酚类物质、抗氧化剂、氨基酸等对人体有益的物质[2-3],现已应用于食品、制药等行业[4-7]。由于其丰富的香气和营养,百香果被称为“果汁之王”。不同产地的黄金百香果因地理位置、环境条件和生产方式不同,具有不同的风味特征。因此探索不同产地黄金百香果的挥发性差异代谢物质具有重要意义。
百香果具有特殊的风味和香气,可以散发出菠萝、草莓、柠檬和荔枝等水果的香味[8]。独特的香味常常由不同挥发性物质之间的平衡导致[9-11]。目前,已对百香果挥发性物质进行一定的研究,主要包括酯类、醇类、酮类、醛类、烯类、烷类、酸类及其他类,其中酯类物质为其独特香味的主要贡献者[12],主要包括丁酸乙酯、己酸乙酯、乙酸乙酯、丁酸己酯等[13]。气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)在百香果香气物质分析检测中应用很广泛,方灵等[14]研究表明,黄金百香果不同发育阶段果皮间、果肉间挥发性成分存在差异性,正己酸乙酯、乙酸己酯、(E)-Β-罗勒烯及乙酸叶醇酯等可判别黄金百香果肉是否完全成熟。但同一品种不同产地挥发性代谢物质的差异分析研究较少,金润楠等[15]对浙江、湖北、湖南3个产地温州蜜柑果汁中的挥发性代谢物质差异进行分析比较,结果表明产地对挥发性代谢物质具有显著影响。刘慧宇等[16]利用气相色谱-质谱联用技术分析信丰、兴山和秭归3个产区赣南早脐橙果实中挥发性成分的差异性,结果显示挥发性代谢物质是能够区分不同产地的生物标志物。黄金百香果因其味甜,风味奇特,在贵州、福建、广西等地大面积种植,但对不同产地黄金百香果挥发性物质代谢组学的研究未见报道。
本研究采用固相微萃取与气相色谱-质谱联用技术对贵州、福建和广西等3个不同产地的黄金百香果进行挥发性代谢物质比较分析,筛选不同产地黄金百香果的差异代谢物,解析不同产地黄金百香果的品质差异,初步为黄金百香果的产地鉴别及深加工提供理论参考。
1 材料与方法
1.1 材料与试剂
黄金百香果(坐果后75 d)采集于贵州(GZ)、福建(FJ)、广西(GX)三地的百香果主产基地,每地区各选取20株进行采样,每株采集发育良好,果形一致,无病害的5个果实样品,将果汁分别混匀后液氮冻存备用。氯化钠,国药集团化学试剂有限公司;正己烷,默克医药生物科技公司;标准品,西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
8890-5977B型气相质谱联用仪、顶空瓶、TFE硅胶顶盖,美国安捷伦公司;65 μm SPME纤维组件二乙烯基苯/羧基/聚二甲基硅氧烷,美国Supelco公司。
1.3 样品制备方法
从-80 ℃冰箱中取出样品进行液氮研磨,涡旋混合均匀,每个样本称取约1 g粉末于顶空瓶中,加入饱和NaCl溶液,使用TFE硅胶顶盖(安捷伦)密封。SPME分析时,将每个小瓶放入60 ℃保持10 min,温度平衡后,采用65 μm SPME纤维组件二乙烯基苯/羧基/聚二甲基硅氧烷(色谱科)在60 ℃下暴露于样品的顶部空间20 min。每个样品做6组平行。
1.4 色谱与质谱条件
萃取后,在GC仪的注入端口中,在250 ℃条件下,从纤维涂层中解吸挥发性有机物5 min。挥发性有机物的鉴定和定量采用气相质谱联用仪,配备30 m×0.25 mm×0.25 μm 5%苯基-聚甲基硅氧烷(DB-5MS)毛细管柱。以氦气为载气,线速为1.0 mL/min。喷射器温度保持在250 ℃,探测器温度保持在280 ℃。加热速率为5 /min时,烘箱温度由40 ℃上升到250 ℃。所有的质谱都是在电子冲击(electronic impact,EI)模式下获得的,电离电压为70 eV。四极质量探测器、离子源和传递线温度分别设置为150 ℃、230 ℃和280 ℃。质谱在m/z 30~350 amu内进行扫描,间隔为1 s。将质谱与数据系统库(MWGC)和线性保留指数进行了比较,对分离的挥发性化合物进行了质谱鉴定。
1.4 数据处理
采用R软件进行主成分分析(principal component analysis,PCA)及正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),以反映不同样本分布状况,最大程度地分离不同变量指标。基于OPLS-DA模型获得的变量重要性投影(variable importance in project,VIP)进行评分,将根据 VIP≥1、P<0.05筛选出的代谢物定义为差异代谢物(significant changed metabolites,SCMs)。利用KEGG代谢库将鉴定出的差异代谢物进行比对并注释,进行相关代谢通路的分析。
2 结果与分析
2.1 GC-MS定性定量分析
本实验对3个不同产地黄金百香果挥发性成分进行了定性和定量分析。一共鉴定出183个与香气相关的挥发性代谢物质。分类统计(图1-A)表明183个代谢物中一共分成14类,其中酯类占38%,萜类占16%,酮类占9%,杂环化合物占8%,醇类占6%,芳烃类占6%,烷烃类占5%,烯烃类占3%。并绘制不同产地黄金百香果挥发性成分热图,聚类结果表明不同产地的18个样本分为3组,贵州样本和广西样本的挥发性物质种类与含量接近,聚为一类,福建样本单独聚为一类(图1-B)。
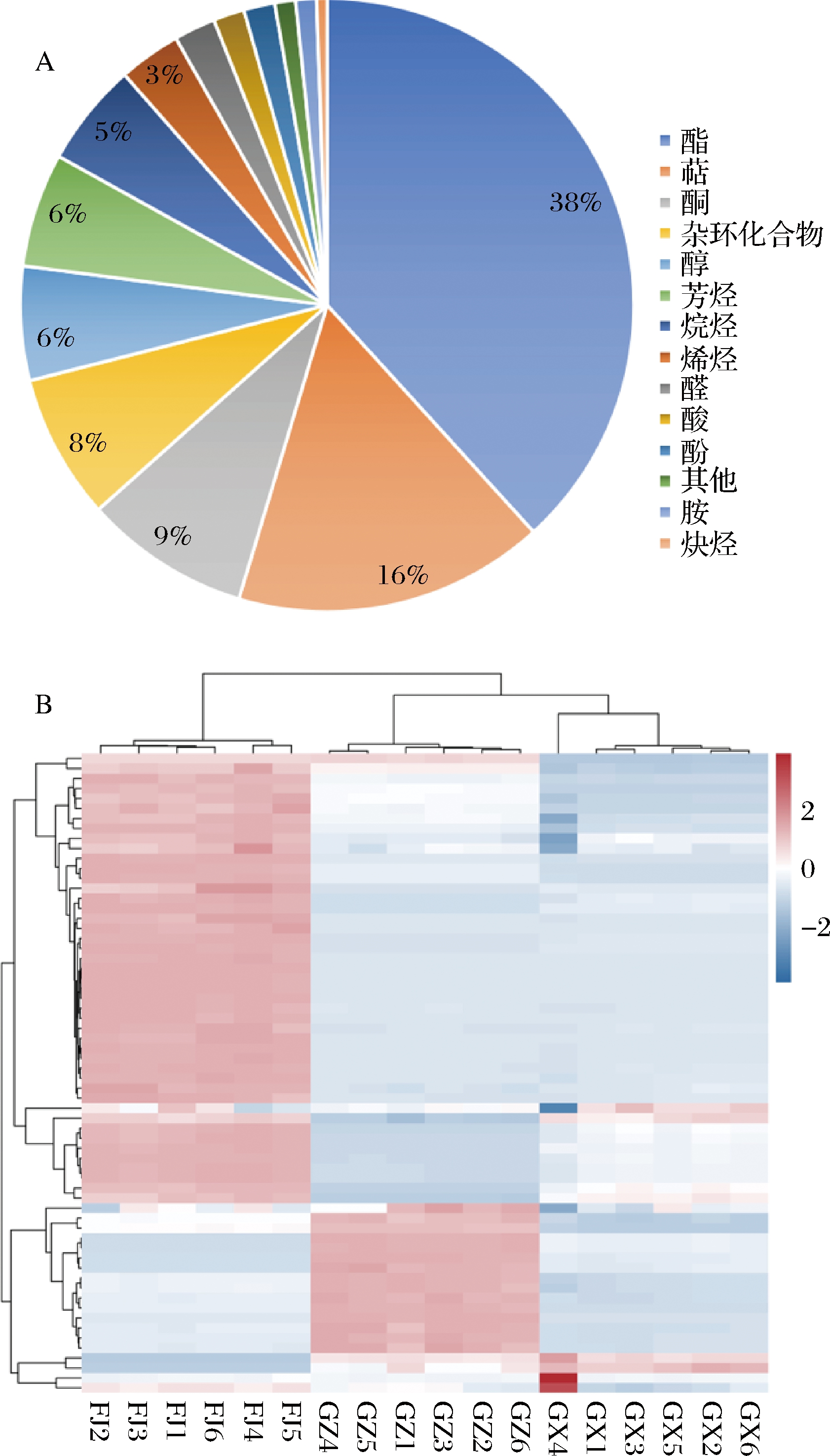
A-挥发性成分分类饼图;B-不同产地聚类分析热图
图1 GC-MS定性定量结果
Fig.1 Qualitative and quantitative results of GC-MS
酯类物质是本研究中最丰富的挥发性代谢物质(图1-A),大多数酯类被描述为具有水果和花的香味[17]。其次是萜类物质,挥发性的萜主要包含异戊二烯、单倍半萜及其衍生物,这一类物质也往往具有花果香气并具有较强的挥发性[18]。这些代谢物质不仅使百香果具有独特的香气和风味,也是决定其品质和口感的重要因素之一。
2.2 PCA分析
针对不同产地黄金百香果的挥发性物质进行非监督模式识别方法PCA分析。由图2可知,PCA得分图中主成分1和主成分2的贡献率之和为89.4%。一般情况下,当累计贡献率达到60%时,选择PCA模型作为分离模型[19]。本研究供试样品的PCA模型可以将贵州、福建及广西等不同地区种植的百香果区分开,且组内各点分布较为集中。主成分1将福建与贵州、广西分为两类,与聚类热图结果一致(图2)。表明不同产地黄金百香果的挥发性代谢物质具有一定的差异性。
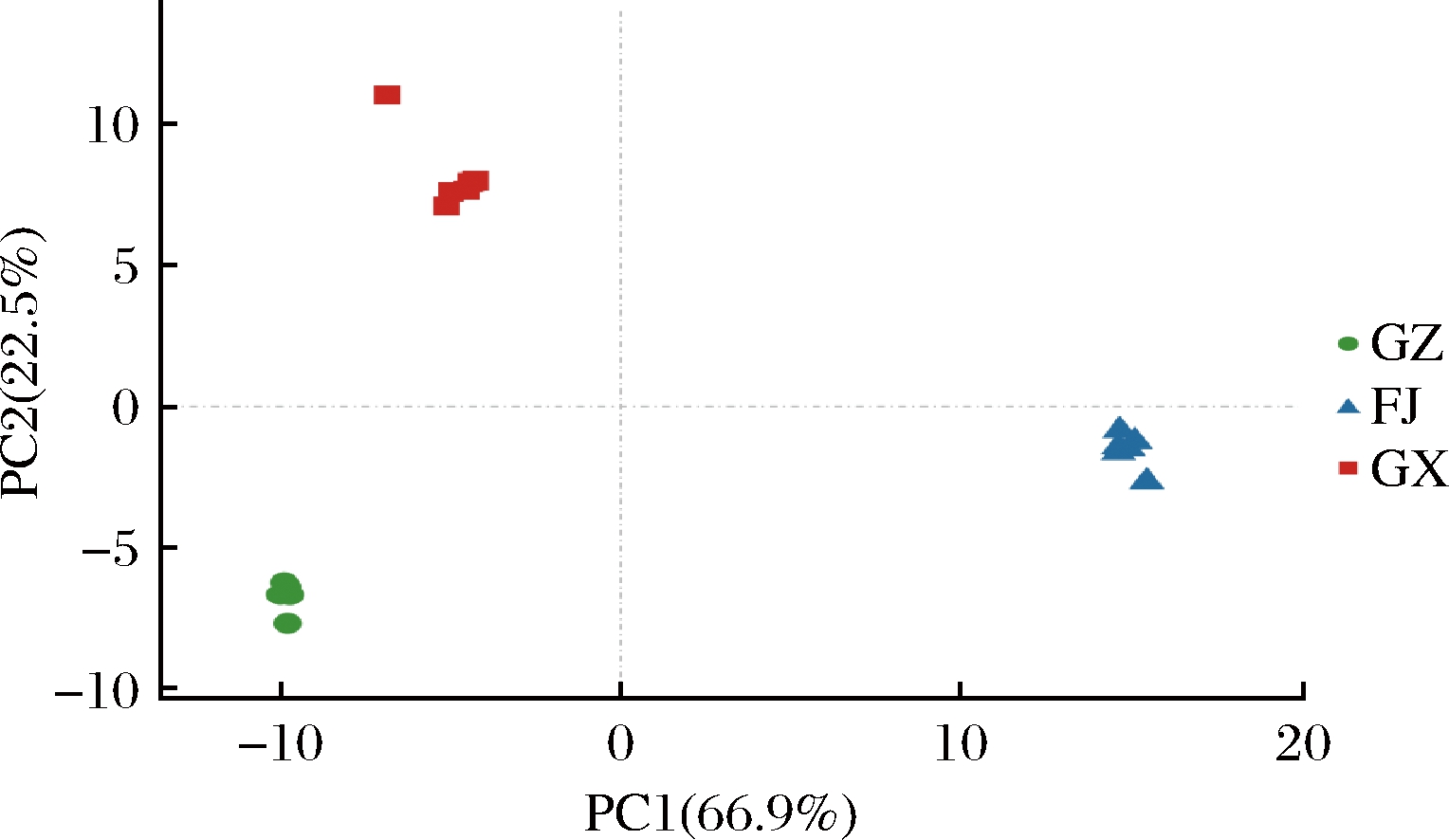
图2 PCA结果
Fig.2 The results of PCA
2.3 OPLS-DA分析
相对于PCA技术,OPLS-DA在建立分类模型时能够提供更准确的结果,从而提高模型预测能力和精度。OPLS-DA得分图(图3-A)的R2Y(cum)值为0.997,Q2Y(cum)值为0.994,表明该模型稳定性良好,可以应用于差异挥发物成分的筛选。对模型进行了200次置换验证检验(图3-B),结果表明这个OPLS-DA模型没有过拟合,具有统计学意义。
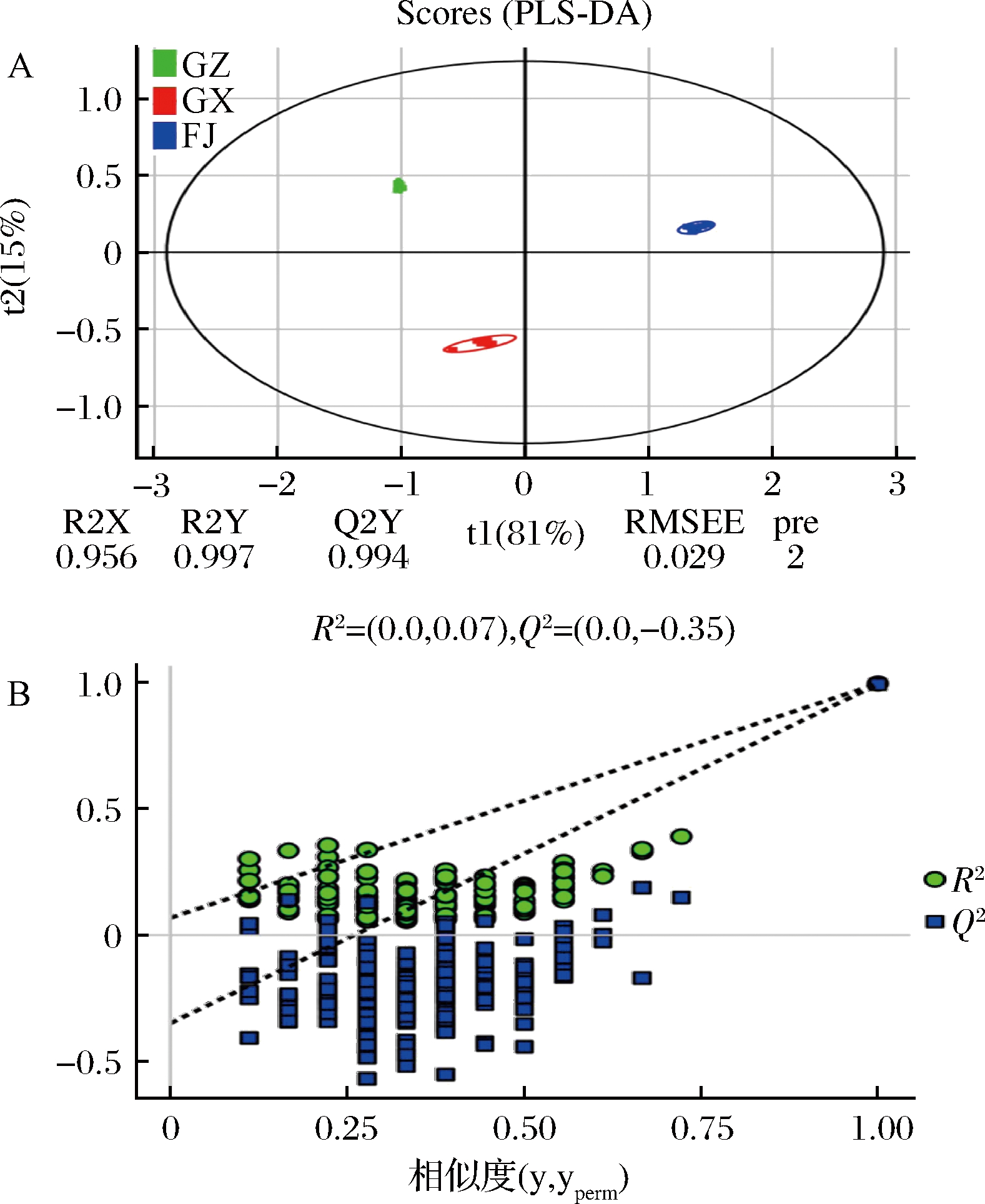
A-S-plot图;B-200次置换验证检验
图3 OPLS-DA结果
Fig.3 OPLS-DA results
2.4 主要差异代谢物质分析
通过对该OPLS-DA模型的VIP值进行多变量分析,对VIP值进行排序,VIP值越大,则对模型的贡献度越高,筛选出VIP值≥1,且P<0.05的挥发性成分(图4)。GX vs FJ筛选到31种差异代谢物,其中酯类占45.1%,包括丁酸己酯、(Z)-3-己烯基丁酸酯、丁酸乙酯、(Z)-3-己烯己酸酯、辛酸乙酯、1-甲基己酯-己酸、2-乙基丁酸辛酯、(Z)-3-己烯基酯辛酸、己酸己酯、庚烷-2-基丁酸酯、乙酸己酯、丁酸香叶酯、异丁酸香茅酯、己酸异戊酯等14种代谢物;萜类占29.0%,包括δ-3-烯、(1S)-6,6-二甲基-2-亚甲基-双环[3.1.1]庚烷、4-蒈烯、(+)-柠檬烯、2,6,10,10-四甲基-1-氧杂螺[4.5]癸烯、3,6,6-三甲基-双环[3.1.1]庚-2-烯、γ-萜品烯、8-(2,6-二甲基-庚-1,5-二烯基)-3,7,7-三甲基-双环[4.2.0]辛-2-烯、L-α-松油醇等9种代谢物;醇类占9.6%,包括1,2-辛二醇、己醇、呋喃醇TM3种代谢物;杂环化合物占6.4%,包括4,4′-双氮唑基、4-甲基噻唑2种代谢物;酮类占3.2%,仅2-庚酮1种代谢物;芳烃类占3.2%,仅苯酚1种代谢物;其他占3.2%,仅丁酸酸酐1种代谢物。GZ vs FJ筛选到35种差异代谢物,其中酯类占45.7%,包括丁酸己酯、(Z)-3-己烯己酸酯、(Z)-3-己烯基丁酸酯、丁酸乙酯、辛酸乙酯、1-甲基己酯-己酸、(Z)-3-己烯基酯辛酸、2-乙基丁酸辛酯、乙酸苄酯、庚烷-2-基丁酸酯、4-(2,6,6-三甲基环己烯-1-基)丁烷-2-基乙酸酯、己酸己酯、乙酸己烯酯、反式-3-己烯基乙酸酯、丁酸香叶酯、乙酸己酯等16种代谢物;萜类占31.4%,包括δ-3-烯、(1S)-6,6-二甲基-2-亚甲基-双环[3.1.1]庚烷、2,6,10,10-四甲基-1-氧杂螺[4.5]癸烯、4-蒈烯、(+)-柠檬烯、1,1,5-三甲基-1,2-二氢萘、3,6,6-三甲基-双环[3.1.1]庚-2-烯、γ-萜品烯、对薄荷脑1,5,8-三烯、8-(2,6-二甲基-庚-1,5-二烯基)-3,7,7-三甲基-双环[4.2.0]辛-2-烯、L-α-松油醇等11种代谢物;醇类占5.7%,包括1,2-辛二醇、4-羟基-3-甲氧基苄醇2种代谢物;酮类占5.7%,包括4-(2,6,6-三甲基-1-环己烯-1-基)-2-丁酮、2-庚酮2种代谢物;芳烃类占5.7%,包括1,2,3,4-四氢-1,4,6-三甲基-萘、苯酚2种代谢物;杂环化合物占2.8%,仅4,4′-双氮唑基1种代谢物;其他占2.8%,仅丁酸酸酐1种代谢物。GZ vs GX筛选到31种差异代谢物,其中酯类占35.4%,包括(Z)-3-己烯己酸酯、4-(2,6,6-三甲基环己烯-1-基)丁烷-2-基乙酸酯、(Z)-3-己烯基丁酸酯、乙酸苄酯、γ-十内酯、苯乙酸甲酯、丁酸苄酯、乙酸己酯、己酸己酯、吡螺烷、丁酸己酯等11种代谢物;萜类占35.4%,包括δ-3-烯、2,6,10,10-四甲基-1-氧杂螺[4.5]癸烯、(1S)-6,6-二甲基-2-亚甲基-双环[3.1.1]庚烷、1,1,5-三甲基-1,2-二氢萘、(+)-柠檬烯、4-蒈烯、龙脑、对薄荷脑1,5,8-三烯、3,6,6-三甲基-双环[3.1.1]庚-2-烯、1,8-二甲基-8,9-环氧-4-异丙基-螺癸烷、甲基异冰片等11种代谢物;醇类占9.6%,包括4-羟基-3-甲氧基苄醇、(R)-3,7-二甲基-6-辛烯醇、己醇3种代谢物;芳烃类占6.4%,包括1,2,3,4-四氢-1,4,6-三甲基-萘、1-甲基-3-(1-甲基乙基)-苯2种代谢物;杂环化合物占6.4%,包括4,4′-双氮唑基、2,4a-表二氧基-5,6,7,8-四氢-2,5,5,8a-四甲基-2H-1-苯并吡喃等2种代谢物;酮类占3.2%,仅4-(2,6,6-三甲基-1-环己烯-1-基)-2-丁酮1种代谢物;烯烃类占3.2%,仅3,4-二甲基-2,4,6-辛三烯1种代谢物。
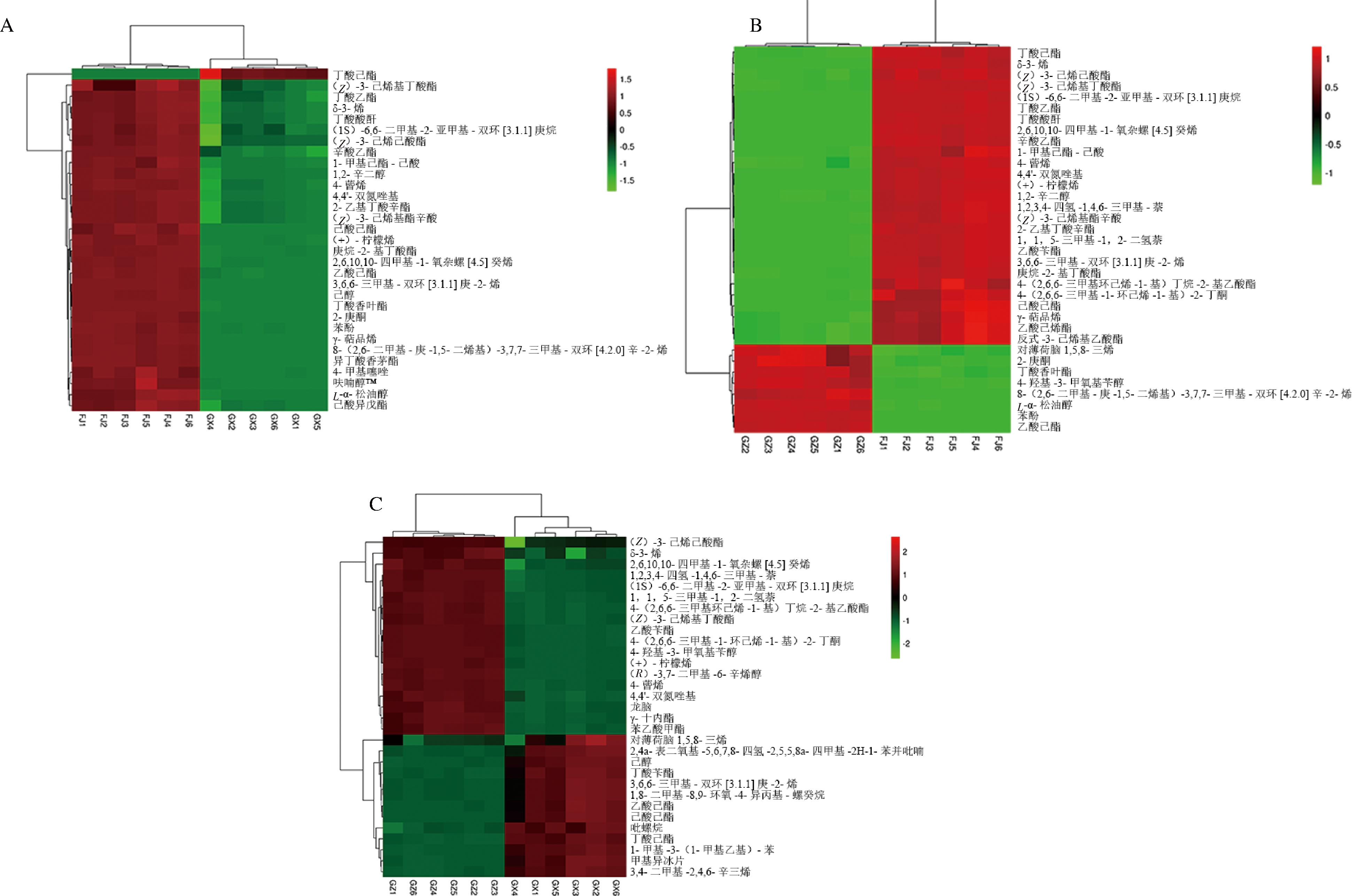
A-GX vs FJ; B-GZ vs FJ; C-GZ vs GX
图4 主要差异代谢物质
Fig.4 Main differential metabolites
有趣的是,在贵州、广西和福建等3个不同地区种植的黄金百香果,根据地区不同,检出了特征性代谢物质(图5),其中,己酸己酯在贵州和广西采集样品中检出,3-羟基丁酸乙酯在福建和广西采集样品中检出。此外,1-甲基己基乙酸酯在贵州和福建采集样品中检出,呋喃醇TM、水杨酸乙酯、十四烷酸乙酯、十六烷酸乙酯、甲烷亚磺酰氟、2-壬醇乙酸酯等6种代谢物质只在福建采集样品中检出。说明产地不同对酯类挥发性物质有较大的影响(图5)。以往的研究表明,乙酸乙酯、丁酸乙酯等酯类挥发性物质是区分草莓香味的重要化合物质[9,20]。
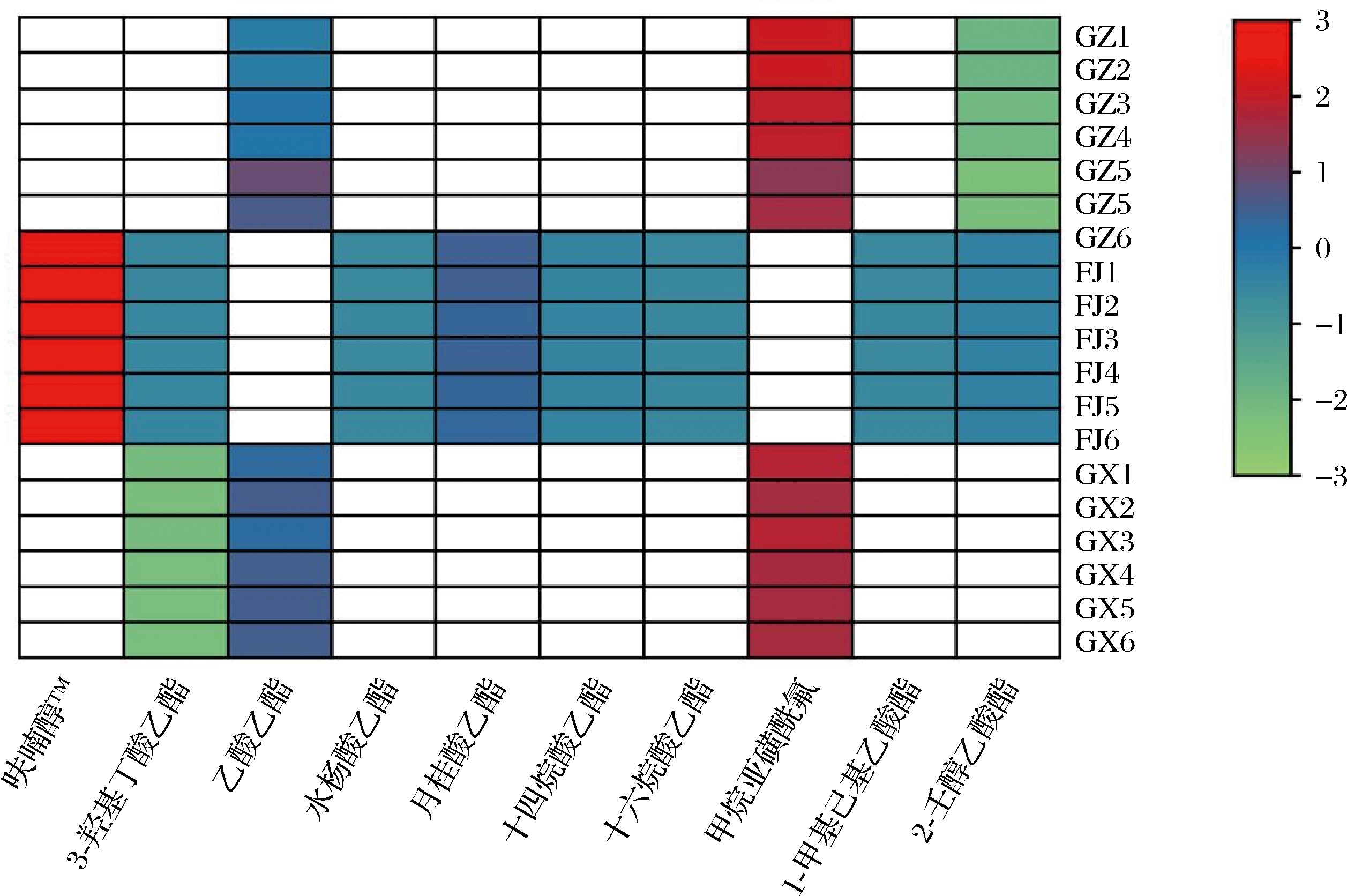
图5 特征性代谢物质
Fig.5 Characteristic metabolic substances
注:其中白色方框表示该样品未检出相应代谢物。
2.5 共有差异代谢物分析
由图6可知,在GX vs FJ、GZ vs FJ和GZ vs GX比较组中,3 个比较组间共同认定12个标志性代谢物,包括6个萜类物质{3,6,6-三甲基-双环[3.1.1]庚-2-烯、δ-3-烯、(1S)-6,6-二甲基-2-亚甲基-双环[3.1.1]庚烷、(+)-柠檬烯、2,6,10,10-四甲基-1-氧杂螺[4.5]癸烯、4-蒈烯};5个酯类物质[己酸己酯、丁酸乙酯、乙酸己酯、(Z)-3-己烯己酸酯、(Z)-3-己烯基丁酸酯];1个杂环化合物(4,4′-双氮唑基)。
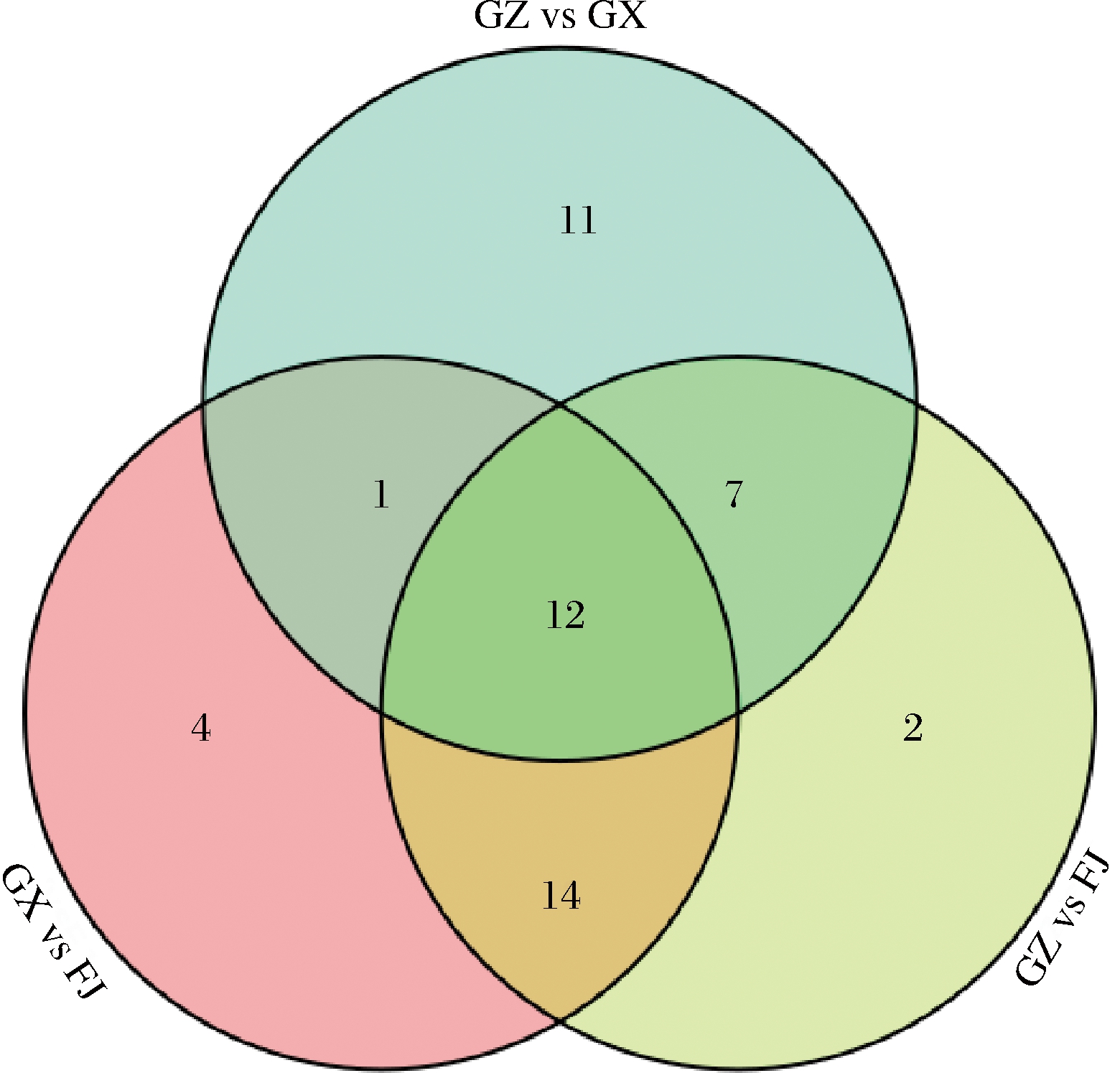
图6 差异代谢物韦恩图
Fig.6 Venn diagram of differential metabolites
本研究3个比较组间共同认定12个标志性代谢物,其中包括6个萜类物质,说明萜类物质在黄金百香果不同产地鉴别中承担重要作用。单萜类化合物一般具有挥发性和较强的香气[18,21-22]。5个酯类物质也被认定为标志性代谢物,这些物质往往作为脂肪酸与醇的酯化产物出现,可能起到能量贮存和释放的作用[17]。以往的研究表明,茶类的挥发性萜类化合物对茶的风味和品质有直接影响[23]。从结果来看,这些标志性代谢物在不同的比较组中都被认定为共同存在的代谢物,这表明它们可能在不同组之间具有一定的代谢通路和相似的生物功能。同时,这些代谢物的共同存在也可能与样本来源的地理位置、生长条件等因素有关。深入研究这些标志性代谢物,有助于更好地理解不同组之间的代谢差异,并有助于对物种的生长和适应机制进行更深入的探究。
2.6 差异代谢物通路分析
共有代谢物分析可以帮助本研究了解不同样本之间的差异,KEGG富集分析可以进一步帮助本研究了解这些差异代谢物所富集的生物学通路及其功能。在3个黄金百香果产地之间的差异代谢物KEGG富集分析结果中,可以看出不同样本之间存在的生物学差异(图7)。在GX vs FJ比较组中,差异代谢物主要富集在单萜类生物合成、酪氨酸代谢、柠檬烯和针烯降解、代谢途径及次生代谢物的生物合成中。这些富集通路与百香果的营养成分和香气有关,其中单萜类物质和柠檬烯是重要香气成分[24]。在GZ vs FJ比较组中,差异代谢物主要富集在单萜类生物合成、次生代谢物的生物合成、酪氨酸代谢、α-亚麻酸代谢、柠檬烯和针烯降解及代谢途径中。这些差异代谢物与GX vs FJ比较组相似,但还包括亚麻酸代谢,这表明2个产地之间的差异还在于脂肪酸的含量和类型,脂肪酸是参与果实香气挥发物生物合成的重要代谢途径[25]。在GZ vs GX比较组中,差异代谢物主要富集在单萜类生物合成、柠檬烯和针烯降解、代谢途径及次生代谢物的生物合成中。以上结果表明,不同产地的黄金百香果在化学成分和生物学功能方面存在差异,这可以为产地的鉴别和质量控制提供重要的参考。
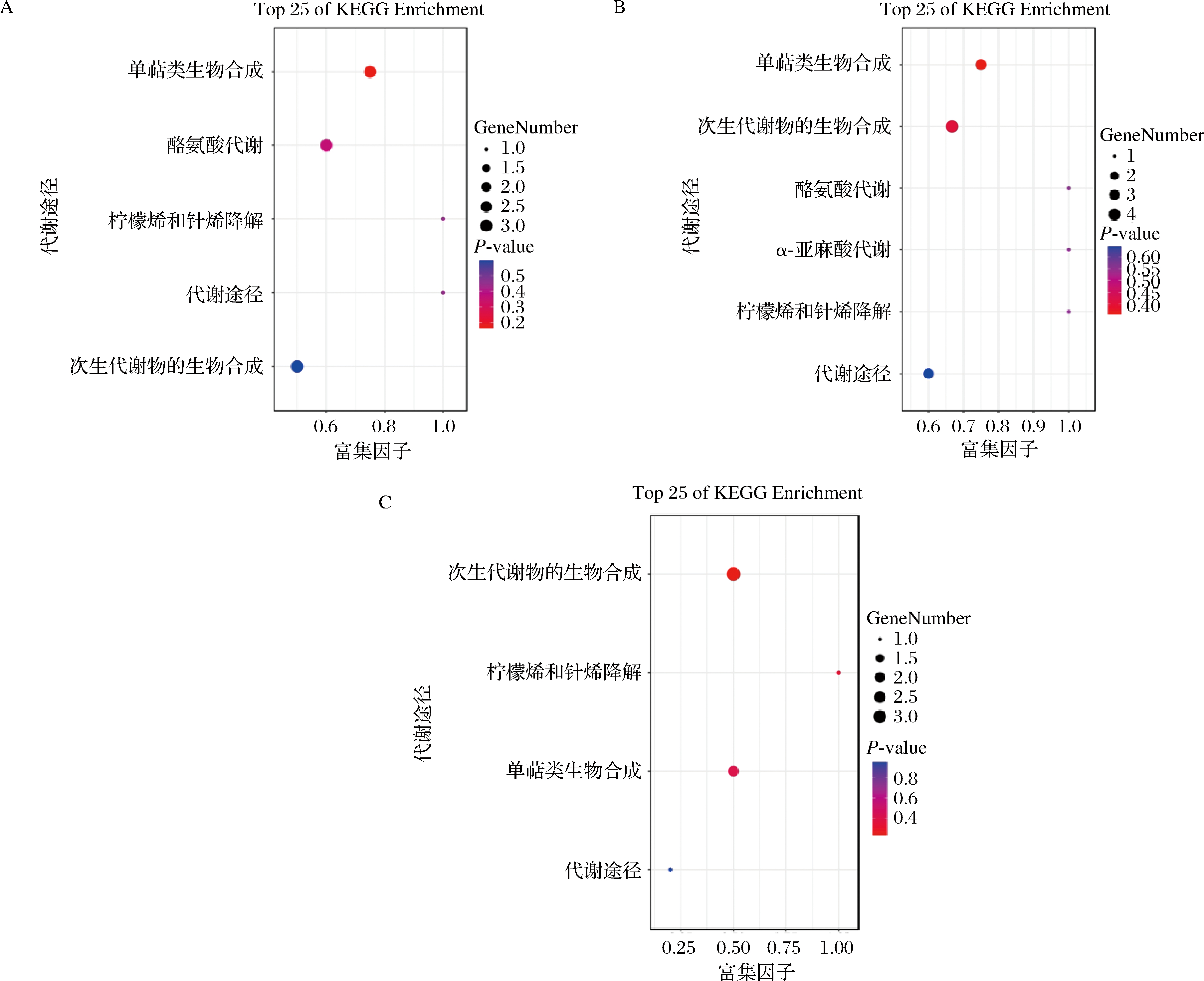
A-GX vs FJ; B-GZ vs FJ; C-GZ vs GX
图7 差异代谢物KEGG富集图
Fig.7 Differential metabolite KEGG enrichment map
注:横坐标为代谢通路对应的 Rich factor,纵坐标为代谢通路名称,点的颜色为P-value(越红表示富集越显著),点的大小为所富集的差异代谢物个数(越大表示个数越多)。
3 结论
产地溯源能够证明农产品的真实性,确保食品质量安全。本研究分析对比了贵州、福建、广西3个不同产地黄金百香果挥发性成分,研究发现,黄金百香果中的挥发性成分主要为酯类与萜类,在3个产地间共同认定了12个标志性代谢物,其中6个为萜类物质,5个为酯类物质,1个杂环化合物。不同地区种植的黄金百香果中检测出的代谢物质有所不同。在贵州和广西的样品中发现了己酸己酯和1-甲基己基乙酸酯,而在福建和广西的样品中检测到了3-羟基丁酸乙酯。此外,在福建的样品中检测到了呋喃醇TM、水杨酸乙酯、十四烷酸乙酯、十六烷酸乙酯、甲烷亚磺酰氟、2-壬醇乙酸酯等6种代谢物质,而这些物质在其他2个地区的样品中没有检测到。研究结果可以帮助鉴别和区分不同产地的百香果,但是只采集了贵州、福建及广西的黄金百香果样本做了广靶代谢组学分析,在今后的研究工作中,除了已知的挥发性代谢物外,还有许多未知的代谢物需要进一步分析和鉴定,这些代谢物可能对百香果的品质和营养成分具有重要影响。此外,通过对百香果的基因组进行分析,可以了解其生长和发育过程中挥发性代谢物的合成和调控机制。
[1] SANTOS A A, PENHA H A, BELLEC A, et al.Begin at the beginning:A BAC-end view of the passion fruit (Passiflora) genome[J].BMC Genomics, 2014, 15(1):816.
[2] CORR A R C G, PERALTA R M, HAMINIUK C W I, et al.The past decade findings related with nutritional composition, bioactive molecules and biotechnological applications of Passiflora spp.(passion fruit)[J].Trends in Food Science &Technology, 2016, 58:79-95.
A R C G, PERALTA R M, HAMINIUK C W I, et al.The past decade findings related with nutritional composition, bioactive molecules and biotechnological applications of Passiflora spp.(passion fruit)[J].Trends in Food Science &Technology, 2016, 58:79-95.
[3] SEPTEMBRE-MALATERRE A, STANISLA S G, DOURAGUIA E, et al.Evaluation of nutritional and antioxidant properties of the tropical fruits banana, litchi, mango, papaya, passion fruit and pineapple cultivated in Réunion French Island[J].Food Chemistry, 2016, 212:225-233.
[4] MORAI S D R, ROTTA E M, SARGI S C, et al.Antioxidant activity, phenolics and UPLC-ESI(-)-MS of extracts from different tropical fruits parts and processed peels[J].Food Research International, 2015, 77:392-399.
[5] OLIVEIRA D A, ANGONESE M, GOMES C, et al.Valorization of passion fruit (Passiflora edulis sp.) by-products:Sustainable recovery and biological activities[J].The Journal of Supercritical Fluids, 2016, 111:55-62.
[6] CAZARIN C B B, RODRIGUEZ-NOGALES A, ALGIERI F, et al.Intestinal anti-inflammatory effects of Passiflora edulis peel in the dextran sodium sulphate model of mouse colitis[J].Journal of Functional Foods, 2016, 26:565-576.
[7] SILVA R O, DAMASCENO S R B, BRITO T V, et al.Polysaccharide fraction isolated from Passiflora edulis inhibits the inflammatory response and the oxidative stress in mice[J].Journal of Pharmacy and Pharmacology, 2015, 67(7):1017-1027.
[8] 郭艳峰, 吴惠婵, 夏雨, 等.百香果不同发育阶段果汁挥发性成分研究[J].福建农业学报, 2017, 32(3):299-304.
GUO Y F, WU H C, XIA Y, et al.Volatiles in juice of passion fruitsat different developmental stages[J].Fujian Journal of Agricultural Sciences, 2017, 32(3), 299-304.
[9] URRUTIA M, RAMBLA J L, ALEXIOU K G, et al.Genetic analysis of the wild strawberry (Fragaria vesca) volatile composition[J].Plant Physiology and Biochemistry, 2017, 121:99-117.
[10] WANG Y G, LI X R, JIANG Q J, et al.GC-MS analysis of the volatile constituents in the leaves of 14 compositae plants[J].Molecules, 2018, 23(1):166.
[11] YU Y, BAI J H, CHEN C X, et al.Identification of QTLs controlling aroma volatiles using a ‘Fortune’ x ‘Murcott’ (Citrus reticulata) population.BMC Genomics[J].BMC Genomics, 2017, 18(1):646.
[12] 潘葳, 刘文静, 韦航, 等.不同品种百香果果汁营养与香气成分的比较[J].食品科学, 2019, 40(22):277-286.
PAN W, LIU W J, WEI H, et al.Comparative analysis of nutritional and aroma components in passion fruit juices from five cultivars[J].Food Science, 2019, 40(22):277-286.
[13] 刘纯友, 江素珍, 冯笑, 等.HS-SPME-GC-MS测定三种类型百香果果实挥发性风味成分[J].食品工业科技, 2021,42(11):255-262.
LIU C Y, JIANG S Z, FENG X, et al.Study on volatile flavor compounds from three types of passion fruit using headspace solid phase micro-extraction gas chromatography mass spectrometry[J].Science and Technology of Food Industry, 2021, 42(11):255-262.
[14] 方灵, 孔宝玉, 韦航, 等.不同发育阶段黄金百香果挥发性成分差异性研究[J].果树学报, 2022, 39(12):2376-2389.
FANG L, KONG B Y,WEI H, et al.Study on variation of volatile components in Golden Passion Fruit at different development stages[J].Journal of Fruit Science, 2022, 39(12):2376-2389.
[15] 金润楠, 李子函, 赵开丽, 等.基于气质联用的不同产地温州蜜柑香气成分比较分析[J].食品与发酵工业, 2020, 46(2):252-260.
JIN R N, LI Z H, ZHAO K L, et al.A comparative analysis of aroma components of Satsuma mandarin from different producing areas based on HS-SPME-GC-MS[J].Food and Fermentation Industries, 2020, 46(2):252-260.
[16] 刘慧宇, 唐启正, 伊华林.不同产地赣南早脐橙果实挥发性物质比较分析[J].中国南方果树, 2023, 52(2):39-44.
LIU H Y, TANG Q Z, YI H L.Comparative analysis of volatile components in early Gannan navel orange fruits from different producing areas[J].South China Fruits, 2023, 52(2):39-44.
[17] WANG J, TANG X X, CHU Q L, et al.Characterization of the volatile compounds in Camellia oleifera seed oil from different geographic origins[J].Molecules, 2022, 27(1):308.
[18] ZHENG T, GUAN L B, YU K, et al.Expressional diversity of grapevine 3-Hydroxy-3-methylglutaryl-CoA reductase (VvHMGR) in different grapes genotypes[J].BMC Plant Biology, 2021, 21(1):279.
[19] WU Z B, CHEN L Z, WU L M, et al.Classification of Chinese honeys according to their floral origins using elemental and stable isotopic compositions[J].Journal of Agricultural and Food Chemistry, 2015, 63(22):5388-5394.
[20] ULRICH D, KECKE S, OLBRICHT K.What do we know about the chemistry of strawberry aroma?[J].Journal of Agricultural and Food Chemistry, 2018, 66(13):3291-3301.
[21] 李响. 基于转录组测序挖掘蜡梅挥发类萜代谢途径关键基因及功能分析[D].武汉:华中农业大学, 2020.
LI X.Identification of genes related to volatile terpenoids biosynthesis in Chimonanthus praecox based on RNA-seq technology[D].Wuhan:Huazhong Agricultural University, 2020.
[22] 张帆, 王颖, 李春.单萜类化合物的微生物合成[J].生物工程学报, 2022, 38(2):427-442.
ZHANG F, WANG Y, LI C.Microbial synthesis of monoterpenoids:A review[J].Chinese Journal of Biotechnology, 2022, 38(2):427-442.
[23] JOSHI R, GULATI A.Biochemical attributes of tea flowers (Camellia sinensis) at different developmental stages in the Kangra region of India[J].Scientia Horticulturae, 2011, 130(1):266-274.
[24] ZHANG L L, HUANG W, ZHANG Y Y, et al.Genomic and transcriptomic study for screening genes involved in the limonene biotransformation of Penicillium digitatum DSM 62840[J].Frontiers in Microbiology, 2020, 11:744.
[25] QIN G H, TAO S T, ZHANG H P, et al.Evolution of the aroma volatiles of pear fruits supplemented with fatty acid metabolic precursors[J].Molecules, 2014, 19(12):20183-20196.