便秘是一种发病率较高、覆盖人群较广的胃肠道功能紊乱性疾病[1-2]。中华医学会消化病学分会胃肠动力学组在2019年发布文件《中国慢性便秘专家共识意见(2019)》,其中数据显示在我国大约有5 000万的成年人存在便秘的困扰,相当于患病率为4.0%~10.0%。并且便秘的患病率也随着年龄的增长逐年呈现上升的趋势,其中>70岁人群患病率达23.0%,>80岁可达38.0%,还有高达80%的患者需要接受长期照护[3]。便秘除具有排便困难,排便频率低,粪便干硬等临床症状外[4],还会导致肠道菌群失调[2, 5]。目前,药物依旧是治疗便秘的主要途径,但这些药物或多或少都具有一些毒副作用。近年来,肠道菌群已成为科研领域的研究热点,膳食、肠道菌群与疾病之间的相关性研究则是重中之重,因此通过膳食补充益生菌缓解便秘也顺理成章的成为可能。
益生菌作为一种活的微生物具有诸多益生特性,当摄入足够数量的益生菌时,就能够对宿主产生众多正向的益处。乳杆菌属中的大多数菌株都具有益生作用,其中的植物乳杆菌(Lactobacillus plantarum)就是最有代表性的[6]。我们实验室的明星菌株L.plantarum CCFM 8661在前期的动物实验和临床试验中均展现出良好的益生作用。例如减除重金属,缓解重金属毒性,清除幽门螺旋杆菌,缓解过敏性皮炎等[7-9]。虽然有众多研究表明植物乳杆菌能够缓解便秘[10-11],但L.plantarum CCFM 8661这株菌是否具有缓解便秘的作用,目前尚未可知。基于此,本研究旨在通过动物实验,研究L.plantarum CCFM 8661是否具有调节肠道菌群及缓解便秘的作用,并初步探讨其机制,针对具有治疗便秘功能的产品开发提供更多的思路,也为L.plantarum CCFM 8661新功能的开发和应用提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 实验菌株及材料
L.plantarum CCFM 8661冻干粉(3×1011 CFU/g),格乐瑞(无锡)营养科技有限公司;叠氮钠-结晶紫-七叶苷琼脂、伊红美蓝琼脂、BBL琼脂、Lbs琼脂、TSC琼脂,青岛海博生物技术有限公司;盐酸洛哌丁胺(loperamide hydrochloride)胶囊,西安杨森制药有限公司;阿拉伯树胶粉、活性炭粉、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸,国药集团化学试剂公司;小鼠乙酰胆碱(acetylcholine,ACH)、小鼠胃泌素(gastrin,GAS)、小鼠酪酪肽(peotide YY,PYY)、小鼠P物质(substance P,SP)、小鼠胃动素(mouse motilin,MTL)、小鼠5羟色胺(5-hydroxy tryptamine,5-HT)、小鼠血管活性肠肽(vasoactive intestinal peptide,VIP)、小鼠生长抑素(somatostatin,SS)、小鼠白细胞介素1(interleukin-1,IL-1)、小鼠白细胞介素6(interleukin-6,IL-6)、小鼠白细胞介素8(interleukin-8,IL-8)、小鼠白细胞介素10(interleukin-10,IL-10)、小鼠转化生长因子β(transforming growth factor-β,TGF-β) ELISA试剂盒,上海酶联生物科技有限公司。
1.1.2 仪器与设备
真空冷冻干燥机,美国LABCONCO公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;1300-ISQ GC-MS,美国Thermo 公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司。
1.2 动物实验设计
50只6周龄SPF级C57BL/6 J雄性小鼠经过1周的适应喂养后,随机分为5小组:空白对照组、模型组、低剂量L.plantarum CCFM 8661组、中剂量L.plantarum CCFM 8661组、高剂量L.plantarum CCFM 8661组。第8~28天,空白对照组和模型组灌胃无菌生理盐水,低剂量组、中剂量组、高剂量组分别灌胃无菌生理盐水重悬的1.5×106、1.5×107、1.5×108 CFU/mL的L.plantarum CCFM 8661菌液;灌胃剂量为0.2 mL。第29~35天,空白对照组灌胃无菌生理盐水,其他组灌胃10 mg/kg·BW盐酸洛哌丁胺,1 h后,模型组灌胃无菌生理盐水,菌干预组灌胃相对应剂量(高、中、低剂量)的L.plantarum CCFM 8661菌液,灌胃剂量均为0.2 mL。试验期间饲喂小鼠标准饲料,每周对小鼠粪便进行收集并尽快保存于-80 ℃冰箱备用。实验结束后,给予小鼠腹腔注射100 mg/kg·BW的氯胺酮,麻醉完成之后采取摘眼球取血,然后脱颈椎处死小鼠。血液在4 ℃,3 000×g条件下离心10 min,分装血清后-80 ℃冻存备用。具体实验分组及动物实验流程分别见表1和图1。实验所需动物全部购自江苏集萃药康生物科技股份有限公司。实验期间,所有小鼠自由进食进水并喂养于IVC笼盒中,饲养环境条件如下:温度(25±2) ℃、湿度(50±5)%、12 h光照和12 h黑夜。本动物实验中所用的方法均经过江南大学伦理委员会审阅并批准(JN.No20211215c1200515[531]),并符合欧盟实验动物指南(Directive 2010/63/EU)。
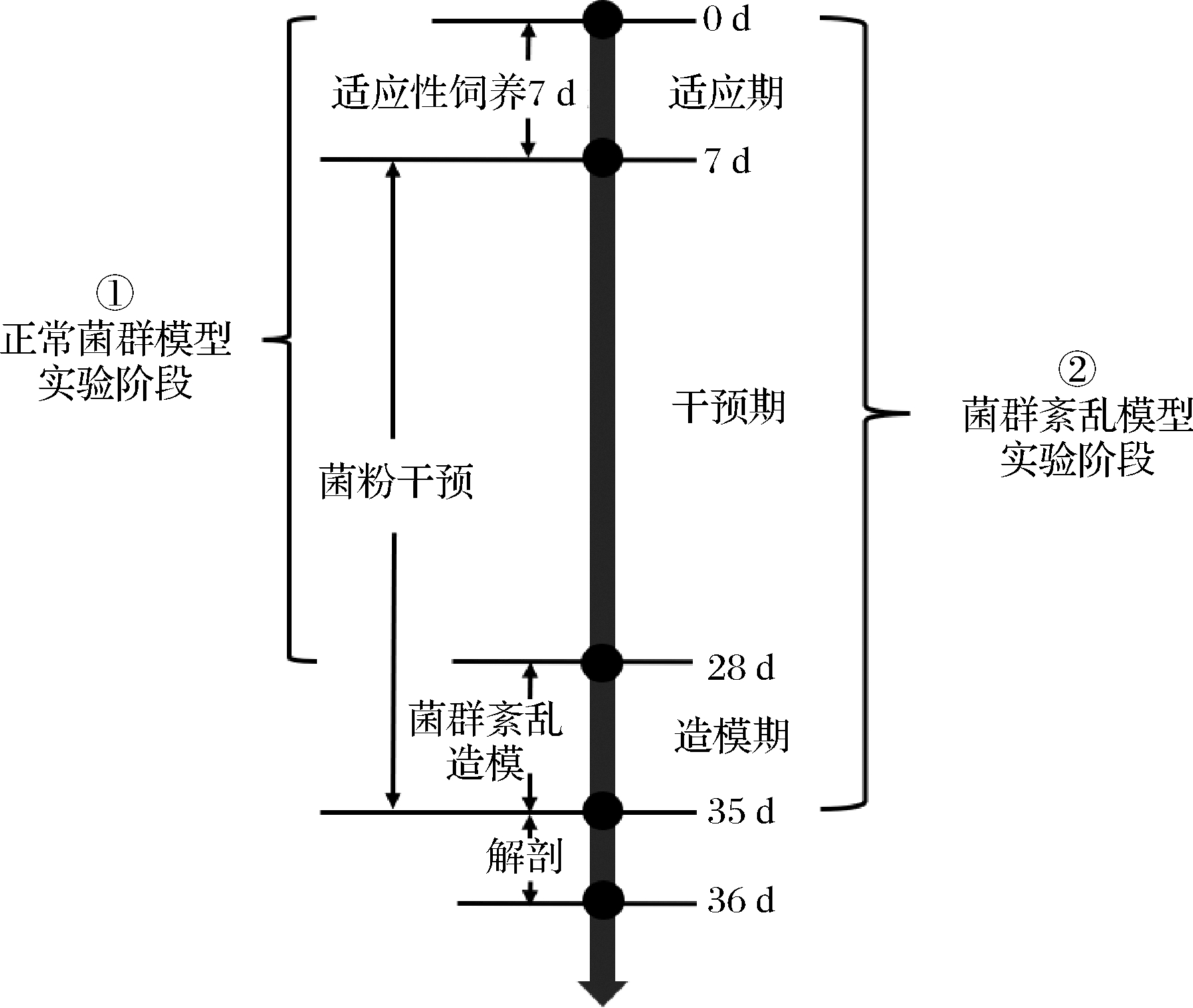
图1 动物实验流程图
Fig.1 Animal experiment schedule
表1 动物实验分组情况一览表
Table 1 List of animal testing groups

组别灌胃物质灌胃浓度空白对照组无菌生理盐水-模型组盐酸洛哌丁胺10 mg/kg·BW低剂量组L.plantarum CCFM 86611.5×106 CFU/mL中剂量组L.plantarum CCFM 86611.5×107 CFU/mL高剂量组L.plantarum CCFM 86611.5×108 CFU/mL
1.3 实验方法
1.3.1 调节肠道菌群功能实验
参考《保健食品功能检验与评价方法(2022年版)》中“有助于调节肠道菌群检验方法”进行实验设计和相关指标测定。此处调节肠道菌群,我们选择了两种不同状态下,L.plantarum CCFM 8661对小鼠菌群的影响。(1)在正常菌群状态下(7~28 d):分别无菌采取第7天和第28天小鼠肛门内粪便2~3粒,放置于无菌离心管中备用;(2)在菌群紊乱状态下(29~35 d):同样在无菌的条件下采集第35天的粪便备用。按照如下的检测方法检测肠道菌群:首先称量两种不同状态下的粪便湿重后进行10倍系列稀释,选择菌落数在30~300的稀释度,接种在对应的培养基上进行培养,根据菌落形态、革兰氏染色镜检、生化反应等鉴定计数菌落[12],计算每克湿便中双歧杆菌、乳杆菌、肠杆菌、肠球菌、产气荚膜梭菌的菌数,结果取对数(lg CFU/g)后进行统计。
1.3.2 便秘相关指标测定
1.3.2.1 粪便含水量
每周收集小鼠粪便用于粪便含水量的检测。方法如下:将灌胃结束后的小鼠单独放入垫有滤纸的洁净笼盒中,收集新鲜粪便,称重后冷冻干燥,根据公式(1)计算粪便含水量:
粪便含水量![]()
(1)
1.3.2.2 排首粒黑便时间
实验第35天,灌胃0.2 mL盐酸洛哌丁胺和活性炭的混合溶液,将每只小鼠灌胃墨汁时间到其排出第一粒黑便时的时长记录为排首粒黑便时间。超出模型组最后一只小鼠排首粒黑便时间的处理组则说明无效,将各个处理组与模型组进行比较,用于说明各组在缓解便秘方面的差异。
1.3.2.3 小肠推进率
解剖前12 h对小鼠禁食不禁水处理,第36天除正常组外的所有组小鼠灌胃0.2 mL盐酸洛哌丁胺和活性炭的混合液,正常组灌胃无菌生理盐水和活性炭混合溶液,30 min后处死小鼠,打开小鼠腹腔后剪取幽门至盲肠的肠管,并将此肠管拉成直线,测量肠管长度为“小肠总长度”,从幽门到墨汁前沿的长度为“活性炭溶液前端推进长度”[13],根据公式(2)计算小肠推进率:
小肠推进率![]()
(2)
1.3.3 小鼠血清中神经递质、炎症因子的测定
用ELISA试剂盒测定小鼠血清中便秘相关胃肠调节递质含量:MTL、GAS、SP、VIP、SS、PYY、ACH、5-HT、IL-1, IL-6, IL-8, IL-10、TGF-β的水平,上述操作方法按照说明书要求进行操作。
1.3.4 小鼠粪便中短链脂肪酸(short-chain fatty acids,SCFAs)的测定
称取30 mg左右冻干小鼠粪便,小鼠粪便中SCFAs的抽提及检测方法参照毛丙永[14]的方法,GC-MS检测选取全波长扫描。采用外标法绘制不同SCFA的标准曲线,根据得到的标准曲线计算样品中SCFAs浓度(μmol/g)。
1.3.5 数据统计与分析
实验数据均以“平均值±标准差”表示,用SPSS软件进行方差分析,P<0.05即判定为差异显著。实验结果参考《保健食品功能检验与评价方法(2022年版)》中“有助于调节肠道菌群检验方法”进行阳性结果判定。利用GrapaPad Prism 8.0作图、数据比较。
2 结果与分析
2.1 L.plantarum CCFM 8661有助于调节小鼠肠道菌群
2.1.1 L.plantarum CCFM 8661对小鼠体重的影响
经L.plantarum CCFM 8661干预后,小鼠体重在正常和菌群紊乱两种状态下的情况如表2和表3所示。
表2 在正常菌群状态下L.plantarum CCFM 8661对小鼠体重的影响(±SD) 单位:g
Table 2 Effect of L.plantarum CCFM 8661 on the body weight of mice under normal microbiota condition(±SD)
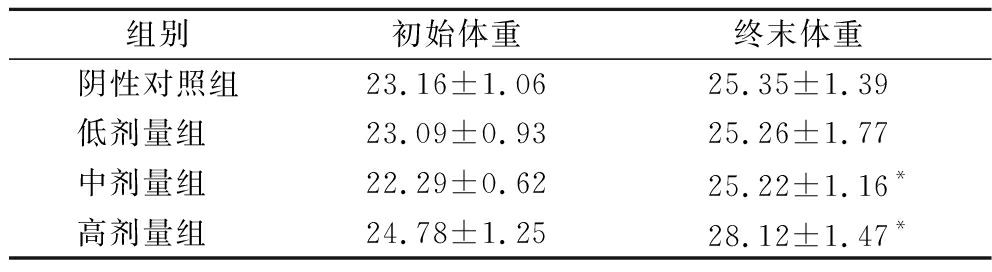
组别初始体重终末体重阴性对照组23.16±1.0625.35±1.39低剂量组 23.09±0.9325.26±1.77中剂量组 22.29±0.6225.22±1.16*高剂量组 24.78±1.2528.12±1.47*
注:*表示干预前后小鼠体重有显著性差异(P<0.05)。
表3 在菌群紊乱状态下L.plantarum CCFM 8661对小鼠体重的影响(±SD) 单位:g
Table 3 Effect of L.plantarum CCFM 8661 on the body weight of mice under disorder microbiota condition(±SD)
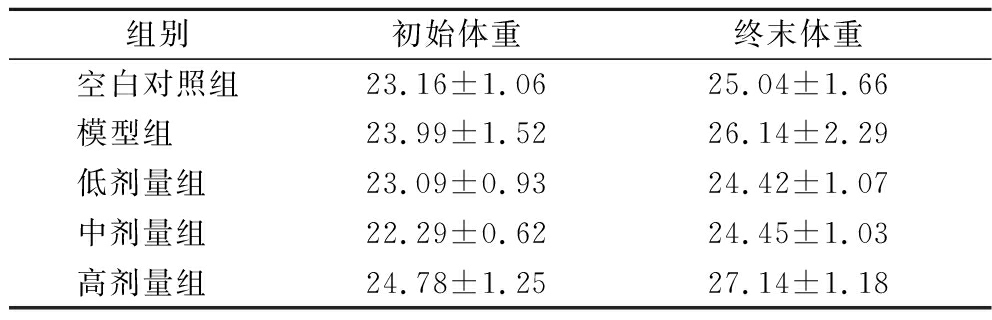
组别初始体重终末体重空白对照组23.16±1.0625.04±1.66模型组 23.99±1.5226.14±2.29低剂量组 23.09±0.9324.42±1.07中剂量组 22.29±0.6224.45±1.03高剂量组 24.78±1.2527.14±1.18
由表2可知,在正常菌群状态下,与空白对照组相比,小鼠体重随灌胃L.plantarum CCFM 8661剂量的提升而呈现显著增加的趋势(P<0.05)。而在菌群紊乱状态下,小鼠体重在低、中、高剂量组与对照组间均无显著性差异,以上结果表明,在健康状态下,随着时间的推移及一段时间益生菌的摄入,宿主的脾胃功能得到改善,进食量提高而出现体重提高的情况[15];菌群紊乱状态下由于造模药物的影响和肠道菌群的改变,小鼠体重虽有不同程度增加,但并没有显著性差异[16]。
2.1.2 L.plantarum CCFM 8661对小鼠肠道菌群的影响
2.1.2.1 正常菌群状态下L.plantarum CCFM 8661对小鼠肠道菌群的影响
在正常菌群状态下,通过为期3周的L.plantarum CCFM 8661干预,小鼠肠道中双歧杆菌、乳杆菌、肠杆菌、肠球菌、产气荚膜梭菌的变化情况如图2所示,粪便中双歧杆菌和乳杆菌的数量在3种不同剂量的L.plantarum CCFM 8661干预后均显著增加(P<0.05),而肠杆菌、肠球菌和产气荚膜梭菌的数量在干预前后无显著性变化。结合《保健食品功能检验与评价方法(2022年版)》中“有助于调节肠道菌群检验方法”中阳性结果判定标准,说明L.plantarum CCFM 8661具有调节小鼠肠道菌群的作用。刘伟贤等[17]的研究结果显示,干酪乳杆菌K56具有调节肠道菌群的功能,能够显著提高小鼠肠道内益生菌含量,并且使条件致病菌含量降低,本研究结果与其相一致,当补充足够益生菌会改变机体的肠道菌群[18]。

a-双歧杆菌;b-乳杆菌;c-肠球菌;d-肠杆菌;e-产气荚膜梭菌
图2 正常菌群状态下L.plantarum CCFM 8661对小鼠肠道菌群的影响
Fig.2 Effect of L.plantarum CCFM 8661 on intestinal microflora of mice under normal microbiota condition
注:*表示干预前后对比差异有显著性,其中*代表P<0.05,**代表P<0.01,***代表P<0.001,****代表P<0.000 1;#表示与阴性对照组比较差异有显著性,P<0.05(图3、图7同)。
2.1.2.2 菌群紊乱状态下L.plantarum CCFM 8661对小鼠肠道菌群的影响
在菌群紊乱状态下,L.plantarum CCFM 8661干预后,小鼠肠道菌群内双歧杆菌、乳杆菌、肠杆菌、肠球菌、产气荚膜梭菌的变化情况如图3所示,不论是实验组实验前后自身比较,还是实验后实验组与对照组组间比较,粪便中双歧杆菌在3种不同剂量的L.plantarum CCFM 8661干预后均显著增加(P<0.05),而肠杆菌、肠球菌和产气荚膜梭菌的数量在干预前后无显著性变化。结合《保健食品功能检验与评价方法(2022年版)》中“有助于调节肠道菌群检验方法”中阳性结果判定标准,说明L.plantarum CCFM 8661具有调节小鼠肠道菌群的作用。早前就有研究提到乳杆菌能够有效调节肠道菌群失衡,恢复菌群数量[19-20]。

a-双歧杆菌;b-乳杆菌;c-肠球菌;d-肠杆菌;e-产气荚膜梭菌
图3 菌群紊乱状态下L.plantarum CCFM 8661对小鼠肠道菌群的影响
Fig.3 Effect of L.plantarum CCFM 8661 on intestinal microflora in mice under the condition of microbiota disorder
注:##表示与阴性对照组比较差异有显著性(P<0.01)。
综上所述,不论是在正常菌群状态下,还是在菌群紊乱状态下,L.plantarum CCFM 8661均具有调节宿主肠道菌群的作用。
2.2 L.plantarum CCFM 8661具有缓解小鼠便秘的趋势
导致便秘的原因比较复杂,在临床上便秘多表现为自发性排便频率低、排便费力且费时、粪便干硬等[4]。本文应用洛哌丁胺构建便秘模型,通过检测便秘相关指标(粪便含水量、小肠推进率、排首粒黑便时间)发现,与空白组相比,洛哌丁胺显著降低了小鼠的粪便含水量(图4-a),延长了小鼠整个肠道的传输时间(排首粒黑便时间)(图4-b)以及小肠推进率(图4-c)。这些结果表明应用洛哌丁胺可成功构建小鼠便秘模型。

a-粪便含水量;b-排首粒黑便时间;c-小肠推进率
图4 L.plantarum CCFM 8661对小鼠便秘相关指标的影响
Fig.4 Effect of L.plantarum CCFM 8661 on constipation-related indexes in mice
注:*表示与模型对照组比较差异显著,其中*代表P<0.05,****代表P<0.000 1(图5、图6同)。
应用不同剂量的L.plantarum CCFM 8661处理便秘小鼠后,其对便秘相关指标的影响不同。对于粪便含水量,结果如图4-a所示,不同剂量菌处理组与模型组相比虽无显著性差异,但具有提高粪便含水量的趋势。对于排首粒黑便时间,结果如图4-b所示,经不同剂量的L.plantarum CCFM 8661处理后,小鼠的排首粒黑便时间显著降低,且其降低整个肠道通过时间的效果与其浓度无关(P<0.05)。对于小肠推进率,结果如图4-c所示。经不同剂量L.plantarum CCFM 8661处理后,小鼠小肠推进率较模型组有提高,但并无显著性,其中低剂量组小鼠小肠推进率效果最好。
综合3种不同剂量L.plantarum CCFM 8661干预后对小鼠便秘3个表观指标的影响情况可知,低剂量L.plantarum CCFM 8661具有缓解便秘的潜力。这与我们前期临床试验的结果相一致。前期的临床结果发现,低剂量植物乳杆菌具有缓解便秘的效果,而高剂量的植物乳杆菌则会加重便秘症状。同时,唐田等[11]关于植物乳杆菌P9对小鼠功能性便秘作用研究中也表现出了中剂量组缓解效果优于高剂量组的相同结果,这就说明植物乳杆菌在缓解便秘时,其添加量并不是越多越好,需要在一定的范围内才能起到缓解疾病的目的,这可能与双歧杆菌与其竞争消化道定植位点,改变肠道pH、氧气含量等肠道内环境和肠道微生物组成有关[21]。
2.3 低剂量L.plantarum CCFM 8661能够调控小鼠血清中神经递质和炎症因子水平
2.3.1 L.plantarum CCFM 8661对小鼠血清中神经递质的影响
便秘会通过对胃肠调节递质和神经营养因子的影响,进而改变肠道的转运能力。胃肠调节递质可以分为兴奋型胃肠调节递质和抑制型胃肠调节递质,其含量的改变会使宿主肠道功能发生变化[22]。通过与模型组的比较探究L.plantarum CCFM 8661对小鼠体内便秘相关胃肠调节递质的影响,结果如图5所示。与模型对照组比较,低剂量组能够显著提高小鼠血清中4种兴奋型胃肠调节递质(MTL、GAS、SP、ACH)的含量,并且使4种抑制型胃肠调节递质(VIP、SS、PYY、5-HT)的含量显著降低(P<0.05);高剂量组的MTL含量较模型组有显著的升高(P<0.01),VIP、PYY、5-HT含量较模型组有显著的降低(P<0.05)。综合上述结果表明低剂量的L.plantarum CCFM 8661可改变由便秘所引起的胃肠调节递质的变化。这也与低剂量L.plantarum CCFM 8661可缓解便秘结果相一致,说明L.plantarum CCFM 8661可能是通过改变肠道内神经递质的含量进而发挥缓解便秘的效果。而L.plantarum CCFM 8661如何影响肠道内便秘相关胃肠调节递质的变化情况则是我们下一步的研究重点。
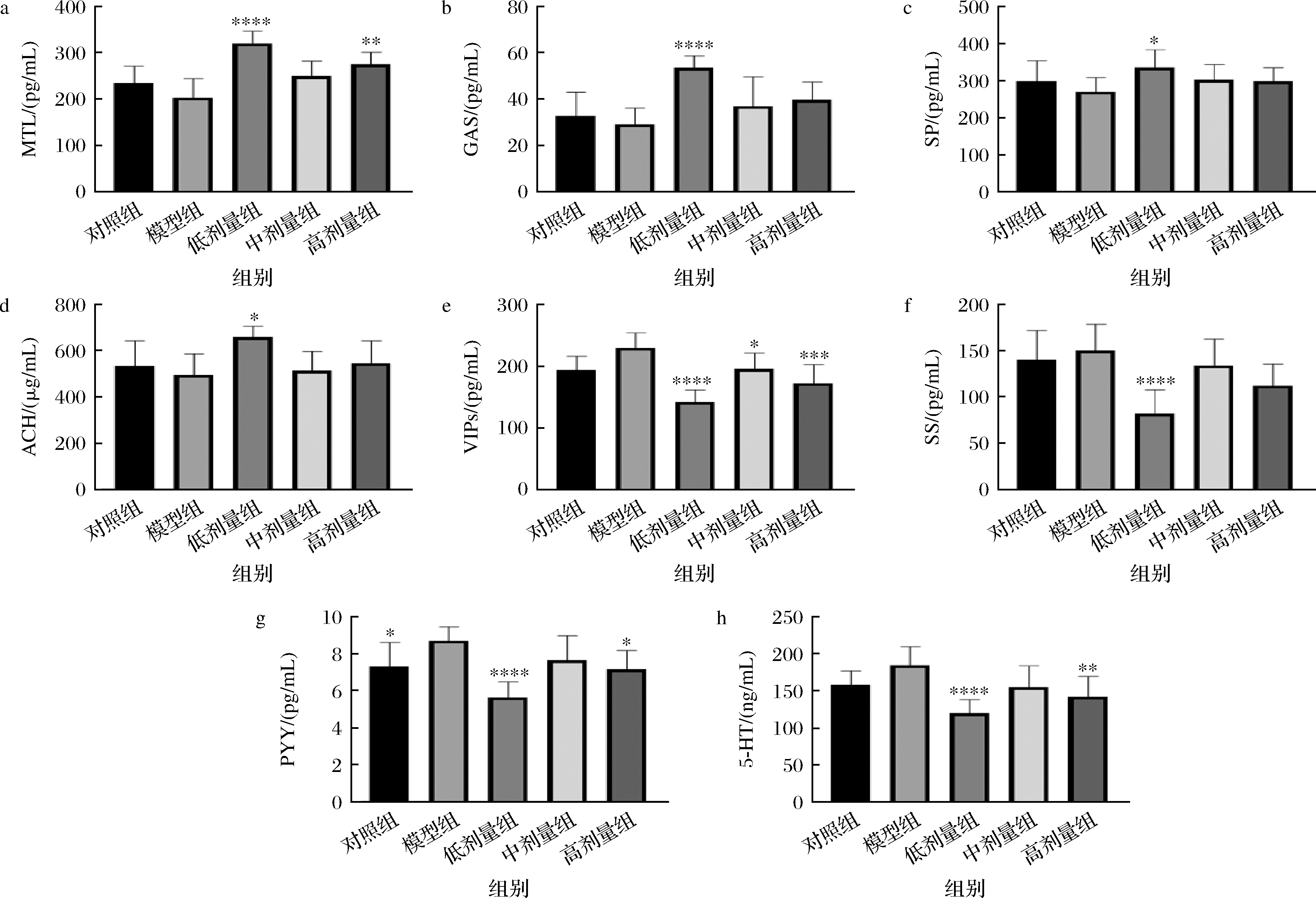
a-MTL;b-GAS;c- SP;d-乙ACH;e-VIP;f-SS;g-PYY;h-5-HT
图5 L.plantarum CCFM 8661对小鼠血清中神经递质的影响
Fig.5 Effects of L.plantarum CCFM 8661 on serum neurotransmitters in mice
注:*表示与模型对照组比较差异显著,其中**代表P<0.01,***代表P<0.001(图6同)。
2.3.2 L.plantarum CCFM 8661对小鼠血清中炎症因子的影响
促炎细胞因子由Th1细胞、CD4+细胞、巨噬细胞和树突状细胞分泌。其特征在于生成多种白细胞介素。例如IL-1、IL-2、IL-8、IL-12、IL-17, IL-18、IFN-γ和TNF-α等。本文主要针对几个关键的促炎细胞因子IL-1、IL-6、IL-8和抑炎细胞因子IL-10等展开研究。结果如图6所示。低剂量L.plantarum CCFM 8661处理组能显著下调小鼠血清中促炎细胞因子IL-1、IL-6、IL-8的含量,上调抑炎细胞因子IL-10的含量,而其他2个剂量处理组则对部分细胞因子有影响。此结果与低剂量L.plantarum CCFM 8661缓解便秘的结果相一致,说明L.plantarum CCFM 8661缓解便秘可能是通过改变小鼠体内炎症因子的水平实现的。这也与我们前期的研究结果,便秘同时伴有低水平的炎症,双歧杆菌在缓解便秘的同时,降低了由于便秘所引起的炎症因子的水平[23]。
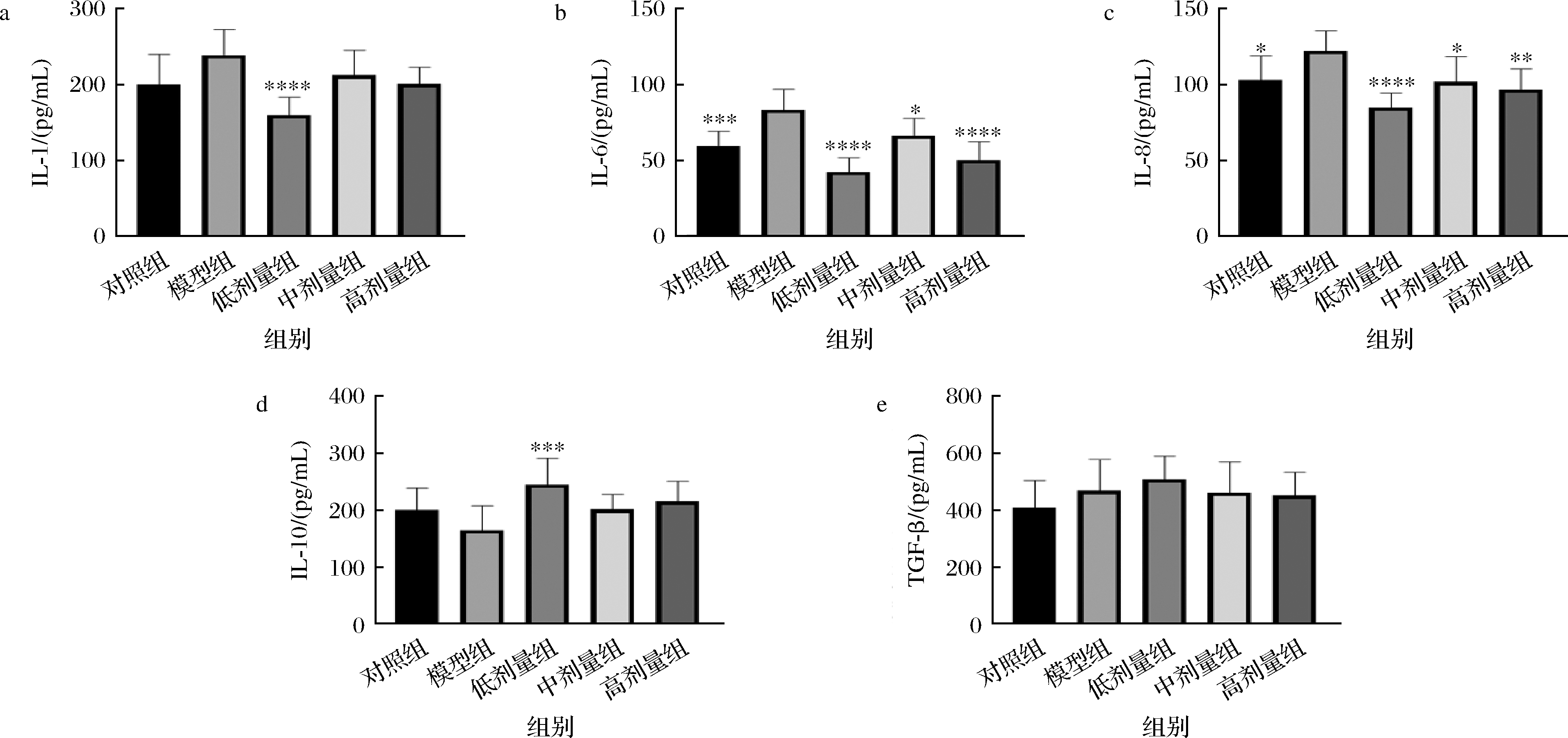
a-IL-1;b-IL-6;c-IL-8;d-IL-10;e-TGF-β
图6 L.plantarum CCFM 8661对小鼠血清中炎症因子的影响
Fig.6 Effects of L.plantarum CCFM 8661 on serum inflammatory factors in mice
2.4 L.plantarum CCFM 8661上调便秘小鼠粪便中乙酸含量
SCFAs主要包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸等,其产生主要是由于微生物发酵未被消化的碳水化合物或蛋白质。本文主要针对肠道内最主要的3种SCFAs(乙酸、丙酸、丁酸)进行检测。结果如图7所示,洛哌丁胺造模后便秘小鼠的乙酸、丙酸、丁酸的含量都有下降的趋势,不同剂量的L.plantarum CCFM 8661干预后,与模型组相比,低剂量组和高剂量组便秘小鼠粪便中乙酸的含量显著升高(P<0.05),而丙酸和丁酸含量并无统计学差异。众多研究显示便秘患者粪便中乙酸含量会出现下调的情况[24],我们的结果也提示L.plantarum CCFM 8661缓解便秘可能与粪便中乙酸含量上调有关,下一步拟定通过直接给予不同的SCFAs验证其对便秘的缓解作用。

a-乙酸;b-丙酸;c-丁酸
图7 L.plantarum CCFM 8661对便秘小鼠粪便中SCFAs含量的影响
Fig.7 Effect of L.plantarum CCFM 8661 on the content of SCFAs in the feces of constipated mice
3 结论
本研究针对L.plantarum CCFM 8661调节肠道菌群及缓解便秘效果展开研究。研究发现,宿主无论处于正常菌群状态下或处于菌群紊乱状态下,L.plantarum CCFM 8661的摄入都能显著改变宿主的肠道菌群,主要是提高宿主肠道内双歧杆菌和乳杆菌的含量,而对于肠杆菌、肠球菌和产气荚膜梭菌的数量无影响。同时低剂量的L.plantarum CCFM 8661的摄入具有缓解便秘的潜力,主要表现在提高了宿主整个肠道的蠕动时间,且其缓解便秘可能是通过调节宿主肠道内与便秘相关的胃肠调节递质的含量,上调SCFAs中乙酸水平,降低便秘所引起的宿主炎症因子的水平实现的。
[1] WANG J C, BAI X Y, PENG C T, et al.Fermented milk containing Lactobacillus casei Zhang and Bifidobacterium animalis ssp.lactis V9 alleviated constipation symptoms through regulation of intestinal microbiota, inflammation, and metabolic pathways[J].Journal of Dairy Science, 2020, 103(12):11025-11038.
[2] MOSTAFA S M, BHANDARI S, RITCHIE G, et al.Constipation and its implications in the critically ill patient[J].British Journal of Anaesthesia, 2003, 91(6):815-819.
[3] 刘瑜. 胃肠湿热型功能性便秘临床特点及清淡素食干预的疗效研究[D].北京:北京中医药大学, 2020.
LIU Y.Study on the clinical characteristics of gastrointestinal damp-heat functional constipation and the effect of light vegetarian intervention [D].Beijing:Beijing University of traditional Chinese Medicine, 2020.
[4] GHOSHAL U C.Chronic constipation in Rome IV era:The Indian perspective[J].Indian Journal of Gastroenterology, 2017, 36(3):163-173.
[5] HUANG L S, ZHU Q, QU X, et al.Microbial treatment in chronic constipation[J].Science China(Life Sciences), 2018, 61(7):744-752.
[6] 张群.新型益生菌发酵乳制品的研究与开发[J].食品与生物技术学报,2015,34(6):672.
ZHANG Q.Research and development of novel probiotic fermented dairy products[J].Journal of Food Science and Biotechnology, 2015,34(6):672.
[7] 田丰伟, 翟齐啸, 孙媛媛, 等.缓解铅毒性植物乳杆菌CCFM8661的微生物学性质及其应用的研究[J].食品安全质量检测学报, 2014, 5(4):1010-1015.
TIAN F W, ZHAI Q X, SUN Y Y, et al.A preliminary study of microbiological properties and applications of Lactobacillus plantarum CCFM8661[J].Journal of Food Safety and Quality Inspection, 2014, 5(4):1010-1015.
[8] 殷瑞杰. 植物乳杆菌CCFM8661吸附铅离子及缓解肠细胞铅毒性的机制解析[D].无锡: 江南大学, 2016.
YIN R J.Mechanism of Pb2+ removal and cytotoxicity alleviation by L.plantarum CCFM8661[D].Wuxi: Jiangnan University, 2016.
[9] 余雅琦. 植物乳杆菌CCFM8661缓解铅毒性与肠道菌群的关联性研究[D].无锡:江南大学, 2021.
YU Y Q.The correlation analysis of lead toxicity alleviation and gut microbiota regulation by Lactobacillus plantarum CCFM8661[D].Wuxi:Jiangnan University, 2021.
[10] 彭芝榕, 刘晓梅, 倪学勤, 等.植物乳杆菌F1208对便秘大鼠胃肠道功能的影响[J].食品科学, 2013, 34(13):243-246.
PENG Z R, LIU X M, NI X Q, et al.Effect of Lactobacillus plantarum F1208 on gastrointestinal functions in constipated rats[J].Food Science, 2013, 34 (13):243-246.
[11] 唐田, 沈真如, 石璐, 等.植物乳杆菌P9对小鼠功能性便秘的作用及机制[J].食品科学, 2023, 44(9):123-130.
TANG T, SHEN Z R, SHI L, et al.Effect and mechanism of Lactobacillus plantarum P9 on functional constipation in mice[J].Food Science, 2023, 44(9):123-130.
[12] 李鑫. 复合型黑蒜通便功能饮料的研究与开发[D].天津:天津科技大学, 2015.
LI X.Research and development of laxative functional black garlic beverage[D].Tianjin:Tianjin University of Science and Technology, 2015.
[13] 李亦汉, 王琳琳, 赵建新, 等. 两歧双歧杆菌CCFM1167通过提升肠道中乙酸水平以抑制炎症从而缓解便秘. 食品与发酵工业, 2023, 49(6):35-41.
LI Y H, WANG L L, ZHAO J X, et al. Constipation relief by increasing intestinal acetate level to suppress inflammation using Bifidobacterium bifidum CCFM1167. Food and Fermentation Industries, 2023, 49(6):35-41.
[14] 毛丙永. 功能性低聚糖对肠道细菌的影响及机制[D].无锡:江南大学, 2015.
MAO B Y.Effects of functional oligosaccharides on the gut bacteria and the mechanism[D].Wuxi:Jiangnan University, 2015.
[15] WANG J J, TANG H, ZHANG C H, et al.Modulation of gut microbiota during probiotic-mediated attenuation of metabolic syndrome in high fat diet-fed mice[J].The ISME Journal, 2015, 9(1):1-15.
[16] 何竹筠. 双歧杆菌对2’-岩藻糖基乳糖的利用及对小鼠肠道微生态影响的研究[D].无锡:江南大学, 2021.
HE Z Y.Study on the utilization of 2’-fucosyllactose by Bifidobacterium and its effect on intestinal microecology of mice[D].Wuxi:Jiangnan University, 2021.
[17] 刘伟贤, 郝婧宇, 陈希民, 等.副干酪乳杆菌K56调节肠道菌群及润肠通便功能研究[J].食品工业科技, 2020, 41(20):279-284.
LIU W X, HAO J Y, CHEN X M, et al.Improvement in intestinal flora regulation and laxative function to Lactobacillus paracasei K56[J].Science and Technology of Food Industry, 2020, 41(20):279-284.
[18] MA C C, WASTI S, HUANG S, et al.The gut microbiome stability is altered by probiotic ingestion and improved by the continuous supplementation of galactooligosaccharide[J].Gut Microbes, 2020, 12(1):1785252.
[19] 唐欢. 抗生素所致肠道菌群失衡及乳杆菌对其调节作用的研究[D].重庆:第三军医大学, 2007.
TANG H.Enteric dysbacteriosis caused by antibiotic and modulation of the intestinal microflora by Lactobacillus spp[D].Chongqing:Third Military Medical University, 2007.
[20] 曾献春, 朱雅琴, 王明明, 等.干酪乳杆菌对便秘小鼠肠道菌群的影响[J].食品与发酵工业, 2022, 48(6):64-70.
ZENG X C, ZHU Y Q, WANG M M, et al.Effect of Lactobacillus casei on intestinal flora of mice with constipation[J].Food and fermentation Industries, 2022, 48(6):64-70.
[21] 孙笑非, 温俊.益生菌调节肠道菌群的作用机制及研究进展[J].饲料研究, 2010(4):56-58.
SUN X F, WEN J.Mechanism and research progress of probiotics regulating intestinal flora[J].Feed Research, 2010(4):56-58.
[22] 张程程. 中国不同地区人群肠道中长双歧杆菌的生理特性及肠道调节功能分析[D].无锡:江南大学, 2021.
ZHANG C C.Analysis of physiological characteristics and intestinal regulatory function of intestinal Bifidobacterium in different regions of China [D].Wuxi:Jiangnan University, 2021.
[23] 柴茂. 双歧杆菌对便秘的缓解作用及其机制分析[D].无锡:江南大学, 2021.
CHAI M.Analysis of the alleviation effects on constipation by Bifidobacterium and its mechanisms[D].Wuxi:Jiangnan University, 2021.
[24] NIWA T, NAKAO M, HOSHI S, et al.Effect of dietary fiber on morphine-induced constipation in rats[J].Bioscience Biotechnology and Biochemistry, 2002, 66(6):1233-1240.