畜禽鲜骨是畜禽肉加工过程中产生的副产物,富含极高的营养价值[1]。我国肉鸡总产量居世界前列,鸡骨资源非常丰富,鸡骨中含有约51%的水分、19%的蛋白质和15%的灰分,目前,我国有少部分鸡骨被加工成骨粉、骨泥等低价值产品,并没有实现鸡骨的高值化利用,造成了蛋白资源浪费[2]。
研究表明,鸡骨被酶水解后,蛋白质被催化分解,释放出大量的呈味游离氨基酸,是风味物质的重要前体物,具有制作调味料基料的潜质[3]。此外,发酵技术有助于促进鸡骨中风味前体物的产生,可以改善产品的风味[4]。而通过酶解-发酵联用技术能够改善产品风味,产生功能性物质,因此利用酶解-发酵技术制备肉类风味香精具有广阔的应用前景。
YANG等[5]研究表明超声预处理草鱼蛋白水解物后,可以促进草鱼蛋白水解物发生美拉德反应,并且可以改善美拉德反应产物的风味。美拉德反应能够改善蛋白质水解物的风味、稳定性、溶解性、黏度等功能特性,同时影响美拉德反应产物的抗氧化性、抑菌性、降血压、消化性等性质[6]。蛋白酶水解和美拉德反应的结合可以有效改善产品的风味:降低鸡骨提取物的口味,改善口感、新鲜度[6]。蛋白质水解物的美拉德反应涉及许多因素,包括游离氨基和羰基的比例、温度、时间、pH值等,此外,研究发现超声处理、微波处理等外在的处理方式会影响美拉德反应速率。超声波通过机械作用、空化效应作用于反应物质,产生巨大的压力、剪切应力、动态搅拌和温度梯度,超声协同热处理改变了空间结构,加快分子间的反应速度,促进了美拉德反应的进行[7]。目前,关于美拉德反应制备鸡骨香精基料的研究较少,因此,对鸡骨香精基料及其活性的研究具有重要意义。
本实验以鸡骨为原料,加入木瓜蛋白酶和风味蛋白酶进行酶解,接种发酵剂,制成鸡骨酶解发酵液,在此基础上添加糖和氨基酸进行美拉德反应,制成鸡骨香精基料,对比热处理、超声协同热处理制备鸡骨香精基料的美拉德反应体系及挥发性物质的相对含量,并测定鸡骨香精基料的抗氧化活性、血管紧张素转换酶(angiotensin-converting enzyme,ACE)抑制活性、胆固醇抑制率等活性,旨在明确超声处理对鸡骨香精基料美拉德反应程度及活性的影响,以期为开发具有抗氧化活性和抑制活性的高品质肉味衍生化产品提供一定参考,并实现鸡骨的高值化利用。
1 材料与方法
1.1 材料与试剂
鸡骨架购于银川市同心路综合市场;木瓜蛋白酶(100 000 U/g)、风味蛋白酶(15 000 U/g)(食品级),夏盛生物科技开发有限公司;植物乳杆菌冻干粉,济南金雨源生物技术有限公司;戊糖片球菌冻干粉,上海北诺有限公司;D-木糖、L-丙氨酸、L-半胱氨酸、L-精氨酸、维生素C、维生素B1、酵母抽提物(食品级),英博生物科技有限公司;葡萄糖(食品级),济南铭锋生物科技有限公司;食盐(食品级),银川聚信汇科生物技术有限公司;ABTS,上海麦克林生化科技有限公司;血管紧张素转换酶、马尿酰-组氨酰-亮氨酸(Hip-His-Leu,HHL),美国Sigma试剂公司。
1.2 仪器与设备
SE-150型高速万能粉碎机,北京科一电器有限公司;LRH-150-B型生化培养箱,广州瑞丰实验设备有限公司;DSX-280型手提式压力蒸汽灭菌锅,山东欧莱博医疗器械;pHS-2F型pH计、970CRT型荧光分光光度计,上海仪电科学仪器股份有限公司;KQ-500DE型数控超声波清洗器,河南博汇机械设备有限公司;DP-400型色差仪,柯尼卡美能达公司;UV-18000304042502型紫外可见光分光光度计,日本岛津;Agilent 5975GC-MSD型气质联用仪质谱仪 安捷伦科技有限公司;GL-10C型高速冷冻离心机,济南好来宝医疗器械有限公司。
1.3 实验方法
1.3.1 鸡骨香精基料制备
在前期研究[8]的基础上,建立鸡骨酶解发酵液美拉德反应体系。向鸡骨泥中添加木瓜蛋白酶8.15 g/kg,55 ℃条件下水解4 h,风味蛋白酶8 g/kg,55 ℃条件下水解3 h,酶解完成后在90 ℃条件下进行灭菌,得到鸡骨酶解液,接入发酵剂(植物乳杆菌:戊糖片球菌为1:1),发酵温度为33 ℃,发酵剂接种量为6%,发酵时间为49 h,得到鸡骨酶解发酵液;香精配料为:L-半胱氨酸和酵母提取物2%,L-丙氨酸1%,L-精氨酸2.5%,维生素C和维生素B1 0.8%,木糖和葡萄糖3%,食盐0.6%,放入美拉德反应瓶中,使原料全部溶解,调节pH值至6.0,置于105 ℃油浴锅中反应50 min,发生美拉德反应得到鸡骨香精基料。每10 min从油浴锅中取美拉德反应产物,用冰浴停止反应,用高速冷冻离心机以10 000 r/min离心10 min,得到测试原液,测定美拉德反应程度及生物活性。
1.3.2 超声协同热处理
参考刘伟[9]的方法,先将鸡骨酶解发酵液超声处理30 min,超声条件为:超声功率因数60%(900 W),超声温度保持在(60±3) ℃,再置于105 ℃油浴锅中热处理50 min发生美拉德反应。
1.3.3 色泽测定
参考TAN等[10]的方法并略作修改,使用色度计测定美拉德反应产物的颜色,色度计的校准使用白色标准板(L*=95.28,a*=-0.14,b*=0.95)。
1.3.4 中间产物的测定
参考TAN等[10]的方法并略作修改,取测试原液用去离子水稀释20倍,于最大吸收波长294 nm处测定吸光度。
1.3.5 褐变程度的测定
参考TAN等[10]的方法并略作修改,取测试原液用去离子水稀释20倍,于最大吸收波长420 nm处测定吸光度。
1.3.6 荧光光谱的测定
参考TAN等[10]的方法并略作修改,取测试原液稀释16倍,用荧光分光光度计进行测定:荧光光谱激发波长为417 nm,扫描发射波长为200~450 nm,狭缝宽度为10 nm,灵敏度为1。
1.3.7 挥发性物质的测定
参考依胜男等[11]的方法并略作修改,固相微萃取(DVB/CAR/PDMS 50 μm):取5 mL鸡骨香精基料置于20 mL的顶空瓶中,温度50 ℃,水浴平衡10 min,顶空吸附30 min,进样分析,解析5 min,温度为250 ℃。
GC条件:DB-5MS毛细管柱(30 mm×0.25 mm×0.5 μm,Agilent Techonologies),载气为高纯氦气,起始温度设定为40 ℃,持续3 min后,以5 ℃/min升温到230 ℃,持续3 min,共40 min。恒定流速为1.2 mL/min,不分流。
MS条件:GC-MS接口温度为200 ℃,质谱库NIST17.L,质谱质量扫描范围40~450 amu。各挥发性物质相对含量(%)按照峰面积归一化法计算。
1.3.8 抗氧化活性的测定
1.3.8.1 DPPH自由基清除活性的测定
参考XIONG等[12]的方法并略作修改,将超声协同热处理制备的测试原液稀释20倍,取2 mL加入2.0 mL DPPH溶液(0.20 mmol/L),振荡混匀,置于阴凉处避光静置30 min,于最大吸收波长517 nm处测定其吸光度,阳性对照为样液与无水乙醇溶液以及无水乙醇与DPPH溶液。
1.3.8.2 超氧阴离子自由基清除活性的测定
参考张亚琨等[13]的方法,取5 mL Tris-HCl(0.05 mol/L)缓冲溶液,25 ℃下预热20 min,将超声协同热处理制备的测试原液稀释20倍,取1 mL加入500 μL邻苯三酚溶液(3 mmol/L),混合均匀,继续反应5 min,添加1 mL盐酸(8 mmol/L)停止反应,于最大吸收波长299 nm处测定吸光度。
1.3.8.3 ABTS阳离子自由基清除活性的测定
参考TAN等[10]的方法并略作修改,取0.352 mL K2S2O8溶液(140 mmol/L)和20 mL ABTS阳离子溶液(7 mmol/L),在室温下避光反应12~16 h,用无水乙醇稀释至在734 nm处的吸光度为0.7±0.02,取5 mL该溶液,将测试原液稀释20倍,取50 μL样液与之混合,在室温下避光反应6 min,于734 nm处测定吸光度。
1.3.9 ACE抑制活性的测定
参考LI等[14]的方法并略作修改,反应开始后,每间隔10 min取超声协同热处理制备的测试原液15 μL,添加30 μL HHL(2 mg/mL)溶液和ACE酶液(12.5 mg/mL),置于96孔酶标板,混合均匀后在37 ℃条件下反应60 min,立即加入120 μL NaOH(1.2 mol/L)溶液停止反应,加入30 μL 2%的邻苯二甲醛溶液,混合均匀,室温下静置20 min,添加30 μL的HCl(6 mol/L)溶液停止反应。测定荧光强度:激发波长340 nm,扫描发射波长300~600 nm,狭缝宽度10 nm,灵敏度为2。
1.3.10 体外降胆固醇能力的测定
参考李晶等[15]的方法并略作修改,制备1 mg/mL的胆固醇标准液,配制胆固醇标准系列溶液,测定混合液在550 nm处的吸光度,以胆固醇浓度为横坐标,吸光值为纵坐标,绘制胆固醇标准曲线,计算回归方程。根据不加测试原液的胆固醇标准溶液的吸光值A0,添加与之相同量的测试原液测得吸光度A1,带入回归方程得到美拉德反应产物的胆固醇浓度ω0和ω1,计算胆固醇抑制率,如公式(1)所示:
胆固醇抑制率![]()
(1)
1.4 数据处理
所有实验进行3次平行,采用Excel 2010对数据进行统计并做标准差,采用SPSS 21.0对数据进行显著性分析,P<0.05表示差异显著,采用Origin 2019对数据进行处理并绘图。
2 结果与分析
2.1 色泽分析
美拉德反应底物的糖基化程度可以通过反应过程中的颜色变化来判断[10]。由图1可知,不同处理方式不同反应时间之间的a*、b*、L*在反应第10~50 min时差异性均显著(P<0.05)。随热反应时间延长,各处理组鸡骨香精基料的L*值呈下降趋势,a*值呈上升趋势,b*值呈降低趋势,说明随反应时间延长,鸡骨香精基料的色泽逐渐变暗,红色加深,黄色变浅,这是由于加热时间延长,美拉德反应产物不断增加,类黑精物质累计,导致颜色不断加深,且加热时间增加,美拉德反应程度越高,颜色变化越明显。另外,超声协同热处理组的a*值始终高于热处理组,L*值在反应第20 min时高于热处理组,剩余时间均低于热处理组,b*值在反应第10 min时高于热处理组,剩余时间均低于热处理组,说明经超声处理过的鸡骨香精基料色泽较暗,亮度更低。美拉德反应产生的棕色黑色素会使L*持续下降,由于黑色素的积累,美拉德反应产物会产生红色和黄色。经超声处理后,鸡骨蛋白的三级结构得到更广泛的扩展,使美拉德反应产物具有更好的溶解性,有利于颜色产生;超声波的物理和机械作用改变了鸡骨香精基料的蛋白质性质,这可能会加速美拉德反应过程,导致黑色素增加,因此色泽变化更为明显[16]。

a-L*;b-a*;c-b*
图1 鸡骨香精基料的色泽变化
Fig.1 Changes of color of chicken bone essence basic material
注:同一种处理方式不同反应时间之间的差异性用小写字母表示(P<0.05),同一反应时间不同处理方式之间的差异性用大写字母表示(P<0.05)。
2.2 中间产物及褐变程度分析
鸡骨香精基料中间产物及褐变程度的变化如图2所示。在美拉德反应中产生的二羰基化合物(如酮类和醛类)可在294 nm处进行测量[17],可反映美拉德反应的中间产物变化。由于色素产物的形成,美拉德反应通常伴随着褐变,因此褐变程度(A420 nm)可以反映样品美拉德反应的剧烈程度[17]。由图2可知,超声协同热处理组的样品其在294、420 nm处的吸光度始终高于热处理组,且随着时间延长而增加,中间产物的变化趋势与褐变程度相一致,原因可能是因为鸡骨蛋白被酶解后,三级结构被破坏,蛋白质链上的氨基裸露出来,然后在酶的作用下,蛋白链的肽键被破坏,分解为小分子的肽链或游离氨基酸,而超声处理改变了鸡骨蛋白的高级结构,促进了鸡骨的酶解,产生了更多肽和氨基酸[17]。因此可得出结论:超声协同热处理可使鸡骨香精基料美拉德反应产物的中间产物和褐变程度增强,类黑精含量增多。

a-中间产物;b-褐变程度
图2 鸡骨香精基料A294nm吸光度及褐变程度的变化
Fig.2 Changes of intermediate products and browning degree of chicken bone essence basic material
2.3 荧光光谱分析
不同处理方式对鸡骨香精基料荧光光谱如图3所示。荧光化合物出现在可见棕色色素形成之前,因此可用作美拉德反应初始阶段的指示剂[17]。由图3可知,不同反应时间产生的美拉德反应产物其荧光光谱仅呈现单峰,且各处理组鸡骨香精基料的荧光强度随着时间延长呈现逐步增长的趋势,当处理时间为50 min时,热处理和超声协同热处理的样品荧光强度均达到峰值(414 nm处),分别为127、238,表明随着加热时间延长,美拉德反应过程中产生了更多的荧光化合物,考虑原因可能是随着加热时间延长,蛋白质的肽键被破坏,暴露出更多的酪氨酸(Tyr)和色氨酸(Trp)残基,酪蛋白发生去折叠现象,使更多具有荧光吸收能力的苯环基团裸露,从而增加了对荧光的吸收,使荧光强度增加。而在荧光强度达到峰值后荧光强度的降低可能是因为木糖与蛋白酶解物发生共价反应,美拉德产物的空间位阻增加,氨基酸吸收荧光的信号被屏蔽,使荧光强度降低[18],也有学者认为荧光化合物是美拉德反应混合物的前体,而不是最终产物[19]。LI等[19]对山药多糖美拉德反应产物的荧光强度进行测定,发现山药多糖美拉德反应产物的荧光强度在426 nm处达到峰值,达到最大值后荧光强度呈下降趋势,与本实验结论相一致。另外,经超声预处理的样品,荧光强度始终高于热处理的样品,考虑原因可能是超声使蛋白质分子链伸展,蛋白质分子之间的疏水键被破坏,暴露出更多的疏水性基团,进而导致荧光强度增加[17],因此超声协同热处理有利于美拉德反应生成荧光化合物,促进美拉德反应的进行。
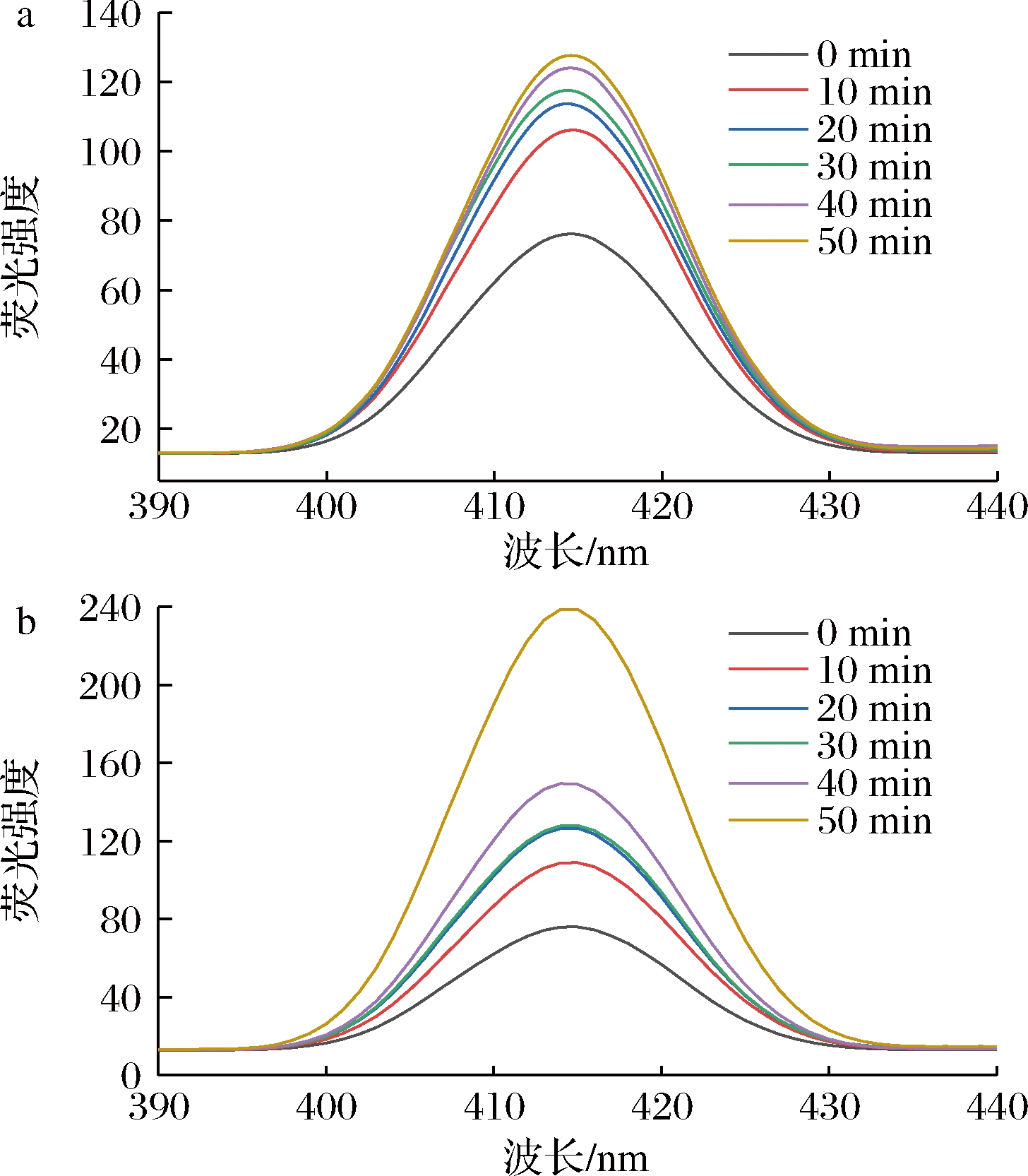
a-热处理;b-超声协同热处理
图3 鸡骨香精基料荧光光谱的变化
Fig.3 Changes in the fluorescence spectra of chicken bone essence basic material
2.4 挥发性物质分析
不同处理方式的鸡骨香精基料挥发性物质总离子流图如图4所示。结合图4和表1容易看出,热处理过的鸡骨香精基料美拉德反应体系共检测出22种挥发性风味物质;超声协同热处理过的鸡骨香精基料美拉德反应体系共检测出26种挥发性风味物质。可分为七类,其中醛类物质5种、醇类物质4种、酮类物质2种、酚类物质1种、酯类物质3种、烷烃类物质7种、杂环类化合物10种。热处理组中烷烃类占比最高,相对含量为34.77%,杂环类次之,占比为22.81%;超声协同热处理组中同样烷烃类和杂环类占比最高,分别为30.30%、24.44%。
表1 美拉德反应体系中的挥发性物质
Table 1 Volatile substances in Maillard reaction system

化合物种类化合物名称挥发性物质相对含量/%热处理超声协同热处理醛类正己醛4.504.51正庚醛1.091.02壬醛2.762.742,5-二羟基苯甲醛1.121.053-羟基-4-甲氧基苯甲醛-1.27总和9.4710.59醇类二甲基-硅烷二醇-2.961-辛烯-3-醇-0.372-甲基-3-呋喃硫醇2.04-1-辛醇-0.581-金刚烷醇0.250.252-糠硫醇0.741.234-甲基-5-噻唑乙醇-6.23总和3.0311.62酮类5-甲基-2-己酮1.421.224-羟基-5-甲基-3(2H)-呋喃酮-1.134,6'-二甲氧基-2'-(叔丁基二甲基硅)氧查尔酮0.23-总和1.652.35酚类2,4-二叔丁基苯酚0.470.59酯类甲酸辛酯0.42-9-十六碳烯酸乙酯0.710.82正己酸乙烯基酯-0.39总和1.131.21烷烃六甲基-环三硅氧烷7.876.14八甲基-环四硅氧烷6.115.64十甲基-环戊硅氧烷8.938.12十二甲基-环六硅氧烷8.67.84十四甲基-环庚硅氧烷1.821.95辛弗林,N,O,O'-三甲基三甲硅烷基-0.61苯基五甲基二硅氧烷1.44-总和34.7730.30杂环化合物2-戊基-呋喃21.5422.861,4-二甲基-吡唑-0.312-正庚呋喃0.250.293,3'-二硫代双-2-甲基-呋喃0.490.981,2,3,6-四氢-1-亚硝基吡啶0.53-总和22.8124.44
注:-,未检出。
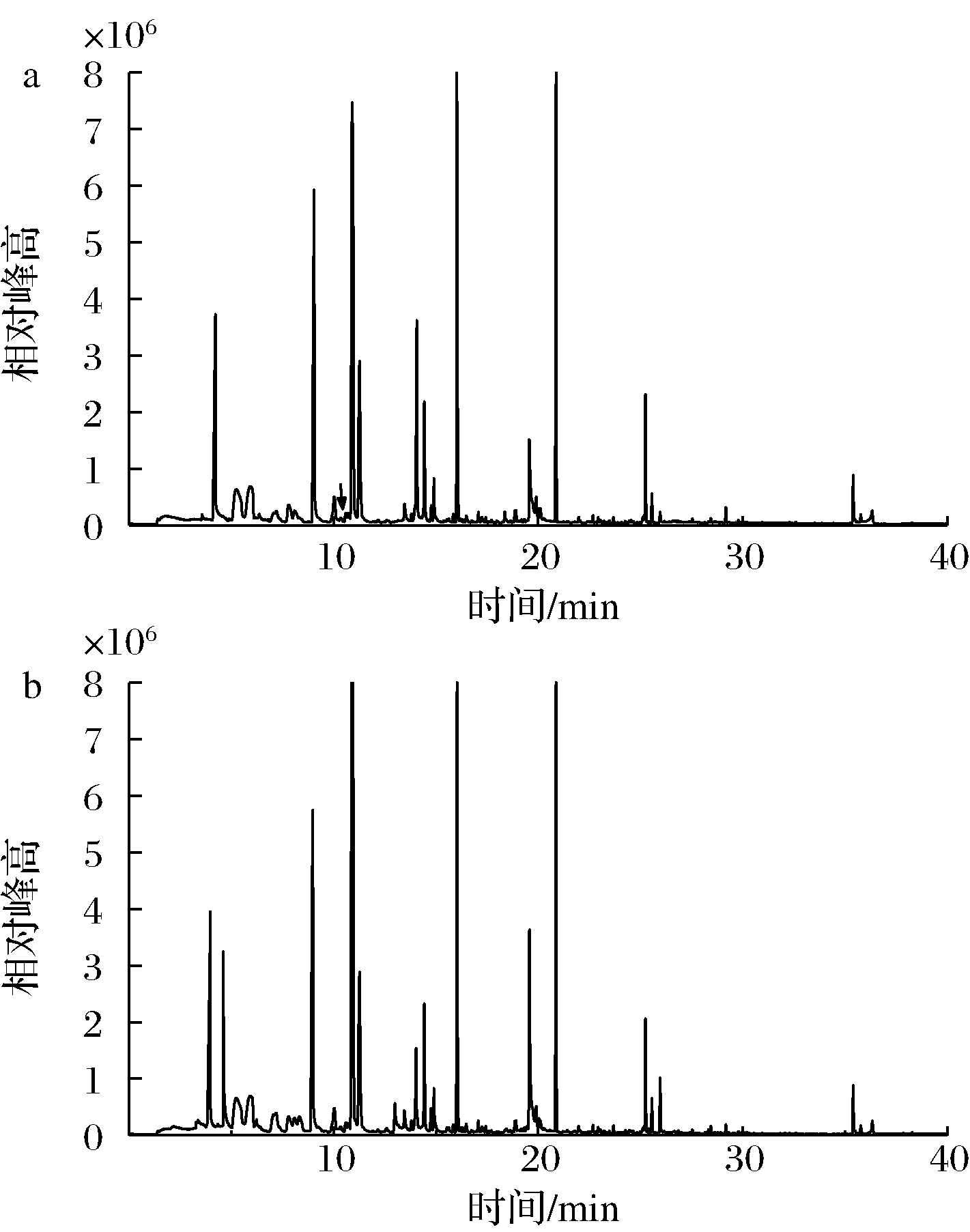
a-热处理;b-超声协同热处理
图4 鸡骨香精基料挥发性物质总离子流图
Fig.4 The total ion current diagrams of volatile substances in chicken bone essence basic material
SUN等[20]证明用鸡骨的美拉德反应制作的广东香肠具有良好的质地和感官特性,也有论文描述了从海鲜副产品和羊骨中制备风味化合物[21-22]。研究发现,醛类物质主要来自脂肪的氧化分解以及戊糖和氨基酸的热降解,由于醛的气味阈值极低,因此,醛类物质是美拉德反应体系极重要的芳香化合物,其中苯甲醛具有坚果和水果香气[23]。由表1可以看出,超声处理过的样品,醛类物质含量较高。含硫化合物主要提供低阈值的肉类风味,醇类物质也是美拉德反应产物中重要的挥发性化合物,1-辛烯-3-醇可以改善或增强肉类风味,且只在超声处理过的样品中检测到了1-辛烯-3-醇。而醇酮类、酚类物质相对含量较低,这些物质气味阈值较高,对产物香气无明显影响,但可以协调补充产物的整体香气。杂环类化合物相对含量最高,而且杂环类化合物阈值较低,很有可能是鸡骨香精基料中的主体风味物质,呋喃类化合物是肉制品的主要杂环化合物,主要提供烧烤和海鲜风味,且超声处理过的鸡骨酶解发酵液,其呋喃类化合物含量较高,这可能与超声协同热处理过程中,木糖环化的加剧有关,其他杂环类化合物也贡献烤香、焦甜香、坚果香、肉香等风味,其中2-戊基-呋喃相对含量最高,呈现豆腥味[24]。美拉德反应体系中最重要的呈味物质是醛类和杂环类化合物,超声处理得到的鸡骨香精基料中醛类化合物和杂环类化合物均高于热处理组,同样证明超声可促进美拉德反应的发生。
2.5 抗氧化活性分析
由图5可知,随着时间延长,鸡骨香精基料的抗氧化活性呈现先增加后降低的趋势。DPPH自由基清除率在反应第20 min时最高,为95.45%,ABTS阳离子自由基、超氧阴离子自由基清除率在反应进行到30 min时最高,分别为83.82%和90.63%。抗氧化活性增加的原因可能是美拉德反应产物中一些还原性化合物的氢键被破坏,使更多羟基裸露出来,从而提供氢电子,氢电子的还原性对其他物质发生氧化具有抑制作用[12]。美拉德反应产物中类黑精的抗氧化特性部分归因于这些化合物的金属螯合能力,类黑精的阴离子能够螯合过渡金属,另外,类黑精组分可以清除多种活性氧,可清除自由基[25]。美拉德反应产物通过提供氢清除DPPH自由基,形成稳定的DPPH-H分子。通过接受美拉德反应产物中的氢自由基,DPPH的颜色从紫色变为黄色,从而形成稳定的分子[15]。ABTS阳离子自由基的主要清除机制是电子转移,抗氧化剂为ABTS阳离子自由基提供电子以产生聚合物产品,并将ABTS阳离子溶液的颜色从绿色变为无色[15],这些结果可以表明,美拉德反应和发酵水解破坏了蛋白质结构,可以对鸡骨酶解发酵液的还原能力产生积极影响。此外,超声波作用增强了氨基和羰基之间的分子运动,产生更多的抗氧化剂,这些结果可以表明超声可以改变美拉德反应产物的抗氧化性能[12]。抗氧化活性降低的原因可能是在反应后期,大量的氨基酸、多肽被消耗,美拉德反应产物减少,这也可能导致抗氧化活性降低。
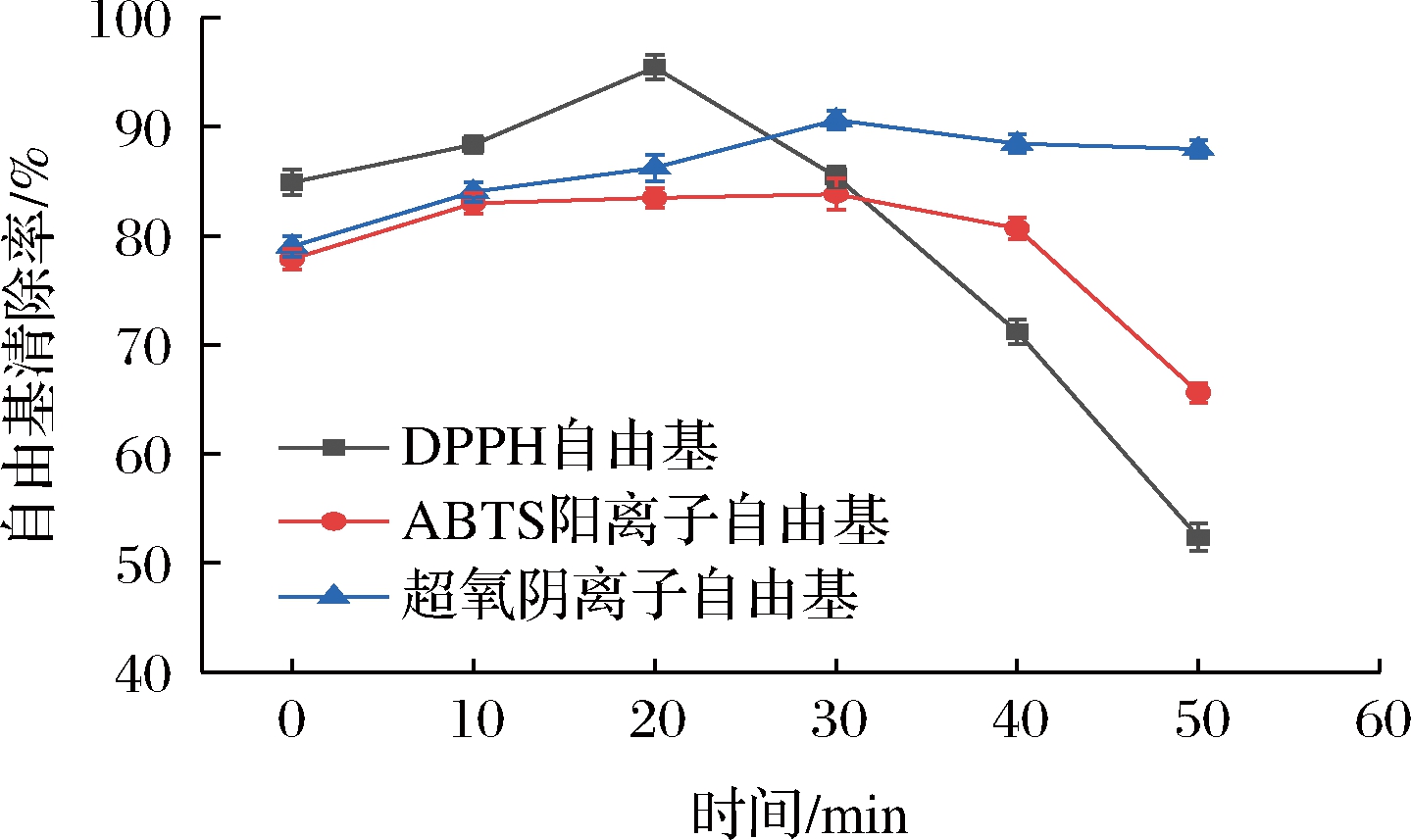
图5 鸡骨香精基料的自由基清除活性
Fig.5 Radical scavenging activity of chicken bone essence basic material
2.6 ACE抑制活性分析
由图6可知,美拉德反应产物的ACE抑制活性呈先上升后下降的趋势,与自由基清除活性的变化趋势相一致。ACE在调节动脉血压中起关键作用,血管紧张素Ⅰ由肾素水解产生,ACE可催化血管紧张素Ⅰ转化为血管紧张素Ⅱ(血管收缩剂),血管紧张素Ⅱ可使具有血管舒张作用的缓激肽失活,还能与血管紧张素Ⅱ 1型(AT1)受体结合,导致血管收缩和血压升高[26]。反应至40 min时,ACE抑制活性由53.25%增加到89.997%,ACE抑制活性增加的原因可能是超声空化效应使蛋白分子的分散性增加,加速了美拉德反应过程中具有ACE抑制活性的物质释放,导致ACE抑制活性增加,在反应至50 min时,ACE抑制活性降低至84.39%,原因可能是美拉德反应消耗了具有ACE抑制活性的肽,导致ACE抑制活性降低[26]。研究发现,美拉德反应产物类黑精具有ACE抑制作用,目前,已经研究了从咖啡、啤酒、甜酒中分离的纯类黑素的体外ACE抑制活性,具备潜在的抗高血压活性[26]。LI等[27]研究发现,大豆分离物具有ACE抑制活性,从中分离鉴定出一种化合物C15H21NO7,推测是苯丙氨酸与葡萄糖通过美拉德反应形成的共轭物,证实了美拉德反应产物在豆瓣酱ACE抑制活性中的重要作用。
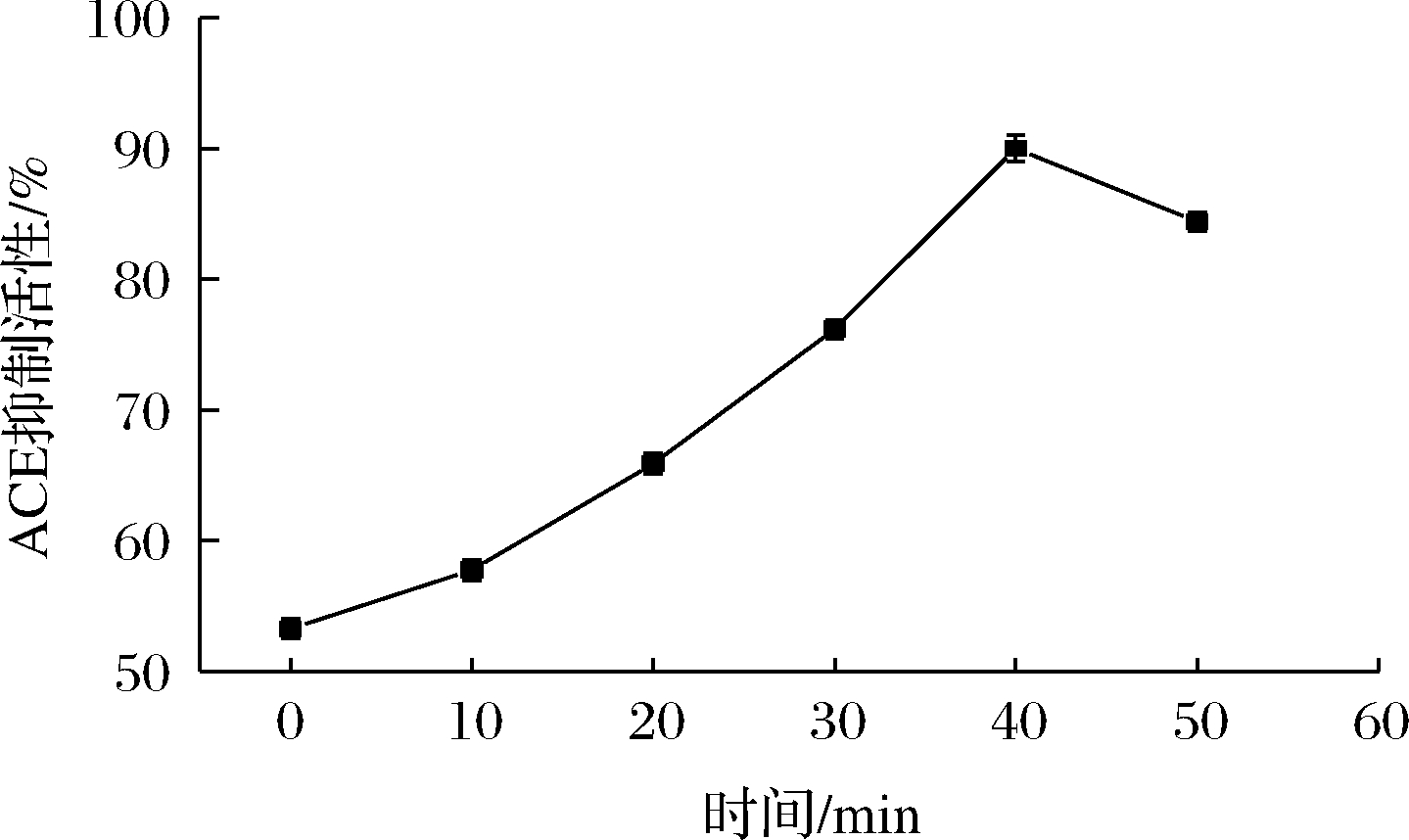
图6 鸡骨香精基料的ACE抑制活性
Fig.6 ACE inhibitory activity of chicken bone essence basic material
2.7 体外降胆固醇能力分析
由图7可知,随反应时间延长,美拉德反应产物的体外降胆固醇能力在10~50 min呈上升趋势。这可能是由于随反应时间延长,美拉德反应程度加剧,美拉德反应体系中类黑精物质及其他生物活性物质不断积累,改善了鸡骨香精基料的降胆固醇能力,另一方面,胆固醇抑制活性与肽的疏水性有关,超声能够使鸡骨蛋白中的疏水基团外露,从而提高鸡骨香精基料的降胆固醇能力[28]。PAK等[29]确定疏水性是导致胆固醇降低的关键因素,而脯氨酸残基是关键的组成部分,此外,疏水性和与胆汁酸结合的能力之间的相关性表明,具有高胆汁酸结合能力的多肽可以抑制回肠中胆汁酸的吸收并降低血清胆固醇水平。还有学者研究发现美拉德反应协同发酵显著提高了乳蛋白的抗血栓活性水平和3-羟基-3-甲基戊二酰辅酶A还原酶抑制作用,但并未改变胶束胆固醇溶解度的活性水平,同时美拉德反应增强了乳蛋白的抗氧化性能,确定了美拉德反应产物中产生的小分子大小的化合物,这些化合物具有更高的心血管预防作用,因此,发酵的美拉德反应产物可用于降低氧化应激,血小板聚集和胆固醇合成[30]。但是关于美拉德反应产物的抑制机理还未有明确报道,需要进一步探究。

图7 鸡骨香精基料的体外降胆固醇能力
Fig.7 Cholesterol lowering ability of chicken bone essence basic material
3 结论
本研究基于美拉德反应制备鸡骨香精基料,分析超声预处理对鸡骨酶解发酵液制备鸡骨香精基料的影响及鸡骨香精基料的生物活性。结果表明,超声预处理对鸡骨香精基料的美拉德反应具有积极影响,促进了美拉德反应的发生。GC-MS检测到呋喃类化合物、1-辛烯-3-醇等对风味有重要影响的挥发性物质,能够改善鸡骨香精基料的风味;实验结果证明鸡骨香精基料具有较高的抗氧化活性、ACE抑制活性,还具备一定的体外降胆固醇能力。总体而言,以上结果为美拉德反应制备鸡骨香精基料提供了技术支持,证明利用肉类工业的副产品骨骼残渣制备肉味香精具有一定的可行性。
[1] MIRABELLA N, CASTELLANI V, SALA S.Current options for the valorization of food manufacturing waste:A review[J].Journal of Cleaner Production, 2014, 65:28-41.
[2] DONG Z Y, LI M Y, TIAN G, et al.Effects of ultrasonic pretreatment on the structure and functionality of chicken bone protein prepared by enzymatic method[J].Food Chemistry, 2019, 299:125103.
[3] KONG Y, YANG X, DING Q, et al.Comparison of non-volatile umami components in chicken soup and chicken enzymatic hydrolysate[J].Food Research International, 2017, 102:559-566.
[4] 陈树俊, 徐晓霞, 胡洁, 等.苦荞、燕麦和杏鲍菇酶解液发酵工艺优化及其抗氧化活性[J].食品工业科技, 2018, 39(3):153-157;166.
CHEN S J, XU X X, HU J, et al.Optimization of fermentation process of enzymatic hydrolysate of buckwheat, oat and Pleurotus eryngii and its antioxidant capacity[J].Science and Technology of Food Industry, 2018, 39(3):153-157;166.
[5] YANG X, LI Y L, LI S T, et al.Effects and mechanism of ultrasound pretreatment of protein on the Maillard reaction of protein-hydrolysate from grass carp (Ctenopharyngodon idella)[J].Ultrasonics Sonochemistry, 2020, 64:104964.
[6] SUN H M, WANG J Z, ZHANG C H, et al.Changes of flavor compounds of hydrolyzed chicken bone extracts during Maillard reaction[J].Journal of Food Science, 2014, 79(12):C2415-C2426.
[7] HABINSHUTI I, MU T H, ZHANG M.Structural, antioxidant, aroma, and sensory characteristics of Maillard reaction products from sweet potato protein hydrolysates as influenced by different ultrasound-assisted enzymatic treatments[J].Food Chemistry, 2021, 361:130090.
[8] 田玉潭. 鸡骨热反应香精基料的制备及抗氧化与抑制性的研究[D].银川:宁夏大学, 2021.
TIAN Y T.Study on preparation and antioxidant and inhibitoryity of chicken bone thermal reaction flavor base[D].Yinchuan:Ningxia University, 2021.
[9] 刘伟. 超声波处理对河蚌肉酶解物美拉德反应的影响及其微囊化调味料制备[D].长春:吉林大学, 2019.
LIU W.Effect of ultrasonic treatment on Maillard reaction of hydrolysate derived from mussel meat and its manufacture of microencapsulated seasoning[D].Changchun:Jilin University, 2021.
[10] TAN J E, LIU T T, YAO Y, et al.Changes in physicochemical and antioxidant properties of egg white during the Maillard reaction induced by alkali[J].LWT, 2021, 143:111151.
[11] 依胜男, 芦晶, 逄晓阳, 等.热处理对牛乳美拉德反应程度及挥发性成分的影响[J].食品科学, 2021, 42(14):9-15.
YI S N, LU J, PANG X Y, et al.Effect of heat treatment on Maillard reaction degree and volatile components of milk[J].Food Science, 2021, 42(14):9-15.
[12] XIONG G Y, CHEN X, ZHANG X X, et al.Process optimization and the relationship between the reaction degree and the antioxidant activity of Maillard reaction products of chicken liver protein hydrolysates[J].Poultry Science, 2020, 99(7):3733-3741.
[13] 张亚琨, 张美莉, 郭新月.微粉碎对燕麦麸皮功能性成分及抗氧化性的影响[J].中国食品学报, 2021, 21(11):22-28.
ZHANG Y K, ZHANG M L, GUO X Y.Effect of micronization on the functional components and antioxidant properties in oat bran[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(11):22-28.
[14] LI X Y, FENG C S, HONG H, et al.Novel ACE inhibitory peptides derived from whey protein hydrolysates:Identification and molecular docking analysis[J].Food Bioscience, 2022, 48:101737.
[15] 李晶, 薛霖莉, 郝左亮, 等.冰葡果醋的功能成分及抗氧化、降血糖和降胆固醇作用[J].中国调味品, 2019, 44(5):197-200.
LI J, XUE L L, HAO Z L, et al.Functional components, antioxidation, hypoglycemic and cholesterol-lowering effects of ice grape vinegar[J].China Condiment, 2019, 44(5):197-200.
[16] XU B G, ZHANG M, BHANDARI B, et al.Effect of ultrasound immersion freezing on the quality attributes and water distributions of wrapped red radish[J].Food and Bioprocess Technology, 2015, 8(6):1366-1376.
[17] ZHENG Z L, ZHANG M, LIU W C, et al.Effect of beef tallow, phospholipid and microwave combined ultrasonic pretreatment on Maillard reaction of bovine bone enzymatic hydrolysate[J].Food Chemistry, 2021, 377:131902.
[18] 陈晓. 鸡肝蛋白酶解物的美拉德反应条件优化及其产物特性[D].合肥:安徽农业大学, 2020.
CHEN X.Optimization of Maillard reaction conditions for chicken liver protein enzymatic hydrolysate and its product characteristics[D].Hefei:Anhui Agricultural University, 2020.
[19] LI Q, LI X J, REN Z Y, et al.Physicochemical properties and antioxidant activity of Maillard reaction products derived from Dioscorea opposita polysaccharides[J].LWT, 2021, 149:111833.
[20] SUN W Z, ZHAO M M, CUI C, et al.Effect of Maillard reaction products derived from the hydrolysate of mechanically deboned chicken residue on the antioxidant, textural and sensory properties of Cantonese sausages[J].Meat Science, 2010, 86(2):276-282.
[21] BAEK H H, CADWALLADER K R.Enzymatic hydrolysis of crayfish processing by-products[J].Journal of Food Science, 1995, 60(5):929-935.
[22] ZHAN P, TIAN H L, ZHANG X M, et al.Contribution to aroma characteristics of mutton process flavor from the enzymatic hydrolysate of sheep bone protein assessed by descriptive sensory analysis and gas chromatography olfactometry[J].Journal of Chromatography B Analyt Technol Biomed Life, 2013, 921-922(6):1-8.
[23] 刘子轩, 高雅, 王文倩, 等.不同品种食用菌制备热反应肉味基料风味差异分析[J].食品科学技术学报, 2022, 40(1):30-43.
LIU Z X, GAO Y, WANG W Q, et al.Flavor difference analysis of thermal processing meat flavoring prepared with different varieties of mushroom materials[J].Journal of Food Science and Technology, 2022, 40(1):30-43.
[24] BI S, LAO F, PAN X, et al.Flavor formation and regulation of peas (Pisum sativum L.) seed milk via enzyme activity inhibition and off-flavor compounds control release[J].Food Chemistry, 2022, 380:132203.
[25] WANG H Y, QIAN H, YAO W R.Melanoidins produced by the Maillard reaction:Structure and biological activity[J].Food Chemistry, 2011, 128(3):573-584.
[26] RUFI N-HENARES J A, MORALES F J.Angiotensin-i converting enzyme inhibitory activity of coffee melanoidins[J].Journal of Agricultural and Food Chemistry, 2007, 55(4):1480-1485.
N-HENARES J A, MORALES F J.Angiotensin-i converting enzyme inhibitory activity of coffee melanoidins[J].Journal of Agricultural and Food Chemistry, 2007, 55(4):1480-1485.
[27] LI F J, OHNISHI-KAMEYAMA M, TAKAHASHI Y, et al.Angiotensin I-converting enzyme inhibitory activities of Chinese fermented soypaste and estimation of the inhibitory substances[J].Journal of Functional Foods, 2013, 5(4):1991-1995.
[28] 刘兰涛. 山西老陈醋醋泥的降血脂和抗氧化活性研究[D].太原:山西大学, 2016.
LIU L T.Research on hypolipidemic and antioxidant activity of Shanxi aged vinegar sludge[D].Taiyuan:Shanxi university, 2016.
[29] PAK V V, KOO M, LEE N, et al.Structure—Activity relationships of the peptide Ile-Ala-Val-pro and its derivatives revealed using the semi-empirical am1 method[J].Chemistry of Natural Compounds, 2005, 41(4):454-460.
[30] OH N S, KWON H S, LEE H A, et al.Preventive effect of fermented Maillard reaction products from milk proteins in cardiovascular health[J].Journal of Dairy Science, 2014, 97(6):3300-3313.