氧化白藜芦醇,又名氧化芪三酚,结构如图1所示,其分子式为C14H12O4,分子质量244.24,熔点199~204 ℃,外观呈淡黄色非晶型固体,可溶于甲醇、乙醇、二甲基亚砜等有机溶剂。氧化白藜芦醇作为天然产物白藜芦醇2′-位的羟基化衍生物,结构上含4个酚羟基,具备多种有益的生物和药理活性(抗肿瘤、抗癌、抗氧化、抗炎和抗肥胖等作用[1-5]),此外还具有保肝、抑制酪氨酸酶和改善帕金森症等作用[6-8]。大量研究显示含有氧化白藜芦醇的食品或者口服药物安全且低毒,未来将广泛应用于保健品、化妆品及药品等领域当中[9]。
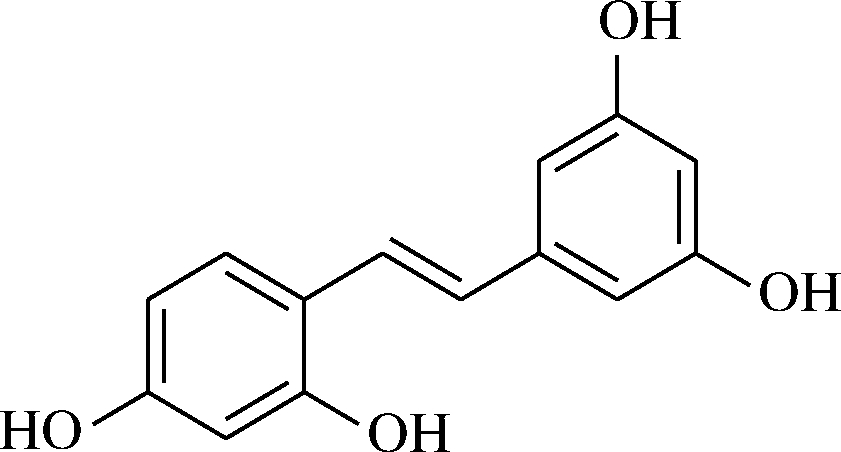
图1 氧化白藜芦醇结构
Fig.1 Structure of oxyresveratrol
氧化白藜芦醇主要存在于多种天然植物当中,如:桑树、紫檀科、藜芦、菠萝蜜、买麻藤属、片麻岩科和菝葜属等[10-11],但含量很低,且分离纯化较困难。目前,人们主要通过植物提取法、微生物转化[12-13]和化学合成法来获取氧化白藜芦醇。赵建萍等[14]采用乙醇提取法提取拓木茎粗提液,并使用AB-8大孔树脂分离纯化获得氧化白藜芦醇,其提取及精制工艺过程过于复杂,且未报道其收率;PARK等[15]运用Pectinex®对桑椹苷A的酶解来产生氧化白藜芦醇,其中桑椹苷也需从植物中提取,且价格与氧化白藜芦醇的市场价相近,由此可见植物提取法和微生物转化法并不适合于大规模的工业化生产。氧化白藜芦醇功效强大且毒副作用小,其市场需求大但来源不足,从而导致其价格昂贵,严重制约了其在保健食品、功能饮料、天然药物及化妆品等领域内的开发。因此,探索出反应条件温和、简洁高效、操作简单以及绿色环保的化学全合成氧化白藜芦醇的路线颇有意义。
化学合成氧化白藜芦醇的关键点在于其反式二苯乙烯骨架的构建,根据国内外相关文献,目前构建反式二苯乙烯骨架的方法主要有Perkin反应法、Heck反应法、Wittig反应法以及Wittig-Horner反应法,其中,Perkin反应得到的双键为顺式构型,需进行异构化转化,操作复杂;Heck反应条件苛刻,卤代物制备污染大;Wittig反应选择性不高,收率低;Wittig-Horner反应法是Wittig反应法的改良,该反应条件温和、后处理简单,得到的双键皆为反式构型且收率高[16-17]。2004年CHOI等[18]以3,5-二甲氧基苄基溴与三苯基膦反应制得相应的Wittig盐,再与2,4-二甲氧基苯甲醛通过Witing反应构建双键骨架,经碘异构化反应后,最终以格氏试剂甲基碘化镁(CH3MgI)脱除甲基制得氧化白藜芦醇,总收率较低;2010年SUN等[19]以3,5-二羟基苯乙酮经甲基化反应和Willgerodt-Kindler重排反应得到3,5-二甲氧基苯乙酸,再与2,4-二甲氧基苯甲醛发生Perkin反应构建双键骨架,经脱羧和脱甲基反应后,同样还需异构化反应才能合成氧化白藜芦醇,总收率30%;2012年,李晓霞等[20]以3,4-二甲氧基苄醇为原料,经溴代、Arbuzov重排反应、Wittig-Horner反应构建二苯乙烯骨架,最后用无水AlCl3脱除甲基获得白皮杉醇,产率43.7%;2013年郑群怡等[21]从3,5-二甲氧基苯甲醇出发,经HBr于甲苯中溴代,Arbuzov重排反应、Wittig-Horner反应获得反式二苯乙烯骨架,最后使用CH3MgI脱除甲基得到氧化白藜芦醇,脱甲基步骤较为繁琐,且工艺过程中用到甲苯等有毒试剂,污染大;2016年李志伟等[22]由间苯二酚经碘代反应、Heck反应和脱羧反应制得中间体2,4-二羟基苯乙烯,再与3,5-二羟基碘苯在钯催化下再次发生Heck反应制得氧化白藜芦醇,该路线条件苛刻且成本高。
本研究在国内外已有合成路线的基础上,为克服这些路线所存在的原料昂贵、路线长、操作危险性大、不够环保及收率低等缺点,对氧化白藜芦醇的合成工艺进行改进。选择Wittig-Horner反应法来构建反式二苯乙烯骨架,以3,5-二甲氧基苄醇、2,4-二甲氧基苯甲醛为原料,经溴代、Arbuzov重排反应、Wittig-Horner反应和脱甲基反应四步合成氧化白藜芦醇,对工艺条件进行优化,重点对脱甲基试剂进行了优选。以维生素C、BHT和TBHQ为参照,通过DPPH自由基清除能力、ABTS阳离子自由基清除能力和铁离子还原能力评价了氧化白藜芦醇的抗氧化活性,并与同为多酚类的化合物白皮杉醇、白藜芦醇和茶多酚作对比,期望为氧化白藜芦醇的工业化生产及其未来在食品、化妆品、药品等领域中的运用提供理论与技术支持。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
3,5-二甲氧基苄醇、2,4-二甲氧基苯甲醛、甲醇钠、N, N-二甲基甲酰胺、无水AlCl3、BBr3(1.0 mol/L CH2Cl2溶液),安徽泽升科技有限公司;PBr3、亚磷酸三乙酯、吡啶、HBr溶液(质量分数为40%),ABTS、DPPH,上海麦克林生化科技有限公司;吡啶盐酸盐、CH3MgI(3.0 mol/L乙醚溶液),上海吉至生化科技有限公司;BCl3(1.0 mol/L CH2Cl2溶液),北京百灵威科技有限公司;氘代氯仿、氘代甲醇,安诺伦(北京)生物科技有限公司;白藜芦醇、白皮杉醇均为实验室合成;茶多酚(≥98.0%)、2,6-二叔丁基对甲酚(2,6-butylated hydroxytoluene,BHT,>99.0%)、特丁基对苯二酚(tert-butylhydroquinone,TBHQ,98.0%)、维生素C(99.0%),北京索莱宝科技有限公司;其他所用化学试剂均为市售化学纯或分析纯。
1.1.2 仪器与设备
手提式紫外分析仪,华睿鼎顺(北京)科贸有限公司;X-5控温型显微熔点测定仪,北京泰克仪器有限公司;AL204电子天平,瑞士梅特勒-托利多公司;Infinite M200Pro多功能酶标仪,瑞士Tecan公司;EQUINOX55红外光谱仪、AVANCEⅢ型核磁共振波谱仪(600 MHz),布鲁克科学仪器公司;N-1300型低温反应仪,东京理化器械株式会社;X500R QTOF型高分辨质谱仪,上海爱博才思分析仪器贸易有限公司;MS-H-Pro磁力搅拌器,美国赛洛捷克公司;N-1300型旋转蒸发仪,东京理化器械株式会社。
1.2 实验方法
1.2.1 合成路线
如图2所示,首先由3,5-二甲氧基苄醇(化合物1)与PBr3发生溴代反应制得3,5-二甲氧基苄溴(化合物2);化合物2与P(OEt)3通过Arbuzov重排反应制得Wittig-Horner试剂3,5-二甲氧基苄基磷酸二乙酯(化合物3);化合物3和2,4-二甲氧基苯甲醛(化合物4)通过Wittig-Horner反应构建反式二苯乙烯骨架制得中间体2,3′,4,5′-四甲氧基二苯乙烯(化合物5);最后化合物5在无水AlCl3的作用下脱除甲基合成终产物氧化白藜芦醇(化合物6)。

图2 氧化白藜芦醇的合成路线
Fig.2 Synthesis route of oxyresveratrol
1.2.2 合成方法
1.2.2.1 3,5-二甲氧基苄溴(化合物2)[23]
取8.00 g(0.048 mol)3,5-二甲氧基苄醇、56 mL无水CH2Cl2于250 mL圆底烧瓶中,N2保护,搅拌溶解。在0 ℃条件下,缓慢滴加含2.60 mL PBr3的CH2Cl2溶液(9.60 mL)于反应瓶中,滴加完毕于0 ℃反应1 h,转至室温继续反应3~4 h,薄层层析色谱(thin layer chromatography,TLC)监测。反应结束后,
将反应液缓慢倒入冰水中,分液,水层用CH2Cl2洗涤,合并有机相,有机相用饱和NaCl溶液洗涤至中性,无水Na2SO4干燥,过滤,旋转蒸发除去CH2Cl2,得到淡黄色固体粗品,用甲醇重结晶得到白色晶体(2,10.79 g,0.047 mol),收率97.3%。熔点71~73.5 ℃(文献值[23]72.9~73.8 ℃)。
1.2.2.2 3, 5-二甲氧基苄基磷酸二乙酯(化合物3)[24]
取5.00 g(0.022 mol) 3,5-二甲氧基苄溴、13 mL亚磷酸三乙酯于50 mL圆底烧瓶中,充分搅拌,先升温至100 ℃反应约1 h,待溴乙烷等低沸点副产物蒸出后,装上回流冷凝管,再升温至130 ℃继续回流反应4 h,TLC监测反应。待反应结束后,停止反应,使反应液冷却至室温,于120 ℃条件下进行减压蒸馏,除去未反应的亚磷酸三乙酯,得到淡黄色油状液体(3,5-二甲氧基苄基磷酸二乙酯粗品),无需进一步柱层析纯化,直接投入下一步反应。1H NMR (600 MHz,氘代氯仿) δ 6.46(t,J=2.4 Hz,2H,2×Ar—H),6.35(q,J=2.3 Hz,1H,Ar—H),4.08-3.97(m,4H,2×O—CH2),3.77(s,6H,2×O—CH3),3.11(s,1H,Ar—CH2),3.07(s,1H,Ar—CH2),1.26(t,J=7.1 Hz,6H,2×O—CH3)。MS(ESI),m/z:C13H21O5P [M+H]+,理论值289.119 9,实测值289.120 4。
1.2.2.3 2,3′,4,5′-四甲氧基二苯乙烯(化合物5)[25]
将上步减压蒸馏后得到的3,5-二甲氧基苄基磷酸二乙酯粗品4.68 g、19 mL N,N-二甲基甲酰胺加入100 mL三口圆底烧瓶中,充分搅拌,0 ℃条件下于反应体系中继续加入2.70 g (0.05 mol)甲醇钠,搅拌30 min后,缓慢滴加含2.80 g (0.017 mol) 2,4-二甲氧基苯甲醛的N,N-二甲基甲酰胺10 mL,继续于0 ℃反应1 h,转至室温反应过夜,TLC监测。反应结束后,将反应液缓慢倒入冰水中,乙酸乙酯萃取,萃取液用饱和NaCl溶液洗涤至中性,无水Na2SO4干燥,过滤、旋转蒸发除去乙酸乙酯,得到黄色固体粗品,用石油醚/乙酸乙酯混合溶剂重结晶,得到白色固体(5,4.45 g,0.015 mol),产率87.1%。熔点81~83.5 ℃(文献值[25]81~82 ℃)。IR(KBr),v/cm-1:3 000、2 944、2 840、1 589、1 506、1 460、1 428、1 295、1 154、968、836。1H NMR (600 MHz,氘代氯仿) δ 7.50(d,J=8.5 Hz,1H,Ar—H),7.37(d,J=16.4 Hz,1H,CH![]() CH),6.94(d,J=16.4 Hz,1H,CH
CH),6.94(d,J=16.4 Hz,1H,CH![]() CH),6.67(d,J=2.3 Hz,2H,Ar—H),6.52(dd,J=8.5,2.3 Hz,1H,Ar—H),6.47(s,1H,Ar—H),6.37(t,J=2.2 Hz,1H,Ar—H),3.87(s,3H,O—CH3),3.8 (d,J=2.9 Hz,9H,3×O—CH3)。13C NMR(126 MHz,氘代氯仿) δ 161.04(C4),160.77(C3′,C5′),158.25(C2),140.53(C1′),127.51(双键上的碳),127.14(C6),124.01(C1),119.49(双键上的碳),105.14(C5),104.53(C2′,C6′),99.57(C4′),98.65(C3),55.67(—OCH3),55.55(—OCH3),55.51(—OCH3×2)。MS(ESI),m/z:C18H20O4[M+H]+,理论值301.143 4,实测值301.142 9。
CH),6.67(d,J=2.3 Hz,2H,Ar—H),6.52(dd,J=8.5,2.3 Hz,1H,Ar—H),6.47(s,1H,Ar—H),6.37(t,J=2.2 Hz,1H,Ar—H),3.87(s,3H,O—CH3),3.8 (d,J=2.9 Hz,9H,3×O—CH3)。13C NMR(126 MHz,氘代氯仿) δ 161.04(C4),160.77(C3′,C5′),158.25(C2),140.53(C1′),127.51(双键上的碳),127.14(C6),124.01(C1),119.49(双键上的碳),105.14(C5),104.53(C2′,C6′),99.57(C4′),98.65(C3),55.67(—OCH3),55.55(—OCH3),55.51(—OCH3×2)。MS(ESI),m/z:C18H20O4[M+H]+,理论值301.143 4,实测值301.142 9。
1.2.2.4 氧化白藜芦醇(化合物6)[20]
取2.00 g (0.007 mol)2,3′,4,5′-四甲氧基二苯乙烯、3.0 mL无水吡啶于50 mL三口圆底烧瓶中,架上干燥管和回流冷凝管,充分搅拌,升温至100 ℃左右时,分批加入7.46 g(0.056 mol)无水AlCl3,约1 h加完,加完后升温至160 ℃,反应4 h,TLC监测反应进程。待反应结束后,将反应液趁热倒入冰水中,乙酸乙酯萃取,无水Na2SO4干燥,过滤,活性炭回流脱色,旋转蒸发除去乙酸乙酯,得褐色固体粗品,粗品经柱层析纯化(CH2Cl2∶甲醇=16∶1)得到淡黄色固体氧化白藜芦醇(6,1.30 g,0.005 mol,收率76.2%。熔点199~201 ℃(文献值[19]202~205 ℃)。IR (KBr),v/cm-1:3 236、1 613、1 594、1 519、1 315、1 173、1 157、1 117、979、825。1H NMR (600 MHz,氘代甲醇) δ 7.32 (d,J=9.1 Hz,1H,Ar—H),7.26(d,J=16.4 Hz,1H,CH![]() CH),6.81 (d,J=16.4 Hz,1H,CH
CH),6.81 (d,J=16.4 Hz,1H,CH![]() CH),6.44 (d,J=2.1 Hz,2H,Ar—H),6.30 (d,J=6.5 Hz,2H,Ar—H),6.13 (d,J=2.2 Hz,1H,Ar—H)。13C NMR (126 MHz,氘代甲醇)δ 159.59(C4),159.25(C3′,C5′),157.36(C2),142.21(C1′),128.41(C6),126.51(双键上的碳),124.83(双键上的碳),117.86(C1),108.40(C5),105.67(C2′,C6′),103.57(C3),102.29(C4′)。MS(ESI),m/z:C14H12O4[M+H]-,理论值243.066 3,实测值243.065 7。
CH),6.44 (d,J=2.1 Hz,2H,Ar—H),6.30 (d,J=6.5 Hz,2H,Ar—H),6.13 (d,J=2.2 Hz,1H,Ar—H)。13C NMR (126 MHz,氘代甲醇)δ 159.59(C4),159.25(C3′,C5′),157.36(C2),142.21(C1′),128.41(C6),126.51(双键上的碳),124.83(双键上的碳),117.86(C1),108.40(C5),105.67(C2′,C6′),103.57(C3),102.29(C4′)。MS(ESI),m/z:C14H12O4[M+H]-,理论值243.066 3,实测值243.065 7。
1.2.3 抗氧化活性的测定
参照文献[26]的方法进行测定,略作修改。分别称取0.192 g ABTS、0.033 1 g K2S2O8于烧杯中,并用超纯水定容至50 mL,将ABTS溶液(7 mmol/L)与K2S2O8溶液(2.45 mmol/L)以体积比1∶1混合均匀,于室温避光条件下静置过夜,将生成的ABTS阳离子自由基溶液用无水乙醇稀释至734 nm处吸光值为0.70±0.02。反应体系中,取以上方法配好的ABTS阳离子自由基溶液200 μL于96孔板中,并添加不同浓度的样品溶液2 μL,充分摇匀,室温静置10 min,反应液用酶标仪在734 nm处测定吸光值,ABTS阳离子自由基清除能力按公式(1)计算。
ABTS阳离子自由基清除率![]()
(1)
式中,Ao,无水乙醇与ABTS阳离子自由基溶液在734 nm处的吸光值;Ai,测定液与无水乙醇在734 nm处的吸光值;Aj,测定液与ABTS阳离子自由基溶液在734 nm处的吸光值。
参照文献[26-27]的方法对样品清除DPPH自由基能力和铁离子还原能力进行测定。DPPH自由基清除能力按公式(1)计算。ABTS阳离子自由基清除能力与DPPH自由基清除能力以基于线性回归方程计算得到的添加2 μL样品溶液中的半抑制浓度(half inhibitory concerntration,IC50)值表示,铁离子还原能力测定中以维生素C作为标准物并绘制标准曲线,所得线性回归方程为y=0.184 1x-0.328 1, R2=0.999 7. 其中x代表维生素C质量浓度(μg/mL),y代表吸光度。铁离子还原能力以与样品吸光值相同时的维生素C当量来表示。
1.2.4 数据处理
采用Chemdraw 18.1绘制化合物结构式、分析化合物结构以及化学反应;采用MestReNova 14.0解析化合物的核磁谱图、确证化合物结构。采用SPSS 26.0统计软件分析差异显著性,P<0.05,差异显著;P<0.01,差异极显著。采用Origin 2019软件绘制图表,所有实验均重复3次,结果表示为平均值±标准偏差。
2 结果与分析
2.1 溴代反应
卤原子置换羟基是用来制备卤化物常用的方法之一,其中苄醇的溴代较氯代容易。溴代试剂的种类有很多,本文选用了40%的HBr溶液、HBr气体以及PBr3作为溴代试剂,综合操控性、产率以及成本来考虑,采用PBr3作为溴代试剂操作简单、产率高、且价格便宜易得,更适用于工业化生产,具体对比结果如表1所示。选取以无水CH2Cl2为溶剂,反应温度为室温,反应时间3 h,苄溴收率可高达97%。
表1 不同溴代试剂的比较
Table 1 Comparison of different brominated reagents

溴代试剂溶剂反应温度/℃反应时间/h收率/%PBr3CH2Cl2室温397.3HBr气体苯80582.340%HBr苯80386.7
2.2 Arbuzov 重排反应
3,5-二甲氧基苄基磷酸二乙酯是整个合成路线的重要中间体,作为Wittig-Horner试剂,它可以和醛反应生成C![]() C双键。本文采用3,5-二甲氧基苄溴与亚磷酸三乙酯通过Arbuzov重排反应来制备3,5-二甲氧基苄基磷酸二乙酯。亚磷酸三乙酯为液态,它既可作反应物又可作反应溶剂。亚磷酸三乙酯与3,5-二甲氧基苄溴几乎为化学计量反应,因此反应过程中使其稍过量,就可将3,5-二甲氧基苄溴反应完全。Arbuzov重排反应需要较高的温度,本文重点考察了温度对反应收率的影响,结果如表2所示。
C双键。本文采用3,5-二甲氧基苄溴与亚磷酸三乙酯通过Arbuzov重排反应来制备3,5-二甲氧基苄基磷酸二乙酯。亚磷酸三乙酯为液态,它既可作反应物又可作反应溶剂。亚磷酸三乙酯与3,5-二甲氧基苄溴几乎为化学计量反应,因此反应过程中使其稍过量,就可将3,5-二甲氧基苄溴反应完全。Arbuzov重排反应需要较高的温度,本文重点考察了温度对反应收率的影响,结果如表2所示。
表2 反应温度对产率的影响
Table 2 Effect of reaction temperature on yield
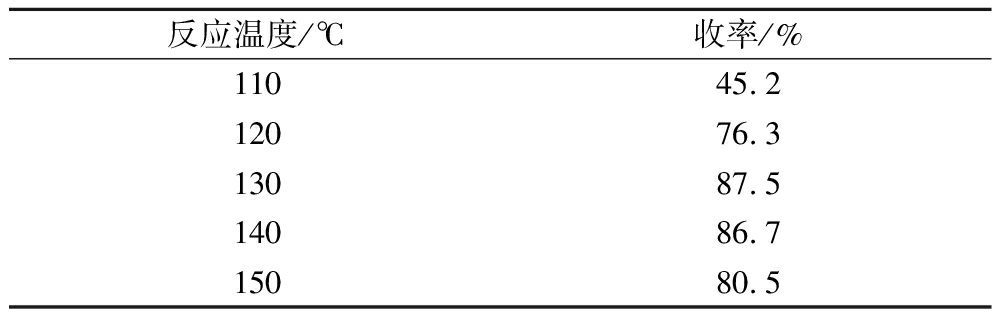
反应温度/℃收率/%11045.212076.313087.514086.715080.5
反应温度选择在130 ℃,反应4 h时,TLC检测原料反应较为完全,收率最高,整个过程反应温和、操作简单。此外,应注意反应刚开始时如果温度过高,
反应体系会产生溴乙烷等副产物,在副产物作用下,亚磷酸三乙酯会发生异构化转变,影响产率,因此我们一开始控温在100 ℃左右,使溴乙烷以及其他低沸点副产物先行蒸出,以利于原料的充分反应。反应结束后,只需减压蒸馏除去未反应的亚磷酸三乙酯及其他低沸点杂质,无需进一步柱层析纯化,便可直接投入下一步反应当中,简化了后处理,利于工业化的操作。
2.3 Wittig-Horner反应
Wittig-Horner反应条件温和,不需无水无氧条件,操作简单,立体选择性高,反应所产生的次膦酸或膦酸阴离子都溶于水,易于分离提纯。在进行Wittig-Horner反应时,3,5-二甲氧基苄基磷酸二乙酯与2,4-二甲氧基苯甲醛两者使其中之一微微过量,便可使反应顺利。以N,N-二甲基甲酰胺为溶剂,选择廉价易得的甲醇钠来代替以往所用昂贵的氢化钠作为反应所需的碱,实验过程中发现甲醇钠的用量对产物的产率及纯度影响较大,因此考察了甲醇钠用量对产率的影响,结果如表3所示。当甲醇钠与反应物物质的量比例为3∶1时,室温反应过夜(约12 h),通过重结晶纯化后得到的2,3′,4,5′-四甲氧基二苯乙烯的产率可达87%以上。
表3 甲醇钠用量对产率的影响
Table 3 Effect of sodium methoxide dosage on yield
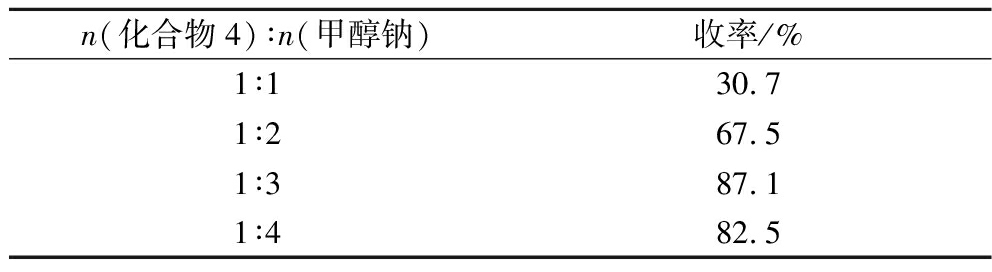
n(化合物4)∶n(甲醇钠)收率/%1∶130.71∶267.51∶387.11∶482.5
2.4 脱甲基反应
甲基醚性质稳定,不容易裂解脱除,这一步反应制约着氧化白藜芦醇总产率的提高,因此选择合适的脱甲基试剂是提高总产率的关键。本文尝试了使用吡啶盐酸盐、格氏试剂CH3MgI、路易斯酸(BBr3、BCl3、AlCl3)、48% HBr和对甲苯磺酸来脱甲基,各试剂的脱甲基效果如表4所示。
表4 脱甲基试剂对产率的影响
Table 4 Effect of demethylation reagents on yield
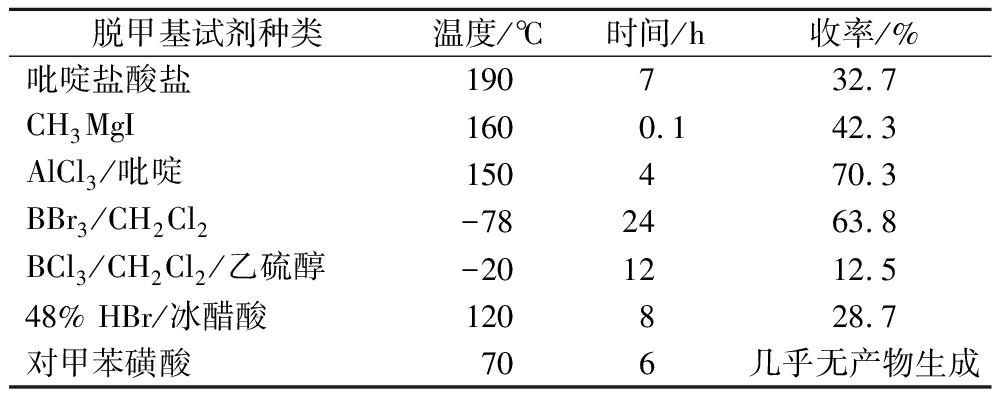
脱甲基试剂种类温度/℃时间/h收率/%吡啶盐酸盐1907 32.7CH3MgI1600.142.3AlCl3/吡啶150470.3BBr3/CH2Cl2-782463.8BCl3/CH2Cl2/乙硫醇-201212.548% HBr/冰醋酸120828.7对甲苯磺酸706几乎无产物生成
通过对比实验结果,吡啶盐酸盐以及CH3MgI价格昂贵、脱甲基所需条件苛刻、操作困难;BBr3是最常用的脱甲基试剂,虽然收率可观,但试剂不易保存且成本偏高,需低温反应、操作危险性大,不利于工业化生产;BCl3和对甲苯磺酸脱除甲基的收率极低,48% HBr脱甲基产率不高。我们最终选取了价格便宜的AlCl3来脱甲基,并且以无水吡啶作为反应溶剂时脱除甲基效率较好。本文进一步对AlCl3的用量和反应温度进行优化,优化结果如表5、表6所示。
表5 AlCl3用量对产率的影响
Table 5 Effect of AlCl3 dosage on yield
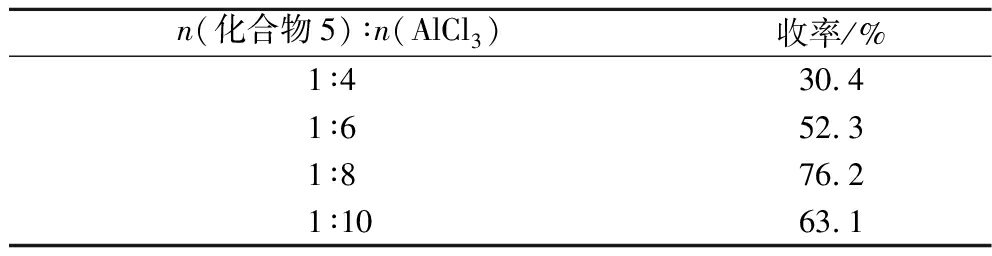
n(化合物5)∶n(AlCl3)收率/%1∶4 30.41∶6 52.31∶8 76.21∶1063.1
表6 温度对产率的影响
Table 6 Effect of temperature on yield

反应温度/℃收率/%12020.114049.316076.2
无水AlCl3与2,3′,4,5′-四甲氧基二苯乙烯的物质的量比和反应温度对收率影响较大,当AlCl3用量过少,温度较低时,脱甲基不完全;温度过高,AlCl3用量过多时,副产物增多,产物易发生异构化,增加了纯化的难度。由表5和表6可知,通过优化反应条件,当n(AlCl3)∶n(2,3′,4,5′-四甲氧基二苯乙烯)=8∶1,温度为160 ℃时,反应时间为4 h时,脱甲基较为完全,收率为76.2%。
2.5 抗氧化活性
2.5.1 清除ABTS阳离子自由基的能力
由图3可知,氧化白藜芦醇清除ABTS阳离子自由基的IC50值为(0.17±0.01) mg/mL,其清除ABTS阳离子自由基能力仅次于白皮杉醇,大于白藜芦醇以及茶多酚。通过方差分析得到白藜芦醇与茶多酚在统计学上没有显著性差异(P>0.05),氧化白藜芦醇与白藜芦醇之间存在显著性差异(P<0.05),与其余各样品之间存在极显著性差异(P<0.01),各样品清除ABTS阳离子自由基能力大小依次为:白皮杉醇>氧化白藜芦醇>白藜芦醇≈茶多酚>维生素C>TBHQ>BHT。

图3 各样品ABTS阳离子自由基清除能力
Fig.3 ABTS cation radical scavenging ability of each sample
注:P<0.05时,不同字母表示差异性显著;误差线代表标准偏差,n=3(下同)。
2.5.2 清除DPPH自由基的能力
由图4可知,氧化白藜芦醇清除DPPH自由基的IC50值为(16.80±0.65) μg/mL,通过方差分析得到氧化白藜芦醇和白皮杉醇在统计学上没有显著性差异(P>0.05),与其余各样品之间存在极显著性差异(P<0.01)。各样品清除DPPH自由基能力的大小依次为:茶多酚≈维生素C≈TBHQ>氧化白藜芦醇≈白皮杉醇>BHT>白藜芦醇。DPPH是一种以氮为中心的很稳定的自由基,易与含多羟基的化合物结合,达到清除自由基的作用。茶多酚结构末端连接多个羟基,因此清除DPPH自由基能力最强,白皮杉醇和氧化白藜芦醇结构上均带有4个酚羟基,比白藜芦醇多一个酚羟基,因此白皮杉醇和氧化白藜芦醇的DPPH自由基清除能力大于白藜芦醇。
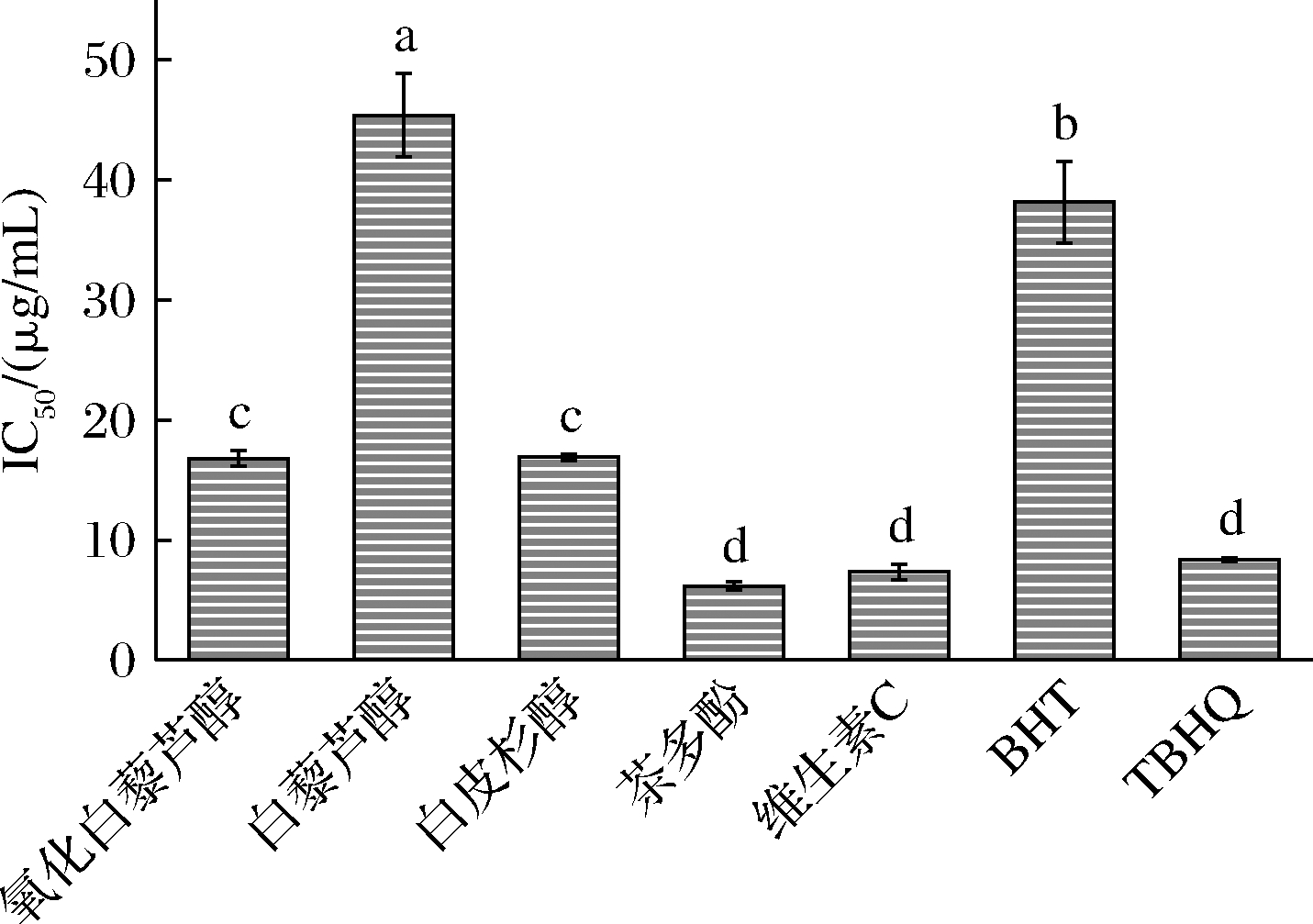
图4 各样品DPPH自由基清除能力
Fig.4 DPPH free radical scavenging ability of each sample
2.5.3 铁离子还原能力
由图5可知,氧化白藜芦醇和各样品的铁离子还原能力随浓度的增大而增大。由表7可知,在质量浓度为8 μg/mL时,各样品的铁离子还原能力大小依次为:白皮杉醇>茶多酚>TBHQ>氧化白藜芦醇>BHT>白藜芦醇。由方差分析得知,当样品质量浓度为2 μg/mL时,氧化白藜芦醇与TBHQ在统计学上无显著性差异(P>0.05);当样品质量浓度为4 μg/mL时,氧化白藜芦醇与TBHQ存在显著性差异(P<0.05),与其余样品之间存在极显著性差异(P<0.01);当样品质量浓度为6、8、10 μg/mL时,氧化白藜芦醇与其他样品之间皆存在极显著性差异(P<0.01)。
表7 各浓度样品所对应的铁离子还原能力
Table 7 Ferric reducing antioxidant power of samples with different concentrations
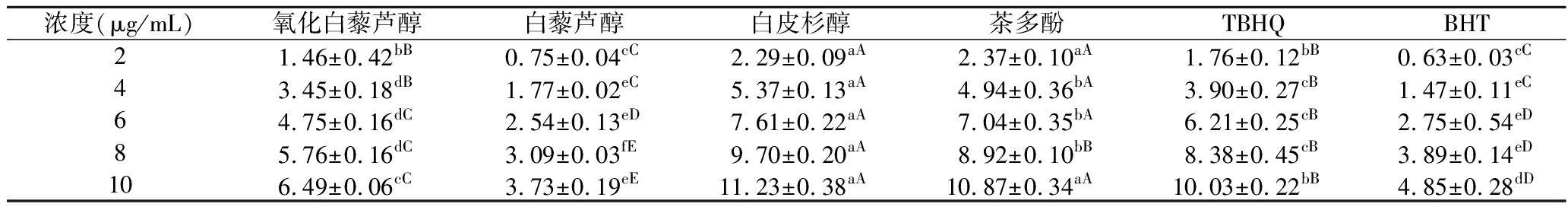
浓度(μg/mL)氧化白藜芦醇白藜芦醇白皮杉醇茶多酚TBHQBHT21.46±0.42bB0.75±0.04cC2.29±0.09aA2.37±0.10aA1.76±0.12bB0.63±0.03cC43.45±0.18dB1.77±0.02eC5.37±0.13aA4.94±0.36bA3.90±0.27cB1.47±0.11eC64.75±0.16dC2.54±0.13eD7.61±0.22aA7.04±0.35bA6.21±0.25cB2.75±0.54eD85.76±0.16dC3.09±0.03fE9.70±0.20aA8.92±0.10bB8.38±0.45cB3.89±0.14eD106.49±0.06cC3.73±0.19eE11.23±0.38aA10.87±0.34aA10.03±0.22bB4.85±0.28dD
注:不同小写字母表示组间差异显著(P<0.05);不同大写字母表示组间差异极显著(P<0.01)。
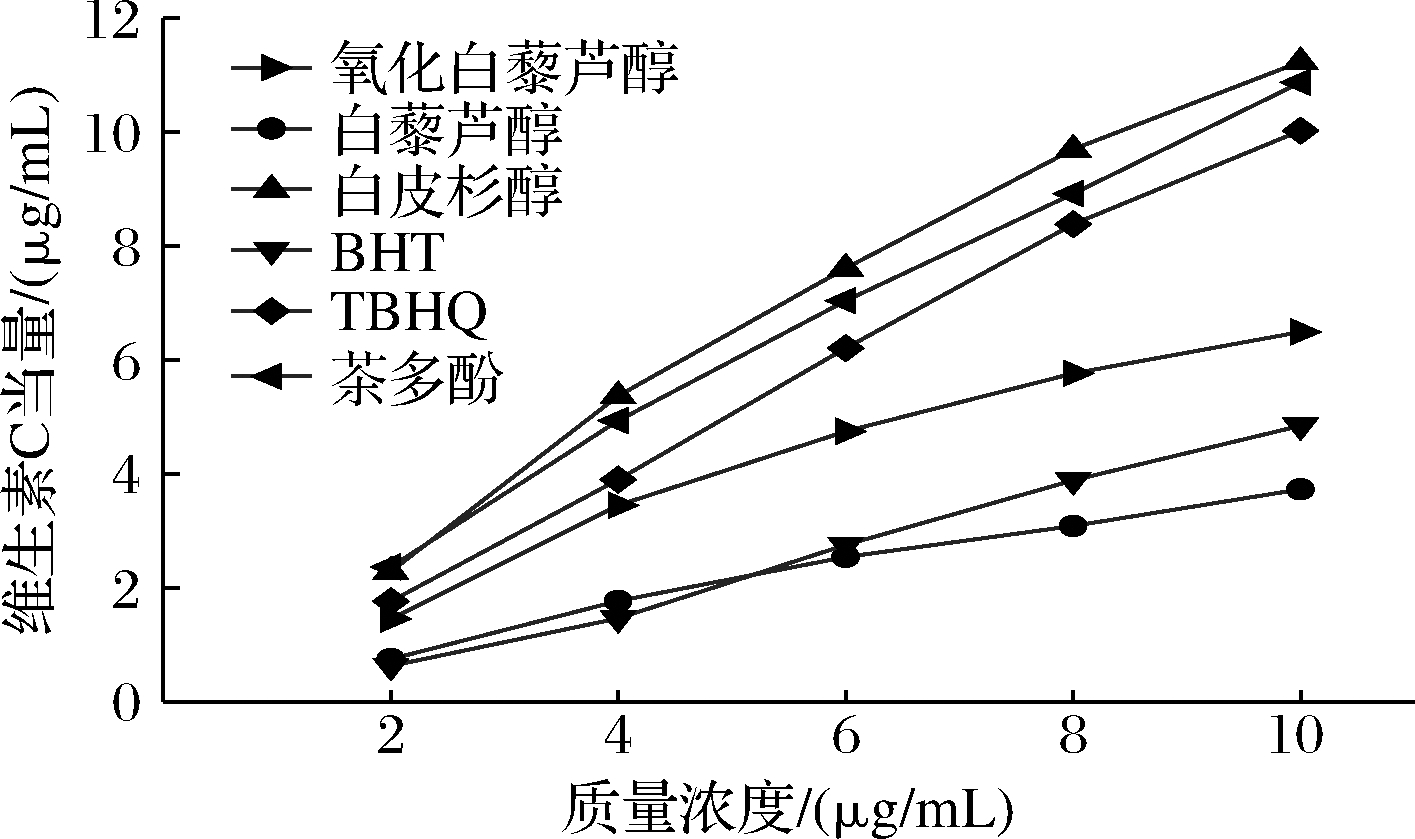
图5 各样品铁离子还原能力
Fig.5 Ferric reducing antioxidant power of each sample
3 结论
以3,5-二甲氧基苄醇、2,4-二甲氧基苯甲醛为原料,通过Wittig-Horner反应法四步合成氧化白藜芦醇,改进了合成工艺并优化了反应条件,合成总产率为64.6%。重点对2,3′,4′,5-四甲氧基二苯乙烯的脱甲基试剂进行了筛选,最终,对比一系列脱甲基试剂后,选取廉价易得的无水AlCl3作为脱甲基试剂,并确定最佳反应条件为:在无水吡啶中,n(AlCl3)∶n(2,3′,4,5′-四甲氧基二苯乙烯)=8∶1,反应温度160 ℃,反应时间4 h。
与现有的合成工艺相比,本文选择以Wittig-Horner反应为特征的路线合成氧化白藜芦醇,避免了使用Perkin反应需进行的异构化转化、Heck反应所需的苛刻条件以及Wittig反应导致的副产物不易分离等问题,反应中所使用的原料价格便宜且来源广泛,其中使用AlCl3脱甲基大大降低了生产成本,反应路线简短,操作方便,反应条件温和,总产率较高,具有潜在的工业利用价值。氧化白藜芦醇的抗氧化活性测定结果表明其具备很强的抗氧化性,其ABTS阳离子自由基清除能力远大于维生素C、BHT、TBHQ,DPPH自由基清除能力以及铁离子还原能力均强于白藜芦醇和BHT,未来可作为优良的天然抗氧化剂应用于食品添加剂、化妆品等邻域当中。
[1] LEE S G, LEE D G, JOO Y H, et al. Synergistic inhibitory effects of the oxyresveratrol and dacarbazine combination against melanoma cells[J]. Oncology Letters, 2021, 22(3):667.
[2] ZHAO F L, QIN J R, LIANG Y J, et al. Exploring anti-liver cancer targets and mechanisms of oxyresveratrol: In silico and verified findings[J]. Bioengineered, 2021, 12(2): 9939-9948.
[3] RODR GUEZ-BONILLA P, GAND
GUEZ-BONILLA P, GAND A-HERRERO F, MATENCIO A, et al. Comparative study of the antioxidant capacity of four stilbenes using ORAC, ABTS+, and FRAP techniques[J]. Food Analytical Methods, 2017, 10(9):2994-3000.
A-HERRERO F, MATENCIO A, et al. Comparative study of the antioxidant capacity of four stilbenes using ORAC, ABTS+, and FRAP techniques[J]. Food Analytical Methods, 2017, 10(9):2994-3000.
[4] YEOM J, MA S, KIM J K, et al. Oxyresveratrol ameliorates dextran sulfate sodium-induced colitis in rats by suppressing inflammation[J]. Molecules, 2021, 26(9): 2630.
[5] TAN H Y, TSE I M Y, LI E T S, et al. Oxyresveratrol supplementation to C57BL/6 mice fed with a high-fat diet ameliorates obesity-associated symptoms[J]. Nutrients, 2017, 9(2): 147.
[6] JIA Y N, PENG Y L, ZHAO Y P, et al. Comparison of the hepatoprotective effects of the three main stilbenes from mulberry twigs[J]. Journal of Agricultural and Food Chemistry, 2019, 67(19):5521-5529.
[7] ZENG H J, LI Q Y, MA J, et al. A comparative study on the effects of resveratrol and oxyresveratrol against tyrosinase activity and their inhibitory mechanism[J]. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy, 2021, 251:119405.
[8] SHAH A, CHAO J F, LEGIDO-QUIGLEY C, et al. Oxyresveratrol exerts ATF4- and Grp78-mediated neuroprotection against endoplasmic reticulum stress in experimental Parkinson’s disease[J]. Nutritional Neuroscience, 2021, 24(3):181-196.
[9] 熊斯, 周晋, 唐敏, 等. 桑中氧化白藜芦醇的研究进展[J]. 中医药导报, 2017, 23(12): 101-104.
XIONG S, ZHOU J, TANG M, et al. The research progress of oxyresveratrol[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2017, 23(12): 101-104.
[10] 虢小翊, 周晋, 李顺祥, 等. 氧化白藜芦醇(苷)的植物资源分布及药用价值的研究进展[J]. 科技导报, 2011, 29(30): 63-67.
GUO X Y, ZHOU J, LI S X, et al. Summary of plant resources distribution and research progress in medicinal value of oxyresveratrol and mulberroside A[J]. Science &Technology Review, 2011, 29(30):63-67.
[11] LIKHITWITAYAWUID K. Oxyresveratrol: Sources, productions, biological activities, pharmacokinetics, and delivery systems[J]. Molecules, 2021, 26(14):4212.
[12] LI J, LIN Z Y, TANG X D, et al. Oxyresveratrol extracted from Artocarpus heterophyllus Lam. inhibits tyrosinase and age pigments in vitro and in vivo[J]. Food &Function, 2020, 11(7):6595-6607.
[13] KIM J K, KIM M, CHO S G, et al. Biotransformation of mulberroside A from Morus alba results in enhancement of tyrosinase inhibition[J]. Journal of Industrial Microbiology &Biotechnology, 2010, 37(6):631-637.
[14] 赵建萍, 陈倩, 曹俊东, 等. 柘木多酚和氧化白藜芦醇的制备与其抗氧化活性研究[J]. 中国现代中药, 2018, 20(10):1288-1291.
ZHAO J P, CHEN Q, CAO J D, et al. Preparation and antioxidant activities of polyphenols and oxyresveratrol in stems of Cudrania tricuspidata[J]. Modern Chinese Medicine, 2018, 20(10):1288-1291.
[15] PARK K T, KIM J K, HWANG D, et al. Inhibitory effect of mulberroside A and its derivatives on melanogenesis induced by ultraviolet B irradiation[J]. Food and Chemical Toxicology, 2011, 49(12):3038-3045.
[16] 李鸿鹏. 白藜芦醇O-糖苷单体的制备及氧化白藜芦醇类二聚体的仿生合成[D]. 兰州: 兰州交通大学, 2020.
LI H P. Preparation of resveratrol O-glycoside monomer and biomimetic synthesis of oxyresveratrol-like dimer[D].Lanzhou: Lanzhou Jiatong University, 2020.
[17] 丁刘刚, 晏日安, 黄雪松, 等. 功能性食品配料白藜芦醇的合成方法[J]. 现代食品科技, 2007, 23(3): 83-85.
DING L G, YAN R A, HUANG X S, et al. Synthesis of a functional food ingredients resveratrol[J]. Modern Food Science and Technology, 2007, 23(3):83-85.
[18] CHOI S Y, HWANG J S, KIM S, et al. Synthesis, discovery and mechanism of 2, 6-dimethoxy-N-(4-methoxyphenyl)benzamide as potent depigmenting agent in the skin[J]. Biochemical and Biophysical Research Communications, 2006, 349(1):39-49.
[19] SUN H Y, XIAO C F, CAI Y C, et al. Efficient synthesis of natural polyphenolic stilbenes: Resveratrol, piceatannol and oxyresveratrol[J]. Chemical &Pharmaceutical Bulletin, 2010, 58(11):1492-1496.
[20] 李晓霞, 晏日安, 段翰英. 白皮杉醇的合成[J]. 精细化工, 2011, 28(5):475-478.
LI X X, YAN R A, DUAN H Y. Synthesis of piceatannol[J]. Fine Chemicals, 2011, 28(5):475-478.
[21] 郑群怡, 李志伟, 谢朝阳, 等. 氧化芪三酚的合成方法: 中国,CN103172499A[P]. 2013-06-26.
ZHENG Q Y, LI Z W, XIE C Y, et al. The synthetic method of oxyresveratrol: China, CN103172499A[P]. 2013-06-26.
[22] 李志伟, 康绍英, 陈琳, 等. 钯催化合成氧化芪三酚的研究[J]. 有机化学, 2016, 36(5):1143-1147.
LI Z W, KANG S Y, CHEN L, et al. Study on the synthesis of oxyresveratrol catalyzed by palladium[J]. Chinese Journal of Organic Chemistry, 2016, 36(5):1143-1147.
[23] OLIVEIRA R E, HIGA V M, OMORI A T. Studies toward the synthesis of caramboxin analogues[J]. Journal of the Brazilian Chemical Society, 2019, 30: 528-540.
[24] LEE I, CHOE Y S, CHOI J Y, et al. Synthesis and evaluation of 18F-labeled styryltriazole and resveratrol derivatives for β-amyloid plaque imaging[J]. Journal of Medicinal Chemistry, 2012, 55(2):883-892.
[25] LI Y Q, LI Z L, ZHAO W J, et al. Synthesis of stilbene derivatives with inhibition of SARS coronavirus replication[J]. European Journal of Medicinal Chemistry, 2006, 41(9):1084-1089.
[26] 范金波, 蔡茜彤, 冯叙桥, 等. 5种天然多酚类化合物抗氧化活性的比较[J]. 食品与发酵工业, 2014, 40(7): 77-83.
FAN J B, CAI Q T, FENG X Q, et al. The comparison of five natural phenolic compounds on antioxidant activity in vitro[J]. Food and Fermentation Industries, 2014, 40(7): 77-83.
[27] 单旺, 陈永生, 梁晓为, 等. 羟基肉桂酸衍生物的合成及其抗氧化构效关系[J]. 食品工业科技, 2017, 38(12): 287-291;332.
SHAN W, CHEN Y S, LIANG X W, et al. Synthesis and antioxidant structure-activity relationships of hydroxycinnamic acid derivatives[J]. Science and Technology of Food Industry, 2017, 38(12): 287-291;332.