姜黄素(curcumin)是一种含多个双键、酚羟基等活性基团的天然物质,具有抗氧化、抗癌和降血脂等生理活性功能[1]。然而,由于姜黄素的载药量低、水溶性低及新陈代谢快,使其生物利用度很低[2],阻碍其在食品领域中的应用。目前,已开发出多种用于姜黄素包封和递送的体系,其中,基于脂质的递送体系具有更高的姜黄素生物可及性。姜黄素负载于脂质中,脂质可在消化道内被脂肪酶水解为有助于形成胆汁盐和内源性磷脂混合胶束的2-单甘油酯和脂肪酸,同时,原本负载于脂质的姜黄素溶解于混合胶束中,成为生物可及性的(溶解的),被胃肠道吸收[3]。MIAO等[4]通过构建由多糖稳定的水包油高内相乳液使姜黄素的生物可及性提高至46.3%。LI等[5]将姜黄素置于硅涂层脂质体中,其生物可及性是姜黄素悬浮液的7.76倍。尽管上述递送体系在一定程度上改善了姜黄素的生物可及性,但是它们的制备工艺相对复杂,载药量偏低,易受外界环境影响。
目前,油凝胶是一类在食品领域研究较为广泛的有机凝胶,因其不含反式和饱和脂肪酸,不对人体健康造成危害,备受消费者的青睐,其制备工艺也相对简便,即通过凝胶剂自组装形成三维网络结构,将基料油固定在其中[6]。此外,由于其具有增溶和稳定脂溶性活性成分的作用,是负载脂溶性活性成分的理想递送体系之一,因此近年来受到食品领域研究人员的广泛关注。LI等[7]利用卵磷脂和β-谷甾醇制备的油凝胶增强了进食状态下姜黄素的生物可及性(67.66%)。有研究表明油凝胶能够通过凝胶剂形成的三维网络来减缓脂解和活性成分的释放[8]。然而,目前还没有关于通过调控油凝胶网络结构来提高负载姜黄素油凝胶的脂解程度和生物可及性方面的研究。故本研究拟采用已被美国食品与药品管理局 (Food and Drug Administration, FDA)确认为公共安全,成本低及凝胶效率高的小烛树蜡(candelilla wax,CLW)作为凝胶剂来制备负载姜黄素的油凝胶[9-10]。有研究将β-胡萝卜素负载于小烛树蜡基油凝胶中,但其负载量仅有1 mg/g,且在消化过程中其在混合胶束层的浓度仅有30 μg/g[11]。这项研究表明若仅靠CLW基油凝胶负载姜黄素,较难实现姜黄素的高负载及高生物可及性。姜黄素也因熔点高,以晶体形式存在,其物理性质与β-胡萝卜素类似,有研究者发现溶解状态的β-胡萝卜素的生物可及性远高于晶体状态的[12]。因此若将姜黄素由晶体状态转变为溶解状态,能较大程度地提高其生物可及性,此外,由于其在油中的溶解度偏低(玉米油0.08 mg/mL)[13],目前绝大多数油凝胶所负载的姜黄素含量也偏低(0.4%~1%),若鉴于其高熔点,通过高温加热使高含量的姜黄素(>1%)完全溶解在玉米油中,有望实现姜黄素的去晶体化、高负载量及较高生物可及性。此外,有研究表明单硬脂酸甘油酯油凝胶中加入司盘20可提高姜黄素的亚稳态溶解度及生物可及性[14],但上述表面活性剂是化学合成的,故本研究拟采用具有良好乳化、分散和渗透性能的天然表面活性剂葵花卵磷脂(sunflower lecithin,SFL)来协同提高姜黄素的生物可及性。有研究表明SFL的两亲特性可使其在油相或水相中均可对客体分子起到增溶作用,已被作为众多生物活性成分的载体,如维生素E和姜黄素[15-16]。
本研究以含高温加热溶解的姜黄素的玉米油为基料油,小烛树蜡为凝胶剂,同时加入不同质量分数SFL(0%、1%、3%、5%、10%)制备负载姜黄素的油凝胶,研究高温加热对姜黄素晶体、溶解度及其生物可及性的影响,并探究姜黄素的加入及不同SFL的添加量对小烛树蜡基油凝胶三维网络结构、脂解程度和姜黄素生物可及性的改善作用,以期为开发姜黄素高负载及高生物可及性的功能性食品提供理论支持。
1 材料与方法
1.1 实验原料
姜黄素,河南中大恒源生物科技有限公司;小烛树蜡,上海阿拉丁生化科技有限公司;葵花卵磷脂,上海安康精细化工有限公司;玉米油,益海嘉里(南昌)粮油食品有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
T6新世纪紫外可见分光分度计,北京普析通用仪器有限责任公司;D8 Advance X-射线衍射仪,德国布鲁克有限公司;MCR302旋转流变仪,美国安东帕有限公司;TA型物性测试仪,英国Stable Micro System公司;DM2700P偏振光显微镜,德国Leica公司;Pyris Diamond示差扫描量热仪,美国PE公司;Metrohm 907自动电位滴定仪,瑞士万通公司。
1.3 实验方法
1.3.1 负载姜黄素油凝胶样品制备
称取150 g的玉米油,将其置于恒温磁力搅拌器上加热至150 ℃后,加入9 g的姜黄素,继续加热搅拌至姜黄素完全溶解(Cur-Oil),之后冷却至室温,6 000 r/min离心10 min,取上清液;随后向上述上清液中加入质量分数为12%的CLW和不同质量分数的SFL(0%、1%、3%、5%、10%),90 ℃加热搅拌30 min后,样品转移到4 ℃冰箱中过夜冷却,获得不同的油凝胶样品(0%SFL,1%SFL,3%SFL,5%SFL和10%SFL)。为探究姜黄素对油凝胶特性的影响,参照上述方法制备未添加姜黄素的空白油凝胶(OGCtrl);为探究高温加热对姜黄素晶体及消化特性的影响,以未经加热的姜黄素玉米油悬浮液为对照组(oil dispersion)。
1.3.2 微观结构分析
在室温下,取适量样品置于载玻片上,用镊子将盖玻片小心地盖在样品上,使用连接Canon数码相机的偏光显微镜观察油凝胶及姜黄素晶体的微观形态,并拍照记录。
1.3.3 差示扫描量热法分析
称取5.0~10.0 mg样品置于坩埚中并密封,以空坩埚为空白对照。将样品从25 ℃加热至200 ℃,加热速率为10 ℃/min,N2流速为40 mL/min[17]。
1.3.4 晶体结构分析
采用X-射线衍射法(X-ray diffraction,XRD)分析样品晶体结构,将适量的样品均匀平铺在检测片圆孔中,测量过程中使用的仪器参数:Cu-Kα放射源,工作电压为40 kV,工作电流为30 mA,反发射狭缝为1.0 mm,接收狭缝为0.1 mm,2θ角的扫描范围为5°~90°,扫描速度为5°/min,使用软件Jade 6.0对所得图谱进行分析。
1.3.5 流变特性的测定
采用配备有PP-50平板夹具的旋转流变仪对油凝胶的流变特性进行表征[17]。取适量油凝胶于测试台上,测量时上下板之间的间隙固定为500 μm。首先,进行动态应变扫描以获得线性黏弹性区域,之后在0.01~100 s-1测定凝胶的表观剪切黏度,随后对凝胶进行0.1至100 rad/s的频率扫描以获得其储能模量(G′)和损耗模量(G″)。
1.3.6 硬度测定
取适量油凝胶于10 mL螺口玻璃瓶中,并确保凝胶表面光洁平整,使用质构仪对凝胶进行硬度测定。采用P 0.5R探头,测前速率为5 mm/s,测中速率为1 mm/s,测后速率1 mm/s,触发力为5.0 g,下压距离为10.0 mm。每个样品重复测量3次后取平均值。
1.3.7 姜黄素含量的测定
称取0.1 g的含姜黄素的样品于2 mL离心管中,随后加入0.9 mL无水乙醇,8 000 r/min离心5 min后,收集上清液,重复此步骤6次[18]。将收集的上清液用无水乙醇稀释一定的倍数,在420 nm处测定样品的吸光度,根据标准曲线计算得出样品中姜黄素的浓度。
1.3.8 模拟体外消化
参考CHEN等[19]的方法采用三步模拟消化模型(口腔、胃和肠道)进行体外胃肠道消化实验。试验之前,将适量样品与蒸馏水混合,将最终油脂质量分数调整至2.7%,随后加入消化液,在37 ℃以100 r/min振荡孵育。模拟消化结束后,收集消化液并将其立即放入冰水浴中,冷却10 min后,将所收集的消化液在4 ℃下以10 000 r/min离心30 min,收集中间胶束层,以三氯甲烷为萃取剂,萃取胶束层中的姜黄素,在420 nm处测定所收集萃取液吸光度,根据标准曲线计算出姜黄素的浓度。姜黄素的生物可及性可通过先前研究中描述的公式(1)进行计算[19]。
生物可及性![]()
(1)
式中:CInitial,模拟消化系统中姜黄素的初始浓度,mol/L;CMicelle,胶束层中姜黄素的浓度,mol/L。
通过自动电位滴定仪测定小肠消化阶段游离脂肪酸(free fatty acid,FFA)的释放,即自动电位滴定仪在37 ℃下连续向消化液中添加0.1 mol/L NaOH 以使消化液pH恒定在7.0,从样品中释放的FFA的量由消耗的NaOH的体积计算,假设1分子甘油三酯被脂肪酶水解成1个单酰基甘油和2个FFA。FFA的释放量根据公式(2)确定:
FFA释放量![]()
(2)
式中:CNaOH,NaOH的摩尔浓度,mol/L;VNaOH,中和游离脂肪酸消耗NaOH的总体积,L;MLipid,脂质的摩尔质量,g/mol;WLipid,样品中脂质的总质量,g。
1.3.9 数据统计与分析
所有实验重复3次,数据以平均值±标准偏差表示。采用SPSS 24.0进行统计分析,通过单因素方差分析获得总体显著性差异(P<0.05)。
2 结果与分析
2.1 微观结构分析
使用偏正光显微镜对姜黄素的溶解状态,以及油凝胶的晶体形态及晶体网络结构进行观察(图1)。在Oil dispersion中观察到明亮的黄色斑点(图1-a),表明存在姜黄素晶体。但姜黄素经150 ℃加热处理后,负载姜黄素的玉米油及油凝胶均未观察到姜黄素晶体(图1-b, 图1-d~图1-h),说明高温加热可实现姜黄素的去晶体化,此外,经测定,这些样品中姜黄素的含量约为2.7%。另外,观察到CLW以簇状晶体的形态存在,并形成众多聚集体,这些聚集体相互间作用形成三维凝胶网络。姜黄素的加入并不会影响凝胶结构(图1-c, 图1-d),但加入SFL后,凝胶晶体网络结构的致密度随着SFL添加量的增加而降低(图1-d~图1-h),这可能是因为磷脂吸附在了CLW晶体的生长点上,从而改变了CLW晶体的形态和排列方式[20]。

a-Oil dispersion;b-Cur-Oil;c-OGCtrl;d-0%SFL;e-1%SFL;f-3%SFL;g-5%SFL;h-10%SFL
图1 姜黄素玉米油及油凝胶的微观结构
Fig.1 Microstructure of curcumin corn oil and oleogels
2.2 热力学特性及晶型分析
为了再次验证高温加热可实现姜黄素的去晶体化及了解SFL对油凝胶样品晶体结构的影响,对所有样品进行热力学和晶型结构分析(图2)。由图2-a可见,只有Oil dispersion在176.42 ℃处出现尖锐的峰,即姜黄素晶体熔化[21],这与前面偏振光分析结果一致。图2-b显示了Cur-Oil、OGCtrl、0%SFL、1%SFL、3%SFL、5%SFL、10%SFL的XRD图谱,在这些图谱中均未出现姜黄素晶体的衍射峰,这一结果再次验证了姜黄素的去晶体化。此外,在油凝胶的XRD图谱中,均在0.414和0.373 nm附近出现2个尖锐的衍射峰,表明油凝胶的凝胶晶型为β′型[22],这一结果说明不同浓度的SFL和姜黄素的加入并不会影响油凝胶的晶型。根据经典油脂化学的理论,β′晶型更易形成能够束缚住大量液体油的三维网络结构以及构成口感最佳的固体脂肪。
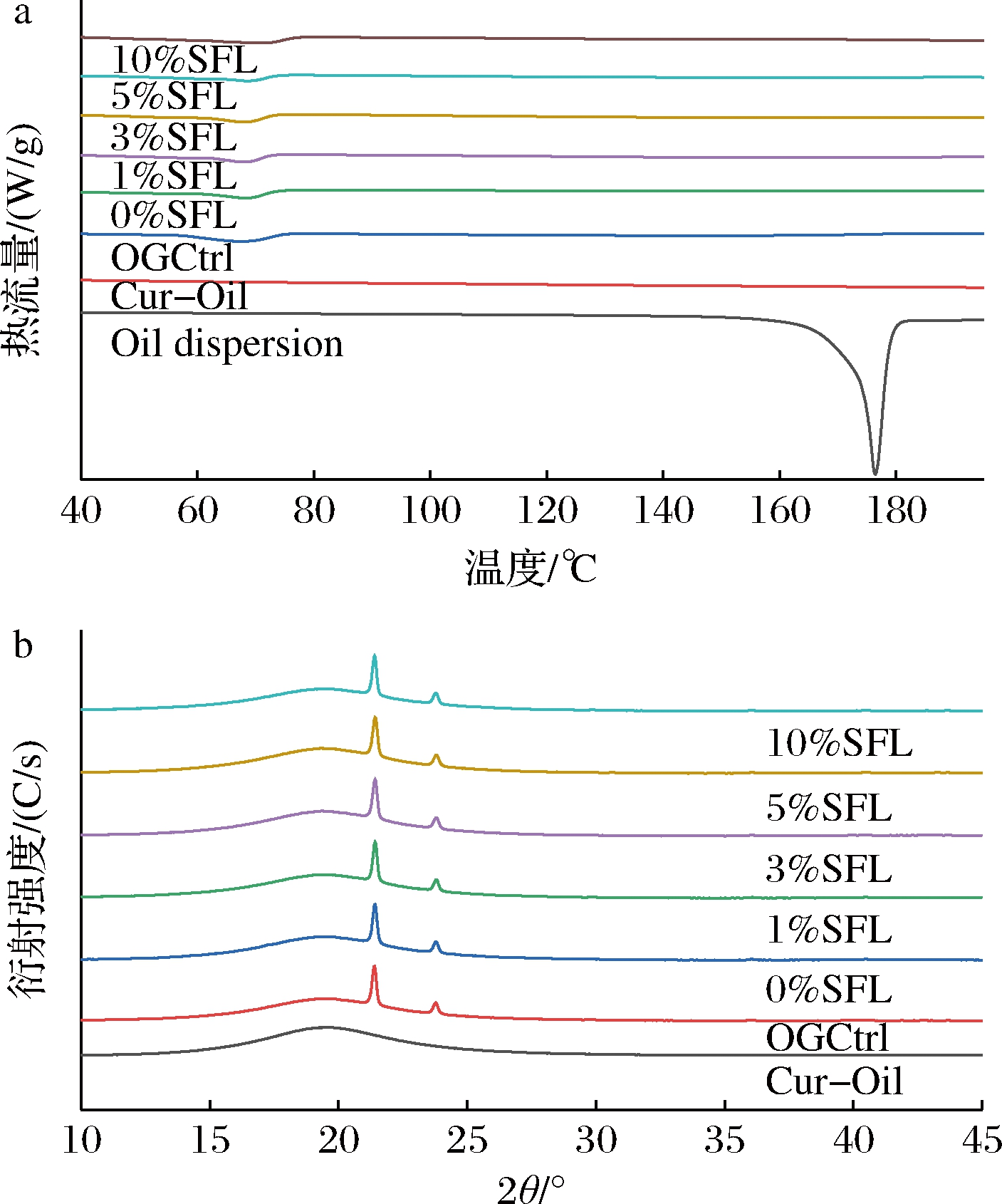
a-熔化曲线;b-XRD图谱
图2 姜黄素玉米油及油凝胶的熔化曲线和XRD图谱
Fig.2 Melting curves and XRD patterns of curcumin corn oil and oleogels
2.3 流变特性分析
图3分别为不同油凝胶样品的剪切扫描和频率扫描,用于分析不同SFL含量对油凝胶样品的宏观结构特性。如图3-a所示,所有油凝胶的表观黏度均随着剪切速率的增加而降低,这一结果可能是因为施加到油凝胶上的剪切力使凝胶结构逐渐分解,并对结构造成不可逆的破坏所导致的[17]。此外,仅仅加入姜黄素并没有对油凝胶的初始表观黏度造成显著性影响,但加入SFL后,油凝胶的初始表观黏度发生较大程度的下降,且随着SFL含量增加而逐步降低,表明SFL的加入会对凝胶质地造成影响。

a-剪切扫描;b-频率扫描
图3 不同油凝胶的剪切扫描和频率扫描曲线
Fig.3 Shear sweep and frequency sweep curves of different oleogels
油凝胶的总G′值可用来反应凝胶强度,如图3-b所示,OGCtrl的凝胶强度最强,其次是0%SFL,油凝胶的凝胶强度随着SFL含量的增加而减弱。有研究表明油凝胶的凝胶强度主要与其所含结晶结构的数量及结晶结构间的交联程度有关[23]。研究结果表明油凝胶中SFL含量越高,其所含结晶结构越少,结晶结构间的交联程度越弱,凝胶结构越松散,与前面油凝胶微观结构分析结果一致。此外,在整个频率范围内,OGCtrl的G′均小于G″,表现出黏性特征,但加入姜黄素和质量分数为1%的SFL后,油凝胶的G′大于G″,表现出弹性特征,当SFL的添加量高于3%后,随着扫描频率的增加,油凝胶的G′先大于G″,随后与G″交叉,之后小于G″,表明油凝胶由弹性特征转变为黏性特征。因此油凝胶的流变学特性可通过SFL的含量来进行调控。
2.4 硬度分析
硬度是在设计递送体系时需要考虑的一个重要参数,因为它可能会影响油凝胶在消化过程中的分解程度,进而影响所负载的生物活性成分的生物可及性[24]。由图4-a所示,所有油凝胶经倒立放置后,均呈现出固体凝胶的状态,但它们的硬度存在一定的差异性(图4-b)。0%SFL的硬度均显著低于OGCtrl(P<0.05),这可能是因为OGCtrl的表面形成了坚硬的外壳,其在测量过程中触发了相当高的阻力,但加入姜黄素后,这一影响在很大程度上被削弱[17]。此外,本研究所制备油凝胶样品的硬度随SFL含量的增加而降低,且当SFL的质量分数从5%增加到10%时,油凝胶的硬度变化差异不显著(P>0.05),这一结果表明可通过调控SFL的含量对凝胶的机械强度进行调节,进而调节凝胶的质地和口感,可广泛应用于固体与半固体食品中。

a-外观形态;b-及硬度
图4 不同油凝胶的外观形态及硬度
Fig.4 The appearance and hardness of different oleogels
2.5 体外消化特性分析
油凝胶作为一种负载姜黄素的递送体系,在人体消化过程中需释放姜黄素,并达到较高的姜黄素生物可及性,才能实现最终的递送目的,而油凝胶的脂肪分解程度会直接影响姜黄素的释放,进而影响姜黄素生物可及性。本研究采用模拟胃肠道模型评估姜黄素经去晶体化后、油凝胶内三维凝胶网络结构以及不同SFL含量对油凝胶的脂解程度和姜黄素生物可及性的影响(图5)。
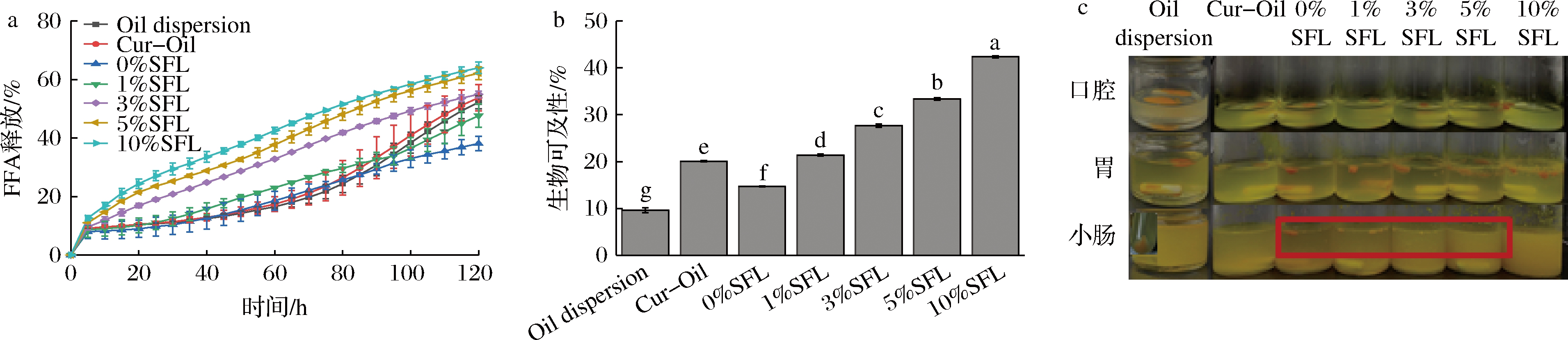
a-FFA释放曲线;b-姜黄素的生物可及性;c-每个模拟消化阶段末的外观图
图5 负载姜黄素样品的FFA释放曲线,姜黄素的生物可及性,每个模拟消化阶段末的外观图
Fig.5 FFA release profiles of curcumin loaded samples, bioaccessibility of curcumin, visual appearance of curcumin loaded samples at the end of each simulated digestion stage
由图5-a所示,在小肠消化阶段的前5 min,所有样品的FFAs释放速率均急剧增加,可能是因为样品中存在少量自由分散的小油滴,它们与脂肪酶接触面积较大。之后,所有样品的FFAs释放速率均减慢,但存在一定的差异性。Oil dispersion、Cur-Oil和0%SFL的FFAs释放速率最为缓慢,但前两者的最终FFAs释放量比0%SFL高,表明油凝胶内三维凝胶网络结构会影响FFAs的释放,这可能是因为凝胶结构会阻碍脂肪酶进入甘油三酯消化位点,进而影响FFAs的最终释放量。随着SFL的加入量增加,FFAs的释放速率及释放量在逐渐加快和增多,当SFL的加入量达到10%后,其释放速率达到最快,释放量最多,说明SFL的加入及其含量的增加可以加快油脂的脂解速率,这可能是因为在消化过程中,脂解产物聚集在油水界面上,阻碍脂肪酶与内部油脂接触,但是样品中所加入的SFL可与消化液中的猪胆盐形成很多外源性卵磷脂-猪胆盐混合胶束,其可促进脂解产物增溶于消化液中,达到移除脂解产物的目的,进而提高脂解速率[18]。
生物可及性是衡量生物活性分子从脂质相转移至混合胶束的百分比,处于混合胶束中的生物活性成分被肠道上皮细胞所吸收利用以实现有效的生物转化。如图5-b所示,Cur-Oil的生物可及性是Oil dispersion的2.1倍左右,表明姜黄素经去晶体化可显著地提高其生物可及性。0%SFL的生物可及性比Cur-Oil低,姜黄素生物可及性随着SFL含量的增加而显著增加,当SFL含量达到10%时,其生物可及性显著提高至(42.35±0.25)%(P< 0.05),此外,由图5-c可知,不同油凝胶样品的凝胶结构在长时间的机械振荡和消化酶的作用下逐渐分解,小肠消化结束后,只有10%SFL被完全分解,而其他样品则具有不同程度的保留,这一结果与前面凝胶硬度及脂解程度分析一致,另外,各样品消化液的颜色也与其生物可及性对应,其中Oil dispersion消化液经10 000 r/min离心30 min后,可以明显观察到离心管底部存在大量姜黄素粉末。综上所述,添加SFL及增加其含量可提高姜黄素生物可及性的原因可能归因于:(1)SFL含量增加,有利于形成更多溶解姜黄素的胆汁盐-磷脂酰胆碱混合胶束;(2)凝胶网络结构的松散程度和凝胶硬度对姜黄素生物可及性有一定影响,凝胶结构越松散,质地越柔软,越易被脂肪酶分解,进而姜黄素释放量更高,这与YANG等[25]的研究结果一致。
3 结论
本研究通过对姜黄素进行高温加热并添加小烛树蜡和葵花卵磷脂协同制备负载姜黄素油凝胶,偏振光、热力学及XRD分析结果表明姜黄素经150 ℃加热后,实现了姜黄素去晶体化及高负载(含量约2.7%)的目的。添加姜黄素及葵花卵磷脂并不会对凝胶晶型结构产生影响(β′型)。凝胶结构分析结果表明,与空白油凝胶相比,去晶体化姜黄素的加入对油凝胶的凝胶强度及网络结构无显著影响,通过调控葵花卵磷脂的添加量可实现对负载姜黄素油凝胶的凝胶结构调节,进而调控其流变及质地特性。体外模拟消化研究结果表明经加热去结晶化姜黄素可显著提高姜黄素的生物可及性。此外,随葵花卵磷脂含量的提高,油凝胶的脂解程度及姜黄素生物可及性增加,其中凝胶脂解程度的提升与凝胶网络结构减弱、硬度降低、便于消化酶的吸附有关,姜黄素生物可及性的增加可归因于姜黄素的充分释放及形成胆汁盐-磷脂酰胆碱混合胶束增多。因此,本研究可为开发姜黄素高负载及高生物可及性的功能食品提供一些有效见解。
[1] SHARIFI-RAD J, RAYESS Y E, RIZK A A, et al.Turmeric and its major compound curcumin on health:Bioactive effects and safety profiles for food, pharmaceutical, biotechnological and medicinal applications[J]. Frontiers in Pharmacology, 2020, 11:01021.
[2] LIU W D, ZHAI Y J, HENG X Y, et al.Oral bioavailability of curcumin:Problems and advancements[J].Journal of Drug Targeting, 2016, 24(8):694-702.
[3] CALLIGARIS S, ALONGI M, LUCCI P, et al.Effect of different oleogelators on lipolysis and curcuminoid bioaccessibility upon in vitro digestion of sunflower oil oleogels[J].Food Chemistry, 2020, 314:126146.
[4] MIAO J Y, XU N, CHENG C, et al.Fabrication of polysaccharide-based high internal phase emulsion gels:Enhancement of curcumin stability and bioaccessibility[J].Food Hydrocolloids, 2021, 117:106679.
[5] LI C, ZHANG Y, SU T T, et al.Silica-coated flexible liposomes as a nanohybrid delivery system for enhanced oral bioavailability of curcumin[J].International Journal of Nanomedicine, 2012, 7:5995-6002.
[6] MARTINS A J, VICENTE A A, CUNHA R L, et al.Edible oleogels:An opportunity for fat replacement in foods[J]. Food &Function, 2018, 9(2):758-773.
[7] LI L L, WAN W B, CHENG W W, et al.Oxidatively stable curcumin-loaded oleogels structured by β-sitosterol and lecithin:Physical characteristics and release behaviour in vitro[J].International Journal of Food Science &Technology, 2019, 54(7):2502-2510.
[8] O’SULLIVAN C M, BARBUT S, MARANGONI A G.Edible oleogels for the oral delivery of lipid soluble molecules:Composition and structural design considerations[J]. Trends in Food Science &Technology, 2016, 57:59-73.
[9] TORO-VAZQUEZ J F, MORALES-RUEDA J A, DIBILDOX-ALVARADO E, et al.Thermal and textural properties of organogels developed by candelilla wax in safflower oil[J].Journal of the American Oil Chemists’ Society, 2007, 84(11):989-1000.
[10] ALVAREZ-RAMIREZ J, VERNON-CARTER E J, CARRERA-TARELA Y, et al.Effects of candelilla wax/canola oil oleogel on the rheology, texture, thermal properties and in vitro starch digestibility of wheat sponge cake bread[J].LWT, 2020, 130:109701.
[11] LI L T, TAHA A, GENG M J, et al.Ultrasound-assisted gelation of β-carotene enriched oleogels based on candelilla wax-nut oils:Physical properties and in-vitro digestion analysis[J].Ultrasonics Sonochemistry, 2021, 79:105762.
[12] XIA Z Y, MCCLEMENTS D J, XIAO H.Influence of physical state of β-carotene (crystallized versus solubilized) on bioaccessibility[J].Journal of Agricultural and Food Chemistry, 2015, 63(3):990-997.
[13] 古成. 魔芋甘露聚糖稳定姜黄素纳米乳状液及其缓释消化研究[D].哈尔滨:哈尔滨工业大学, 2019.
GU C.Study on curcumin nanoemulsion stabilized by konjac mannan and its slow release digestion[D].Harbin:Harbin Institute of Technology, 2019.
[14] YU H L, SHI K, LIU D, et al.Development of a food-grade organogel with high bioaccessibility and loading of curcuminoids[J].Food Chemistry, 2012, 131(1):48-54.
[15] OZTURK B, ARGIN S, OZILGEN M, et al.Formation and stabilization of nanoemulsion-based vitamin E delivery systems using natural surfactants:Quillaja saponin and lecithin[J].Journal of Food Engineering, 2014, 142:57-63.
[16] PENG S F, ZOU L Q, LIU W, et al.Fabrication and characterization of curcumin-loaded liposomes formed from sunflower lecithin:Impact of composition and environmental stress[J].Journal of Agricultural and Food Chemistry, 2018, 66(46):12421-12430.
[17] LIU N, LU Y, ZHANG Y H, et al.Surfactant addition to modify the structures of ethylcellulose oleogels for higher solubility and stability of curcumin[J].International Journal of Biological Macromolecules, 2020, 165:2286-2294.
[18] 万文博. 荷载姜黄素油脂凝胶的制备及性能研究[D].广州:华南理工大学, 2016.
WAN W B.Preparation and properties of curcumin loaded grease gel[D].Guangzhou:South China University of Technology, 2016.
[19] CHEN X, MCCLEMENTS D J, WANG J A, et al.Coencapsulation of (-)-epigallocatechin-3-gallate and quercetin in particle-stabilized W/O/W emulsion gels:Controlled release and bioaccessibility[J].Journal of Agricultural and Food Chemistry, 2018, 66(14):3691-3699.
[20] OKURO P K, TAVERNIER I, BIN SINTANG M D, et al.Synergistic interactions between lecithin and fruit wax in oleogel formation[J].Food &Function, 2018, 9(3):1755-1767.
[21] GUPTA N K, DIXIT V K.Bioavailability enhancement of curcumin by complexation with phosphatidyl choline[J].Journal of Pharmaceutical Sciences, 2011, 100(5):1987-1995.
[22] RAM REZ-CARRASCO P, PAREDES-TOLEDO J, ROMERO-HASLER P, et al.Effect of adding curcumin on the properties of linseed oil organogels used as fat replacers in P
REZ-CARRASCO P, PAREDES-TOLEDO J, ROMERO-HASLER P, et al.Effect of adding curcumin on the properties of linseed oil organogels used as fat replacers in P tés[J].Antioxidants, 2020, 9(8):735.
tés[J].Antioxidants, 2020, 9(8):735.
[23] DA PIEVE S, CALLIGARIS S, PANOZZO A, et al.Effect of monoglyceride organogel structure on cod liver oil stability[J].Food Research International, 2011, 44(9):2978-2983.
[24] GUO Q, YE A Q, LAD M, et al.Behaviour of whey protein emulsion gel during oral and gastric digestion:Effect of droplet size[J].Soft Matter, 2014, 10(23):4173-4183.
[25] YANG S, ZHU M P, WANG N, et al.Influence of oil type on characteristics of β-sitosterol and stearic acid based oleogel[J].Food Biophysics, 2018, 13(4):362-373.