明胶是来源于动物胶原蛋白的天然高分子化合物,价格低廉,具有良好的持水性、成膜性和凝胶性等,在食品行业中应用广泛[1]。但明胶在制备过程中由于酸、碱和高温的作用,胶原蛋白的三螺旋结构会被不同程度破坏,导致明胶在用于包埋与递送等体系中时稳定性欠佳,不能完全满足食品加工需求[2-3]。
为扩大明胶在食品行业中应用范围,通常对明胶进行改性处理改善其功能。常见的蛋白质改性方法有物理、化学和酶法改性,化学改性有酰基化、磷酸化和糖基化改性等,基于美拉德反应途径的糖基化反应操作简单,效果明显,不需添加其他催化剂[4]。美拉德前期反应会使蛋白质和还原糖共价结合形成糖蛋白,此过程可由干法或湿法催化,干法反应比湿法反应温和,反应条件更可控,蛋白质变性程度更低,可使糖基化反应缓慢进行[5]。美拉德反应前期产物Amadori重排产物(Amadori rearrangement product, ARPs)、中期降解产物还原酮以及末期聚合产物类黑精等都具有抗氧化活性[6]。已有研究报道,乳清分离蛋白[7]、大米酶解蛋白[8]和甘薯蛋白水解产物[9]的美拉德糖基化改性都可以提高其抗氧化性。但目前明胶糖基化改性聚焦于改善功能特性,对糖基化反应改善明胶抗氧化活性的研究少有报道。
明胶稳定乳液在使用时倾向形成大液滴,稳定性较差[10]。相关研究表明,多糖和蛋白质糖基化交联可改善蛋白质在油水界面的厚度和机械强度,有利于蛋白质乳化稳定性提高[5]。单糖糖基化反应活性较强,但易产生美拉德反应副产物,褐变明显,不宜用于乳液中[11]。低聚甘露糖是葡甘聚糖水解之后的多羟基糖,具有多种生理活性,可作为糖基化反应良好的羰基供体[12],但目前用低聚甘露糖进行蛋白质糖基化改性未见报道。
明胶的乳化性和抗氧化性对其作为包埋壁材和递送载体的稳定性与保护性有重要影响[13]。本研究选取不同干热时间,分别比较明胶与低聚甘露糖(低聚糖)和多糖(麦芽糊精)糖基化反应后结构、乳化性和抗氧化活性变化情况,以期为明胶乳化性和抗氧化性的改善提供参考。
1 材料与方法
1.1 材料与试剂
A型明胶(凝胶强度约220 g Bloom),河南博洋生物科技有限公司;麦芽糊精(还原糖当量15~20),济南长风新材料有限公司;低聚甘露糖(聚合度2~10),郑州宇控生物科技有限公司;邻苯二甲醛(o-phthalaldehyde,OPA),上海阿拉丁生化科技股份有限公司;SDS-PAGE凝胶快速制备试剂盒,兰杰柯科技有限公司;ABTS、DPPH,上海源叶生物科技有限公司;宽分子质量标准蛋白Marker,北京中科瑞泰生物科技有限公司;本研究其他试剂均为分析纯。
1.2 主要仪器
759紫外可见分光光度计,上海菁华科技仪器有限公司;SY-10真空冷冻干燥机,北京松源华兴科技发展有限公司;XHF-DY高速分散器,宁波新芝生物科技股份有限公司;Power PacTM基础电泳仪,美国Bio-Rad公司;5804R多功能台式冷冻离心机,德国艾本德公司;UltraScan PRO测色仪,美国HunterLab公司;Spectrum 100傅里叶变换红外光谱仪,美国珀金埃尔默公司;Nano ZS90纳米粒度仪,英国马尔文公司。
1.3 实验方法
1.3.1 糖基化明胶的制备
采用干法制备糖基化明胶[2],准确称取一定量明胶,室温去离子水溶胀2 h,40 ℃水浴搅拌溶解1 h,使终质量浓度为0.1 g/mL,并将麦芽糊精和低聚甘露糖分别用去离子水配制为0.1 g/mL的溶液,按照V(明胶)∶V(糖)=2∶1的比例混合2种溶液。用0.1 mol/L NaOH和0.1 mol/L HCl调节混合溶液pH至7,40 ℃搅拌1 h,冷冻干燥。将冻干粉分别置于底部装有饱和KCl溶液的干燥器中,65 ℃(相对湿度为79%)分别干热反应24 h和48 h,冷冻干燥得糖基化明胶。原始明胶进行同样干热处理作为对照。将原始明胶记为G,麦芽糊精记为MD,麦芽糊精和明胶糖基化产物记为MD-G,低聚甘露糖记为OM,低聚甘露糖和明胶糖基化产物记为OM-G。
1.3.2 接枝度测定
接枝度采用OPA法测定,参考文献[14]的方法制备OPA试剂。测定时,取3 mL OPA试剂与0.2 mL 1 mg/mL样品溶液混合,室温反应5 min,340 nm处测定吸光值,去离子水作为空白对照。用相同方法,以赖氨酸作标准曲线,根据曲线方程计算样品中游离氨基含量。接枝度计算如公式(1)所示:
接枝度![]()
(1)
式中:w0,原始明胶的游离氨基含量;ws,糖基化明胶的游离氨基含量。
1.3.3 色差测定
分光测色仪用标准黑色背景板校准,均一样品粉末装入透明塑料自封袋,平铺整齐,在塑封袋上取三点测定样品L*、a*、b*值。
1.3.4 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)测定
对糖基化明胶进行FT-IR测定,扫描区间为4 000~600 cm-1,分辨率为4 cm-1,扫描32次,对谱图1 600~1 700 cm-1范围去卷积并二阶导拟合(R2>0.999),计算二级结构相对含量。
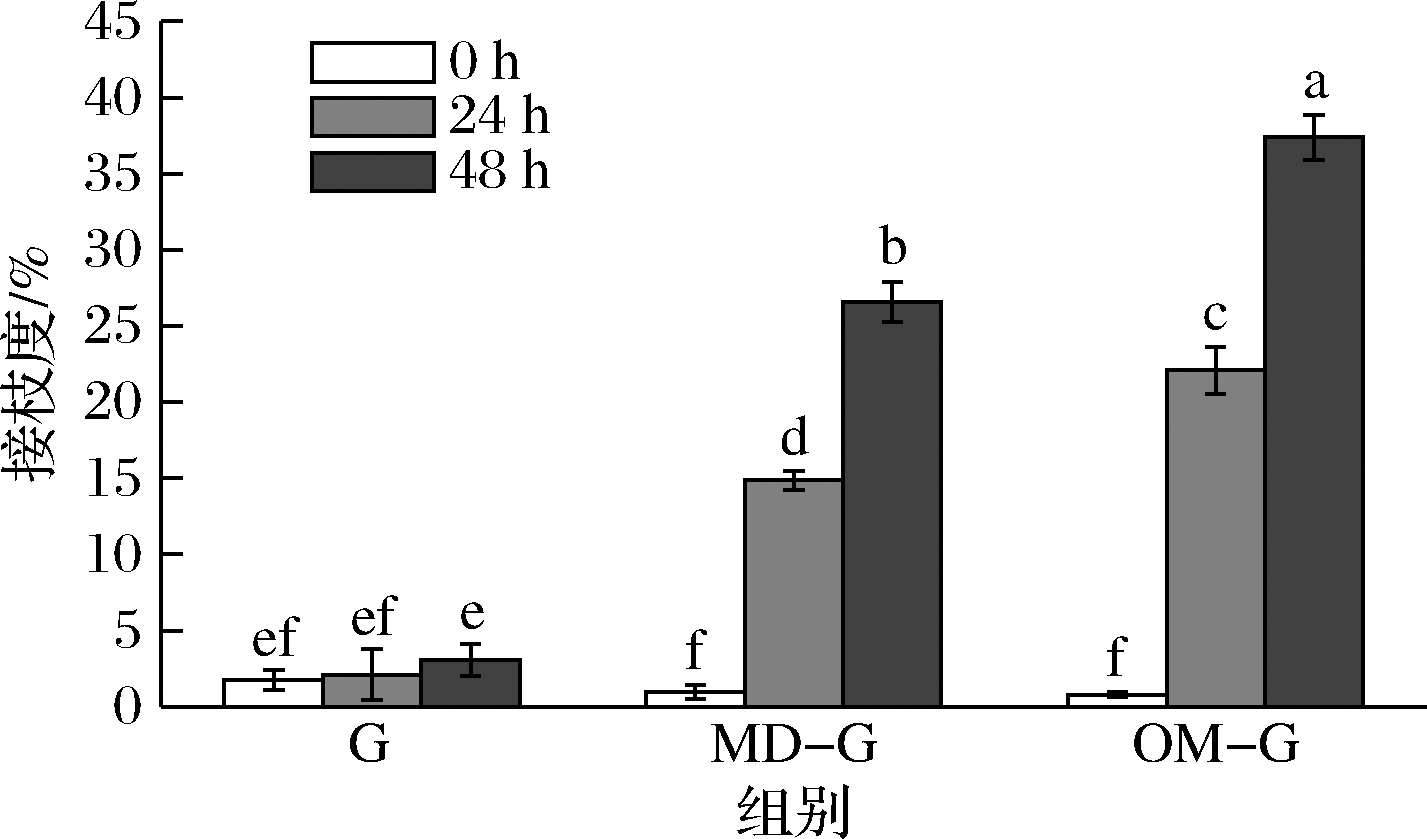
图1 原始明胶和糖基化明胶的接枝度
Fig.1 The grafting degree of the gelatin and the glycated gelatin
注:组间不同字母表示差异显著(P<0.05)(下同)。
1.3.5 分子质量分布测定
参考刘廷薇等[15]的方法并略做修改。配制质量分数为5%和6%的浓缩胶和分离胶。5 mg/mL样品溶液和4倍上样缓冲液涡旋混匀,煮沸6 min,冷却后上样15 μL,并上样5 μL标准蛋白。设置电泳仪初始电压为80 V,待条带进入分离胶,调节电源至120 V。条带到达分离胶底部时,停止电泳,取出凝胶用去离子水冲洗,并用考马斯亮蓝R-250染色液染色3 h,脱色至背景透明,观察分子质量分布。
1.3.6 乳化活性指数和乳化稳定性指数测定
通过比浊法测定乳化特性[16],配制pH为7的10 mg/mL的样品溶液,以10 000 r/min的转速将30 mL样品溶液与10 mL大豆油均质2 min。取0 min和10 min时的管底乳液50 μL分别加入至5 mL 质量分数为0.1%的SDS溶液中,混匀后在500 nm下测定稀释溶液的浊度。乳化活性指数和乳化稳定性指数通过下列公式(2)和公式(3)计算:
乳化活性![]()
(2)
乳化稳定性![]()
(3)
式中:A0,0 min时稀释乳液的吸光值;A10,10 min时稀释乳液的吸光值;μ,稀释因子;ρ,样品质量浓度,g/mL;θ,大豆油体积比例0.25。
1.3.7 乳液平均粒径测定
配制10 mg/mL的样品溶液,与其3倍体积的大豆油混合,10 000 r/min均质1 min,静置4 h,稀释至 0.1 mg/L,随后使用纳米粒度仪进行粒径测定[16]。
1.3.8 Fe3+还原能力测定
参考WANG等[7]的方法并做适当修改,取质量浓度为1 mg/mL的样品溶液1 mL,加入到不同具塞试管,并加入2.5 mL 0.2 mol/L磷酸缓冲液(pH 6.6)和2.5 mL质量分数为1%铁氰化钾溶液,混合均匀。50 ℃水浴振荡20 min,加入2.5 mL质量分数为10%三氯乙酸,3 500 r/min离心10 min。取2.5 mL上清液加入2.5 mL去离子水和0.5 mL质量分数为0.1% FeCl3溶液,混合均匀,静置10 min,700 nm处测定吸光值,以维生素C(Vc)作标准曲线,还原能力用Vc当量表示。
1.3.9 DPPH自由基清除能力测定
参考KCHAOU等[17] 的方法并适当修改,取0.1 mmol/L DPPH乙醇溶液2 mL与1 mg/mL样品溶液等体积混合、摇匀。黑暗条件室温反应30 min,517 nm处测定吸光度,以去离子水为空白对照。DPPH自由基清除能力按公式(4)计算:
DPPH自由基清除率![]()
(4)
式中:A2,样品溶液与DPPH溶液等体积混合吸光值;A1,样品溶液与乙醇溶液等体积混合吸光值;A0,去离子水与DPPH溶液等体积混合吸光值。
1.3.10 ABTS阳离子自由基清除能力测定
参考TAN等[18]的方法并适当修改。ABTS工作液配制:分别将ABTS溶液(7 mmol/L)和过硫酸钾溶液(2.45 mmol/L)等体积混合,室温放置12 h,用pH为7.4的磷酸盐缓冲液稀释混合液,使其734 nm处吸光度为0.70±0.02。测定时,取1 mg/mL样品溶液0.2 mL加入3 mL ABTS工作液,混合均匀,避光放置5 min,在波长734 nm处测定吸光度,以抗氧化剂Trolox作标曲,清除能力用Trolox当量表示。
1.4 数据处理
用SPSS 25.0、Excel 2019和peakfit 4.0软件进行数据分析,所有实验平行3次,数据以平均值±标准偏差表示,结果用Origin 9.5软件作图表示。
2 结果与分析
2.1 接枝度分析
OPA法可测定试样游离氨基含量,赖氨酸中游离氨基是主要的糖基化位点,游离氨基含量变化可反映明胶糖基化程度[14]。如图1所示,原始明胶的接枝度在干热过程中保持在较低水平且无显著变化(P>0.05),干热时间越长,糖基化明胶接枝度越高。MD-G和OM-G干热24 h时的接枝度分别为14.87%和22.09%,而到干热48 h时则为26.59%和37.40%,相同干热时间下,OM-G的接枝度显著高于MD-G(P<0.05)。这是因为多糖和蛋白的糖基化反应受空间位阻影响较大,并且在糖与蛋白质比例相同的情况下,分子质量更小的糖具有更多反应位点[11],因此多糖的糖基化速度也比低聚糖更慢,SPOTTI等[19]的研究也发现葡聚糖的分子质量越小,和乳清蛋白的糖基化反应程度越高。总的来说,低聚甘露糖的糖基化反应活性比麦芽糊精更强,并且干热48 h后的MD-G和OM-G糖基化程度都维持在较低水平(接枝度<40%)。
2.2 色差分析
褐变是美拉德反应的重要标志,美拉德反应末期产生的类黑精等产物会导致食品褐变,褐变可以反映出糖基化程度[6]。如表1和图2所示,原始明胶在干热过程中也会产生颜色变化,但变化程度弱于糖基化明胶。
表1 原始明胶和糖基化明胶的色度
Table 1 Color of the gelatin and the glycated gelatin
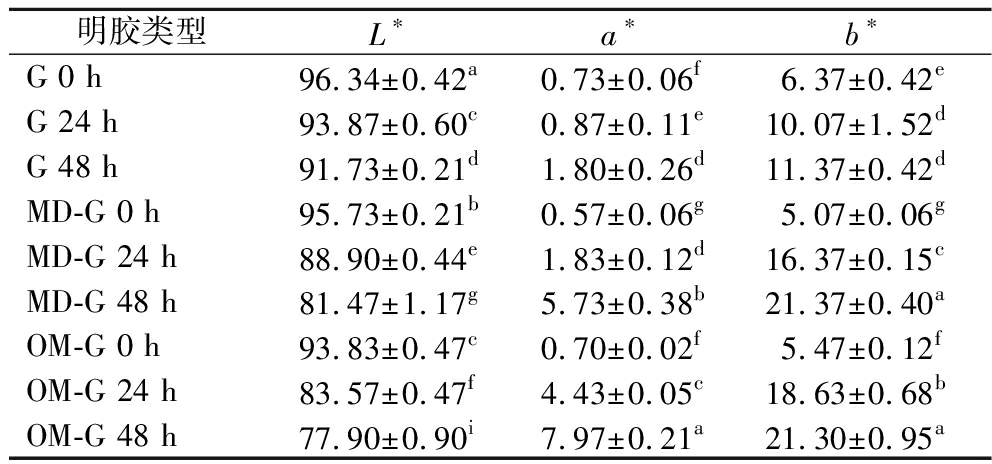
明胶类型L∗a∗b∗G 0 h96.34±0.42a0.73±0.06f6.37±0.42eG 24 h93.87±0.60c0.87±0.11e10.07±1.52dG 48 h91.73±0.21d1.80±0.26d11.37±0.42dMD-G 0 h95.73±0.21b0.57±0.06g5.07±0.06gMD-G 24 h88.90±0.44e1.83±0.12d16.37±0.15cMD-G 48 h81.47±1.17g5.73±0.38b21.37±0.40aOM-G 0 h93.83±0.47c0.70±0.02f5.47±0.12fOM-G 24 h83.57±0.47f4.43±0.05c18.63±0.68bOM-G 48 h77.90±0.90i7.97±0.21a21.30±0.95a
注:同列不同字母表示差异显著(P<0.05)(下同)。

图2 明胶和糖基化明胶的外观
Fig.2 Appearance of gelatin and glycated gelatin
随干热时间延长,2种糖基化明胶的L*值显著减小,a*值和b*值显著增加(P<0.05),说明颜色逐渐变暗,黄色和红色逐渐加深。OM-G颜色变化比MD-G更加明显,可能因OM-G的接枝度随干热时间上升更快,其糖基化速度更快所导致。色差变化的趋势同已报道的糖基化产物研究结果一致,即干热反应时间越长,糖基化程度越高,美拉德反应末期产物积累量越高,导致的褐变也越严重[20]。
2.3 FT-IR分析
图3为原始明胶和糖基化明胶的红外光谱图,明胶的酰胺A带在3 300 cm-1出峰,对应—NH和—OH的振动,2 930 cm-1的吸收峰是由酰胺B带C—N伸缩振动产生,而酰胺Ⅰ带在1 634 cm-1出峰,是C![]() O和C
O和C![]() N的拉伸振动的特征谱带,酰胺Ⅱ带位于1 532 cm-1,为蛋白C—N伸缩振动与N—H弯曲振动[21]。
N的拉伸振动的特征谱带,酰胺Ⅱ带位于1 532 cm-1,为蛋白C—N伸缩振动与N—H弯曲振动[21]。

a-原始明胶与麦芽糊精-明胶对比;b-原始明胶与低聚甘露糖-明胶对比
图3 原始明胶、糖和糖基化明胶的红外光谱图
Fig.3 FT-IR spectra of gelatin, oligosaccharide, and glycated gelatin
不同化合物的化学基团之间的氢键或其他相互作用可能会导致参与基团的峰位置发生变化,进而导致蛋白质的结构变化。相比于原始明胶,干热0 h的MD-G和OM-G的酰胺A带分别向低波数移至3 289 cm-1和3 285 cm-1,酰胺B带移至2 920 cm-1和2 919 cm-1,这可能由于明胶和糖混合后的交联作用导致了更多氢键生成,影响了明胶中—NH和—OH振动[22],而糖基化会使明胶和糖之间产生共价相互作用,在明胶肽链上引入更多—OH[9],因此干热24 h和48 h的糖基化明胶的酰胺A带和B带也移动到了比干热0 h时的更低波数。干热0 h的MD-G和OM-G酰胺Ⅰ带和Ⅱ带出峰位置和原始明胶相同,但峰形发生了明显变化,可能也与明胶和糖之间的交联有关。糖基化过程会导致蛋白质游离氨基丢失,也会生成Amadori化合物、席夫碱和吡嗪等美拉德反应产物,这会影响糖基化产物中C—N、N—H、C![]() O和C
O和C![]() N的振动,使酰胺Ⅰ带和Ⅱ带向更低波数移动[23]。相比于干热0 h的糖基化明胶,干热24 h和干热48 h的糖基化明胶酰胺Ⅰ带和Ⅱ带峰强变大,并且明显向低波数移动。由此可见,明胶糖基化后的酰胺A带、B带、Ⅰ带和Ⅱ带都发生了变化,进而导致了明胶的二级结构也受到了影响。
N的振动,使酰胺Ⅰ带和Ⅱ带向更低波数移动[23]。相比于干热0 h的糖基化明胶,干热24 h和干热48 h的糖基化明胶酰胺Ⅰ带和Ⅱ带峰强变大,并且明显向低波数移动。由此可见,明胶糖基化后的酰胺A带、B带、Ⅰ带和Ⅱ带都发生了变化,进而导致了明胶的二级结构也受到了影响。
原始明胶和糖基化明胶的二级结构含量如图4所示,原始明胶和糖基化明胶的β-折叠在干热糖基化过程中有轻微提升,干热0 h的MD-G和OM-G的无规则卷曲结构占比相比于原始明胶更低,β-折叠结构更高,说明糖和明胶混合后的交联作用影响了明胶二级结构[22]。MD-G和OM-G的二级结构含量在糖基化过程中变化相似,糖基化程度越深,α-螺旋越少,干热48 h后,MD-G的α-螺旋占比由15.65%减少至6.36%,OM-G则由16.57%减少至5.70%,而β-转角结构明显增加,无规则卷曲和β-折叠也略有增加。周伟等[24]的研究表明,鱼鳞明胶的酶法糖基化导致了α -螺旋消失,转化为β-折叠和β-转角和无规则卷曲。卜单等[25]的研究也发现不同还原单糖和乳白蛋白的糖基化都会使α-螺旋减少,转化为更为稳定的β-折叠。从蛋白二级结构含量变化也可以看出,明胶和糖混合后的交联作用就影响了明胶的二级结构,并且糖基化也会改变交联体系中蛋白的二级结构。

图4 原始明胶和糖基化明胶二级结构占比
Fig.4 Percentage of secondary structure of gelatin and glycated gelatin
2.4 SDS-PAGE分析
由图5可观察到,原始明胶2条α亚基分布于100~150 kDa,γ和β亚基分子质量大于200 kDa,但图中不并不清晰,可能由于明胶在生产过程中胶原蛋白的三螺旋结构被破坏较多,导致γ和β亚基保留较少,这可提升明胶分子溶解性,并且使明胶中游离氨基暴露,减少糖基化反应时氨基同羰基结合的空间位阻[3, 5]。从1~3泳道可观察到原始明胶的α1和α2亚基带无明显变化,说明干热处理没有影响原始明胶分子质量分布。糖基化反应会在蛋白质侧链上共价结合上糖链形成糖蛋白,因此会导致蛋白分子质量升高[26],从泳道4~6和7~9可以明显观察到,干热时间越长,MD-G和OM-G的α1和α2亚基分子质量越高,说明高分子质量蛋白接枝物的产生。研究表明,鱼明胶和葡萄糖美拉德反应会导致明胶部分亚基分解[17],MD-G和OM-G的α1和α2亚基条带干热处理后变得模糊,并且干热时间越长越模糊,可能由于干热糖基化导致的明胶部分亚基分解导致,在谢思怡等[27]的研究中也观察到糖基化处理后猪肉肌原纤维蛋白电泳图变得不清晰,并且分子质量随糖基化时间延长而上升的现象。

M-标准蛋白;1~3-干热0、24、48 h的原始明胶;4~6-干热0、24、48 h的MD-G;7~9-干热0、24、48 h的OM-G
图5 标准蛋白、原始明胶和糖基化明胶的SDS-PAGE图
Fig.5 SDS-PAGE patterns of marker protein gelatin and glycated gelatin
2.5 乳化性分析
2.5.1 乳化活性和乳化稳定性分析
如图6所示,原始明胶的乳化活性在干热过程中轻微下降,乳化稳定性无显著变化(P>0.05)。糖基化改性后,MD-G和OM-G的乳化活性轻微提升,但变化也不明显。MD-G的乳化稳定性随干热时间延增加,在干热48 h达到最高。已有研究表明,糖基化改性可以改变蛋白的三级结构,使其具有更高的表面疏水性,在油水界面的结合吸附能力增强[10]。但过长时间的干热反应却不利于糖基化明胶的乳化性能提升,OM-G的乳化稳定性随干热时间先升高后降低,在干热24 h达到最高,为78.75%,在干热48 h却降低至60.55%。值得注意的是,过长时间的糖基化处理会使蛋白质热变性缩合,导致其溶解度降低,进而影响乳化性能[13],因此可能导致干热24~48 h过程中,MD-G的乳化稳定性提升不高,并且OM-G的乳化稳定性出现降低现象。总的来说,糖基化改性主要提升了明胶的乳化稳定性,相比于原始明胶,干热48 h的MD-G的乳化稳定性提升了32.67%(P<0.05),干热24 h的OM-G提升了37.56%(P<0.05),OM-G在更短的干热时间内即可获更佳的提升效果。

图6 原始明胶和糖基化明胶乳化活性(a)和乳化稳定性(b)
Fig.6 Emulsifying activity(a) and emulsifying stability(b) of gelatin and glycated gelatin
2.5.2 乳液粒径分析
研究表明,乳化剂稳定乳液能力和乳液粒径呈负相关[28],如图7所示,经干热后的原始明胶稳定的乳液粒径有轻微上升,从乳化活性和乳化稳定性测定结果中也显示干热处理会导致原始明胶的乳化性能降低。干热0 h的MD-G乳液粒径分布较为不均,但其平均粒径(289.3 nm)仍小于原始明胶乳液的平均粒径(309.5 nm)。MD-G干热时间越长,其稳定的乳液平均粒径更小(干热24 h时为177.4 nm,干热48 h时为145.0 nm),这可能因糖基化会增加体系黏度,进而导致乳液液滴界面厚度增加,防止了乳液液滴聚集[27]。低聚甘露糖本身具有较高的黏度,可能导致了干热0 h的OM-G乳液粒径分布较为均一,干热24 h的OM-G乳液具有最小的平均粒径(116.8 nm),粒径分布为91~164 nm。但是干热48 h的OM-G粒径分布变宽,并且平均粒径也比干热24 h时更大(平均粒径为170.7 nm),这同乳化性测定结果一致。

图7 原始明胶和糖基化明胶稳定的乳液粒径
Fig.7 Emulsified particle size of gelatin and glycated gelatin
2.6 抗氧化活性分析
如表2所示,原始明胶在干热过程中抗氧化活性有轻微提升但不明显。MD-G和OM-G经糖基化后Fe3+还原能力、ABTS阳离子自由基清除能力和DPPH自由基清除能力显著提升(P<0.05)。MD-G的干热时间越长,其抗氧化活性指标越高,说明糖基化程度越深,具有抗氧化活性的美拉德反应产物生成越多,但MD-G在干热24~48 h抗氧化活性提升不如干热0~24 h,推测为美拉德末期反应生成了大分子聚合物类黑精,受空间位阻影响,导致抗氧化活性提升减缓[6]。美拉德反应前期产物ARPs和中期产物还原酮等提供了良好的供氢能力和自由基清除活性,但前中期产物在糖基化过程中生成的同时也在分解[29],因OM-G糖基化速度较快,可能导致了OM-G的Fe3+还原能力和ABTS阳离子自由基清除能力在干热48 h时低于干热24 h。XIAO等[8]研究发现,酶解大米蛋白-葡萄糖在糖基化过程中抗氧化活性也出现了上升后降低的现象。糖基化明胶总体的DPPH自由基清除率不高,都未超过50%,这可能是由于DPPH自由基为疏水性自由基,美拉德反应末期产物类黑精难溶于水,相比于水溶性自由基ABTS,更易与DPPH自由基结合反应[30],由接枝度和褐变测定结果可知,MD-G和OM-G干热48 h后,美拉德末期反应程度较低,可能导致DPPH自由基清除率较低。
表2 原始明胶和糖基化明胶的抗氧化活性
Table 2 Antioxidant activity of gelatin and glycated gelatin
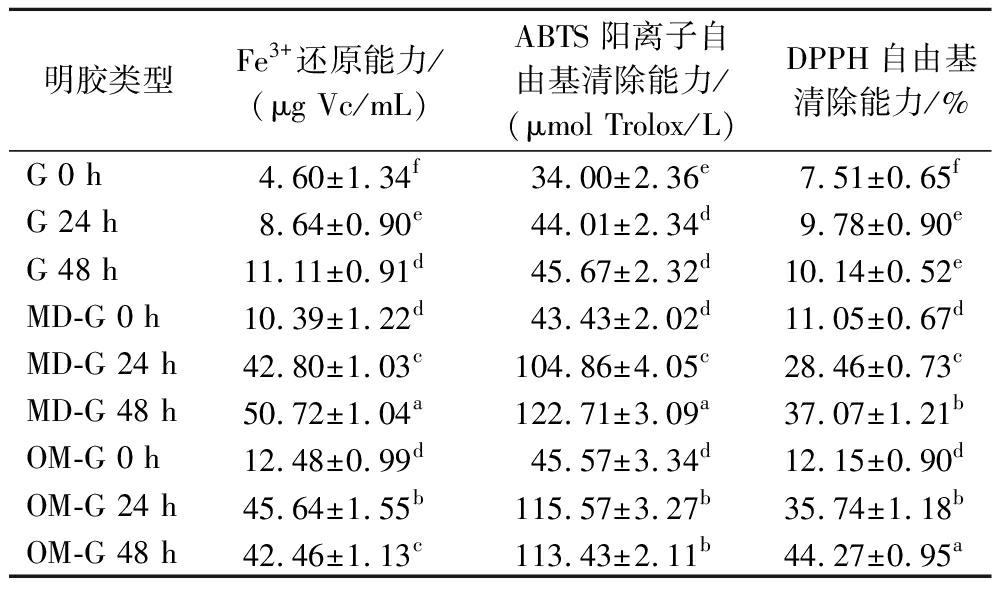
明胶类型Fe3+还原能力/(μg Vc/mL)ABTS阳离子自由基清除能力/(μmol Trolox/L)DPPH自由基清除能力/%G 0 h4.60±1.34f34.00±2.36e7.51±0.65fG 24 h8.64±0.90e44.01±2.34d9.78±0.90eG 48 h11.11±0.91d45.67±2.32d10.14±0.52eMD-G 0 h10.39±1.22d43.43±2.02d11.05±0.67dMD-G 24 h42.80±1.03c104.86±4.05c28.46±0.73cMD-G 48 h50.72±1.04a122.71±3.09a37.07±1.21bOM-G 0 h12.48±0.99d45.57±3.34d12.15±0.90dOM-G 24 h45.64±1.55b115.57±3.27b35.74±1.18bOM-G 48 h42.46±1.13c113.43±2.11b44.27±0.95a
干热24 h,OM-G的3种抗氧化指标提升得比MD-G更多,这可能由OM-G糖基化反应比MD-G快所导致,但在干热48 h,OM-G的Fe3+还原能力和ABTS自由基清除能力出现下降趋势,说明过长的干热时间不利于糖基化明胶的抗氧化活性提升。总的来说,糖基化改性可显著提高明胶抗氧化活性,干热48 h的MD-G具有最佳的Fe3+还原能力和ABTS阳离子自由基清除能力,干热48 h的OM-G具有最佳的DPPH自由基清除能力。
3 结论
糖基化会使明胶亚基分子质量上升和部分分解,并且也会导致明胶二级结构发生改变,且明胶同低聚糖(低聚甘露糖)的糖基化速度比多糖(麦芽糊精)快,但褐变也更明显。糖基化改性主要影响了明胶的乳化稳定性,对乳化活性影响较小,OM-G在较短干热时间(24 h)即获得了较好的乳化性能改善效果。糖基化也显著提升了明胶的抗氧化活性,干热时间越长,MD-G抗氧化活性越强,但过长干热时间对OM-G抗氧化活性提升却有不利影响。因此明胶同麦芽糊精和低聚甘露糖的干热糖基化改性是提升明胶乳化稳定性和抗氧化性的有效途径,可为扩大明胶应用范围提供指导。
[1] 朱雨辰, 张单单, 王少甲, 等.转谷氨酰胺酶改性对明胶耐酶解性的影响 [J].中国食品学报, 2020, 20(5):91-96.
ZHU Y C, ZHANG D D, WANG S J, et al.Effect of transglutaminase modified on the resistance to enzymatic hydrolysis of gelatin[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(5):91-96.
[2] IFEDUBA E A, AKOH C C.Microencapsulation of stearidonic acid soybean oil in Maillard reaction-modified complex coacervates[J].Food Chemistry, 2016, 199:524-532.
[3] ZHANG T, XU J M, ZHANG Y Y, et al.Gelatins as emulsifiers for oil-in-water emulsions:Extraction, chemical composition, molecular structure, and molecular modification[J].Trends in Food Science &Technology, 2020, 106:113-131.
[4] LIN L, REGENSTEIN J M, LV S, et al.An overview of gelatin derived from aquatic animals:Properties and modification[J].Trends in Food Science &Technology, 2017, 68:102-112.
[5] KAN X H, CHEN G J, ZHOU W T, et al.Application of protein-polysaccharide Maillard conjugates as emulsifiers:Source, preparation and functional properties[J].Food Research International, 2021, 150:110740.
[6] NOOSHKAM M, VARIDI M, BASHASH M.The Maillard reaction products as food-born antioxidant and antibrowning agents in model and real food systems[J].Food Chemistry, 2019, 275:644-660.
[7] WANG W Q, BAO Y H, CHEN Y.Characteristics and antioxidant activity of water-soluble Maillard reaction products from interactions in a whey protein isolate and sugars system[J].Food Chemistry, 2013, 139(1-4):355-361.
[8] XIAO Q, WOO M W, HU J W, et al.The role of heating time on the characteristics, functional properties and antioxidant activity of enzyme-hydrolyzed rice proteins-glucose Maillard reaction products[J].Food Bioscience, 2021, 43:101225.
[9] HABINSHUTI I, MU T H, ZHANG M.Structural, antioxidant, aroma, and sensory characteristics of Maillard reaction products from sweet potato protein hydrolysates as influenced by different ultrasound-assisted enzymatic treatments[J].Food Chemistry, 2021, 361:130090.
[10] HUANG T, TU Z C, ZOU Z Z, et al.Glycosylated fish gelatin emulsion:Rheological, tribological properties and its application as model coffee creamers[J].Food Hydrocolloids, 2020, 102:105552.
[11] KARBASI M, MADADLOU A.Interface-related attributes of the Maillard reaction-born glycoproteins[J].Critical Reviews in Food Science and Nutrition, 2018, 58(10):1595-1603.
[12] 张东霞, 张琪, 邓丽玲, 等.魔芋葡甘聚糖及其衍生物治疗乳糖不耐受症[J].食品与发酵工业, 2020, 46(11):112-118.
ZHANG D X, ZHANG Q, DENG L L, et al.Konjac glucomannan and its derivatives in treating lactose intolerance[J].Food and Fermentation Industries, 2020, 46(11):112-118.
[13] NOOSHKAM M, VARIDI M.Maillard conjugate-based delivery systems for the encapsulation, protection, and controlled release of nutraceuticals and food bioactive ingredients:A review[J].Food Hydrocolloids, 2020, 100:105389.
[14] ERTUGRUL U, NAMLI S, TAS O, et al.Pea protein properties are altered following glycation by microwave heating[J].LWT, 2021, 150:111939.
[15] 刘廷薇, 陈雪珂, 马良, 等.快速冻融猪皮明胶理化性质分析[J].食品与发酵工业, 2019, 45(20):81-86.
LIU T W, CHEN X K, MA L, et al.Physicochemical properties analysis of pig skin gelatin prepared by rapid freezing-thawing pretreatment[J].Food and Fermentation Industries, 2019, 45(20):81-86.
[16] WANG X, YUE C H, XU H H, et al.Comparison of emulsifying properties of fibrils formed from whey protein concentrate following induction by nuclei and nuclei fragments[J].International Dairy Journal, 2021, 123:105166.
[17] KCHAOU H, BENBETTAIEB N, JRIDI M, et al.Influence of Maillard reaction and temperature on functional, structure and bioactive properties of fish gelatin films[J].Food Hydrocolloids, 2019, 97:105196.
[18] TAN J E, LIU T, YAO Y, et al.Changes in physicochemical and antioxidant properties of egg white during the Maillard reaction induced by alkali[J].LWT-Food Science and Technology, 2021, 143:111151.
[19] SPOTTI M J, LOYEAU P A, MARANG N A, et al.Influence of Maillard reaction extent on acid induced gels of whey proteins and dextrans[J].Food Hydrocolloids, 2019, 91:224-231.
N A, et al.Influence of Maillard reaction extent on acid induced gels of whey proteins and dextrans[J].Food Hydrocolloids, 2019, 91:224-231.
[20] SOMJAI C, SIRIWOHARN T, KULPRACHAKARN K, et al.Utilization of Maillard reaction in moist-dry-heating system to enhance physicochemical and antioxidative properties of dried whole Longan fruit[J].Heliyon, 2021, 7(5):e07094.
[21] SU Y R, TSAI Y C, HSU C H, et al.Effect of grape seed proanthocyanidin-gelatin colloidal complexes on stability and in vitro digestion of fish oil emulsions[J].Journal of Agricultural and Food Chemistry, 2015, 63(46):10200-10208.
[22] XUE F, LI C, ZHU X W, et al.Comparative studies on the physicochemical properties of soy protein isolate-maltodextrin and soy protein isolate-gum acacia conjugate prepared through Maillard reaction[J].Food Research International, 2013, 51(2):490-495.
[23] ZHAO T T, ZHANG Q, WANG S G, et al.Effects of Maillard reaction on bioactivities promotion of anchovy protein hydrolysate:The key role of MRPs and newly formed peptides with basic and aromatic amino acids[J].LWT, 2018, 97:245-253.
[24] 周伟, 胡熠, 张进杰, 等.杨梅素和糖基化协同改性鱼鳞明胶可食膜[J].食品与发酵工业, 2018, 44(6):58-66.
ZHOU W, HU Y, ZHANG J J, et al.Optimization of properties of fish-scale gelatin edible films modified by myricetin associated with glycosylation[J].Food and Fermentation Industries, 2018, 44(6):58-66.
[25] 卜单, 涂宗财, 刘光宪, 等. 不同还原糖糖基化对超声波预处理α-乳白蛋白结构和抗氧化活性的影响[J]. 食品科学, 2022, 43(24):1-6.
BU D, TU Z C, LIU G X, et al. Effect of glycation with different reducing saccharides on conformation and antioxidant activities of ultrasonic pretreated α-lactalbumin[J]. Food Science, 2022, 43(24):1-6.
[26] LIU J H, RU Q M, DING Y T.Glycation a promising method for food protein modification:Physicochemical properties and structure, a review[J].Food Research International, 2012, 49(1):170-183.
[27] 谢思怡, 付余, 邬威.核糖糖基化修饰对猪肉肌原纤维蛋白功能特性和抗氧化活性的影响[J].食品与发酵工业, 2021, 47(20):90-96.
XIE S Y, FU Y, WU W.Impacts of ribose-induced glycosylation on functional property and antioxidant activity of porcine myofibrillar protein[J].Food and Fermentation Industries, 2021, 47(20):90-96.
[28] LOW L E, SIVA S P, HO Y K, et al.Recent advances of characterization techniques for the formation, physical properties and stability of Pickering emulsion[J].Advances in Colloid and Interface Science, 2020, 277:102117.
[29] ZHOU Y, PETROVA S P, EDGAR K J.Chemical synthesis of polysaccharide-protein and polysaccharide-peptide conjugates:A review[J].Carbohydrate Polymers, 2021, 274:118662.
[30] NASROLLAHZADEH F, VARIDI M, KOOCHEKI A, et al.Effect of microwave and conventional heating on structural, functional and antioxidant properties of bovine serum albumin-maltodextrin conjugates through Maillard reaction[J].Food Research International, 2017, 100:289-297.