海参是一种富含生物活性物质的海洋动物,药食兼用,产地遍布全球。大宗低值海参品类产值低,传统海参产品制作方式易造成多糖等水溶性营养物质的流失。对海参生物活性物质进行深入研究,有利于促进低值海参的高值化利用,为临床医学、制药行业提供巨大的经济价值和应用前景。
海参多糖是海参中一类重要生物活性物质[1],占海参干质量6%以上,主要有岩藻聚糖和岩藻糖基硫酸软骨素2类,具有抗炎[2]、护肝[3]及抗氧化[4]等多种生物活性。岩藻聚糖是由L-岩藻糖构成的直链多糖;岩藻糖基硫酸软骨素是葡萄糖醛酸、N-乙酰氨基半乳糖、岩藻糖连接构成的支链多糖[4]。2种多糖的链构象、生物活性[5]、研究方法均有差异;分子质量、黏度等物化性质也不同,具有不同的应用场景,分离纯化岩藻聚糖及岩藻糖基硫酸软骨素,对于它们的研究、应用,以及海参的充分开发具有重要意义。
海参中的岩藻聚糖和硫酸软骨素的分离纯化方法主要有分步醇沉及色谱法2类。分步醇沉法较为简便,通过添加乙醇至终体积分数为40%、75%,使多糖沉淀,但提取产物中含有杂蛋白及色素,该方法常用于粗多糖的提取。色谱法可以有效分离海参中的2种多糖,主要有阴离子交换柱层析法[6-7]和凝胶色谱柱层析法[8-9],2种层析法联用[10]能够获得单一多糖组分,但该法操作繁琐、耗时长,且处理的样品量少。目前,建立一种操作简便、高效且分离效果好的分离方法有助于海参多糖进一步的研究与开发。
双水相体系在天然复杂基质的单一组分精确提取方面展现出极大的潜力,常被用于分离纯化活性要求高、浓度低的天然产物,如DNA[11]、病毒[12]、蛋白质[13]、多糖[14]、青霉素[15]等多种生物分子[16]。该体系是2种高聚物或高聚物与无机盐在水中以适当的浓度溶解后形成的互不相溶的两相体系[17]。其中,聚乙二醇(polyethylene glycol,PEG)-盐双水相体系在多糖纯化方面应用广泛,如糖胺聚糖[18]、龙葵多糖[14]、芦荟多糖[19]、牛蒡多糖[20]等多糖。目前相关研究多将双水相体系运用于不同种生物大分子之间的分离纯化,对于同类型生物大分子,尤其是不同种类多糖之间的分离纯化报道较少。通过前期预实验,我们发现PEG-盐双水相体系在海参中的岩藻聚糖和硫酸软骨素的分离纯化方面展现了较大的潜力,本研究将对该方法进行进一步研究及优化。
本研究以海地瓜(Acaudina molpadioides)为原料,拟通过单因素试验,分别研究其中岩藻聚糖、硫酸软骨素在双水相体系中的分配行为,并设计和建立双水相体系,实现岩藻聚糖和硫酸软骨素2种多糖组分的分离,以期获得一个可以有效分离岩藻聚糖与硫酸软骨素的方法,为其他海参来源多糖的分离研究提供参考。
1 材料与方法
1.1 材料与试剂
新鲜海地瓜(Acaudina molpadioides),市售;柠檬酸钠、K2CO3、Na2SO4、(NH4)2SO4、K2HPO4、NaH2PO4、无水乙醇、NaCl、L-半胱氨酸、EDTA-Na2,国药集团化学试剂有限公司;PEG(分子质量为2 000、4 000、6 000、10 000、20 000 Da)、木瓜蛋白酶,上海麦克林生化科技有限公司;TSKgel Super AW4000凝胶柱,日本Tosoh公司;HiPrep 26/10 Desalting凝胶柱、色谱柱HiPrepTM26/60 Sephacryl S-500 column,美国GE Healthcare Life Sciences公司。
1.2 仪器与设备
Milli-Q Advantage A10超纯水机、10 kDa超滤离心管,美国密理博公司;酶标仪,美国BioRad公司;Agilent 1260 HPLC高效液相色谱仪,配备示差检测器(refractive index detector,RID),美国安捷伦公司; KTA Prime Plus高效蛋白质纯化系统,美国GE Healthcare Life Sciences公司;FD5-3T冷冻干燥机,GOLD-SIM公司。
KTA Prime Plus高效蛋白质纯化系统,美国GE Healthcare Life Sciences公司;FD5-3T冷冻干燥机,GOLD-SIM公司。
1.3 实验方法
1.3.1 海地瓜中的岩藻聚糖与硫酸软骨素的制备
将新鲜海地瓜烘干、粉碎、酶解及分步醇沉[21],获得沉淀即为粗多糖(含有色素、蛋白等杂质)。利用 KTA Prime Plus蛋白纯化系统,采用凝胶排阻色谱法(色谱柱:HiPrepTM 26/60 Sephacryl S-500 column)进行多糖纯化,所得2种海参多糖的纯度由HPLC测定,色谱柱为凝胶柱TSKgel Super AW4000,流动相为0.2 mol/L的NaCl,流速0.5 mL/min,检测器采用RID。
KTA Prime Plus蛋白纯化系统,采用凝胶排阻色谱法(色谱柱:HiPrepTM 26/60 Sephacryl S-500 column)进行多糖纯化,所得2种海参多糖的纯度由HPLC测定,色谱柱为凝胶柱TSKgel Super AW4000,流动相为0.2 mol/L的NaCl,流速0.5 mL/min,检测器采用RID。
1.3.2 单因素实验探究海地瓜中岩藻聚糖与硫酸软骨素的分配行为
在25 ℃条件下,选择质量分数为15%的PEG 8000与12.5%的盐组成双水相体系,分别进行岩藻聚糖、硫酸软骨素2种多糖在双水相体系中的分配行为的研究。制备上述体系,总质量共5 g,向其中加入0.5 g 2 g/L岩藻聚糖或硫酸软骨素溶液,5 000 r/min离心5 min,静置,将上下相分离并测量体积,采用次甲基蓝法[22]检测多糖质量浓度,计算相应参数。
固定条件:双水相体系总质量为5 g,PEG的质量分数为15%,盐的质量分数为12.5%,提取时间4 h,提取温度25 ℃。分别考查盐种类[柠檬酸钠、K2CO3、Na2SO4、(NH4)2SO4、K2HPO4、NaH2PO4]、PEG分子质量(2 000、4 000、6 000、10 000、20 000 Da)、pH值(6、7、8、9、9.3)、PEG的质量分数(10%、12.5%、15%、17.5%、20%)和盐的质量分数(10%、12.5%、15%、17.5%、20%)5种因素对岩藻聚糖、硫酸软骨素分配行为的影响。
1.3.3 岩藻聚糖与硫酸软骨素质量浓度的测定
采用次甲基蓝法[22]进行2种海地瓜多糖的浓度测定。分别移取0.02 mL质量浓度为0、0.03、0.06、0.09、0.12、0.15、0.18、0.2 g/L的海地瓜岩藻聚糖溶液,加入0.18 mL次甲基蓝溶液(0.18 g/L),混匀,测定560 nm处的吸光值,从而绘制岩藻聚糖的标准曲线。硫酸软骨素标准曲线的绘制方式相同。计算多糖的分配系数及回收率。
岩藻聚糖分配系数Ka计算如公式(1)所示:
(1)
岩藻聚糖回收率Ya计算如公式(2)所示:
(2)
硫酸软骨素分配系数Kb计算如公式(3)所示:
(3)
硫酸软骨素回收率Yb计算如公式(4)所示:
(4)
式中:Ca,样品岩藻聚糖的质量浓度,g/L;Cb,样品硫酸软骨素的质量浓度,g/L;Ka,岩藻聚糖分配系数;Kb,硫酸软骨素分配系数;Ya,岩藻聚糖回收率,%;Yb,硫酸软骨素回收率,%;VT,上相体积,mL;VB,下相体积,mL。
1.4 HPLC验证双水相体系对海地瓜粗多糖的分离效果
制备双水相体系,PEG 6000和K2HPO4质量分数分别为15%、10%。将经酶解醇沉法制得的海地瓜粗多糖作为样品,溶解后加入至上述双水相体系中,进行海地瓜粗多糖的分离。分离双水相体系的上下相,分别使用10 kDa超滤离心管进行超滤,以脱除PEG或K2HPO4,采用HPLC进行上、下相中多糖组分的测定,通过与标准品比对,确定最终海地瓜粗多糖的分离效果。
1.5 统计分析
试验设计3个平行,实验数据均表示为平均值±标准偏差。利用t检验进行显著性分析,用Origin Pro 2019软件作图。利用P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 海地瓜中的岩藻聚糖及硫酸软骨素的制备
按照1.3.1节中方法制得海地瓜中的岩藻聚糖及硫酸软骨素,经HPLC检测(图1),结果显示2种多糖组分皆为单一狭窄峰,峰形良好,表明2种多糖纯度高,满足后续实验要求。
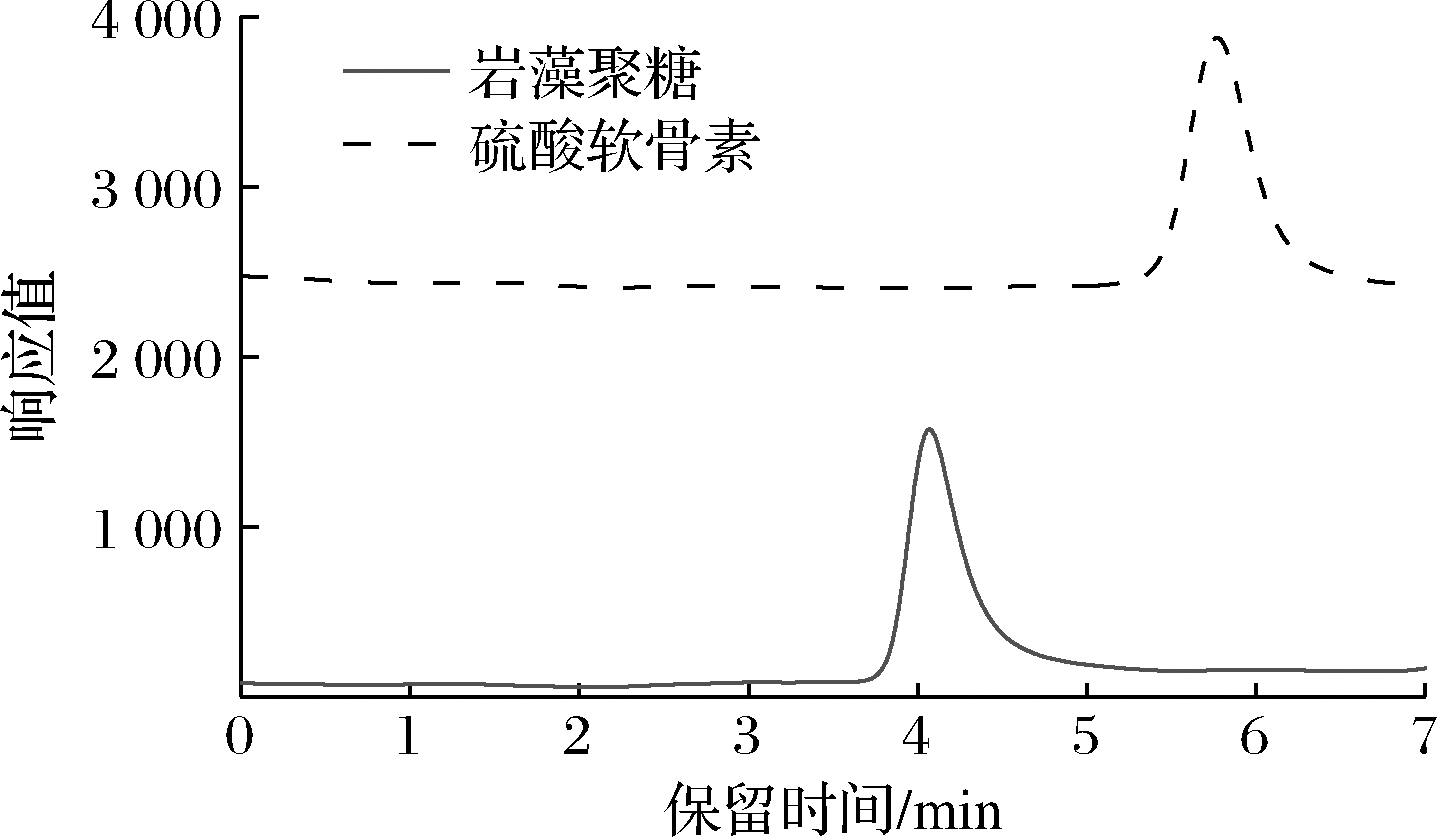
图1 制备的海地瓜岩藻聚糖、硫酸软骨素的HPLC图
Fig.1 HPLC chromatogram of Acaudina molpadioidessulfated fucan and chondroitin sulfate
2.2 盐种类对多糖组分在双水相体系中分配行为的影响
岩藻聚糖、硫酸软骨素在6种盐-PEG 8000的双水相体系中的分配情况如图2所示。岩藻聚糖主要分配在双水相体系的上相,在PEG-K2HPO4体系的分配系数最高,为8.72±0.49(P<0.05)。不同盐使得双水相体系上下相体积比不同,岩藻聚糖回收率呈现不同规律,岩藻聚糖在PEG-NaH2PO4体系中的回收率为(83.16±1.92)%,与岩藻聚糖在PEG-柠檬酸钠、PEG-K2CO3、PEG-K2HPO4三个体系中的回收率无显著性差异,显著高于剩余两组(P<0.05)。从分配情况来看,岩藻聚糖在PEG-K2HPO4体系的分配效果最好。
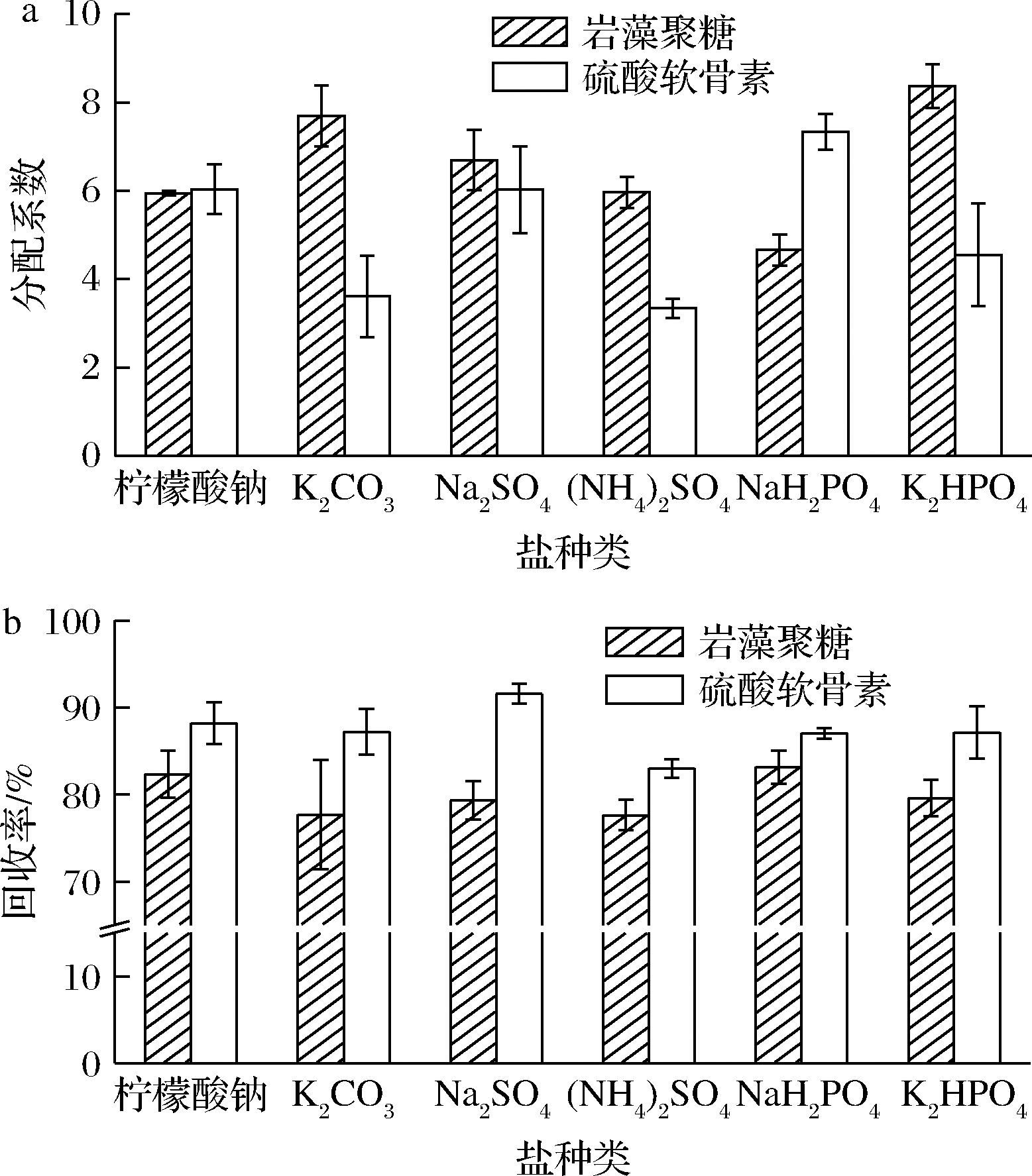
a-分配系数;b-回收率
图2 岩藻聚糖、硫酸软骨素在6种PEG-盐双水相体系中的分配系数及回收率
Fig.2 Partition coefficient and recovery rate of sulfated fucan and chondroitin sulfate in six PEG-salt aqueous two-phase systems
硫酸软骨素主要分配在双水相体系下相,在各组双水相体系中的回收率都在82%以上,分配效果良好。硫酸软骨素在PEG-NaH2PO4体系中的分配系数最高,为7.33±0.41(P<0.05),在PEG-Na2SO4体系中的回收率最高,为(91.60±1.19)%。从整体来看,硫酸软骨素在PEG-Na2SO4体系中分配效果最好。综合2种多糖组分的分配行为,选定PEG-K2HPO4体系进行下一步实验。
在PEG-盐的双水相体系中,疏水相互作用、静电相互作用和双水相表面张力可能是生物大分子在双水相体系中受到的主要作用力[23]。2种多糖的分配行为是多种作用力共同作用的结果。岩藻聚糖、硫酸软骨素均带有负电荷,因结构存在差别,前者带有电荷量大,受到静电相互作用更强。岩藻聚糖主要分配在PEG富集相,硫酸软骨素主要分配在盐相。由此推测,静电相互作用可能是岩藻聚糖的主要作用力,而硫酸软骨素还受到其他更强的作用力可以抵消静电相互作用而向体系下相移动。
2.3 PEG分子质量对多糖组分在双水相体系中分配行为的影响
PEG分子质量的增加会导致其成相能力增强,从而影响其所在的双水相体系中生物大分子的分配[24]。如图3所示,PEG分子质量由2 000 Da增加至10 000 Da,岩藻聚糖的分配系数及回收率都随之增加。PEG分子质量为10 000、20 000 Da的2个实验组之间,岩藻聚糖的回收率无显著性差异。岩藻聚糖在PEG的分子质量为10 000 Da时,分配效果最好。

a-分配系数;b-回收率
图3 PEG分子质量对岩藻聚糖、硫酸软骨素在不同双水相体系中的分配系数与回收率的影响
Fig.3 Effect of PEG molecular weight on the partition coefficient and recovery rate of sulfated fucan and chondroitin sulfate in aqueous two-phase system
PEG分子质量由2 000 Da增加至20 000 Da,硫酸软骨素的分配系数与回收率均呈现先增加后减小的趋势;在PEG分子质量为6 000 Da时,分配系数及回收率达到最大。PEG分子质量过大会使得体系黏度过高,导致岩藻聚糖、硫酸软骨素因在体系中转移时受到的阻力过大而不能进行良好的分配。综合2种多糖的分配行为,选择PEG 6000进行后续实验。
PEG分子质量的增加会导致PEG富集相中可容纳其他大分子的空间减少,PEG组分对上相中存在的生物大分子具有排除体积效应[25]。从熵的角度看,生物分子更倾向于分配空间位阻较小的相[11]。岩藻聚糖更多地分配在体系的上相,表明岩藻聚糖受到的静电相互作用可以抵消PEG的体积排除效应,被推动向上相移动。而硫酸软骨素随着PEG分子质量的增加在下相的分配系数增加,此时体积排阻效应为其在体系中受到的主要作用力。当PEG分子质量过大时,上相的黏度增加,硫酸软骨素在体系中移动时阻力增加,从而导致分配系数降低。
2.4 pH对多糖组分在双水相体系中分配行为的影响
pH会影响生物大分子和离子组成的电荷,以及污染物质的表面特征,导致它们在双水相体系中的分配行为发生变化[26]。如图4所示,在pH值为6、7、8、9、9.3(未调节pH实验组)的5个实验组中,随着体系pH增加,岩藻聚糖的分配系数增加,回收率先降低后增加。整体来看,未调节pH时,PEG-K2HPO4在双水相体系中分配效果最好。硫酸软骨素在不同pH实验组的分配效果相当,在上相的浓度接近于0,回收率接近100%。因此,不对体系pH值作出调整。
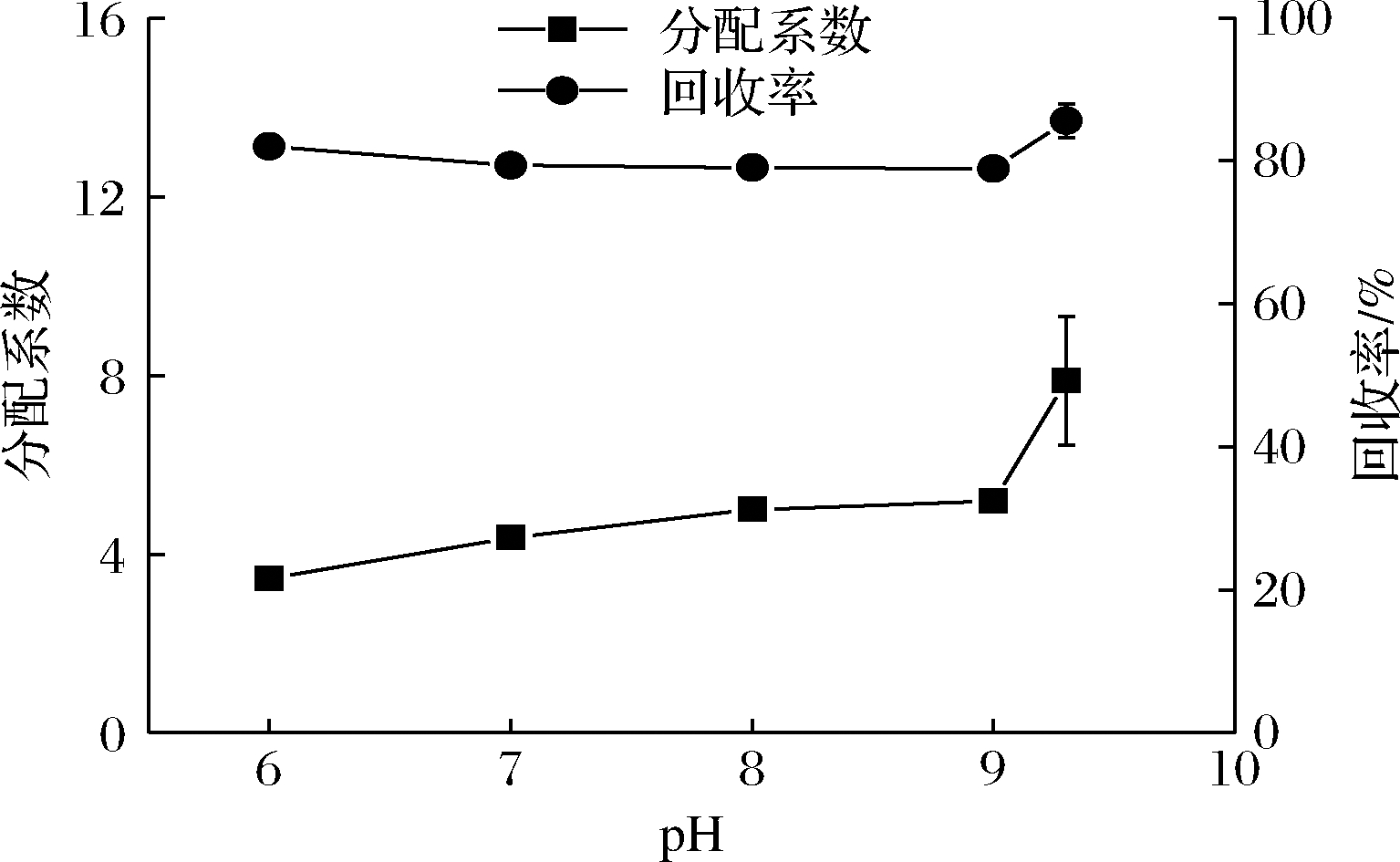
图4 pH值对岩藻聚糖在PEG-K2HPO4双水相体系中的分配系数及回收率的影响
Fig.4 Effect of pH on the partition coefficient and recovery rate of sulfated fucan in PEG-K2HPO4 aqueous two-phase system
岩藻聚糖、硫酸软骨素的分配行为是多种作用力共同作用的结果。2种多糖的分配行为表明,岩藻聚糖受到更大的作用力,推动其向上相富集,硫酸软骨素受到的主要作用力推动其向下相富集。由此推测,pH的改变可能会影响体系中盐离子产生的电势,使得岩藻聚糖在体系中受到的静电相互作用力增强,更多的岩藻聚糖分配在体系上相;硫酸软骨素受到的静电相互作用力亦增强,但未能抵消其在体系中受到的体积排除效应。
2.5 PEG质量分数对多糖组分在双水相体系中分配行为的影响
PEG质量分数的改变会使双水相体系的构成改变,从而影响多糖的分配情况。如图5所示,随着PEG质量分数自10%增加至20%,岩藻聚糖的分配系数和回收率均呈现先增加后降低后趋于平稳的结果;在PEG质量分数为15%时,岩藻聚糖分配效果最好。
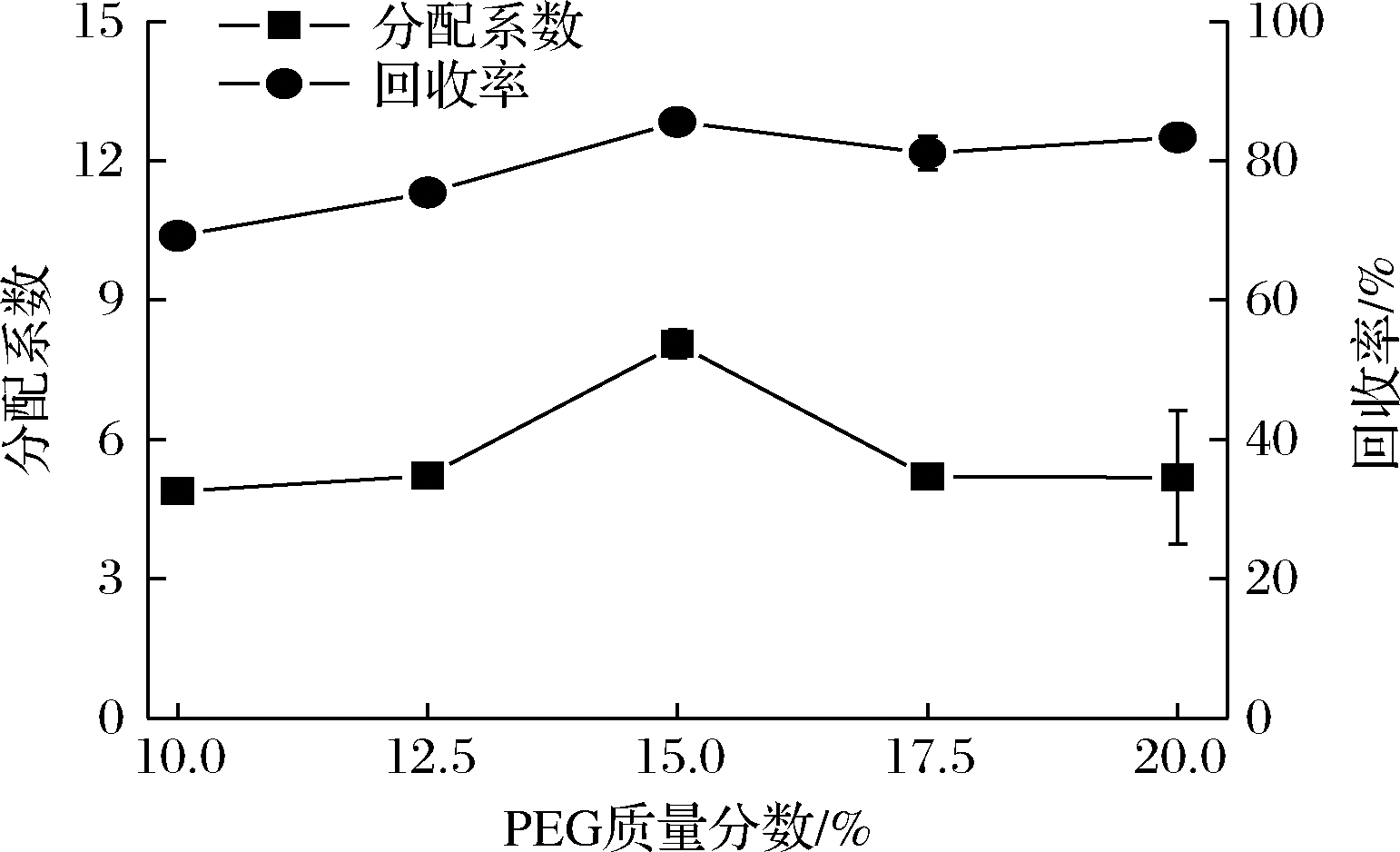
图5 PEG质量分数对岩藻聚糖在PEG-K2HPO4双水相体系中的分配系数与回收率的影响
Fig.5 Effect of PEG concentration on the partition coefficient and recovery rate of sulfated fucan in PEG-K2HPO4 aqueous two-phase system
在各实验组中,硫酸软骨素在上相的浓度接近零,分配效果良好。表明PEG质量分数的增加,未改变硫酸软骨素在体系中受到的主要作用力和分配行为。因此,选择PEG 6000的质量分数为15%作为最佳条件。
2.6 K2HPO4质量分数对多糖组分在双水相体系中分配行为的影响
如图6所示,随着K2HPO4质量分数由10%增加至25%,岩藻聚糖的分配系数整体呈增加趋势,回收率整体呈降低的趋势,在K2HPO4质量分数为10%时,岩藻聚糖的分配效果最佳,此时回收率最高,测定为(86.92±0.97)%。
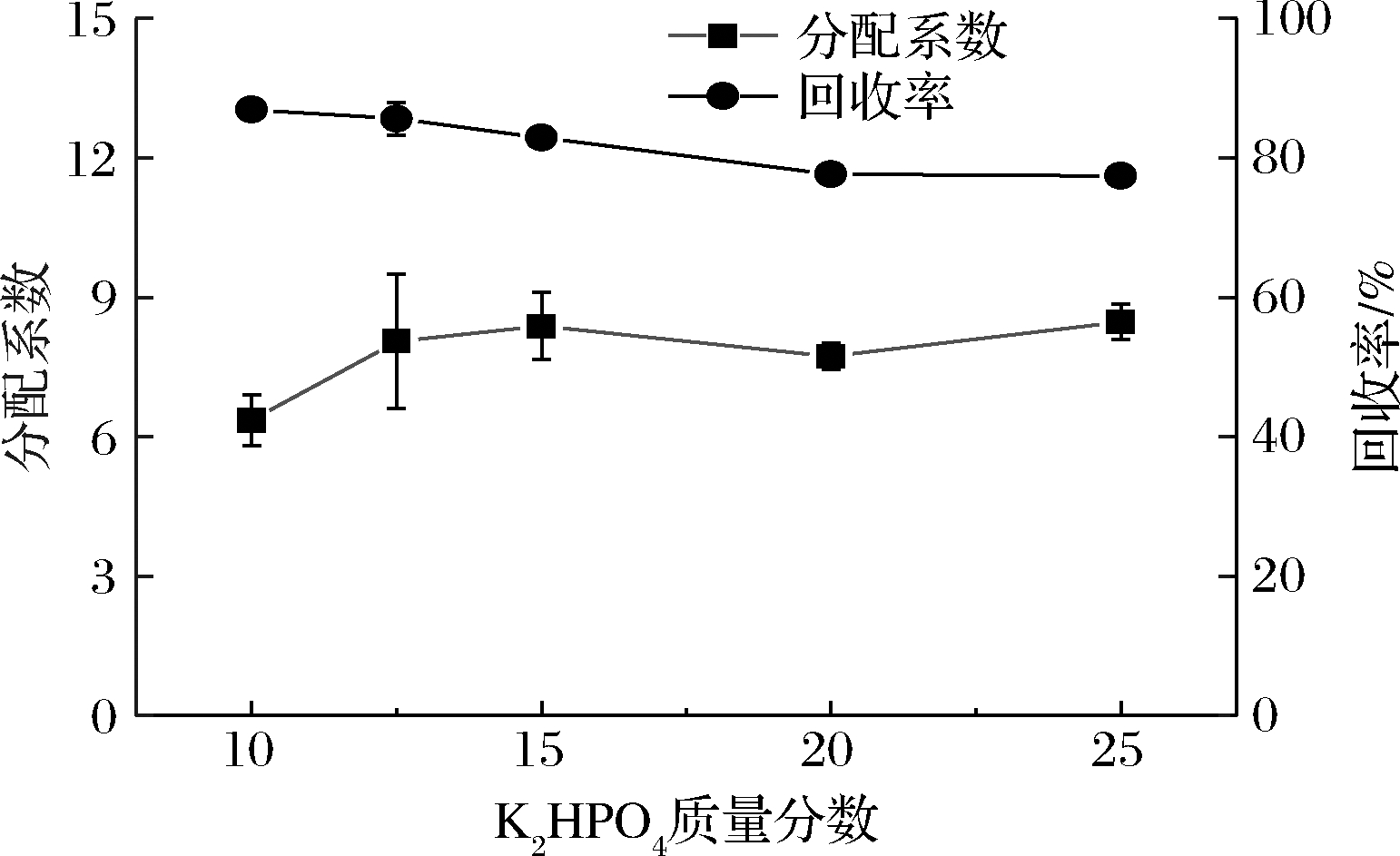
图6 K2HPO4质量分数对岩藻聚糖在PEG-K2HPO4双水相体系中的分配系数与回收率的影响
Fig.6 Effect of K2HPO4 concentration on the partition coefficient and recovery rate of sulfated fucan in PEG-K2HPO4 aqueous two-phase system
硫酸软骨素在各实验组中回收率均大于95%,其在上相的浓度均接近零,具有较好的分配效果。当K2HPO4的质量分数为10%时,硫酸软骨素的分配系数为16.53,回收率测定为(106.47±1.84)%。总体来看,K2HPO4质量分数在10%时,2种海地瓜多糖组分在体系中有最好的分离效果。
岩藻聚糖回收率整体呈降低的趋势,可能是由于盐浓度的增加使其产生的电势发生了改变,导致多糖在体系中受到的静电相互作用发生改变;同时上相体积减小,PEG对多糖的体积排除效应增强。硫酸软骨素主要分配在体系下相中,盐浓度的改变不会显著的影响其分配行为。
2.7 优化后双水相体系的分离效果评价
制备双水相体系,PEG 6000和K2HPO4质量分数分别为15%、10%。海地瓜粗多糖经此双水相体系的分离,采用HPLC检测上、下相中的样品,结果如图7所示。上下相中都仅含有1个样品峰,根据出峰时间可以确定上相中仅有海地瓜岩藻聚糖,下相中仅含有海地瓜硫酸软骨素。该结果表明最终设计的双水相体系可以有效的分离海地瓜中的岩藻聚糖与硫酸软骨素。
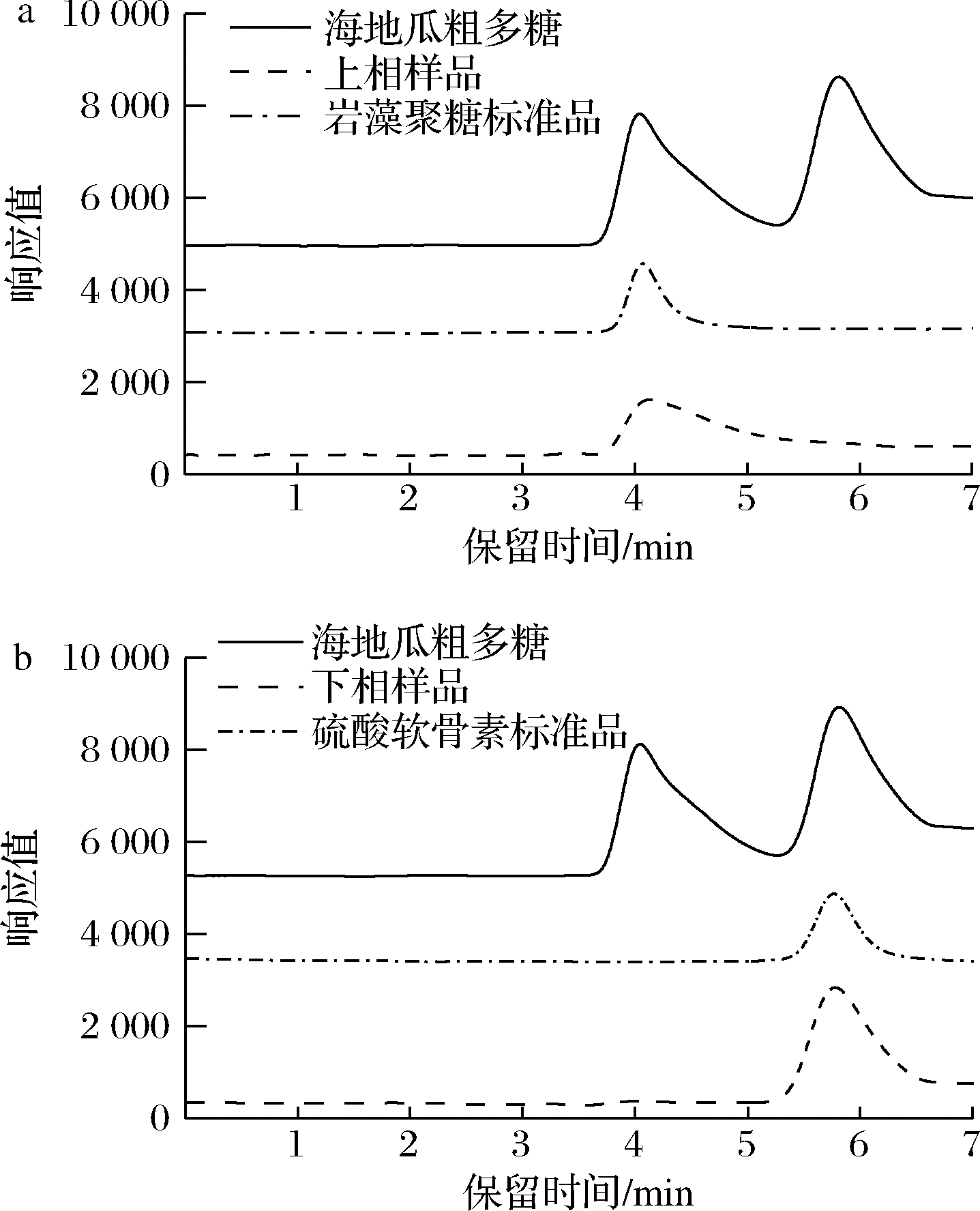
a-上相;b-下相
图7 海地瓜粗多糖经PEG-K2HPO4双水相体系分离后上、下相中样品的HPLC检测色谱图
Fig.7 HPLC chromatograms of A. molpadioides crude polysaccharide in upper and lower phases after separation by PEG-K2HPO4 aqueous two-phase system
与目前常用的海参多糖的纯化方法相比,本实验建立的双水相分离方法具有以下优点:其一,无需大型仪器设备,操作简单,省时省力;其二,选择性强,对海参多糖具有较好的分离效果;其三,条件温和,易于工业放大。上述试验结果可为海参多糖的分离纯化提供参考,具有一定的理论研究及工业应用价值。
3 结论
本研究探明了海地瓜岩藻聚糖与硫酸软骨素在双水相体系中的分配行为,确定PEG 6000-K2HPO4双水相体系为分离上述2个组分的最优体系,具体条件为:PEG 6000质量分数为15%,K2HPO4质量分数为10%。在该体系中,硫酸软骨素主要分配于下相,分配系数为16.53,回收率测定为(106.47±1.84)%;岩藻聚糖主要分配在上相,分配系数为6.36,回收率测定为(86.92±0.97)%。本方法分离效果良好且简便快捷,有助于海参多糖与低值海参资源的开发。
[1] 王静杰, 钟强, 董春晖, 等.海参多糖生物学活性及其作用机制研究进展[J].食品科学, 2021, 42(23):370-380.
WANG J J, ZHONG Q, DONG C H, et al.Recent progress in the biological activity and mechanism of action of sea cucumber polysaccharides[J].Food Science, 2021, 42(23):370-380.
[2] 张帅. 刺参岩藻聚糖硫酸酯对RAW264.7细胞炎症和自噬的影响[D].杨凌:西北农林科技大学, 2021.
ZHANG S.Effects of fucoidan from Apostichopus japonicus on inflammation and autophagy in RAW264.7 cells[D].Yangling:Northwest A &F University, 2021.
[3] 尹嘉玉. 海参岩藻聚糖改善LPS诱导的C57BL/6J小鼠急性肝损伤的机制[D].哈尔滨:哈尔滨商业大学, 2020.
YIN J Y.The mechanisms of the fucoidan from sea cucumber Apostichopus japonicus on attenuating lipopolysaccharide-challenged liver injury in C57BL/6J mice[D].Harbin:Harbin University of Commerce, 2020.
[4] 李启冬. 海参肠壁硫酸软骨素的结构解析和活性研究[D].哈尔滨:哈尔滨工业大学, 2021.
LI Q D.Structural elucidation and activity studies of fucosylated chondroitin sulfate from intestinal wall of sea cucumber Stichopus japonicas[D].Harbin:Harbin Institute of Technology, 2021.
[5] LI Y, LI M, XU B J, et al.The Current status and future perspective in combination of the processing technologies of sulfated polysaccharides from sea cucumbers:A comprehensive review[J].Journal of Functional Foods, 2021, 87:104744.
[6] LIU X X, ZHANG Z X, MAO H, et al.Characterization of the hydrolysis kinetics of fucosylated glycosaminoglycan in mild acid and structures of the resulting oligosaccharides[J].Marine Drugs, 2020, 18(6):286.
[7] YANG W J, CAI Y, YIN R H, et al.Structural analysis and anticoagulant activities of two sulfated polysaccharides from the sea cucumber Holothuria coluber[J].International Journal of Biological Macromolecules, 2018, 115:1055-1062.
[8] SHI D L, QI J H, ZHANG H W, et al.Comparison of hydrothermal depolymerization and oligosaccharide profile of fucoidan and fucosylated chondroitin sulfate from Holothuria floridana[J].International Journal of Biological Macromolecules, 2019, 132:738-747.
[9] MA Y, GAO N, ZUO Z C, et al.Five distinct fucan sulfates from sea cucumber Pattalus mollis:Purification, structural characterization and anticoagulant activities[J].International Journal of Biological Macromolecules, 2021, 186:535-543.
[10] DONG X D, PAN R J, DENG X Y, et al.Separation, purification, anticoagulant activity and preliminary structural characterization of two sulfated polysaccharides from sea cucumber Acaudina molpadioidea and Holothuria nobilis[J].Process Biochemistry, 2014, 49(8):1352-1361.
[11] NAZER B, DEHGHANI M R, GOLIAEI B.Plasmid DNA affinity partitioning using polyethylene glycol - sodium sulfate aqueous two-phase systems[J].Journal of Chromatography.B, Analytical Technologies in the Biomedical and Life Sciences, 2017, 1044-1045:112-119.
[12] JOSHI P U, TURPEINEN D G, WEISS M, et al.Tie line framework to optimize non-enveloped virus recovery in aqueous two-phase systems[J].Journal of Chromatography.B, Analytical Technologies in the Biomedical and Life Sciences, 2019, 1126-1127:121744.
[13] MARCHEL M, JO O K G, MARRUCHO I M.On the use of ionic liquids as adjuvants in PEG-(NH4)2SO4 aqueous biphasic systems:Phase diagrams behavior and the effect of IL concentration on myoglobin partition[J].Separation and Purification Technology, 2019, 210:710-718.
O K G, MARRUCHO I M.On the use of ionic liquids as adjuvants in PEG-(NH4)2SO4 aqueous biphasic systems:Phase diagrams behavior and the effect of IL concentration on myoglobin partition[J].Separation and Purification Technology, 2019, 210:710-718.
[14] ZHU L N, LU Y, SUN Z, et al.The application of an aqueous two-phase system combined with ultrasonic cell disruption extraction and HPLC in the simultaneous separation and analysis of solanine and Solanum nigrum polysaccharide from Solanum nigrum unripe fruit[J].Food Chemistry, 2020, 304:125383.
[15] OSLOOB M, ROOSTA A.Experimental study of choline chloride and K2HPO4 aqueous two-phase system, and its application in the partitioning of penicillin G[J].Journal of Molecular Liquids, 2019, 279:171-176.
[16] VIEIRA A W, DA CRUZ SILVA K, MAGESTE A B, et al.Lycopene partition in new aqueous two-phase systems[J].Journal of Molecular Liquids, 2021, 339:116755.
[17] 郝晓棠. 双水相萃取技术分离纯化水中腺病毒和流感病毒的研究[D].广州:广东药科大学, 2021.
HAO X T.Separation and purification of adenovirus and influenza virus from water by aqueous two phase extraction technology[D].Guangzhou:Guangdong Pharmaceutical University, 2021.
[18] RAGHAVA RAO J, NAIR B U.Novel approach towards recovery of glycosaminoglycans from tannery wastewater[J].Bioresource Technology, 2011, 102(2):872-878.
[19] XING J M, LI F F.Purification of aloe polysaccharides by using aqueous two-phase extraction with desalination[J].Natural Product Research, 2009, 23(15):1424-1430.
[20] 巫永华, 陆文静, 刘梦虎, 等.响应面优化超声波辅助双水相提取牛蒡多糖及抗氧化分析[J].食品与发酵工业, 2020, 46(5):215-223.
WU Y H, LU W J, LIU M H, et al.Optimization of ultrasonic-assisted aqueous two-phase extraction of burdock polysaccharide by response surface design and its antioxidant activities[J].Food and Fermentation Industries, 2020, 46(5):215-223.
[21] YANG D D, LIN F D, HUANG Y Y, et al.Separation, purification, structural analysis and immune-enhancing activity of sulfated polysaccharide isolated from sea cucumber viscera[J].International Journal of Biological Macromolecules, 2020, 155:1003-1018.
[22] 续晓琪, 薛长湖, 张翠玉, 等.次甲基蓝显色法定量海参硫酸软骨素[J].食品科学, 2013, 34(22):246-249.
XU X Q, XUE C H, ZHANG C Y, et al.Determination of chondroitin sulfate from sea cucumber by methylene blue colorimetry[J].Food Science, 2013, 34(22):246-249.
[23] VIJAYARAGAVAN K S, ZAHID A, YOUNG J W, et al.Separation of porcine parvovirus from bovine serum albumin using PEG-salt aqueous two-phase system[J].Journal of Chromatography B, 2014, 967:118-126.
[24] ALBERTSSON P Å.Partition of cell particles and macromolecules in polymer two-phase systems[J].Advances in Protein Chemistry, 1970, 24:309-341.
[25] MOHAMADI H S, OMIDINIA E, DINARVAND R.Evaluation of recombinant phenylalanine dehydrogenase behavior in aqueous two-phase partitioning[J].Process Biochemistry, 2007, 42(9):1296-1301.
[26] ANDERSSON E, HAHN-H GERDAL B.Bioconversions in aqueous two-phase systems[J].Enzyme and Microbial Technology, 1990, 12(4):242-254.
GERDAL B.Bioconversions in aqueous two-phase systems[J].Enzyme and Microbial Technology, 1990, 12(4):242-254.